Method Article
Iniezione intratecale lombare di vettori di terapia genica per il targeting del sistema nervoso centrale in topi e ratti
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Un'iniezione intratecale lombare rappresenta una via di somministrazione traslazionalmente rilevante per la somministrazione della terapia genica al sistema nervoso centrale. Questo protocollo standardizzato completo per le iniezioni intratecali lombari in topi e ratti neonatali, giovani e adulti mira a guidare i ricercatori nell'adozione di questa tecnica per gli studi preclinici di terapia genica.
Abstract
Un metodo per colpire il sistema nervoso centrale per il trattamento delle malattie neurologiche prevede l'utilizzo della via di somministrazione intratecale lombare. Questo approccio bypassa la barriera emato-encefalica per accedere direttamente al liquido cerebrospinale e indirizzare preferenzialmente le cellule all'interno del sistema nervoso centrale. Diversi studi preclinici pubblicati che utilizzano la via di iniezione intratecale lombare hanno contribuito allo sviluppo di studi clinici di terapia genica; Tuttavia, i protocolli descritti sono variabili e distribuiti su più risorse. Qui viene presentato un set completo di protocolli per iniezioni intratecali lombari in topi e ratti neonatali, giovani e adulti per studi preclinici di terapia genica. Con una formazione adeguata, questa tecnica di iniezione può essere eseguita in modo rapido e affidabile. Oltre a dettagliare il protocollo di iniezione in ogni fase dello sviluppo, vengono discussi i parametri associati, come il volume di iniezione, che possono influenzare i risultati dello studio. Per dimostrare l'applicazione delle iniezioni intratecali lombari per il targeting del sistema nervoso centrale, l'espressione del virus adeno-associato sierotipo 9 nel cervello, nel midollo spinale e nei tessuti periferici viene presentata dopo un'iniezione riuscita o non riuscita.
Introduzione
Una sfida nel trattamento delle malattie neurologiche che richiedono la somministrazione globale del sistema nervoso centrale (SNC) ma che sono altrimenti buoni candidati per la terapia genica è stata in gran parte attribuita al targeting inefficiente del SNC e dei tipi di cellule rilevanti1. È in corso una notevole quantità di ricerca per ottimizzare il targeting globale delle cellule e dei tessuti del SNC ingegnerizzando veicoli di consegna 1,2. Tuttavia, la somministrazione di vettori ragionevolmente diffusa può ancora essere ottenuta con l'attuale tecnologia dei vettori di terapia genica, utilizzando determinate combinazioni di vettori virali e vie di somministrazione 3,4. L'attuale gold standard per ottenere una somministrazione diffusa del SNC da un trattamento una tantum consiste nell'utilizzare il sierotipo 9 del virus adeno-associato (AAV9) insieme a un'iniezione diretta nel liquido cerebrospinale (CSF).
Esistono tre vie di somministrazione tipiche per le iniezioni dirette di liquido cerebrospinale: intratecale lombare (IT), intracerebroventricolare (ICV) e intracisternale (ICM)5. Ognuna di queste vie di somministrazione si traduce in diversi modelli di biodistribuzione nel SNC e nei tessuti periferici, ma tutte hanno il vantaggio di bypassare la barriera emato-encefalica (BBB) per raggiungere le cellule del SNC che contribuiscono alla patologia e ai fenotipi della malattia neurologica6. L'iniezione di IT lombare è lo standard per l'uso clinico della somministrazione di farmaci nell'uomo, poiché la procedura clinica è di routine e semplice, con meno invasività rispetto alle iniezioni di ICV e ICM.
L'iniezione di IT lombare è una tecnica consolidata che viene prontamente utilizzata nel campo degli anestetici e degli analgesici, con il primo articolo pubblicato nel 18857. Il primo protocollo per le iniezioni di IT lombare nei topi adulti è stato pubblicato nel 19808 e da allora è stato ampiamente adottato e rivisto9. Sono stati apportati lievi aggiustamenti o miglioramenti a questi protocolli 10,11,12, inclusa una tecnica di conservazione del prodotto 13. Anche i protocolli per le iniezioni di IT lombare nei ratti adulti sono stati pubblicati per la prima volta nel 1976, con cateterismo per somministrazione cronica14 e iniezione diretta per trattamenti una tantum15. Più recentemente, gruppi hanno pubblicato protocolli per iniezioni di IT lombare in topi e ratti neonatali o giovani16,17.
L'ampia adozione e convalida di questa tecnica per bypassare la BBB e le cellule bersaglio nel SNC ha portato a molteplici studi preclinici e clinici di terapia genica di successo per il trattamento delle malattie neurologiche. I dati positivi sull'efficacia e la sicurezza nei topi, nei ratti e nei primati non umani che modellano le malattie neurologiche hanno suscitato entusiasmo e interesse per il potenziale beneficio clinico di queste malattie 18,19,20,21,22,23. Alcuni di questi studi sono ora in fase di sperimentazione clinica (ad esempio, identificatori clinicaltrials.gov NCT02362438, NCT04737460, NCT03381729 e NCT05518188)3,6. In questo articolo viene descritto un semplice protocollo per iniezioni di IT lombare in topi e ratti di età diverse, senza rimuovere il liquido cerebrospinale, che può essere adottato per progetti di terapia genica traslazionale. Questo protocollo è simile ai protocolli già disponibili che sono ampiamente adottati; Tuttavia, è utile citare questi protocolli pertinenti in un unico posto per un facile accesso e riferimento, insieme alle immagini video di accompagnamento. Questo protocollo spiega l'iniezione per topi e ratti neonatali al giorno postnatale (P) 0-1 e per topi e ratti giovani P21, con risultati rappresentativi da un'iniezione di IT lombare riuscita e non riuscita a P1 nei topi. Nella discussione, vengono affrontati i passi falsi comuni e i dettagli specifici che richiedono un'attenta attenzione durante l'esecuzione di questa procedura, nonché le raccomandazioni su come praticare queste iniezioni prima di iniziare uno studio preclinico.
Protocollo
Le procedure qui descritte sono state approvate dall'Institutional Animal Care and Use Committee (IACUC) presso il Southwestern Medical Center dell'Università del Texas. Topi maschi e femmine C57BL6/J wild-type, di età P1-P28, sono stati utilizzati per i protocolli che coinvolgono i topi. I ratti maschi e femmine di Sprague-Dawley wild-type, di età P1-P56, sono stati utilizzati per i protocolli che coinvolgono i ratti. A parte la chirurgia di sopravvivenza descritta nel paragrafo 3, si ritiene che tutte le altre procedure causino solo un disagio momentaneo e non richiedano l'uso di anestetici o analgesici. Gli individui dovrebbero monitorare gli animali da laboratorio per qualcosa di più di un disagio momentaneo e chiedere consiglio al loro personale IACUC e veterinario sulla necessità di anestetici e analgesici. I dettagli dei reagenti e delle attrezzature utilizzate sono forniti nella Tabella dei Materiali.
1. Iniezione IT lombare di topi >P21
- Preparazione
- Preparare le soluzioni per iniezione, compreso il vettore di terapia genica alla concentrazione o alle concentrazioni desiderate e una soluzione di controllo (di solito il tampone di formulazione utilizzato nella produzione del vettore). Le soluzioni iniettabili devono essere sterili e devono rimanere sterili per tutta la durata della procedura.
NOTA: Tutte le soluzioni devono essere mantenute in ghiaccio per tutta la durata della procedura. - Raccogli e disinfetta tutti i materiali, inclusi siringa e ago, pipetta e soluzione per iniezione. Seguire le linee guida istituzionali relative all'uso di cappe di biosicurezza e all'esposizione agli iniettori. Le procedure qui descritte sono state condotte in una cabina di biosicurezza di classe 2.
- Utilizzando una pipetta da microlitro, misurare il volume desiderato di soluzione iniettabile e trasferirlo in un film di paraffina sterile. Un volume di iniezione di 5 μl è comunemente usato ed è trattato come il volume target per i topi adulti >P21 (Tabella 1).
NOTA: Se necessario, è possibile aumentare il volume; Tuttavia, gli animali devono essere attentamente monitorati per rilevare eventuali reazioni avverse a volumi di iniezione maggiori. Vedere la sezione Discussione per i dettagli sul volume di iniezione e sulle reazioni avverse. La soluzione può anche essere trasferita direttamente dal puntale della pipetta a una siringa, oppure possono essere utilizzate siringhe da microlitri calibrate a tenuta di gas per misurare direttamente il volume della soluzione iniettabile. - Aspirare la soluzione in una siringa da microlitro con un ago da 30 G 0,5", facendo attenzione a non aspirare bolle d'aria.
NOTA: Il calibro e la lunghezza dell'ago possono influire sulla penetrazione della pelle. Quando si considera la dimensione della siringa da utilizzare, il volume di iniezione non deve essere inferiore al 10% della capacità della siringa. Per volumi superiori al 50% della capacità della siringa, assicurarsi che lo stantuffo possa essere facilmente premuto con il dito indice. Se non è possibile premere facilmente lo stantuffo, utilizzare una siringa di capacità maggiore.
- Preparare le soluzioni per iniezione, compreso il vettore di terapia genica alla concentrazione o alle concentrazioni desiderate e una soluzione di controllo (di solito il tampone di formulazione utilizzato nella produzione del vettore). Le soluzioni iniettabili devono essere sterili e devono rimanere sterili per tutta la durata della procedura.
- Trattenente
- Usando la mano dominante, tieni il topo cosciente (non anestetizzato) per la coda su un tovagliolo di carta. Il tovagliolo di carta aiuterà a trattenere, calmare e impedire al topo di mordere. Il mouse deve essere in posizione prona neutra con l'aspetto laterale del corpo rivolto verso di te.
NOTA: Non è necessario addestrare o abituare i topi a questa contenzione prima della procedura. I topi possono avere difficoltà a causa della contenzione, ma non dovrebbero suscitare una risposta specifica al dolore. Se si osservano risposte al dolore più che momentanee, può essere necessaria la somministrazione di analgesici; consultare un veterinario. - Con la mano non dominante, piega una parte del tovagliolo di carta sopra la testa e la parte superiore del corpo del topo e afferra saldamente la cintura pelvica tra il pollice non dominante e l'indice. Assicurati che il palmo sia a coppa, appoggiato intorno alla testa del mouse. La cresta iliaca del topo dovrebbe essere palpabile e posizionata al centro della falange distale di ciascun dito (Figura 1A, B).
NOTA: L'irruzione da mani o tovaglioli di carta non deve compromettere la respirazione. - Ruotare delicatamente la base della coda per garantire il corretto allineamento della colonna vertebrale. Il bacino del topo dovrebbe essere quadrato, in modo tale che i processi vertebrali della colonna lombare siano perpendicolari alla superficie di lavoro.
- Tamponare la regione lombare dorsale del topo con un tampone per la preparazione di alcol al 70%.
- Separare i capelli da ~2-6 mm cranialmente alla cresta iliaca per aiutare a visualizzare la posizione dell'iniezione.
- Sentire lo spazio intervertebrale L4-L5 o L5-L6, ~2-6 mm dal cranio alla cresta iliaca.
NOTA: La distanza esatta è variabile a seconda delle dimensioni e dell'età del mouse.
- Usando la mano dominante, tieni il topo cosciente (non anestetizzato) per la coda su un tovagliolo di carta. Il tovagliolo di carta aiuterà a trattenere, calmare e impedire al topo di mordere. Il mouse deve essere in posizione prona neutra con l'aspetto laterale del corpo rivolto verso di te.
- Iniezione
- Usando la mano dominante, tenere il centro della siringa da microlitro e posizionarla perpendicolarmente alla colonna vertebrale del topo nello spazio intervertebrale L4-L5 o L5-L6. Assicurarsi che lo stantuffo della siringa possa essere premuto con il dito indice senza movimenti eccessivi della mano. Con lo smusso dell'ago rivolto verso la testa del topo, perforare la pelle sullo spazio intervertebrale.
- Quando i bordi dell'osso attorno allo spazio intervertebrale si avvertono sulla punta dell'ago, ridurre l'angolo della siringa a 30-45 gradi (Figura 1A).
- L'ago dovrebbe scivolare nello spazio intervertebrale provocando un improvviso movimento della coda e dovrebbe essere stretto saldamente tra le vertebre.
- Facendo attenzione a non spostare la siringa, premere costantemente lo stantuffo per erogare la soluzione entro 10 s.
- Tenere la siringa in posizione per 15-30 s dopo aver premuto completamente lo stantuffo per consentire la dissipazione della soluzione e prevenire il riflusso.
- Estrarre dolcemente e lentamente la siringa dal mouse con lo stesso angolo di ingresso di 30-45 gradi. Quando l'ago viene estratto, ruotare la siringa per evitare il riflusso.
NOTA: Prestare attenzione a non far avanzare l'ago quando si ruota la siringa, poiché ciò potrebbe causare danni fisici al midollo spinale. - Libera il mouse dal sistema di ritenuta e rimettilo nella gabbia di casa.
- Monitorare il topo dopo l'iniezione per deambulazione anormale, compromissione motoria, anomalie respiratorie e coordinazione. Vedere la Discussione per ulteriori dettagli sulle reazioni avverse.
- Pulire l'attrezzatura seguendo le raccomandazioni del produttore. Per iniezioni multiple, si raccomandano siringhe diverse per ogni vettore di terapia genica e soluzione di controllo.
NOTA: Gli aghi rimovibili possono essere puliti, sterilizzati e riutilizzati più volte; Tuttavia, gli aghi smussati non devono essere utilizzati in quanto possono danneggiare l'animale e aumentare la probabilità di iniezioni mancate. Un ago smussato non perfora facilmente la pelle e deve essere scartato in modo appropriato. Se le siringhe sono limitate, si consiglia di completare tutte le iniezioni del veicolo prima di procedere al vettore di terapia genica e di iniettare la dose più bassa di terapia genica prima di somministrare dosi più elevate. - Seguire le linee guida istituzionali per la sterilizzazione delle attrezzature tra gli animali.
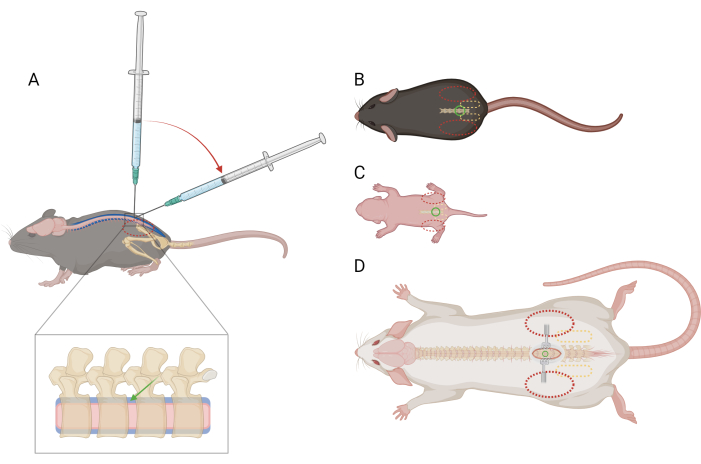
Figura 1: Schema del posizionamento del dito e della siringa per l'iniezione intratecale lombare in topi e ratti. (A) Vista laterale di un >P21 di topo che mostra il posizionamento dell'ago e la transizione dell'angolo della siringa durante un'iniezione IT lombare. L'ovale rosso tratteggiato indica il posizionamento delle dita sulla cresta iliaca del topo. Una vista ingrandita della colonna vertebrale mostra lo spazio intratecale (blu) con il posizionamento approssimativo dell'ago (freccia verde) e il midollo spinale (rosa). Vista dorsale di (B) un topo >P21), (C) un topo D) un ratto >P21, con punti di riferimento per il posizionamento dell'ago (cerchio verde), la cintura pelvica (ovale giallo tratteggiato) e il posizionamento delle dita (ovale rosso tratteggiato). Anche il sito di incisione e i divaricatori sono raffigurati in (D). Clicca qui per visualizzare una versione più grande di questa figura.
2. Iniezione IT lombare di topi e ratti
- Preparazione
- Segui il passaggio 1.1. L'unica eccezione è il volume di iniezione nel passaggio 1.1.3.
NOTA: I volumi di iniezione raccomandati per i topi neonatali (P0-P1) non devono superare i 3 μL, per i topi giovani (P5-P7) non devono superare i 5 μL e per i topi giovani (P10) non devono superare i 10 μL. I volumi di iniezione raccomandati per i ratti neonatali (P0-P1) non devono superare i 5 μL, per i ratti giovani (P5-P7) non devono superare i 10 μL e per i ratti giovani (P10) non devono superare i 30 μL (Tabella 1).
- Segui il passaggio 1.1. L'unica eccezione è il volume di iniezione nel passaggio 1.1.3.
- Trattenente
- Usando la mano dominante, tieni il topo/ratto per la coda su un tovagliolo di carta. Il topo/ratto dovrebbe essere in posizione prona neutra con l'aspetto laterale del corpo rivolto verso di te.
NOTA: I topi/ratti possono avere difficoltà a causa della contenzione, ma non dovrebbero suscitare una risposta specifica al dolore. Se si osservano risposte al dolore più che momentanee, può essere necessaria la somministrazione di analgesici; consultare un veterinario. - Afferrare delicatamente ma saldamente la cintura pelvica tra il pollice non dominante e l'indice. La cresta iliaca dovrebbe essere palpabile e posizionata al centro della falange distale di ciascun dito (Figura 1C).
NOTA: A questa età, non c'è preoccupazione di essere morsi, quindi non è necessario avvolgere il tovagliolo di carta sul topo/ratto. Potrebbe essere necessario utilizzare un tovagliolo di carta nei ratti P5-10 per mantenere fermi i cuccioli di ratto più grandi. - Ruotare delicatamente la base della coda per garantire il corretto allineamento della colonna vertebrale. Il bacino del topo/ratto dovrebbe essere quadrato in modo che i processi vertebrali della colonna lombare siano perpendicolari alla superficie di lavoro.
- Tamponare la regione lombare dorsale del topo/ratto con un tampone per la preparazione di alcol al 70%.
- Separare i capelli, se applicabile, ~1-3 mm cranialmente alla cresta iliaca per aiutare a visualizzare la posizione di iniezione. La visualizzazione dell'area target è più facile nei topi/ratti più giovani. Nei neonati glabri, si può vedere una rientranza nello spazio intervertebrale.
- Sentire o visualizzare lo spazio intervertebrale L4-L5 o L5-L6, ~1-3 mm dal cranio alla cresta iliaca.
NOTA: La distanza esatta è variabile a seconda delle dimensioni e dell'età del topo/ratto.
- Usando la mano dominante, tieni il topo/ratto per la coda su un tovagliolo di carta. Il topo/ratto dovrebbe essere in posizione prona neutra con l'aspetto laterale del corpo rivolto verso di te.
- Iniezione
- Usando la mano dominante, tenere il centro della siringa da microlitro e posizionarla con un angolo di 30-45 gradi rispetto alla colonna vertebrale del topo/ratto. Con lo smusso dell'ago rivolto verso la testa del topo/ratto, perforare la pelle di circa 1-3 mm di caudle allo spazio intervertebrale. A causa dell'orientamento angolato della siringa, il punto di inserimento sulla pelle è leggermente caudale rispetto allo spazio intervertebrale.
NOTA: Questa distanza può variare in base all'età e alle dimensioni del topo/ratto. - Il resto dei passaggi è identico ai passaggi 1.3.3-1.3.10 dei topi >P21.
- Usando la mano dominante, tenere il centro della siringa da microlitro e posizionarla con un angolo di 30-45 gradi rispetto alla colonna vertebrale del topo/ratto. Con lo smusso dell'ago rivolto verso la testa del topo/ratto, perforare la pelle di circa 1-3 mm di caudle allo spazio intervertebrale. A causa dell'orientamento angolato della siringa, il punto di inserimento sulla pelle è leggermente caudale rispetto allo spazio intervertebrale.
3. Iniezione IT lombare di ratti >P21
NOTA: In letteratura sono descritte diverse procedure di iniezione IT, che vanno dalle tecniche non anestetizzate ad approcci chirurgici più estesi14,15. Una procedura per l'iniezione diretta con una tecnica minimamente invasiva è descritta utilizzando una leggera anestesia e una piccola incisione cutanea. L'uso di anestesia, come il gas isoflurano, può aiutare con la contenzione, rilassare la muscolatura e prevenire il movimento durante l'iniezione. Praticare una piccola incisione nella pelle sopra il sito di iniezione migliora l'accuratezza dell'iniezione consentendo la visualizzazione dello spazio intervertebrale ed eliminando la necessità di perforare la pelle spessa. A causa dell'incisione, è necessario l'uso di anestetici e analgesici. Con la pratica, è possibile eseguire iniezioni di IT lombare in ratti di età superiore a P21 senza anestesia o incisione a discrezione dell'utente e in base ai requisiti istituzionali15. Seguire le linee guida e le considerazioni istituzionali relative all'anestesia, agli analgesici appropriati e alla chirurgia di sopravvivenza per gli animali da laboratorio.
- Preparazione
- Segui il passaggio 1.1. Le uniche eccezioni sono il volume di iniezione al punto 1.1.3 e la dimensione dell'ago al passaggio 1.1.4. I volumi di iniezione per i ratti possono variare notevolmente in base all'età e alle dimensioni corporee. Vedere la sezione Discussione per ulteriori informazioni sul volume di iniezione alle diverse età (Tabella 1).
NOTA: Si consiglia un ago da 27 G x 1" per i ratti adulti, poiché gli aghi di calibro inferiore possono piegarsi e gli aghi più corti potrebbero non penetrare adeguatamente nello spazio intratecale. Se lo si desidera, è possibile utilizzare un ago più lungo (1,25-1,5"). - Anestetizzare il ratto utilizzando l'anestetico preferito e approvato (seguendo i protocolli istituzionalmente approvati).
NOTA: Per le procedure qui descritte, i ratti sono stati anestetizzati utilizzando gas isoflurano e una miscela 1:1 di lidocaina: la bupivacaina è stata utilizzata come anestetico locale. La temperatura corporea deve essere mantenuta utilizzando una fonte di calore esterna approvata durante la procedura e il recupero. - Seguire la preparazione standard del sito chirurgico asettico per ogni animale. Brevemente, radere la regione lombare dorsale e preparare la pelle con uno scrub chirurgico, betadina e alcol isopropilico al 70%.
- Segui il passaggio 1.1. Le uniche eccezioni sono il volume di iniezione al punto 1.1.3 e la dimensione dell'ago al passaggio 1.1.4. I volumi di iniezione per i ratti possono variare notevolmente in base all'età e alle dimensioni corporee. Vedere la sezione Discussione per ulteriori informazioni sul volume di iniezione alle diverse età (Tabella 1).
- Procedura chirurgica
- Posiziona il ratto in posizione prona neutra con l'aspetto laterale del corpo rivolto verso di te.
- Palpare il cingolo pelvico, identificando la cresta iliaca e la giunzione lombosacrale. Nei ratti >P21, i processi vertebrali possono essere facilmente identificati.
- Utilizzando un bisturi, praticare un'incisione di 1 cm sullo spazio intervertebrale L4-L5 o L5-L6. L'incisione deve coinvolgere solo la pelle e la fascia sottostante, lasciando intatto il muscolo.
NOTA: È utile utilizzare i divaricatori per tenere aperta la pelle durante il resto della procedura. - Afferrare delicatamente ma saldamente la cintura pelvica tra il pollice non dominante e l'indice. La cresta iliaca deve essere palpabile e posizionata al centro della falange distale di ciascun dito (Figura 1D). Usa una pinza per zanzare per sondare lungo la linea mediana della schiena per localizzare lo spazio intervertebrale.
- Iniezione
- Usando la mano dominante, tenere il centro della siringa da microlitro e posizionarla perpendicolarmente alla colonna vertebrale del ratto nello spazio intervertebrale L4-L5 o L5-L6. Assicurarsi che lo stantuffo della siringa possa essere premuto con il dito indice senza movimenti eccessivi della mano. Con lo smusso dell'ago rivolto verso la testa del ratto, perforare il muscolo con l'ago sopra lo spazio intervertebrale.
- Far avanzare l'ago nello spazio intervertebrale.
NOTA: L'ago può avere una leggera resistenza mentre passa tra i processi vertebrali e potrebbe essere necessario regolare leggermente l'angolo della siringa per passare attraverso questo spazio. Tuttavia, dovrebbe rimanere di circa 90 gradi, perpendicolare alla colonna vertebrale. Si avvertirà uno schiocco quando l'ago entra nello spazio intratecale. A seconda dei parametri anestetici, un movimento della coda o della gamba può essere evidente o meno. L'ago deve essere stretto saldamente tra le vertebre. - Facendo attenzione a non spostare la siringa fuori posizione, premere lo stantuffo per erogare la soluzione entro 30 s.
NOTA: A differenza delle iniezioni nei topi, potrebbe non essere possibile ridurre l'angolo della siringa nei ratti >P21 utilizzando questo metodo. Volumi maggiori devono essere iniettati a una velocità più lenta per evitare un eccessivo accumulo di pressione. - Tenere la siringa in posizione per 30-60 secondi dopo aver premuto completamente lo stantuffo per consentire la dissipazione della soluzione e prevenire il riflusso.
- Estrarre delicatamente la siringa dal ratto. Quando l'ago viene estratto, ruotare la siringa per evitare il riflusso.
NOTA: Prestare attenzione a non far avanzare l'ago quando si ruota la siringa, poiché ciò potrebbe causare danni fisici al midollo spinale. - Chiudere l'incisione cutanea utilizzando un metodo approvato, come sutura o clip per ferite. Per i ratti utilizzati in questo protocollo, la pelle è stata chiusa in un modello intradermico continuo o semplicemente interrotto utilizzando una sutura PDS II 5-0.
- Recupera il ratto dall'anestesia.
- Seguire i passaggi 1.3.9-1.3.10 e tutte le linee guida per la cura post-operatoria.
Risultati
Sebbene molti fattori possano influenzare la trasduzione del vettore della terapia genica, la colorazione istologica del tessuto rimane il metodo più accurato per determinare il successo delle iniezioni intratecali lombari (IT). La distribuzione ampia e uniforme del vettore della terapia genica all'interno del sistema nervoso centrale (SNC) dopo l'iniezione è indicativa di una procedura di successo. La Figura 2C rappresenta un'iniezione riuscita di una terapia genica autocomplementare mediata da AAV9 che guida l'espressione di transgeni ubiquitari deboli sotto il promotore JeT alla dose di 1,3 × 1011 vg/topo in topi neonatali (P1), 4 mesi dopo l'iniezione. L'analisi dell'RNAscope, utilizzando una sonda mirata al transgene fornito dalla terapia genica, rivela un'ampia distribuzione nel midollo spinale lombare, nel midollo spinale cervicale e nel cervello. È inclusa una sezione del fegato e del cuore per evidenziare che, anche con l'iniezione diretta di liquido cerebrospinale (CSF), il vettore della terapia genica può ancora essere distribuito ai tessuti periferici.

Figura 2: Sezioni di tessuto colorate da 5 micron del SNC e del tessuto periferico di topo 4 mesi dopo l'iniezione a P1. La colorazione rossa indica l'espressione del transgene tramite RNAscope e la controcolorazione blu dei nuclei viene eseguita tramite ematossilina. (A) Iniezione con un tampone di formulazione di controllo. (B) Iniezione intraparenchimale non riuscita con un vettore AAV9 (scAAV9_JeT-hDDX3Xopt-SpA). (C) Iniezione di IT lombare riuscita con un vettore AAV9 (scAAV9_JeT-hDDX3Xopt-SpA). Il vettore di terapia genica utilizzato in (B) e (C) è stato somministrato a una dose traslazionalmente rilevante di 1,3E11 vg/topo. Barra della scala: pannello superiore (5 mm); Pannello inferiore (1 mm). Clicca qui per visualizzare una versione più grande di questa figura.
L'espressione concentrata nel midollo spinale lombare abbinata a una mancanza di espressione nel cervello, come mostrato nella Figura 2B, può indicare un'iniezione intraparenchimale del midollo spinale e deve essere considerata un'iniezione fallita. Ciò accade quando l'ago viene inserito troppo in profondità nella colonna vertebrale, oltre lo spazio intratecale e nel midollo spinale. Inoltre, un'espressione molto bassa o assente nel midollo spinale e nel cervello (non mostrata) dovrebbe essere considerata un'iniezione fuori bersaglio fallita, supponendo che un vettore e una dose vengano utilizzati dove è prevista un'ampia distribuzione del SNC. Ciò può essere dovuto al fatto che l'ago non è inserito abbastanza lontano o che è laterale alla linea mediana.
I modelli di espressione osservati dalle iniezioni riuscite possono differire a causa dei seguenti otto fattori come esempi: (1) età all'iniezione, (2) immunità preesistente, (3) velocità di infusione, (4) vettore di terapia genica, (5) dose di terapia genica, (6) proteine della superficie cellulare, (7) tropismo e (8) se applicabile, una scelta appropriata del promotore per guidare l'espressione transgenica6. Sebbene i modelli di espressione possano differire, la distribuzione ampia, uniforme e diffusa sarà universale purché la dose sia sufficientemente alta con un vettore efficace, come AAV9.
I principali limiti dell'utilizzo dell'analisi istologica per confermare il successo dell'iniezione di IT lombare sono i lunghi tempi di attesa - attendere fino alla fine di uno studio, dopo che le necroscopie sono state eseguite e il tessuto è stato raccolto - e le ampie risorse necessarie per l'elaborazione del tessuto di tutti i topi in un ampio studio di terapia genica. Purtroppo, la nostra esperienza è stata che gli indicatori immediati e diretti di un'iniezione positiva o negativa possono essere inaffidabili; Tuttavia, il riflesso del colpo di coda quando l'ago entra nello spazio intratecale è un buon indicatore di posizionamento riuscito in tempo reale e probabilmente indica un'iniezione riuscita. Non confondere una contrazione poiché l'ago perfora la pelle in un topo/ratto non anestetizzato con una risposta del colpo di coda all'ago che entra nello spazio intratecale. È stato riportato che l'uso di agenti farmacologici come NMDA, sostanza P e lidocaina, sia in allenamento che miscelati con la soluzione sperimentale per iniezione, fornisce un'indicazione più immediata del successo dell'iniezione 9,11,24. Se si considerano questi agenti, è importante valutare la loro compatibilità con il vettore di terapia genica.
Discussione
L'iniezione di IT lombare è una procedura rapida e minimamente invasiva che rilascia in modo affidabile un vettore di terapia genica nel liquido cerebrospinale per il trattamento delle malattie del SNC 5,6. La procedura è rilevante dal punto di vista della traduzione e il protocollo qui descritto descrive in dettaglio come eseguire questa via di somministrazione in topi e ratti di tutte le età, dai neonati agli adulti. È importante definire questo protocollo per topi e ratti di tutte le età, oltre a fornire video di supporto, per aiutare i ricercatori nell'adozione di questo metodo per la somministrazione della terapia genica. L'esperienza del nostro laboratorio è che questo protocollo può essere implementato in modo coerente su più utenti e studia nel tempo 18,25,26,27,28,29,30.
Ci sono importanti differenze quando si esegue l'iniezione di IT lombare nei topi/ratti più giovani rispetto ai topi/ratti più anziani, in particolare l'angolo con cui l'ago viene inserito nella colonna vertebrale e il volume raccomandato che viene iniettato. I volumi di iniezione di IT lombare riportati variano considerevolmente tra gli studi e tra le specie31. La considerazione del volume di iniezione è importante per evitare aumenti duraturi della pressione intracranica (ICP), che possono compromettere il flusso del liquido cerebrospinale e del sangue cerebrale, causare disagio e portare a complicanze neurologiche croniche, tra cui idrocefalo, ischemia, danno cellulare e morte32,33. L'ICP è determinato dal volume del liquido cerebrospinale, del sangue cerebrale e del tessuto del SNC, che non può essere direttamente correlato al peso corporeo. Al normale funzionamento, l'ICP è autoregolato da molti fattori, tra cui il volume del liquido cerebrospinale, il volume del sangue cerebrale, la respirazione, la posizione del corpo, il tasso di produzione del liquido cerebrospinale e il tasso di drenaggio del liquido cerebrospinale nel sangue33,34. I volumi di iniezione di IT dovrebbero quindi essere determinati in base alle proprietà del liquido cerebrospinale (Tabella 1) anziché al peso corporeo 25,27,28,30. I volumi raccomandati da iniettare ad ogni età in ciascuna specie sono indicati in grassetto.
| Volume di iniezione IT | Valori del CSF negli adulti | |||||||
| P0-1 (μL) | P5-7 (μL) | P10 (μL) | >P21 (μL) | Volume totale (μL) | Velocità di produzione (μL/min) | Fatturato (h) | Pressione intracranica (mm Hg) | |
| Topi | 3 | 5 | 5-10 | 5-20 | 30-40ore 25,30 | 0,32-0,3525,30 | 1.7-2ore 25,30 | 5,0 +/- 0,528 |
| Ratti | 5 | 5-10 | 10-30 | 10-200 (20-75) | Codice: 15025 | 1,7-2,825 | 2-2,6625 | 8,6 +/- 1,7,27 |
Tabella 1: Riepilogo dei volumi di iniezione di IT lombare per topi e ratti di età diverse. I valori in grassetto sono consigliati e sono stati consegnati in modo sicuro. I volumi massimi possibili non sono stati valutati formalmente. Ulteriori informazioni sui parametri noti del liquido cerebrospinale - volume totale, velocità di produzione, turnover e pressione intracranica - nei topi e nei ratti sono incluse come riferimento.
C'è una mancanza di conoscenza in tutto il campo per quanto riguarda la soglia superiore per i volumi di iniezione IT in bolo una tantum. Nell'uomo adulto, nei ratti e nei topi in cui il volume del liquido cerebrospinale è noto, un aumento del 30% del volume totale del liquido cerebrospinale non sembra causare lesioni croniche o malattie 31,33,35,36. La mancanza di volumi noti di liquido cerebrospinale nei topi giovani o neonati rende impossibile un'estrapolazione simile. Alcuni gruppi stanno iniziando a esaminare il volume e la produzione di liquido cerebrospinale negli animali più giovani37. Fino a quando non saranno comprovate ulteriori indagini in queste aree, il volume di iniezione continuerà a essere soggetto ai valori riportati dallo sperimentatore.
Topi e ratti, specialmente se trattati in giovane età o con alti volumi di iniezione, possono provocare flessione dei muscoli, estensione degli arti, respirazione rapida o paralisi temporanea degli arti posteriori che dovrebbe risolversi da sola entro pochi minuti. In casi estremi, gli aumenti acuti dell'ICP possono causare anomalie cardiovascolari e respiratorie, che possono essere mortali32,33. Se eventuali anomalie post-procedurali persistono dopo 24 ore, i topi/ratti devono essere rimossi dallo studio e sottoposti a eutanasia umana. La paralisi persistente degli arti posteriori può verificarsi se l'ago viene inserito troppo in profondità, colpendo il midollo spinale. Ciò può essere dovuto a un errore comune durante l'esecuzione dell'iniezione IT lombare: movimento della siringa dopo il colpo di coda mentre si preme lo stantuffo. Il movimento della siringa e dell'ago deve essere evitato. Se non è possibile acquisire la posizione corretta con la puntura iniziale, è possibile effettuare un secondo tentativo nella stessa posizione. Se anche il secondo tentativo non ha successo, prova a modificare la posizione dell'ago per mirare allo spazio intervertebrale successivo. Si noti che più punture di ago possono causare la fuoriuscita di un'iniezione successivamente riuscita.
Diventare esperti nell'iniezione di informatica lombare può richiedere tempo. Per praticare le iniezioni come procedura terminale, seguire il protocollo di cui sopra utilizzando una soluzione colorante approvata, come il blu di Evans o il colorante verde McCormick filtrato a 0,2 micron (Figura 3) o con gli agenti farmacologici trattati nella sezione Risultati rappresentativi. Si consiglia di utilizzare il colorante per risolvere i problemi e padroneggiare l'iniezione perché è facile capire se un'iniezione è stata un successo o un fallimento entro 1 minuto. La pratica con il colorante è solo per le procedure di non sopravvivenza, poiché gli animali possono sviluppare una reazione al colorante quando somministrato direttamente al SNC. Questa reazione può verificarsi entro un minuto da un'iniezione riuscita ed è caratterizzata da rapidi movimenti di prurito e contorsione. Gli animali dovrebbero essere immediatamente soppressi una volta osservata questa reazione per ridurre al minimo il disagio. Dopo un'iniezione di colorante praticata con successo, il colorante rimarrà localizzato nella colonna vertebrale (nessun colorante nel tessuto periferico vicino) e si sposterà lungo la colonna vertebrale fino al cervelletto, al cervello e ai bulbi olfattivi. A P1, la pelle è abbastanza trasparente da poter vedere il colorante muoversi lungo la colonna vertebrale nella coda. Se il colorante non raggiunge il cervello entro pochi minuti, l'iniezione fallisce.

Figura 3: Colorante verde McCormick nel cervello dopo iniezioni di IT lombare di successo. Tutti i cervelli provengono da topi P21 iniettati con 5 μL di colorante e sono mostrati nella vista ventrale. Clicca qui per visualizzare una versione più grande di questa figura.
Per ulteriori informazioni sui parametri associati rilevanti per la progettazione della sperimentazione preclinica, come il titolo virale e le dosi, vedere le revisioni precedentemente pubblicate 3,6,31.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Desideriamo ringraziare l'UT Southwestern AAV Viral Vector Core Facility per la produzione del vettore AAV9 e Yuhui Hu, ricercatore presso il Gray Lab, per l'elaborazione e la colorazione del tessuto presentato nella Figura 2.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.2 micron filter | Electron Microscopy Sciences | 67005 | Used to filter dye solution |
| 0.5 to 10 µL Pipette | Eppendorf | TI13690026 | Used to measure injection solution |
| 1.5 mL Microtube | Eppendorf | 22364111 | Used to store injection solutions |
| 10 µL Syringe | Hamilton | 7635-01 | Injection volume should not be less than 10% of syringe capacity |
| 10 to 100 µL Pipette | Eppendorf | TI13690029 | Used to measure injection solution |
| 10µl Pipette Tips | USA Scientific Inc | 11203810 | Used to measure injection solution |
| 100 µL Syringe | Hamilton | 7638-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 100 µL Pipette Tips | USA Scientific Inc | 11231840 | Used to measure injection solution |
| 25 µL Syringe | Hamilton | 7636-01 | Ideal for 5-10 µL injections. Injection volume should not be less than 10% of syringe capacity |
| 27 Gauge Needle(s) | Hamilton | 7803-01 | For rat >21 only. 27 gauge, Small Hub RN Needle, 1 in, point style 4 at 12°, 6/PK |
| 30 Gauge Needle(s) | Hamilton | 7803-17 | 30 gauge, Small Hub RN Needle, 0.5 in, point style 4 at 12°, 6/PK |
| 50 µL Syringe | Hamilton | 7637-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 70% Ethanol | Pharmco | 111000140 | Used to sanitize workspace and equipment |
| 70% Isopropyl Alcohol Prep Pads | PDI | B60307 | Used to prepare injection site |
| Analgesic | For rat >21 only. | ||
| Anesthetic (Isoflurane) | Piramal Critical Care | 66794001725 | For rat >21 only. |
| Betadine | Purdue Products | 6906606 | For rat >21 only. Used for skin prep |
| Control Solution | Injection solution | ||
| Dye Solution (green) | McCormick | For practice, non-survival only | |
| Gloves | Kimberly-Clark | 19-149-863B | PPE |
| Ice bucket with ice | Fisher Scientific | 03-395-150 | Maintain viral vector solution on ice |
| Mosquito Forceps (curved or straight) | Fine Science Tools | 13009-12 | For rat >21 only. Used to palpate intervertebral space. |
| Needle Holders | Fine Science Tools | 12002-12 | For rat >21 only. Used for skin closure with suture |
| Paper Towel | Berkshire | 18-998-123 | Used to restrain adult mice during injection |
| Parafilm | StatLab | PM996 | Used to draw solution into syringe |
| Retractors | Stoelting | 52124P | For rat >21 only. Used to hold skin incision open |
| Scalpel Blade | Fine Science Tools | 10015-00 | For rat >21 only. Used for incision |
| Scalpel Blade Handle | Fine Science Tools | 10003-12 | For rat >21 only. Used for incision |
| Sterile Syringe | Fisher Scientific | 14-955-459 | Used to filter dye solution |
| Surgical Scrub (Skin Prep) | Medline Industries Inc. | MDS098720 | For rat >21 only. Used for skin prep |
| Suture or Wound Clips | Stoelting | 50483 | For rat >21 only. Used for skin closure. |
| Syringe / Needle Cleaning Solution | Hamilton | 18311 | Can use alternative cleaning solution |
| Thumb Forceps | Fine Science Tools | 11019-12 | For rat >21 only. Used throughout surgical approach and closure |
| Vector Solution | Injection solution |
Riferimenti
- Deverman, B. E., Ravina, B. M., Bankiewicz, K. S., Paul, S. M., Sah, D. W. Y. Gene therapy for neurological disorders: Progress and prospects. Nat Rev Drug Discov. 17 (9), 641-659 (2018).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Ling, Q., Herstine, J. A., Bradbury, A., Gray, S. J. AAV-based in vivo gene therapy for neurological disorders. Nat Rev Drug Discov. 22 (10), 789-806 (2023).
- Lykken, E. A., Shyng, C., Edwards, R. J., Rozenberg, A., Gray, S. J. Recent progress and considerations for AAV gene therapies targeting the central nervous system. J Neurodev Disord. 10 (1), 16(2018).
- Hocquemiller, M., Giersch, L., Audrain, M., Parker, S., Cartier, N. Adeno-associated virus-based gene therapy for CNS diseases. Hum Gene Ther. 27 (7), 478-496 (2016).
- Chen, X., et al. Biodistribution of adeno-associated virus gene therapy following cerebrospinal fluid-directed administration. Hum Gene Ther. 34 (3-4), 94-111 (2023).
- Corning, J. L. Spinal anesthesia and local medication of the cord. NY Med. J. , 483-485 (1885).
- Hylden, J. L., Wilcox, G. L. Intrathecal morphine in mice: A new technique. Eur J Pharmacol. 67 (2-3), 313-316 (1980).
- Fairbanks, C. A. Spinal delivery of analgesics in experimental models of pain and analgesia. Adv Drug Deliv Rev. 55 (8), 1007-1041 (2003).
- Choi, S. E., et al. High-frequency ultrasound-guided intrathecal injections in a young mouse model: Targeting the central nervous system in drug delivery. J Neurosci Methods. 386, 109778(2023).
- Li, D., Li, Y., Tian, Y., Xu, Z., Guo, Y. Direct intrathecal injection of recombinant adeno-associated viruses in adult mice. J Vis Exp. 144, e58565(2019).
- Njoo, C., Heinl, C., Kuner, R. In vivo SiRNA transfection and gene knockdown in spinal cord via rapid noninvasive lumbar intrathecal injections in mice. J Vis Exp. 85, e51229(2014).
- Vulchanova, L., et al. Differential adeno-associated virus-mediated gene transfer to sensory neurons following intrathecal delivery by direct lumbar puncture. Mol Pain. 6, 31(2010).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Mestre, C., Pelissier, T., Fialip, J., Wilcox, G., Eschalier, A. A method to perform direct transcutaneous intrathecal injection in rats. J Pharmacol Toxicol Methods. 32 (4), 197-200 (1994).
- Donsante, A., Rasmussen, S. A., Fridovich-Keil, J. L. Intrathecal vector delivery in juvenile rats via lumbar cistern injection. J Vis Exp. 205, e66463(2024).
- Lu, X., Jiang, Y. H. Intrathecal injection of newborn mouse for genome editing and drug delivery. J Vis Exp. 205, e65761(2024).
- Chen, X., et al. Intrathecal AAV9/AP4M1 gene therapy for hereditary spastic paraplegia 50 shows safety and efficacy in preclinical studies. J Clin Invest. 133 (10), JCI164575(2023).
- Deschenes, N. M., et al. Biochemical correction of GM2 ganglioside accumulation in AB-variant GM2 gangliosidosis. Int J Mol Sci. 24 (11), ijms24119217(2023).
- Hwang, S. M., Rahman, M. M., Go, E. J., Kim, Y. H., Park, C. K. Specific transcription factors Ascl1 and Lhx6 attenuate diabetic neuropathic pain by modulating spinal neuroinflammation and microglial activation in mice. Biomed Pharmacother. 173, 116392(2024).
- Kagiava, A., et al. Gene replacement therapy in two Golgi-retained CMT1X mutants before and after the onset of demyelinating neuropathy. Mol Ther Methods Clin Dev. 30, 377-393 (2023).
- Wong, H., et al. CNS-dominant human FMRP isoform rescues seizures, fear, and sleep abnormalities in Fmr1-KO mice. JCI Insight. 8 (11), 169650(2023).
- Laoharawee, K., et al. Prevention of neurocognitive deficiency in mucopolysaccharidosis type ii mice by central nervous system-directed, AAV9-mediated iduronate sulfatase gene transfer. Hum Gene Ther. 28 (8), 626-638 (2017).
- Aanonsen, L. M., Wilcox, G. L. Phencyclidine selectively blocks a spinal action of N-methyl-D-aspartate in mice. Neurosci Lett. 67 (2), 191-197 (1986).
- Bailey, R. M., Armao, D., Nagabhushan Kalburgi, S., Gray, S. J. Development of intrathecal AAV9 Gene therapy for giant axonal neuropathy. Mol Ther Methods Clin Dev. 9, 160-171 (2018).
- Bailey, R. M., Rozenberg, A., Gray, S. J. Comparison of high-dose intracisterna magna and lumbar puncture intrathecal delivery of AAV9 in mice to treat neuropathies. Brain Res. 1739, 146832(2020).
- Chen, X., et al. AAV9/MFSD8 gene therapy is effective in preclinical models of neuronal ceroid lipofuscinosis type 7 disease. J Clin Invest. 132 (5), JCI146286(2022).
- Karumuthil-Melethil, S., et al. Intrathecal administration of AAV/GALC vectors in 10-11-day-old twitcher mice improves survival and is enhanced by bone marrow transplant. J Neurosci Res. 94 (11), 1138-1151 (2016).
- Ling, Q., Rioux, M., Hu, Y., Lee, M., Gray, S. J. Adeno-associated viral vector serotype 9-based gene replacement therapy for SURF1-related Leigh syndrome. Mol Ther Methods Clin Dev. 23, 158-168 (2021).
- Sinnett, S. E., Boyle, E., Lyons, C., Gray, S. J. Engineered microRNA-based regulatory element permits safe high-dose miniMECP2 gene therapy in Rett mice. Brain. 144 (10), 3005-3019 (2021).
- Rahman, M. M., Lee, J. Y., Kim, Y. H., Park, C. K. Epidural and Intrathecal Drug Delivery in Rats and Mice for Experimental Research: Fundamental Concepts, Techniques, Precaution, and Application. Biomedicines. 11 (5), 11051413(2023).
- Allen, C. H., Ward, J. D. An evidence-based approach to management of increased intracranial pressure. Crit Care Clin. 14 (3), 485-495 (1998).
- Belov, V., et al. Large-volume intrathecal administrations: Impact on CSF pressure and safety implications. Front Neurosci. 15, 604197(2021).
- Moazen, M., et al. Intracranial pressure changes during mouse development. J Biomech. 49 (1), 123-126 (2016).
- Rieselbach, R. E., Di Chiro, G., Freireich, E. J., Rall, D. P. Subarachnoid distribution of drugs after lumbar injection. N Engl J Med. 267, 1273-1278 (1962).
- Pardridge, W. M. CSF, blood-brain barrier, and brain drug delivery. Expert Opin Drug Deliv. 13 (7), 963-975 (2016).
- Ghersi-Egea, J. F., Babikian, A., Blondel, S., Strazielle, N. Changes in the cerebrospinal fluid circulatory system of the developing rat: quantitative volumetric analysis and effect on blood-CSF permeability interpretation. Fluids Barriers CNS. 12, 8(2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon