Method Article
Lumbale intrathekale Injektion von Gentherapie-Vektoren für das Targeting des Zentralnervensystems bei Mäusen und Ratten
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Eine lumbale intrathekale Injektion stellt einen translational relevanten Verabreichungsweg für die Verabreichung einer Gentherapie an das zentrale Nervensystem dar. Dieses umfassende standardisierte Protokoll für lumbale intrathekale Injektionen bei Neugeborenen, juvenilen und adulten Mäusen und Ratten soll Forscher bei der Übernahme dieser Technik für präklinische Gentherapiestudien unterstützen.
Zusammenfassung
Eine Methode, um das zentrale Nervensystem zur Behandlung neurologischer Erkrankungen zu behandeln, ist die Verwendung des lumbalen intrathekalen Verabreichungswegs. Dieser Ansatz umgeht die Blut-Hirn-Schranke, um direkt auf die Zerebrospinalflüssigkeit zuzugreifen und bevorzugt Zellen im Zentralnervensystem zu treffen. Mehrere veröffentlichte präklinische Studien, in denen die lumbale intrathekale Injektion angewendet wurde, haben zur Entwicklung klinischer Gentherapiestudien beigetragen. Die beschriebenen Protokolle sind jedoch variabel und über mehrere Ressourcen verteilt. Hier wird ein umfassender Satz von Protokollen für lumbale intrathekale Injektionen bei Neugeborenen, juvenilen und adulten Mäusen und Ratten für präklinische Gentherapiestudien vorgestellt. Mit der richtigen Schulung kann diese Injektionstechnik schnell und zuverlässig durchgeführt werden. Neben der detaillierten Beschreibung des Injektionsprotokolls in jeder Entwicklungsphase werden die damit verbundenen Parameter, wie z. B. das Injektionsvolumen, diskutiert, die die Studienergebnisse beeinflussen können. Um die Anwendung von lumbalen intrathekalen Injektionen zur Ausrichtung auf das Zentralnervensystem zu demonstrieren, wird die Expression des Adeno-assoziierten Virus Serotyp 9 im Gehirn, im Rückenmark und im peripheren Gewebe nach einer erfolgreichen oder erfolglosen Injektion vorgestellt.
Einleitung
Eine Herausforderung bei der Behandlung neurologischer Erkrankungen, die eine globale Verabreichung des Zentralnervensystems (ZNS) erfordern, aber ansonsten gute Kandidaten für eine Gentherapie sind, wurde weitgehend auf ein ineffizientes Targeting des ZNS und relevanter Zelltypen zurückgeführt1. Es wird intensiv geforscht, um das globale Targeting von ZNS-Zellen und -Geweben durch die Entwicklung von Verabreichungsvehikeln zu optimieren 1,2. Eine einigermaßen weit verbreitete Vektorverabreichung kann jedoch mit der derzeitigen Gentherapie-Vektortechnologie unter Verwendung bestimmter Kombinationen von viralen Vektoren und Verabreichungswegen immer noch erreicht werden 3,4. Der derzeitige Goldstandard für eine weit verbreitete ZNS-Verabreichung durch eine einmalige Behandlung ist die Verwendung des Adeno-assoziierten Virus Serotyp 9 (AAV9) zusammen mit einer direkten Injektion in die Zerebrospinalflüssigkeit (CSF).
Es gibt drei typische Verabreichungswege für direkte Liquorinjektionen: lumbale intrathekale (IT), intrazerebroventrikuläre (ICV) und intrazisternale (ICM)5. Jeder dieser Verabreichungswege führt zu unterschiedlichen Bioverteilungsmustern im ZNS und im peripheren Gewebe, aber sie alle haben den Vorteil, dass sie die Blut-Hirn-Schranke (BHS) umgehen, um die Zellen im ZNS zu erreichen, die zur Pathologie und den Phänotypen der neurologischen Erkrankung beitragen6. Die lumbale IT-Injektion ist der Standard für die klinische Verabreichung von Medikamenten beim Menschen, da das klinische Verfahren routinemäßig und unkompliziert ist und im Vergleich zu ICV- und ICM-Injektionen weniger invasiv ist.
Die lumbale IT-Injektion ist eine etablierte Technik, die im Bereich der Anästhesie und Analgetika gerne eingesetzt wird, wobei die erste Arbeit 1885 veröffentlicht wurde7. Das erste Protokoll für lumbale IT-Injektionen bei erwachsenen Mäusen wurde 1980veröffentlicht 8 und seitdem weithin übernommenund überprüft 9. Geringfügige Anpassungen oder Verbesserungen an diesen Protokollen wurden vorgenommen 10,11,12, einschließlich einer produktschonenden Technik 13. Protokolle für lumbale IT-Injektionen bei erwachsenen Ratten wurden ebenfalls erstmals 1976 veröffentlicht, mit Katheterisierung für chronische Verabreichung14 und Direktinjektion für einmalige Behandlungen15. In jüngerer Zeit haben Gruppen Protokolle für lumbale IT-Injektionen bei Neugeborenen oder juvenilen Mäusen und Ratten veröffentlicht16,17.
Die breite Akzeptanz und Validierung dieser Technik zur Umgehung der BHS und der Zielzellen im ZNS hat zu mehreren erfolgreichen präklinischen und klinischen Gentherapiestudien zur Behandlung neurologischer Erkrankungen geführt. Positive Wirksamkeits- und Sicherheitsdaten bei Mäusen, Ratten und nicht-menschlichen Primaten, die neurologische Erkrankungen modellieren, haben Begeisterung und Interesse am potenziellen klinischen Nutzen für diese Krankheiten geweckt 18,19,20,21,22,23. Eine Handvoll dieser Studien befindet sich derzeit in klinischen Studien (z. B. clinicaltrials.gov Identifikatoren NCT02362438, NCT04737460, NCT03381729 und NCT05518188)3,6. In diesem Artikel wird ein einfaches Protokoll für lumbale IT-Injektionen bei Mäusen und Ratten unterschiedlichen Alters beschrieben, ohne Liquor zu entfernen, das für translationale Gentherapieprojekte übernommen werden kann. Dieses Protokoll ähnelt bereits verfügbaren Protokollen, die weit verbreitet sind. Es ist jedoch sinnvoll, diese relevanten Protokolle an einem Ort zu zitieren, um einen einfachen Zugang und eine einfache Referenz zu ermöglichen, zusammen mit den begleitenden Videovisuals. Dieses Protokoll erklärt die Injektion für neugeborene Mäuse und Ratten am postnatalen Tag (P) 0-1 und juvenile Mäuse und Ratten P21, mit repräsentativen Ergebnissen einer erfolgreichen und erfolglosen lumbalen IT-Injektion an P1 bei Mäusen. In der Diskussion werden häufige Fehltritte und spezifische Details, die bei der Durchführung dieses Verfahrens besondere Aufmerksamkeit erfordern, sowie Empfehlungen, wie diese Injektionen vor Beginn einer präklinischen Studie geübt werden sollten, angesprochen.
Protokoll
Die hier beschriebenen Verfahren wurden vom Institutional Animal Care and Use Committee (IACUC) am Southwestern Medical Center der University of Texas genehmigt. Männliche und weibliche Wildtyp-Mäuse vom Typ C57BL6/J im Alter von P1-P28 wurden für Protokolle mit Mäusen verwendet. Männliche und weibliche Wildtyp-Ratten vom Typ Sprague-Dawley im Alter von P1-P56 wurden für Protokolle mit Ratten verwendet. Abgesehen von der in Abschnitt 3 beschriebenen Überlebensoperation gelten alle anderen Eingriffe als nur vorübergehende Beschwerden und erfordern keine Anästhetika oder Analgetika. Einzelpersonen sollten Labortiere auf mehr als nur vorübergehende Beschwerden überwachen und sich von ihrem IACUC- und Veterinärpersonal über die Notwendigkeit von Anästhetika und Analgetika beraten lassen. Einzelheiten zu den verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Lumbale IT-Injektion von Mäusen >P21
- Präparat
- Bereiten Sie die Injektionslösungen vor, einschließlich des Gentherapievektors in der/den gewünschten Konzentration(en) und einer Kontrolllösung (in der Regel der Formulierungspuffer, der bei der Vektorherstellung verwendet wird). Die Injektionslösungen sollten steril sein und während des gesamten Eingriffs steril bleiben.
HINWEIS: Alle Lösungen sollten für die Dauer des Eingriffs auf Eis gehalten werden. - Sammeln und desinfizieren Sie alle Materialien, einschließlich Spritze und Nadel, Pipette und Injektionslösung. Befolgen Sie die institutionellen Richtlinien bezüglich der Verwendung von Biosicherheitswerkbänken und der Exposition gegenüber Injektionsmitteln. Die hier beschriebenen Verfahren wurden in einer Biosicherheitswerkbank der Klasse 2 durchgeführt.
- Messen Sie mit einer Mikroliterpipette das gewünschte Volumen der Injektionslösung und geben Sie es auf einen sterilen Paraffinfilm. Ein Injektionsvolumen von 5 μl wird häufig verwendet und wird als Zielvolumen für adulte Mäuse >P21 behandelt (Tabelle 1).
HINWEIS: Die Lautstärke kann bei Bedarf erhöht werden; Die Tiere sollten jedoch engmaschig auf Nebenwirkungen bei größeren Injektionsmengen überwacht werden. Einzelheiten zum Injektionsvolumen und zu Nebenwirkungen finden Sie im Abschnitt Diskussion. Die Lösung kann auch direkt von der Pipettenspitze auf eine Spritze übertragen werden, oder kalibrierte gasdichte Mikroliterspritzen können verwendet werden, um das Volumen der Injektionslösung direkt zu messen. - Ziehen Sie die Lösung mit einer 30 G 0,5" Nadel in eine Mikroliterspritze und achten Sie darauf, keine Luftblasen zu bilden.
HINWEIS: Die Nadelstärke und -länge können die Hautpenetration beeinflussen. Bei der Betrachtung der Größe der zu verwendenden Spritze sollte das Injektionsvolumen nicht weniger als 10 % der Spritzenkapazität betragen. Bei Volumina von mehr als 50 % der Spritzenkapazität stellen Sie sicher, dass der Kolben leicht mit dem Zeigefinger gedrückt werden kann. Wenn der Kolben nicht leicht gedrückt werden kann, verwenden Sie eine Spritze mit größerem Fassungsvermögen.
- Bereiten Sie die Injektionslösungen vor, einschließlich des Gentherapievektors in der/den gewünschten Konzentration(en) und einer Kontrolllösung (in der Regel der Formulierungspuffer, der bei der Vektorherstellung verwendet wird). Die Injektionslösungen sollten steril sein und während des gesamten Eingriffs steril bleiben.
- Zurückhaltend
- Halten Sie die bewusste (nicht betäubte) Maus mit der dominanten Hand am Schwanz auf einem Papiertuch fest. Das Papiertuch hilft, die Maus zu bändigen, zu beruhigen und zu verhindern, dass sie beißt. Die Maus sollte sich in der neutralen Bauchlage befinden, wobei die seitliche Seite des Körpers zu Ihnen zeigt.
HINWEIS: Es ist nicht notwendig, Mäuse vor dem Eingriff an diese Fixierung zu erziehen oder zu gewöhnen. Mäuse können aufgrund der Fixierung Schwierigkeiten haben, sollten aber keine spezifische Schmerzreaktion hervorrufen. Wenn mehr als nur vorübergehende Schmerzreaktionen beobachtet werden, kann die Verabreichung von Analgetika erforderlich sein. Suchen Sie tierärztlichen Rat ein. - Falten Sie mit der nicht-dominanten Hand einen Teil des Papiertuchs über den Kopf und den Oberkörper der Maus und fassen Sie den Beckengürtel fest zwischen Daumen und Zeigefinger. Stellen Sie sicher, dass die Handfläche umschlossen ist und um den Kopf der Maus herum liegt. Der Beckenkamm der Maus sollte tastbar sein und in der Mitte der distalen Phalanx jedes Fingers positioniert sein (Abbildung 1A,B).
HINWEIS: Das Zurückhalten von der Hand oder von einem Papiertuch sollte die Atmung nicht beeinträchtigen. - Drehen Sie vorsichtig die Basis des Schwanzes, um die richtige Ausrichtung der Wirbelsäule zu gewährleisten. Das Becken der Maus sollte rechtwinklig sein, so dass die Wirbelfortsätze der Lendenwirbelsäule senkrecht zur Arbeitsfläche stehen.
- Tupfen Sie die dorsale Lendenwirbelsäule der Maus mit einem Vorbereitungspad mit 70 % Alkohol ab.
- Teilen Sie das Haar ~2-6 mm kranial zum Beckenkamm, um die Injektionsstelle besser sichtbar zu machen.
- Fühlen Sie nach dem L4-L5 oder L5-L6 Zwischenwirbelraum, ~2-6 mm kranial zum Beckenkamm.
HINWEIS: Die genaue Entfernung ist je nach Größe und Alter der Maus variabel.
- Halten Sie die bewusste (nicht betäubte) Maus mit der dominanten Hand am Schwanz auf einem Papiertuch fest. Das Papiertuch hilft, die Maus zu bändigen, zu beruhigen und zu verhindern, dass sie beißt. Die Maus sollte sich in der neutralen Bauchlage befinden, wobei die seitliche Seite des Körpers zu Ihnen zeigt.
- Injektion
- Halten Sie mit der dominanten Hand die Mitte der Mikroliterspritze fest und positionieren Sie sie senkrecht zur Wirbelsäule der Maus im Zwischenwirbelraum L4-L5 oder L5-L6. Achten Sie darauf, dass der Kolben der Spritze mit dem Zeigefinger gedrückt werden kann, ohne dass die Hand übermäßig bewegt wird. Mit der Abschrägung der Nadel zum Kopf der Maus zeigend, stechen Sie die Haut über dem Zwischenwirbelraum ein.
- Wenn die Ränder des Knochens um den Zwischenwirbelraum an der Spitze der Nadel zu spüren sind, reduzieren Sie den Winkel der Spritze auf 30-45 Grad (Abbildung 1A).
- Die Nadel sollte in den Zwischenwirbelraum gleiten, was zu einem plötzlichen Schwanzschlag führt, und sollte fest zwischen den Wirbeln eingeklemmt werden.
- Achten Sie darauf, dass sich die Spritze nicht verschiebt, und drücken Sie den Kolben gleichmäßig nieder, um die Lösung innerhalb von 10 s abzugeben.
- Halten Sie die Spritze nach dem vollständigen Drücken des Kolbens 15-30 s lang an Ort und Stelle, um die Ableitung der Lösung zu ermöglichen und einen Rückfluss zu verhindern.
- Ziehen Sie die Spritze sanft und langsam im gleichen Einfallswinkel von 30 bis 45 Grad aus der Maus zurück. Wenn die Nadel zurückgezogen wird, drehen Sie die Spritze, um einen Rückfluss zu verhindern.
HINWEIS: Achten Sie darauf, die Nadel beim Drehen der Spritze nicht vorzuschieben, da dies zu körperlichen Schäden am Rückenmark führen kann. - Lösen Sie die Maus aus der Fesselung und bringen Sie sie in den Heimatkäfig zurück.
- Überwachen Sie die Maus nach der Injektion auf abnormale Gehfähigkeit, motorische Beeinträchtigungen, Atemanomalien und Koordination. Weitere Informationen zu Nebenwirkungen finden Sie in der Diskussion.
- Reinigen Sie die Geräte gemäß den Empfehlungen des Herstellers. Bei Mehrfachinjektionen werden für jeden Gentherapievektor und jede Kontrolllösung unterschiedliche Spritzen empfohlen.
HINWEIS: Abnehmbare Nadeln können mehrmals gereinigt, sterilisiert und wiederverwendet werden. Stumpfe Nadeln sollten jedoch nicht verwendet werden, da sie dem Tier schaden und die Wahrscheinlichkeit von verpassten Injektionen erhöhen können. Eine stumpfe Nadel sticht nicht leicht in die Haut und sollte entsprechend entsorgt werden. Wenn die Spritzen begrenzt sind, ist es ratsam, alle Vehikelinjektionen abzuschließen, bevor Sie mit dem Gentherapievektor fortfahren, und die niedrigste Gentherapiedosis zu injizieren, bevor höhere Dosen verabreicht werden. - Befolgen Sie die institutionellen Richtlinien für die Sterilisation von Geräten zwischen Tieren.
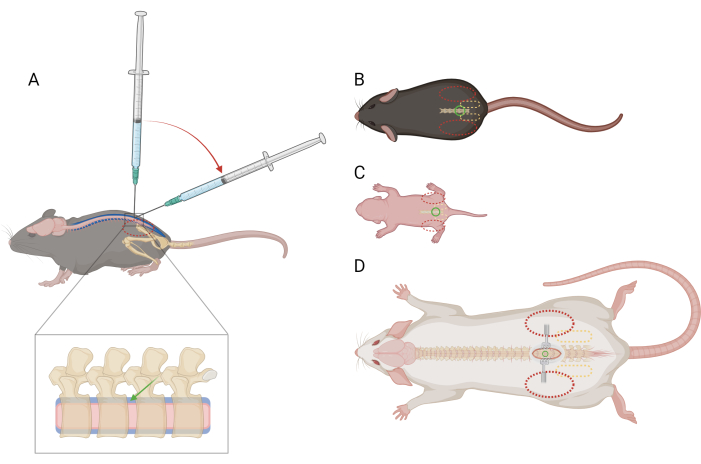
Abbildung 1: Schematische Darstellung der Finger- und Spritzenplatzierung für die lumbale intrathekale Injektion bei Mäusen und Ratten. (A) Seitenansicht einer Maus >P21 mit Nadelplatzierung und Spritzenwinkelübergang während einer lumbalen IT-Injektion. Das gestrichelte rote Oval zeigt die Positionierung der Finger über dem Beckenkamm der Maus an. Eine vergrößerte Ansicht der Wirbelsäule zeigt den intrathekalen Raum (blau) mit ungefährer Nadelplatzierung (grüner Pfeil) und das Rückenmark (rosa). Dorsale Ansicht von (B) einer Maus >P21, (C) einer Maus D) einer Ratte >P21, mit Referenzpunkten für die Platzierung der Nadel (grüner Kreis), den Beckengürtel (gestricheltes gelbes Oval) und die Fingerplatzierung (gestricheltes rotes Oval). Die Inzisionsstelle und die Retraktoren sind ebenfalls in (D) dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Lumbale IT-Injektion von Mäusen und Ratten
- Präparat
- Folgen Sie Schritt 1.1. Die einzige Ausnahme ist das Einspritzvolumen in Schritt 1.1.3.
HINWEIS: Die empfohlenen Injektionsvolumina für neugeborene Mäuse (P0-P1) sollten 3 μl, für juvenile Mäuse (P5-P7) nicht mehr als 5 μl und für juvenile Mäuse (P10) nicht mehr als 10 μl betragen. Die empfohlenen Injektionsvolumina für neugeborene Ratten (P0-P1) sollten 5 μl, für juvenile Ratten (P5-P7) nicht mehr als 10 μl und für juvenile Ratten (P10) nicht mehr als 30 μl betragen (Tabelle 1).
- Folgen Sie Schritt 1.1. Die einzige Ausnahme ist das Einspritzvolumen in Schritt 1.1.3.
- Zurückhaltend
- Halten Sie die Maus/Ratte mit der dominanten Hand am Schwanz auf einem Papiertuch fest. Die Maus/Ratte sollte sich in neutraler Bauchlage befinden, wobei die seitliche Seite des Körpers zu Ihnen zeigt.
HINWEIS: Mäuse/Ratten können aufgrund der Fixierung Schwierigkeiten haben, sollten aber keine spezifische Schmerzreaktion hervorrufen. Wenn mehr als nur vorübergehende Schmerzreaktionen beobachtet werden, kann die Verabreichung von Analgetika erforderlich sein. Suchen Sie tierärztlichen Rat ein. - Fassen Sie den Beckengürtel sanft, aber fest zwischen Daumen und Zeigefinger. Der Beckenkamm sollte tastbar sein und in der Mitte der distalen Phalanx jedes Fingers positioniert sein (Abbildung 1C).
HINWEIS: In diesem Alter besteht keine Sorge, gebissen zu werden, daher ist es nicht erforderlich, das Papiertuch über die Maus/Ratte zu wickeln. Es kann notwendig sein, bei P5-10 Ratten ein Papiertuch zu verwenden, um die größeren Rattenbabys ruhig zu halten. - Drehen Sie vorsichtig die Basis des Schwanzes, um die richtige Ausrichtung der Wirbelsäule zu gewährleisten. Das Becken der Maus/Ratte sollte rechtwinklig sein, so dass die Wirbelfortsätze der Lendenwirbelsäule senkrecht zur Arbeitsfläche stehen.
- Tupfen Sie die dorsale Lendenwirbelsäule der Maus/Ratte mit einem Vorbereitungspad mit 70 % Alkohol ab.
- Teilen Sie das Haar, falls zutreffend, ~1-3 mm kranial zum Beckenkamm, um die Injektionsstelle besser sichtbar zu machen. Die Visualisierung des Zielbereichs ist bei jüngeren Mäusen/Ratten einfacher. Bei haarlosen Neugeborenen kann eine Vertiefung im Zwischenwirbelraum zu sehen sein.
- Fühlen oder visualisieren Sie den L4-L5- oder L5-L6-Zwischenwirbelraum, ~1-3 mm kranial zum Beckenkamm.
HINWEIS: Die genaue Entfernung ist je nach Größe und Alter der Maus/Ratte variabel.
- Halten Sie die Maus/Ratte mit der dominanten Hand am Schwanz auf einem Papiertuch fest. Die Maus/Ratte sollte sich in neutraler Bauchlage befinden, wobei die seitliche Seite des Körpers zu Ihnen zeigt.
- Injektion
- Halten Sie mit der dominanten Hand die Mitte der Mikroliterspritze fest und positionieren Sie sie in einem Winkel von 30-45 Grad zur Wirbelsäule der Maus/Ratte. Mit der Fase der Nadel in Richtung des Kopfes der Maus/Ratte stechen Sie die Haut etwa 1-3 mm caudle zum Zwischenwirbelraum ein. Aufgrund der abgewinkelten Ausrichtung der Spritze liegt der Einstichpunkt auf der Haut leicht kaudal zum Zwischenwirbelraum.
HINWEIS: Dieser Abstand kann sich je nach Alter und Größe der Maus/Ratte ändern. - Die restlichen Schritte sind identisch mit den Schritten 1.3.3-1.3.10 von Mäusen >P21.
- Halten Sie mit der dominanten Hand die Mitte der Mikroliterspritze fest und positionieren Sie sie in einem Winkel von 30-45 Grad zur Wirbelsäule der Maus/Ratte. Mit der Fase der Nadel in Richtung des Kopfes der Maus/Ratte stechen Sie die Haut etwa 1-3 mm caudle zum Zwischenwirbelraum ein. Aufgrund der abgewinkelten Ausrichtung der Spritze liegt der Einstichpunkt auf der Haut leicht kaudal zum Zwischenwirbelraum.
3. Lendenwirbelsäulen-IT-Injektion von Ratten >P21
HINWEIS: In der Literatur werden mehrere IT-Injektionsverfahren beschrieben, die von nicht anästhesierten Techniken bis hin zu umfangreicheren chirurgischen Ansätzen reichen14,15. Beschrieben wird ein Verfahren zur Direktinjektion in minimal-invasiver Technik unter leichter Narkose und einem kleinen Hautschnitt. Die Verwendung von Anästhesiemitteln, wie z. B. Isoflurangas, kann bei der Fixierung helfen, die Muskulatur entspannen und Bewegungen während der Injektion verhindern. Ein kleiner Hautschnitt über der Injektionsstelle verbessert die Genauigkeit der Injektion, indem er die Visualisierung des Zwischenwirbelraums ermöglicht und die Notwendigkeit einer Durchstichung durch dicke Haut eliminiert. Aufgrund des Schnittes ist der Einsatz von Anästhetika und Analgetika erforderlich. Mit der Praxis ist es möglich, lumbale IT-Injektionen bei Ratten, die älter als P21 sind, ohne Anästhesie oder Schnitt nach Ermessen des Benutzers und vorbehaltlich der institutionellen Anforderungen durchzuführen15. Befolgen Sie die institutionellen Richtlinien und Überlegungen in Bezug auf Anästhesie, geeignete Analgetika und Überlebensoperationen für Labortiere.
- Präparat
- Folgen Sie Schritt 1.1. Die einzigen Ausnahmen sind das Injektionsvolumen in Schritt 1.1.3 und die Nadelstärke in Schritt 1.1.4. Das Injektionsvolumen für Ratten kann je nach Alter und Körpergröße stark variieren. Weitere Informationen zum Injektionsvolumen in verschiedenen Altersstufen finden Sie im Abschnitt "Diskussion" (Tabelle 1).
HINWEIS: Für erwachsene Ratten wird eine 27 G x 1" Nadel empfohlen, da sich kleinere Nadeln verbiegen können und kürzere Nadeln den intrathekalen Raum möglicherweise nicht ausreichend durchdringen. Auf Wunsch kann eine längere (1,25-1,5") Nadel verwendet werden. - Betäuben Sie die Ratte mit dem bevorzugten und zugelassenen Anästhetikum (gemäß den institutionell anerkannten Protokollen).
HINWEIS: Für die hier beschriebenen Verfahren wurden Ratten mit Isoflurangas und einer 1:1-Mischung aus Lidocain anästhesiert: Bupivacain wurde als Lokalanästhetikum verwendet. Die Körpertemperatur sollte während des gesamten Eingriffs und der Genesung mit einer zugelassenen externen Wärmequelle aufrechterhalten werden. - Befolgen Sie die standardmäßige aseptische Vorbereitung der Operationsstelle für jedes Tier. Rasieren Sie kurz die dorsale Lendenwirbelsäule und bereiten Sie die Haut mit einem chirurgischen Peeling, Betadin und 70% Isopropylalkohol vor.
- Folgen Sie Schritt 1.1. Die einzigen Ausnahmen sind das Injektionsvolumen in Schritt 1.1.3 und die Nadelstärke in Schritt 1.1.4. Das Injektionsvolumen für Ratten kann je nach Alter und Körpergröße stark variieren. Weitere Informationen zum Injektionsvolumen in verschiedenen Altersstufen finden Sie im Abschnitt "Diskussion" (Tabelle 1).
- Chirurgischer Eingriff
- Bringen Sie die Ratte in die neutrale Bauchlage, wobei die seitliche Seite des Körpers zu Ihnen zeigt.
- Palpieren Sie den Beckengürtel und identifizieren Sie den Beckenkamm und den lumbosakralen Übergang. Bei Ratten >P21 lassen sich die Wirbelfortsätze gut identifizieren.
- Machen Sie mit einem Skalpell einen 1 cm langen Schnitt über den Zwischenwirbelraum L4-L5 oder L5-L6. Der Schnitt sollte nur die Haut und die darunter liegende Faszie betreffen und den Muskel intakt lassen.
HINWEIS: Es ist hilfreich, Retraktoren zu verwenden, um die Haut während des restlichen Eingriffs offen zu halten. - Fassen Sie den Beckengürtel sanft, aber fest zwischen Daumen und Zeigefinger. Der Beckenkamm sollte tastbar sein und in der Mitte der distalen Phalanx jedes Fingers positioniert sein (Abbildung 1D). Sondieren Sie mit einer Mückenzange entlang der Mittellinie des Rückens, um den Zwischenwirbelraum zu lokalisieren.
- Injektion
- Halten Sie mit der dominanten Hand die Mitte der Mikroliterspritze fest und positionieren Sie sie senkrecht zur Rattenwirbelsäule im Zwischenwirbelraum L4-L5 oder L5-L6. Stellen Sie sicher, dass der Kolben der Spritze mit dem Zeigefinger gedrückt werden kann, ohne dass die Hand übermäßig bewegt wird. Mit der Fase der Nadel zum Kopf der Ratte zeigend, stechen Sie mit der Nadel den Muskel über den Zwischenwirbelraum.
- Schieben Sie die Nadel in den Zwischenwirbelraum vor.
HINWEIS: Die Nadel kann einen leichten Widerstand aufweisen, wenn sie zwischen den Wirbelfortsätzen hindurchläuft, und der Winkel der Spritze muss möglicherweise leicht angepasst werden, um durch diesen Spalt zu gelangen. Es sollte jedoch etwa 90 Grad senkrecht zur Wirbelsäule bleiben. Ein Knacken ist zu spüren, wenn die Nadel in den intrathekalen Raum eintritt. Abhängig von den anästhetischen Parametern kann ein Schwanz- oder Beinschlag spürbar sein oder auch nicht. Die Nadel sollte fest zwischen den Wirbeln eingeklemmt werden. - Achten Sie darauf, die Spritze nicht aus ihrer Position zu bewegen, und drücken Sie den Kolben, um die Lösung innerhalb von 30 s abzugeben.
HINWEIS: Im Gegensatz zu den Injektionen bei Mäusen ist es bei Ratten >P21 mit dieser Methode möglicherweise nicht möglich, den Spritzenwinkel zu reduzieren. Größere Volumina sollten langsamer eingespritzt werden, um einen übermäßigen Druckaufbau zu vermeiden. - Halten Sie die Spritze 30-60 s lang an Ort und Stelle, nachdem Sie den Kolben vollständig gedrückt haben, um die Ableitung der Lösung zu ermöglichen und einen Rückfluss zu verhindern.
- Ziehen Sie die Spritze vorsichtig aus der Ratte heraus. Wenn die Nadel zurückgezogen wird, drehen Sie die Spritze, um einen Rückfluss zu verhindern.
HINWEIS: Achten Sie darauf, die Nadel beim Drehen der Spritze nicht vorzuschieben, da dies zu körperlichen Schäden am Rückenmark führen kann. - Verschließen Sie den Hautschnitt mit einer zugelassenen Methode, wie z. B. Naht- oder Wundclips. Bei den Ratten, die in diesem Protokoll verwendet wurden, wurde die Haut in einem kontinuierlichen intradermalen oder einfach unterbrochenen Muster mit einer 5-0 PDS II-Naht verschlossen.
- Erholen Sie die Ratte aus der Narkose.
- Befolgen Sie die Schritte 1.3.9-1.3.10 und alle Richtlinien für die postoperative Versorgung.
Ergebnisse
Obwohl viele Faktoren die Vektortransduktion der Gentherapie beeinflussen können, bleibt die histologische Färbung des Gewebes die genaueste Methode zur Bestimmung des Erfolgs von lumbalen intrathekalen (IT) Injektionen. Eine breite und gleichmäßige Verteilung des Gentherapievektors im Zentralnervensystem (ZNS) nach der Injektion ist ein Hinweis auf ein erfolgreiches Verfahren. Abbildung 2C zeigt eine erfolgreiche Injektion einer selbstkomplementären AAV9-vermittelten Gentherapie, die eine schwache ubiquitäre Transgenexpression unter dem JeT-Promotor in einer Dosis von 1,3 × 1011 vg/Maus bei neonatalen (P1) Mäusen 4 Monate nach der Injektion fördert. Die RNAscope-Analyse mit einer Sonde, die auf das von der Gentherapie verabreichte Transgen abzielt, zeigt eine breite Verteilung im lumbalen Rückenmark, im zervikalen Rückenmark und im Gehirn. Ein Abschnitt der Leber und des Herzens ist enthalten, um hervorzuheben, dass der Gentherapie-Vektor auch bei direkter Injektion von Liquor (Liquor) immer noch an periphere Gewebe verteilt werden kann.

Abbildung 2: Gefärbte 5-Mikron-Gewebeschnitte des ZNS der Maus und des peripheren Gewebes 4 Monate nach der Injektion bei P1. Die rote Färbung zeigt die Transgenexpression über das RNAscope an, die blaue Gegenfärbung der Zellkerne erfolgt über Hämatoxylin. (A) Injektion mit einem Puffer der Kontrollformulierung. (B) Erfolglose intraparenchymale Injektion mit einem AAV9-Vektor (scAAV9_JeT-hDDX3Xopt-SpA). (C) Erfolgreiche lumbale IT-Injektion mit einem AAV9-Vektor (scAAV9_JeT-hDDX3Xopt-SpA). Der in (B) und (C) verwendete Gentherapievektor wurde in einer translational relevanten Dosis von 1,3E11 vg/Maus verabreicht. Maßstabsleiste: obere Platte (5 mm); Bodenplatte (1 mm). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Eine konzentrierte Expression im lumbalen Rückenmark gepaart mit einem Mangel an Expression im Gehirn, wie in Abbildung 2B gezeigt, kann auf eine intraparenchymale Injektion des Rückenmarks hinweisen und sollte als fehlgeschlagene Injektion angesehen werden. Dies geschieht, wenn die Nadel zu weit in die Wirbelsäule, über den intrathekalen Raum hinaus und in das Rückenmark eingeführt wird. Darüber hinaus sollte eine sehr geringe oder keine Expression im Rückenmark und im Gehirn (nicht gezeigt) ebenfalls als fehlgeschlagene Off-Target-Injektion angesehen werden, unter der Annahme, dass ein Vektor und eine Dosis verwendet werden, bei denen eine breite ZNS-Verteilung erwartet wird. Dies kann daran liegen, dass die Nadel nicht weit genug eingeführt wurde oder dass sie sich seitlich zur Mittellinie befindet.
Die Expressionsmuster, die bei erfolgreichen Injektionen beobachtet werden, können sich aufgrund der folgenden acht Faktoren unterscheiden: (1) Alter bei der Injektion, (2) bereits bestehende Immunität, (3) Infusionsrate, (4) Gentherapie-Vektor, (5) Dosis der Gentherapie, (6) Zelloberflächenproteine, (7) Tropismus und (8) gegebenenfalls eine geeignete Promotorwahl zur Steuerung der Transgenexpression6. Während die Expressionsmuster unterschiedlich sein können, ist die breite, gleichmäßige, weit verbreitete Verteilung universell, solange die Dosis mit einem wirksamen Vektor wie AAV9 ausreichend hoch ist.
Die größten Einschränkungen bei der Verwendung histologischer Analysen zur Bestätigung des Erfolgs der lumbalen IT-Injektion sind die langen Wartezeiten - das Warten bis zum Ende einer Studie, nachdem die Autopsie durchgeführt und das Gewebe entnommen wurde - und die umfangreichen Ressourcen, die bei der Verarbeitung von Gewebe aller Mäuse in einer großen Gentherapie-Studie erforderlich sind. Leider haben wir die Erfahrung gemacht, dass unmittelbare und direkte Indikatoren für eine positive oder negative Injektion unzuverlässig sein können. Der Schwanzreflex beim Eintritt der Nadel in den intrathekalen Raum ist jedoch ein guter Indikator für eine erfolgreiche Positionierung in Echtzeit und deutet wahrscheinlich auf eine erfolgreiche Injektion hin. Verwechseln Sie ein Zucken, wenn die Nadel die Haut einer nicht betäubten Maus/Ratte durchbohrt, nicht mit einer Schwanzbewegungsreaktion auf das Eindringen der Nadel in den intrathekalen Raum. Es wurde berichtet, dass die Verwendung von pharmakologischen Wirkstoffen wie NMDA, Substanz P und Lidocain, entweder im Training oder gemischt mit der experimentellen Injektionslösung, einen unmittelbareren Hinweis auf den Injektionserfolg gibt 9,11,24. Wenn diese Wirkstoffe in Betracht gezogen werden, ist es wichtig, ihre Verträglichkeit mit dem Gentherapievektor zu bewerten.
Diskussion
Die lumbale IT-Injektion ist ein schnelles und minimalinvasives Verfahren, das zur Behandlung von ZNS-Erkrankungen zuverlässig einen Gentherapie-Vektor in den Liquor einbringt 5,6. Das Verfahren ist translational relevant, und das hier beschriebene Protokoll beschreibt, wie dieser Verabreichungsweg bei Mäusen und Ratten aller Altersgruppen, von Neugeborenen bis zu Erwachsenen, durchgeführt wird. Es ist wichtig, dieses Protokoll für Mäuse und Ratten jeden Alters zu definieren und unterstützende Videos bereitzustellen, um den Forschern bei der Einführung dieser Methode für die Verabreichung von Gentherapien zu helfen. Die Erfahrung unseres Labors zeigt, dass dieses Protokoll konsistent über mehrere Benutzer und Studien hinweg im Laufe der Zeit implementiert werden kann 18,25,26,27,28,29,30.
Es gibt wichtige Unterschiede bei der Durchführung der lumbalen IT-Injektion bei jüngeren Mäusen/Ratten im Vergleich zu älteren Mäusen/Ratten, vor allem der Winkel, in dem die Nadel in die Wirbelsäule eingeführt wird, und das empfohlene Volumen, das injiziert wird. Die berichteten lumbalen IT-Injektionsvolumina variieren erheblich zwischen den Studien und zwischen den Spezies31. Die Berücksichtigung des Injektionsvolumens ist wichtig, um lang anhaltende Erhöhungen des intrakraniellen Drucks (ICP) zu vermeiden, die den Fluss des Liquors und des zerebralen Blutes beeinträchtigen, Beschwerden verursachen und zu chronischen neurologischen Komplikationen wie Hydrozephalus, Ischämie, Zellschädigung und Tod führen können32,33. Der ICP wird durch das Volumen des Liquors, des Hirnblutes und des ZNS-Gewebes bestimmt, das nicht direkt mit dem Körpergewicht korreliert werden kann. Bei normaler Funktion wird der ICP durch viele Faktoren automatisch reguliert, einschließlich des Liquorvolumens, des zerebralen Blutvolumens, der Atmung, der Körperposition, der Liquorproduktionsrate und der Geschwindigkeit der Liquordrainage in das Blut33,34. Das IT-Injektionsvolumen sollte daher auf der Grundlage der Liquoreigenschaften (Tabelle 1) und nicht auf der Grundlage des Körpergewichts 25,27,28,30 bestimmt werden. Die empfohlenen Injektionsmengen in jedem Alter und bei jeder Tierart sind fett gedruckt.
| Volumen der IT-Injektion | CSF-Werte bei Erwachsenen | |||||||
| P0-1 (μL) | P5-7 (μL) | P10 (μL) | >P21 (μL) | Gesamtvolumen (μL) | Produktionsrate (μL/min) | Umsatz (h) | Intrakranieller Druck (mm Hg) | |
| Mäuse | 3 | 5 | 5-10 kg | 5-20 Uhr | 30-4025,30 | 0,32-0,3525,30 | 1.7-225,30 kg | 5,0 +/- 0,528 |
| Ratten | 5 | 5-10 | 10-30 | 10-200 (20-75) | 15025 kg | 1,7-2,825 kg | 2-2,6625 kg | 8,6 +/- 1,7,27 |
Tabelle 1: Zusammenfassung der lumbalen IT-Injektionsvolumina für Mäuse und Ratten unterschiedlichen Alters. Fettgedruckte Werte werden empfohlen und wurden sicher geliefert. Die maximal möglichen Volumina wurden nicht formell bewertet. Zusätzliche Informationen über bekannte Liquorparameter -- Gesamtvolumen, Produktionsrate, Umsatz und Hirndruck -- bei Mäusen und Ratten sind als Referenz enthalten.
In der gesamten Branche mangelt es an Wissen über die Obergrenze für einmalige Bolus-IT-Injektionsvolumina. Bei erwachsenen Menschen, Ratten und Mäusen, bei denen das Liquorvolumen bekannt ist, scheint eine 30%ige Zunahme des gesamten Liquorvolumens keine chronischen Verletzungen oder Krankheiten zu verursachen 31,33,35,36. Das Fehlen bekannter Liquorvolumina bei juvenilen oder neonatalen Mäusen macht eine ähnliche Extrapolation unmöglich. Einige Gruppen beginnen, sich mit dem Volumen und der Produktion von Liquor bei jüngeren Tieren zu befassen37. Bis zu zusätzlichen Untersuchungen in diesen Bereichen wird das Injektionsvolumen weiterhin den von den Prüfärzten gemeldeten Werten unterliegen.
Mäuse und Ratten, insbesondere wenn sie in jüngerem Alter oder mit hohem Injektionsvolumen behandelt werden, können eine Muskelbeugung, eine Streckung der Gliedmaßen, eine schnelle Atmung oder eine vorübergehende Lähmung der Hintergliedmaßen hervorrufen, die sich innerhalb weniger Minuten von selbst auflösen sollte. In extremen Fällen können akute ICP-Erhöhungen kardiovaskuläre und respiratorische Anomalien verursachen, die tödlich sein können32,33. Wenn nach 24 Stunden postprozedurale Anomalien weiterhin bestehen, sollten die Mäuse/Ratten aus der Studie entfernt und auf humane Weise eingeschläfert werden. Eine anhaltende Lähmung der Hintergliedmaßen kann auftreten, wenn die Nadel zu weit eingeführt wird und das Rückenmark beeinträchtigt. Dies kann auf einen häufigen Fehler bei der Durchführung der lumbalen IT-Injektion zurückzuführen sein: die Bewegung der Spritze nach dem Schwanzschlag beim Drücken des Kolbens. Spritzen- und Nadelbewegungen sollten vermieden werden. Wenn die richtige Position mit der ersten Punktion nicht erreicht werden kann, kann ein zweiter Versuch an der gleichen Stelle unternommen werden. Wenn auch der zweite Versuch nicht erfolgreich ist, versuchen Sie, die Nadelposition so zu ändern, dass der nächste Zwischenwirbelraum anvisiert wird. Beachten Sie, dass mehrere Nadelstiche zum Auslaufen einer anschließenden erfolgreichen Injektion führen können.
Es kann einige Zeit dauern, bis Sie sich mit der lumbalen IT-Injektion vertraut gemacht haben. Um die Injektionen als terminales Verfahren zu üben, befolgen Sie das obige Protokoll mit einer zugelassenen Farbstofflösung, wie z. B. Evansblau oder 0,2 Mikrometer filtriertem McCormickgrün-Farbstoff (Abbildung 3) oder mit den pharmakologischen Wirkstoffen, die im Abschnitt "Repräsentative Ergebnisse" angesprochen werden. Die Verwendung von Farbstoff wird empfohlen, um die Injektion zu beheben und zu beherrschen, da innerhalb von 1 Minute leicht zu erkennen ist, ob eine Injektion erfolgreich oder fehlgeschlagen war. Die Verwendung von Farbstoffen gilt nur für Verfahren, die nicht überleben, da Tiere eine Reaktion auf den Farbstoff entwickeln können, wenn sie direkt an das ZNS verabreicht werden. Diese Reaktion kann innerhalb einer Minute nach erfolgreicher Injektion auftreten und ist durch schnellen Juckreiz und sich windende Bewegungen gekennzeichnet. Die Tiere sollten sofort eingeschläfert werden, sobald diese Reaktion beobachtet wird, um die Beschwerden zu minimieren. Nach einer erfolgreichen Übungsfärbeinjektion bleibt der Farbstoff in der Wirbelsäule lokalisiert (kein Farbstoff im nahegelegenen peripheren Gewebe) und wandert die Wirbelsäule hinauf zum Kleinhirn, Großhirn und Riechkolben. Bei P1 ist die Haut so transparent, dass man sehen kann, wie sich der Farbstoff an der Wirbelsäule im Schwanz nach unten bewegt. Wenn der Farbstoff das Gehirn nicht innerhalb weniger Minuten erreicht, schlägt die Injektion fehl.

Abbildung 3: McCormick-grüner Farbstoff im Gehirn nach erfolgreicher Übung lumbaler IT-Injektionen. Alle Gehirne stammen von P21-Mäusen, die mit 5 μL Farbstoff injiziert wurden, und sind in der ventralen Ansicht zu sehen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Weitere Informationen zu relevanten assoziierten Parametern für das präklinische Studiendesign, wie Virustiter und Dosen, finden Sie in den zuvor veröffentlichten Übersichtsarbeiten 3,6,31.
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Wir danken der UT Southwestern AAV Viral Vector Core Facility für die Herstellung des AAV9-Vektors und Yuhui Hu, Research Scientist im Gray Lab, für die Verarbeitung und Färbung des in Abbildung 2 dargestellten Gewebes.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.2 micron filter | Electron Microscopy Sciences | 67005 | Used to filter dye solution |
| 0.5 to 10 µL Pipette | Eppendorf | TI13690026 | Used to measure injection solution |
| 1.5 mL Microtube | Eppendorf | 22364111 | Used to store injection solutions |
| 10 µL Syringe | Hamilton | 7635-01 | Injection volume should not be less than 10% of syringe capacity |
| 10 to 100 µL Pipette | Eppendorf | TI13690029 | Used to measure injection solution |
| 10µl Pipette Tips | USA Scientific Inc | 11203810 | Used to measure injection solution |
| 100 µL Syringe | Hamilton | 7638-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 100 µL Pipette Tips | USA Scientific Inc | 11231840 | Used to measure injection solution |
| 25 µL Syringe | Hamilton | 7636-01 | Ideal for 5-10 µL injections. Injection volume should not be less than 10% of syringe capacity |
| 27 Gauge Needle(s) | Hamilton | 7803-01 | For rat >21 only. 27 gauge, Small Hub RN Needle, 1 in, point style 4 at 12°, 6/PK |
| 30 Gauge Needle(s) | Hamilton | 7803-17 | 30 gauge, Small Hub RN Needle, 0.5 in, point style 4 at 12°, 6/PK |
| 50 µL Syringe | Hamilton | 7637-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 70% Ethanol | Pharmco | 111000140 | Used to sanitize workspace and equipment |
| 70% Isopropyl Alcohol Prep Pads | PDI | B60307 | Used to prepare injection site |
| Analgesic | For rat >21 only. | ||
| Anesthetic (Isoflurane) | Piramal Critical Care | 66794001725 | For rat >21 only. |
| Betadine | Purdue Products | 6906606 | For rat >21 only. Used for skin prep |
| Control Solution | Injection solution | ||
| Dye Solution (green) | McCormick | For practice, non-survival only | |
| Gloves | Kimberly-Clark | 19-149-863B | PPE |
| Ice bucket with ice | Fisher Scientific | 03-395-150 | Maintain viral vector solution on ice |
| Mosquito Forceps (curved or straight) | Fine Science Tools | 13009-12 | For rat >21 only. Used to palpate intervertebral space. |
| Needle Holders | Fine Science Tools | 12002-12 | For rat >21 only. Used for skin closure with suture |
| Paper Towel | Berkshire | 18-998-123 | Used to restrain adult mice during injection |
| Parafilm | StatLab | PM996 | Used to draw solution into syringe |
| Retractors | Stoelting | 52124P | For rat >21 only. Used to hold skin incision open |
| Scalpel Blade | Fine Science Tools | 10015-00 | For rat >21 only. Used for incision |
| Scalpel Blade Handle | Fine Science Tools | 10003-12 | For rat >21 only. Used for incision |
| Sterile Syringe | Fisher Scientific | 14-955-459 | Used to filter dye solution |
| Surgical Scrub (Skin Prep) | Medline Industries Inc. | MDS098720 | For rat >21 only. Used for skin prep |
| Suture or Wound Clips | Stoelting | 50483 | For rat >21 only. Used for skin closure. |
| Syringe / Needle Cleaning Solution | Hamilton | 18311 | Can use alternative cleaning solution |
| Thumb Forceps | Fine Science Tools | 11019-12 | For rat >21 only. Used throughout surgical approach and closure |
| Vector Solution | Injection solution |
Referenzen
- Deverman, B. E., Ravina, B. M., Bankiewicz, K. S., Paul, S. M., Sah, D. W. Y. Gene therapy for neurological disorders: Progress and prospects. Nat Rev Drug Discov. 17 (9), 641-659 (2018).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Ling, Q., Herstine, J. A., Bradbury, A., Gray, S. J. AAV-based in vivo gene therapy for neurological disorders. Nat Rev Drug Discov. 22 (10), 789-806 (2023).
- Lykken, E. A., Shyng, C., Edwards, R. J., Rozenberg, A., Gray, S. J. Recent progress and considerations for AAV gene therapies targeting the central nervous system. J Neurodev Disord. 10 (1), 16(2018).
- Hocquemiller, M., Giersch, L., Audrain, M., Parker, S., Cartier, N. Adeno-associated virus-based gene therapy for CNS diseases. Hum Gene Ther. 27 (7), 478-496 (2016).
- Chen, X., et al. Biodistribution of adeno-associated virus gene therapy following cerebrospinal fluid-directed administration. Hum Gene Ther. 34 (3-4), 94-111 (2023).
- Corning, J. L. Spinal anesthesia and local medication of the cord. NY Med. J. , 483-485 (1885).
- Hylden, J. L., Wilcox, G. L. Intrathecal morphine in mice: A new technique. Eur J Pharmacol. 67 (2-3), 313-316 (1980).
- Fairbanks, C. A. Spinal delivery of analgesics in experimental models of pain and analgesia. Adv Drug Deliv Rev. 55 (8), 1007-1041 (2003).
- Choi, S. E., et al. High-frequency ultrasound-guided intrathecal injections in a young mouse model: Targeting the central nervous system in drug delivery. J Neurosci Methods. 386, 109778(2023).
- Li, D., Li, Y., Tian, Y., Xu, Z., Guo, Y. Direct intrathecal injection of recombinant adeno-associated viruses in adult mice. J Vis Exp. 144, e58565(2019).
- Njoo, C., Heinl, C., Kuner, R. In vivo SiRNA transfection and gene knockdown in spinal cord via rapid noninvasive lumbar intrathecal injections in mice. J Vis Exp. 85, e51229(2014).
- Vulchanova, L., et al. Differential adeno-associated virus-mediated gene transfer to sensory neurons following intrathecal delivery by direct lumbar puncture. Mol Pain. 6, 31(2010).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Mestre, C., Pelissier, T., Fialip, J., Wilcox, G., Eschalier, A. A method to perform direct transcutaneous intrathecal injection in rats. J Pharmacol Toxicol Methods. 32 (4), 197-200 (1994).
- Donsante, A., Rasmussen, S. A., Fridovich-Keil, J. L. Intrathecal vector delivery in juvenile rats via lumbar cistern injection. J Vis Exp. 205, e66463(2024).
- Lu, X., Jiang, Y. H. Intrathecal injection of newborn mouse for genome editing and drug delivery. J Vis Exp. 205, e65761(2024).
- Chen, X., et al. Intrathecal AAV9/AP4M1 gene therapy for hereditary spastic paraplegia 50 shows safety and efficacy in preclinical studies. J Clin Invest. 133 (10), JCI164575(2023).
- Deschenes, N. M., et al. Biochemical correction of GM2 ganglioside accumulation in AB-variant GM2 gangliosidosis. Int J Mol Sci. 24 (11), ijms24119217(2023).
- Hwang, S. M., Rahman, M. M., Go, E. J., Kim, Y. H., Park, C. K. Specific transcription factors Ascl1 and Lhx6 attenuate diabetic neuropathic pain by modulating spinal neuroinflammation and microglial activation in mice. Biomed Pharmacother. 173, 116392(2024).
- Kagiava, A., et al. Gene replacement therapy in two Golgi-retained CMT1X mutants before and after the onset of demyelinating neuropathy. Mol Ther Methods Clin Dev. 30, 377-393 (2023).
- Wong, H., et al. CNS-dominant human FMRP isoform rescues seizures, fear, and sleep abnormalities in Fmr1-KO mice. JCI Insight. 8 (11), 169650(2023).
- Laoharawee, K., et al. Prevention of neurocognitive deficiency in mucopolysaccharidosis type ii mice by central nervous system-directed, AAV9-mediated iduronate sulfatase gene transfer. Hum Gene Ther. 28 (8), 626-638 (2017).
- Aanonsen, L. M., Wilcox, G. L. Phencyclidine selectively blocks a spinal action of N-methyl-D-aspartate in mice. Neurosci Lett. 67 (2), 191-197 (1986).
- Bailey, R. M., Armao, D., Nagabhushan Kalburgi, S., Gray, S. J. Development of intrathecal AAV9 Gene therapy for giant axonal neuropathy. Mol Ther Methods Clin Dev. 9, 160-171 (2018).
- Bailey, R. M., Rozenberg, A., Gray, S. J. Comparison of high-dose intracisterna magna and lumbar puncture intrathecal delivery of AAV9 in mice to treat neuropathies. Brain Res. 1739, 146832(2020).
- Chen, X., et al. AAV9/MFSD8 gene therapy is effective in preclinical models of neuronal ceroid lipofuscinosis type 7 disease. J Clin Invest. 132 (5), JCI146286(2022).
- Karumuthil-Melethil, S., et al. Intrathecal administration of AAV/GALC vectors in 10-11-day-old twitcher mice improves survival and is enhanced by bone marrow transplant. J Neurosci Res. 94 (11), 1138-1151 (2016).
- Ling, Q., Rioux, M., Hu, Y., Lee, M., Gray, S. J. Adeno-associated viral vector serotype 9-based gene replacement therapy for SURF1-related Leigh syndrome. Mol Ther Methods Clin Dev. 23, 158-168 (2021).
- Sinnett, S. E., Boyle, E., Lyons, C., Gray, S. J. Engineered microRNA-based regulatory element permits safe high-dose miniMECP2 gene therapy in Rett mice. Brain. 144 (10), 3005-3019 (2021).
- Rahman, M. M., Lee, J. Y., Kim, Y. H., Park, C. K. Epidural and Intrathecal Drug Delivery in Rats and Mice for Experimental Research: Fundamental Concepts, Techniques, Precaution, and Application. Biomedicines. 11 (5), 11051413(2023).
- Allen, C. H., Ward, J. D. An evidence-based approach to management of increased intracranial pressure. Crit Care Clin. 14 (3), 485-495 (1998).
- Belov, V., et al. Large-volume intrathecal administrations: Impact on CSF pressure and safety implications. Front Neurosci. 15, 604197(2021).
- Moazen, M., et al. Intracranial pressure changes during mouse development. J Biomech. 49 (1), 123-126 (2016).
- Rieselbach, R. E., Di Chiro, G., Freireich, E. J., Rall, D. P. Subarachnoid distribution of drugs after lumbar injection. N Engl J Med. 267, 1273-1278 (1962).
- Pardridge, W. M. CSF, blood-brain barrier, and brain drug delivery. Expert Opin Drug Deliv. 13 (7), 963-975 (2016).
- Ghersi-Egea, J. F., Babikian, A., Blondel, S., Strazielle, N. Changes in the cerebrospinal fluid circulatory system of the developing rat: quantitative volumetric analysis and effect on blood-CSF permeability interpretation. Fluids Barriers CNS. 12, 8(2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten