Method Article
Injection intrathécale lombaire de vecteurs de thérapie génique pour le ciblage du système nerveux central chez la souris et le rat
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Une injection intrathécale lombaire représente une voie d’administration pertinente sur le plan translationnel pour l’administration de la thérapie génique au système nerveux central. Ce protocole standardisé complet pour les injections intrathécales lombaires chez les souris et les rats néonatals, juvéniles et adultes vise à guider les chercheurs dans l’adoption de cette technique pour les études précliniques de thérapie génique.
Résumé
Une méthode pour cibler le système nerveux central pour traiter les maladies neurologiques consiste à utiliser la voie d’administration intrathécale lombaire. Cette approche contourne la barrière hémato-encéphalique pour accéder directement au liquide céphalo-rachidien et cibler préférentiellement les cellules du système nerveux central. De nombreuses études précliniques publiées utilisant la voie d’injection intrathécale lombaire ont contribué au développement d’essais cliniques de thérapie génique ; Cependant, les protocoles décrits sont variables et dispersés sur plusieurs ressources. Ici, un ensemble complet de protocoles pour les injections intrathécales lombaires chez les souris et les rats néonatals, juvéniles et adultes pour les études précliniques de thérapie génique est présenté. Avec une formation appropriée, cette technique d’injection peut être réalisée rapidement et de manière fiable. En plus de détailler le protocole d’injection à chaque étape du développement, les paramètres associés, tels que le volume d’injection, qui peuvent influencer les résultats de l’étude sont discutés. Pour démontrer l’application des injections intrathécales lombaires pour cibler le système nerveux central, l’expression du virus adéno-associé sérotype 9 dans le cerveau, la moelle épinière et les tissus périphériques est présentée après une injection réussie ou infructueuse.
Introduction
Un défi dans le traitement des maladies neurologiques qui nécessitent une administration globale du système nerveux central (SNC) mais qui sont par ailleurs de bons candidats pour la thérapie génique a été largement attribué à un ciblage inefficace du SNC et des types de cellules pertinents1. De nombreuses recherches sont en cours pour optimiser le ciblage mondial des cellules et des tissus du SNC en concevant des véhicules d’administration 1,2. Cependant, il est encore possible d’obtenir une administration de vecteurs raisonnablement généralisée avec la technologie actuelle des vecteurs de thérapie génique, en utilisant certaines combinaisons de vecteurs viraux et de voiesd’administration3,4. La norme d’or actuelle pour obtenir une administration généralisée du SNC à partir d’un traitement unique est d’utiliser le virus adéno-associé de sérotype 9 (AAV9) avec une injection directe dans le liquide céphalo-rachidien (LCR).
Il existe trois voies d’administration typiques pour les injections directes de LCR : lombaire intrathécale (IT), intraventriculaire intra-ventrale (ICV) et intracisternale (ICM)5. Chacune de ces voies d’administration entraîne des modèles de biodistribution différents dans le SNC et les tissus périphériques, mais elles ont toutes l’avantage de contourner la barrière hémato-encéphalique (BHE) pour atteindre les cellules du SNC qui contribuent à la pathologie et aux phénotypes des maladies neurologiques6. L’injection lombaire IT est la norme pour l’utilisation clinique des médicaments chez l’homme, car la procédure clinique est routinière et simple, avec moins d’invasivité par rapport aux injections ICV et ICM.
L’injection lombaire est une technique établie qui est facilement utilisée dans les domaines de l’anesthésie et de l’analgésique, avec le premier article publié en 18857. Le premier protocole pour les injections lombaires de TI chez les souris adultes a été publié en 19808, et il a depuis été largement adopté et révisé9. De légers ajustements ou améliorations ont été apportés à ces protocoles 10,11,12, y compris une technique de conservation du produit13. Des protocoles pour les injections lombaires chez les rats adultes ont également été publiés pour la première fois en 1976, avec le cathétérisme pour l’administration chronique14 et l’injection directe pour les traitements uniques15. Plus récemment, des groupes ont publié des protocoles pour les injections lombaires chez les souris et les rats nouveau-nés ou juvéniles16,17.
L’adoption et la validation à grande échelle de cette technique pour contourner la BHE et cibler les cellules du SNC ont conduit à de multiples études précliniques et cliniques réussies de thérapie génique pour le traitement des maladies neurologiques. Des données positives sur l’efficacité et l’innocuité chez des souris, des rats et des primates non humains modélisant des maladies neurologiques ont suscité l’enthousiasme et l’intérêt autour du potentiel de bénéfice clinique pour ces maladies 18,19,20,21,22,23. Une poignée de ces études font actuellement l’objet d’essais cliniques (par exemple, clinicaltrials.gov identificateurs NCT02362438, NCT04737460, NCT03381729 et NCT05518188)3,6. Dans cet article, un protocole simple pour les injections lombaires d’IT chez les souris et les rats d’âges différents est décrit, sans enlever le LCR, qui peut être adopté pour des projets de thérapie génique translationnelle. Ce protocole est similaire aux protocoles déjà disponibles qui sont largement adoptés ; Cependant, il est utile de citer ces protocoles pertinents en un seul endroit pour un accès et une référence faciles, ainsi que les visuels vidéo qui les accompagnent. Ce protocole explique l’injection pour les souris et les rats nouveau-nés au jour postnatal (P) 0-1 et les souris et rats juvéniles P21, avec des résultats représentatifs d’une injection lombaire réussie et infructueuse d’IT à P1 chez la souris. Au cours de la discussion, les erreurs courantes et les détails spécifiques qui nécessitent une attention particulière lors de l’exécution de cette procédure, ainsi que les recommandations sur la façon de pratiquer ces injections avant de commencer une étude préclinique, sont abordés.
Protocole
Les procédures décrites dans le présent document ont été approuvées par l’Institutional Animal Care and Use Committee (IACUC) du Southwestern Medical Center de l’Université du Texas. Des souris mâles et femelles C57BL6/J de type sauvage, âgées de P1 à P28, ont été utilisées pour des protocoles impliquant des souris. Des rats mâles et femelles Sprague-Dawley de type sauvage, âgés de P1 à P56, ont été utilisés pour des protocoles impliquant des rats. Mis à part la chirurgie de survie décrite dans la rubrique 3, toutes les autres procédures sont considérées comme ne causant qu’une gêne momentanée et ne nécessitent pas l’utilisation d’anesthésiques ou d’analgésiques. Les individus doivent surveiller les animaux de laboratoire pour détecter toute gêne plus qu’un inconfort momentané et demander conseil à leur personnel IACUC et vétérinaire sur la nécessité d’anesthésiques et d’analgésiques. Les détails des réactifs et de l’équipement utilisés sont fournis dans la table des matériaux.
1. Injection lombaire de souris >P21
- Préparation
- Préparez les solutions d’injection, y compris le vecteur de thérapie génique à la ou les concentrations souhaitées et une solution de contrôle (généralement le tampon de formulation utilisé dans la production de vecteurs). Les solutions d’injection doivent être stériles et doivent rester stériles tout au long de la procédure.
REMARQUE : Toutes les solutions doivent être maintenues sur de la glace pendant toute la durée de l’intervention. - Rassemblez et désinfectez tout le matériel, y compris la seringue et l’aiguille, la pipette et la solution d’injection. Suivre les lignes directrices de l’établissement concernant l’utilisation des enceintes de sécurité biologique et l’exposition aux injecteurs. Les procédures décrites ici ont été exécutées dans une enceinte de biosécurité de classe 2.
- À l’aide d’une pipette d’un microlitre, mesurez le volume souhaité de solution d’injection et transférez-le dans un film de paraffine stérile. Un volume d’injection de 5 μL est couramment utilisé et est considéré comme le volume cible pour les souris adultes >P21 (tableau 1).
REMARQUE : Le volume peut être augmenté si nécessaire ; Cependant, les animaux doivent être surveillés de près pour détecter les effets indésirables à des volumes d’injection plus importants. Voir la section Discussion pour plus de détails sur le volume d’injection et les effets indésirables. La solution peut également être transférée directement de l’extrémité de la pipette à une seringue, ou des seringues de microlitre calibrées étanches aux gaz peuvent être utilisées pour mesurer directement le volume de la solution d’injection. - Aspirez la solution dans une seringue d’un microlitre avec une aiguille de 30 G 0,5", en prenant soin de ne pas aspirer de bulles d’air.
REMARQUE : Le calibre et la longueur de l’aiguille peuvent affecter la pénétration de la peau. Lorsque l’on considère la taille de la seringue à utiliser, le volume d’injection ne doit pas être inférieur à 10 % de la capacité de la seringue. Pour des volumes supérieurs à 50 % de la capacité de la seringue, assurez-vous que le piston peut être facilement enfoncé avec votre index. Si le piston ne peut pas être facilement enfoncé, utilisez une seringue de plus grande capacité.
- Préparez les solutions d’injection, y compris le vecteur de thérapie génique à la ou les concentrations souhaitées et une solution de contrôle (généralement le tampon de formulation utilisé dans la production de vecteurs). Les solutions d’injection doivent être stériles et doivent rester stériles tout au long de la procédure.
- Retenue
- À l’aide de la main dominante, tenez la souris consciente (non anesthésiée) par la queue sur une serviette en papier. L’essuie-tout aidera à retenir, calmer et empêcher la souris de mordre. La souris doit être en position couchée neutre avec l’aspect latéral du corps face à vous.
REMARQUE : Il n’est pas nécessaire d’entraîner ou d’habituer les souris à cette contention avant la procédure. Les souris peuvent avoir des difficultés en raison de la contention, mais ne devraient pas provoquer de réponse spécifique à la douleur. Si des réponses à la douleur plus que momentanées sont observées, l’administration d’analgésiques peut être nécessaire ; Demandez conseil à un vétérinaire. - Avec la main non dominante, pliez une partie de l’essuie-tout sur la tête et le haut du corps de la souris et saisissez fermement la ceinture pelvienne entre le pouce et l’index non dominants. Assurez-vous que la paume est en coupe, reposant autour de la tête de la souris. La crête iliaque de la souris doit être palpable et positionnée au centre de la phalange distale de chaque doigt (Figure 1A,B).
REMARQUE : La contention de la main ou de l’essuie-tout ne doit pas entraver la respiration. - Faites pivoter doucement la base de la queue pour assurer un bon alignement de la colonne vertébrale. Le bassin de la souris doit être carré, de sorte que les apophyses vertébrales de la colonne lombaire soient perpendiculaires à la surface de travail.
- Frottez la région lombaire dorsale de la souris avec un tampon de préparation à 70 % d’alcool.
- Séparez les cheveux de ~2 à 6 mm du crâne à la crête iliaque pour aider à visualiser l’emplacement de l’injection.
- Sentez l’espace intervertébral L4-L5 ou L5-L6, crânien de ~2-6 mm à la crête iliaque.
REMARQUE : La distance exacte est variable en fonction de la taille et de l’âge de la souris.
- À l’aide de la main dominante, tenez la souris consciente (non anesthésiée) par la queue sur une serviette en papier. L’essuie-tout aidera à retenir, calmer et empêcher la souris de mordre. La souris doit être en position couchée neutre avec l’aspect latéral du corps face à vous.
- Injection
- À l’aide de la main dominante, tenez le centre de la seringue d’un microlitre et positionnez-la perpendiculairement à la colonne vertébrale de la souris au niveau de l’espace intervertébral L4-L5 ou L5-L6. Assurez-vous que le piston de la seringue peut être enfoncé avec votre index sans mouvement excessif de votre main. Avec le biseau de l’aiguille face à la tête de la souris, percez la peau sur l’espace intervertébral.
- Lorsque les bords de l’os autour de l’espace intervertébral sont ressentis à l’extrémité de l’aiguille, réduisez l’angle de la seringue à 30-45 degrés (Figure 1A).
- L’aiguille doit glisser dans l’espace intervertébral, provoquant un mouvement soudain de la queue, et doit être fermement serrée entre les vertèbres.
- En prenant soin de ne pas déplacer la seringue, appuyez régulièrement sur le piston pour administrer la solution dans les 10 s.
- Maintenez la seringue en place pendant 15 à 30 secondes après avoir enfoncé complètement le piston pour permettre la dissipation de la solution et éviter le reflux.
- Retirez doucement et lentement la seringue de la souris avec le même angle d’entrée de 30 à 45 degrés. Lorsque l’aiguille est retirée, tournez la seringue pour éviter le reflux.
REMARQUE : Faites attention de ne pas avancer l’aiguille lors de la rotation de la seringue, car cela pourrait causer des dommages physiques à la moelle épinière. - Relâchez la souris de la contrainte et remettez-la dans la cage d’origine.
- Surveillez la souris après l’injection pour détecter une marche anormale, une déficience motrice, des anomalies respiratoires et une coordination. Voir la discussion pour plus de détails sur les effets indésirables.
- Nettoyez l’équipement en suivant les recommandations du fabricant. Pour les injections multiples, des seringues différentes sont recommandées pour chaque vecteur de thérapie génique et solution de contrôle.
REMARQUE : Les aiguilles amovibles peuvent être nettoyées, stérilisées et réutilisées plusieurs fois ; Cependant, il ne faut pas utiliser d’aiguilles émoussées, car elles peuvent nuire à l’animal et augmenter la probabilité d’injections manquées. Une aiguille émoussée ne percera pas facilement la peau et doit être jetée de manière appropriée. Si les seringues sont limitées, il est conseillé de terminer toutes les injections de véhicule avant de passer au vecteur de thérapie génique et d’injecter la dose de thérapie génique la plus faible avant d’administrer des doses plus élevées. - Suivre les lignes directrices de l’établissement pour la stérilisation du matériel entre animaux.
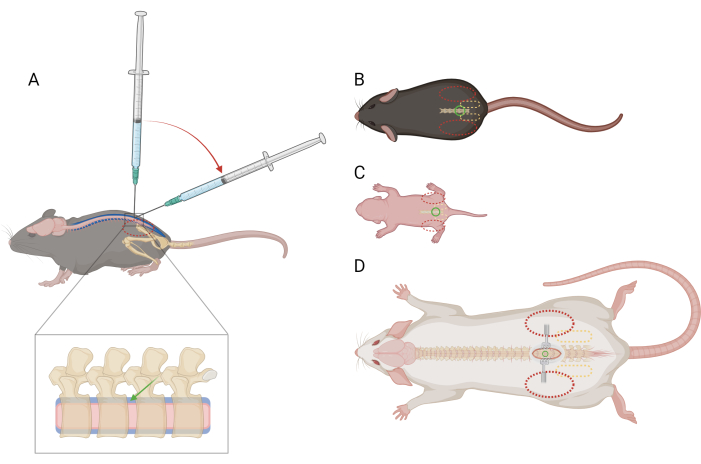
Figure 1 : Schéma de l’emplacement du doigt et de la seringue pour l’injection intrathécale lombaire chez la souris et le rat. (A) Vue latérale d’une souris >P21 montrant l’emplacement de l’aiguille et la transition de l’angle de la seringue lors d’une injection lombaire. L’ovale rouge pointillé indique le positionnement du doigt sur la crête iliaque de la souris. Une vue agrandie de la colonne vertébrale montre l’espace intrathécal (bleu) avec le placement approximatif de l’aiguille (flèche verte) et la moelle épinière (rose). Vue dorsale (B) d’une souris >P21), (C) d’une souris D) d’un rat >P21, avec des points de référence pour le placement de l’aiguille (cercle vert), la ceinture pelvienne (ovale jaune pointillé) et le placement des doigts (ovale rouge pointillé). Le site d’incision et les écarteurs sont également représentés en (D). Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Injection lombaire IT de souris et de rats
- Préparation
- Suivez l’étape 1.1. La seule exception est le volume d’injection à l’étape 1.1.3.
REMARQUE : Les volumes d’injection recommandés pour les souris néonatales (P0-P1) ne doivent pas dépasser 3 μL, pour les souris juvéniles (P5-P7) ne doivent pas dépasser 5 μL et pour les souris juvéniles (P10) ne doivent pas dépasser 10 μL. Les volumes d’injection recommandés pour les rats nouveau-nés (P0-P1) ne doivent pas dépasser 5 μL, pour les rats juvéniles (P5-P7) ne doivent pas dépasser 10 μL et pour les rats juvéniles (P10) ne doivent pas dépasser 30 μL (tableau 1).
- Suivez l’étape 1.1. La seule exception est le volume d’injection à l’étape 1.1.3.
- Retenue
- À l’aide de la main dominante, tenez la souris/le rat par la queue sur une serviette en papier. La souris/le rat doit être en position couchée neutre avec l’aspect latéral du corps face à vous.
REMARQUE : Les souris/rats peuvent avoir des difficultés en raison de la contention, mais ne devraient pas provoquer de réponse spécifique à la douleur. Si des réponses à la douleur plus que momentanées sont observées, l’administration d’analgésiques peut être nécessaire ; Demandez conseil à un vétérinaire. - Saisissez doucement mais fermement la ceinture pelvienne entre le pouce et l’index non dominants. La crête iliaque doit être palpable et positionnée au centre de la phalange distale de chaque doigt (Figure 1C).
REMARQUE : À cet âge, il n’y a aucune crainte d’être mordu, il n’est donc pas nécessaire d’enrouler l’essuie-tout sur la souris / le rat. Il peut être nécessaire d’utiliser une serviette en papier chez les rats P5-10 pour garder les plus gros rats. - Faites pivoter doucement la base de la queue pour assurer un bon alignement de la colonne vertébrale. Le bassin de la souris/rat doit être carré de sorte que les apophyses vertébrales de la colonne lombaire soient perpendiculaires à la surface de travail.
- Frottez la région lombaire dorsale de la souris/du rat avec un tampon de préparation à 70 % d’alcool.
- Séparez les cheveux, le cas échéant, de ~1 à 3 mm du crâne de la crête iliaque pour aider à visualiser l’emplacement de l’injection. La visualisation de la zone cible est plus facile chez les souris et les rats plus jeunes. Chez les nouveau-nés glabres, une indentation peut être observée dans l’espace intervertébral.
- Sentez ou visualisez l’espace intervertébral L4-L5 ou L5-L6, crânien de ~1-3 mm jusqu’à la crête iliaque.
REMARQUE : La distance exacte est variable en fonction de la taille et de l’âge de la souris/du rat.
- À l’aide de la main dominante, tenez la souris/le rat par la queue sur une serviette en papier. La souris/le rat doit être en position couchée neutre avec l’aspect latéral du corps face à vous.
- Injection
- À l’aide de la main dominante, tenez le centre de la seringue d’un microlitre et positionnez-la à un angle de 30 à 45 degrés par rapport à la colonne vertébrale de la souris ou du rat. Avec le biseau de l’aiguille face à la tête de la souris/rat, percez la peau d’environ 1 à 3 mm jusqu’à l’espace intervertébral. En raison de l’orientation inclinée de la seringue, le point d’insertion sur la peau est légèrement caudal par rapport à l’espace intervertébral.
REMARQUE : Cette distance peut changer avec l’âge et la taille de la souris/du rat. - Le reste des étapes est identique aux étapes 1.3.3-1.3.10 des souris >P21.
- À l’aide de la main dominante, tenez le centre de la seringue d’un microlitre et positionnez-la à un angle de 30 à 45 degrés par rapport à la colonne vertébrale de la souris ou du rat. Avec le biseau de l’aiguille face à la tête de la souris/rat, percez la peau d’environ 1 à 3 mm jusqu’à l’espace intervertébral. En raison de l’orientation inclinée de la seringue, le point d’insertion sur la peau est légèrement caudal par rapport à l’espace intervertébral.
3. Injection lombaire de rats >P21
REMARQUE : Il existe de multiples procédures d’injection informatique décrites dans la littérature, allant des techniques non anesthésiées aux approches chirurgicales plus étendues14,15. Une procédure d’injection directe utilisant une technique peu invasive est décrite à l’aide d’une légère anesthésie et d’une petite incision cutanée. L’utilisation d’anesthésiques, tels que le gaz isoflurane, peut aider à la retenue, détendre la musculature et empêcher les mouvements pendant l’injection. Faire une petite incision dans la peau au-dessus du site d’injection améliore la précision de l’injection en permettant de visualiser l’espace intervertébral et en éliminant le besoin de percer à travers une peau épaisse. En raison de l’incision, l’utilisation d’anesthésiques et d’analgésiques est nécessaire. Avec de la pratique, il est possible d’effectuer des injections lombaires chez des rats âgés de plus de P21 sans anesthésie ni incision à la discrétion de l’utilisateur et en fonction des exigences institutionnelles15. Suivre les directives et les considérations de l’établissement concernant l’anesthésie, les analgésiques appropriés et la chirurgie de survie pour les animaux de laboratoire.
- Préparation
- Suivez l’étape 1.1. Les seules exceptions sont le volume d’injection à l’étape 1.1.3 et la taille de l’aiguille à l’étape 1.1.4. Les volumes d’injection chez les rats peuvent varier considérablement selon l’âge et la taille du corps. Voir la section Discussion pour en savoir plus sur le volume d’injection à différents âges (tableau 1).
REMARQUE : Une aiguille de 27 g x 1 po est recommandée pour les rats adultes, car les aiguilles de plus petit calibre peuvent se plier et les aiguilles plus courtes peuvent ne pas pénétrer adéquatement dans l’espace intrathécal. Une aiguille plus longue (1,25-1,5") peut être utilisée si vous le souhaitez. - Anesthésie le rat à l’aide de l’anesthésique préféré et approuvé (en suivant les protocoles approuvés par l’établissement).
REMARQUE : Pour les procédures décrites ici, les rats ont été anesthésiés à l’aide d’isoflurane et d’un mélange 1:1 de lidocaïne : la bupivacaïne a été utilisée comme anesthésique local. La température corporelle doit être maintenue à l’aide d’une source de chaleur externe approuvée tout au long de la procédure et de la récupération. - Suivre la préparation aseptique standard du site chirurgical pour chaque animal. Brièvement, rasez la région lombaire dorsale et préparez la peau avec un gommage chirurgical, de la bétadine et de l’alcool isopropylique à 70 %.
- Suivez l’étape 1.1. Les seules exceptions sont le volume d’injection à l’étape 1.1.3 et la taille de l’aiguille à l’étape 1.1.4. Les volumes d’injection chez les rats peuvent varier considérablement selon l’âge et la taille du corps. Voir la section Discussion pour en savoir plus sur le volume d’injection à différents âges (tableau 1).
- Intervention chirurgicale
- Placez le rat en position couchée neutre avec l’aspect latéral du corps face à vous.
- Palper la ceinture pelvienne, en identifiant la crête iliaque et la jonction lombo-sacrée. Chez le rat >P21, les processus vertébraux peuvent être facilement identifiés.
- À l’aide d’un scalpel, faites une incision de 1 cm sur l’espace intervertébral L4-L5 ou L5-L6. L’incision ne doit impliquer que la peau et le fascia sous-jacent, laissant le muscle intact.
REMARQUE : Il est utile d’utiliser des écarteurs pour maintenir la peau ouverte pendant le reste de la procédure. - Saisissez doucement mais fermement la ceinture pelvienne entre le pouce et l’index non dominants. La crête iliaque doit être palpable et positionnée au centre de la phalange distale de chaque doigt (Figure 1D). Utilisez une pince à moustiques pour sonder le long de la ligne médiane du dos afin de localiser l’espace intervertébral.
- Injection
- À l’aide de la main dominante, tenez le centre de la seringue d’un microlitre et positionnez-la perpendiculairement à la colonne vertébrale du rat au niveau de l’espace intervertébral L4-L5 ou L5-L6. Assurez-vous que le piston de la seringue peut être enfoncé avec l’index sans mouvement excessif de la main. Avec le biseau de l’aiguille face à la tête du rat, percez le muscle avec l’aiguille sur l’espace intervertébral.
- Faites avancer l’aiguille dans l’espace intervertébral.
REMARQUE : L’aiguille peut avoir une légère résistance lorsqu’elle passe entre les apophyses vertébrales, et l’angle de la seringue peut avoir besoin d’être légèrement ajusté pour passer à travers cet espace. Cependant, il doit rester à environ 90 degrés, perpendiculaire à la colonne vertébrale. Un pop sera ressenti lorsque l’aiguille entrera dans l’espace intrathécal. Selon les paramètres anesthésiques, un mouvement de queue ou de jambe peut être perceptible ou non. L’aiguille doit être fermement serrée entre les vertèbres. - En prenant soin de ne pas déplacer la seringue hors de sa position, appuyez sur le piston pour administrer la solution dans les 30 s.
REMARQUE : Contrairement aux injections chez la souris, il peut ne pas être possible de réduire l’angle de la seringue chez le rat >P21 en utilisant cette méthode. Les plus grands volumes doivent être injectés à un rythme plus lent pour éviter une accumulation excessive de pression. - Maintenez la seringue en place pendant 30 à 60 secondes après avoir enfoncé complètement le piston pour permettre la dissipation de la solution et empêcher le reflux.
- Retirez doucement la seringue du rat. Lorsque l’aiguille est retirée, tournez la seringue pour éviter le reflux.
REMARQUE : Faites attention de ne pas avancer l’aiguille lors de la rotation de la seringue, car cela pourrait causer des dommages physiques à la moelle épinière. - Fermez l’incision cutanée à l’aide d’une méthode approuvée, telle que des clips de suture ou de plaie. Chez les rats utilisés dans ce protocole, la peau a été fermée selon un schéma intradermique continu ou un motif interrompu simple à l’aide d’une suture 5-0 PDS II.
- Récupérez le rat de l’anesthésie.
- Suivez les étapes 1.3.9 et 1.3.10 et toutes les directives de soins postopératoires.
Résultats
Bien que de nombreux facteurs puissent influencer la transduction des vecteurs de thérapie génique, la coloration histologique des tissus reste la méthode la plus précise pour déterminer le succès des injections intrathécales lombaires (IT). Une distribution large et uniforme du vecteur de thérapie génique dans le système nerveux central (SNC) après l’injection est indicative de la réussite de la procédure. La figure 2C représente une injection réussie d’une thérapie génique auto-complémentaire médiée par AAV9 entraînant une faible expression transgénique ubiquitaire sous le promoteur JeT à une dose de 1,3 × 1011 vg/souris chez des souris néonatales (P1), 4 mois après l’injection. L’analyse par ARNASCOPE, à l’aide d’une sonde ciblant le transgène délivré par la thérapie génique, révèle une large distribution dans la moelle épinière lombaire, la moelle épinière cervicale et le cerveau. Une section du foie et du cœur est incluse pour souligner que, même avec une injection directe de liquide céphalo-rachidien (LCR), le vecteur de thérapie génique peut toujours être distribué aux tissus périphériques.

Figure 2 : Coupes de tissu coloré de 5 microns du SNC et du tissu périphérique de souris 4 mois après l’injection à P1. La coloration rouge indique l’expression du transgène via l’ARNASCOPE, et la contre-coloration bleue des noyaux se fait par l’hématoxyline. (A) Injection avec un tampon de formulation témoin. (B) Injection intraparenchymateuse infructueuse avec un vecteur AAV9 (scAAV9_JeT-hDDX3Xopt-SpA). (C) Injection lombaire réussie avec un vecteur AAV9 (scAAV9_JeT-hDDX3Xopt-SpA). Le vecteur de thérapie génique utilisé dans (B) et (C) a été administré à une dose pertinente sur le plan translationnel de 1,3E11 vg/souris. Barre d’échelle : panneau supérieur (5 mm) ; panneau inférieur (1 mm). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Une expression concentrée dans la moelle épinière lombaire associée à un manque d’expression dans le cerveau, comme le montre la figure 2B, peut indiquer une injection intraparenchymateuse de la moelle épinière et doit être considérée comme un échec de l’injection. Cela se produit lorsque l’aiguille est insérée trop loin dans la colonne vertébrale, au-delà de l’espace intrathécal et dans la moelle épinière. De plus, une expression très faible ou nulle dans la moelle épinière et le cerveau (non illustrée) doit également être considérée comme un échec de l’injection hors cible, en supposant qu’un vecteur et une dose sont utilisés là où une large distribution du SNC est attendue. Cela peut être dû au fait que l’aiguille n’est pas insérée assez loin ou qu’elle est latérale à la ligne médiane.
Les profils d’expression observés lors d’injections réussies peuvent différer en raison des huit facteurs suivants à titre d’exemple : (1) l’âge à l’injection, (2) l’immunité préexistante, (3) le débit de perfusion, (4) le vecteur de thérapie génique, (5) la dose de thérapie génique, (6) les protéines de surface cellulaire, (7) le tropisme et (8) le cas échéant, un choix de promoteur approprié pour stimuler l’expression du transgène6. Bien que les profils d’expression puissent différer, la distribution large, uniforme et généralisée sera universelle tant que la dose est suffisamment élevée avec un vecteur efficace, tel que l’AAV9.
Les principales limites de l’utilisation de l’analyse histologique pour confirmer le succès de l’injection lombaire sont les longs délais d’attente - attendre jusqu’à la fin d’une étude, après que les nécropsies ont été effectuées et que les tissus ont été prélevés - et les ressources importantes nécessaires pour traiter les tissus de toutes les souris dans une grande étude de thérapie génique. Malheureusement, notre expérience a montré que les indicateurs immédiats et directs d’une injection positive ou négative peuvent ne pas être fiables ; Cependant, le réflexe de battement de la queue lorsque l’aiguille pénètre dans l’espace intrathécal est un bon indicateur d’un positionnement réussi en temps réel et indique probablement une injection réussie. Ne confondez pas une contraction lorsque l’aiguille perce la peau d’une souris ou d’un rat non anesthésié avec une réponse de la queue à l’entrée de l’aiguille dans l’espace intrathécal. L’utilisation d’agents pharmacologiques tels que le NMDA, la substance P et la lidocaïne, soit en formation, soit mélangée à la solution d’injection expérimentale, a été signalée comme fournissant une indication plus immédiate du succès de l’injection 9,11,24. Si l’on considère ces agents, il est important d’évaluer leur compatibilité avec le vecteur de thérapie génique.
Discussion
L’injection lombaire IT est une procédure rapide et peu invasive qui délivre de manière fiable un vecteur de thérapie génique dans le LCR pour le traitement des maladies du SNC 5,6. La procédure est pertinente sur le plan translationnel, et le protocole décrit ici détaille comment effectuer cette voie d’administration chez les souris et les rats de tous âges, des nouveau-nés aux adultes. Il est important de définir ce protocole pour les souris et les rats de tous âges, ainsi que de fournir des vidéos de soutien, afin d’aider les chercheurs dans l’adoption de cette méthode pour l’administration de la thérapie génique. L’expérience de notre laboratoire est que ce protocole peut être mis en œuvre de manière cohérente par plusieurs utilisateurs et études au fil du temps 18,25,26,27,28,29,30.
Il existe des différences importantes lors de l’injection lombaire chez les souris/rats plus jeunes par rapport aux souris/rats plus âgés, notamment l’angle auquel l’aiguille est insérée dans la colonne vertébrale et le volume recommandé qui est injecté. Les volumes d’injection lombaire d’IT rapportés varient considérablement d’une étude à l’autre et d’une espèce à l’autre31. Il est important de tenir compte du volume d’injection pour éviter des élévations durables de la pression intracrânienne (PIC), qui peuvent compromettre le flux de LCR et de sang cérébral, causer de l’inconfort et entraîner des complications neurologiques chroniques, notamment l’hydrocéphalie, l’ischémie, les lésions cellulaires et la mort32,33. L’ICP est déterminée par le volume du LCR, du sang cérébral et du tissu du SNC, qui ne peuvent pas être directement corrélés au poids corporel. Lors d’un fonctionnement normal, l’ICP est autorégulée par de nombreux facteurs, notamment le volume du LCR, le volume sanguin cérébral, la respiration, la position du corps, le taux de production du LCR et le taux de drainage du LCR dans le sang33,34. Les volumes d’injection d’IT doivent donc être déterminés sur la base des propriétés du LCR (tableau 1) au lieu du poids corporel 25,27,28,30. Les volumes recommandés à injecter à chaque âge chez chaque espèce sont indiqués en gras.
| Volume d’injection informatique | Valeurs du LCR chez l’adulte | |||||||
| P0-1 (μL) | P5-7 (μL) | P10 (μL) | >P21 (μL) | Volume total (μL) | Taux de production (μL/min) | Chiffre d’affaires (h) | Pression intracrânienne (mm Hg) | |
| Souris | 3 | 5 | 5 à 10 | 5 à 20 | 30-4025,30 | 0,32 à 0,3525,30 | 1,7-225,30 | 5,0 +/- 0,528 |
| Rats | 5 | 5-10 | 10-30 | 10 à 200 (20 à 75) | 15025 | 1,7 à 2,825 | 2-2,6625 | 8,6 +/- 1,7,27 |
Tableau 1 : Résumé des volumes d’injection lombaire de TI chez les souris et les rats à différents âges. Les valeurs audacieuses sont recommandées et ont été livrées en toute sécurité. Les volumes maximaux possibles n’ont pas été formellement évalués. Des informations supplémentaires sur les paramètres connus du LCR - volume total, taux de production, renouvellement et pression intracrânienne - chez les souris et les rats sont incluses à titre de référence.
Il y a un manque de connaissances dans le domaine concernant le seuil supérieur pour les volumes d’injection unique de bolus informatique. Chez les humains adultes, les rats et les souris où le volume du LCR est connu, une augmentation de 30 % du volume total du LCR ne semble pas causer de lésions ou de maladies chroniques 31,33,35,36. L’absence de volumes connus de LCR chez les souris juvéniles ou néonatales rend impossible une extrapolation similaire. Certains groupes commencent à s’intéresser au volume et à la production de LCR chez les jeunes animaux37. Jusqu’à ce que d’autres investigations dans ces domaines soient corroborées, le volume d’injection continuera d’être assujetti aux valeurs déclarées par les chercheurs.
Les souris et les rats, en particulier lorsqu’ils sont traités à un plus jeune âge ou avec des volumes d’injection élevés, peuvent provoquer une flexion des muscles, une extension des membres, une respiration rapide ou une paralysie temporaire des membres postérieurs qui devrait se résoudre d’elle-même en quelques minutes. Dans les cas extrêmes, les élévations aiguës de la PIC peuvent provoquer des anomalies cardiovasculaires et respiratoires, qui peuvent être mortelles32,33. Si des anomalies post-opératoires persistent après 24 heures, les souris et les rats doivent être retirés de l’étude et euthanasiés sans cruauté. Une paralysie persistante des membres postérieurs peut survenir si l’aiguille est insérée trop loin, ce qui a un impact sur la moelle épinière. Cela peut être dû à une erreur courante lors de l’injection lombaire IT : le mouvement de la seringue après le coup de queue tout en appuyant sur le piston. Le mouvement de la seringue et de l’aiguille doit être évité. Si la position correcte ne peut pas être obtenue avec la crevaison initiale, une deuxième tentative au même endroit peut être effectuée. Si la deuxième tentative échoue également, essayez de modifier la position de l’aiguille pour cibler l’espace intervertébral suivant. Notez que plusieurs piqûres d’aiguille peuvent entraîner une fuite d’une injection réussie par la suite.
Devenir compétent lors de l’injection lombaire peut prendre du temps. Pour pratiquer les injections en tant que procédure terminale, suivez le protocole ci-dessus en utilisant une solution de colorant approuvée, telle que le bleu Evans ou le colorant vert McCormick filtré à 0,2 micron (figure 3) ou avec les agents pharmacologiques abordés dans la section Résultats représentatifs. L’utilisation d’un colorant est recommandée pour dépanner et maîtriser l’injection, car il est facile de dire si une injection a été un succès ou un échec en 1 minute. La pratique avec le colorant ne concerne que les procédures de non-survie, car les animaux peuvent développer une réaction au colorant lorsqu’ils sont directement administrés au SNC. Cette réaction peut se produire dans la minute qui suit une injection réussie et se caractérise par des démangeaisons rapides et des mouvements de tortille. Les animaux doivent être euthanasiés immédiatement une fois que cette réaction est observée afin de minimiser l’inconfort. Après une injection réussie de colorant, le colorant restera localisé dans la colonne vertébrale (pas de colorant dans les tissus périphériques voisins) et remontera la colonne vertébrale jusqu’au cervelet, au cerveau et aux bulbes olfactifs. En P1, la peau est suffisamment transparente pour que l’on puisse voir le colorant descendre dans la colonne vertébrale de la queue. Si le colorant n’atteint pas le cerveau en quelques minutes, l’injection échoue.

Figure 3 : Colorant vert McCormick dans le cerveau après des injections lombaires réussies. Tous les cerveaux proviennent de souris P21 auxquelles on a injecté un colorant de 5 μL et sont représentés en vue ventrale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Pour plus d’informations sur les paramètres associés pertinents pour la conception d’essais précliniques, tels que le titre viral et les doses, voir les revues précédemment publiées 3,6,31.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Nous tenons à remercier l’UT Southwestern AAV Viral Vector Core Facility pour la fabrication du vecteur AAV9 et Yuhui Hu, chercheur scientifique au laboratoire Gray, pour le traitement et la coloration du tissu présenté à la figure 2.
matériels
| Name | Company | Catalog Number | Comments |
| 0.2 micron filter | Electron Microscopy Sciences | 67005 | Used to filter dye solution |
| 0.5 to 10 µL Pipette | Eppendorf | TI13690026 | Used to measure injection solution |
| 1.5 mL Microtube | Eppendorf | 22364111 | Used to store injection solutions |
| 10 µL Syringe | Hamilton | 7635-01 | Injection volume should not be less than 10% of syringe capacity |
| 10 to 100 µL Pipette | Eppendorf | TI13690029 | Used to measure injection solution |
| 10µl Pipette Tips | USA Scientific Inc | 11203810 | Used to measure injection solution |
| 100 µL Syringe | Hamilton | 7638-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 100 µL Pipette Tips | USA Scientific Inc | 11231840 | Used to measure injection solution |
| 25 µL Syringe | Hamilton | 7636-01 | Ideal for 5-10 µL injections. Injection volume should not be less than 10% of syringe capacity |
| 27 Gauge Needle(s) | Hamilton | 7803-01 | For rat >21 only. 27 gauge, Small Hub RN Needle, 1 in, point style 4 at 12°, 6/PK |
| 30 Gauge Needle(s) | Hamilton | 7803-17 | 30 gauge, Small Hub RN Needle, 0.5 in, point style 4 at 12°, 6/PK |
| 50 µL Syringe | Hamilton | 7637-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 70% Ethanol | Pharmco | 111000140 | Used to sanitize workspace and equipment |
| 70% Isopropyl Alcohol Prep Pads | PDI | B60307 | Used to prepare injection site |
| Analgesic | For rat >21 only. | ||
| Anesthetic (Isoflurane) | Piramal Critical Care | 66794001725 | For rat >21 only. |
| Betadine | Purdue Products | 6906606 | For rat >21 only. Used for skin prep |
| Control Solution | Injection solution | ||
| Dye Solution (green) | McCormick | For practice, non-survival only | |
| Gloves | Kimberly-Clark | 19-149-863B | PPE |
| Ice bucket with ice | Fisher Scientific | 03-395-150 | Maintain viral vector solution on ice |
| Mosquito Forceps (curved or straight) | Fine Science Tools | 13009-12 | For rat >21 only. Used to palpate intervertebral space. |
| Needle Holders | Fine Science Tools | 12002-12 | For rat >21 only. Used for skin closure with suture |
| Paper Towel | Berkshire | 18-998-123 | Used to restrain adult mice during injection |
| Parafilm | StatLab | PM996 | Used to draw solution into syringe |
| Retractors | Stoelting | 52124P | For rat >21 only. Used to hold skin incision open |
| Scalpel Blade | Fine Science Tools | 10015-00 | For rat >21 only. Used for incision |
| Scalpel Blade Handle | Fine Science Tools | 10003-12 | For rat >21 only. Used for incision |
| Sterile Syringe | Fisher Scientific | 14-955-459 | Used to filter dye solution |
| Surgical Scrub (Skin Prep) | Medline Industries Inc. | MDS098720 | For rat >21 only. Used for skin prep |
| Suture or Wound Clips | Stoelting | 50483 | For rat >21 only. Used for skin closure. |
| Syringe / Needle Cleaning Solution | Hamilton | 18311 | Can use alternative cleaning solution |
| Thumb Forceps | Fine Science Tools | 11019-12 | For rat >21 only. Used throughout surgical approach and closure |
| Vector Solution | Injection solution |
Références
- Deverman, B. E., Ravina, B. M., Bankiewicz, K. S., Paul, S. M., Sah, D. W. Y. Gene therapy for neurological disorders: Progress and prospects. Nat Rev Drug Discov. 17 (9), 641-659 (2018).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Ling, Q., Herstine, J. A., Bradbury, A., Gray, S. J. AAV-based in vivo gene therapy for neurological disorders. Nat Rev Drug Discov. 22 (10), 789-806 (2023).
- Lykken, E. A., Shyng, C., Edwards, R. J., Rozenberg, A., Gray, S. J. Recent progress and considerations for AAV gene therapies targeting the central nervous system. J Neurodev Disord. 10 (1), 16(2018).
- Hocquemiller, M., Giersch, L., Audrain, M., Parker, S., Cartier, N. Adeno-associated virus-based gene therapy for CNS diseases. Hum Gene Ther. 27 (7), 478-496 (2016).
- Chen, X., et al. Biodistribution of adeno-associated virus gene therapy following cerebrospinal fluid-directed administration. Hum Gene Ther. 34 (3-4), 94-111 (2023).
- Corning, J. L. Spinal anesthesia and local medication of the cord. NY Med. J. , 483-485 (1885).
- Hylden, J. L., Wilcox, G. L. Intrathecal morphine in mice: A new technique. Eur J Pharmacol. 67 (2-3), 313-316 (1980).
- Fairbanks, C. A. Spinal delivery of analgesics in experimental models of pain and analgesia. Adv Drug Deliv Rev. 55 (8), 1007-1041 (2003).
- Choi, S. E., et al. High-frequency ultrasound-guided intrathecal injections in a young mouse model: Targeting the central nervous system in drug delivery. J Neurosci Methods. 386, 109778(2023).
- Li, D., Li, Y., Tian, Y., Xu, Z., Guo, Y. Direct intrathecal injection of recombinant adeno-associated viruses in adult mice. J Vis Exp. 144, e58565(2019).
- Njoo, C., Heinl, C., Kuner, R. In vivo SiRNA transfection and gene knockdown in spinal cord via rapid noninvasive lumbar intrathecal injections in mice. J Vis Exp. 85, e51229(2014).
- Vulchanova, L., et al. Differential adeno-associated virus-mediated gene transfer to sensory neurons following intrathecal delivery by direct lumbar puncture. Mol Pain. 6, 31(2010).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Mestre, C., Pelissier, T., Fialip, J., Wilcox, G., Eschalier, A. A method to perform direct transcutaneous intrathecal injection in rats. J Pharmacol Toxicol Methods. 32 (4), 197-200 (1994).
- Donsante, A., Rasmussen, S. A., Fridovich-Keil, J. L. Intrathecal vector delivery in juvenile rats via lumbar cistern injection. J Vis Exp. 205, e66463(2024).
- Lu, X., Jiang, Y. H. Intrathecal injection of newborn mouse for genome editing and drug delivery. J Vis Exp. 205, e65761(2024).
- Chen, X., et al. Intrathecal AAV9/AP4M1 gene therapy for hereditary spastic paraplegia 50 shows safety and efficacy in preclinical studies. J Clin Invest. 133 (10), JCI164575(2023).
- Deschenes, N. M., et al. Biochemical correction of GM2 ganglioside accumulation in AB-variant GM2 gangliosidosis. Int J Mol Sci. 24 (11), ijms24119217(2023).
- Hwang, S. M., Rahman, M. M., Go, E. J., Kim, Y. H., Park, C. K. Specific transcription factors Ascl1 and Lhx6 attenuate diabetic neuropathic pain by modulating spinal neuroinflammation and microglial activation in mice. Biomed Pharmacother. 173, 116392(2024).
- Kagiava, A., et al. Gene replacement therapy in two Golgi-retained CMT1X mutants before and after the onset of demyelinating neuropathy. Mol Ther Methods Clin Dev. 30, 377-393 (2023).
- Wong, H., et al. CNS-dominant human FMRP isoform rescues seizures, fear, and sleep abnormalities in Fmr1-KO mice. JCI Insight. 8 (11), 169650(2023).
- Laoharawee, K., et al. Prevention of neurocognitive deficiency in mucopolysaccharidosis type ii mice by central nervous system-directed, AAV9-mediated iduronate sulfatase gene transfer. Hum Gene Ther. 28 (8), 626-638 (2017).
- Aanonsen, L. M., Wilcox, G. L. Phencyclidine selectively blocks a spinal action of N-methyl-D-aspartate in mice. Neurosci Lett. 67 (2), 191-197 (1986).
- Bailey, R. M., Armao, D., Nagabhushan Kalburgi, S., Gray, S. J. Development of intrathecal AAV9 Gene therapy for giant axonal neuropathy. Mol Ther Methods Clin Dev. 9, 160-171 (2018).
- Bailey, R. M., Rozenberg, A., Gray, S. J. Comparison of high-dose intracisterna magna and lumbar puncture intrathecal delivery of AAV9 in mice to treat neuropathies. Brain Res. 1739, 146832(2020).
- Chen, X., et al. AAV9/MFSD8 gene therapy is effective in preclinical models of neuronal ceroid lipofuscinosis type 7 disease. J Clin Invest. 132 (5), JCI146286(2022).
- Karumuthil-Melethil, S., et al. Intrathecal administration of AAV/GALC vectors in 10-11-day-old twitcher mice improves survival and is enhanced by bone marrow transplant. J Neurosci Res. 94 (11), 1138-1151 (2016).
- Ling, Q., Rioux, M., Hu, Y., Lee, M., Gray, S. J. Adeno-associated viral vector serotype 9-based gene replacement therapy for SURF1-related Leigh syndrome. Mol Ther Methods Clin Dev. 23, 158-168 (2021).
- Sinnett, S. E., Boyle, E., Lyons, C., Gray, S. J. Engineered microRNA-based regulatory element permits safe high-dose miniMECP2 gene therapy in Rett mice. Brain. 144 (10), 3005-3019 (2021).
- Rahman, M. M., Lee, J. Y., Kim, Y. H., Park, C. K. Epidural and Intrathecal Drug Delivery in Rats and Mice for Experimental Research: Fundamental Concepts, Techniques, Precaution, and Application. Biomedicines. 11 (5), 11051413(2023).
- Allen, C. H., Ward, J. D. An evidence-based approach to management of increased intracranial pressure. Crit Care Clin. 14 (3), 485-495 (1998).
- Belov, V., et al. Large-volume intrathecal administrations: Impact on CSF pressure and safety implications. Front Neurosci. 15, 604197(2021).
- Moazen, M., et al. Intracranial pressure changes during mouse development. J Biomech. 49 (1), 123-126 (2016).
- Rieselbach, R. E., Di Chiro, G., Freireich, E. J., Rall, D. P. Subarachnoid distribution of drugs after lumbar injection. N Engl J Med. 267, 1273-1278 (1962).
- Pardridge, W. M. CSF, blood-brain barrier, and brain drug delivery. Expert Opin Drug Deliv. 13 (7), 963-975 (2016).
- Ghersi-Egea, J. F., Babikian, A., Blondel, S., Strazielle, N. Changes in the cerebrospinal fluid circulatory system of the developing rat: quantitative volumetric analysis and effect on blood-CSF permeability interpretation. Fluids Barriers CNS. 12, 8(2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon