Method Article
Generazione di una linea cellulare RIP1 knockout U937 utilizzando il sistema CRISPR-Cas9
In questo articolo
Riepilogo
Man mano che i protocolli relativi a CRISPR diventano sempre più utili e accessibili, possono ancora sorgere complicazioni e ostacoli in specifiche condizioni sperimentali. Questo protocollo delinea la creazione di una linea cellulare umana knockout per serina/treonina-proteina chinasi 1 (RIPK1/RIP1) che interagisce con il recettore utilizzando CRISPR/Cas9 ed evidenzia le potenziali sfide incontrate durante questo processo.
Abstract
Questo protocollo delinea una procedura per eliminare il gene RIP1 utilizzando CRISPR/Cas9 nella linea cellulare di monociti umani U937. Il metodo utilizza plasmidi di RNA guida designati e plasmidi di confezionamento lentivirale per ottenere il knockout del gene RIP1. Il protocollo affronta le sfide e i miglioramenti dei metodi CRISPR tradizionali, consentendone la replicazione per futuri studi sulla morte cellulare. Le cellule mutanti risultanti possono essere utilizzate per studiare i cambiamenti meccanicistici nella morte cellulare, dove le proteine funzionali RIP1 svolgerebbero altrimenti un ruolo. I saggi di vitalità hanno dimostrato una significativa riduzione della morte cellulare nelle cellule knockout in seguito all'induzione della necroptosi. La microscopia a fluorescenza ha rivelato una marcata diminuzione delle specie reattive dell'ossigeno (ROS) mitocondriali nelle cellule knockout nelle stesse condizioni. Insieme, questi saggi funzionali confermano la perdita della proteina RIP1. Ottimizzata per l'uso con monociti umani U937, questa procedura può anche essere adattata per colpire altri regolatori chiave della morte cellulare, producendo mutanti funzionali e non letali. Le potenziali insidie vengono affrontate in tutto il percorso per fornire informazioni sulle sfide che possono sorgere durante la generazione dei mutanti.
Introduzione
L'uso della tecnologia di editing genetico CRISPR/Cas9 si è evoluto rapidamente dalla sua scoperta 1,2,3. La capacità di knock-in o knockout di geni all'interno di linee cellulari o batteri è inestimabile per far progredire la ricerca e la comprensione dei meccanismi intracellulari 1,2,3,4,5,6. Il sistema CRISPR-Cas9 migliora i precedenti metodi di editing genetico, come la nucleasi effettrice simile all'attivatore della trascrizione (TALEN), semplificando l'ingegnerizzazione della specificità genica. Questa procedura include due componenti fondamentali: l'RNA guida (gRNA) utilizzato per localizzare il bersaglio genico previsto e Cas9, che è un'endonucleasi che modifica la posizione del genoma prevista con una rottura del DNA a doppio filamento 3,4. Il gRNA fungerà da guida per l'endonucleasi Cas9 per localizzare e avviare la rottura a doppio filamento nella sequenza genetica prevista attraverso l'appaiamento di basi Watson-Crick. L'intero processo di editing del genoma da parte del sistema CRISPR/Cas9 coinvolge il macchinario cellulare che ripara queste rotture a doppio filamento nel DNA attraverso l'unione di estremità non omologa (NHEJ) o la ricombinazione omologa 3,7. È più probabile che si verifichi NHEJ, creando efficacemente una mutazione nel genoma che si traduce in una perdita di espressione per il gene bersaglio 3,4.
Le fonti commerciali sono state in grado di creare librerie di bersagli di gRNA che possono essere espressi attraverso la crescita batterica e l'isolamento, il che migliora significativamente la loro facilità d'uso. Tuttavia, il principale limite del sistema CRISPR/Cas9 è la difficoltà di veicolare il gRNA e il complesso Cas9 nelle linee cellulari bersaglio. Queste limitazioni insorgono nelle linee cellulari in sospensione, poiché sono generalmente indicate come8 difficili da trasfettare. I metodi di trasfezione tipici non sono generalmente efficienti nel fornire il sistema CRISPR/Cas9 in cellule di sospensione, motivo per cui i metodi di somministrazione virale come la trasfezione e la trasduzione lentivirale sono più adatti per questo tipo di linea cellulare 8,9.
Questo tipo di trasfezione richiede un vettore lentivirale che codifica il gRNA e l'endonucleasi Cas9 insieme all'aggiunta di plasmidi di imballaggio lentivirale, che vengono trasfettati in una linea cellulare in grado di produrre particelle lentivirali. Una linea cellulare tipicamente scelta per questo processo è HEK293T cellule, in quanto sono più facili da trasfettare e lavorano in modo molto efficiente nell'assemblaggio di gRNA e Cas9 9,10. Queste particelle vengono quindi rilasciate come lentivirus nel surnatante, che può essere utilizzato per trasdurre il gRNA e Cas9 nella linea cellulare di sospensione prevista, come i monociti umani U937. Pertanto, la procedura qui descritta presenta le seguenti modifiche rispetto ai metodi consolidati: (1) Metodo di trasfezione alternativo per linee cellulari difficili da trasfettare; (2) Non è necessario concentrare il DNA plasmidico CRISPR o utilizzare l'ultracentrifuga; e (3) Elimina la necessità di clonazione di singole cellule.
L'obiettivo diretto di questo articolo è stato quello di eliminare il gene RIP1 nei monociti umani U937. La forma canonica della necroptosi della via di morte cellulare altamente infiammatoria è controllata da RIP1, che funge da bersaglio fondamentale per gli studi sulla morte cellulare. 11,12,13,14 Quando RIP1 diventa attivo attraverso l'autofosforilazione, recluta e provoca la fosforilazione diretta e l'attivazione della serina/treonina-proteina chinasi 3 (RIPK3/RIP3) che interagisce con il recettore e della pseudochinasi MLKL (Mixed Lineage Kinase Domain-Like) per formare il necrosoma. A seguito di questa formazione, il necrosoma è libero di muoversi all'interno della cellula per interagire con organelli come i mitocondri12,13. A livello dei mitocondri, RIP1 potenzia un ciclo di feedback positivo con il metabolismo cellulare, influenzando direttamente la produzione di ROS mitocondriali, che a sua volta promuove un'ulteriore autofosforilazione di RIP1, la formazione di necrosomi e l'esecuzione a valle della necroptosi 11,12,13,14.
Mentre l'obiettivo dell'attuale gruppo di ricerca è il ruolo di RIP1 nella morte cellulare, altri motivi per studiare RIP1 includono i suoi ruoli nell'infiammazione e nell'infezione. Dopo l'attivazione da parte di recettori di morte come i recettori del TNF, RIP1 promuove l'attivazione della via di segnalazione NF-κB, che innesca la trascrizione di citochine pro-infiammatorie, chemochine e altre molecole essenziali per il reclutamento delle cellule immunitarie e l'amplificazione della risposta infiammatoria15. Oltre all'attivazione di NF-κB, RIPK1 può anche coinvolgere le vie di segnalazione MAPK, migliorando ulteriormente l'infiammazione15,16. Per quanto riguarda il suo ruolo nelle risposte all'infezione, RIP1 agisce come mediatore fondamentale della risposta infiammatoria dell'ospite, in particolare in risposta a pattern molecolari associati a patogeni (PAMP) riconosciuti dai recettori di riconoscimento dei pattern (PRR) come i recettori Toll-like (TLR)17. Inoltre, durante la sepsi, RIP1 viene attivato dalla segnalazione attraverso i recettori di morte come il recettore del TNF, portando all'inizio di cascate pro-infiammatorie. RIPK1 media l'attivazione delle vie NF-κB e MAPK, promuovendo la produzione di citochine pro-infiammatorie come TNF-α, IL-1β e IL-6, che sono fattori chiave della risposta infiammatoria sistemica caratteristica della sepsi18.
Protocollo
Una rappresentazione schematica della procedura è fornita nella Figura 1. L'RNA guida (gRNA) e la sequenza target sono riportati nella Tabella 1. I dettagli dei reagenti e delle attrezzature utilizzate sono elencati nella Tabella dei Materiali.
1. Raccolta di CRISPR gRNA vettore di espressione lentivirale CRISPR contenente l'endonucleasi Cas9 e la resistenza alla puromicina da Escherichia coli
- E. coli striato a quadrante che ospita il gRNA del vettore lentiviralesu piastre di agar LB integrate con 100 μg/mL di ampicillina.
- Incubare le piastre a 37°C per 1-2 giorni fino a quando le singole colonie sono visibili nell'area più diluita della piastra.
- Selezionare una singola colonia con ansa sterile e aggiungere individualmente ciascuna colonia a 5 ml di brodo LB integrato con 100 μg/mL di ampicillina in una provetta conica da 50 mL. Assicurarsi di pipettare accuratamente su e giù dopo aver aggiunto la singola colonia per garantire l'omogeneizzazione.
- Sfiatare e fissare con nastro adesivo il tappo della provetta conica da 50 mL e incubare in un agitatore orbitale a 37°C e 225 giri/min per 8 ore.
- Durante l'incubazione di 8 ore a 37°C, aggiungere 40 mL di brodo LB integrato con 100 μg/mL di ampicillina a ciascuna delle quattro provette coniche separate da 50 mL.
- Dopo l'incubazione di 8 ore a 37°C, prelevare 40 μL di E cresciuto.coli e aggiungerlo a tutte e quattro le provette coniche da 50 mL.
- Sfiatare e fissare con nastro adesivo i tappi delle provette coniche da 50 mL e incubarle in un agitatore orbitale a 37°C e 225 giri/min per 12-16 ore.
- Dopo questa incubazione a 37°C, centrifugare tutte le provette a 3220 x g in un rotore a secchiello oscillante per 20 minuti per pellettare i batteri E. coli cresciuti.
- Decantare i surnatanti in un becher di scarto, quindi unire tutti e quattro i pellet in 10 ml di brodo LB integrato con 100 μg/mL di ampicillina.
- Centrifuga di nuovo i pellet combinati alla massima velocità in un rotore a secchio oscillante per 20 minuti per ottenere un pellet singolare.
- Scartare la maggior parte possibile dei surnatanti nel becher di scarto e procedere con una delle seguenti opzioni: (1) Congelare il pellet umido a -80° per un massimo di 1 mese. (2) Procedere con la purificazione del plasmide vettore lentivirale.
NOTA: Se si sceglie l'opzione 1, il protocollo potrebbe essere messo in pausa qui.
2. Trasfezione di cellule HEK293T con vettore di espressione lentivirale CRISPR gRNA purificato che ha come bersaglio RIP1
- Seminare HEK293T cellule per una notte a una concentrazione di 3 × 10-6-5 × 106 cellule in una piastra di 10 cm contenente DMEM con 4,5 g/L di D-glucosio, L-glutammina, 110 mg/L di piruvato di sodio e il 10% di FBS inattivato termicamente.
- Il giorno seguente, assicurati che le piastre abbiano una confluenza di circa il 70%-90%, quindi procedi con il protocollo.
- Impostare la trasfezione delle cellule con un rapporto 1:1:1:1 di plasmidi (plasmide CRISPR sperimentale: pLP1: pLP2: pLP/VSVG) utilizzando il reagente di trasfezione in un rapporto 3:1 (3 parti di reagente: 1 parte di DNA plasmidico), insieme a un terreno sierico ridotto.
NOTA: La porzione pLP1: pLP2: pLP/VSVG del rapporto è una miscela di confezionamento lentivirale.- Equilibrare il reagente di trasfezione, il terreno sierico ridotto, il DNA plasmidico CRISPR e la miscela di confezionamento lentivirale a temperatura ambiente prima di impostare la trasfezione.
- Miscelare insieme 75 μl di reagente di trasfezione, 2500 μl di terreno sierico ridotto e 25 μg di DNA totale (calcolo basato sull'analisi spettrofotometrica per il DNA plasmidico CRISPR e il rapporto 1:1:1:1 con la miscela di confezionamento lentivirale).
- Lasciare incubare questa miscela a temperatura ambiente per 15-30 minuti. Pipettare con cura l'intero volume di questa miscela nella piastra cellulare HEK293T confluente direttamente nel terreno (non è necessario cambiare il terreno).
- Agitare delicatamente la piastra per garantire un'adeguata omogeneizzazione della miscela di trasfezione e del terreno di coltura della piastra. Incubare la piastra a 37 °C per 48 ore.
3. Trasduzione lentivirale di cellule U937 o cellule bersaglio
- Una volta completata l'incubazione di 48 ore a 37 °C , trasferire il terreno dalla piastra cellulare del produttore HEK293T in una provetta conica da 15 mL.
- Centrifugare il volume a 800 x g per 5 minuti a temperatura ambiente per pellettare eventuali celle HEK293T rimanenti. Rimuovere tutto il surnatante contenente virus, facendo attenzione a non disturbare le cellule HEK293T pellettate, e conservarlo in una provetta conica separata da 15 mL. Quindi, decontaminare e gettare il tubo contenente pellet nell'apposito contenitore per rifiuti a rischio biologico.
NOTA: I surnatanti del lentivirus a base di HIV possono essere conservati a -80°C; Tuttavia, ciò comporta il rischio di una perdita di stabilità del virus fino al 55% dopo il primo ciclo di congelamento/disgelo19. - Contare e ottenere un pellet di 2 × 106 cellule U937 in una provetta conica da 15 mL centrifugando un volume appropriato a 400 x g per 10 minuti a temperatura ambiente e decantare il surnatante, lasciando il pellet di cellule nella provetta.
- Risospendere il pellet di cellule U937 con tutto il surnatante contenente virus e quindi centrifugare la provetta a 290 x g per 60 minuti.
- Dopo la centrifugazione, utilizzare una pipetta per risospendere il pellet con il surnatante contenente il virus già nella provetta.
- Posizionare il tubo su un rotatore end-over-end (o un dispositivo rotante simile) per 60 minuti.
- Dopo questa incubazione, centrifugare le provette a 400 x g per 10 minuti a temperatura ambiente per pellettare le cellule.
- Risospendere il pellet cellulare con una miscela di terreni con rapporto 1:1 di surnatanti contenenti virus e terreni RPMI-1640 completi integrati con FBS inattivato a caldo al 10%.
- Trasferire la miscela di cellule in una piastra di coltura tissutale di 10 cm e incubare a 37°C per 48 ore.
- Dopo questa incubazione, centrifugare le cellule U937 a 400 x g per 10 minuti e rimuovere il surnatante.
- Risospendere il pellet con un terreno RPMI-1640 completo integrato con il 10% di FBS inattivato a caldo e 5 μg/mL di puromicina e trasferire le cellule in un pallone T25.
- Incubare le cellule a 37 °C intatte per 2-3 settimane, assicurandosi di controllarle ogni 1-2 giorni per rilevare eventuali segni di crescita cellulare.
NOTA: Una volta che le cellule diventano confluenti e hanno un tempo di turnover sano dopo un passaggio iniziale, possono essere testate per l'efficacia del protocollo completato.
4. Verifica dell'efficacia del protocollo completato nella creazione di cellule mutanti CRISPR RIP1 mediante analisi Western blot
- Generare lisati proteici cellulari di monociti U937 wild-type (WT), cellule CRISPR di controllo non mirate (NTC) e cellule mutanti CRISPR RIP1 11,12,13.
- Eseguire questi lisati su un gel SDS-PAGE e procedere con l'analisi Western blot14.
- Normalizzare prima i campioni in una proteina di pulizia.
- Dopo la normalizzazione, analizzare i campioni per i livelli di espressione della proteina RIP1 per determinare adeguatamente il successo della creazione di una linea cellulare mutante CRISPR RIP1 14.
- Dopo la conformazione dell'analisi western blot, le cellule possono essere utilizzate a scopo di sperimentazione.
Risultati
A seguito della produzione di una popolazione confluente di cellule U937 mutanti CRISPR RIP1 , sono state eseguite analisi SDS-PAGE e Western blot. L'analisi Western blot è stata utilizzata per determinare il successo della creazione di una linea cellulare mutante CRISPR RIP1 valutando la perdita dei livelli di espressione della proteina RIP1. Questa determinazione è stata effettuata sulla base del risultato comparativo dei monociti WT U937 e delle cellule NTC. Nella Figura 2, l'espressione di RIP1 non è stata rilevata per le cellule mutanti CRISPR RIP1 di puromicina da 5 μg/mL, ma è stata rilevata sia per le cellule WT U937 che per le cellule NTC. Questo risultato dimostra che questo protocollo è un metodo affidabile ed efficace per selezionare un mutante CRISPR RIP1 vitale.
Con la perdita di espressione della proteina RIP1 nelle cellule mutanti CRISPR di RIP1, abbiamo quindi determinato se ciò equivaleva a una perdita funzionale anche di RIP1. In studi precedentemente stabiliti, una combinazione di fattore di necrosi tumorale-alfa (TNF-α), cicloesimide e inibitore della pan-caspasi zVAD-fmk è uno stimolo diretto della necroptosi abbreviato in TCZ11,14. Come si vede nella Figura 3, l'induzione della morte cellulare necroptotica con il trattamento con TCZ viene invertita dopo il trattamento con il noto inibitore di RIP1, la necrostatina-1 (nec-1s), sia nei monociti WT U937 che nella linea cellulare NTC. Per le cellule mutanti CRISPR RIP1, tuttavia, il trattamento con TCZ ha determinato una significativa perdita di morte cellulare rispetto alle cellule WT e NTC. Il successivo trattamento con nec-1 non ha avuto alcun effetto sulle cellule mutanti CRISPR di RIP1, indicando l'assenza di necroptosi e funzione di RIP1.
Per valutare ulteriormente la perdita delle funzioni di RIP1 all'interno di queste cellule mutanti CRISPR RIP1 , è stata eseguita la microscopia a fluorescenza su cellule vive con una colorazione di DNA Hoecsht (fluorescenza blu) e una colorazione di superossido mitocondriale (fluorescenza rossa). Questi esperimenti ci hanno permesso di determinare se l'aumento precedentemente stabilito della produzione di superossido mitocondriale durante la necroptosi viene perso in queste cellule. È noto che RIP1 interagisce direttamente con il metabolismo cellulare e aumenta significativamente la produzione di superossido mitocondriale. Questa abbondanza di superossido all'interno della cellula, a sua volta, crea un ciclo di feedback positivo con l'attivazione di RIP1 e l'esecuzione a valle della necroptosi. Come si vede nella Figura 4, il trattamento con TCZ ha mostrato un'abbondanza di produzione di superossido mitocondriale sia nei monociti WT U937 che nelle cellule NTC, ma non nelle cellule mutanti CRISPR RIP1 . Il successivo trattamento con nec-1 ha portato a una significativa diminuzione della colorazione a fluorescenza rossa sia per i monociti WT U937 che per le cellule NTC, senza che siano stati osservati cambiamenti nelle cellule mutanti CRISPR RIP1 .

Figura 1: Modello schematico del protocollo CRISPR/Cas9. Rappresentazione visiva dei vari passaggi forniti all'interno di questo protocollo per facilitarne la comprensione. Clicca qui per visualizzare una versione più grande di questa figura.
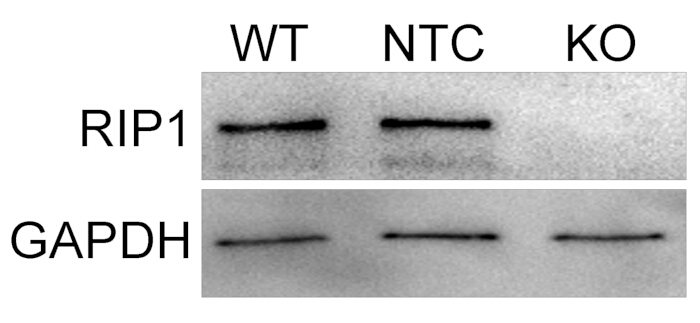
Figura 2: L'analisi Western blot conferma la perdita dell'espressione della proteina RIP1 nelle cellule mutanti CRISPR RIP1.L'espressione della proteina RIP1 è stata persa con una selezione di puromicina di 5 μg/mL nelle cellule U937 mutanti CRISPR RIP1 rispetto alle cellule WT U937 e alle cellule NTC. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Il test di vitalità cellulare mostra la perdita di funzione di RIP1 nelle cellule mutanti CRISPR di RIP1.La morte cellulare necroptotica è stata indotta attraverso il trattamento con TCZ e analizzata con il successivo trattamento con nec-1s. Sia i monociti WT U937 che le cellule NTC hanno mostrato una significativa diminuzione della morte cellulare dopo il trattamento con nec-1. Le cellule mutanti CRISPR RIP1 hanno mostrato una morte cellulare molto inferiore quando trattate con TCZ e non hanno mostrato alcun cambiamento quando sono state successivamente trattate con nec-1. I risultati mostrati provengono da 3 esperimenti indipendenti. Le barre di errore rappresentano la deviazione standard. ANOVA a due vie con post-test Bonferroni ***p < 0,001. ns = non statisticamente significativo. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Analisi funzionale a valle di RIP1 in cellule mutanti CRISPR RIP1 mediante microscopia a fluorescenza. (A) La misurazione della colorazione mitocondriale con superossido (fluorescenza rossa) ha mostrato una diminuzione della produzione di superossido sia nei monociti WT U937 che nelle cellule NTC dopo il trattamento con nec-1s. Le cellule mutanti CRISPR RIP1 non hanno mostrato produzione di superossido mitocondriale quando trattate con TCZ e non hanno mostrato alcun cambiamento quando sono state successivamente trattate con nec-1. Barre della scala: 100 μm. (B) Quantificazione dell'intensità media di fluorescenza dei risultati rappresentati in (A). I risultati mostrati provengono da 3 esperimenti indipendenti. Le barre di errore rappresentano la deviazione standard. ANOVA a due vie con post-test Bonferroni, ***p < 0,001. Clicca qui per visualizzare una versione più grande di questa figura.
| Bersaglio del gene | Gene ID | gRNA | Nucleotidi corrispondenti nel gene | PAM | Cantiere di taglio Cas9 | ||
| RIPK1 | 8737 | GCTTTGCGTTGACGTCATTC | 88-841 | AGG | 816 | ||
Tabella 1: RNA guida (gRNA) e sequenza bersaglio.
Discussione
Questo protocollo mira a fornire istruzioni dettagliate e analisi delle potenziali insidie nell'efficienza e nell'affidabilità della trasfezione e della trasduzione lentivirale per creare una linea cellulare RIP1 knockout U937. Sebbene questo metodo di trasfezione e trasduzione richieda molto lavoro e tempo, è generalmente considerato un modo efficiente per incorporare il gRNA scelto e l'endonucleasi Cas9 in linee cellulari difficili da trasfettare 8,9,20. Come nel caso dei monociti come le cellule U937 e altre cellule immunitarie, c'è una difficoltà intrinseca nell'eseguire la trasfezione poiché ospitano sensori innati che riconoscono e rispondono agli acidi nucleici estranei. Ciò può portare alla distruzione/ipermutazione dell'acido nucleico, alla repressione trascrizionale e/o alla morte cellulare in risposta agli acidi nucleici estranei21.
Questo metodo di somministrazione è possibile solo utilizzando una linea cellulare in grado di produrre particelle lentivirali, HEK293T cellule, che sono una linea cellulare di rene embrionale umano aderente che è ampiamente accettata come facile da trasfettare 9,10. Con queste informazioni, vengono delineati i passaggi più critici di questa procedura che devono essere gestiti con cura. La coltura cellulare e il monitoraggio sono della massima importanza. Questo studio ha utilizzato le cellule U937 come linea cellulare bersaglio per il gRNA e Cas9, che sono monociti umani in sospensione a crescita rapida e facili da usare22. Come per la maggior parte delle cellule a crescita rapida, la manutenzione e il passaggio regolari delle cellule sono importanti per evitare che diventino troppo cresciute e non funzionino nella sperimentazione come previsto. Lo stesso concetto si applica alle celle HEK293T in questo protocollo. Garantire che queste linee cellulari siano adeguatamente mantenute e mantenute in uno stato sano e confluente durante il loro utilizzo nel protocollo è essenziale per un'efficiente produzione di lentivirali. Un altro passaggio critico in questa procedura consiste nell'utilizzare le concentrazioni appropriate di reagente di trasfezione e i rapporti tra il DNA plasmidico CRISPR e la miscela di confezionamento lentivirale. Queste proporzioni matematiche sono state testate empiricamente in diverse concentrazioni con questo metodo e i valori elencati sono fondamentali per la trasfezione di cellule HEK293T.
Come per la maggior parte dei metodi e delle procedure ideati, c'è una discreta quantità di risoluzione dei problemi che va nel processo di sperimentazione funzionante stabilito. Un problema qui determinato con altri protocolli accettati è la sfida immediata della puromicina dopo una fase di trasduzione più breve per le cellule U937. Poiché la fase di trasduzione utilizza solo 2 × 10 celluleU937 , è stata determinata empiricamente un'intera incubazione di 48 ore con metà del terreno completo RPMI-1640 integrato con il 10% di FBS inattivato a caldo per facilitare la generazione di questa linea cellulare mutante CRISPR RIP1 . Quando le cellule sono state continuamente stimolate con 5 μg/mL di puromicina senza intervento, le cellule U937 vive e sane hanno iniziato a comparire nella coltura dopo 2-3 settimane. Poiché questo protocollo richiede molto tempo, più iterazioni di questa fase di trasfezione e trasduzione hanno diverse possibili colture recuperabili. Una volta che le colture diventano confluenti, si può verificare l'efficacia del protocollo attraverso tecniche SDS-PAGE e Western blotting. Anche dopo il successo dell'isolamento e della conferma di una linea cellulare mutante CRISPR RIP1 , si farebbe bene a eseguire il monitoraggio di routine della SDS-PAGE basata sul lisato proteico e l'analisi western blot per la perdita cellulare dell'espressione della proteina RIP1 per l'uso continuo di queste cellule nella sperimentazione.
Un altro motivo per la risoluzione empirica dei problemi è la mancanza di informazioni chiare disponibili per l'uso di reagenti di trasfezione con linee cellulari immunitarie. Tra le informazioni disponibili da parte delle aziende e i protocolli, ci sono informazioni contrastanti riguardo a un rapporto basato sulla concentrazione per il reagente di trasfezione utilizzato in questo protocollo al DNA. Mentre il tentativo varia da 5:1 a 3:1, rispettivamente, ha determinato che 3:1 è il rapporto massimo da utilizzare, altrimenti la trasfezione non viene completata in modo efficiente con le celle HEK293T. Insieme a questa scelta, è stato determinato che una singola iterazione del DNA plasmidico CRISPR a volumi inferiori era insufficiente per trasfettare completamente una piastra di 10 cm di cellule HEK293T. Poiché il kit di purificazione del plasmide produce un grande volume di DNA plasmidico CRISPR da E. coli, aumentando i volumi di tutti i componenti della trasfezione, ha prodotto un'efficienza di trasfezione migliorata di 5 volte per il recupero delle cellule U937 dopo la trasduzione. I volumi elencati per questi componenti nel protocollo rappresentano un aumento di 5 volte rispetto a una singola iterazione rispetto ai protocolli accettati. Tra questi cambiamenti nel rapporto del reagente di trasfezione e il volume totale utilizzato per questi componenti, il protocollo è stato ideato senza la necessità di concentrare il DNA plasmidico CRISPR o richiedere l'uso di un'ultracentrifuga. Tuttavia, se questi materiali sono disponibili, il DNA plasmidico CRISPR isolato può essere concentrato utilizzando metodi consolidati, diminuendo così i volumi richiesti di altri componenti di questo protocollo23,24.
Quando si utilizzano metodi di trasfezione lentivirale, si possono notare limitazioni per il loro utilizzo nell'editing genetico CRISPR/Cas9. La limitazione più notevole è il tempo e i requisiti di manodopera per questo protocollo 9,20. La procedura include solo due passaggi in cui può essere messa in pausa, ma è ottimizzata per linee cellulari difficili da trasfettare. Per le linee cellulari difficili da trasfettare come i monociti U937, i metodi di trasfezione tipici, inclusa l'introduzione di plasmidi mediata da sostanze chimiche, non sono efficaci quanto la somministrazione a base lentivirale25.
L'interesse di ricerca più ampio si concentra sul passaggio iperglicemico dall'apoptosi alla necroptosi nei monociti U937, sottolineando la necessità di un knockout funzionale di RIP1 per la comprensione meccanicistica durante questo processo. Poiché RIP1 è una proteina fondamentale nell'esecuzione della necroptosi, è essenziale comprendere tutte le sue funzioni e interazioni proteiche all'interno della cellula 11,12,13,14. Le direzioni future di questo protocollo includono l'applicazione di questi metodi a ulteriori indagini ed esperimenti riguardanti il passaggio iperglicemico dall'apoptosi alla necroptosi. Si prevede che questo protocollo sarà ampiamente applicabile ai metodi di trasfezione e trasduzione lentivirale con cellule in sospensione per vari bersagli di gRNA utilizzando il sistema CRISPR/Cas9, estendendosi oltre le cellule U937 e il knockout funzionale di RIP1.
Divulgazioni
Nessuno.
Riconoscimenti
Questa ricerca è stata finanziata dal National Heart, Lung, and Blood Institute (NHLBI) del National Institutes of Health (NIH), numero di sovvenzione NIH 2R15-HL135675-02 a T.J.L.
Materiali
| Name | Company | Catalog Number | Comments |
| Adjusted DMEM Medium | Gibco | 11995-040 | |
| Ampicillin | Sigma | A1593 | |
| bisBenzimide Hoechst 33342 trihydrochloride | Sigma | B2261 | |
| Complete RPMI-1640 Medium | Sigma | R6504 | |
| CRISPR NTC gRNA E.coli Strain | transOMIC | TELA1011 | |
| CRISPR RIP1 gRNA E.coli Strain | transOMIC | TEVH-1162203 | |
| End-over-end Rotator | Thermo Scientific | ||
| EVOS FL Fluorescence Microscope | Life Technologies | ||
| GenElute Plasmid Maxiprep Kit | Sigma | PLX15 | |
| Goat Anti-Rabbit IgG Antibody, (H+L) HRP conjugate | Sigma | AP307P | |
| HEK293T Cells | ATCC | ||
| Incubator Shaker | New Brunswick Scientific | ||
| LB Agar | BD | 244520 | |
| LB Broth | BD | 244610 | |
| LV-MAX Lentiviral Packaging Mix | Gibco | A43237 | |
| MitoSOX Red | MedChemExpress | HY-D1055 | |
| NanoDrop Spectrophotometer | Thermo Scientific | ||
| Necrostatin-1 | MedChemExpress | HY-14622A | |
| OPTI-MEM | Gibco | 31985-062 | |
| Puromycin | Sigma | P7255 | |
| Rabbit anti-human RIP1 mAb | Cell Signaling Technology | 3493 | |
| SDS-PAGE and western blot equipment | BioRad | ||
| TNF-α | MedChemExpress | HY-P7058 | |
| U937 Human Monocytes | ATCC | ||
| WST-1 Cell Proliferation Assay System | TaKaRa | MK400 | |
| X-tremeGENE 9 DNA Transfection Reagent | Roche Diagnostics | 6365779001 | |
| z-VAD-FMK | APExBIO | A1902 |
Riferimenti
- Gostimskaya, I. CRISPR–Cas9: A History of its discovery and ethical considerations of its use in genome editing. Biochem (Mosc.). 87 (8), 777-788 (2022).
- Jinek, M., et al. A programmable dual RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Redman, M., King, A., Watson, C., King, D. What is CRISPR/Cas9. Arch Dis Child Educ Pract Ed. 101 (4), 213-215 (2016).
- Ebrahimi, S., et al. In vitro evaluation of CRISPR PX-LmGP63 vector effect on pathogenicity of Leishmania major as a primary step to control leishmaniasis. Microb Pathog. 161 (Pt A), 105281 (2021).
- Ebrahimi, S., Alipour, H., Azizi, K., Kalantari, M. Construction of px-lmgp63 using crispr-cas9 as primary goal for gp63 gene knockout in Leishmania major and leishmanization. Jundishapur J Microbiol. 14 (1), 112965 (2021).
- Lim, J. M., Kim, H. H. Basic principles and clinical applications of CRISPR-based genome editing. Yonsei Med J. 63 (2), 105-113 (2022).
- Han, X., et al. CRISPR-Cas9 delivery to hard-to-transfect cells via membrane deformation. Sci Adv. 1 (7), 1500454 (2015).
- Sano, S., et al. Lentiviral CRISPR/Cas9-mediated genome editing for the study of hematopoietic cells in disease models. J Vis Exp. (152), e59977 (2019).
- Tan, E., Chin, C. S. H., Lim, Z. F. S., Ng, S. K. HEK293 cell line as a platform to produce recombinant proteins and viral vectors. Front Bioeng Biotechnol. 9, 796991 (2021).
- Mccaig, W. D., et al. Hyperglycemia potentiates a shift from apoptosis to RIP1-dependent necroptosis. Cell Death Dis. , 1-14 (2018).
- Deragon, M. A., et al. Mitochondrial ROS prime the hyperglycemic shift from apoptosis to necroptosis. Cell Death Dis. 6 (1), (2020).
- Deragon, M. A., et al. Mitochondrial trafficking of MLKL, Bak/Bax, and Drp1 Is mediated by RIP1 and ROS which leads to decreased mitochondrial membrane integrity during the hyperglycemic shift to necroptosis. Int J Mol Sci. 24 (10), 8609 (2023).
- LaRocca, T. J., Sosunov, S. A., Shakerley, N. L., Ten, V. S., Ratner, A. J. Hyperglycemic conditions prime cells for RIP1-dependent necroptosis. J Biol Chem. 291 (26), 13753-13761 (2016).
- Pasparakis, M., Vandenabeele, P. Necroptosis and its role in inflammation. Nature. 517 (7534), 311-320 (2015).
- Yang, Y., et al. A Cytosolic ATM/NEMO/RIP1 complex recruits TAK1 To mediate the NF-κB and p38 Mitogen-Activated Protein Kinase (MAPK)/MAPK-activated protein 2 responses to DNA damage. Mol Cell Biol. 31 (14), 2774-2786 (2011).
- Eng, V. V., Wemyss, M. A., Pearson, J. S. The diverse roles of RIP kinases in host-pathogen interactions. Semin Cell Dev Biol. 109, 125-143 (2021).
- Liu, X., et al. RIPK1 in the inflammatory response and sepsis: Recent advances, drug discovery and beyond. Front Immunol. 14, 1114103 (2023).
- Kowolik, C. M., Yee, J. -. K. Preferential transduction of human hepatocytes with lentiviral vectors pseudotyped by Sendai virus F protein. Mol Ther. 5 (6), 762-769 (2002).
- Chong, Z. X., Yeap, S. K., Ho, W. Y. Transfection types, methods and strategies: A technical review. PeerJ. 9, 11165 (2021).
- Keller, A. A., Maeß, M. B., Schnoor, M., Scheiding, B., Lorkowski, S. Transfecting Macrophages. Methods Mol Biol (Clifton, N.J). 1784, 187-195 (2018).
- Chanput, W., Peters, V., Wichers, H. THP-1 and U937 cells. The impact of food bioactives on health: In vitro and ex vivo. models. 159 (147), (2015).
- Kutner, R. H., Zhang, X. Y., Reiser, J. Production, concentration and titration of pseudotyped HIV-1-based lentiviral vectors. Nat Protoc. 4 (4), 495-505 (2009).
- Ricks, D. M., Kutner, R., Zhang, X. Y., Welsh, D. A., Reiser, J. Optimized lentiviral transduction of mouse bone marrow-derived mesenchymal stem cells. Stem Cells Dev. 17 (3), 441-450 (2008).
- Swainson, L., Mongellaz, C., Adjali, O., Vicente, R., Taylor, N. Lentiviral transduction of immune cells. Methods Mol Biol (Clifton, N.J.). 415, 301-320 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon