Method Article
חיזוי מובהקות נוגדנים של כדוריות דם אדומות באמצעות בדיקת מונוציטים-מקרופאגים
In This Article
Summary
פיתחנו שיפורים ושיטות מעודכנות לבדיקת מונוציטים-חד-שכבתיים (MMA) הקיימת, שבה נעשה שימוש במקרופאגים כדי לעזור לחזות טוב יותר את הרלוונטיות הקלינית של נוגדנים של כדוריות אדומות ברפואת עירוי ואימונולוגיה. בדיקה זו נקראת בדיקת מונוציטים-מקרופאגים (M-MA).
Abstract
מקרופאגים, שמקורם במונוציטים במח העצם, הם תאים חיסוניים גדולים ומולדים הממלאים תפקיד מרכזי בפינוי תאים מתים, פסולת, תאי גידול ופתוגנים זרים. היכולת הפגוציטית של מונוציטים לעומת מקרופאגים היא מושג שאינו מובן היטב. כאן, אנו שואפים לבחון את ההבדל בפגוציטוזיס של מונוציטים לעומת מקרופאגים, במיוחד מקרופאגים M1/M2, לעומת תאים אדומים אופסוניים שונים באמצעות גרסה שונה ומעודכנת של בדיקת מונוציטים חד-שכבתית מבוססת (MMA). תאים חד-גרעיניים בדם היקפי (PBMCs) בודדו ממעילי באפי של התורם. באמצעות מונוציטים מטוהרים, מקרופאגים M1 דלקתיים ואנטי דלקתיים M2 הופקו על ידי תרבית מבחנה וקיטוב. תאי M1/M2 נקצרו ושימשו בבדיקה דמוית MMA, שאנו מכנים M-MA, כדי לפענח פגוציטוזיס משמעותי קלינית של נוגדנים שונים של כדוריות אדומות. אינדקס פגוציטי (PI) > 5 נחשב לפגוציטוזיס משמעותי מבחינה קלינית עם שימוש במונוציטים. אינדקס פגוציטי (PI) > 12 נחשב לפגוציטוזיס משמעותי מבחינה קלינית עם שימוש במקרופאגים M1/M2. מקרופאגים M2 מפגינים יכולת מוגברת לפגוציטוזה של RBCs אופסוניים בהשוואה למונוציטים ו-M1. אותו נוגדן חלש (anti-S) מניב פגוציטוזיס משמעותי עם מקרופאגים M2 בלבד (PI=43) אך לא M1s (PI=2) או מונוציטים (PI=0), וזה הוכח שוב ושוב באמצעות נוגדנים שונים. השימוש במקרופאגים M2 במקום מונוציטים עשוי לאפשר תוצאות מדויקות יותר מכיוון שתאים אלה פגוציטים יותר, ומציעים רלוונטיות קלינית נוספת לבדיקה. מחקרים נוספים עם נוגדנים שונים לתאי דם אדומים, כולל אימות של בדיקת מונוציטים-מקרופאגים (M-MA) עם נוגדנים בעלי משמעות קלינית ידועה, עשויים להראות שה-M-MA שימושי יותר לניבוי נוגדנים משמעותיים קלינית של כדוריות אדומות ותגובות עירוי. שיטה זו תקדם את תחום רפואת העירוי והאימונולוגיה.
Introduction
חיזוי תגובות עירוי נותר אתגר משמעותי בתחום רפואת העירוי. במהלך 4 העשורים האחרונים, בדיקת מונוציטים-חד-שכבתיים (MMA), שפותחה על ידי טונג וענף 1,2, שימשה כבדיקה תאית חשובה במבחנה לחיזוי התוצאה הקלינית של המוליזה בחולי עירוי דם1. ואכן, בדיקה זו הייתה חיונית בהבחנה בין נוגדנים משמעותיים קלינית לתאי דם אדומים (RBC)2. בעוד שמונוציטים היו באופן מסורתי הלויקוציטים הסטנדרטיים המשמשים בבדיקה זו, המחקר שלנו נועד לחקור את היתרונות הפוטנציאליים של שימוש במקרופאגים שמקורם במונוציטים כחלופה. תאים אלה עשויים לשפר את יכולת הבדיקות להעריך את הרלוונטיות הקלינית של נוגדנים של תאים אדומים.
ב-MMA ההיסטורי, מונוציטים, שהם הקודמים למקרופאגים, תאי החיסון האחראים לפינוי והרס של כדוריות דם אדומות במהלך תגובת עירוי שלילית, מוחדרים בבדיקת מבחנה יחד עם RBCs ונוגדנים 1,2,3,4,5,6,7 . לאחר מכן מוערכת פגוציטוזיס באופן ויזואלי על ידי ספירת RBCs פגוציטוזיים בתוך מונוציטים. אינדקס פגוציטי (PI) של < 5 תאי דם אדומים פגוציטוזיים לכל 100 מונוציטים שנספרו מצביע על כך שהמטופל נמצא בסיכון מופחת לחוות תגובה שלילית לעירוי, והנוגדן נחשב לחסר משמעות קלינית 4,5,6,7. ניסויים ראשוניים מראים ששימוש במונוציטים שמקורם בדם היקפי עשוי להיות לא אידיאלי לקביעת משמעות קלינית מכיוון שיש להם יכולת פגוציטית נמוכה יותר מאשר מונוציטים מופעלים ומקרופאגים מסוימים.
מונוציטים הם תת-קבוצה של תאים הנמצאים בדם, בטחול ובמח העצם ומהווים 10% מכלל הלויקוציטים בבני אדם8. תאים אלה מסתובבים בדרך כלל במשך 1-2 ימים לפני שהם מגויסים על ידי רקמות שונות, שם הם ממשיכים להתמיין למקרופאגים8. זה קורה בדרך כלל במהלך המטופואיזה, שבה מח העצם מייצר מונוציטים המשתחררים למחזור הדם והופכים למקרופאגים רקמתיים השוכנים בטחול ובכבד2. הידועים כקו ההגנה הראשון נגד פתוגנים זרים, מקרופאגים הם תאים חד-גרעיניים פגוציטים גדולים הממלאים תפקיד בחסינות אדפטיבית ומולדת9. בין התפקידים המורכבים והמורכבים של מערכת החיסון, הבנה ואפיון של פנוטיפים של מקרופאגים מציבים אתגר אדיר שעדיין לא הובן במלואו. במהלך שני העשורים האחרונים, הרעיון של קיטוב מקרופאגים זכה להכרה הולכת וגוברת, כאשר מחקרים אחרונים משתמשים בריצוף RNA של תא בודד כדי להבחין בספקטרום שבו מקרופאגים אלה קיימים.
מקרופאגים דמויי M1 ו-M1 המופעלים באופן קלאסי מתעוררים בסביבות דלקתיות הנשלטות על ידי קולטנים דמויי Toll (TLRs)10. תאים אלה עשויים להיות מעורבים במחלות אוטואימוניות וטרשת עורקים ומציגים סמני שטח כגון MHC-II, CD80 ו-CD8611,12. מקרופאגים אנטי דלקתיים דמויי M2 ו-M2 נמצאים בסביבות הנשלטות על ידי תגובות Th2, חסרות ביטוי של CD80 ומציגות סמני שטח כגון CD209 ו-CD20611,12. מקרופאגים M1/M2 עשויים להיות מתורבתים במבחנה מתאים חד-גרעיניים בדם היקפי, כאשר ליפופוליסכריד (LPS) וציטוקינים כגון GM-CSF ו-IFNγ (M1) ו-M-CSF ו-IL-4 (M2) מעוררים את הקיטוב שלהם10,12.
כתב יד זה ומחקרים קשורים נועדו להוכיח כי מקרופאגים M2 מציגים רגישות מוגברת לפגוציטוזיס בהשוואה למקרופאגים ומונוציטים M1. חקירת הפעילות הפגוציטית של מקרופאגים M1/M2 לעומת מונוציטים בהקשר של נוגדנים של כדוריות אדומות ורפואת עירוי היא תחום שעדיין לא נחקר. כאן, אנו מתארים את העבודה המתמשכת הנוכחית ליצירת מקרופאגים M1/M2 ומשווים את הבדיקה הקלאסית של מונוציטים חד-שכבתיים (MMA) לבדיקת מונוציטים-מקרופאגים חדשים, תוך שימוש בראשי התיבות M-MA כדי להבחין בין בדיקת מקרופאגים זו לבין בדיקת המונוציטים, כדי לשפר את ערך החיזוי של מבחני פגוציטוזיס במבחנה .
Protocol
מחקר זה בוצע בהתאם להנחיות מוסדיות לביצוע מחקר אתי הכולל נבדקים אנושיים. אישור האתיקה ניתן ממועצת האתיקה של מחקר שירותי הדם הקנדיים (REB), אישור CBSREB#2023.008. כל השלבים של פרוטוקול זה צריכים להתבצע בארון בטיחות ביולוגית בתנאים סטריליים.
1. בידוד PBMCs
- השג דם אנושי מלא מתורם בצינור ACD. אחסן את הדם בטמפרטורת החדר (18 מעלות צלזיוס - 22 מעלות צלזיוס) עד 36 שעות.
- העבירו את צינורות ה-ACD בדם המלא לצינורות צנטריפוגה של 50 מ"ל (צינור יחיד של 50 מ"ל לכל שני צינורות ACD). הוסף מדיום שלם RPMI-1640 בטמפרטורת החדר לנפח סופי של 35 מ"ל.
- הוסף 15 מ"ל של מדיום שיפוע צפיפות טמפרטורת החדר לצינור חדש של 50 מ"ל. שכב בזהירות את הדם המלא המדולל על גבי מדיום שיפוע הצפיפות, תוך מזעור הערבוב בממשק להפרדה אופטימלית של הדם.
- צנטריפוגה את תערובת השכבות ב-700 x גרם למשך 30 דקות עם בלמים כבויים. צנטריפוגת שיפוע הצפיפות תפריד את התערובת לשכבות הבאות מלמעלה למטה: פלזמה, מעיל באפי (המכיל PBMCs), חומר שיפוע צפיפות, גרנולוציטים ותאי דם אדומים.
- שואבים וזורקים את רוב השכבה העליונה (פלזמה). בעזרת פיפטת העברה, אחזר בזהירות את שכבת מעיל האפי (PBMCs), הימנע מהבאת חומר נוסף. העבר את ה-PBMCs שאוחזרו לצינור חדש של 50 מ"ל.
- שטפו את שכבת מעיל באפי המבודדת 1x עם תמיסת pH 7.4 PBS למשך 10 דקות ב-350 x גרם עם בלמים מלאים מופעלים.
- השתמש במסננת תאים של 70 מיקרומטר כדי לסלק פסולת או חומר לא רצוי מה-PBMCs לפני העברתם לצינור חרוטי של 15 מ"ל. שטפו פעמיים עם תמיסת pH 7.4 PBS למשך 10 דקות ב-350 x גרם עם בלמים מלאים מופעלים.
- אופציונלי: ליז כל RBCs המועברים עם מאגר ליזה ACK. הוסף 5-10 מ"ל של מאגר ליזה ACK, תלוי בגודל הגלולה, ודגר בטמפרטורת החדר עד 3 דקות. לאחר הדגירה, יש למלא pH 7.4 PBS וצנטריפוגה למשך 10 דקות ב-350 x g עם בלמים מלאים מופעלים ולשטוף 1x. בצע שלב זה אם מספר ה-RBCs גבוה מדי.
הערה: תמיד עדיף להימנע משימוש ב-ACK לקבלת תוצאות טובות יותר. לחלופין, ניתן להשתמש במים כדי לחסל תאי דם אדומים שאינם פגוציטוזים על ידי דגירה במים למשך לא יותר מ-15 שניות, ולאחר מכן להוסיף מיד 1X PBS לשטיפה. - הרכיב מחדש גלולת PBMC ב-2-3 מ"ל (השתמש ב-0.5 מ"ל לכל צינור ACD ראשוני) של מדיום שלם RPMI-1640. ספרו PBMCs עם המוציטומטר לאחר הכנת תערובת 1:1 עם טריפן כחול. סופר רק תאים שאינם מוכתמים בכחול טריפאן. להרכיב מחדש PBMCs ל-2 x 106 תאים/מ"ל במדיום שלם RPMI-1640.
2. תרבית של מקרופאגים M1/M2
- יום 0 זריעה של מונוציטים
- הכן בקבוק תרבית תאים של 25 מ"ל לכל אוכלוסיית מקרופאגים. הוסף 5 מ"ל של פולי-D-ליזין (50 מ"ג/500 מ"ל) לכל אחד והשאיר אותו במכסה המנוע למשך שעה אחת לפחות. שוטפים את הבקבוק עם PBS כדי להיפטר משאריות הפולי-D-ליזין.
- בודד PBMCs ממעיל באפי או מדגימות מטופלים, כרגיל (ראה שלב 1). לאחר שנוצרה גלולה של PBMCs, השעו אותה מחדש ב-10 מ"ל של מדיום שלם RPMI-1640 שחומם מראש.
- קבע את מספר התא והתחל בבידוד המונוציטים עם ערכת הבידוד של מונוציטים. כדי להפעיל את הערכה, השתמש לפחות ב-50 x 106 תאים.
- השעו מחדש את התאים ב-50 x 106 תאים/מ"ל במדיום בידוד. על פי מספר התא שהתקבל, השתמש במגנט הסגול (0.25-2 מ"ל) או האפור (0.5-8.5 מ"ל) המומלץ בערכת בידוד המונוציטים.
- עקוב אחר הוראות הערכה והוסף את הדגימה לצינור הפרופילן הנדרש (5 מ"ל או 14 מ"ל). הוסף קוקטייל העשרה לדגימה ב-50 מיקרוליטר/מ"ל של דגימה.
- צנרת למעלה ולמטה או מערבולת כדי לערבב את הדגימה ולאחר מכן לדגור בטמפרטורה של 2-8 מעלות צלזיוס למשך 10 דקות בדלי קרח. בינתיים, מערבולת חלקיקים מגנטיים למשך 30 שניות. לאחר הדגירה, הוסף חלקיקים מגנטיים לדגימה: 100 מיקרוליטר/מ"ל של דגימה.
- פיפט למעלה ולמטה או מערבולת כדי לערבב את הדגימה ולאחר מכן דגירה בטמפרטורה של 2-8 מעלות צלזיוס למשך 5 דקות. מלא במדיום בידוד עד 2.5 מ"ל או 10 מ"ל, בהתאם באמצעות פיפטה מדורגת. פיפטה למעלה ולמטה פי 2-3 לערבוב.
- הנח את הצינור (ללא מכסה) לתוך המגנט ודגר בטמפרטורת החדר למשך 2.5 דקות. הרם את המגנט ובתנועה רציפה אחת, הפוך את המגנט והצינור, ושפך את מתלה התא לצינור חדש, 5 מ"ל או 14 מ"ל.
- השעו מחדש תאים במדיום RPMI-1640 וספרו אותם. בצע שלב זה בהקדם האפשרי. זרעים בין 1 x 106 - 5 x 106 מונוציטים לכל בקבוק של 25 מ"ל שצופה בעבר בפולי-D-ליזין. הביאו את הנפח ל-5 מ"ל עם RPMI-1640 במידת הצורך.
- דגירה בטמפרטורה של 37 מעלות צלזיוס, 5% CO2, למשך שעתיים לפחות. בינתיים, הכן מדיית בידול M1 ו-M2. התכוננו מספיק לטעינה של יום 0 (10 מ"ל) ויום 4 (2 מ"ל).
הערה: מדיום התמיינות M1: RPMI-1640 + 2.5 ננוגרם/מ"ל GM-CSF; מדיום בידול M2: RPMI-1640 + 50 ננוגרם/מ"ל M-CSF. - לאחר זמן הדגירה, שטפו כל בקבוק 1x עם PBS ו-2x עם RPMI-1640 מלא. הוסף 10 מ"ל של מדיום התמיינות לכל בקבוק בהתאם לסוג התא כדי להתמיין.
- תנו לתאים להתמיין במשך 6 ימים בחממה בטמפרטורה של 37 מעלות צלזיוס, 5% CO2. עקב אידוי, יש למלא מדיום בידול ביום 4.
- יום 4 - תוספת
- הוסף 2 מ"ל מכל מדיום התמיינות לבקבוק המתאים. הוסף מדיום ישירות לבקבוק.
- יום 6 - קיטוב מקרופאגים
- הכן מדיית קיטוב M1 ו-M2. עבור מדיית קיטוב M1, הכינו 5 מ"ל של מדיום קיטוב M1 כדי להוסיף לבקבוק המתאים. הריכוזים הסופיים צריכים להיות 50 ננוגרם/מ"ל IFNγ, 10 ננוגרם/מ"ל LPS ו-2.5 ננוגרם/מ"ל GM-CSF ב-RPMI-1640. הבקבוק בסוף יהיה בעל נפח כולל של 15 מ"ל (10 מ"ל כבר ב + 5 מ"ל להוסיף), בצע את החישובים בהתאם.
- עבור מדיית קיטוב M2, הכינו 5 מ"ל של מדיום קיטוב M2 כדי להוסיף לבקבוק המתאים. הריכוזים הסופיים צריכים להיות 20 ננוגרם/מ"ל IL-4 ו-50 ננוגרם/מ"ל M-CSF ב-RPMI-1640. שימו לב שהבקבוק בסוף יהיה בעל נפח כולל של 15 מ"ל (10 מ"ל כבר ב + 5 מ"ל יש להוסיף); בצע את החישובים בהתאם.
- הוסף 5 מ"ל של מדיום קיטוב M1 או M2 לכל בקבוק. תנו למקרופאגים לקוטב לפחות יומיים ולא יותר מ-4 ימים בחממה בטמפרטורה של 37 מעלות צלזיוס, 5% CO2.
- יום 8 - ציטומטריית קציר וזרימה
- לפני קצירת המקרופאגים M1 או M2, אספו את הסופרנטנט לצינורות של 1.5 מ"ל לשימוש נוסף (במידת הצורך). הוסף 1 מ"ל של תמיסת ניתוק תאים לבקבוק והשאיר אותו בחממה בטמפרטורה של 37 מעלות צלזיוס, 5% CO2 למשך 5 דקות.
- כדי לעצור את התגובה, הוסף 3 מ"ל של RPMI-1640 שלם. אוספים מדיה לתוך צינור של 15 מ"ל. הוסף 3 מ"ל של RPMI-1640 שלם לבקבוק והשתמש במגרד תאים כדי לנתק את התאים מתחתית הבקבוק.
- אוספים תאים בצינור של 15 מ"ל. הניחו את הבקבוק מתחת למיקרוסקופ ב-10x וצפו בתאים כדי לוודא שלא יהיו יותר תאים מחוברים לתחתית הבקבוק.
- שוטפים את התאים ב- PBS 2x. השעו אותם מחדש ב-RPMI-1640 מלא וספרו באמצעות המוציטומטר.
- כדי לנתח את האיכות והכמות של מקרופאגים M1/M2, הפעל בדיקת זרימה ציטומטרית. השתמש ב-0.5 x 106 תאים לכל צינור וצבוע באופן הבא: M1: CD80+ CCR7+ CD209- M2: CD206+ CD209+ CD80-. אסטרטגיית שער המשמשת בבדיקה זו: #1 פיזור קדימה (FSC-A) לעומת פיזור צדדי (SSC-A) תרשים נקודה, #2 גובה פיזור קדימה (FSC-H) לעומת שטח פיזור קדימה (FSC-A) תרשים נקודה להבחנה כפולה, #3 פיזור צדדי (SSC-A) לעומת עלילת נקודות DAPI-A להבחנת תאים חיים/מתים, #4 פיזור צדדי (SSC-A) לעומת תרשים נקודה או היסטוגרמה של פרמטר יחיד (כלומר, SSC-A לעומת FITC-A), #5 תרשים נקודות פרמטר כפול (כלומר, FITC-A לעומת APC-A).
3. MMA באמצעות מקרופאגים M1/M2
- לאחר השגת המקרופאגים M1/M2, ספרו אותם באמצעות המוציטומטר ביחס צביעה של 1:1 עם טריפאן כחול. להרכיב מחדש M1/M2 ל-1 x 106 תאים/מ"ל במדיום שלם RPMI-1640.
- זרע 400 מיקרוליטר (400,000 תאים) של תרחיף תאים באמצעות מיקרופיפטה לכל באר של מגלשת התא בת 8 הבארות ודגירה בטמפרטורה של 37 מעלות צלזיוס, 5% CO2 למשך 1.5 שעות לפחות בחממת תרבית רקמות לחה לחלוטין. יש לבצע כל בדיקה באמצעות מינימום בארות משולשות.
- אופסוניזציה של דגימות בדיקה ותאי דם אדומים RhD+ R2R2
- שטפו את RhD+ R2R2 RBCs ב-pH 7.4 PBS 3x על ידי צנטריפוגה ב-350 x גרם למשך 5 דקות בכל פעם. אנו מעדיפים להשתמש ב-R2R2 RhD+ RBCs כבקרה שלנו בשל צפיפות אנטיגן D גבוהה יותר, אך ניתן להחליף כל RBCs של RhD+. בצע את בדיקת דגימת ה-RBC (למשל, מטופל או תורם) RBCs באמצעות נוגדנים מעניינים. השתמש בתרחיף RBC של 5% על ידי הוספת 15 מיקרוליטר של RBCs ארוזים ל-300 מיקרוליטר של תערובת נוגדנים. השתמש ב-R2R2 RBCs עם Anti-D על ידי הוספת 15 מיקרוליטר של RBCs R2R2 ארוזים ל-300 מיקרוליטר של תערובת נוגדנים Anti-D (100 ננוגרם/מ"ל).
- דגירה בטמפרטורה של 37 מעלות צלזיוס, 5% CO2 למשך שעה. בצע בנייה מחדש לסירוגין של RBCs המיושבים בתחתית (למשל, מערבולת כל 15 דקות). שטפו תאי דם אדומים אופסוניים עם pH 7.4 PBS פי 3 על ידי צנטריפוגה ב-350 x גרם למשך 5 דקות בכל פעם.
- כדי לבדוק אם יש אופסוניזציה של RBC, בצע בדיקת אנטיגלובולין עקיפה (IAT). הוסף נוגדן אנטי-אנושי אופסוניסטי משני לנוגדנים האופסוניזציה הראשוניים. ניתן לצפות בהמגלוטינציה או גוש של תאי דם אדומים תוך 30 שניות ולפרש כאופוניזציה מוצלחת13.
- להרכיב מחדש RBCs RhD+ R2R2 שטופים ב-1.25% (v/v) עם מדיום שלם RPMI-1640. הוסף 1,200 μL של בינוני עד 15 μL של RBCs כדי להשיג 1.25% (v/v) לבאר.
- פגוציטוזיס בתיווך קולטן Fc
- לאחר הדגירה של 1.5 שעות של מקרופאגים M1/M2, כדי לאפשר לתאים אלה להיצמד לבארות של מגלשת החדר, שאפו את המדיום הסופרנטנט והשליכו, בטכניקה עדינה, תוך הקפדה על קצה הפיפטה רק בפינת הבארות. יש להדביק את המקרופאגים לבארות. הימנע מלגעת באמצע הבארות עם קצה הפיפטה.
- יש לשטוף בעדינות בארות 1x עם pH 7.4 PBS. הוסף 400 מיקרוליטר מתערובת ה-RBC האופסונית המתאימה של 1.25% (v/v) לכל באר של המשולש. דגירה בטמפרטורה של 37 מעלות צלזיוס, 5% CO2 למשך שעתיים ללא הפרעה.
- לאחר הדגירה הכינו שתי כוסות עם 100 מ"ל pH 7.4 PBS בכל אחת.
- הסר את תאי 8 הבארות באמצעות מתאמי היצרן. טפחו עודפים על מגבת נייר תוך שמירה על לחות השקופיות.
- טבלו את השקופית בכוס עם הסופרנטנטים שהושלכו ושטפו אותה על ידי הזזתה קדימה ואחורה לאט (20-30 פעימות) כדי להסיר את כל ה-RBCs שנותרו שאינם פגוציטוזיים.
- לאחר מכן טבלו את השקופית בכוס השנייה ושטפו לאט במשך 20-30 פעימות נוספות. הסר את השקופית מ-PBS וטפטף את העודפים על מגבת נייר. הימנע מלגעת בחלק הקדמי של התאים. בשלב זה, טבלו את המגלשה במים למשך דקה אחת כדי להסיר כל RBCs דביקים ולא פגוציטוזיים, אך ייתכן שלא יהיה צורך אם תוכלו להבחין בין RBCs פגוציטוזיים לבין RBCs דבקים.
- טבלו את השקופיות ב-100% מתנול למשך 45 שניות כדי לתקן אותן, ולאחר מכן יבשו באוויר. התקן את המגלשה באמצעות אמצעי הרכבה שהוכן בבית והוסף כיסויים (24 x 75 מ"מ). הניחו לו להתייבש למשך הלילה לפני הכמות.
- כימות פגוציטוזיס
- באמצעות מיקרוסקופ ניגודיות פאזה, עדשת אובייקטיבית פי 40 ומונה תאים ידני, מכמתים פגוציטוזיס.
- בעזרת שני מוני תאים ידניים, אחד בכל יד, ספרו RBCs פגוציטוזים עם מונה אחד ואת המספר הכולל של מונוציטים/מקרופאגים עם השני. ספרו 300 מונוציטים/מקרופאגים לבאר.
- חשב את האינדקס הפגוציטי הממוצע (PI) לבדיקה (על פני משולש) על ידי חלוקת מספר ה-RBCs הפגוציטוזיים במספר המונוציטים הכולל שנספרו והכפלה ב-100. בטא את הנתונים כ-PI ממוצע ± שגיאת תקן של הממוצע (SEM).
PI = (RBCs פגוציטוזיים / 300 מקרופאגים) x 100
תוצאות
התוצאות באיור 1 תואמות את הספרות ומצביעות על קיטוב מוצלח של מקרופאגים ממצב M0 למצב M1/M2 הבא שלהם. מקרופאגים M1 ו-M2 תורבבו במשך 8 ימים (6 ימים עם גורמי גדילה ויומיים של קיטוב), ונבדקו RBCs אופסוניים אנטי-D או אנטי-k (איור 2). מקרופאגים M2 מפגינים אינדקס פגוציטי גבוה בהשוואה ל-M1 עם RBCs המאוגדים על ידי אנטי-D (בקרה) או אנטי-k. תוצאה זו עולה בקנה אחד עם בדיקות מקדימות אחרות שבוצעו באמצעות M-MA (ראה טבלה 1). מקרופאגים M2 הם פגוציטים מאוד בהשוואה למקרופאגים או מונוציטים M1, אפילו עם נוגדנים חזקים ל-RBC (איור 2B). טבלה 1 מציגה תוצאות ראשוניות עם 4 נוגדנים שונים של RBC בעלי ספציפיות הנחשבות משמעותיות מבחינה קלינית. נוגדנים המשמשים לאופסוניזציה של תאי דם אדומים חיוביים לאנטיגן ונוספו למונוציטים ב-MMA מציגים פגוציטוזיס חלש (PI < 5). תאי דם אדומים עם אותם נוגדנים שנוספו למקרופאגים M1 מראים גם פגוציטוזיס חלש (PI < 12). תאי דם אדומים עם אותם נוגדנים שנוספו למקרופאגים M2 מראים פגוציטוזיס גבוה ומשמעותי (PI > 12), מה שמדגים את יכולתם של מקרופאגים אלה לחזות טוב יותר את המשמעות הקלינית בהשוואה למונוציטים ו-M1. בהתבסס על התוצאות שנצפו, אנו יכולים להסיק שהשימוש במקרופאגים M2 עשוי לנבא יותר את המשמעות הקלינית של נוגדני RBC ברפואת עירוי. כמו כן, השיטות הנוכחיות באימונולוגיה עשויות למצוא את זה שימושי להסתגל לשיטות המוצגות במאמר זה מכיוון שהן מציעות תוצאות מדויקות יותר ועשויות להיות מתורגמות לרלוונטיות קלינית. עם זאת, נדרשים מחקרים נוספים הבוחנים נוגדנים ל-RBC עם ספציפיות ונתונים קליניים המצביעים על חשיבותם הקלינית או חוסר חשיבותם, תוך השוואה בין ה-MMA ל-M-MA.
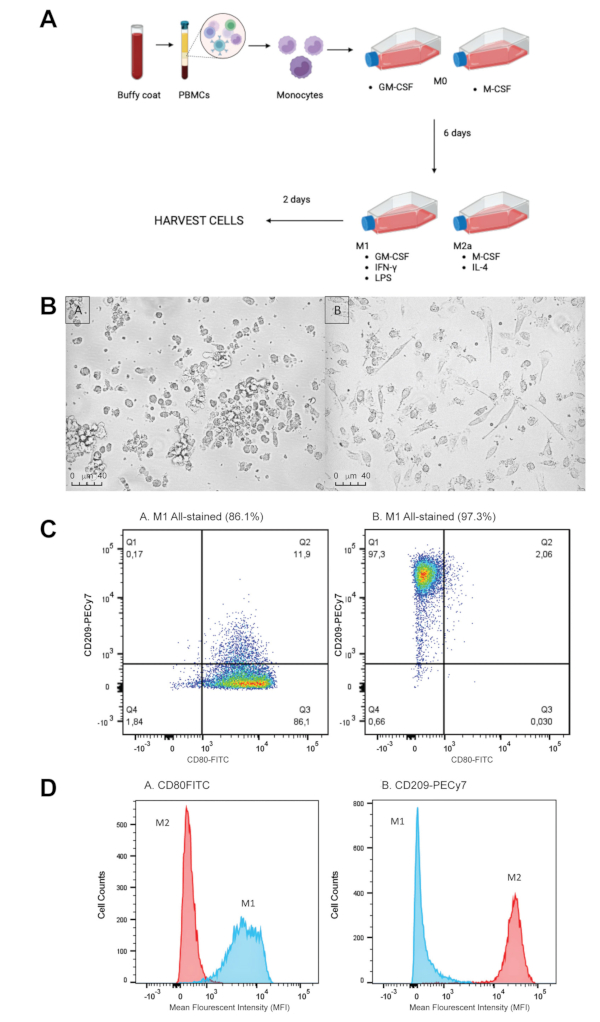
איור 1: קיטוב ואפיון של מקרופאגים M1/M2. (A) מעיל באפי תורם משמש לחילוץ תאים חד-גרעיניים בדם היקפי (PBMCs) באמצעות הפרדת שיפוע צפיפות. לאחר מכן מבודדים מונוציטים CD16+/CD14+ מ-PBMCs ומכניסים אותם לשתי צלוחיות תרבית כדי להבדיל ב-37 מעלות צלזיוס למשך 6 ימים, עם תוספת ביום 4. אמצעי בידול: M1- GM-CSF (2.5 ננוגרם/מ"ל) ו-M2- M-CSF (50 ננוגרם/מ"ל). מדיית קיטוב מתווספת לכל בקבוק מתאים ב-144 שעות, ומקרופאגים נותרים לקיטוב למשך 48 שעות נוספות ב-37 מעלות צלזיוס. מדיית קיטוב: M1 – IFN-gamma (50 ננוגרם/מ"ל), LPS (10 ננוגרם/מ"ל) ו-GM-CSF (2.5 ננוגרם/מ"ל). M2 – IL-4 (20 ננוגרם/מ"ל) ו-M-CSF (50 ננוגרם/מ"ל). לאחר מכן ניתן לקצור תאים ולתייג אותם לאפיון על ידי זרימה ציטומטרית, או להשתמש בהם בבדיקת פגוציטוזיס (איור 2). (B) M1 לעומת M2 מקרופאגים במבחנה. תמונות שצולמו יומיים לאחר הקיטוב. A. M1 מקרופאגים מציגים מורפולוגיה עגולה ומעגלית. למקרופאגים של B. M2 יש מורפולוגיה מובחנת, נמתחת וארוכה, שניהם מעידים על קיטוב מוצלח. (C) ניתוח זרימה ציטומטרי של מקרופאגים M1/M2 המאופיינים ב-CD80(M1) ו-CD209(M2). מקרופאגים M1/M2 תורבבו במשך 8 ימים וסומנו עם CD80-FITC ו-CD209-PECy7 לאפיון באמצעות ציטומטריית זרימה. A. מקרופאגים M1 מציגים כ-86.1% ביטוי של CD80 ו-0.17% ביטוי של CD209. B. מקרופאגים M2 מציגים 97.3% מביטוי CD209 ו-0.003% מביטוי CD80. (D) אות פלואורסצנטי של CD80 ו-CD209 על מקרופאגים M1/M2. מקרופאגים M1/M2 תורבבו במשך 8 ימים וסומנו עם CD80-FITC או CD209-PECy7 לאפיון על ידי ציטומטריית זרימה. A. עוצמת הפלואורסצנט הממוצעת (MFI) של CD80 גבוהה בהרבה ב-M1s, מאשר M2s. ה-MFI של CD209 גבוה בהרבה ב-M2s מאשר ב-M1s. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: בדיקת מונוציטים-מקרופאגים (M-MA). (A) M1/M2s מתורבתים במשך 6 ימים עם גורמי גדילה ולאחר מכן יומיים עם ציטוקינים כדי לקטב אותם. לאחר מכן מכניסים את המקרופאגים M1/M2 למגלשות תא ומודגרים בטמפרטורה של 37 מעלות צלזיוס למשך שעתיים. RBCs עוברים אופסוניזציה באמצעות הנוגדן/סרום לבחירתכם ומודגרים למשך שעה אחת עם ערבוב לסירוגין כל 15 דקות. תאי דם אדומים אופסוניים ממוקמים במגלשות תא עם מקרופאגים מחוברים ומודגרים למשך שעתיים בטמפרטורה של 37 מעלות צלזיוס ללא הפרעה. שקופיות נשטפות ב- PBS; תאים מקובעים באמצעות מתנול ומורכבים עם פלבנול. תאים נספרים באמצעות מיקרוסקופ ניגודיות פאזה ב-40x. האינדקס הפגוציטי (PI) מחושב על ידי ספירת 300 מקרופאגים ו-RBCs פגוציטוזיים מתאימים. (B) M-MA המשווה בין מקרופאגים M1 לעומת M2 עם אנטי-D ואנטי-k. R2R2 מתייחס לדם RhD+. K+k+ מתייחס ל-K+k+ RBCs הטרוזיגוטיים. קווי שגיאה מצביעים על SD ובדיקת t בוצעה עם ערך p < 0.05 שנחשב משמעותי. (C) תאי דם אדומים עם אנטי-k פגוציטוז על ידי M1 לעומת מקרופאגים M2 על ידי M-MA. התמונות צולמו ב-40x באמצעות מיקרוסקופ ניגודיות פאזה. a. מקרופאגים M1 מראים פעילות פגוציטית מועטה עם RBCs עם אנטי-k. b. מקרופאגים M2 מראים פעילות פגוציטית גבוהה עם RBCs עם אנטי-k. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| אינדקס פגוציטי (PI) | ||||
| נוגדן | IAT^ | ומונוציטים* | M1** | מ2*** |
| אנטי פייא | 1-2+ | 3 | 4 | 13 |
| אנטי-ג'יי-קייא | 1+ | 0 | 5 | 41 |
| אנטי S | 1+ | 0 | 2 | 43 |
| אנטי-דיב | 1+ | 0 | 5 | 16 |
| ^בדיקת אנטיגלובולין עקיפה באמצעות אנטי-IgG | ||||
| *בדיקת מונוציטים חד-שכבתיים (MMA) באמצעות מונוציטים; PI>5 נחשב בעל פוטנציאל משמעותי מבחינה קלינית. | ||||
| **בדיקת מונוציטים-מקרופאגים (M-MA) באמצעות מקרופאגים M1; PI>12 נחשב בעל פוטנציאל משמעותי מבחינה קלינית. | ||||
| M-MA באמצעות מקרופאגים M2; PI>12 נחשב בעל פוטנציאל משמעותי מבחינה קלינית. | ||||
טבלה 1. שימוש במקרופאגים M2 עשוי לנבא יותר נוגדנים ל-RBC בעלי פוטנציאל משמעותי קלינית בבדיקת M-MA בהשוואה למונוציטים (MMA).
Discussion
כדי להבטיח את הצלחת השיטה, יש להקפיד על השלבים הקריטיים הבאים: 1) קיטוב M1/M2 מוצלח, 2) יצירת שכבת המקרופאגים ובקרת RhD+ 3) כימות האינדקס הפגוציטי. בעוד שהשיטות שלנו קובעות להשתמש במונוציטים מבודדים לתרבית התאים, ניתן להשתמש ב-PBMCs, אך אנו ממליצים להשתמש במונוציטים מטוהרים. ידוע כי PBMCs מכילים סוגי תאים שונים, כאשר תאים אלה מפרישים מספר ציטוקינים שונים וגורמים מתווכים. זה עשוי להשפיע על ההתמיינות או הקיטוב של המקרופאגים M1/M2; לכן, שימוש במונוציטים מטוהרים יניב תוצאות טובות יותר. כמו כן, חשוב לזכור שכ-10% מהמונוציטים יתקבלו מהכמות המקורית של PBMCs בעת שימוש בערכת הבידוד של מונוציטים STEMCELL. נצפה כי 50 x 106 PBMCs הוא המספר ההתחלתי המינימלי של PBMCs כדי להשיג כ-5 x106 מונוציטים. בעת שטיפת הבקבוק עם מונוציטים דבוקים, הקפידו לשטוף בעדינות בתנועה מסתחררת כדי למנוע ניתוק תאים. בשל האידוי המתרחש בחממה, יש צורך בשלב המדיה הטעינה ביום 4 של התרבות. הימנע מהשלכת מדיה כלשהי והוסף את המדיה לבקבוק, מכיוון שהציטוקינים המופרשים על ידי M1/M2s חשובים להתמיינות. לאחר הקיטוב בן היומיים, ניתן להשתמש במקרופאגים M1/M2 לניסויים או לשמור בתרבית עד 7 ימים. אורך הקיטוב גמיש וניתן לכוונון על סמך התוצאות שנצפו, אך יומיים הם המינימום לקיטוב מוצלח. שלב ציטומטריית הזרימה נדרש רק בעת הגדרת ההליך. לאחר שהבדיקה פועלת כראוי והפעלות חוזרות אפיינו בהצלחה תאי M1/M2, בחר להשמיט שלב זה. התשואה המתקבלת צריכה להיות בסביבות 90% מ-M1 (CD80+ CCR7+ CD209-) ומעל 85% מ-M2 (CD206+ CD209+ CD80-). M1s עשוי להיות חיובי ל-CD209 או CD206; זה נורמלי מכיוון שסמנים אלה באים לידי ביטוי חלש ב-M1s אך עדיין מעידים על קיטוב מוצלח. מקרופאגים M2 תמיד צריכים להיות שליליים עבור CD80.
ב-M-MA, יש להניח בזהירות את שכבת המקרופאגים על מגלשת החדר. ניתן להוריד את מספר הזריעה של M1/M2 בעד 250,000 תאים לבאר במידת הצורך, אך בדרך כלל צריך לנוע בין 400,000-500,000. כמות גבוהה יותר עלולה לגרום לקריאות גושיות ולא מדויקות. היו עדינים בעת שאיפה או הוספת פתרונות לתאים; קצה הפיפט צריך לגעת רק בפינת הבארות, ולהימנע מהתאים המודבקים בצורה חלשה. כדי להימנע מייבוש הבארות, עבדו במשולש טכני בעת הוספת פתרונות והחלפת מדיה. לעולם אל תיגע בחלק הקדמי של השקופית; זה יכול לגרום לאובדן של מקרופאגים או מונוציטים. RBCs RhD+ R2R2 משמשים כבקרה חיובית לפגוציטוזיס בתיווך FcγR כדי להבטיח פעילות. למרות שאנו משתמשים ב-RhD+ R2R2 RBCs לאופסוניזציה עם אנטי-D לשליטה חיובית, ניתן להשתמש בכל RBCs RhD+ 1,2. הקפד להשתמש בריכוז המתאים של נוגדנים בעת ביצוע RBCs בבדיקה זו. כמויות מוגזמות יגרמו להצטברות RBC ולחוסר יכולת לקרוא שקופיות. לבסוף, מומלץ שיותר מצוות מעבדה אחד יספור את השקופיות. כימות ידני באמצעות המיקרוסקופ עשוי להיות מסובך מכיוון שהוא סובייקטיבי, מה שמרמז על שונות גבוהה בין ספירות בין בארות תא שונות וניסויים. עקביות בשדה הראייה בו נספרים התאים וספירת מספר תאים גבוה יותר עשויה לאפשר תוצאות מדויקות יותר.
המגבלות של שיטה זו כוללות את האופי הסובייקטיבי של כימות האינדקס הפגוציטי והשונות בין דם תורם. PBMCs מופקים ממעילי באפי של התורם כדי לבסס את תרבית התאים M1/M2, ונתונים ראשוניים מהמעבדה מראים שונות משמעותית בפעילות הפגוציטית M1 ו-M2 בהתאם לתורם. אותו נוגדן עשוי לייצר אינדקס פגוציטי גבוה יותר עם תאי M2 מתורם אחד בהשוואה לאלה מתורם אחר. כדי להפחית את השונות ולשמור על עקביות, יצירת משאב תורם מאוחד תהיה מועילה, וזה חל גם על RBCs המשמשים ב-MMA. למרות שמירה על שיטה עקבית, תמיד תהיה שונות קלה בין דם תורם RBC/PBMC.
ביקורת מרכזית הן על ה-MMA והן על ה-M-MA היא הסובייקטיביות המובנית בספירת מונוציטים או מקרופאגים ותאי הדם האדומים המתאימים להם (RBCs). למרות הפרוטוקולים שנקבעו, שונות בטכניקות ספירה בודדות תחת המיקרוסקופ היא בלתי נמנעת. כדי לטפל בכך, יהיה זה מועיל לאנשי המעבדה לבסס גישת כימות סטנדרטית - כגון הגדרת נקודת התחלה עקבית בשדה הראייה או הגדלת גודל המדגם לספירה. יישום אמצעים כאלה ישפר את העקביות והדיוק של ספירת התאים, ובסופו של דבר יוביל לתוצאות ומסקנות אמינות יותר.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכת וממומנת על ידי המרכז הקנדי לשירותי דם לחדשנות בטורונטו, אונטריו. המחקר מבוצע במרכז המחקר קינן למדעים ביו-רפואיים בבית החולים סנט מייקלס בטורונטו, אונטריו.
Materials
| Name | Company | Catalog Number | Comments |
| 1X PBS, pH 7.4, without Ca2+/Mg2+ | Wisent Bioproducts | 311-425-CL | Store at 4 degrees or room temperauture |
| AccutaseTM | STEMCELL Technologies | 7920 | Cell detachment solution |
| ACK Lysis Buffer | STEMCELL Technologies | 07850, 07800 | Store at 4 degrees |
| Anti-Human Globulin | NOVACLONE, Immunocor. | N/A | NOVACLONE Anti-igG for IAT testing |
| Anti-Rh(D) (WinRho. SDF CDN) | Saol Therapeutics | 1003092 | Any commerical source of Rh immune globin will suffice |
| Cell Scraper | UofT Medstore | 83.395 | cell detachement |
| Cell Strainer 70uM nylon | Falcon | 352350 | filter of cells |
| Chamber slide Nunc. Lab-TekTM II with Cover, RS Glass Slide Sterile | Thermo Fisher Scientific | 154534 | chamber slides for MMA |
| Coverslips | VWR | 48393-081 | 24 x 50 mm |
| Cytiva Ficoll Paque Plus, density 1.077 g/L | Thermo Fisher Scientific | 17-1440-03 | sepeation of PBMCS from whole blood; density gradient medium |
| Elvanol Mounting Medium | N/A | N/A | Dulbecco’s PBS (D-PBS) without Ca2+/Mg2+, 15% (w/v) polyvinyl resin, and 30% (v/v) glycerine. |
| Fresh whole blood (ACD tube) or Buffy coat | Canadian Blood Services | May rest at room tempruatre for up to 36 hours | |
| Human Recombinant GM-CSF | STEMCELL Technologies | 78015.1 | Cytokine for polarization of M1 macrophages |
| Human Recombinant IFN-gamma | STEMCELL Technologies | 78020 | Cytokine for polarization of M1 macrophages |
| Human Recombinant IL-4 | STEMCELL Technologies | 78045.1 | Cytokine for polarization of M2 macrophages |
| Human Recombinant M-CSF | STEMCELL Technologies | 78057.1 | Cytokine for polarization of M2 macrophages |
| ID-CellStab | Bio-Rad | 005650 05740 | RBC cell storage/stabilization solution |
| Isolation Medium | N/A | N/A | PBS Ca2+ and Mg2+ free + FBS 2% + 1mM EDTA |
| Lipopolysaaracide (LPS) | Sigma Aldrich | L3024-5MG | Cytokine for polarization of M1 macrophages |
| Methanol (100%) | N/A | N/A | Fixing of slides |
| Monocyte Isolation Kit STEM-cells EasySep Human Monocyte Enrichment Kit without CD16 Depletion | STEMCELL Technologies | 19058 | Isolation of monocytes from PBMCs |
| Poly-D-ysine | UofT Medstore | P6407 | Cell attachment solution |
| Rh(D) positive R2R2 RBCs | Canadian Blood Services | N/A | Also commerically avaiable |
| RPMI-1640 | Wisent Bioproducts | 350-000-CL | supplemented with 10% heat-inactivated FBS,1 mM GlutaMAX supplement, 1 mM HEPES, and 1%penicillin/streptomycin. Store at 4 degrees. |
| Trypan Blue solution | Thermo Fisher Scientific | 15250061 | Cell counting solution |
References
- Tong, T. N., Branch, D. R. Use of a monocyte monolayer assay to evaluate Fcγ receptor-mediated phagocytosis. J Vis Exp. (119), e55039 (2017).
- Tong, T. N., Cen, S., Branch, D. R. The monocyte monolayer assay: Past, present and future. Transfus Med Rev. 33 (1), 24-28 (2019).
- Frias Boligan, K., Sandhu, G., Branch, D. R. Methods to evaluate the potential clinical significance of antibodies to red blood cells. Curr Protoc. 2 (8), e504 (2022).
- Lemay, A. S., et al. The first case of severe acute hemolytic transfusion reaction caused by anti-Sc2. Transfusion. 58 (11), 2506-2512 (2018).
- Tong, T. N., et al. The utility of a monocyte monolayer assay in the assessment of intravenous immunoglobulin-associated hemolysis. Transfusion. 60 (12), 3010-3018 (2020).
- Srivastava, K., et al. SCAR: the high-prevalence antigen 013.008 in the Scianna blood group system. Transfusion. 61 (1), 246-254 (2021).
- Branch, D. R., et al. Potentially clinically significant anti-Dib identified by monocyte monolayer assay before transfusion. Transfusion. 61 (1), 331-332 (2021).
- Italiani, P., Boraschi, D. From monocytes to M1/M2 macrophages: Phenotypical vs. functional differentiation. Front Immunol. 5, 514 (2014).
- Mills, C. M1 and M2 macrophages: Oracles of health and disease. Crit Rev Immunol. 32 (6), 463-488 (2012).
- Atri, C., Guerfali, F. Z., Laouini, D. Role of human macrophage polarization in inflammation during infectious diseases. Int J Mol Sci. 19 (6), 1801 (2018).
- Bertani, F. R., et al. Classification of M1/M2-polarized human macrophages by label-free hyperspectral reflectance confocal microscopy and multivariate analysis. Sci Rep. 7, 8965 (2017).
- Murray, J. Macrophage polarization. Annu Rev Physiol. 79, 541-566 (2017).
- Cohn, C., Delaney, M., Johnson, S. T., Katz, L. M., Schwartz, J. . Technical Manual. , (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved