Method Article
Vorhersage der Bedeutung von Antikörpern roter Blutkörperchen mit dem Monozyten-Makrophagen-Assay
In diesem Artikel
Zusammenfassung
Wir haben Verbesserungen und aktualisierte Methoden für den bestehenden Monozyten-Monolayer-Assay (MMA) entwickelt, bei dem Makrophagen verwendet werden, um die klinische Relevanz von Erythrozyten-Alloantikörpern in der Transfusionsmedizin und Immunologie besser vorhersagen zu können. Dieser Assay wird als Monozyten-Makrophagen-Assay (M-MA) bezeichnet.
Zusammenfassung
Makrophagen, die aus Monozyten im Knochenmark gewonnen werden, sind große, angeborene Immunzellen, die eine wichtige Rolle bei der Beseitigung von abgestorbenen Zellen, Ablagerungen, Tumorzellen und fremden Krankheitserregern spielen. Die phagozytische Kapazität von Monozyten im Vergleich zu Makrophagen ist ein Konzept, das nicht gut verstanden wird. In dieser Arbeit wollen wir einen Unterschied in der Phagozytose von Monozyten und Makrophagen, insbesondere M1/M2-Makrophagen, gegen verschiedene opsonisierte Erythrozyten mit einer modifizierten und aktualisierten Version des etablierten Monozyten-Monolayer-Assays (MMA) untersuchen. Mononukleäre Zellen des peripheren Blutes (PBMCs) wurden aus Buffy-Coats von Spendern isoliert. Unter Verwendung gereinigter Monozyten wurden inflammatorische M1- und entzündungshemmende M2-Makrophagen durch in vitro Kultur und Polarisation hergestellt. M1/M2-Zellen wurden geerntet und in einem MMA-ähnlichen Assay, den wir als M-MA bezeichnen, verwendet, um die klinisch signifikante Phagozytose verschiedener Erythrozyten-Antikörper zu entschlüsseln. Ein phagozytärer Index (PI) > 5 wurde unter Verwendung von Monozyten als klinisch signifikante Phagozytose eingestuft. Ein phagozytärer Index (PI) > 12 wurde unter Verwendung von M1/M2-Makrophagen als klinisch signifikante Phagozytose eingestuft. M2-Makrophagen zeigen im Vergleich zu Monozyten und M1s eine erhöhte Fähigkeit, opsonisierte Erythrozyten zu phagozytieren. Derselbe schwache Antikörper (Anti-S) führt zu einer signifikanten Phagozytose mit nur M2-Makrophagen (PI=43), nicht aber mit M1s (PI=2) oder Monozyten (PI=0), und dies wurde wiederholt mit verschiedenen Antikörpern nachgewiesen. Die Verwendung von M2-Makrophagen anstelle von Monozyten kann genauere Ergebnisse ermöglichen, da diese Zellen phagozytärer sind, was dem Assay eine weitere klinische Relevanz verleiht. Weitere Studien mit verschiedenen Antikörpern gegen rote Blutkörperchen, einschließlich der Validierung des Monozyten-Makrophagen-Assays (M-MA) mit Antikörpern mit bekannter klinischer Bedeutung, könnten zeigen, dass der M-MA nützlicher ist, um klinisch signifikante Alloantikörper und Transfusionsreaktionen der roten Blutkörperchen vorherzusagen. Diese Methode wird das Gebiet der Transfusionsmedizin und Immunologie voranbringen.
Einleitung
Die Vorhersage von Transfusionsreaktionen stellt nach wie vor eine große Herausforderung im Bereich der Transfusionsmedizin dar. In den letzten 4 Jahrzehnten hat der Monozyten-Monolayer-Assay (MMA), der von Tong und Branch 1,2 entwickelt wurde, als wertvoller zellulärer In-vitro-Assay zur Vorhersage des klinischen Ergebnisses der Hämolyse bei Bluttransfusionspatienten gedient1. In der Tat hat dieser Assay maßgeblich dazu beigetragen, zwischen klinisch signifikanten und unbedeutenden Antikörpern gegen rote Blutkörperchen (RBC) zu unterscheiden2. Während Monozyten traditionell die Standard-Leukozyten sind, die in diesem Assay verwendet werden, zielt unsere Forschung darauf ab, die potenziellen Vorteile der Verwendung von Monozyten-abgeleiteten Makrophagen als Alternative zu untersuchen. Diese Zellen können die Fähigkeit der Assays verbessern, die klinische Relevanz von Erythrozyten-Alloantikörpern zu beurteilen.
In der historischen MMA werden Monozyten, die die Vorläufer von Makrophagen sind, den Immunzellen, die für die Beseitigung und Zerstörung der roten Blutkörperchen während einer unerwünschten Transfusionsreaktion verantwortlich sind, in einem In-vitro-Assay zusammen mit Erythrozyten und Antikörperneingeführt 1,2,3,4,5,6,7 . Die Phagozytose wird dann visuell beurteilt, indem phagozytierte Erythrozyten innerhalb der Monozyten gezählt werden. Ein phagozytärer Index (PI) von < 5 phagozytierten Erythrozyten pro 100 gezählten Monozyten deutet darauf hin, dass der Patient ein verringertes Risiko für eine unerwünschte Transfusionsreaktion hat, und der Antikörper wird als klinisch unbedeutend eingestuft 4,5,6,7. Vorläufige Experimente zeigen, dass die Verwendung von Monozyten aus peripherem Blut möglicherweise nicht ideal für die Bestimmung der klinischen Signifikanz ist, da sie eine geringere phagozytische Kapazität haben als aktivierte Monozyten und bestimmte Makrophagen.
Monozyten sind eine Untergruppe von Zellen, die im Blut, in der Milz und im Knochenmark vorkommen und 10 % der gesamten Leukozyten beim Menschen ausmachen8. Diese Zellen zirkulieren in der Regel 1-2 Tage, bevor sie von verschiedenen Geweben rekrutiert werden, wo sie sich zu Makrophagen differenzieren8. Dies geschieht typischerweise während der Hämatopoese, bei der das Knochenmark Monozyten produziert, die in den Kreislauf freigesetzt werden, um zu Gewebemakrophagen zu werden, die sich in der Milz und der Leber befinden2. Makrophagen, die als erste Verteidigungslinie gegen fremde Krankheitserreger bekannt sind, sind große phagozytäre mononukleäre Zellen, die eine Rolle bei der adaptiven und angeborenen Immunität spielen9. Unter den komplizierten und komplexen Rollen des Immunsystems stellt das Verständnis und die Charakterisierung von Makrophagen-Phänotypen eine gewaltige Herausforderung dar, die noch nicht vollständig verstanden wurde. In den letzten zwei Jahrzehnten hat der Begriff der Makrophagenpolarisation zunehmend Anerkennung gefunden, wobei neuere Studien die Verwendung von Einzelzell-RNA-Sequenzierung verwenden, um das Spektrum zu erkennen, in dem diese Makrophagen vorkommen.
Klassisch aktivierte M1- und M1-ähnliche Makrophagen entstehen in entzündlichen Umgebungen, die von Toll-like-Rezeptoren (TLRs) dominiert werden10. Diese Zellen können an Autoimmunerkrankungen und Arteriosklerose beteiligt sein und weisen Oberflächenmarker wie MHC-II, CD80 und CD86auf 11,12. Entzündungshemmende M2- und M2-ähnliche Makrophagen finden sich in Umgebungen, die von Th2-Reaktionen dominiert werden, keine Expression von CD80 aufweisen und Oberflächenmarker wie CD209 und CD206aufweisen 11,12. M1/M2-Makrophagen können in vitro aus mononukleären Zellen des peripheren Blutes kultiviert werden, wobei Lipopolysaccharid (LPS) und Zytokine wie GM-CSF und IFNγ (M1) sowie M-CSF und IL-4 (M2) ihre Polarisation stimulieren10,12.
Dieses Manuskript und die damit verbundenen Studien sollen zeigen, dass M2-Makrophagen im Vergleich zu M1-Makrophagen und Monozyten eine erhöhte Sensitivität für Phagozytose aufweisen. Die Untersuchung der phagozytären Aktivität von M1/M2-Makrophagen im Vergleich zu Monozyten im Zusammenhang mit Erythrozyten-Alloantikörpern und der Transfusionsmedizin ist ein Bereich, der noch erforscht werden muss. Hier beschreiben wir die laufenden Arbeiten zur Generierung von M1/M2-Makrophagen und vergleichen den klassischen Monozyten-Monolayer-Assay (MMA) mit dem neuartigen Monozyten-Makrophagen-Assay, wobei das Akronym M-MA verwendet wird, um diesen Makrophagen-Assay vom Monozyten-Assay zu unterscheiden und die Vorhersagekraft von in vitro Phagozytose-Assays zu verbessern.
Protokoll
Diese Forschung wurde in Übereinstimmung mit den institutionellen Richtlinien für die Durchführung ethischer Forschung am Menschen durchgeführt. Die Ethikgenehmigung wurde vom Canadian Blood Services Research Ethics Board (REB) erteilt, Genehmigung CBSREB#2023.008. Alle Schritte dieses Protokolls sind in einer Biosicherheitswerkbank unter sterilen Bedingungen durchzuführen.
1. Isolierung von PBMCs
- Entnehmen Sie menschliches Vollblut von einem Spender in einem ACD-Röhrchen. Lagern Sie das Blut bei Raumtemperatur (18 °C–22 °C) bis zu 36 h.
- Übertragen Sie die Vollblut-ACD-Röhrchen in 50-ml-Zentrifugenröhrchen (ein einzelnes 50-ml-Röhrchen für jeweils zwei ACD-Röhrchen). Geben Sie RPMI-1640 vollständiges Medium bei Raumtemperatur zu einem Endvolumen von 35 mL.
- Geben Sie 15 ml Dichtegradientenmedium bei Raumtemperatur in ein neues 50-ml-Röhrchen. Schichten Sie das verdünnte Vollblut vorsichtig auf das Dichtegradientenmedium, um die Vermischung an der Grenzfläche für eine optimale Trennung des Blutes zu minimieren.
- Das Schichtgemisch bei 700 x g für 30 min bei ausgeschalteten Bremsen zentrifugieren. Die Dichtegradientenzentrifugation trennt das Gemisch von oben nach unten in die folgenden Schichten: Plasma, Buffy-Mantel (mit PBMCs), Dichtegradientenmaterial, Granulozyten und rote Blutkörperchen.
- Saugen Sie den größten Teil der obersten Schicht (Plasma) an und entsorgen Sie sie. Entnehmen Sie mit einer Transferpipette vorsichtig die Buffy Coat (PBMCs)-Schicht und vermeiden Sie das Mitbringen von zusätzlichem Material. Übertragen Sie die entnommenen PBMCs in ein neues 50-ml-Röhrchen.
- Waschen Sie die isolierte Buffy-Coat-Schicht 1x mit pH 7,4 PBS-Lösung für 10 min bei 350 x g bei voller Bremse EIN.
- Verwenden Sie ein 70-μM-Zellsieb, um Ablagerungen oder unerwünschtes Material aus den PBMCs zu entfernen, bevor Sie sie in ein konisches 15-ml-Röhrchen übertragen. 2x mit pH 7,4 PBS-Lösung für 10 min bei 350 x g waschen, bei voller Bremse EIN.
- Optional: Lysieren Sie alle mit ACK-Lysepuffer übertragenen Erythrozyten. Je nach Pelletgröße 5-10 ml ACK-Lysepuffer zugeben und bis zu 3 Minuten bei Raumtemperatur inkubieren. Nach der Inkubation mit pH 7,4 PBS auffüllen und 10 min bei 350 x g bei vollen Bremsen zentrifugieren und 1x waschen. Führen Sie diesen Schritt aus, wenn die Anzahl der RBCs zu hoch ist.
HINWEIS: Es ist immer besser, die Verwendung von ACK zu vermeiden, um bessere Ergebnisse zu erzielen. Alternativ kann Wasser verwendet werden, um nicht phagozytierte Erythrozyten zu eliminieren, indem es nicht länger als 15 Sekunden mit Wasser inkubiert und dann sofort 1X PBS zum Waschen hinzufügt. - Rekonstituieren Sie das PBMC-Pellet in 2-3 mL (verwenden Sie 0,5 mL pro anfänglichem ACD-Röhrchen) des RPMI-1640 Komplettmediums. Zählen Sie PBMCs mit einem Hämozytometer, nachdem Sie eine 1:1-Mischung mit Trypanblau hergestellt haben. Zählt nur Zellen, die nicht mit Trypanblau gefärbt sind. Rekonstituieren Sie PBMCs zu 2 x 106 Zellen/ml in RPMI-1640 vollständigem Medium.
2. Kultur von M1/M2-Makrophagen
- Tag 0 Aussaat von Monozyten
- Bereiten Sie für jede Makrophagenpopulation einen 25-ml-Zellkulturkolben vor. Fügen Sie jeweils 5 ml Poly-D-Lysin (50 mg/500 ml) hinzu und lassen Sie es mindestens 1 h in der Haube. Spülen Sie den Kolben mit PBS, um das restliche Poly-D-Lysin zu entfernen.
- Isolieren Sie PBMCs wie gewohnt aus Buffy-Mantel- oder Patientenproben (siehe Schritt 1). Nachdem ein Pellet aus PBMCs erzeugt wurde, resuspendieren Sie es in 10 mL vorgewärmtem RPMI-1640 Komplettmedium.
- Bestimmen Sie die Zellzahl und beginnen Sie mit der Monozytenisolierung mit dem Monozyten-Isolationskit. Verwenden Sie zum Ausführen des Kits mindestens 50 x 106 Zellen.
- Resuspendieren Sie die Zellen bei 50 x 106 Zellen/ml in einem Isolationsmedium. Verwenden Sie je nach erhaltener Zellzahl den violetten (0,25-2 ml) oder grauen (0,5-8,5 ml) Magneten, der im Monozyten-Isolationskit empfohlen wird.
- Befolgen Sie die Anweisungen des Kits und geben Sie die Probe in das erforderliche Propylenröhrchen (5 mL oder 14 mL). Geben Sie der Probe einen Anreicherungscocktail mit 50 μl/ml der Probe.
- Pipettieren Sie auf und ab oder wirbeln Sie die Probe auf, um sie zu mischen, und inkubieren Sie sie dann 10 Minuten lang bei 2-8 °C in einem Eiskübel. Währenddessen wirbeln magnetische Partikel 30 s lang vortexen. Nach der Inkubation fügen Sie der Probe magnetische Partikel hinzu: 100 μl/ml der Probe.
- Pipettieren Sie die Probe auf und ab oder wirbeln Sie sie und inkubieren Sie sie dann 5 Minuten lang bei 2-8 °C. Füllen Sie mit Isolationsmedium auf 2,5 mL oder 10 mL auf, entsprechend mit einer abgestuften Pipette. Pipettieren Sie 2x-3x auf und ab, um zu mischen.
- Setzen Sie das Röhrchen (ohne Deckel) in den Magneten ein und inkubieren Sie es bei Raumtemperatur für 2,5 min. Nehmen Sie den Magneten auf und drehen Sie den Magneten und das Röhrchen in einer kontinuierlichen Bewegung um, indem Sie die Zellsuspension in ein neues Röhrchen mit 5 mL oder 14 mL gießen.
- Resuspendieren Sie die Zellen im RPMI-1640-Medium und zählen Sie sie. Führen Sie diesen Schritt so schnell wie möglich aus. Zwischen 1 x 106 – 5 x 106 Monozyten in jeden 25-ml-Kolben aussäen, der zuvor mit Poly-D-Lysin vorbeschichtet war. Bringen Sie das Volumen bei Bedarf mit dem RPMI-1640 auf 5 ml.
- Bei 37 °C, 5 % CO2, mindestens 2 h inkubieren. Bereiten Sie in der Zwischenzeit M1- und M2-Differenzierungsmedien vor. Bereiten Sie genug für Tag 0 (10 ml) und Tag 4 (2 ml) Nachfüllung vor.
HINWEIS: M1-Differenzierungsmedium: RPMI-1640 + 2,5 ng/mL GM-CSF; M2-Differenzierungsmedium: RPMI-1640 + 50 ng/mL M-CSF. - Nach der Inkubationszeit jeden Kolben 1x mit PBS und 2x mit komplettem RPMI-1640 waschen. Geben Sie 10 ml Differenzierungsmedium in jeden Kolben entsprechend dem zu differenzierenden Zelltyp.
- Lassen Sie die Zellen 6 Tage lang im Inkubator bei 37 °C, 5 % CO2 differenzieren. Aufgrund der Verdunstung an Tag 4 mit Differenzierungsmedium auffüllen.
- Tag 4 - Aufladen
- Von jedem Differenzierungsmedium werden 2 ml in den jeweiligen Kolben gegeben. Medium direkt in den Kolben geben.
- Tag 6 - Polarisation der Makrophagen
- Bereiten Sie die Polarisationsmedien M1 und M2 vor. Für M1-Polarisationsmedien sind 5 ml M1-Polarisationsmedium für die Zugabe in den entsprechenden Kolben vorzubereiten. Die endgültigen Konzentrationen sollten 50 ng/ml IFNγ, 10 ng/ml LPS und 2,5 ng/ml GM-CSF in RPMI-1640 betragen. Der Kolben am Ende hat ein Gesamtvolumen von 15 mL (10 mL bereits in + 5 mL müssen hinzugefügt werden), führen Sie die Berechnungen entsprechend durch.
- Für M2-Polarisationsmedien sind 5 ml M2-Polarisationsmedium für die Zugabe in den entsprechenden Kolben vorzubereiten. Die Endkonzentrationen sollten 20 ng/mL IL-4 und 50 ng/mL M-CSF in RPMI-1640 betragen. Es ist zu beachten, dass der Kolben am Ende ein Gesamtvolumen von 15 mL hat (10 mL bereits in + 5 mL müssen hinzugefügt werden); Führen Sie die Berechnungen entsprechend durch.
- 5 ml M1- oder M2-Polarisationsmedium werden in jeden Kolben gegeben. Lassen Sie die Makrophagen mindestens 2 Tage und nicht länger als 4 Tage im Inkubator bei 37 °C, 5 % CO2 polarisieren.
- Tag 8 - Ernte und Durchflusszytometrie
- Sammeln Sie vor der Entnahme der M1- oder M2-Makrophagen den Überstand in 1,5-ml-Röhrchen zur weiteren Verwendung (falls erforderlich). 1 ml Zellablösungslösung in den Kolben geben und 5 Minuten lang bei 37 °C, 5 % CO2 im Inkubator belassen.
- Um die Reaktion zu stoppen, fügen Sie 3 ml vollständiges RPMI-1640 hinzu. Sammeln Sie das Medium in einem 15-ml-Röhrchen. Geben Sie 3 ml des vollständigen RPMI-1640 in den Kolben und lösen Sie die Zellen mit einem Zellschaber vom Boden des Kolbens.
- Sammeln Sie die Zellen in einem 15-ml-Röhrchen. Legen Sie den Kolben bei 10x unter das Mikroskop und beobachten Sie die Zellen, um sicherzustellen, dass keine weiteren Zellen am Boden des Kolbens haften.
- Waschen Sie die Zellen in PBS 2x. Resuspendieren Sie sie in vollständigem RPMI-1640 und zählen Sie mit dem Hämozytometer.
- Um die Qualität und Quantität von M1/M2-Makrophagen zu analysieren, führen Sie einen Durchflusszytometrie-Assay durch. Verwenden Sie 0,5 x 106 Zellen pro Röhrchen und färben Sie wie folgt: M1: CD80+ CCR7+ CD209- M2: CD206+ CD209+ CD80-. Gating-Strategie, die in diesem Assay verwendet wird: #1 Forward Scatter (FSC-A) vs. Side Scatter (SSC-A) Dot Plot, #2 Forward Scatter Height (FSC-H) vs. Forward Scatter Area (FSC-A) Dot Plot für Dublett-Diskriminierung, #3 Side Scatter (SSC-A) vs. DAPI-A Dot Plot für Lebend-/Totzellen-Diskrepanz, #4 Side Scatter (SSC-A) vs. Einzelparameter-Dotplot oder Histogramm (d. h. SSC-A vs. FITC-A), #5 Double Parameter Dot Plot (d. h. FITC-A vs. APC-A).
3. MMA mit M1/M2-Makrophagen
- Nachdem Sie die M1/M2-Makrophagen erhalten haben, zählen Sie sie mit einem Hämozytometer in einem Färbeverhältnis von 1:1 mit Trypanblau. Rekonstituieren Sie M1/M2 zu 1 x 106 Zellen/ml in RPMI-1640 vollständigem Medium.
- 400 μl (400.000 Zellen) Zellsuspension mit einer Mikropipette in jede Vertiefung des 8-Well-Kammerobjektträgers säen und mindestens 1,5 h lang in einem vollständig befeuchteten Gewebekultur-Inkubator bei 37 °C, 5 % CO2 inkubieren. Jeder Test sollte mit mindestens dreifachen Vertiefungen durchgeführt werden.
- Opsonisierung von Testproben und RhD+ R2R2 roten Blutkörperchen
- RhD+ R2R2 Erythrozyten werden 3x bei einem pH-Wert von 7,4 PBS gewaschen, indem sie jeweils 5 Minuten lang bei 350 x g zentrifugieren. Wir bevorzugen die Verwendung von R2R2 RhD+ Erythrozyten als Kontrolle, da sie eine höhere D-Antigendichte aufweisen, aber alle RhD+ Erythrozyten können substituiert werden. Opsonisieren Sie die Erythrozyten der Test-Erythrozytenprobe (z. B. Patient oder Spender) mit Antikörpern von Interesse. Verwenden Sie eine 5%ige Erythrozytensuspension, indem Sie 15 μl gepackte Erythrozyten zu 300 μl Antikörpermischung hinzufügen. Opsonisieren Sie die R2R2-Erythrozyten mit Anti-D, indem Sie 15 μl gepackte R2R2-Erythrozyten zu 300 μl Anti-D-Antikörpermischung (100 ng/ml) hinzufügen.
- Inkubieren bei 37 °C, 5 % CO2 für 1 h. Führen Sie eine intermittierende Rekonstitution der am Boden abgesetzten Erythrozyten durch (z. B. Wirbel alle 15 Minuten). Opsonisierte Erythrozyten mit einem pH-Wert von 7,4 PBS 3x durch Zentrifugation bei 350 x g für jeweils 5 min waschen.
- Um die Erythrozyten-Opsonisierung zu überprüfen, führen Sie einen indirekten Antiglobulintest (IAT) durch. Fügen Sie dem primären opsonisierenden Antikörper einen sekundären opsonisierenden Anti-Human-Antikörper hinzu. Eine Hämagglutination bzw. Verklumpung von Erythrozyten kann innerhalb von 30 s beobachtet und als erfolgreiche Opsonisierung interpretiertwerden 13.
- Rekonstituieren von gewaschenen, opsonisierten RhD+ R2R2-Erythrozyten in 1,25 % (v/v) mit RPMI-1640 vollständigem Medium. Fügen Sie 1.200 μl Medium bis 15 μl Erythrozyten hinzu, um 1,25 % (v/v) pro Vertiefung zu erreichen.
- Fc-Rezeptor-vermittelte Phagozytose
- Nach der 1,5-stündigen Inkubation der M1/M2-Makrophagen wird das überstehende Medium abgesaugt und nach einer schonenden Technik verworfen, damit diese Zellen an den Vertiefungen des Kammerobjektträgers haften können, wobei darauf zu achten ist, dass die Pipettenspitze nur die Ecke der Vertiefungen berührt. Die Makrophagen sollten an die Vertiefungen geklebt werden. Vermeiden Sie es, die Mitte der Vertiefungen mit der Pipettenspitze zu berühren.
- Waschen Sie die Vertiefungen 1x schonend mit einem pH-Wert von 7,4 PBS. Geben Sie 400 μl des entsprechenden 1,25 % (v/v) opsonisierten Erythrozytengemisches in jede Vertiefung des Triplikats. Bei 37 °C, 5 % CO2 2 ungestört 2 h inkubieren.
- Nach der Inkubation werden zwei Becher mit je 100 ml pH 7,4 PBS vorbereitet.
- Entfernen Sie die 8-Well-Kammern mit den Adaptern des Herstellers. Tupfen Sie den Überschuss auf einem Papiertuch ab und halten Sie die Objektträger feucht.
- Tauchen Sie den Objektträger mit den weggeworfenen Überständen in das Becherglas und waschen Sie ihn, indem Sie ihn langsam hin und her bewegen (20-30 Hübe), um alle verbleibenden nicht phagozytierten Erythrozyten zu entfernen.
- Tauchen Sie dann den Objektträger in den zweiten Becher und waschen Sie ihn langsam für weitere 20-30 Züge. Entfernen Sie den Objektträger von PBS und tupfen Sie den Überschuss auf einem Papiertuch ab. Vermeiden Sie es, die Vorderseite der Kammern zu berühren. Tauchen Sie den Objektträger zu diesem Zeitpunkt 1 Minute lang in Wasser, um alle anhaftenden, nicht phagozytierten Erythrozyten zu entfernen, aber es ist möglicherweise nicht notwendig, wenn Sie phagozytierte von adhärenten Erythrozyten unterscheiden können. An der Luft trocknen.
- Tauchen Sie die Objektträger 45 s lang in 100% Methanol, um sie zu fixieren, und trocknen Sie sie dann an der Luft. Montieren Sie das Objektträger mit einem eigens vorbereiteten Montagemedium und fügen Sie Deckgläser (24 x 75 mm) hinzu. Lassen Sie es über Nacht trocknen, bevor Sie es quantifizieren.
- Quantifizierung der Phagozytose
- Mit einem Phasenkontrastmikroskop, einem 40-fach-Objektiv und einem manuellen Zellzähler können Sie die Phagozytose quantifizieren.
- Mit Hilfe von zwei manuellen Zellzählern, einer in jeder Hand, zählen Sie mit einem Zähler phagozytierte Erythrozyten und mit dem anderen die Gesamtzahl der Monozyten/Makrophagen. Zählen Sie 300 Monozyten/Makrophagen pro Well.
- Berechnen Sie den durchschnittlichen phagozytären Index (PI) pro Test (über Triplikate), indem Sie die Anzahl der phagozytierten Erythrozyten durch die Anzahl der insgesamt gezählten Monozyten dividieren und mit 100 multiplizieren. Drücken Sie die Daten als durchschnittlichen PI ± Standardfehler des Mittelwerts (SEM) aus.
PI = (phagozytierte Erythrozyten / 300 Makrophagen) x 100
Ergebnisse
Die Ergebnisse in Abbildung 1 stimmen mit der Literatur überein und deuten auf eine erfolgreiche Polarisation der Makrophagen von ihrem M0-Zustand in ihren nachfolgenden M1/M2-Zustand hin. M1- und M2-Makrophagen wurden 8 Tage lang kultiviert (6 Tage mit Wachstumsfaktoren und 2 Tage Polarisation), und es wurden anti-D- oder anti-k-opsonisierte Erythrozyten getestet (Abbildung 2). M2-Makrophagen weisen einen hohen phagozytären Index im Vergleich zu M1-Makrophagen auf, deren Erythrozyten entweder durch Anti-D (Kontrolle) oder Anti-K opsonisiert werden. Dieses Ergebnis stimmt mit anderen Vorversuchen überein, die mit M-MA durchgeführt wurden (siehe Tabelle 1). M2-Makrophagen sind im Vergleich zu M1-Makrophagen oder Monozyten stark phagozytisch, selbst bei starken Erythrozyten-Antikörpern (Abbildung 2B). Tabelle 1 zeigt vorläufige Ergebnisse mit 4 verschiedenen Erythrozyten-Alloantikörpern mit Spezifitäten, die als klinisch signifikant gelten. Antikörper, die zur Opsonisierung antigenpositiver Erythrozyten verwendet und zu Monozyten im MMA hinzugefügt werden, weisen eine schwache Phagozytose auf (PI < 5). Erythrozyten, die mit denselben Antikörpern opsonisiert wurden, die M1-Makrophagen zugesetzt wurden, zeigen ebenfalls eine schwache Phagozytose (PI < 12). Erythrozyten, die mit den gleichen Antikörpern opsonisiert wurden, die M2-Makrophagen zugesetzt wurden, weisen eine hohe, signifikante Phagozytose auf (PI > 12), was die Fähigkeit dieser Makrophagen zeigt, die klinische Signifikanz im Vergleich zu Monozyten und M1-Makrophagen möglicherweise besser vorherzusagen. Basierend auf den beobachteten Ergebnissen können wir den Schluss ziehen, dass die Verwendung von M2-Makrophagen die klinische Bedeutung von Erythrozyten-Antikörpern in der Transfusionsmedizin besser vorhersagen kann. Auch aktuelle Methoden in der Immunologie könnten es nützlich sein, sich an die in dieser Arbeit gezeigten Methoden anzupassen, da sie genauere Ergebnisse liefern und sich auf die klinische Relevanz übertragen können. Es sind jedoch weitere Studien erforderlich, die Erythrozyten-Antikörper mit Spezifitäten und klinischen Daten untersuchen, die auf ihre klinische Bedeutung oder Bedeutungslosigkeit hinweisen, wobei das MMA mit dem M-MA verglichen wird.
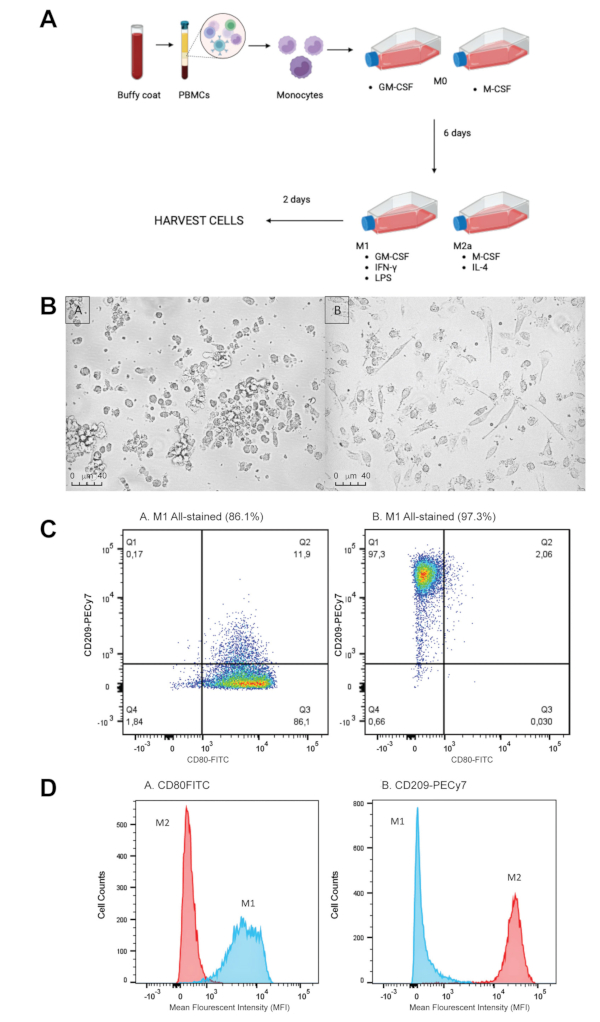
Abbildung 1: Polarisation und Charakterisierung von M1/M2-Makrophagen. (A) Ein Spender-Buffy-Coat wird verwendet, um mononukleäre Zellen des peripheren Blutes (PBMCs) mittels Dichtegradiententrennung zu extrahieren. CD16+/CD14+-Monozyten werden dann aus PBMCs isoliert und zur Differenzierung bei 37 °C für 6 Tage in zwei Kulturflaschen gegeben, mit einer Auffrischung an Tag 4. Differenzierungsmedien: M1-GM-CSF (2,5 ng/mL) und M2-M-CSF (50 ng/mL). Polarisationsmedium wird in jeden entsprechenden Kolben nach 144 h gegeben, und die Makrophagen werden weitere 48 h bei 37 °C polarisiert. Polarisationsmedien: M1 – IFN-gamma (50 ng/ml), LPS (10 ng/ml) und GM-CSF (2,5 ng/ml). M2 – IL-4 (20 ng/ml) und M-CSF (50 ng/ml). Die Zellen können dann geerntet und für die Charakterisierung durch Durchflusszytometrie markiert oder in einem Phagozytose-Assay verwendet werden (Abbildung 2). (B) M1 vs. M2 Makrophagen in vitro Morphologie. Bilder, die 2 Tage nach der Polarisation aufgenommen wurden. A. M1-Makrophagen weisen eine runde und zirkuläre Morphologie auf. B. M2-Makrophagen haben eine ausgeprägte, dehnbare, lange Morphologie, die beide auf eine erfolgreiche Polarisation hinweisen. (C) Durchflusszytometrische Analyse von M1/M2-Makrophagen, die durch CD80(M1) und CD209(M2) charakterisiert sind. M1/M2-Makrophagen wurden 8 Tage lang kultiviert und mit CD80-FITC und CD209-PECy7 zur Charakterisierung mittels Durchflusszytometrie markiert. A. M1-Makrophagen weisen eine Expression von etwa 86,1 % von CD80 und eine Expression von 0,17 % von CD209 auf. B. M2-Makrophagen weisen 97,3 % der CD209-Expression und 0,003 % der CD80-Expression auf. (D) Fluoreszenzsignal von CD80 und CD209 auf M1/M2-Makrophagen. M1/M2-Makrophagen wurden 8 Tage lang kultiviert und entweder mit CD80-FITC oder CD209-PECy7 für die Charakterisierung mittels Durchflusszytometrie markiert. Ein. Die mittlere Fluoreszenzintensität (MFI) von CD80 ist bei M1s viel höher als bei M2s. Der MFI von CD209 ist bei M2 viel höher als bei M1. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Monozyten-Makrophagen-Assay (M-MA). (A) M1/M2s werden 6 Tage lang mit Wachstumsfaktoren und dann 2 Tage mit Zytokinen kultiviert, um sie zu polarisieren. Die M1/M2-Makrophagen werden dann in Objektträger gegeben und 2 Stunden lang bei 37 °C inkubiert. Die Erythrozyten werden mit dem Antikörper/Serum der Wahl opsonisiert und 1 h lang inkubiert, wobei alle 15 Minuten intermittierend gemischt wird. Opsonisierte Erythrozyten werden in Objektträger mit angehängten Makrophagen gelegt und 2 h bei 37 °C ungestört inkubiert. Die Dias werden in PBS gewaschen; Die Zellen werden mit Methanol fixiert und mit Flavanol eingefasst. Die Zellen werden mit Hilfe der Phasenkontrastmikroskopie bei 40x gezählt. Der phagozytische Index (PI) wird durch Zählung von 300 Makrophagen und entsprechenden phagozytierten Erythrozyten berechnet. (B) M-MA Vergleich von M1- und M2-Makrophagen mit Anti-D und Anti-k. R2R2 bezieht sich auf RhD+ Blut. K+k+ bezieht sich auf heterozygote K+k+ Erythrozyten. Fehlerbalken zeigen SD an und es wurde ein t-Test mit einem p-Wert < 0,05 durchgeführt, der als signifikant eingestuft wurde. (C) Erythrozyten, die mit Anti-k-Phagophagen opsonisiert wurden, die von M1 im Vergleich zu M2-Makrophagen von M-MA geleitet wurden. Die Bilder wurden mit Hilfe der Phasenkontrastmikroskopie bei 40x aufgenommen. ein. M1-Makrophagen zeigen eine geringe phagozytäre Aktivität mit Erythrozyten, die mit Anti-k opsonisiert sind. b. M2-Makrophagen zeigen eine hohe phagozytäre Aktivität mit Erythrozyten, die mit Anti-k opsonisiert sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Phagozytenindex (PI) | ||||
| Antikörper | IAT^ | monozyten* | M1** | M2*** |
| Anti-Fya | 1-2+ | 3 | 4 | 13 |
| Anti-Jka | 1+ | 0 | 5 | 41 |
| Anti-S | 1+ | 0 | 2 | 43 |
| Anti-Dib | 1+ | 0 | 5 | 16 |
| ^Indirekter Antiglobulintest mit Anti-IgG | ||||
| *Monozyten-Monolayer-Assay (MMA) unter Verwendung von Monozyten; PI>5 gilt als potenziell klinisch signifikant. | ||||
| **Monozyten-Makrophagen-Assay (M-MA) mit M1-Makrophagen; PI>12 gilt als potenziell klinisch signifikant. | ||||
| M-MA mit M2-Makrophagen; PI>12 gilt als potenziell klinisch signifikant. | ||||
Tabelle 1. Die Verwendung von M2-Makrophagen kann im Vergleich zu Monozyten (MMA) prädiktiver für potenziell klinisch signifikante Erythrozyten-Antikörper im M-MA-Assay sein.
Diskussion
Um den Erfolg der Methode zu gewährleisten, müssen die folgenden kritischen Schritte eingehalten werden: 1) erfolgreiche M1/M2-Polarisation, 2) Generierung der Makrophagenschicht und RhD+-Kontrolle, 3) Quantifizierung des phagozytären Index. Während unsere Methoden angeben, isolierte Monozyten für die Zellkultur zu verwenden, können PBMCs verwendet werden, aber wir empfehlen die Verwendung von gereinigten Monozyten. Es ist bekannt, dass PBMCs verschiedene Zelltypen enthalten, wobei diese Zellen mehrere verschiedene Zytokine und vermittelnde Faktoren sezernieren. Dies kann Auswirkungen auf die Differenzierung bzw. Polarisation der M1/M2-Makrophagen haben; Daher führt die Verwendung von gereinigten Monozyten zu besseren Ergebnissen. Es ist auch wichtig, sich daran zu erinnern, dass etwa 10 % der Monozyten aus der ursprünglichen Menge an PBMCs gewonnen werden, wenn das STEMCELL-Monozyten-Isolationskit verwendet wird. Es wurde beobachtet, dass 50 x 106 PBMCs die minimale Ausgangszahl von PBMCs ist, um etwa 5 x106 Monozyten zu erhalten. Wenn Sie den Kolben mit anhaftenden Monozyten waschen, achten Sie darauf, ihn vorsichtig mit einer wirbelnden Bewegung zu waschen, um ein Ablösen von Zellen zu vermeiden. Aufgrund der im Inkubator stattfindenden Verdunstung ist der Nachfüllmedienschritt an Tag 4 der Kultur notwendig. Vermeiden Sie es, Medien zu verwerfen, und geben Sie die Medien in den Kolben, da die von den M1/M2s sezernierten Zytokine für die Differenzierung wichtig sind. Nach der 2-tägigen Polarisation können die M1/ M2-Makrophagen für Experimente verwendet oder bis zu 7 Tage in Kultur gehalten werden. Die Länge der Polarisation ist flexibel und kann auf der Grundlage der beobachteten Ergebnisse angepasst werden, aber 2 Tage sind das Minimum für eine erfolgreiche Polarisation. Der Schritt der Durchflusszytometrie ist nur bei der Einrichtung des Verfahrens erforderlich. Sobald der Assay ordnungsgemäß ausgeführt wird und Wiederholungsläufe die M1/M2-Zellen erfolgreich charakterisiert haben, können Sie diesen Schritt auslassen. Die erzielte Ausbeute sollte bei etwa 90 % von M1 (CD80+ CCR7+ CD209-) und über 85 % von M2 (CD206+ CD209+ CD80-) liegen. M1s können positiv für CD209 oder CD206 sein; Dies ist normal, da diese Marker auf M1s schwach exprimiert werden, aber immer noch auf eine erfolgreiche Polarisation hinweisen. M2-Makrophagen sollten immer negativ für CD80 sein.
Bei der M-MA muss die Makrophagenschicht vorsichtig auf den Kammerobjektträger aufgesetzt werden. Die Aussaatzahl von M1/M2 kann bei Bedarf um bis zu 250.000 Zellen pro Well gesenkt werden, sollte jedoch in der Regel zwischen 400.000 und 500.000 liegen. Ein höherer Betrag kann zu Verklumpungen und ungenauen Messwerten führen. Seien Sie vorsichtig beim Ansaugen oder Hinzufügen von Lösungen zu den Kammern; Die Spitze der Pipette sollte nur eine Ecke der Vertiefungen berühren, um die schwach anhaftenden Zellen zu vermeiden. Um ein Austrocknen der Vertiefungen zu vermeiden, ist bei der Zugabe von Lösungen und dem Medienwechsel in technischer Dreifachausfertigung zu arbeiten. Berühren Sie niemals die Vorderseite der Rutsche; Es kann zum Verlust von Makrophagen oder Monozyten führen. RhD+ R2R2-Erythrozyten werden als Positivkontrolle für die FcγR-vermittelte Phagozytose verwendet, um die Aktivität sicherzustellen. Obwohl wir RhD+ R2R2 Erythrozyten für die Opsonisierung mit Anti-D für die Positivkontrolle verwenden, können alle RhD+ Erythrozyten verwendet werden 1,2. Achten Sie darauf, die richtige Antikörperkonzentration zu verwenden, wenn Sie Erythrozyten in diesem Assay opsonisieren. Übermäßige Mengen führen dazu, dass die Erythrozyten verklumpen und Folien nicht gelesen werden können. Schließlich wird empfohlen, dass mehr als ein Laborpersonal die Objektträger zählt. Die manuelle Quantifizierung mit dem Mikroskop kann schwierig sein, da sie subjektiv ist, was auf eine hohe Variabilität zwischen den Zählungen zwischen verschiedenen Kammervertiefungen und Experimenten hindeutet. Die Konsistenz des Sichtfelds, in dem die Zellen gezählt werden, und das Zählen einer höheren Anzahl von Zellen können genauere Ergebnisse ermöglichen.
Zu den Einschränkungen dieser Methode gehören die subjektive Natur der Quantifizierung des phagozytischen Index und die Variabilität zwischen Spenderblut. PBMCs werden aus Spender-Buffy-Coats extrahiert, um die M1/M2-Zellkultur zu etablieren, und vorläufige Daten aus dem Labor zeigen eine signifikante Variabilität der phagozytären Aktivität von M1 und M2 je nach Spender. Derselbe Antikörper kann mit M2-Zellen eines Spenders im Vergleich zu denen eines anderen Spenders einen höheren phagozytären Index erzeugen. Um die Variabilität zu verringern und die Konsistenz zu wahren, wäre die Schaffung einer gepoolten Spenderressource von Vorteil, und dies gilt auch für RBCs, die in der MMA verwendet werden. Trotz der Beibehaltung einer konsistenten Methode wird es immer eine leichte Variabilität zwischen Erythrozyten/PBMC-Spenderblut geben.
Ein Hauptkritikpunkt sowohl an der MMA als auch an der M-MA ist die inhärente Subjektivität beim Zählen von Monozyten oder Makrophagen und den entsprechenden phagozytierten roten Blutkörperchen (RBCs). Trotz etablierter Protokolle ist eine Variabilität der einzelnen Zähltechniken unter dem Mikroskop unvermeidlich. Um dies zu beheben, wäre es für das Laborpersonal von Vorteil, einen standardisierten Quantifizierungsansatz zu etablieren, z. B. die Definition eines konsistenten Startpunkts im Sichtfeld oder die Erhöhung der Stichprobengröße für die Zählung. Die Umsetzung solcher Maßnahmen würde die Konsistenz und Genauigkeit der Zellzählungen verbessern, was letztendlich zu zuverlässigeren Ergebnissen und Schlussfolgerungen führen würde.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wird vom Canadian Blood Services Centre for Innovation in Toronto, Ontario, unterstützt und finanziert. Die Forschung wird am Keenan Research Centre for Biomedical Sciences am St. Michaels Hospital in Toronto, Ontario, durchgeführt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1X PBS, pH 7.4, without Ca2+/Mg2+ | Wisent Bioproducts | 311-425-CL | Store at 4 degrees or room temperauture |
| AccutaseTM | STEMCELL Technologies | 7920 | Cell detachment solution |
| ACK Lysis Buffer | STEMCELL Technologies | 07850, 07800 | Store at 4 degrees |
| Anti-Human Globulin | NOVACLONE, Immunocor. | N/A | NOVACLONE Anti-igG for IAT testing |
| Anti-Rh(D) (WinRho. SDF CDN) | Saol Therapeutics | 1003092 | Any commerical source of Rh immune globin will suffice |
| Cell Scraper | UofT Medstore | 83.395 | cell detachement |
| Cell Strainer 70uM nylon | Falcon | 352350 | filter of cells |
| Chamber slide Nunc. Lab-TekTM II with Cover, RS Glass Slide Sterile | Thermo Fisher Scientific | 154534 | chamber slides for MMA |
| Coverslips | VWR | 48393-081 | 24 x 50 mm |
| Cytiva Ficoll Paque Plus, density 1.077 g/L | Thermo Fisher Scientific | 17-1440-03 | sepeation of PBMCS from whole blood; density gradient medium |
| Elvanol Mounting Medium | N/A | N/A | Dulbecco’s PBS (D-PBS) without Ca2+/Mg2+, 15% (w/v) polyvinyl resin, and 30% (v/v) glycerine. |
| Fresh whole blood (ACD tube) or Buffy coat | Canadian Blood Services | May rest at room tempruatre for up to 36 hours | |
| Human Recombinant GM-CSF | STEMCELL Technologies | 78015.1 | Cytokine for polarization of M1 macrophages |
| Human Recombinant IFN-gamma | STEMCELL Technologies | 78020 | Cytokine for polarization of M1 macrophages |
| Human Recombinant IL-4 | STEMCELL Technologies | 78045.1 | Cytokine for polarization of M2 macrophages |
| Human Recombinant M-CSF | STEMCELL Technologies | 78057.1 | Cytokine for polarization of M2 macrophages |
| ID-CellStab | Bio-Rad | 005650 05740 | RBC cell storage/stabilization solution |
| Isolation Medium | N/A | N/A | PBS Ca2+ and Mg2+ free + FBS 2% + 1mM EDTA |
| Lipopolysaaracide (LPS) | Sigma Aldrich | L3024-5MG | Cytokine for polarization of M1 macrophages |
| Methanol (100%) | N/A | N/A | Fixing of slides |
| Monocyte Isolation Kit STEM-cells EasySep Human Monocyte Enrichment Kit without CD16 Depletion | STEMCELL Technologies | 19058 | Isolation of monocytes from PBMCs |
| Poly-D-ysine | UofT Medstore | P6407 | Cell attachment solution |
| Rh(D) positive R2R2 RBCs | Canadian Blood Services | N/A | Also commerically avaiable |
| RPMI-1640 | Wisent Bioproducts | 350-000-CL | supplemented with 10% heat-inactivated FBS,1 mM GlutaMAX supplement, 1 mM HEPES, and 1%penicillin/streptomycin. Store at 4 degrees. |
| Trypan Blue solution | Thermo Fisher Scientific | 15250061 | Cell counting solution |
Referenzen
- Tong, T. N., Branch, D. R. Use of a monocyte monolayer assay to evaluate Fcγ receptor-mediated phagocytosis. J Vis Exp. (119), e55039 (2017).
- Tong, T. N., Cen, S., Branch, D. R. The monocyte monolayer assay: Past, present and future. Transfus Med Rev. 33 (1), 24-28 (2019).
- Frias Boligan, K., Sandhu, G., Branch, D. R. Methods to evaluate the potential clinical significance of antibodies to red blood cells. Curr Protoc. 2 (8), e504 (2022).
- Lemay, A. S., et al. The first case of severe acute hemolytic transfusion reaction caused by anti-Sc2. Transfusion. 58 (11), 2506-2512 (2018).
- Tong, T. N., et al. The utility of a monocyte monolayer assay in the assessment of intravenous immunoglobulin-associated hemolysis. Transfusion. 60 (12), 3010-3018 (2020).
- Srivastava, K., et al. SCAR: the high-prevalence antigen 013.008 in the Scianna blood group system. Transfusion. 61 (1), 246-254 (2021).
- Branch, D. R., et al. Potentially clinically significant anti-Dib identified by monocyte monolayer assay before transfusion. Transfusion. 61 (1), 331-332 (2021).
- Italiani, P., Boraschi, D. From monocytes to M1/M2 macrophages: Phenotypical vs. functional differentiation. Front Immunol. 5, 514 (2014).
- Mills, C. M1 and M2 macrophages: Oracles of health and disease. Crit Rev Immunol. 32 (6), 463-488 (2012).
- Atri, C., Guerfali, F. Z., Laouini, D. Role of human macrophage polarization in inflammation during infectious diseases. Int J Mol Sci. 19 (6), 1801 (2018).
- Bertani, F. R., et al. Classification of M1/M2-polarized human macrophages by label-free hyperspectral reflectance confocal microscopy and multivariate analysis. Sci Rep. 7, 8965 (2017).
- Murray, J. Macrophage polarization. Annu Rev Physiol. 79, 541-566 (2017).
- Cohn, C., Delaney, M., Johnson, S. T., Katz, L. M., Schwartz, J. . Technical Manual. , (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten