Method Article
Prédiction de la signification des anticorps anti-globules rouges à l’aide du dosage des monocytes-macrophages
Dans cet article
Résumé
Nous avons développé des améliorations et mis à jour des méthodes pour le test monocyte-monocouche (MMA) existant, dans lequel les macrophages sont utilisés pour aider à mieux prédire la pertinence clinique des alloanticorps érythrocytaires en médecine transfusionnelle et en immunologie. Ce test est appelé test monocyte-macrophage (M-MA).
Résumé
Dérivés de monocytes dans la moelle osseuse, les macrophages sont de grandes cellules immunitaires innées qui jouent un rôle majeur dans l’élimination des cellules mortes, des débris, des cellules tumorales et des agents pathogènes étrangers. La capacité phagocytaire des monocytes par rapport aux macrophages est un concept qui n’est pas bien compris. Ici, nous visons à examiner une différence dans la phagocytose des monocytes par rapport aux macrophages, en particulier les macrophages M1/M2, contre divers globules rouges opsonisés en utilisant une version modifiée et mise à jour du test établi des monocouches de monocytes (MMA). Des cellules mononucléées du sang périphérique (PBMC) ont été isolées à partir d’enveloppes leucocytaires de donneur. À l’aide de monocytes purifiés, des macrophages inflammatoires M1 et anti-inflammatoires M2 ont été produits par culture in vitro et polarisation. Les cellules M1/M2 ont été récoltées et utilisées dans un test de type MMA, que nous appelons le M-MA, pour déchiffrer la phagocytose cliniquement significative de divers anticorps anticytaires rouges. Un indice phagocytaire (IP) > 5 a été jugé cliniquement significatif pour une phagocytose avec l’utilisation de monocytes. Un indice phagocytaire (IP) > 12 a été jugé cliniquement significatif pour la phagocytose avec l’utilisation de macrophages M1/M2. Les macrophages M2 démontrent une capacité accrue à phagocyter les globules rouges opsonisés par rapport aux monocytes et aux M1. Le même anticorps faible (anti-S) produit une phagocytose significative avec seulement les macrophages M2 (PI=43) mais pas les M1 (PI=2) ou les monocytes (PI=0), et cela a été démontré à plusieurs reprises en utilisant divers anticorps. L’utilisation de macrophages M2 au lieu de monocytes peut permettre d’obtenir des résultats plus précis, car ces cellules sont plus phagocytaires, ce qui offre une pertinence clinique supplémentaire pour le test. D’autres études portant sur différents anticorps dirigés contre les globules rouges, y compris la validation du dosage des monocytes-macrophages (M-MA) avec des anticorps ayant une signification clinique connue, pourraient montrer que le M-MA est plus utile pour aider à prédire les alloanticorps et les réactions transfusionnelles cliniquement significatifs. Cette méthode fera progresser le domaine de la médecine transfusionnelle et de l’immunologie.
Introduction
La prédiction des réactions transfusionnelles reste un défi important dans le domaine de la médecine transfusionnelle. Au cours des 4 dernières décennies, le test monocyte-monocouche (MMA), mis au point par Tong et Branch 1,2, a constitué un test cellulaire in vitro précieux pour prédire l’issue clinique de l’hémolyse chez les patients transfusésde sang 1. En effet, ce test a permis de distinguer les anticorps antiglobules rouges (GR) cliniquement significatifs et non significatifs2. Alors que les monocytes ont traditionnellement été le leucocyte standard utilisé dans ce test, notre recherche vise à explorer les avantages potentiels de l’utilisation de macrophages dérivés de monocytes comme alternative. Ces cellules peuvent améliorer la capacité des tests à évaluer la pertinence clinique des alloanticorps anti-globules rouges.
Dans le MMA historique, les monocytes, qui sont les précurseurs des macrophages, les cellules immunitaires responsables de l’élimination et de la destruction des globules rouges lors d’une réaction transfusionnelle indésirable, sont introduits dans un test in vitro avec des globules rouges et des anticorps 1,2,3,4,5,6,7 . La phagocytose est ensuite évaluée visuellement en comptant les globules rouges phagocytés dans les monocytes. Un indice phagocytaire (IP) de < 5 globules rouges phagocytés pour 100 monocytes dénombrés indique que le patient présente un risque réduit de subir une réaction transfusionnelle indésirable, et l’anticorps est jugé cliniquement non significatif 4,5,6,7. Des expériences préliminaires démontrent que l’utilisation de monocytes dérivés du sang périphérique peut ne pas être idéale pour déterminer la signification clinique, car ils ont une capacité phagocytaire inférieure à celle des monocytes activés et de certains macrophages.
Les monocytes sont un sous-ensemble de cellules présentes dans le sang, la rate et la moelle osseuse et représentent 10 % du total des leucocytes chez l’homme8. Ces cellules circulent généralement pendant 1 à 2 jours avant d’être recrutées par différents tissus, où elles se différencient en macrophages8. Cela se produit généralement lors de l’hématopoïèse, dans laquelle la moelle osseuse produit des monocytes qui sont libérés dans la circulation pour devenir des macrophages tissulaires qui résident dans la rate et le foie2. Connus comme la première ligne de défense contre les agents pathogènes étrangers, les macrophages sont de grandes cellules mononucléées phagocytaires qui jouent un rôle dans l’immunité adaptative et innée9. Parmi les rôles complexes et complexes du système immunitaire, la compréhension et la caractérisation des phénotypes des macrophages représentent un formidable défi qui n’est pas encore entièrement compris. Au cours des deux dernières décennies, la notion de polarisation des macrophages a été de plus en plus reconnue, des études récentes utilisant l’utilisation du séquençage de l’ARN unicellulaire pour discerner le spectre dans lequel ces macrophages existent.
Les macrophages M1 et de type M1 activés de manière classique apparaissent dans des environnements inflammatoires dominés par des récepteurs de type Toll (TLR)10. Ces cellules peuvent être impliquées dans des maladies auto-immunes et l’artériosclérose et présenter des marqueurs de surface tels que le CMH-II, le CD80 et le CD8611,12. Les macrophages anti-inflammatoires M2 et de type M2 se trouvent dans des environnements dominés par les réponses Th2, l’absence d’expression de CD80 et la présence de marqueurs de surface tels que CD209 et CD20611,12. Les macrophages M1/M2 peuvent être cultivés in vitro à partir de cellules mononucléées du sang périphérique, avec des lipopolysaccharides (LPS) et des cytokines telles que GM-CSF et IFNγ (M1) et M-CSF et IL-4 (M2) stimulant leur polarisation10,12.
Ce manuscrit et les études associées visent à démontrer que les macrophages M2 présentent une sensibilité accrue à la phagocytose par rapport aux macrophages et monocytes M1. L’étude de l’activité phagocytaire des macrophages M1/M2 par rapport aux monocytes dans le contexte des alloanticorps érythrocytaires et de la médecine transfusionnelle est un domaine qui reste à explorer. Ici, nous décrivons les travaux en cours pour la génération de macrophages M1/M2 et comparons le test classique des monocouches de monocytes (MMA) au nouveau test monocytes-macrophages, en utilisant l’acronyme M-MA pour distinguer ce test de macrophages du test de monocytes, afin d’améliorer la valeur prédictive des tests de phagocytose in vitro .
Protocole
Cette recherche a été réalisée dans le respect des directives institutionnelles pour la conduite de recherches éthiques impliquant des sujets humains. L’approbation éthique a été accordée par le Comité d’éthique de la recherche (CER) de la Société canadienne du sang, approbation CBSREB#2023.008. Toutes les étapes de ce protocole doivent être effectuées dans une enceinte de biosécurité dans des conditions stériles.
1. Isolement des PBMC
- Obtenez du sang humain entier d’un donneur dans un tube ACD. Conservez le sang à température ambiante (18 °C – 22 °C) jusqu’à 36 h.
- Transférez les tubes ACD de sang entier dans des tubes à centrifuger de 50 mL (un seul tube de 50 mL pour deux tubes ACD). Ajouter le milieu complet RPMI-1640 à température ambiante à un volume final de 35 ml.
- Ajouter 15 ml de milieu de gradient de densité de température ambiante dans un nouveau tube de 50 mL. Superposez soigneusement le sang total dilué sur le milieu à gradient de densité, en minimisant le mélange à l’interface pour une séparation optimale du sang.
- Centrifuger le mélange stratifié à 700 x g pendant 30 min avec les freins désactivés. La centrifugation à gradient de densité séparera le mélange en couches suivantes de haut en bas : plasma, couche leucocytaire (contenant des PBMC), matériau à gradient de densité, granulocytes et globules rouges.
- Aspirez et jetez la majorité de la couche supérieure (plasma). À l’aide d’une pipette de transfert, récupérez soigneusement la couche leucocytaire (PBMCs), en évitant d’apporter de la matière supplémentaire. Transférez les PBMC récupérés dans un nouveau tube de 50 ml.
- Lavez la couche de couche leuforogène isolée 1x avec une solution PBS pH 7,4 pendant 10 min à 350 x g avec les freins complets activés.
- À l’aide d’une crépine à cellules de 70 μM, éliminez les débris ou les matières indésirables des PBMC avant de les transférer dans un tube conique de 15 ml. Laver 2 fois avec une solution de PBS au pH 7,4 pendant 10 min à 350 x g avec les freins à fond activés.
- Facultatif : Lyser tous les globules rouges reportés avec le tampon de lyse ACK. Ajouter 5 à 10 ml de tampon de lyse ACK, selon la taille des granules, et incuber à température ambiante jusqu’à 3 min. Après l’incubation, complétez avec un pH de 7,4 PBS et centrifugez pendant 10 min à 350 x g avec les freins à fond et lavez 1x. Effectuez cette étape si le nombre de globules rouges est trop élevé.
REMARQUE : Il est toujours préférable d’éviter l’utilisation d’ACK pour de meilleurs résultats. Alternativement, l’eau peut être utilisée pour éliminer les globules rouges non phagocytés en incubant avec de l’eau pendant pas plus de 15 secondes, puis en ajoutant immédiatement 1X PBS pour laver. - Reconstituez la pastille PBMC dans 2 à 3 mL (utiliser 0,5 mL par tube ACD initial) de milieu complet RPMI-1640. Comptez les PBMC à l’aide d’un hémocytomètre après avoir préparé un mélange 1:1 avec du bleu de trypan. Ne compte que les cellules non colorées au bleu trypan. Reconstituer les PBMC en 2 x 106 cellules/mL dans le milieu complet RPMI-1640.
2. Culture de macrophages M1/M2
- Jour 0 : ensemencement des monocytes
- Préparez une fiole de culture cellulaire de 25 mL pour chaque population de macrophages. Ajoutez 5 ml de poly-D-lysine (50 mg/500 ml) à chacun et laissez-le dans la hotte pendant au moins 1 h. Rincez le ballon avec du PBS pour éliminer la poly-D-lysine résiduelle.
- Isolez les PBMC à partir de la couche leucocytaire ou des échantillons de patients, comme d’habitude (voir étape 1). Après la production d’une pastille de PBMC, la remettre en suspension dans 10 mL de milieu complet RPMI-1640 préchauffé.
- Déterminez le numéro de cellule et commencez l’isolement des monocytes à l’aide du kit d’isolement des monocytes. Pour faire fonctionner le kit, utilisez au moins 50 x 106 cellules.
- Remettre les cellules en suspension à 50 x 106 cellules/mL dans un milieu d’isolement. Selon le numéro de cellule obtenu, utilisez l’aimant violet (0,25-2 mL) ou gris (0,5-8,5 mL) recommandé dans le kit d’isolement des monocytes.
- Suivez les instructions de la trousse et ajoutez l’échantillon dans le tube de propylène requis (5 ml ou 14 ml). Ajouter le cocktail d’enrichissement à l’échantillon à raison de 50 μL/mL d’échantillon.
- Pipette de haut en bas ou vortex pour mélanger l’échantillon, puis incuber à 2-8 °C pendant 10 min dans un seau à glace. Pendant ce temps, vortex particules magnétiques pendant 30 s. Après l’incubation, ajouter des particules magnétiques à l’échantillon : 100 μL/ml d’échantillon.
- Pipette de haut en bas ou vortex pour mélanger l’échantillon, puis incuber à 2-8 °C pendant 5 min. Complétez avec un agent isolant à 2,5 mL ou 10 mL, en conséquence à l’aide d’une pipette graduée. Pipeter de haut en bas 2x-3x pour mélanger.
- Placez le tube (sans couvercle) dans l’aimant et incubez à température ambiante pendant 2,5 min. Prenez l’aimant et, d’un mouvement continu, retournez l’aimant et le tube, en versant la suspension cellulaire dans un nouveau tube, de 5 ml ou 14 ml.
- Réinstillez les cellules dans le milieu RPMI-1640 et comptez-les. Faites cette étape dès que possible. Ensemencer entre 1 x 106 et 5 x 106 monocytes dans chaque flacon de 25 mL préalablement enduit de poly-D-lysine. Porter le volume à 5 mL avec le RPMI-1640 si nécessaire.
- Incuber à 37 °C, 5 % CO2, pendant au moins 2 h. Pendant ce temps, préparez les milieux de différenciation M1 et M2. Préparez-vous suffisamment pour l’appoint du jour 0 (10 ml) et du jour 4 (2 ml).
REMARQUE : Milieu de différenciation M1 : RPMI-1640 + 2,5 ng/mL GM-CSF ; Milieu de différenciation M2 : RPMI-1640 + 50 ng/mL M-CSF. - Après le temps d’incubation, laver chaque flacon 1x avec du PBS et 2x avec du RPMI-1640 complet. Ajouter 10 mL de milieu de différenciation dans chaque fiole en fonction du type de cellule à différencier.
- Laisser les cellules se différencier pendant 6 jours dans l’incubateur à 37 °C, 5 % CO2. En raison de l’évaporation, compléter avec un milieu de différenciation le jour 4.
- Jour 4 - Rechargement
- Ajouter 2 mL de chaque milieu de différenciation dans la fiole correspondante. Ajouter le milieu directement dans la fiole.
- Jour 6 - Polarisation des macrophages
- Préparez les milieux de polarisation M1 et M2. Pour les milieux de polarisation M1, préparer 5 mL de milieu de polarisation M1 à ajouter à la fiole correspondante. Les concentrations finales devraient être de 50 ng/mL d’IFNγ, de 10 ng/mL de LPS et de 2,5 ng/mL DE GM-CSF dans le RPMI-1640. Le flacon à la fin aura 15 mL de volume total (10 mL déjà dans + 5 mL à ajouter), faites les calculs en conséquence.
- Pour les milieux polarisants M2, préparer 5 mL de milieu polarisant M2 à ajouter à la fiole correspondante. Les concentrations finales devraient être de 20 ng/mL d’IL-4 et de 50 ng/mL DE M-CSF dans le RPMI-1640. A noter que le ballon à la fin aura 15 mL de volume total (10 mL déjà dans + 5 mL à ajouter) ; Faites les calculs en conséquence.
- Ajouter 5 mL de milieu de polarisation M1 ou M2 dans chaque fiole. Laissez les macrophages se polariser pendant au moins 2 jours et pas plus de 4 jours dans l’incubateur à 37 °C, 5 % de CO2.
- Jour 8 - Récolte et cytométrie en flux
- Avant de récolter les macrophages M1 ou M2, recueillir le surnageant dans des tubes de 1,5 mL pour une utilisation ultérieure (si nécessaire). Ajouter 1 mL de solution de détachement cellulaire dans le ballon et le laisser dans l’incubateur à 37 °C, 5 % de CO2 pendant 5 min.
- Pour arrêter la réaction, ajoutez 3 ml de RPMI-1640 complet. Recueillir le support dans un tube de 15 ml. Ajouter 3 mL de RPMI-1640 complet dans le ballon et détacher les cellules du fond du ballon à l’aide d’un grattoir à cellules.
- Prélever les cellules dans un tube de 15 ml. Placez le ballon sous le microscope à 10x et observez les cellules pour vous assurer qu’il n’y a plus de cellules attachées au fond du ballon.
- Lavez les cellules dans du PBS 2x. Remettez-les en suspension dans le RPMI-1640 complet et comptez à l’aide de l’hémocytomètre.
- Pour analyser la qualité et la quantité de macrophages M1/M2, exécutez un test de cytométrie en flux. Utilisez 0,5 x 106 cellules par tube et colorez comme suit : M1 : CD80+ CCR7+ CD209- M2 : CD206+ CD209+ CD80-. Stratégie de contrôle utilisée dans ce test : Diagramme de points #1 Forward Scatter (FSC-A) vs. Side Scatter (SSC-A), Dot Plot #2 Forward Scatter Height (FSC-H) vs. Forward Scatter Area (FSC-A) pour la discrimination des doublets, #3 Lateral Scatter (SSC-A) vs. DAPI-A Dot Plot pour la discrimination des cellules vivantes/mortes, #4 Side Scatter (SSC-A) vs. Dot Plot ou histogramme à paramètre unique (i.e., SSC-A vs. FITC-A), graphique à points à double paramètre #5 (c’est-à-dire, FITC-A vs. APC-A).
3. MMA utilisant des macrophages M1/M2
- Après avoir obtenu les macrophages M1/M2, comptez-les à l’aide d’un hémocytomètre dans un rapport de coloration de 1:1 avec du bleu de trypan. Reconstituer M1/M2 à 1 x 106 cellules/mL dans un milieu complet RPMI-1640.
- Semez 400 μL (400 000 cellules) de suspension cellulaire à l’aide d’une micropipette dans chaque puits de la lame de chambre à 8 puits et incubez à 37 °C, 5 % de CO2 pendant au moins 1,5 h dans un incubateur de culture de tissus entièrement humidifié. Chaque test doit être effectué à l’aide d’un minimum de puits en trois exemplaires.
- Opsonisation d’échantillons d’analyse et de globules rouges RhD+ R2R2
- Laver les globules rouges RhD+ R2R2 à pH 7,4 PBS 3x par centrifugation à 350 x g pendant 5 min à chaque fois. Nous préférons utiliser les globules rouges R2R2 RhD+ comme témoin en raison de leur densité d’antigène D plus élevée, mais tous les globules rouges RhD+ pourraient être substitués. Optimisez les globules rouges de l’échantillon de globules rouges de test (p. ex., patient ou donneur) à l’aide d’anticorps d’intérêt. Utilisez une suspension de globules rouges à 5 % en ajoutant 15 μL de globules rouges emballés à 300 μL de mélange d’anticorps. Appliquez les globules rouges R2R2 avec de l’anti-D en ajoutant 15 μL de globules rouges R2R2 emballés à 300 μL de mélange d’anticorps anti-D (100 ng/mL).
- Incuber à 37 °C, 5 % CO2 pendant 1 h. Effectuer une reconstitution intermittente des globules rouges déposés au fond (ex. : vortex toutes les 15 min). Laver les globules rouges opsonisés avec un pH de 7,4 PBS 3x par centrifugation à 350 x g pendant 5 min à chaque fois.
- Pour vérifier l’absence de globules rouges, effectuez un test d’antiglobuline indirecte (IAT). Ajoutez un anticorps anti-humain opsonisant secondaire à l’anticorps opsonisant primaire. L’hémagglutination ou l’agglutination des globules rouges peut être observée en 30 s et interprétée comme une opsonisation réussie13.
- Reconstituez les globules rouges RhD+ R2R2 opsonisés lavés à 1,25 % (v/v) avec le milieu complet RPMI-1640. Ajouter 1 200 μL de fluide à 15 μL de globules rouges pour obtenir 1,25 % (v/v) par puits.
- Phagocytose médiée par le récepteur Fc
- Après l’incubation de 1,5 h des macrophages M1/M2, pour permettre à ces cellules d’adhérer aux puits de la lame de chambre, aspirez le milieu surnageant et jetez-le, en suivant une technique douce, en veillant à ce que la pointe de la pipette ne touche que le coin des puits. Les macrophages doivent être collés aux puits. Évitez de toucher le milieu des puits avec la pointe de la pipette.
- Laver doucement les puits 1x avec un pH de 7,4 PBS. Ajouter 400 μL du mélange approprié de globules rouges opsonisés à 1,25 % (v/v) dans chaque puits du triplicate. Incuber à 37 °C, 5 % CO2 pendant 2 h sans être dérangé.
- Après l’incubation, préparez deux béchers avec 100 ml de PBS de pH 7,4 dans chacun.
- Retirez les chambres à 8 puits à l’aide des adaptateurs du fabricant. Tamponnez l’excédent sur une serviette en papier tout en gardant les lames humides.
- Immergez la lame dans le bécher avec les surnageants jetés et lavez-la en la déplaçant lentement d’avant en arrière (20 à 30 coups) pour éliminer tous les globules rouges non phagocytés restants.
- Ensuite, immergez la glissière dans le deuxième bécher et lavez lentement pendant 20 à 30 coups de plus. Retirez la diapositive du PBS et tamponnez l’excédent sur une serviette en papier. Évitez de toucher l’avant des chambres. À ce stade, trempez la lame dans l’eau pendant 1 minute pour éliminer tous les globules rouges adhérents et non phagocytés, mais cela peut ne pas être nécessaire si vous pouvez distinguer les globules rouges phagocytés des globules rouges adhérents.
- Immergez les lames dans du méthanol à 100 % pendant 45 s pour les fixer, puis faites sécher à l’air. Montez la glissière à l’aide d’un support de montage préparé en interne et ajoutez des lamelles (24 x 75 mm). Laisser sécher toute la nuit avant de quantifier.
- Quantification de la phagocytose
- À l’aide d’un microscope à contraste de phase, d’une lentille d’objectif 40x et d’un compteur de cellules manuel, quantifiez la phagocytose.
- À l’aide de deux compteurs de cellules manuels, un dans chaque main, comptez les globules rouges phagocytés avec un compteur et le nombre total de monocytes/macrophages avec l’autre. Comptez 300 monocytes/macrophages par puits.
- Calculez l’indice phagocytaire (IP) moyen par test (sur trois exemplaires) en divisant le nombre de globules rouges phagocytés par le nombre total de monocytes comptés et en multipliant par 100. Exprimez les données sous forme de PI ± d’erreur type moyenne (SEM) moyenne.
PI = (globules rouges phagocytés / 300 macrophages) x 100
Résultats
Les résultats de la figure 1 sont cohérents avec la littérature et indiquent une polarisation réussie des macrophages de leur état M0 à leur état M1/M2 ultérieur. Les macrophages M1 et M2 ont été cultivés pendant 8 jours (6 jours avec des facteurs de croissance et 2 jours de polarisation), et des globules rouges anti-D ou anti-k ont été testés (Figure 2). Les macrophages M2 présentent un indice phagocytaire élevé par rapport aux M1 avec des globules rouges opsonisés soit par l’anti-D (contrôle), soit par l’anti-k. Ce résultat est cohérent avec d’autres essais préliminaires effectués à l’aide de M-MA (voir le tableau 1). Les macrophages M2 sont très phagocytaires par rapport aux macrophages ou monocytes M1, même avec de puissants anticorps globules rouges (Figure 2B). Le tableau 1 présente des résultats préliminaires avec 4 alloanticorps globulaires différents ayant des spécificités considérées comme cliniquement significatives. Les anticorps utilisés pour opsoniser les globules rouges positifs à l’antigène et ajoutés aux monocytes dans le MMA présentent une phagocytose faible (PI < 5). Les globules rouges opsonés avec ces mêmes anticorps ajoutés aux macrophages M1 présentent également une phagocytose faible (PI < 12). Les globules rouges opsonnés avec les mêmes anticorps ajoutés aux macrophages M2 présentent une phagocytose élevée et significative (PI > 12), démontrant la capacité de ces macrophages à prédire peut-être mieux l’importance clinique par rapport aux monocytes et aux M1. Sur la base des résultats observés, nous pouvons conclure que l’utilisation des macrophages M2 pourrait être plus prédictive de l’importance clinique des anticorps anti-globules rouges en médecine transfusionnelle. De plus, les méthodes actuelles en immunologie peuvent trouver utile de s’adapter aux méthodes présentées dans cet article, car elles offrent des résultats plus précis et peuvent se traduire par une pertinence clinique. Cependant, d’autres études sont nécessaires pour examiner les anticorps contre les globules rouges avec des spécificités et des données cliniques qui indiquent leur signification ou leur insignifiance clinique, en comparant le MMA au M-MA.
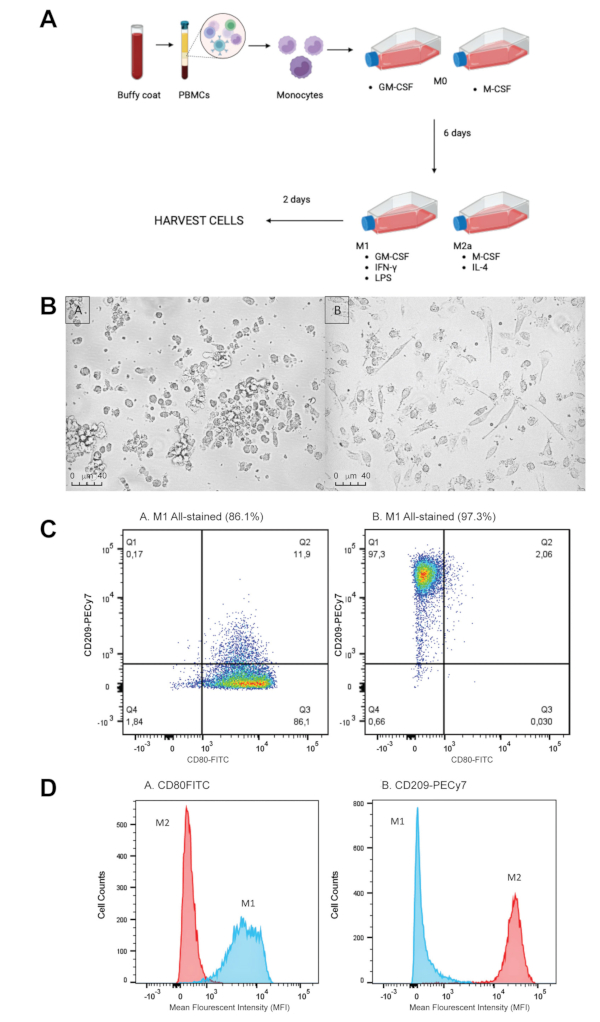
Figure 1 : Polarisation et caractérisation des macrophages M1/M2. (A) Une couche leucocytaire de donneur est utilisée pour extraire les cellules mononucléées du sang périphérique (PBMC) en utilisant la séparation par gradient de densité. Les monocytes CD16+/CD14+ sont ensuite isolés des PBMC et placés dans deux flacons de culture pour différencier à 37 °C pendant 6 jours, avec un appoint le jour 4. Milieux de différenciation : M1-GM-CSF (2,5 ng/mL) et M2-M-CSF (50 ng/mL). Un milieu de polarisation est ajouté à chaque fiole correspondante à 144 h, et les macrophages sont laissés à polariser pendant 48 h supplémentaires à 37 °C. Milieux polarisants : M1 – IFN-gamma (50 ng/mL), LPS (10 ng/mL) et GM-CSF (2,5 ng/mL). M2 – IL-4 (20 ng/mL) et M-CSF (50 ng/mL). Les cellules peuvent ensuite être récoltées et marquées pour être caractérisées par cytométrie en flux ou utilisées dans un test de phagocytose (Figure 2). (B) Morphologie in vitro des macrophages M1 vs M2. Images prises 2 jours après la polarisation. Les macrophages A. M1 présentent une morphologie ronde et circulaire. Les macrophages B. M2 ont une morphologie distincte, extensible et longue, toutes deux indicatrices d’une polarisation réussie. (C) Analyse cytométrique en flux des macrophages M1/M2 caractérisés par CD80(M1) et CD209(M2). Les macrophages M1/M2 ont été cultivés pendant 8 jours et marqués avec CD80-FITC et CD209-PECy7 pour caractérisation par cytométrie en flux. Les macrophages M1 présentent environ 86,1 % d’expression de CD80 et 0,17 % d’expression de CD209. Les macrophages B. M2 présentent 97,3 % de l’expression de CD209 et 0,003 % de l’expression de CD80. (D) Signal fluorescent de CD80 et CD209 sur les macrophages M1/M2. Les macrophages M1/M2 ont été cultivés pendant 8 jours et marqués avec CD80-FITC ou CD209-PECy7 pour caractérisation par cytométrie en flux. Un. L’intensité fluorescente moyenne (MFI) de CD80 est beaucoup plus élevée sur les M1 que sur les M2. L’IMF du CD209 est beaucoup plus élevé sur les M2 que sur les M1. Veuillez cliquer ici pour voir une version agrandie de ce chiffre.

Figure 2 : Dosage monocytes-macrophages (M-MA). (A) Les M1/M2 sont cultivés pendant 6 jours avec des facteurs de croissance puis 2 jours avec des cytokines pour les polariser. Les macrophages M1/M2 sont ensuite placés dans des lames de chambre et incubés à 37 °C pendant 2 h. Les globules rouges sont opsonisés à l’aide de l’anticorps ou du sérum de leur choix et incubés pendant 1 h avec un mélange intermittent toutes les 15 minutes. Les globules rouges opsonisés sont placés dans des lames de chambre avec des macrophages attachés et incubés pendant 2 h à 37 °C sans être dérangés. Les diapositives sont lavées en PBS ; Les cellules sont fixées à l’aide de méthanol et montées avec du flavanol. Les cellules sont comptées à l’aide de la microscopie à contraste de phase à 40x. L’indice phagocytaire (IP) est calculé en comptant 300 macrophages et les globules rouges phagocytés correspondants. (B) M-MA comparant les macrophages M1 et M2 avec anti-D et anti-k. R2R2 fait référence au sang RhD+. K+k+ fait référence à des globules rouges hétérozygotes K+k+. Les barres d’erreur indiquent l’écart-type et un test t a été effectué avec une valeur p < 0,05 jugée significative. (C) Les globules rouges opsonisés avec des phagocytes anti-k par les macrophages M1 contre les macrophages M2 par M-MA. Les photos ont été prises à 40x à l’aide de la microscopie à contraste de phase. un. Les macrophages M1 montrent une faible activité phagocytaire avec des globules rouges opsonisés avec de l’anti-k. b. Les macrophages M2 présentent une activité phagocytaire élevée avec des globules rouges opsonisés avec de l’anti-k. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Indice phagocytaire (IP) | ||||
| Anticorps | IAT^ | Monocytes* | M1** | M2*** |
| Anti-Fya | 1-2+ | 3 | 4 | 13 |
| Anti-Jka | 1+ | 0 | 5 | 41 |
| Anti-S | 1+ | 0 | 2 | 43 |
| Anti-Dib | 1+ | 0 | 5 | 16 |
| ^Test indirect d’antiglobuline à l’aide d’anti-IgG | ||||
| *Dosage des monocouches de monocytes (MMA) à l’aide de monocytes ; L’IP >5 est considéré comme potentiellement cliniquement significatif. | ||||
| **Dosage des monocytes-macrophages (M-MA) à l’aide de macrophages M1 ; PI>12 considéré comme potentiellement cliniquement significatif. | ||||
| M-MA à l’aide de macrophages M2 ; PI>12 considéré comme potentiellement cliniquement significatif. | ||||
Tableau 1. L’utilisation de macrophages M2 pourrait être plus prédictive d’anticorps globulaires potentiellement cliniquement significatifs dans le dosage M-MA que dans les monocytes (MMA).
Discussion
Pour assurer le succès de la méthode, il faut respecter les étapes critiques suivantes : 1) polarisation M1/M2 réussie, 2) génération de la couche de macrophages et contrôle RhD+ 3) quantification de l’indice phagocytaire. Bien que nos méthodes prévoient d’utiliser des monocytes isolés pour la culture cellulaire, des PBMC peuvent être utilisés, mais nous recommandons d’utiliser des monocytes purifiés. On sait que les PBMC contiennent différents types de cellules, ces cellules sécrétant plusieurs cytokines et facteurs médiateurs différents. Cela peut avoir un impact sur la différenciation ou la polarisation des macrophages M1/M2 ; Par conséquent, l’utilisation de monocytes purifiés donnera de meilleurs résultats. De plus, il est important de se rappeler qu’environ 10 % des monocytes seront obtenus à partir de la quantité initiale de PBMC lors de l’utilisation du kit d’isolement des monocytes STEMCELL. Il a été observé que 50 x 106 PBMC est le nombre minimum de départ de PBMC pour obtenir environ 5 x 106 monocytes. Lorsque vous lavez la fiole avec des monocytes collés, assurez-vous de laver doucement en utilisant un mouvement tourbillonnant pour éviter de détacher des cellules. En raison de l’évaporation qui se produit dans l’incubateur, l’étape de remplissage du milieu le jour 4 de la culture est nécessaire. Évitez de jeter tout milieu et ajoutez-le dans le ballon, car les cytokines sécrétées par les M1/M2 sont importantes pour la différenciation. Après la polarisation de 2 jours, les macrophages M1/M2 peuvent être utilisés pour l’expérimentation ou conservés en culture jusqu’à 7 jours. La durée de polarisation est flexible et peut être ajustée en fonction des résultats observés, mais 2 jours est le minimum pour une polarisation réussie. L’étape de cytométrie en flux n’est nécessaire que lors de la mise en place de la procédure. Une fois que le test fonctionne correctement et que des cycles répétés ont permis de caractériser les cellules M1/M2, choisissez d’omettre cette étape. Le rendement obtenu doit être d’environ 90 % de M1 (CD80+ CCR7+ CD209-) et supérieur à 85 % de M2 (CD206+ CD209+ CD80-). Les M1 peuvent être positifs pour CD209 ou CD206 ; c’est normal car ces marqueurs sont faiblement exprimés sur les M1 mais sont toujours indicatifs d’une polarisation réussie. Les macrophages M2 doivent toujours être négatifs pour CD80.
Dans le M-MA, la couche de macrophages doit être soigneusement placée sur la lame de la chambre. Le nombre d’ensemencement de M1/M2 peut être réduit de 250 000 cellules par puits si nécessaire, mais il doit généralement se situer entre 400 000 et 500 000. Une quantité plus élevée peut entraîner des mesures agglomérantes et des lectures inexactes. Soyez doux lorsque vous aspirez ou ajoutez des solutions dans les chambres ; La pointe de la pipette ne doit toucher qu’un coin des puits, en évitant les cellules faiblement adhérentes. Pour éviter d’assécher les puits, travailler en trilets techniques lors de l’ajout de solutions et de l’échange de fluides. Ne touchez jamais l’avant de la glissière ; Cela peut entraîner la perte de macrophages ou de monocytes. Les globules rouges RhD+ R2R2 sont utilisés comme contrôle positif de la phagocytose médiée par FcγR pour assurer l’activité. Bien que nous utilisions des globules rouges RhD+ R2R2 pour l’opsonisation avec anti-D pour le contrôle positif, tous les globules rouges RhD+ peuvent être utilisés 1,2. Assurez-vous d’utiliser la concentration appropriée d’anticorps lors de l’utilisation des globules rouges dans ce test. Des quantités excessives entraîneront l’agglutination des globules rouges et l’incapacité de lire les diapositives. Enfin, il est recommandé que plus d’un membre du personnel de laboratoire compte les lames. La quantification manuelle à l’aide du microscope peut être délicate car elle est subjective, ce qui suggère une grande variabilité entre les comptages entre les différents puits de chambre et les expériences. L’uniformité du champ de vision dans lequel les cellules sont comptées et le comptage d’un plus grand nombre de cellules peuvent permettre d’obtenir des résultats plus précis.
Les limites de cette méthode comprennent la nature subjective de la quantification de l’indice phagocytaire et la variabilité parmi le sang du donneur. Les PBMC sont extraits des couches leucocytaires du donneur pour établir la culture cellulaire M1/M2, et les données préliminaires du laboratoire montrent une variabilité significative de l’activité phagocytaire M1 et M2 selon le donneur. Le même anticorps pourrait produire un indice phagocytaire plus élevé avec les cellules M2 d’un donneur par rapport à celles d’un autre. Pour réduire la variabilité et maintenir l’uniformité, il serait avantageux de créer une ressource de donneur regroupée, et cela s’applique également aux globules rouges utilisés dans l’AMM. Malgré le maintien d’une méthode uniforme, il existera toujours une légère variabilité entre le sang des donneurs de globules rouges et de PBMC.
L’une des principales critiques de la MMA et de la M-MA est la subjectivité inhérente au comptage des monocytes ou des macrophages et de leurs globules rouges phagocytés (GR) correspondants. Malgré les protocoles établis, la variabilité des techniques de comptage individuel au microscope est inévitable. Pour résoudre ce problème, il serait avantageux pour le personnel de laboratoire d’établir une approche de quantification standardisée, par exemple en définissant un point de départ cohérent dans le champ de vision ou en augmentant la taille de l’échantillon pour le comptage. La mise en œuvre de telles mesures améliorerait l’uniformité et la précision de la numération cellulaire, ce qui permettrait d’obtenir des résultats et des conclusions plus fiables.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ces travaux sont soutenus et financés par le Centre d’innovation de la Société canadienne du sang à Toronto, en Ontario, et au Centre de recherche Keenan en sciences biomédicales de l’Hôpital St. Michaels, à Toronto, en Ontario.
matériels
| Name | Company | Catalog Number | Comments |
| 1X PBS, pH 7.4, without Ca2+/Mg2+ | Wisent Bioproducts | 311-425-CL | Store at 4 degrees or room temperauture |
| AccutaseTM | STEMCELL Technologies | 7920 | Cell detachment solution |
| ACK Lysis Buffer | STEMCELL Technologies | 07850, 07800 | Store at 4 degrees |
| Anti-Human Globulin | NOVACLONE, Immunocor. | N/A | NOVACLONE Anti-igG for IAT testing |
| Anti-Rh(D) (WinRho. SDF CDN) | Saol Therapeutics | 1003092 | Any commerical source of Rh immune globin will suffice |
| Cell Scraper | UofT Medstore | 83.395 | cell detachement |
| Cell Strainer 70uM nylon | Falcon | 352350 | filter of cells |
| Chamber slide Nunc. Lab-TekTM II with Cover, RS Glass Slide Sterile | Thermo Fisher Scientific | 154534 | chamber slides for MMA |
| Coverslips | VWR | 48393-081 | 24 x 50 mm |
| Cytiva Ficoll Paque Plus, density 1.077 g/L | Thermo Fisher Scientific | 17-1440-03 | sepeation of PBMCS from whole blood; density gradient medium |
| Elvanol Mounting Medium | N/A | N/A | Dulbecco’s PBS (D-PBS) without Ca2+/Mg2+, 15% (w/v) polyvinyl resin, and 30% (v/v) glycerine. |
| Fresh whole blood (ACD tube) or Buffy coat | Canadian Blood Services | May rest at room tempruatre for up to 36 hours | |
| Human Recombinant GM-CSF | STEMCELL Technologies | 78015.1 | Cytokine for polarization of M1 macrophages |
| Human Recombinant IFN-gamma | STEMCELL Technologies | 78020 | Cytokine for polarization of M1 macrophages |
| Human Recombinant IL-4 | STEMCELL Technologies | 78045.1 | Cytokine for polarization of M2 macrophages |
| Human Recombinant M-CSF | STEMCELL Technologies | 78057.1 | Cytokine for polarization of M2 macrophages |
| ID-CellStab | Bio-Rad | 005650 05740 | RBC cell storage/stabilization solution |
| Isolation Medium | N/A | N/A | PBS Ca2+ and Mg2+ free + FBS 2% + 1mM EDTA |
| Lipopolysaaracide (LPS) | Sigma Aldrich | L3024-5MG | Cytokine for polarization of M1 macrophages |
| Methanol (100%) | N/A | N/A | Fixing of slides |
| Monocyte Isolation Kit STEM-cells EasySep Human Monocyte Enrichment Kit without CD16 Depletion | STEMCELL Technologies | 19058 | Isolation of monocytes from PBMCs |
| Poly-D-ysine | UofT Medstore | P6407 | Cell attachment solution |
| Rh(D) positive R2R2 RBCs | Canadian Blood Services | N/A | Also commerically avaiable |
| RPMI-1640 | Wisent Bioproducts | 350-000-CL | supplemented with 10% heat-inactivated FBS,1 mM GlutaMAX supplement, 1 mM HEPES, and 1%penicillin/streptomycin. Store at 4 degrees. |
| Trypan Blue solution | Thermo Fisher Scientific | 15250061 | Cell counting solution |
Références
- Tong, T. N., Branch, D. R. Use of a monocyte monolayer assay to evaluate Fcγ receptor-mediated phagocytosis. J Vis Exp. (119), e55039 (2017).
- Tong, T. N., Cen, S., Branch, D. R. The monocyte monolayer assay: Past, present and future. Transfus Med Rev. 33 (1), 24-28 (2019).
- Frias Boligan, K., Sandhu, G., Branch, D. R. Methods to evaluate the potential clinical significance of antibodies to red blood cells. Curr Protoc. 2 (8), e504 (2022).
- Lemay, A. S., et al. The first case of severe acute hemolytic transfusion reaction caused by anti-Sc2. Transfusion. 58 (11), 2506-2512 (2018).
- Tong, T. N., et al. The utility of a monocyte monolayer assay in the assessment of intravenous immunoglobulin-associated hemolysis. Transfusion. 60 (12), 3010-3018 (2020).
- Srivastava, K., et al. SCAR: the high-prevalence antigen 013.008 in the Scianna blood group system. Transfusion. 61 (1), 246-254 (2021).
- Branch, D. R., et al. Potentially clinically significant anti-Dib identified by monocyte monolayer assay before transfusion. Transfusion. 61 (1), 331-332 (2021).
- Italiani, P., Boraschi, D. From monocytes to M1/M2 macrophages: Phenotypical vs. functional differentiation. Front Immunol. 5, 514 (2014).
- Mills, C. M1 and M2 macrophages: Oracles of health and disease. Crit Rev Immunol. 32 (6), 463-488 (2012).
- Atri, C., Guerfali, F. Z., Laouini, D. Role of human macrophage polarization in inflammation during infectious diseases. Int J Mol Sci. 19 (6), 1801 (2018).
- Bertani, F. R., et al. Classification of M1/M2-polarized human macrophages by label-free hyperspectral reflectance confocal microscopy and multivariate analysis. Sci Rep. 7, 8965 (2017).
- Murray, J. Macrophage polarization. Annu Rev Physiol. 79, 541-566 (2017).
- Cohn, C., Delaney, M., Johnson, S. T., Katz, L. M., Schwartz, J. . Technical Manual. , (2023).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon