Method Article
ניתוח רשת הלימפה ורשת הדם במהלך השמנת יתר
* These authors contributed equally
In This Article
Summary
השמנת יתר היא בעיה עולמית הולכת וגוברת של בריאות הציבור. זה נקשר בעבר לתפקוד לקוי של הלימפה, מה שמרמז על דיבור צולב חיוני בין רקמת השומן למערכת הלימפה. כאן, אנו מציעים מתודולוגיה נגישה המאפשרת תיוג מובהק של כלי דם ולימפה בתוך רקמת השומן התת עורית.
Abstract
כלי איסוף לימפה ובלוטות לימפה מוטבעים בהכרח ברקמת השומן. המשמעות הפיזיולוגית של תצפית זו עדיין לא הובהרה. עם זאת, השמנת יתר מאופיינת בתפקוד לימפה לקוי ובחדירות מוגברת של כלי הדם. הפוך, תפקוד לקוי של הלימפה גורם להשמנת יתר בעכברים, מה שמרמז על יחסי גומלין משמעותיים בין כלי הלימפה לרקמת השומן. לכן, הבנת הגורמים המובילים לתפקוד לקוי של הלימפה עשויה לפתוח חלונות טיפוליים חדשים למניעת השמנת יתר ומחלות נלוות. השלב הראשון בתהליך זה דורש הדמיה מדויקת ומפורטת של רשת הלימפה ברקמת שומן בריאה ומודלקת. כאן, אנו מתארים שיטה מהירה, זולה ויעילה המאפשרת לתייג ולנתח כלי לימפה ודם. גישה זו מנצלת את לוקליזציה של בלוטות הלימפה הברכיאליות המנקזות את העור בתוך רקמת השומן התת עורית. ניתן לחשוף את הארבוריזציה הלימפטית של רקמה זו על ידי הזרקת לקטינים מצומדים פלואורוכרום תת עורית. יתר על כן, גישת התיוג in vivo מספקת דרך להעריך את צפיפות כלי הלימפה ותפקודם. יחד עם צביעת כלי דם, אדיפוציטים ותאי חיסון, הפרוטוקול מאפשר מיפוי ברזולוציה גבוהה של רקמת השומן התת עורית על ידי הדמיה תלת מימדית.
Introduction
מערכת הדם הלימפטית ממלאת תפקיד מכריע בשמירה על הומאוסטזיס רקמות ובהשראת תגובות חיסוניות יעילות. כלי הלימפה פועלים במקביל לכלי הדם ונושאים נוזל ביניים, מטבוליטים ותאי חיסון לבלוטת הלימפה המנקזת המקומית (LN) ולבסוף לכיוון מחזור הדם הוורידי1. ניקוז לימפטי לא מתפקד נצפה במהלך זיהום, דלקת ומחלות מטבוליות 2,3,4,5. כלי הדם הלימפתיים מורכבים מכלי דם בגודל קטן הנקראים נימים לימפטיים. נימי לימפה נוצרים על ידי שכבה אחת של תאי אנדותל לימפטי דקים (LECs) המאופיינים בצמתים פתוחים (צמתים "דמויי כפתור") המאפשרים נוזל אינטרסטיציאלי, מטבוליטים ותאי חיסון, בעיקר תאים דנדריטיים (DCs) ותאי T, הנכנסים ללומן נימי הלימפה5. נימי לימפה מתמזגים לכלי דם גדולים יותר הנקראים כלי איסוף לימפטיים. קולטי לימפה מאופיינים בשכבת LECs המוקפת בשכבת שריר המספקת טונוס כיווץ אוטונומי ושומרת על זרימת נוזלים5. יתר על כן, לכלי איסוף יש שסתומים המבטיחים זרימת לימפה חד כיוונית.
ה-LECs של קולטים ונימים מבטאים קבוצה ספציפית של סמנים המבדילים אותם מתאי אנדותל דם (BECs). בין הגורמים הללו, Prox1 הוא גורם שעתוק המנחה את יצירת ה-LECs ומתבטא מאוד ב-LECs בזמן שהוא נעדר ב-BECs. המעורבות הקריטית של Prox1 בביולוגיה של LECs הומחשה על ידי יצירה וניתוח של עכברים חסרי Prox16. לעכברים הטרוזיגוטיים Prox1 יש התפתחות כלי דם לימפטית פגומה המאופיינת בצפיפות כלי לימפה מופחתת וחדירות כלי דם מוגברת6. LECs מבטאים מאוד VEGFR3, פודופלנין ו-CCL215. סמנים אלה אינם נמצאים ב-BECs ומאפשרים לנתח בנפרד את רשת כלי הלימפה וכלי הדם. Lyve1 מתבטא באופן סלקטיבי על ידי נימי לימפה בזמן שהוא נעדר בכלי איסוף5.
שלושה סוגים של רקמת שומן תוארו על סמך תכולת המיטוכונדריה שלהם וצבעם לאחר מכן. רקמת שומן חומה תרמוגנית עשירה במיטוכונדריה ממלאת תפקיד מפתח במהלך חשיפה לקור וממוקמת באזור הבין-שכמה בעכברים 7,8. אדיפוציטים לבנים ובז' הם בעלי צפיפות מיטוכונדריאלית נמוכה יותר והם מעורבים בעיקר באגירת אנרגיה בצורה של טיפות שומנים. אדיפוציטים לבנים ובז 'ממוקמים במחסנים קרביים ותת עוריים9.
תצפיות קליניות ביססו קשר בין השמנת יתר לתפקוד לקוי של הלימפה10. השמנת יתר גורמת לשינויים מורפולוגיים בכלי הדם הלימפתיים של רקמת השומן ומובילה לפגיעה בהובלת הלימפה11. נתונים שהתקבלו במודלים פרה-קליניים חשפו כי דיאטה עתירת שומן (HFD) גורמת לעיצוב מחדש של הלימפה ולעכברים שמנים יש בלוטות לימפה קטנות יותר ומספר קטן יותר של כלי לימפה12. עם זאת, המנגנונים המולקולריים המדויקים השולטים בפנוטיפ זה עדיין לא ברורים. מעורבות LECs במהלך השמנת יתר נתמכת עוד יותר על ידי תצפיות במודלים גנטיים עם פגיעה בהתפתחות כלי הלימפה. כפי שנדון קודם לכן, עכברים הטרוזיגוטיים Prox1 (Prox1+/-) מציגים מערכת לימפה לא מתפקדת, ומפתחים במקרה הצטברות מוגזמת של רקמת שומן קרביים בהשוואה לבעלי חיים מספיקים של Prox16. מעניין שפנוטיפ רקמת השומן הזה ניצל על ידי שחזור תפקוד הלימפה13. יחד, תוצאות אלו חשפו קשרים הדדיים חזקים בין כלי הלימפה לרקמת השומן, הדורשים מחקר נוסף.
בהקשר של דלקת, סימן היכר של השמנת יתר, הביטוי השונה של סמני LEC ו-BEC פוגע בניתוח התאים הללו באמצעות צביעת נוגדנים קלאסית14,15. פותחו מודלים גנטיים לתיוג ספציפי של LECs ו-BECs ומאפשרים להקל על בעיה זו 16,17,18,19. עם זאת, השימוש בקווי דיווח גנטיים דורש מספר שלבים של גידול ומגדיל במידה ניכרת את אורך הפרויקט ועלותו לפיכך, אנו מציעים להשתמש בזריקות לקטין מצומדות פלואורוכרום כדי לחקור את מערכות הדם ומחזור הלימפה ברקמת השומן התת עורית, גישה פשוטה ולא יקרה יחסית. לקטין מצומד לפלואורוכרומים שונים זמין מסחרית וניתן להזריק אותו תוך ורידי כדי לסמן כלי דם, או תת עורי כדי לסמן את כלי הלימפה המנקזים את העור המוטבעים ברקמת השומן התת עורית. גישה זו מסתמכת על שימוש במצומדים נפרדים של פלואורוכרום-לקטין לכל הזרקה ומאפשרת תיוג מובהק של כל כלי דם. שיטה זו תואמת גם לשימוש במודלים גנטיים כדי לתייג את רשת כלי הדם הלימפטיים או הדם. חשוב לציין, הוא מספק קריאות מרובות כדי לנתח את המצב הבריאותי הכללי של רקמת השומן התת עורית ואת כלי הדם והלימפה המחלחלים אליה. ניתן ליישם הליך זה בקלות כדי לנתח את רשתות הלימפה וכלי הדם במהלך מחלות עור חריפות וכרוניות כולל פסוריאזיס וזיהומים.
Protocol
כל הניסויים בבעלי חיים בוצעו בהתאם לוועדות אתיות מקומיות.
הערה: Prox1-cre-ERT2 (Prox1tm3(cre/ERT2)Gco/J, Jax #022075) ו-Rosa26-LSL-tdTomato (B6. Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze/J, Ai9, Jax #007914) הושגו ממעבדת ג'קסון ונחצו כדי להשיג את קו העכבר המדווח הלימפטי הניתן להשראה Prox1-cre-ERT2::tdTomato. עכברים הוכלאו לאחור לרקע C57BL/6 במשך 10 דורות. עכברים זכרים בני שישה שבועות Prox1-cre-ERT2::tdעגבניות קיבלו דיאטת טמוקסיפן במשך 3 שבועות. דיאטת טמוקסיפן מבית Envigo Teklad (דיאטה מס. TD.130857; 500 מ"ג/ק"ג). ניסויים נערכו בעכברים בני 12-14 שבועות. פרוטוקול זה חל על עכברים בכל גיל, מין או זן.
1. הכנת חומר
- עקרו מספריים, מלקחיים וסיכות ניתוח באמצעות 70% אתנול.
- הכן שני מזרקים של 1 מ"ל עם מחטים בגודל 25 עד 27. להזרקה תת עורית אנו ממליצים להשתמש במזרק מיקרו כדי להזריק 10 מיקרוליטר בכרית כף הרגל העליונה.
- בשפופרת פלסטיק של 1.5 מ"ל, הכינו 200 מיקרוליטר של לקטין מצומד DyLight 488 מדולל ב-PBS סטרילי בריכוז סופי של 100 מיקרוגרם/מ"ל.
- בפלסטיק אחר, שפופרת של 1.5 מ"ל מכינה 100 מיקרוליטר של לקטין מצומד DyLight 649 מדולל ב-PBS סטרילי בריכוז סופי של 100 מיקרוגרם/מ"ל.
- מכינים צלחת בת 6 בארות המכילה PBS ושומרים אותה על קרח.
- הכינו תמיסה של 4% פרפורמלדהיד ו -30% סוכרוז.
2. תיוג רקמת שומן תת עורית, דם וכלי לימפה.
- להרדים את העכבר בשאיפה של 5% איזופלורן. העריכו את עומק ההרדמה על ידי צביטה חזקה של כף החיה כדי להבטיח שהחיה לא תיפגע במהלך ההליך. יש לשמור על ההרדמה עד סוף שלבי הזרקת הלקטין או עד להמתת חסד.
- הזריק 100 מיקרוליטר של לקטין מצומד DyLight 488 תוך ורידי לווריד הזנב כדי לסמן את כלי הדם בדם. המתן 15 דקות לפני שתמשיך לקצירת רקמות.
- בעזרת מזרק אחר, יש להזריק 10 מיקרוליטר של לקטין מצומד DyLight 649 תת עורי על כרית כף הרגל העליונה של החיה כדי לסמן את כלי הלימפה המנקזים. המתן 15 דקות לפני שתמשיך לקצירת רקמות.
- המתת חסד של העכבר על ידי פריקת צוואר הרחם או חשיפה ל-CO2 15 דקות לאחר ההזרקה.
3. קצירת רקמת שומן תת עורית
- הנח את העכבר על גבו על לוח חיתוך.
- עקר את פרוות העכבר באמצעות 70% אתנול.
- הרם את עור האגף בעזרת מלקחיים ובצע חתך רוחבי כדי לחשוף את כרית השומן הברכיאלי.
- משוך בעדינות את העור כדי לנתק אותו ממחסן רקמות השומן הברכיאלי, ובכך לחשוף את כל רקמת השומן התת עורית המכילה את בלוטת הלימפה וכלי האספן הלימפטי.
- בעזרת מלקחיים ומספריים, הסר בעדינות מצבורי שומן תת עוריים והעביר אותם לכלי המכיל PBS קר. לקבלת התוצאות הטובות ביותר, אנו ממליצים להסיר את מחסני השומן כמקשה אחת.
- מכאן והלאה, הגן על הרקמה מפני אור.
4. קיבוע רקמות
- טבלו את הרקמה שנקטפה בתמיסה המכילה 4% פרפורמלדהיד ו-30% סוכרוז.
- דגרו את הרקמה בתמיסה זו לפחות למשך הלילה לפני הכנתה להדמיה.
5. צביעה והדמיה
- לקבלת תוצאות מיטביות, בצע ניקוי רקמות ורכישה קונפוקלית תלת מימדית כפי שתוארו על ידי גילרון ועמיתיו20. אנו ממליצים להשתמש במיקרוסקופ גיליון אור לניתוח רקמות גדולות. ניתן לבצע צביעה נוספת במהלך תהליך הפינוי.
- כדי להשיג מיפוי רקמות מיטבי, השתמש בנוגדנים הבאים:
עבור אדיפוציטים: פריליפין
למקרופאגים: צביעת CD68 ו-CD11b.
לתאים דנדריטיים: MHC II ו- CD11b.
לתאי B: צביעת B220 (CD45R).
לתאי T: צביעת CD3.
הערה: שיטה זו תואמת לשימוש במודלים גנטיים לסימון תאים חיסוניים. - לניתוח כלי האספן הלימפטי על ידי מיקרוסקופ דו-פוטוני תוך-חיוני יש להזריק את הלקטין באופן תת עורי בכרית כף הרגל התחתונה ולדמיין את כלי האיסוף הלימפטי הפופליטאלי.
תוצאות
כדי לבצע ניתוח טופולוגי של רקמת השומן הברכיאלית דם ורשתות כלי לימפה, הזרקנו תת עורית לקטין מצומד Alexa Fluor 649, והזרקנו תוך ורידי לקטין מצומד Alexa Fluor 488. רקמת השומן הברכיאלית נכרתה בקפידה, תוקנה, הוגשה לפרוטוקול ניקוי ונותחה על ידי צביעה שלמה. ייצוג סכמטי של ההליך כלול באיור 1A. כלי הדם מסומנים בירוק והלימפה באדום. רקמת השומן הברכיאלית מכילה כלי אספן לימפטי יחיד שנכנס לבלוטת הלימפה הברכיאלית. פרסמנו בעבר את התוצאות שהתקבלו בשיטה זו16. יתר על כן, השגנו נתונים דומים באמצעות תיוג לימפטי גנטי (Prox1creERT2 x TdTomatofl/fl meme)16 (איור 1B). כלי הדם סומנו ביעילות (בכחול) לאחר הזרקת לקטין IV. מעניין, הזרקת לקטין תת עורית סימנה את כלי האספן הלימפטי (באדום) (איור 1B). כדי להבטיח שכלי הלימפה וכלי הדם יסומנו באופן ספציפי, ניצלנו את עכברי Prox1creERT2 x TdTomatofl/fl . מתן לקטין תת עורי תייג באופן ספציפי רק את כלי הלימפה, כפי שמודגם על ידי הלוקליזציה המשותפת עם מדווח Prox1 (איור 1B). זיהינו גם כלי אספן לימפטי שני שנצבע חיובי עבור Prox1 אך לא עבור לקטין שהוזרק תת עורית (איור 1B). זה יכול להיות כלי האספן היוצא מבלוטת הלימפה הברכיאלית. ניתן להסביר את היעדר צביעת הלקטין על ידי: 1) בעיה קינטית, בהנחה ש-15 דקות אינן מספיקות ליציאה של הלקטין מבלוטת הלימפה המנקזת; 2) כמות לא מספקת של לקטין מוזרקת, המספקת רק תיוג בקולט הנכנס הראשון ובבלוטת הלימפה הברכיאלית. נקודות אלה דורשות חקירה נוספת וניתן להשתמש בהן כדי לייעל את הפרוטוקול הנוכחי המתואר בכתב יד זה. צביעת MHC II (בירוק) חשפה נוכחות של תאים מציגי אנטיגן רבים, ככל הנראה תאים דנדריטיים, ברקמת השומן התת-עורית של הזרוע (איור 1C). אותה תצפית נעשתה בעכברים מדווחים Prox1 שהוצלבו לעכברים מדווחים CD11cYFP (איור 1D).
כדי לאשר עוד יותר ששיטת תיוג הלקטין צובעת באופן ספציפי כלי לימפה, ביצענו צביעת פודופלנין ברקמת השומן הברכיאלית שחולצה מעכברים מדווחים CD11c-YFP. צביעת פודופלנין מסמנת ביעילות תאי אנדותל לימפתיים. שוב, השגנו תוצאות דומות לשיטת הזרקת הלקטין שלנו (איור 1E). לפיכך, אנו מאמינים כי הפרוטוקול מתאים היטב לניתוח מבנה הלימפה וכלי הדם ברקמת שומן בריאה ומודלקת. הליך זה ניתן לשחזור בקלות רבה.
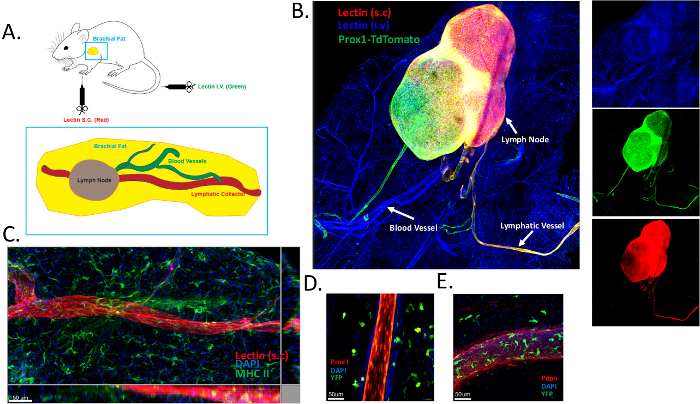
איור 1: תיוג של כלי דם ולימפה ברקמת השומן התת עורית. (A) ייצוג סכמטי של רקמת שומן תת-עורית ברכיאלית שמכילה את בלוטת הלימפה הברכיאלית. לקטין מצומד DyLight 649 (אדום) הוזרק תת עורית (s.c) כדי להמחיש את כלי הדם הלימפתיים המנקזים, ו-DyLight 488-לקטין מצומד ניתן תוך ורידי (i.v) על מנת למפות את כלי הדם בדם. (B) תמונה מייצגת שממחישה תיוג דם (בכחול) ולימפה (אדום וירוק) באמצעות הפרוטוקול שמתואר בפאנל A. עכברי Prox1-TdTomato (בירוק) שימשו בניסוי זה כדי להבטיח שהלקטינים נקשרים בנפרד לתאי הדם והאנדותל הלימפתי. (C) זיהוי כלי האיסוף הלימפטי ברקמת השומן התת עורית הברכיאלית באמצעות מתן לקטין. תאים מציגי אנטיגן סומנו באמצעות צביעת MHC-II (ירוק). (ד,ה) זיהוי כלי לימפה ברקמת השומן התת עורית הברכיאלית של עכברים מדווחים CD11cYFP שעברו חציית עכברי Prox1cre x TdTomatofl/fl (D) או מוכתמים לפודופלנין (Pdpn) (E). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
גישה זו מספקת תיוג יעיל וחזק של כלי הדם וכלי הדם הלימפתיים של רקמת השומן התת עורית. הניתוח הנפרד של רשתות האנדותל של הדם והלימפה עשוי לחשוף מנגנונים פתולוגיים המשפיעים על אחת ממערכות הדם או על שתיהן במהלך השמנת יתר או מצבים פתולוגיים אחרים. פרוטוקול זה נועד לנתח את הארכיטקטורה של מערכות כלי הדם, האינטראקציה שלהן עם תאי סטרומה ומערכת החיסון, והתפקוד שלהן במהלך בריאות וחולי.
השיטה מקלה על ידי נוכחות בלוטת הלימפה המנקזת את העור הברכיאלי, המוטמעת ברקמת שומן תת עורית. כפי שמוצג באיור 1, השיטה מספקת תוצאות דומות לתיוג מדווח גנטי או צביעת נוגדנים, תוך שהיא פטורה מהאזהרות שדנו בהן קודם. זה לא רק מספק דרך מעשית לתיוג נפרד של כלי דם ולימפה, אלא גם מספק קריאות מרובות על הפונקציונליות של האחרונים ועל הבריאות הכללית של הרקמה. יש לציין כי הופעת הצבע בחלל הרקמה הבין-רקמית יכולה להצביע על חדירות מוגברת של כלי הדם. יתר על כן, ניתן לנתח את נוכחות הצבע בבלוטת הלימפה המנקזת באופן מהלך זמן כמדד יחסי לקצב זרימת הלימפה.
פרמטר נוסף שיש לקחת בחשבון הוא הקשר של לויקוציטים עם דם וכלי לימפה. ידוע שתאי חיסון, ובמיוחד מקרופאגים, תאים דנדריטיים ותאי B, ממלאים תפקיד מפתח בהשמנת יתר21. יש לציין כי דיווחנו בעבר על התפקיד שממלאים תאים דנדריטיים בבקרת חדירות הלימפה16. לכן אנו ממליצים בחום לשלב תיוג של כלי דם ולימפה עם תיוג של תאי חיסון של רקמת שומן תת עורית כדי לקבוע את המיקום שלהם ביחס לשני כלי הדם. ניתן להשיג תיוג ספציפי לסוג התא על ידי צביעת נוגדנים מסורתית או על ידי שימוש בעכברים מדווחים (למשל, CD11cYFP, CX3CR1GFP, Zbtb46GFP, LysMCre x tdTomatofl/fl) ובמקרה זה יש להתאים את הפלואורוכרומים המשמשים לתיוג לקטין. ניתן להעריך שינויים במספר השומן או במורפולוגיה באמצעות צביעת פריליפין, המספקת גם דרך מצוינת למיפוי מבנה הרקמה.
לבסוף, למרות שהמתודולוגיה מתוארת כאן כך שתתאים לגישת הדמיה קונפוקלית תלת מימדית, התאמנו בעבר פרוטוקול זה להדמיה תוך-חיונית16. לגישה חלופית זו יש יתרון בכך שהיא מספקת מידע נוסף על תנועתיות תאי מערכת החיסון בתוך ומסביב לכלי איסוף הלימפה, כמו גם על התכווצות כלי הדם. לכן אנו מציעים תיוג לקטין של כלי דם ולימפה כגישה רב-תכליתית לחקר הביולוגיה של רקמת השומן בבריאות וחולי.
Disclosures
למחברים אין גילוי נאות וניגוד אינטרסים להצהיר עליהם.
Acknowledgements
SI נתמך על ידי המכון הלאומי למחקר רפואי (INSERM) והסוכנות הלאומית למחקר (ANR-17-CE14-0017-01 ו-ANR-19-ECVD-0005-01). AG נתמכת על ידי ממשלת צרפת, באמצעות פרויקטי UCAJedi Investments in the Future המנוהלים על ידי סוכנות המחקר הלאומית (ANR) עם מספר סימוכין ANR-15-IDEX-01. RSC נתמך על ידי FA-2020-01-IBD-1 מקרן לורנס סי פאקולה, MD IBD לחינוך וחדשנות".
Materials
| Name | Company | Catalog Number | Comments |
| Lectin DyLight 649 | Vector Labs | DL-1178-1 | Described in protocol |
| Lectin DyLight 488 | Vector Labs | DL-1174 | Described in protocol |
| Paraformaldehyde | VWR Chemicals | 9713.1000 | |
| Sucrose | Euromedex | CAS Number 57-50-1 | |
| Anti-Podoplanin | AngioBio | 11-033 | Dilution : 1/50 |
| Lectin DyLight 594 | Vector Labs | DL-1177 | Described in protocol |
| Anti-MHCII (Clone M5/114.15.2) | Biolegend | 107618 | Dilution : 1/100 |
| Anti-CD11b (Clone M1/70) | Biolegend | 101218 | Dilution : 1/100 |
| Anti-CD68 (Clone FA.11) | Biolegend | 137004 | Dilution : 1/100 |
| Anti-B220 (Clone RA3-6B2) | Biolegend | 103225 | Dilution : 1/100 |
| Anti-Perilipin (Clone PERI 112.17) | Progen | 651156 | Dilution : 1/50 |
| Anti-CD3 (Clone 17A2) | Biolegend | 100210 | Dilution : 1/100 |
References
- Baluk, P., et al. Functionally specialized junctions between endothelial cells of lymphatic vessels. Journal of Experimental Medicine. 204 (10), 2349-2362 (2007).
- Fonseca, D. M., et al. Microbiota-Dependent Sequelae of Acute Infection Compromise Tissue-Specific Immunity. Cell. 163 (2), 354-366 (2015).
- Thomas, S. N., et al. Impaired humoral immunity and tolerance in K14-VEGFR-3-Ig mice that lack dermal lymphatic drainage. The Journal of Immunology. 189 (5), 2181-2190 (2012).
- Kuan, E. L., et al. Collecting lymphatic vessel permeability facilitates adipose tissue inflammation and distribution of antigen to lymph node-homing adipose tissue dendritic cells. The Journal of Immunology. 194 (11), 5200-5210 (2015).
- Randolph, G. J., Ivanov, S., Zinselmeyer, B. H., Scallan, J. P. The Lymphatic System: Integral Roles in Immunity. Annual Review of Immunology. 35, 31-52 (2017).
- Harvey, N. L., et al. Lymphatic vascular defects promoted by Prox1 haploinsufficiency cause adult-onset obesity. Nature Genetics. 37 (10), 1072-1081 (2005).
- Kajimura, S., Spiegelman, B. M., Seale, P. Brown and Beige Fat: Physiological Roles beyond Heat Generation. Cell Metabolism. 22 (4), 546-559 (2015).
- Wu, J., Cohen, P., Spiegelman, B. M. Adaptive thermogenesis in adipocytes: is beige the new brown. Genes and Development. 27 (3), 234-250 (2013).
- Cinti, S. The adipose organ. Prostaglandins, Leukotrienes & Essential Fatty Acids. 73 (1), 9-15 (2005).
- Kataru, R. P., et al. Regulation of Lymphatic Function in Obesity. Frontiers in Physiology. 11, 459 (2020).
- Escobedo, N., Oliver, G. The Lymphatic Vasculature: Its Role in Adipose Metabolism and Obesity. Cell Metabolism. 26 (4), 598-609 (2017).
- Weitman, E. S., et al. Obesity impairs lymphatic fluid transport and dendritic cell migration to lymph nodes. PLoS One. 8 (8), 70703 (2013).
- Escobedo, N., et al. Restoration of lymphatic function rescues obesity in Prox1-haploinsufficient mice. JCI Insight. 1 (2), (2016).
- Commerford, C. D., et al. Mechanisms of Tumor-Induced Lymphovascular Niche Formation in Draining Lymph Nodes. Cell Reports. 25 (13), 3554-3563 (2018).
- Gregory, J. L., et al. Infection Programs Sustained Lymphoid Stromal Cell Responses and Shapes Lymph Node Remodeling upon Secondary Challenge. Cell Reports. 18 (2), 406-418 (2017).
- Ivanov, S., et al. CCR7 and IRF4-dependent dendritic cells regulate lymphatic collecting vessel permeability. Journal of Clinical Investigation. 126 (4), 1581-1591 (2016).
- Zhong, W., et al. Prox1-GFP/Flt1-DsRed transgenic mice: an animal model for simultaneous live imaging of angiogenesis and lymphangiogenesis. Angiogenesis. 20 (4), 581-598 (2017).
- Choi, I., et al. Visualization of lymphatic vessels by Prox1-promoter directed GFP reporter in a bacterial artificial chromosome-based transgenic mouse. Blood. 117 (1), 362-365 (2011).
- Pham, T. H., et al. Lymphatic endothelial cell sphingosine kinase activity is required for lymphocyte egress and lymphatic patterning. Journal of Experimental Medicine. 207 (1), 17-27 (2010).
- Gilleron, J., et al. Exploring Adipose Tissue Structure by Methylsalicylate Clearing and 3D Imaging. Journal of Visualized Experiments. (162), e61640 (2020).
- Ivanov, S., Merlin, J., Lee, M. K. S., Murphy, A. J., Guinamard, R. R. Biology and function of adipose tissue macrophages, dendritic cells and B cells. Atherosclerosis. 271, 102-110 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved