Method Article
肥胖期间的淋巴和血液网络分析
* 这些作者具有相同的贡献
摘要
肥胖是一个日益严重的全球公共卫生问题。它以前与淋巴功能障碍有关,表明脂肪组织和淋巴系统之间存在重要的串扰。在这里,我们提出了一种可访问的方法,允许在皮下脂肪组织内对血液和淋巴管系统进行独特标记。
摘要
淋巴集合血管和淋巴结不可避免地嵌入脂肪组织中。这一观察的生理意义仍未阐明。然而,肥胖的特征是淋巴功能受损和血管通透性增加。相反,淋巴功能障碍会诱导小鼠肥胖,表明淋巴管和脂肪组织之间存在显着的相互作用。因此,了解导致淋巴功能障碍的因素可能会为预防肥胖和相关合并症打开新的治疗窗口。此过程的第一步需要对健康和发炎的脂肪组织中的淋巴网络进行精确和详细的可视化。在这里,我们描述了一种快速、廉价且有效的方法,可以标记和分析淋巴管和血管。这种方法利用了皮下脂肪组织内皮肤引流的肱淋巴结定位。该组织的淋巴树枝化可以通过皮下注射荧光染料偶联的凝集素来揭示。此外,体内标记方法提供了一种评估淋巴管密度和功能的方法。该方案与血管、脂肪细胞和免疫细胞染色相结合,允许通过 3D 成像对皮下脂肪组织进行高分辨率映射。
引言
淋巴循环系统在维持组织稳态和诱导有效免疫反应方面起着至关重要的作用。淋巴管与血管平行,将间质液、代谢物和免疫细胞输送到局部引流淋巴结 (LN),最后输送到静脉循环1。在感染、炎症和代谢疾病期间观察到功能失调的淋巴引流 2,3,4,5。淋巴管系统由称为淋巴毛细血管的小血管组成。淋巴毛细血管由单层薄的淋巴内皮细胞 (LEC) 形成,其特征是开放连接(“纽扣状”连接),促进间质液、代谢物和免疫细胞(主要是树突状细胞 (DC) 和 T 细胞)进入淋巴毛细血管腔5。淋巴毛细血管合并成更大的血管,称为淋巴集合血管。淋巴收集器的特征是一层 LEC 被肌肉层包围,提供自主收缩张力并维持液体流动5。此外,收集血管具有确保单向淋巴液流的阀门。
收集器和毛细血管的 LEC 表达一组特定的标志物,这些标志物将它们与血液内皮细胞 (BEC) 区分开来。在这些因子中,Prox1 是指导 LEC 生成的转录因子,在 LEC 中高度表达,而在 BEC 中不存在。Prox1 缺陷小鼠的生成和分析说明了 Prox1 在 LECs 生物学中的关键参与6。Prox1 杂合子小鼠的淋巴管系统发育有缺陷,其特征是淋巴管密度降低和血管通透性增加6。LEC 高度表达 VEGFR3、Podoplanin 和 CCL215。这些标志物在 BEC 上没有发现,允许分别分析淋巴管和血管的网络。Lyve1 由淋巴毛细血管选择性表达,而在收集血管上不存在5。
已经根据它们的线粒体含量和随后的颜色描述了三种类型的脂肪组织。富含线粒体的产热棕色脂肪组织在寒冷暴露期间起关键作用,位于小鼠的肩胛间区域 7,8。白色和米色脂肪细胞的线粒体密度较低,主要以脂滴的形式参与能量储存。白色和米色脂肪细胞位于内脏和皮下仓库9。
临床观察确定了肥胖与淋巴功能障碍之间的联系10。肥胖会引起脂肪组织淋巴管系统的形态变化,并导致淋巴运输受损11。临床前模型中的数据显示,高脂肪饮食 (HFD) 会诱导淋巴重塑,肥胖小鼠的淋巴结较小,淋巴管数量较少12。然而,控制这种表型的确切分子机制仍有待阐明。在淋巴管发育受损的遗传模型中的观察进一步支持了肥胖期间 LECs 的参与。如前所述,Prox1 杂合子小鼠 (Prox1+/-) 表现出功能不良的淋巴系统,与 Prox1 足够的动物相比,巧合的是出现过多的内脏脂肪组织积累6。有趣的是,这种脂肪组织表型通过恢复淋巴功能来挽救13。总之,这些结果揭示了淋巴管和脂肪组织之间的紧密相互联系,这需要进一步研究。
在炎症的情况下,肥胖的标志,LEC 和 BEC 标志物表达的改变会影响通过经典抗体染色对这些细胞的分析14,15。已经开发了专门标记 LEC 和 BEC 的遗传模型,并允许缓解这个问题 16,17,18,19。然而,使用遗传报告基因系需要多个育种步骤,并大大增加了项目的长度和成本。因此,我们建议使用荧光染料偶联的凝集素注射来研究皮下脂肪组织中的血液和淋巴循环系统,这是一种简单且相对不昂贵的方法。与各种荧光染料偶联的凝集素在市场上有售,可以静脉注射以标记血管,或皮下注射以标记嵌入皮下脂肪组织中的皮肤引流淋巴管。这种方法依赖于每次注射使用单独的荧光染料-凝集素偶联物,并允许对每个脉管系统进行不同的标记。这种方法还与使用遗传模型标记淋巴管或脉管系统网络兼容。重要的是,它提供了多个读数来分析皮下脂肪组织以及灌注它的血液和淋巴管系统的整体健康状况。该程序可以很容易地应用于分析急性和慢性皮肤病(包括牛皮癣和感染)期间的淋巴和血管系统网络。
研究方案
所有动物实验均按照当地伦理委员会进行。
注:Prox1-cre-ERT2 (Prox1tm3(cre/ERT2)Gco/J, Jax #022075) 和 Rosa26-LSL-tdTomato (B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze/J, Ai9, Jax #007914) 从杰克逊实验室获得并杂交得到诱导型淋巴报告小鼠系 Prox1-cre-ERT2::tdTomato。小鼠回交至 C57BL/6 背景 10 代。6 周龄 Prox1-cre-ERT2::tdTomato 雄性小鼠接受他莫昔芬饮食 3 周。来自 Envigo Teklad 的他莫昔芬饮食(饮食编号。编号:TD.130857;500 mg/kg)。在 12-14 周龄的小鼠中进行了实验。该协议适用于任何年龄、性别或品系的小鼠。
1. 材料准备
- 使用 70% 乙醇对剪刀、镊子和解剖针进行消毒。
- 准备两个 1 mL 注射器,配备 25 至 27 号针头。对于皮下注射,我们建议使用微型注射器在上足垫中注射 10 μL。
- 在 1.5 mL 塑料管中,制备 200 μL DyLight 488 偶联的凝集素,用无菌 PBS 稀释,终浓度为 100 μg/mL。
- 在另一种塑料中,1.5 mL 试管制备 100 μL DyLight 649 偶联的凝集素,在无菌 PBS 中稀释,终浓度为 100 μg/mL。
- 准备一个含有 PBS 的 6 孔板并将其保存在冰上。
- 制备 4% 多聚甲醛和 30% 蔗糖的溶液。
2. 皮下脂肪组织血液和淋巴管的标记。
- 通过吸入 5% 异氟醚麻醉小鼠。通过用力捏住动物的爪子来评估麻醉深度,以确保动物在手术过程中不受伤害。麻醉应维持至凝集素注射步骤结束或直至安乐死。
- 在尾静脉静脉内静脉注射 100 μL DyLight 488 偶联的凝集素以标记脉管系统。等待 15 分钟,然后再进行组织收获。
- 使用不同的注射器,在动物的上足垫皮下注射 10 μL DyLight 649 偶联的凝集素,以标记引流的淋巴管。等待 15 分钟,然后再进行组织收获。
- 注射后 15 分钟通过宫颈脱位或暴露于 CO2 对小鼠实施安乐死。
3. 皮下脂肪组织的采集
- 将鼠标仰卧在解剖板上。
- 使用 70% 乙醇对小鼠的皮毛进行消毒。
- 使用镊子提起侧腹皮肤,并做一个横向切口,露出肱脂肪垫。
- 轻轻拉动皮肤,使其与肱脂肪组织库分离,从而露出包含淋巴结和淋巴收集血管的整个皮下肱脂肪组织。
- 使用镊子和剪刀轻轻去除皮下脂肪库,并将它们转移到含有冷 PBS 的培养皿中。为获得最佳效果,我们建议将脂肪库作为一个整体移除。
- 从这里开始,保护组织免受光线照射。
4. 组织固定
- 将收获的组织浸入含有 4% 多聚甲醛和 30% 蔗糖的溶液中。
- 在准备成像之前,将组织在该溶液中孵育至少过夜。
5. 染色和成像
- 为获得最佳结果,请按照 Gilleron 及其同事20 的描述进行组织透明化和 3D 共聚焦采集。我们建议使用光片显微镜分析大组织。在透明化过程中可以进行额外的染色。
- 为了实现最佳组织标测,请使用以下抗体:
对于脂肪细胞:Perilipin
对于巨噬细胞:CD68 和 CD11b 染色。
对于树突状细胞:MHC II 和 CD11b。
对于 B 细胞:B220 (CD45R) 染色。
对于 T 细胞:CD3 染色。
注:该方法与使用遗传模型标记免疫细胞兼容。 - 为了通过活体 2 光子显微镜分析淋巴收集血管,将凝集素皮下注射到下足垫中并观察腘淋巴集合血管。
结果
为了对肱脂肪组织血液和淋巴管网络进行拓扑分析,我们皮下注射了 Alexa Fluor 649 偶联的凝集素,并静脉注射了 Alexa Fluor 488 偶联的凝集素。仔细切除肱脂肪组织,固定,提交透明化方案,并通过整体染色进行分析。该程序的示意图包含在 图 1A 中。血管标记为绿色,淋巴管标记为红色。肱脂肪组织包含一个进入肱淋巴结的淋巴集水管。我们之前发表了通过这种方法获得的结果16。此外,我们使用遗传淋巴标记 (Prox1creERT2 x TdTomatofl/fl 小鼠) 16 获得了类似的数据 (图 1B)。静脉注射凝集素后,血管系统被有效标记(蓝色)。有趣的是,皮下凝集素注射标记了淋巴集水管(红色)(图 1B)。为了确保淋巴管和血管得到特异性标记,我们利用了 Prox1creERT2 x TdTomatofl/fl 小鼠。皮下凝集素给药仅特异性标记淋巴管,如与 Prox1 报告基因的共定位所示(图 1B)。我们还检测到第二个淋巴收集血管,其 Prox1 染色阳性,但皮下注射的凝集素未染色(图 1B)。这可能是离开肱淋巴结的传出集管。凝集素染色的缺失可以用以下原因解释:1) 动力学问题,假设 15 分钟不足以让凝集素从引流淋巴结中排出;2) 注射的凝集素量不足,仅在第一传入收集器和肱淋巴结中提供标记。这些要点需要进一步调查,并可能用于优化本手稿中描述的当前协议。MHC II 染色(绿色)显示皮下臂脂肪组织中存在许多抗原呈递细胞,可能是树突状细胞(图 1C)。在与 CD11cYFP 报告小鼠杂交的 Prox1 报告小鼠中进行了相同的观察(图 1D)。
为了进一步确认凝集素标记方法特异性地对淋巴管进行染色,我们在从 CD11c-YFP 报告小鼠中提取的臂脂肪组织中进行了 podoplanin 染色。Podoplanin 染色可有效标记淋巴内皮细胞。同样,我们获得了与我们的凝集素注射方法相似的结果(图 1E)。因此,我们相信该方案非常适合分析健康和发炎脂肪组织中的淋巴和血管结构。该程序具有高度且易于重现性。
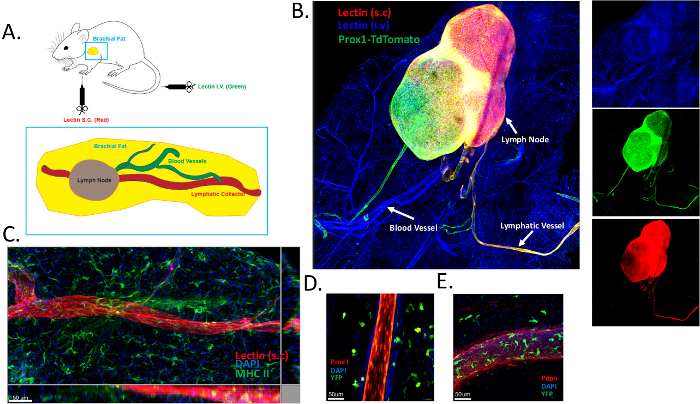
图 1:皮下脂肪组织中血液和淋巴管系统的标记。 (A) 包含肱淋巴结的肱骨皮下脂肪组织的示意图。皮下 (s.c) 注射 DyLight 649 偶联的凝集素(红色)以观察引流的淋巴管系统,并静脉内 (i.v) 施用 DyLight 488 偶联的凝集素以绘制脉管系统。 (B) 使用图 A 中描述的方案说明血液(蓝色)和淋巴(红色和绿色)标记的代表性图像。本实验使用 Prox1-TdTomato (绿色) 小鼠确保凝集素分别与血液和淋巴内皮细胞结合。 (C) 使用凝集素给药鉴定肱骨髓下脂肪组织中的淋巴集合血管。使用 MHC-II 染色 (绿色) 标记抗原呈递细胞。 (D,E) 鉴定 CD11cYFP 报告小鼠与 Prox1cre x TdTomatofl/fl 小鼠 (D) 杂交或鬼臼素 (Pdpn) 染色 (E) 的肱骨皮下脂肪组织中的淋巴管。 请单击此处查看此图的较大版本。
讨论
这种方法为皮下脂肪组织的血液和淋巴管系统提供了有效和稳健的标记。血液和淋巴内皮网络的单独分析可能会揭示在肥胖或其他病理条件下影响一个或两个循环系统的病理机制。该协议旨在分析血管系统的结构、它们与基质细胞和免疫细胞的相互作用以及它们在健康和疾病期间的功能。
该方法通过嵌入皮下脂肪组织的臂皮肤引流淋巴结的存在而得到促进。如图 1 所示,该方法提供了与遗传报告基因标记或抗体染色相似的结果,同时也免除了我们之前讨论的注意事项。它不仅提供了一种单独标记血液和淋巴管系统的实用方法,而且还提供了有关后者功能和组织整体健康状况的多个读数。值得注意的是,染料在间质组织间隙中的出现可能表明血管通透性增加。此外,可以按时间过程方式分析引流淋巴结中染料的存在,作为淋巴流速的相对测量。
另一个需要考虑的参数是白细胞与血液和淋巴管的关联。已知免疫细胞,尤其是巨噬细胞、树突状细胞和 B 细胞,在肥胖中起关键作用21。值得注意的是,我们之前报道了树突状细胞在控制淋巴通透性中的作用16。因此,我们强烈建议将血液和淋巴管系统的标记与皮下脂肪组织免疫细胞的标记相结合,以确定它们相对于两种脉管系统的定位。细胞类型特异性标记可以通过传统抗体染色或使用报告小鼠(例如,CD11cYFP、CX3CR1GFP、Zbtb46GFP、LysMCre x tdTomatofl/fl)来实现,在这种情况下,必须适应用于凝集素标记的荧光染料。使用 perilipin 染色可以了解脂肪细胞数量或形态的变化,这也提供了一种绘制组织结构的好方法。
最后,尽管此处描述了该方法以适应 3D 共聚焦成像方法,但我们之前已将此方案用于活体成像16。这种替代方法的好处是提供有关淋巴收集血管内部和周围的免疫细胞运动以及血管收缩力的额外信息。因此,我们建议将血液和淋巴管系统的凝集素标记作为研究健康和疾病中脂肪组织生物学的通用方法。
披露声明
作者无需声明任何披露和利益冲突。
致谢
SI 得到了 Institut National de la Sante et de la Recherche Medicale (INSERM) 和 Agence Nationale de la Recherche (ANR-17-CE14-0017-01 和 ANR-19-ECVD-0005-01) 的支持。AG 得到法国政府的支持,通过由国家研究机构 (ANR) 管理的 UCAJedi 未来投资项目,参考编号为 ANR-15-IDEX-01。RSC得到了Lawrence C. Pakula, MD IBD教育与创新基金的FA-2020-01-IBD-1的支持。
材料
| Name | Company | Catalog Number | Comments |
| Lectin DyLight 649 | Vector Labs | DL-1178-1 | Described in protocol |
| Lectin DyLight 488 | Vector Labs | DL-1174 | Described in protocol |
| Paraformaldehyde | VWR Chemicals | 9713.1000 | |
| Sucrose | Euromedex | CAS Number 57-50-1 | |
| Anti-Podoplanin | AngioBio | 11-033 | Dilution : 1/50 |
| Lectin DyLight 594 | Vector Labs | DL-1177 | Described in protocol |
| Anti-MHCII (Clone M5/114.15.2) | Biolegend | 107618 | Dilution : 1/100 |
| Anti-CD11b (Clone M1/70) | Biolegend | 101218 | Dilution : 1/100 |
| Anti-CD68 (Clone FA.11) | Biolegend | 137004 | Dilution : 1/100 |
| Anti-B220 (Clone RA3-6B2) | Biolegend | 103225 | Dilution : 1/100 |
| Anti-Perilipin (Clone PERI 112.17) | Progen | 651156 | Dilution : 1/50 |
| Anti-CD3 (Clone 17A2) | Biolegend | 100210 | Dilution : 1/100 |
参考文献
- Baluk, P., et al. Functionally specialized junctions between endothelial cells of lymphatic vessels. Journal of Experimental Medicine. 204 (10), 2349-2362 (2007).
- Fonseca, D. M., et al. Microbiota-Dependent Sequelae of Acute Infection Compromise Tissue-Specific Immunity. Cell. 163 (2), 354-366 (2015).
- Thomas, S. N., et al. Impaired humoral immunity and tolerance in K14-VEGFR-3-Ig mice that lack dermal lymphatic drainage. The Journal of Immunology. 189 (5), 2181-2190 (2012).
- Kuan, E. L., et al. Collecting lymphatic vessel permeability facilitates adipose tissue inflammation and distribution of antigen to lymph node-homing adipose tissue dendritic cells. The Journal of Immunology. 194 (11), 5200-5210 (2015).
- Randolph, G. J., Ivanov, S., Zinselmeyer, B. H., Scallan, J. P. The Lymphatic System: Integral Roles in Immunity. Annual Review of Immunology. 35, 31-52 (2017).
- Harvey, N. L., et al. Lymphatic vascular defects promoted by Prox1 haploinsufficiency cause adult-onset obesity. Nature Genetics. 37 (10), 1072-1081 (2005).
- Kajimura, S., Spiegelman, B. M., Seale, P. Brown and Beige Fat: Physiological Roles beyond Heat Generation. Cell Metabolism. 22 (4), 546-559 (2015).
- Wu, J., Cohen, P., Spiegelman, B. M. Adaptive thermogenesis in adipocytes: is beige the new brown. Genes and Development. 27 (3), 234-250 (2013).
- Cinti, S. The adipose organ. Prostaglandins, Leukotrienes & Essential Fatty Acids. 73 (1), 9-15 (2005).
- Kataru, R. P., et al. Regulation of Lymphatic Function in Obesity. Frontiers in Physiology. 11, 459 (2020).
- Escobedo, N., Oliver, G. The Lymphatic Vasculature: Its Role in Adipose Metabolism and Obesity. Cell Metabolism. 26 (4), 598-609 (2017).
- Weitman, E. S., et al. Obesity impairs lymphatic fluid transport and dendritic cell migration to lymph nodes. PLoS One. 8 (8), 70703 (2013).
- Escobedo, N., et al. Restoration of lymphatic function rescues obesity in Prox1-haploinsufficient mice. JCI Insight. 1 (2), (2016).
- Commerford, C. D., et al. Mechanisms of Tumor-Induced Lymphovascular Niche Formation in Draining Lymph Nodes. Cell Reports. 25 (13), 3554-3563 (2018).
- Gregory, J. L., et al. Infection Programs Sustained Lymphoid Stromal Cell Responses and Shapes Lymph Node Remodeling upon Secondary Challenge. Cell Reports. 18 (2), 406-418 (2017).
- Ivanov, S., et al. CCR7 and IRF4-dependent dendritic cells regulate lymphatic collecting vessel permeability. Journal of Clinical Investigation. 126 (4), 1581-1591 (2016).
- Zhong, W., et al. Prox1-GFP/Flt1-DsRed transgenic mice: an animal model for simultaneous live imaging of angiogenesis and lymphangiogenesis. Angiogenesis. 20 (4), 581-598 (2017).
- Choi, I., et al. Visualization of lymphatic vessels by Prox1-promoter directed GFP reporter in a bacterial artificial chromosome-based transgenic mouse. Blood. 117 (1), 362-365 (2011).
- Pham, T. H., et al. Lymphatic endothelial cell sphingosine kinase activity is required for lymphocyte egress and lymphatic patterning. Journal of Experimental Medicine. 207 (1), 17-27 (2010).
- Gilleron, J., et al. Exploring Adipose Tissue Structure by Methylsalicylate Clearing and 3D Imaging. Journal of Visualized Experiments. (162), e61640 (2020).
- Ivanov, S., Merlin, J., Lee, M. K. S., Murphy, A. J., Guinamard, R. R. Biology and function of adipose tissue macrophages, dendritic cells and B cells. Atherosclerosis. 271, 102-110 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。