Method Article
Lymph- und Blutnetzwerkanalyse bei Adipositas
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Fettleibigkeit ist ein wachsendes globales Problem für die öffentliche Gesundheit. Sie wurde bereits früher mit lymphatischer Dysfunktion in Verbindung gebracht, was auf eine vitale Wechselwirkung zwischen dem Fettgewebe und dem Lymphsystem hindeutet. Hier schlagen wir eine zugängliche Methodik vor, die es ermöglicht, Blut- und Lymphgefäße innerhalb des subkutanen Fettgewebes eindeutig zu markieren.
Zusammenfassung
Lymphsammelgefäße und Lymphknoten sind zwangsläufig in das Fettgewebe eingebettet. Die physiologische Bedeutung dieser Beobachtung ist bis heute nicht geklärt. Adipositas ist jedoch durch eine gestörte Lymphfunktion und eine erhöhte Gefäßpermeabilität gekennzeichnet. Umgekehrt induziert eine lymphatische Dysfunktion bei Mäusen Fettleibigkeit, was auf ein signifikantes Zusammenspiel zwischen Lymphgefäßen und dem Fettgewebe hindeutet. Daher könnte das Verständnis von Faktoren, die zu lymphatischer Dysfunktion führen, neue therapeutische Fenster öffnen, um Adipositas und damit verbundene Komorbiditäten zu verhindern. Der erste Schritt in diesem Prozess erfordert eine genaue und detaillierte Visualisierung des lymphatischen Netzwerks in gesundem und entzündetem Fettgewebe. Hier beschreiben wir eine schnelle, kostengünstige und effiziente Methode, die es ermöglicht, Lymph- und Blutgefäße zu markieren und zu analysieren. Dieser Ansatz nutzt die Vorteile der hautdrainierenden Lokalisation der brachialen Lymphknoten innerhalb des subkutanen Fettgewebes. Die lymphatische Arborisierung dieses Gewebes kann durch subkutane Injektion von Fluorochrom-konjugierten Lektinen aufgedeckt werden. Darüber hinaus bietet der In-vivo-Markierungsansatz eine Möglichkeit, die Dichte und Funktion der Lymphgefäße zu bewerten. In Verbindung mit der Färbung von Blutgefäßen, Adipozyten und Immunzellen ermöglicht das Protokoll eine hochauflösende Kartierung des subkutanen Fettgewebes durch 3D-Bildgebung.
Einleitung
Das lymphatische Kreislaufsystem spielt eine entscheidende Rolle bei der Aufrechterhaltung der Gewebehomöostase und der Induktion effizienter Immunantworten. Lymphgefäße verlaufen parallel zu den Blutgefäßen und transportieren interstitielle Flüssigkeit, Metaboliten und Immunzellen zum lokalen drainierenden Lymphknoten (LN) und schließlich zum venösen Kreislauf1. Eine dysfunktionale Lymphdrainage wurde bei Infektionen, Entzündungen und Stoffwechselerkrankungen beobachtet 2,3,4,5. Das lymphatische Gefäßsystem besteht aus kleinen Gefäßen, die als Lymphkapillaren bezeichnet werden. Lymphkapillaren bestehen aus einer einzigen Schicht dünner lymphatischer Endothelzellen (LECs), die durch offene Verbindungen ("knopfähnliche" Verbindungen) gekennzeichnet sind, die den Eintritt von interstitieller Flüssigkeit, Metaboliten und Immunzellen, hauptsächlich dendritischen Zellen (DCs) und T-Zellen, in das lymphatische Kapillarlumen erleichtern5. Lymphkapillaren verschmelzen zu größeren Gefäßen, die als lymphatische Sammelgefäße bezeichnet werden. Lymphkollektoren zeichnen sich durch eine Schicht von LECs aus, die von einer Muskelschicht umgeben sind, die einen autonomen kontraktilen Tonus bereitstellt und den Flüssigkeitsfluss aufrechterhält5. Darüber hinaus verfügen Auffanggefäße über Ventile, die einen unidirektionalen Lymphfluss gewährleisten.
Die LECs von Kollektoren und Kapillaren exprimieren einen spezifischen Satz von Markern, die sie von Blutendothelzellen (BECs) unterscheiden. Unter diesen Faktoren ist Prox1 ein Transkriptionsfaktor, der die LECs-Bildung steuert und in LECs stark exprimiert wird, während er in BECs nicht vorhanden ist. Die entscheidende Beteiligung von Prox1 an der Biologie der LECs wurde durch die Erzeugung und Analyse von Prox1-defizienten Mäusen veranschaulicht6. Prox1-heterozygote Mäuse haben eine defekte lymphatische Gefäßentwicklung, die durch eine verminderte Lymphgefäßdichte und eine erhöhte Gefäßpermeabilität gekennzeichnet ist6. LECs exprimieren stark VEGFR3, Podoplanin und CCL215. Diese Marker sind auf BECs nicht zu finden und ermöglichen es, das Netzwerk von Lymph- und Blutgefäßen getrennt zu analysieren. Lyve1 wird selektiv von lymphatischen Kapillaren exprimiert, während es an Sammelgefäßen fehlt5.
Es wurden drei Arten von Fettgewebe beschrieben, die auf ihrem mitochondrialen Gehalt und der anschließenden Farbe basieren. Mitochondrienreiches thermogenes braunes Fettgewebe spielt eine Schlüsselrolle bei Kälteexposition und befindet sich bei Mäusen im interscapularen Bereich 7,8. Weiße und beige Adipozyten haben eine geringere mitochondriale Dichte und sind hauptsächlich an der Energiespeicherung in Form von Lipidtröpfchen beteiligt. Weiße und beige Adipozyten befinden sich in viszeralen und subkutanen Depots9.
Klinische Beobachtungen stellten einen Zusammenhang zwischen Adipositas und lymphatischer Dysfunktionher 10. Adipositas führt zu morphologischen Veränderungen des Fettgewebes, der lymphatischen Gefäße und führt zu einer Beeinträchtigung des Lymphtransports11. Daten, die in präklinischen Modellen gewonnen wurden, zeigten, dass eine fettreiche Diät (HFD) einen lymphatischen Umbau induziert und adipöse Mäuse kleinere Lymphknoten und eine geringere Anzahl von Lymphgefäßen haben12. Die genauen molekularen Mechanismen, die diesem Phänotyp zugrunde liegen, müssen jedoch noch aufgeklärt werden. Die Beteiligung von LECs bei Adipositas wird durch Beobachtungen in genetischen Modellen mit gestörter lymphatischer Gefäßentwicklung weiter unterstützt. Wie bereits erwähnt, weisen Prox1-heterozygote Mäuse (Prox1+/-) ein schlecht funktionierendes lymphatisches System auf und entwickeln zufällig eine übermäßige Ansammlung von viszeralem Fettgewebe im Vergleich zu Prox1-ausreichenden Tieren6. Interessanterweise wird dieser Fettgewebsphänotyp durch die Wiederherstellung der lymphatischen Funktion gerettet13. Zusammengenommen haben diese Ergebnisse starke Verbindungen zwischen den Lymphgefäßen und dem Fettgewebe ans Licht gebracht, die weiter untersucht werden müssen.
Im Zusammenhang mit Entzündungen, einem Kennzeichen von Adipositas, beeinträchtigt die veränderte Expression von LEC- und BEC-Markern die Analyse dieser Zellen mittels klassischer Antikörperfärbung14,15. Genetische Modelle zur spezifischen Markierung von LECs und BECs wurden entwickelt und ermöglichen es, dieses Problem zu lindern 16,17,18,19. Die Verwendung genetischer Reporterlinien erfordert jedoch mehrere Züchtungsschritte und erhöht die Länge und die Kosten eines Projekts erheblich. Daher schlagen wir vor, Fluorochrom-konjugierte Lektin-Injektionen zur Untersuchung des Blut- und Lymphkreislaufsystems im subkutanen Fettgewebe zu verwenden, ein einfacher und relativ kostengünstiger Ansatz. Lektin, das an verschiedene Fluorochrome konjugiert ist, ist kommerziell erhältlich und kann intravenös injiziert werden, um Blutgefäße zu markieren, oder subkutan, um die hautdrainierenden Lymphgefäße zu markieren, die in das subkutane Fettgewebe eingebettet sind. Dieser Ansatz beruht auf der Verwendung separater Fluorochrom-Lektin-Konjugate für jede Injektion und ermöglicht die unterschiedliche Markierung jedes Gefäßsystems. Diese Methode ist auch kompatibel mit der Verwendung genetischer Modelle zur Markierung des Lymph- oder Blutgefäßnetzwerks. Wichtig ist, dass es mehrere Messwerte liefert, um den allgemeinen Gesundheitszustand des subkutanen Fettgewebes und der Blut- und Lymphgefäße, die es durchbluten, zu analysieren. Dieses Verfahren könnte leicht angewendet werden, um die Lymph- und Blutgefäßnetzwerke bei akuten und chronischen Hauterkrankungen wie Psoriasis und Infektionen zu analysieren.
Protokoll
Alle Tierversuche wurden in Übereinstimmung mit den lokalen Ethikkommissionen durchgeführt.
HINWEIS: Prox1-cre-ERT2 (Prox1tm3(cre/ERT2)Gco/J, Jax #022075) und Rosa26-LSL-tdTomate (B6. Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze/J, Ai9, Jax #007914) wurden aus dem Jackson Laboratory gewonnen und gekreuzt, um die induzierbare lymphatische Reporter-Mauslinie Prox1-cre-ERT2::tdTomato zu erhalten. Die Mäuse wurden 10 Generationen lang auf den Hintergrund von C57BL/6 rückgekreuzt. Sechs Wochen alte männliche Prox1-cre-ERT2::tdTomato-Mäuse erhielten 3 Wochen lang Tamoxifen-Diät. Tamoxifen Diät von Envigo Teklad (Diät-Nr. TD.130857; 500 mg/kg) verwendet. Die Experimente wurden an 12-14 Wochen alten Mäusen durchgeführt. Dieses Protokoll gilt für Mäuse jeden Alters, Geschlechts und Stammes.
1. Materialvorbereitung
- Sterilisieren Sie Scheren, Pinzetten und Präpariernadeln mit 70% Ethanol.
- Bereiten Sie zwei 1-ml-Spritzen mit 25- bis 27-Gauge-Nadeln vor. Für die subkutane Injektion empfehlen wir die Verwendung einer Mikrospritze, um 10 μl in das obere Fußpolster zu injizieren.
- Bereiten Sie in einem 1,5-ml-Kunststoffröhrchen 200 μl DyLight 488-konjugiertes Lektin in sterilem PBS bei einer Endkonzentration von 100 μg/ml vor.
- In einem anderen Kunststoff-Röhrchen werden 1,5 ml 100 μl DyLight 649-konjugiertes Lektin hergestellt, das in sterilem PBS bei einer Endkonzentration von 100 μg/ml verdünnt ist.
- Bereiten Sie eine 6-Well-Platte mit PBS vor und stellen Sie sie auf Eis.
- Bereiten Sie eine Lösung aus 4 % Paraformaldehyd und 30 % Saccharose vor.
2. Markierung von subkutanem Fettgewebe, Blut und Lymphgefäßen.
- Betäuben Sie die Maus durch Inhalation von 5% Isofluran. Beurteilen Sie die Narkosetiefe, indem Sie die Pfote des Tieres fest einklemmen, um sicherzustellen, dass das Tier während des Eingriffs nicht verletzt wird. Die Anästhesie sollte bis zum Ende der Lektininjektionsschritte oder bis zur Euthanasie aufrechterhalten werden.
- Injizieren Sie 100 μl DyLight 488-konjugiertes Lektin intravenös in die Schwanzvene, um das Blutgefäßsystem zu markieren. Warten Sie 15 Minuten, bevor Sie mit der Gewebeentnahme fortfahren.
- Injizieren Sie mit einer anderen Spritze 10 μl DyLight 649-konjugiertes Lektin subkutan auf den oberen Fußballen des Tieres, um die drainierenden Lymphgefäße zu markieren. Warten Sie 15 Minuten, bevor Sie mit der Gewebeentnahme fortfahren.
- Euthanasieren Sie die Maus durch Gebärmutterhalsluxation oder Exposition gegenüber CO2 15 Minuten nach der Injektion.
3. Entnahme von subkutanem Fettgewebe
- Lege die Maus auf den Rücken auf ein Sezierbrett.
- Sterilisieren Sie das Fell der Maus mit 70% Ethanol.
- Heben Sie die Haut der Flanke mit einer Pinzette an und machen Sie einen Querschnitt, um das brachiale Fettpolster freizulegen.
- Ziehen Sie vorsichtig an der Haut, um sie vom Depot des brachialen Fettgewebes zu lösen, wodurch das gesamte subkutane brachiale Fettgewebe mit dem Lymphknoten und dem lymphatischen Sammelgefäß zum Vorschein kommt.
- Entfernen Sie mit Pinzette und Schere vorsichtig die subkutanen Fettdepots und geben Sie sie in eine Schale mit kaltem PBS. Für ein optimales Ergebnis empfehlen wir, die Fettdepots in einem Stück zu entfernen.
- Schützen Sie das Gewebe von nun an vor Licht.
4. Fixierung des Gewebes
- Tauchen Sie das entnommene Gewebe in eine Lösung, die 4 % Paraformaldehyd und 30 % Saccharose enthält.
- Inkubieren Sie das Gewebe mindestens über Nacht in dieser Lösung, bevor Sie es für die Bildgebung vorbereiten.
5. Färben und Bildgebung
- Für optimale Ergebnisse führen Sie eine Gewebereinigung und eine konfokale 3D-Erfassung durch, wie von Gilleron und Kollegenbeschrieben 20. Wir empfehlen die Verwendung eines Lichtblattmikroskops für die Analyse von großen Geweben. Während des Reinigungsprozesses kann eine zusätzliche Färbung durchgeführt werden.
- Um eine optimale Gewebekartierung zu erreichen, verwenden Sie die folgenden Antikörper:
Für Adipozyten: Perilipin
Für Makrophagen: CD68- und CD11b-Färbung.
Für dendritische Zellen: MHC II und CD11b.
Für B-Zellen: B220 (CD45R) Färbung.
Für T-Zellen: CD3-Färbung.
HINWEIS: Diese Methode ist kompatibel mit der Verwendung genetischer Modelle zur Markierung von Immunzellen. - Für die Analyse des lymphatischen Auffanggefäßes mittels intravitaler 2-Photonen-Mikroskopie wird das Lektin subkutan in den unteren Fußballen injiziert und das popliteale Lymphsammelgefäß sichtbar gemacht.
Ergebnisse
Um eine topologische Analyse des Blutes des brachialen Fettgewebes und der Lymphgefäßnetzwerke durchzuführen, injizierten wir subkutan Alexa Fluor 649-konjugiertes Lektin und intravenös Alexa Fluor 488-konjugiertes Lektin. Das brachiale Fettgewebe wurde sorgfältig exzidiert, fixiert, einem Clearing-Protokoll unterzogen und durch Whole-Mount-Färbung analysiert. Eine schematische Darstellung des Verfahrens ist in Abbildung 1A enthalten. Die Blutgefäße sind grün und die Lymphgefäße rot markiert. Das brachiale Fettgewebe enthält ein einzelnes lymphatisches Sammelgefäß, das in den brachialen Lymphknoten eintritt. Die mit dieser Methode erzielten Ergebnisse haben wir bereits veröffentlicht16. Darüber hinaus erhielten wir ähnliche Daten mit genetischer lymphatischer Markierung (Prox1creERT2 x TdTomatofl/fl Mäuse)16 (Abbildung 1B). Das Blutgefäßsystem wurde nach intravenöser Lektininjektion effizient markiert (in blau). Interessant ist, dass die subkutane Lektininjektion das lymphatische Kollektorgefäß markierte (in rot) (Abbildung 1B). Um sicherzustellen, dass Lymph- und Blutgefäße spezifisch markiert wurden, nutzten wir die Vorteile von Prox1creERT2 x TdTomatofl/fl Mäusen. Bei subkutaner Lektingabe wurden nur die Lymphgefäße spezifisch markiert, wie die Co-Lokalisation mit dem Prox1-Reporter verdeutlicht (Abbildung 1B). Wir entdeckten auch ein zweites lymphatisches Kollektorgefäß, das positiv für Prox1 gefärbt war, aber nicht für subkutan injiziertes Lektin (Abbildung 1B). Dabei kann es sich um das efferente Kollektorgefäß handeln, das den brachialen Lymphknoten verlässt. Das Fehlen einer Lektinfärbung könnte erklärt werden durch: 1) ein kinetisches Problem, unter der Annahme, dass 15 Minuten nicht ausreichen, damit das Lektin aus dem drainierenden Lymphknoten austritt; 2) Unzureichende Menge an injiziertem Lektin, die nur eine Markierung im ersten afferenten Kollektor und im brachialen Lymphknoten liefert. Diese Punkte bedürfen weiterer Untersuchungen und könnten zur Optimierung des aktuellen Protokolls, das in diesem Manuskript beschrieben wird, verwendet werden. Die MHC II-Färbung (in grün) zeigte das Vorhandensein vieler antigenpräsentierender Zellen, wahrscheinlich dendritischer Zellen, im subkutanen brachialen Fettgewebe (Abbildung 1C). Die gleiche Beobachtung wurde bei Prox1-Reportermäusen gemacht, die mit CD11c YFP-Reportermäusen gekreuzt wurden (Abbildung 1D).
Um weiter zu bestätigen, dass die Lektinmarkierungsmethode spezifisch Lymphgefäße färbt, führten wir eine Podoplanin-Färbung im brachialen Fettgewebe durch, das aus CD11c-YFP-Reportermäusen extrahiert wurde. Die Podoplanin-Färbung markiert effizient lymphatische Endothelzellen. Auch hier erzielten wir ähnliche Ergebnisse wie bei unserer Lektin-Injektionsmethode (Abbildung 1E). Daher glauben wir, dass das Protokoll gut für die Analyse der Lymph- und Blutgefäßstruktur in gesundem und entzündetem Fettgewebe geeignet ist. Dieses Verfahren ist sehr gut und leicht reproduzierbar.
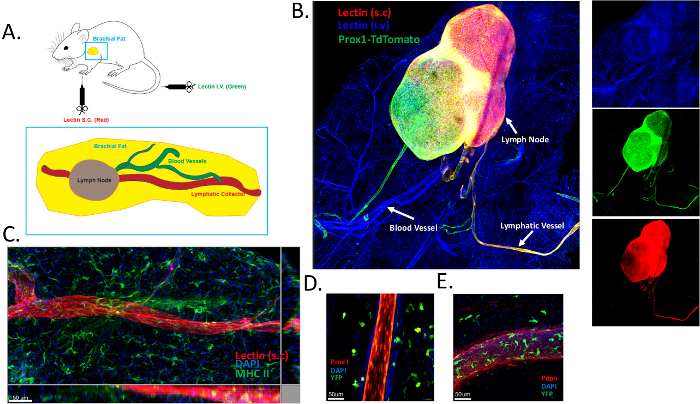
Abbildung 1: Markierung von Blut- und Lymphgefäßen im subkutanen Fettgewebe. (A) Schematische Darstellung des brachialen subkutanen Fettgewebes, das den brachialen Lymphknoten enthält. DyLight 649-konjugiertes Lektin (rot) wurde subkutan (s.c.) injiziert, um das drainierende lymphatische Gefäßsystem sichtbar zu machen, und DyLight 488-konjugiertes Lektin wurde intravenös (i.v.) verabreicht, um das Blutgefäßsystem zu kartieren. (B) Repräsentatives Bild zur Veranschaulichung der Blut- (in blau) und lymphatischen (rot und grün) Markierung unter Verwendung des in Panel A beschriebenen Protokolls. Prox1-TdTomate (in grün) Mäuse wurden in diesem Experiment verwendet, um sicherzustellen, dass Lektine getrennt an Blut- und lymphatische Endothelzellen gebunden werden. (C) Identifizierung des lymphatischen Sammelgefäßes im brachialen subkutanen Fettgewebe durch Verabreichung von Lektin. Antigen-präsentierende Zellen wurden mittels MHC-II-Färbung markiert (grün). (D,E) Identifizierung von Lymphgefäßen im brachialen subkutanen Fettgewebe von CD11c YFP-Reportermäusen, die mit Prox1 cre x TdTomatofl/fl Mäusen (D) gekreuzt oder mit Podoplanin (Pdpn) (E) gefärbt wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Dieser Ansatz ermöglicht eine effiziente und robuste Markierung des Blutes und der lymphatischen Gefäße des subkutanen Fettgewebes. Die getrennte Analyse von Blut- und lymphatischen Endothelnetzwerken könnte pathologische Mechanismen aufdecken, die eines oder beide des Kreislaufsystems bei Adipositas oder anderen pathologischen Zuständen betreffen. Ziel dieses Protokolls ist es, die Architektur der Gefäßsysteme, ihre Interaktion mit Stroma- und Immunzellen und ihre Funktionalität bei Gesundheit und Krankheit zu analysieren.
Die Methode wird durch das Vorhandensein des brachialen hautdrainierenden Lymphknotens erleichtert, der in das subkutane Fettgewebe eingebettet ist. Wie in Abbildung 1 gezeigt, liefert die Methode ähnliche Ergebnisse wie die genetische Reportermarkierung oder die Antikörperfärbung, ist aber auch von den zuvor diskutierten Vorbehalten befreit. Es bietet nicht nur eine praktische Möglichkeit, Blut- und Lymphgefäße getrennt zu kennzeichnen, sondern bietet auch mehrere Auslesungen über die Funktionalität der letzteren und über die allgemeine Gesundheit des Gewebes. Insbesondere könnte das Auftreten des Farbstoffs im interstitiellen Geweberaum auf eine erhöhte Gefäßpermeabilität hinweisen. Darüber hinaus kann das Vorhandensein des Farbstoffs im drainierenden Lymphknoten als relatives Maß für die Lymphflussrate im Zeitverlauf analysiert werden.
Ein weiterer Parameter, der berücksichtigt werden muss, ist die Assoziation von Leukozyten mit Blut- und Lymphgefäßen. Es ist bekannt, dass Immunzellen, insbesondere Makrophagen, dendritische Zellen und B-Zellen, eine Schlüsselrolle bei Fettleibigkeit spielen21. Insbesondere haben wir bereits über die Rolle dendritischer Zellen bei der Kontrolle der lymphatischen Permeabilität berichtet16. Wir empfehlen daher dringend, die Markierung von Blut- und lymphatischen Gefäßen mit der Markierung von Immunzellen des subkutanen Fettgewebes zu koppeln, um deren Lokalisation relativ zu beiden Gefäßen zu bestimmen. Die zelltypspezifische Markierung kann durch traditionelle Antikörperfärbung oder durch die Verwendung von Reportermäusen (z. B. CD11cYFP, CX3CR1GFP, Zbtb46GFP, LysMCre x tdTomatofl/fl) erreicht werden, wobei in diesem Fall die für die Lektinmarkierung verwendeten Fluorochrome angepasst werden müssen. Veränderungen der Adipozytenzahl oder der Morphologie können mit Hilfe der Perilipin-Färbung festgestellt werden, die auch eine gute Möglichkeit bietet, die Gewebestruktur abzubilden.
Obwohl die Methodik hier für einen konfokalen 3D-Bildgebungsansatz beschrieben wird, haben wir dieses Protokoll zuvor für die intravitale Bildgebung angepasst16. Dieser alternative Ansatz hat den Vorteil, dass er zusätzliche Informationen über die Motilität von Immunzellen in und um lymphatische Sammelgefäße sowie über die Kontraktilität der Gefäße liefert. Wir schlagen daher die Lektinmarkierung von Blut und lymphatischen Gefäßen als vielseitigen Ansatz zur Untersuchung der Fettgewebsbiologie in Gesundheit und Krankheit vor.
Offenlegungen
Die Autoren haben keine Offenlegung und keinen Interessenkonflikt zu erklären.
Danksagungen
SI wird unterstützt vom Institut National de la Sante et de la Recherche Medicale (INSERM) und der Agence Nationale de la Recherche (ANR-17-CE14-0017-01 und ANR-19-ECVD-0005-01). AG wird von der französischen Regierung im Rahmen der UCAJedi-Projekte "Investitionen in die Zukunft" unterstützt, die von der Nationalen Forschungsagentur (ANR) unter der Referenznummer ANR-15-IDEX-01 verwaltet werden. RSC wird unterstützt durch FA-2020-01-IBD-1 vom Lawrence C. Pakula, MD IBD Education & Innovation Fund".
Materialien
| Name | Company | Catalog Number | Comments |
| Lectin DyLight 649 | Vector Labs | DL-1178-1 | Described in protocol |
| Lectin DyLight 488 | Vector Labs | DL-1174 | Described in protocol |
| Paraformaldehyde | VWR Chemicals | 9713.1000 | |
| Sucrose | Euromedex | CAS Number 57-50-1 | |
| Anti-Podoplanin | AngioBio | 11-033 | Dilution : 1/50 |
| Lectin DyLight 594 | Vector Labs | DL-1177 | Described in protocol |
| Anti-MHCII (Clone M5/114.15.2) | Biolegend | 107618 | Dilution : 1/100 |
| Anti-CD11b (Clone M1/70) | Biolegend | 101218 | Dilution : 1/100 |
| Anti-CD68 (Clone FA.11) | Biolegend | 137004 | Dilution : 1/100 |
| Anti-B220 (Clone RA3-6B2) | Biolegend | 103225 | Dilution : 1/100 |
| Anti-Perilipin (Clone PERI 112.17) | Progen | 651156 | Dilution : 1/50 |
| Anti-CD3 (Clone 17A2) | Biolegend | 100210 | Dilution : 1/100 |
Referenzen
- Baluk, P., et al. Functionally specialized junctions between endothelial cells of lymphatic vessels. Journal of Experimental Medicine. 204 (10), 2349-2362 (2007).
- Fonseca, D. M., et al. Microbiota-Dependent Sequelae of Acute Infection Compromise Tissue-Specific Immunity. Cell. 163 (2), 354-366 (2015).
- Thomas, S. N., et al. Impaired humoral immunity and tolerance in K14-VEGFR-3-Ig mice that lack dermal lymphatic drainage. The Journal of Immunology. 189 (5), 2181-2190 (2012).
- Kuan, E. L., et al. Collecting lymphatic vessel permeability facilitates adipose tissue inflammation and distribution of antigen to lymph node-homing adipose tissue dendritic cells. The Journal of Immunology. 194 (11), 5200-5210 (2015).
- Randolph, G. J., Ivanov, S., Zinselmeyer, B. H., Scallan, J. P. The Lymphatic System: Integral Roles in Immunity. Annual Review of Immunology. 35, 31-52 (2017).
- Harvey, N. L., et al. Lymphatic vascular defects promoted by Prox1 haploinsufficiency cause adult-onset obesity. Nature Genetics. 37 (10), 1072-1081 (2005).
- Kajimura, S., Spiegelman, B. M., Seale, P. Brown and Beige Fat: Physiological Roles beyond Heat Generation. Cell Metabolism. 22 (4), 546-559 (2015).
- Wu, J., Cohen, P., Spiegelman, B. M. Adaptive thermogenesis in adipocytes: is beige the new brown. Genes and Development. 27 (3), 234-250 (2013).
- Cinti, S. The adipose organ. Prostaglandins, Leukotrienes & Essential Fatty Acids. 73 (1), 9-15 (2005).
- Kataru, R. P., et al. Regulation of Lymphatic Function in Obesity. Frontiers in Physiology. 11, 459(2020).
- Escobedo, N., Oliver, G. The Lymphatic Vasculature: Its Role in Adipose Metabolism and Obesity. Cell Metabolism. 26 (4), 598-609 (2017).
- Weitman, E. S., et al. Obesity impairs lymphatic fluid transport and dendritic cell migration to lymph nodes. PLoS One. 8 (8), 70703(2013).
- Escobedo, N., et al. Restoration of lymphatic function rescues obesity in Prox1-haploinsufficient mice. JCI Insight. 1 (2), (2016).
- Commerford, C. D., et al. Mechanisms of Tumor-Induced Lymphovascular Niche Formation in Draining Lymph Nodes. Cell Reports. 25 (13), 3554-3563 (2018).
- Gregory, J. L., et al. Infection Programs Sustained Lymphoid Stromal Cell Responses and Shapes Lymph Node Remodeling upon Secondary Challenge. Cell Reports. 18 (2), 406-418 (2017).
- Ivanov, S., et al. CCR7 and IRF4-dependent dendritic cells regulate lymphatic collecting vessel permeability. Journal of Clinical Investigation. 126 (4), 1581-1591 (2016).
- Zhong, W., et al. Prox1-GFP/Flt1-DsRed transgenic mice: an animal model for simultaneous live imaging of angiogenesis and lymphangiogenesis. Angiogenesis. 20 (4), 581-598 (2017).
- Choi, I., et al. Visualization of lymphatic vessels by Prox1-promoter directed GFP reporter in a bacterial artificial chromosome-based transgenic mouse. Blood. 117 (1), 362-365 (2011).
- Pham, T. H., et al. Lymphatic endothelial cell sphingosine kinase activity is required for lymphocyte egress and lymphatic patterning. Journal of Experimental Medicine. 207 (1), 17-27 (2010).
- Gilleron, J., et al. Exploring Adipose Tissue Structure by Methylsalicylate Clearing and 3D Imaging. Journal of Visualized Experiments. (162), e61640(2020).
- Ivanov, S., Merlin, J., Lee, M. K. S., Murphy, A. J., Guinamard, R. R. Biology and function of adipose tissue macrophages, dendritic cells and B cells. Atherosclerosis. 271, 102-110 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten