Method Article
Isolement, purification et identification de Bacillus licheniformis producteur de bacitracine à partir de fèces fraîches de porcs en bonne santé
Dans cet article
Résumé
Ce protocole fournit une description complète et exhaustive du processus détaillé d’isolement, de purification et d’identification de Bacillus licheniformis producteur de bacitracine à partir de fèces de porcs sains.
Résumé
Bacillus licheniformis et la bacitracine ont un énorme marché d’application et une valeur dans les domaines de la médecine, de la chimie, de l’aquaculture, de l’agriculture et des produits secondaires. Par conséquent, la sélection de B. licheniformis avec une production élevée de bacitracine est d’une grande importance. Dans ce protocole expérimental, des bacilles à haut rendement de bacitracine ont été isolés, purifiés et identifiés à partir de fèces fraîches de porcs sains. L’effet inhibiteur du métabolite secondaire bacitracine sur Micrococcus luteus a également été testé. La chromatographie sur couche mince et la chromatographie liquide à haute performance ont été utilisées pour la détection qualitative et quantitative de la bacitracine. Les caractéristiques physiologiques et biochimiques de B. licheniformis ont été déterminées à l’aide de trousses pertinentes. Les relations phylogénétiques de B. licheniformis ont été déterminées et construites à l’aide de la détection de séquences génétiques. Ce protocole décrit et présente le processus standard d’isolement, de purification et d’identification de B. licheniformis à partir d’excréments frais d’animaux sous plusieurs angles, fournissant une méthode pour l’utilisation à grande échelle de B. licheniformis et de la bacitracine dans les usines.
Introduction
Bacillus licheniformis est une espèce de Bacillus de la famille des Firmicutes, qui est largement distribuée dans divers environnements tels que l’eau, le sol et les intestins des animaux1. B. licheniformis a une structure courte et robuste en forme de bâtonnet et se déplace individuellement2. La colonie est presque ronde et terne, avec un renflement central et des bords nets de blanc grisâtre3. Il a une forte capacité de croissance et de reproduction et peut absorber et utiliser des nutriments provenant de diverses sources de carbone, telles que les monosaccharides, les polysaccharides, le cétose et les acides organiques4. Aux derniers stades de croissance et de développement, B. licheniformis peut exister sous forme de spores dormantes et produire des substances antibactériennes telles que la bacitracine, la lichénysine et la surfactine. Il peut également résister aux carences nutritionnelles et aux environnements extérieursextrêmes 5. Il n’y a pas de préférence évidente pour les codons, et le système de sécrétion efficace détermine la sécrétion de protéines hétérologues de B. licheniformis, qui est deux fois celle de Bacillus subtilis6. Il est souvent utilisé pour produire des préparations enzymatiques telles que la protéase, l’amylase et la cellulase7. En raison de son absence de toxines endogènes, elle est certifiée comme une souche sans danger pour les aliments et inscrite au QPS par l’EFSA8. Par conséquent, il existe plusieurs utilisations potentielles, y compris la production de composés bioactifs, qui ont un large éventail d’applications dans l’aquaculture, l’agriculture, l’alimentation, la biomédecine et les industries pharmaceutiques. De plus, B. licheniformis est un composant important de la flore intestinale animale, qui peut favoriser l’amélioration des performances de production, l’équilibre de la flore intestinale et la prévention des maladies. L’ensemble du génome de B. licheniformis ATCC14580 a été analysé en 2004, et les informations de base sur la traduction de la transcription, le repliement des protéines et le mécanisme de sécrétion ont été progressivement comprises9. Cette information génétique le rend propice à la modification génétique au niveau moléculaire, contribuant ainsi à faciliter la production à grande échelle de B. licheniformis.
La bacitracine est un antibiotique peptidique dodécacylique produit par la peptide synthétase non ribosomique par métabolisme secondaire chez B. subtilis et B. licheniformis. La bacitracine est un mélange composé de divers composants tels que la bacitracine A, B et C, où un ou deux acides aminés diffèrent entre chaque composant ; parmi celles-ci, la bacitracine A a la plus forte activité biologique10. La bacitracine peut inhiber les bactéries à Gram positif telles que Staphylococcus et Micrococcus luteus et certaines bactéries à Gram négatif en inhibant la formation de la paroi cellulaire et en interagissant avec les protéines de liaison membranaire11. Pendant ce temps, la bacitracine est sûre et stable, il n’est pas facile de produire une résistance aux médicaments et elle peut être compatible avec d’autres médicaments antibactériens12. Par conséquent, la bacitracine est utilisée dans la pratique médicale et vétérinaire. De plus, en raison de son taux d’élimination rapide et de son faible taux d’absorption, il peut également être utilisé comme additif pour l’alimentation animale13.
B. licheniformis peut coloniser l’intestin et améliorer le microenvironnement gastro-intestinal. La capacité d’adhésion et de reproduction et les fonctions physiologiques associées des bacilles provenant de différentes sources dans le tractus gastro-intestinal de différents animaux sont différentes. Le B. licheniformis dérivé du porc est plus propice à la colonisation dans les intestins des porcs et d’autres animaux d’élevage. Il existe une relation étroite entre l’abondance relative de probiotiques intestinaux et l’état de santé de l’hôte14. La supplémentation alimentaire avec un mélange de B. licheniformis chez les porcelets sevrés améliore l’écosystème intestinal en modifiant la composition du microbiote et l’activité métabolique, et affecte également la muqueuse intestinale15. Les excréments d’animaux peuvent refléter le type et la quantité de flore intestinale animale. Ce protocole décrit l’isolement et la purification de Bacillus spp. producteurs de bacitracine à partir d’excréments de porcs sains. Les excréments proviennent de truies de Taihu qui ne sont pas nourries avec des aliments composés et qui ont d’excellentes performances de production dans les élevages porcins. Les isolats ont été identifiés comme étant B . licheniformis en raison de leurs caractéristiques morphologiques, de leurs propriétés physicochimiques et de leur identification biochimique.
Protocole
Toutes les procédures expérimentales ont été documentées et approuvées par le comité d’éthique de l’Université Nanjing Tech. Les excréments provenaient de truies de Taihu âgées d’environ 2 ans (voir tableau des matériaux), qui étaient élevées dans des élevages porcins professionnels et standard.
1. Préparation des supports
- Milieu liquide Luria-Bertani (LB) : Ajouter 10 g de NaCl, 5 g de poudre d’extrait de levure et 10 g de tryptone dans une bouteille conique, ajouter de l’eau distillée à 1 L, remuer et dissoudre avec une tige de verre. Transférez 100 ml de fluide dans une bouteille conique de 500 ml et attachez-la fermement avec une pellicule d’étanchéité respirante. Stériliser à 121 °C dans un autoclave pendant 20 min (voir tableau des matériaux).
- Milieu solide LB : Ajoutez 10 g de NaCl, 5 g de poudre d’extrait de levure, 10 g de tryptone, 20 g de poudre de gélose dans une bouteille conique, ajoutez de l’eau distillée à 1 L, dissolvez avec une tige de verre et attachez fermement avec un film d’étanchéité respirant. Stériliser à 121 °C dans un autoclave pendant 20 min. Lorsque le milieu est refroidi à 50 °C, versez 20 ml du milieu dans des boîtes de Pétri, laissez-les refroidir, puis conservez-les à l’envers.
- Milieu de fermentation de la bacitracine : Ajouter 8 g de tourteau de soja, 4 g d’amidon soluble, 0,1 g (NH4)2SO4, 0,6 g de CaCO3 et 100 ml d’eau distillée dans une bouteille conique de 500 ml, remuer avec une tige de verre pour bien dissoudre et attacher fermement avec un film d’étanchéité respirant. Stériliser à 121 °C dans un autoclave pendant 20 min (voir tableau des matériaux).
- suspension de M. luteus : Choisir un anneau de M. luteus et inoculer sur une plaque de culture LB, préparée à l’étape 1.2 (voir le tableau des matières). Culture dans un incubateur à température constante à 37 °C pendant 16 h (voir le tableau des matériaux). Ajouter 5 ml de solution saline normale dans la plaque et agiter doucement pour éluer les colonies. Mesurez l’OD600 et diluez la solution dans un tube à essai pour obtenir une suspension avec OD600 de 0,3-0,7. Conservez la suspension de M. luteus à 4 °C pour une utilisation ultérieure.
- Milieu d’essai d’activité antibactérienne : Ajouter 1 mL de suspension de M. luteus , préparée à l’étape 1.4, à 100 mL de milieu solide LB liquide préparé à l’étape 1.2 et agiter légèrement. Prélever immédiatement 5 ml de cette solution contenant M. luteus et l’étaler uniformément sur la plaque de culture LB.
2. Isolement et purification de Bacillus à partir d’excréments frais de porcs sains
- Ajouter 9 ml de solution saline normale et 1,0 g d’excréments de porc frais dans un erlenmeyer de 150 ml. Remuer avec un agitateur magnétique (voir tableau des matériaux) à température ambiante à 60 tr/min/min pendant 15 min.
- Mettez l’extrait fécal dans un bain-marie thermostatique à 80 °C (voir tableau des matériaux) pendant 20 min pour tuer les bactéries non productrices de spores.
- Ajouter la suspension à 100 mL de milieu liquide LB dans un erlenmeyer de 250 mL et cultiver dans un agitateur (voir le tableau des matières) à 180 tr/min, à 37 °C pendant 8 h.
- Effectuez une dilution en série de la solution bactérienne cultivée avec une solution saline normale de 10-1 à 10-8. Appliquer 0,1 mL de diluant bactérien 10-6, 10-7 et 10-8 sur des plaques de culture LB individuelles et laisser sécher. Après 10 min, placez les assiettes à l’envers dans un incubateur à température constante à 37 °C pendant 48 h.
- À l’aide de l’anneau d’inoculation, choisissez les colonies qui ressemblent à B. licheniformis (couleur blanc crème, consistance molle, aspect mucoïde, élévation convexe et plate, et forme irrégulière)16et striez-les en zigzag sur un milieu d’essai d’activité antibactérienne préparé à l’étape 1.5 (voir figure 1).
- Mettre les plaques dans l’incubateur à 37 °C pendant 48 h et observer s’il y a une zone d’inhibition autour de la colonie.
3. Dépistage de l’inhibition de l’activité de M. luteus
- Sélectionner une seule colonie qui a généré une zone inhibitrice et l’ajouter à 100 mL de milieu liquide LB, culture dans l’agitateur à 37 °C et 180 tr/min/min pendant 12 h.
- Inoculer 5 mL du milieu de culture dans le milieu de fermentation de la bacitracine préparé à l’étape 1.3 et cultiver à 37 °C pendant 48 h.
- Recueillir le bouillon de fermentation dans un tube à centrifuger et centrifuger à 13 400 x g à 4 °C pendant 15 min, puis filtrer à l’aide d’une membrane filtrante microporeuse de 0,22 μm (voir tableau des matériaux).
- Ajouter une tasse Oxford à une plaque de milieu d’essai d’activité antibactérienne fraîche, puis ajouter 50 μL de filtrat (surnageant de fermentation) dans la tasse Oxford (voir le tableau des matériaux). Culture en incubateur à 37 °C pendant 12 h. Après l’incubation, mesurez le diamètre de la zone inhibitrice à l’aide d’un pied à coulisse (voir tableau des matériaux).
- Sélectionner les souches et le surnageant de fermentation correspondant ayant un diamètre de zone inhibitrice supérieur à 15 mm pour les expériences ultérieures.
4. Identification de la bacitracine par chromatographie sur couche mince
- Ajouter 60 mg de bacitracine étalon et dissoudre dans de l’EDTA-2Na à 1 % (voir le tableau des matériaux) dans un flacon jaugé de 10 mL pour obtenir une solution de bacitracine à 6,0 mg/mL.
- Diluer 1 mL du surnageant de fermentation à 10 mL avec 1 % d’EDTA-2Na. Repérez 5 μL d’échantillon et 5 μL de solution étalon de bacitracine sur la plaque de couche mince de gel de silice activée (voir le tableau des matériaux).
- Ajouter 100 mL d’acide n-butanol-acétique-eau-pyridine-éthanol (60:15:10:6:5) dans la cuve chromatographique (voir le tableau des matériaux). Placez la plaque de couche mince de gel de silice dans le réservoir chromatographique. Couvrir et laisser reposer à température ambiante pendant 30 min.
- Retirer la plaque de gel de silice, vaporiser une solution de butanol-pyridine (99:1) contenant 1 % de ninhydrine (voir le tableau des matières) et chauffer à 105 °C pendant 5 minutes jusqu’à l’apparition de taches rouge brunâtre. Calculer Rf (valeur du facteur de rétention) pour l’étalon et l’échantillon selon la formule suivante :
Rf = Distance de déplacement du spot/Distance de déplacement du solvant.
5. Détection de la bacitracine par HPLC
- Ajouter 0,3 mL de surnageant de fermentation et 1,2 mL d’éthanol à 50 % dans un tube de microcentrifugation de 2 mL, agiter pendant 5 min à la main et laisser reposer à 4 °C pendant 12 h.
- Centrifuger à 13 400 x g pendant 15 min et filtrer dans un flacon d’échantillon étiqueté S1 avec une membrane filtrante microporeuse de 0,22 μm (voir le tableau des matériaux).
- Préparation de la solution mère de bacitracine : Ajouter 0,4 g d’étalon de bacitracine (60 U/mg ; voir le tableau des matières), 100 mL de 40 g/L d’EDTA-2Na (voir le tableau des matériaux) dans une fiole jaugée de 100 mL pour préparer une solution mère de bacitracine de 240 U/mL.
- Ajouter 3 ml de solution mère de bacitracine et 21, 9, 3, 1 et 0 ml d’eau ultrapure dans des tubes à essai étiquetés A1, B1, C1, D1 et E1, respectivement. Après filtration avec une membrane filtrante microporeuse de 0,22 μm, placez le filtrat dans des flacons d’échantillonnage étiquetés A2, B2, C2, D2 et E2.
REMARQUE : Les concentrations de la solution étalon de bacitracine sont de 30, 60, 120, 180 et 240 U/mL. - Placez A2, B2, C2, D2, E2 et S1 dans le plateau de test de l’instrument HPLC. Placez 1000 mL de 50 mM/L de formiate d’ammonium et 1000 mL d’acétonitrile dans le plateau de phase mobile et réglez-les comme phases mobiles A et B, respectivement.
REMARQUE : Le pH du formiate d’ammonium doit être ajusté à 4,0 avec de l’acide formique. - Installez la colonne HPLC C18 (5 μm, 4,6 mm x 250 mm) dans la direction indiquée sur la colonne (voir tableau des matériaux).
- Réglez les paramètres de phase mobile sur 0 min, 77 % A et 23 % B ; 30 min, 70 % A et 30 % B ; 40 min, 60 % A et 40 % B ; 50 min, 60 % A et 40 % B ; 51 min, 77 % A et 23 % B ; 58 min, 77 % A et 23 % B. Définir la taille de l’échantillon à 100 μL ; Débit, 1,0 mL/min ; Température de la colonne, 30 °C.
- Cliquez sur le bouton Exécuter pour exécuter le programme.
6. Identification morphologique
- Diluer et enrober la souche avec le titre de bacitracine le plus élevé sur une plaque de culture LB et la cultiver dans un incubateur à 37 °C pendant 48 h. Colorez et observez la morphologie de la colonie comme décrit ci-dessous.
- Ajoutez une goutte d’eau purifiée stérile sur la lame, prélevez une petite quantité de colonies et ajoutez-la à la gouttelette d’eau. Étalez uniformément, laissez la lame sécher naturellement, puis fixez-la sur une flamme.
- Ajoutez du violet cristallin pendant 1 min pour colorer l’échantillon, puis rincez à l’eau du robinet. Ajoutez de l’iode pendant 1 min pour tacher l’échantillon, puis rincez à l’eau distillée.
- Ajoutez de l’alcool à 95 %, secouez la lame pour la décolorer pendant 1 min, puis rincez à l’eau distillée.
- Ajoutez du safran pendant 1 min pour tacher l’échantillon puis rincez à l’eau distillée. Laissez sécher la lame naturellement et observez la morphologie de la colonie au microscope avec une immersion dans l’huile (voir Tableau des matériaux).
7. Identification physiologique et biochimique
- Ajouter 2 mL de solution saline stérile dans l’éprouvette et inoculer une seule colonie de la plaque dans la solution saline stérile à l’aide d’un anneau d’inoculation pour obtenir une suspension bactérienne.
- Ajouter 100 μL de suspension bactérienne dans chaque trou pour mesurer le V-P, le citrate, la gélatine, le chlorure de sodium à 7 %, le pH 5,7, la réduction du nitrate et l’hydrolyse de l’amidon sur la bande d’identification biochimique du Bacillus (voir le tableau des matériaux).
- Utilisez l’anneau d’inoculation pour choisir une autre colonie unique et les strier en zigzag sur le tube biochimique de croissance anaérobie de la bande d’identification biochimique du Bacillus .
- À l’aide de l’anneau d’inoculation, choisissez les autres colonies et perforez-les verticalement dans les pores pour l’identification du propionate, du D-xylose, du L-arabinose et du D-mannitol sur la bande d’identification biochimique du Bacillus .
8. Détermination de la séquence du gène de la souche
- Extraire l’ADN de la souche à l’aide d’un kit d’extraction d’ADN de bactérie (voir le tableau des matériaux) : Ajouter 2 ml de liquide de graine dans un tube de microcentrifugation de 5 ml et centrifuger à 11 500 x g pendant 1 min. Jeter le surnageant et ajouter 110 μL de tampon (contenant 20 mM de Tris, pH 8,0 ; 2 mM de Na 2-EDTA et 1,2 % de Triton) et 70 μL de solution de lysozyme à 50 mg/mL dans la pastille et incuber à 37 °C pendant 30 min.
- Ajouter 4 μL de 100 mg/mL de RNase A pendant 15 s et laisser agir 5 min à température ambiante. Ajouter 20 μL de solution de protéinase K et bien mélanger.
- Ajouter 220 μL de tampon GB, agiter pendant 15 s jusqu’à ce que la pastille soit en suspension, placer à 70 °C pendant 10 min pour rendre la solution claire et effectuer une courte rotation pour retirer les billes d’eau sur la paroi du tube.
- Ajouter 220 μL d’éthanol anhydre, choquer complètement pendant 15 s, séparation courte. Transvaser la solution et la précipitation de floculation dans la colonne d’adsorption CB3 du tube collecteur, centrifuger à 13 400 x g pendant 30 s et jeter le surnageant.
- Ajouter 500 μL de mémoire tampon GD dans la colonne d’adsorption, centrifuger pendant 30 s à 13 400 x g et jeter le surnageant. Ajouter 600 μL de PW dans la colonne, centrifuger pendant 30 s à 13 400 x g et jeter le surnageant.
- Remettez la colonne d’adsorption dans le tube de collecte, centrifugez pendant 2 min à 13 400 x g et jetez le surnageant.
- Placez la colonne d’adsorption à température ambiante pendant 10 min pour qu’elle sèche. Transférez la colonne dans le tube à centrifuger et ajoutez 100 μL de tampon d’élution TE au milieu de la membrane d’adsorption.
- Laisser à température ambiante pendant 5 min pour recueillir le flux dans le tube de centrifugation et centrifuger pendant 2 min à 13 400 x g.
- Ajoutez 25 μL de mélange maître 2x (voir le tableau des matériaux), 2,5 μL d’échantillon d’ADN obtenu à l’étape 8.8, 2 μL d’amorce directe 27F, 2 μL d’amorce inverse 1492R et 18,5 μL de H2O double distillé dans un tube PCR de 0,1 mL.
REMARQUE : Les séquences génétiques des amorces sont 27F : 5'-AGAGTTTGATCCTGGCTCAG-3' et 1492R : 5'-GGTTACCTTGTTACGACTT-3'. - Placez le tube PCR dans la machine PCR (voir tableau des matériaux) dans les conditions suivantes : pré-dénaturation à 95 °C pendant 10 min, dénaturation à 95 °C pendant 30 s, recuit à 55 °C pendant 30 s, extension à 72 °C pendant 90 s, extension à 72 °C pendant 7 min. Exécutez le cycle de dénaturation, de recuit et d’extension en trois étapes pendant 32x.
- Prélever 5 μL du produit et effectuer une électrophorèse avec un gel d’agarose à 1 % à 120 V pendant 30 min.
- Dissoudre 500 mg d’agarose dans 50 mL de 1 tampon TAE. Faites chauffer la solution au micro-ondes pendant 1 à 2 minutes jusqu’à ce que l’agarose soit complètement dissoute. Ajoutez 5 μL de colorant de coloration de l’ADN, puis versez dans un plateau de gel et insérez la plaque à orifice. Laisser reposer à température ambiante pendant 30 minutes jusqu’à ce qu’il se solidifie ; mettez le gel dans le réservoir d’électrophorèse et ajoutez 1x tampon TAE pour immerger le gel. Ajouter 2 μL d’échelle d’ADN de 2 kb (10 mg/μL) dans le premier puits et 5 μL de produit PCR mélangés à 1 μL de colorant de charge dans les puits restants dans le gel.
- Placez le gel dans le système d’imagerie sur gel et prenez une photo. Coupez rapidement les bandelettes d’ADN sous la lumière ultraviolette et pesez.
- Ajouter des bandelettes dans un tube de microcentrifugation et ajouter un volume égal de solution de PN. Maintenez le tube dans un bain-marie à 50 °C jusqu’à ce que le gel soit complètement dissous.
- Ajouter 500 μL de liquide d’équilibre BL dans la colonne d’adsorption CA2, centrifuger à 13 400 x g pendant 1 min et jeter le surnageant.
- Ajouter la solution de gel dissous dans la colonne d’adsorption CA2 et la placer à température ambiante pendant 2 min, la centrifuger à 13 400 x g pendant 30 s et jeter le surnageant.
- Ajouter 600 μL de PW dans la colonne d’adsorption CA2, centrifuger à 13 400 x g pendant 1 min, jeter le surnageant et répéter 1 fois.
- Placez la colonne d’adsorption CA2 dans un tube de collecte, centrifugez à 13 400 x g pendant 2 min et jetez le surnageant.
- Placez la colonne d’adsorption CA2 à température ambiante pendant 10 minutes pour qu’elle sèche complètement, puis placez-la dans un tube à centrifuger propre.
- Ajouter 50 μL de tampon d’élution EB dans le film d’adsorption en suspension à température ambiante pendant 2 min, et recueillir la solution d’ADN par centrifugation à 13 400 x g pendant 2 min.
REMARQUE : Les solutions ou réactifs mentionnés ci-dessus sont inclus dans le kit de purification (voir tableau des matériaux).- Envoyez la solution d’ADN collectée à une entreprise de séquençage professionnelle (voir la table des matériaux) pour le séquençage. Comparez les résultats de séquençage par Blast dans la base de données GenBank de NCBI. Selon l’homologie de séquence, sélectionner différentes souches et construire des arbres phylogénétiques par la méthode du maximum de vraisemblance dans MEGA-X pour déterminer les relations entre les espèces des souches.
Résultats
Dans cette expérience, 48 souches de Bacillus ont été isolées à partir d’excréments frais de porcs sains, numérotés de 1001 à 1048. Parmi elles, 15 souches avaient une activité antibactérienne contre M. luteus. À partir des 15 souches, les titres de bacitracine ont été mesurés par chromatographie liquide à haute performance, comme le montre le tableau 1. Parmi eux, B. licheniformis n° 1026 avait le titre de bacitracine le plus élevé, 456,35 ± 21,75 U/mL, de sorte que le n° 1026 a été sélectionné pour les expériences ultérieures.
Les résultats de l’identification par CCM sont illustrés à la figure 2A. La position des taches principales dans le bouillon de fermentation de la souche n° 1026 et de la solution étalon de bacitracine était la même, et la valeur Rf était de 0,61. Pour l’analyse HPLC, l’équation de la courbe standard de la bacitracine est y = 50,287x - 250,55, et le coefficient de corrélation R2 = 0,9968 (Figure 2B). Le temps de pointe du surnageant de fermentation était conforme à la norme de bacitracine (figure 2C), de sorte que la substance bactériostatique a été identifiée comme étant de la bacitracine, et le titre de bacitracine était de 456,35 ± 21,75 U/mL.
La colonie de la souche no 1026 a été mise en culture sur un milieu LB pendant 12 h, comme le montre la figure 3A. La colonie était ronde et transparente en forme de gouttelettes d’eau, avec des protubérances pleines et des bords nets. De 12 h à 24 h, les bactéries sont entrées dans les derniers stades de croissance. Comme le montre la figure 3B, les colonies s’étendent en forme de prune, le centre se forme plié et la couleur s’approfondit progressivement jusqu’au blanc laiteux. Elle est conforme à la description de la morphologie de la colonie de B. licheniformis16. Il y avait un mucus transparent sur le bord. Après la coloration de Gram, la souche n° 1026 a été observée au microscope, comme le montre la figure 3C. Les cellules étaient des bâtonnets violets, indiquant des bactéries à Gram positif.
Comme le montre le tableau 2, la souche n° 1026 pourrait se développer dans un environnement anaérobie. La souche a été testée positive pour le test V-P, l’utilisation du citrate, la réduction des nitrates et l’hydrolyse de l’amidon. La souche a été capable de se décomposer et d’utiliser la plupart des sources de carbone. Il avait les mêmes caractéristiques physiologiques et biochimiques que B. licheniformis.
La taille du fragment d’ADNr 16S de la souche n° 1026 était d’environ 1400 pb (figure 4A). Les résultats de séquençage de la souche n° 1026 ont montré une similitude de 99,58 % avec ceux de B. licheniformis DSM 13 dans GenBank. L’arbre phylogénétique a ensuite été construit, comme le montre la figure 4B. La longueur évolutive de la branche de B. licheniformis DSM 13 est de 0,000, ce qui indique qu’il s’agit de B. licheniformis.
D’après les caractéristiques morphologiques, physiologiques et biochimiques de la souche no 1026 et l’analyse d’homologie de la séquence du gène de l’ADNr 16S, la souche no 1026 a été identifiée comme étant B. licheniformis.

Figure 1 : Schéma de principe de l’inoculation de la souche. L’anneau d’inoculation a été utilisé pour prélever les colonies et les marquer en zigzag sur le milieu d’essai d’activité antibactérienne. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Identification des substances bactériostatiques. (A) Chromatographie sur couche mince. (B) Courbe standard HPLC de la bacitracine. (C) Chromatogramme HPLC. Veuillez cliquer ici pour voir une version agrandie de cette figure.
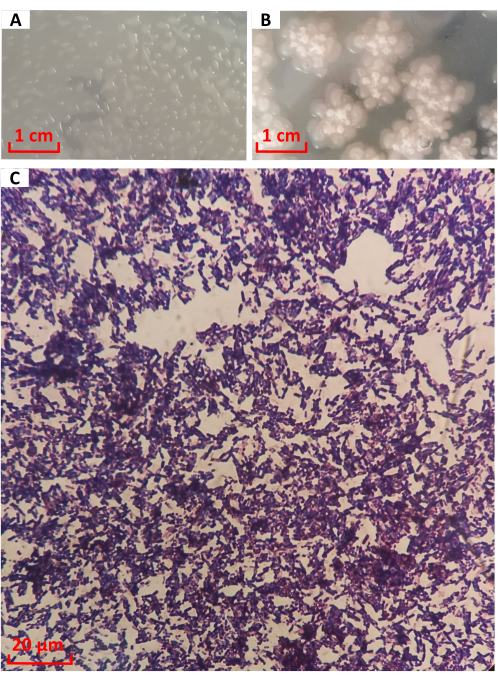
Figure 3 : Caractéristiques morphologiques et coloration de Gram de la souche n° 1026. Morphologie de la colonie à (A) 12 h et (B) 24 h. (C) Coloration de Gram. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Identification biologique moléculaire de la souche n° 1026. (A) Amplification génique de la souche n° 1026 de l’ADNr 16S. (B) Arbre phylogénétique de la souche n° 1026. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| NON. | Titre de bacitracine (U/mL) | NON. | Titre de bacitracine (U/mL) |
| 1003 | 423.57±18.62 | 1021 | 317.46±13.46 |
| 1004 | 325.82±13.23 | 1026 | 456.35±21.75 |
| 1009 | 326.26±14.52 | 1027 | 435.57±19.18 |
| 1011 | 376.65±16.11 | 1030 | 382.48±17.64 |
| 1015 | 325.27±12.37 | 1031 | 215.37±11.73 |
| 1016 | 256.56±15.37 | 1039 | 353.67±16.16 |
| 1017 | 352.47±16.47 | 1041 | 342.36±14.36 |
| 1018 | 328.73±16.12 |
Tableau 1 : Titre de bacitracine des souches à activité antibactérienne.
| Articles | Résultats | Articles | Résultats |
| Test de croissance anaérobie | + | Test D-mannitol | + |
| V.P essai | + | Test de gélatine | + |
| Test d’utilisation du citrate | + | Test NaCl à 7 % | + |
| Test du propionate | + | Test de pH 5,7 | + |
| Test de D-xylose | + | Essai de réduction des nitrates | + |
| L-arabinose | + | Test d’hydrolyse de l’amidon | + |
Tableau 2 : Identification physiologique et biochimique de la souche n° 1026.
Discussion
B. licheniformis se développe rapidement dans des conditions de culture simples et une consommation rapide de sucre, et la technologie de fermentation mature est utile pour réduire les coûts de production industrielle13. L’application généralisée de B. licheniformis et de ses sécrétions, la bacitracine, a déterminé sa valeur marchande prometteuse. En agriculture, B. licheniformis est utilisé comme biofertilisant pour améliorer la croissance des plantes et l’absorption des nutriments en augmentant la fertilité du sol, en favorisant le développement des racines et en aidant à la dégradation de la matière organique15. Pour la production industrielle d’enzymes, B. licheniformis produit une gamme d’enzymes telles que les protéases, les amylases, les cellulases et les lipases, ce qui détermine sa valeur marchande irremplaçable dans la transformation des aliments, la fabrication de détergents, la transformation du cuir et l’industrie textile16. Compte tenu de l’activité pharmacologique antibactérienne supérieure de B. licheniformis et de la bacitracine, il a été utilisé dans le domaine médical pour traiter une variété de maladies infectieuses induites par des bactéries et des champignons1. Pendant ce temps, compte tenu de la croissance des plantes médicinales ainsi que de l’accumulation d’ingrédients pharmacologiquement actifs dans les plantes, B. licheniformis est un stimulant potentiel de la croissance des plantes ainsi qu’utile pour la production de composés tels que le salidroside dérivé de la rhodiole 17,18. Les avantages ci-dessus de B. licheniformis et de la bacitracine les rendent largement utiles dans l’industrie, l’agriculture, l’aquaculture, la biotechnologie et les industries médicales. Par conséquent, la séparation et la purification de B. licheniformis avec un rendement élevé en bacitracine sont un facteur décisif pour assurer une production et une application ultérieures à grande échelle.
Bien que la bacitracine puisse être préparée par synthèse chimique, les étapes sont lourdes et il existe de nombreux sous-produits. Dans l’industrie, la bacitracine est principalement produite par le processus métabolique secondaire de la farine de maïs et du tourteau de soja fermentés par B. licheniformis. Dans la production industrielle moderne de la bacitracine, son coût élevé et son faible rendement entravent son application ultérieure10. Par conséquent, le criblage des souches de bacitracine à haut rendement et l’amélioration du taux d’utilisation des matières premières sont la clé pour améliorer la production de bacitracine.
À l’heure actuelle, la sélection de souches de bacitracine à haut rendement se fait principalement par sélection naturelle à partir du sol et d’autres environnements, par sélection par mutation à l’aide de souches productrices de bacitracine existantes ou par sélection basée sur le génie génétique. L’opération de sélection naturelle est simple et les souches criblées ont une capacité de production stable, mais le processus prend beaucoup de temps et la charge de travail est importante. La sélection par mutation a un taux de mutation élevé et raccourcit le temps de reproduction, mais la mutation peut ne pas être en mesure d’être héritée de manière stable dans les générations suivantes16. La sélection basée sur le génie génétique est plus ciblée pour obtenir des souches à haut rendement10, mais l’introduction de gènes exogènes pose des problèmes de sécurité. Les excréments d’animaux adultes en bonne santé contiennent d’abondantes ressources probiotiques qui peuvent maintenir l’équilibre de la flore.
Dans cet article, basé sur les caractéristiques de B. licheniformis pour produire des spores dormantes dans des environnements extrêmes19, la dilution d’excréments de porc sains a été placée dans un environnement à haute température pour tuer les bactéries et les champignons résistants à la chaleur et non sporulés. Étant donné que M. luteus est sensible à la production de peptides bactériostatiques par B. licheniformis à la fin de sa croissance et qu’il produit un pigment jaune pour faciliter l’observation, il est utilisé pour dépister l’activité antibactérienne en fonction de l’évaluation de la zone d’inhibition. Selon la morphologie de la colonie similaire à la morphologie de B. licheniformis, la morphologie cellulaire est en forme de bâtonnet court, Gram-positif, les caractéristiques physiologiques et biochimiques de B. licheniformis, l’ARN 16 s est étroitement lié à B. licheniformis, de sorte que la souche n° 1026 est B. licheniformis. La substance bactériostatique a été identifiée par CCM et CLHP comme étant de la bacitracine. Ainsi, B. licheniformis producteur de bacitracine a été obtenu. Cette méthode présente également des inconvénients, tels que le processus de dépistage qui prend beaucoup de temps et l’opération nécessite une certaine expérience.
En résumé, ce protocole expérimental a introduit de manière exhaustive et détaillée le processus d’acquisition et d’identification en laboratoire de routine de B. licheniformis producteur de bacitracine, qui a de vastes perspectives d’application et une valeur marchande inestimable20. Ces méthodes sont simples, réalisables et faciles à mettre en œuvre, et constitueront sans aucun doute une référence efficace pour la production à grande échelle de B. licheniformis. Cet article fournit également une idée de dépistage pour la production de souches pour d’autres peptides antimicrobiens.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette étude a été soutenue par le Programme national de recherche et de développement clés de la Chine (n° 2022YFC2104800) et le projet Six Talent Peaks dans la province du Jiangsu (n° 2019-NY-058).
matériels
| Name | Company | Catalog Number | Comments |
| 2 × Phanta Flash Master Mix | Nanjing Vazyme Biotechnology Co., Ltd., Nanjing,China | P252-01 | |
| 2kb DNA Marker | Beijing Trans Biotechnology Co., Ltd., Beijing, China | BM121-01 | |
| Acetonitrile | Shanghai Aladdin Biochemical Technology Co.,Ltd., Shanghai, China | A104443 | |
| Agar powder | Shanghai Macklin Biochemical Technology Co., Ltd., Shanghai, China | A800730 | |
| Agarose | Shanghai Aladdin Biochemical Technology Co.,Ltd., Shanghai, China | A104062 | |
| Ammonium sulfate ((NH4)2SO4) | Sinopharm Chemical Reagent Co., Ltd., Shanghai, China | 10002917 | |
| Autoclave sterilizer | Zealway Instrument Inc., Xiamen, China | GI36DWS | |
| Bacillus biochemical identification strip | Qingdao Haibo Biotechnology Co., Ltd., Qingdao, China | HBIG14 | |
| Bacitracin | Shanghai Yuanye Bio-Technology Co., Ltd., Shanghai, China | B65740 | |
| Bacteria DNA Extraction Kit | Tiangen Biochemical Technology Co., Ltd., Beijing, China | DP209 | |
| Breathable sealing film | Beijing Leiborun Biotechnology Co., Ltd. | BS-QM-01A | |
| Butanol | Shanghai Aladdin Biochemical Technology Co., Ltd., Shanghai, China | B433378 | |
| C18 (5 μm, 4.6 × 250 mm) HPLC column | Rizhao Kepuno New Material Co., Ltd., Rizhao, China | C1805-462510 | |
| Calcium carbonate (CaCO3) | Sinopharm Chemical Reagent Co., Ltd., Shanghai, China | 10005717 | |
| Centrifuge | New Brunswick Scientific Co., Inc., UK | 5452 | |
| Chromatographic tank | Nanjing Tenghui Experimental Technology Co., Ltd., Nanjing, China | P-1 | |
| Conical bottle | Sichuan Shubo Co., Ltd., Chengdu, China | 18012 | |
| Constant temperature incubator | Taist Instrument Co., Ltd., Tianjin, China | GH4500 | |
| Dipotassium phosphate (K2HPO4) | Xilong Chemical Co., Ltd., Guangdong, China | XL0015 | |
| EDTA-2Na | Shanghai Aladdin Biochemical Technology Co.,Ltd., Shanghai, China | E397526 | |
| Electronic balance | Mettler Toledo International Co., Ltd. | FA2104 | |
| Ethyl alcohol | Shanghai Aladdin Biochemical Technology Co.,Ltd., Shanghai, China | E130059 | |
| Gel Midi Purification Kit | Tiangen Biochemical Technology Co., Ltd., Beijing, China | DP302 | |
| Glass rod | Chengdu Yibang Kexi Instrument Co., Ltd. | 1294 | |
| Glucose | Shanghai Macklin Biochemical Technology Co., Ltd., Shanghai, China | D823520 | |
| Gram 's staining solution kit | Qingdao Haibo Biotechnology Co., Ltd., Qingdao, China | HB8278 | |
| High performance liquid chromatograph | Agilent Technologies, Inc., California, America | 1260 | |
| Horizontal electrophoresis apparatus | Beijing Liuyi Biotechnology Co., Ltd., Beijing, China | DYCP-31DN BIOMATE | |
| Inoculation ring | Shanghai Muchen Biotechnology Co., Ltd., Shanghai, China | 3171026 | |
| Magnetic stirrer | Wiggens GmbH Co., Ltd., Germany | WH220 PLUS | |
| Methyl alcohol | Shanghai Aladdin Biochemical Technology Co.,Ltd., Shanghai, China | M116115 | |
| Microcentrifuge tube | Shanghai Muchen Biotechnology Co., Ltd., Shanghai, China | 1351171 | |
| Micrococcus luteus | Bena Culture Collection, Suzhou, China | BNCC102589 | |
| Microporous filter membrane | Nantong Suri Experimental Equipment Co., Ltd. | PES0.22 | |
| Ninhydrin | Shanghai Aladdin Biochemical Technology Co., Ltd., Shanghai, China | N105629 | |
| Optical microscope | Optical Instrument Factory, Shanghai, China | DYS-108 | |
| Pig feces | Nanjing Quanfu Pig Farm, Nanjing, China | ||
| Polymerase chain reaction (PCR) Amplifier | Suzhou Dongsheng Xingye Scientific Instrument Co., Ltd., Suzhou, China | ETC811 | |
| Professional sequencing company | General Biology (Anhui) Co., Ltd., Anhui, China | ||
| Pyridine | Shanghai Aladdin Biochemical Technology Co., Ltd., Shanghai, China | P111516 | |
| Shaker | Taicang Qiangle Experimental Equipment Co., Ltd.,Taicang, China | HYL-C | |
| Silica gel GF254 thin layer plate | Yantai Huayang New Material Co., Ltd., Yantai, China | HPT-HSGF5025023 | |
| Sodium chloride (NaCl) | Shanghai Macklin Biochemical Technology Co., Ltd., Shanghai, China | S805275 | |
| Sodium citrate | Sinopharm Chemical Reagent Co., Ltd., Shanghai, China | C39197100001 | |
| Soluble starch | Shanghai Macklin Biochemical Technology Co., Ltd., Shanghai, China | S817547 | |
| Thermostat water bath | Shanghai Heheng Instrument Equipment Co., Ltd., Shanghai, China | DK-8D | |
| Tryptone | Shanghai Aladdin Biochemical Technology Co., Ltd., Shanghai, China | T139519 | |
| Ultra GelRed | Nanjing Vazyme Biotechnology Co., Ltd., Nanjing,China | GR501-01 | |
| Ultra pure water instrument | Merck KGaA Co., Ltd., Germany | Milli Direct-Q8 | |
| Ultrasonic cleaner | Jiangsu Huaguan Electric Appliance Group Co., Ltd., Jiangsu, China | SB-100DT | |
| Vernier caliper | Sanfeng Company, Japan | N20P | |
| Yeast extract powder | Vicbio Biotechnology Co., Ltd., Beijing, China | LP0021 |
Références
- Shleeva, M. O., Kondratieva, D. A., Kaprelyants, A. S. Bacillus licheniformis: A producer of antimicrobial substances, including antimycobacterials, which are feasible for medical applications. Pharmaceutics. 15 (7), 1893 (2023).
- Muras, A., Romero, M., Mayer, C., Otero, A. Biotechnological applications of Bacillus licheniformis. Crit. Rev. Biotechnol. 41 (4), 609-627 (2021).
- He, H., et al. Biotechnological and food synthetic biology potential of platform strain: Bacillus licheniformis. Syn Syst Biotechno. 8 (2), 281-291 (2023).
- Sun, Y., et al. Enhanced β-mannanase production by Bacillus licheniformis by optimizing carbon source and feeding regimes. Prep Biochem Biotech. 52 (7), 845-853 (2022).
- Trunet, C., et al. Suboptimal Bacillus licheniformis and Bacillus weihenstephanensis spore incubation conditions increase heterogeneity of spore outgrowth time. Appl Environ Microb. 86 (6), e02061-e02119 (2020).
- Lee, N. K., Kim, W. S., Paik, H. D. Bacillus strains as human probiotics: characterization, safety, microbiome, and probiotic carrier. Food Sci Biotechnol. 28 (5), 1297-1305 (2019).
- Yi, W., et al. Dietary novel alkaline protease from Bacillus licheniformis improves broiler meat nutritional value and modulates intestinal microbiota and metabolites. Anim Microbiome. 6 (1), 1-16 (2024).
- Vasileios, B., et al. Safety and efficacy of Bacillus licheniformis DSM 32457 as a silage additive for all animal species. EFSA Journal. 17 (8), e05787 (2019).
- Birgit, V., et al. The complete genome sequence of Bacillus licheniformis DSM13, an organism with great industrial potential. J Mol Microb Biotech. 7 (4), 204-211 (2004).
- Zhu, J., et al. Microbial synthesis of bacitracin: Recent progress, challenges, and prospects. Synth Syst Biotechnol. 8 (2), 314-322 (2023).
- Shleeva, M. O., Kondratieva, D. A., Kaprelyants, A. S. Bacillus licheniformis: A producer of antimicrobial substances, including antimycobacterials, which are feasible for medical applications. Pharmaceutics. 15 (7), 1893 (2023).
- Willdigg, J. R., et al. The Bacillus subtilis cell envelope stress-inducible ytpAB operon modulates membrane properties and contributes to bacitracin resistance. J Bacteriol. 206 (3), e0001524 (2024).
- Silva, K. G. S., et al. Effects of bacterial direct-fed microbial mixtures offered to beef cattle consuming finishing diets on intake, nutrient digestibility, feeding behavior, and ruminal kinetics/fermentation profile. J Anim Sci. 102, (2024).
- Jia, D., et al. Probiotic Bacillus licheniformis ZW3 alleviates DSS-induced colitis and enhances gut homeostasis. Int J Mol Sci. 25 (1), 561 (2024).
- Wang, X., et al. Dietary supplementation with Bacillus mixture modifies the intestinal ecosystem of weaned piglets in an overall beneficial way. J Appl Microbiol. 130 (1), 233-246 (2021).
- James, N., et al. Unravelling the potential plant growth activity of halotolerant Bacillus licheniformis NJ04 isolated from soil and its possible use as a green bioinoculant on Solanum lycopersicum L. Environ. Res. 216 (2), 114620 (2024).
- Shen, P., et al. Exploitation of ammonia-inducible promoters for enzyme overexpression in Bacillus licheniformis. J Ind Microbiol Biot. 48 (5-6), (2021).
- Hou, Y., et al. Rhodiola crenulata alleviates hypobaric hypoxia-induced brain injury by maintaining BBB integrity and balancing energy metabolism dysfunction. Phytomedicine. 128, 155529 (2024).
- Fan, B., Chen, T. Y., Zhang, S., Wu, B., He, B. F. Mining of efficient microbial UDP-glycosyltransferases by motif evolution cross plant kingdom for application in biosynthesis of salidroside. Sci Rep. 7 (1), 463 (2017).
- Hugo, R. O., Bernardo, R. B., Alejandra, C. S. R. Potential application of the probiotic Bacillus licheniformis as an adjuvant in the treatment of diseases in humans and animals: A systematic review. Front Microbiol. 13, 993451 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon