Method Article
Aislamiento, purificación e identificación de Bacillus licheniformis productor de bacitracina a partir de heces frescas de cerdos sanos
En este artículo
Resumen
Este protocolo proporciona una descripción completa y exhaustiva del proceso detallado para el aislamiento, la purificación y la identificación del Bacillus licheniformis productor de bacitracina a partir de heces de cerdos sanos.
Resumen
El Bacillus licheniformis y la bacitracina tienen un enorme mercado de aplicación y valor en los campos de la medicina, la química, la acuicultura, la agricultura y los productos secundarios. Por lo tanto, la selección de B. licheniformis con alta producción de bacitracina es de gran importancia. En este protocolo experimental, se aislaron, purificaron e identificaron bacilos con un alto rendimiento de bacitracina a partir de las heces frescas de cerdos sanos. También se probó el efecto inhibidor del metabolito secundario bacitracina sobre Micrococcus luteus . Para la detección cualitativa y cuantitativa de bacitracina se utilizó cromatografía en capa fina y cromatografía líquida de alta resolución. Las características fisiológicas y bioquímicas de B. licheniformis se determinaron mediante kits relevantes. Las relaciones filogenéticas de B. licheniformis se determinaron y construyeron mediante la detección de secuencias génicas. Este protocolo describe e introduce el proceso estándar de aislamiento, purificación e identificación de B. licheniformis a partir de heces frescas de animales desde múltiples perspectivas, proporcionando un método para la utilización a gran escala de B. licheniformis y bacitracina en fábricas.
Introducción
Bacillus licheniformis es una especie de Bacillus de la familia Firmicutes, que se distribuye ampliamente en diversos ambientes como el agua, el suelo y los intestinos de los animales1. B. licheniformis tiene una estructura corta y robusta en forma de bastón y se mueve individualmente2. La colonia es casi redonda y opaca, con una protuberancia central y bordes limpios de color blanco grisáceo3. Tiene una gran capacidad de crecimiento y reproducción y puede absorber y utilizar nutrientes de diversas fuentes de carbono, como monosacáridos, polisacáridos, cetosa y ácidos orgánicos4. En la etapa posterior de crecimiento y desarrollo, B. licheniformis puede existir en forma de esporas latentes y producir sustancias antibacterianas como bacitracina, liquenisina y surfactina. También puede resistir la deficiencia nutricional y el entorno externo extremo5. No hay una preferencia obvia por los codones, y el eficiente sistema de secreción determina la secreción de proteínas heterólogas de B. licheniformis, que es el doble que la de Bacillus subtilis6. A menudo se utiliza para producir preparaciones enzimáticas como la proteasa, la amilasa y la celulasa7. Debido a su falta de toxinas endógenas, está certificada como cepa segura para los alimentos y está incluida en el QPS de la EFSA8. Por lo tanto, existen varios usos potenciales, incluida la producción de compuestos bioactivos, que tienen una amplia gama de aplicaciones en las industrias acuícola, agrícola, alimentaria, biomédica y farmacéutica. Además, B. licheniformis es un componente importante de la flora intestinal animal, que puede promover que los animales mejoren el rendimiento de la producción, mejoren el equilibrio de la flora intestinal y prevengan enfermedades. En 2004 se analizó el genoma completo de B. licheniformis ATCC14580 y se ha ido comprendiendo gradualmente la información de fondo sobre la traducción de la transcripción, el plegamiento de proteínas y el mecanismo de secreción9. Esta información genética hace que sea propicio para la modificación genética a nivel molecular, contribuyendo a facilitar la producción a gran escala de B. licheniformis.
La bacitracina es un antibiótico péptido dodeccíclico producido por la péptido sintetasa no ribosómica por metabolismo secundario en B. subtilis y B. licheniformis. La bacitracina es una mezcla compuesta por varios componentes como la bacitracina A, B y C, donde uno o dos aminoácidos difieren entre cada componente; entre estos, la bacitracina A tiene la actividad biológica más fuerte10. La bacitacina puede inhibir bacterias grampositivas como Staphylococcus y Micrococcus luteus y algunas bacterias gramnegativas al inhibir la formación de la pared celular e interactuar con las proteínas de unión a la membrana11. Mientras tanto, la bacitracina es segura y estable, no es fácil producir resistencia a los medicamentos y puede ser compatible con otros medicamentos antibacterianos12. Por lo tanto, la bacitracina se utiliza en la práctica médica y veterinaria. Además, debido a su rápida tasa de eliminación y baja tasa de absorción, también se puede utilizar como aditivo para la alimentación animal13.
B. licheniformis puede colonizar el intestino y mejorar el microambiente gastrointestinal. La capacidad de adhesión y reproducción y las funciones fisiológicas relacionadas de Bacillus de diferentes fuentes en el tracto gastrointestinal de diferentes animales son diferentes. La B. licheniformis derivada de cerdos es más propicia para la colonización en los intestinos de cerdos y otros animales. Existe una estrecha relación entre la abundancia relativa de probióticos intestinales y el estado de salud del huésped14. La suplementación dietética con la mezcla de B. licheniformis en lechones destetados mejora el ecosistema intestinal al cambiar la composición de la microbiota y la actividad metabólica, y también afecta a la mucosa intestinal15. Las heces de los animales pueden reflejar el tipo y la cantidad de la flora intestinal animal. Este protocolo describe el aislamiento y purificación de Bacillus spp. productora de bacitracina a partir de heces sanas de cerdo. Las heces se derivan de cerdas Taihu que no se alimentan con piensos compuestos y tienen un excelente rendimiento de producción en las granjas porcinas. Los aislados se identificaron como B. licheniformis con base en sus características morfológicas, propiedades fisicoquímicas e identificación bioquímica.
Protocolo
Todos los procedimientos experimentales fueron documentados y aprobados por el Comité de Ética de la Universidad Tecnológica de Nanjing. Las heces se derivaron de cerdas Taihu de aproximadamente 2 años de edad (ver Tabla de Materiales), que fueron criadas en granjas porcinas profesionales y estándar.
1. Preparación de los medios
- Medio líquido Luria-Bertani (LB): Añadir 10 g de NaCl, 5 g de extracto de levadura en polvo y 10 g de triptona en un frasco cónico, añadir agua destilada a 1 L, remover y disolver con una varilla de vidrio. Transfiera 100 ml de medio a una botella cónica de 500 ml y átela firmemente con una película de sellado transpirable. Esterilizar a 121 °C en autoclave durante 20 min (ver Tabla de Materiales).
- LB de medio sólido: Agregue 10 g de NaCl, 5 g de extracto de levadura en polvo, 10 g de triptona, 20 g de polvo de agar a una botella cónica, agregue agua destilada a 1 L, disuelva con una varilla de vidrio y ate firmemente con una película de sellado transpirable. Esterilizar a 121 °C en autoclave durante 20 min. Cuando el medio se haya enfriado a 50 °C, vierta 20 ml del medio en placas de Petri, deje que se enfríen y luego guárdelas boca abajo.
- Medio de fermentación de la bacitacina: Añadir 8 g de harina de soja, 4 g de almidón soluble, 0,1 g (NH4)2SO4, 0,6 g de CaCO3 y 100 mL de agua destilada a una botella cónica de 500 mL, remover con una varilla de vidrio para que se disuelva completamente y atar firmemente con una película de sellado transpirable. Esterilizar a 121 °C en autoclave durante 20 min (ver Tabla de Materiales).
- Suspensión de M. luteus : Seleccione un anillo de M. luteus e inocule en una placa de cultivo LB, preparada en el paso 1.2 (ver Tabla de Materiales). Cultivo en incubadora a temperatura constante a 37 °C durante 16 h (ver Tabla de Materiales). Agregue 5 mL de solución salina normal a la placa y agite suavemente para eluir las colonias. Mida el OD600 y diluya la solución en un tubo de ensayo para obtener una suspensión con OD600 de 0,3-0,7. Almacene la suspensión de M. luteus a 4 °C para su uso posterior.
- Medio de ensayo de actividad antibacteriana: Añadir 1 mL de suspensión de M. luteus , preparada en el paso 1.4, a 100 mL de medio sólido LB líquido preparado en el paso 1.2 y agitar ligeramente. Tome inmediatamente 5 mL de esta solución que contiene M. luteus y extiéndala uniformemente sobre la placa de cultivo LB.
2. Aislamiento y purificación de Bacillus a partir de heces frescas de cerdos sanos
- Añadir 9 mL de solución salina normal y 1,0 g de heces frescas de cerdo en un matraz Erlenmeyer de 150 mL. Agitar con un agitador magnético (ver Tabla de Materiales) a temperatura ambiente a 60 rpm/min durante 15 min.
- Coloque el extracto fecal en un baño de agua con termostato a 80 °C (consulte la tabla de materiales) durante 20 minutos para matar las bacterias que no producen esporas.
- Añadir la suspensión a 100 mL de medio líquido LB en un matraz Erlenmeyer de 250 mL y cultivar en un agitador (ver Tabla de Materiales) a 180 rpm/min a 37 °C durante 8 h.
- Realizar la dilución en serie de la solución bacteriana cultivada con solución salina normal de 10-1 a 10-8. Aplique 0,1 ml de diluyente bacteriano 10-6, 10-7 y 10-8 a las placas de cultivo LB individuales y deje secar. Después de 10 minutos, coloque las placas boca abajo en una incubadora de temperatura constante a 37 °C durante 48 h.
- Utilice el anillo de inoculación para seleccionar las colonias que se parezcan a B. licheniformis (color blanco cremoso, consistencia blanda, aspecto mucoide, elevación convexa y plana, y forma irregular)16y véanlas utilizando un patrón en zigzag en un medio de ensayo de actividad antibacteriana preparado en el paso 1.5 (véase la Figura 1).
- Coloque las placas en la incubadora a 37 °C durante 48 h y observe si hay una zona de inhibición alrededor de la colonia.
3. Cribado de la inhibición de la actividad de M. luteus
- Seleccionar una sola colonia que generó una zona inhibitoria y agregar a 100 mL de medio líquido LB, cultivo en el agitador a 37 °C y 180 rpm/min durante 12 h.
- Inocular 5 mL del medio de cultivo en el medio de fermentación de bacitracina preparado en el paso 1.3 y cultivar a 37 °C durante 48 h.
- Recoja el caldo de fermentación en un tubo de centrífuga y centrifugue a 13.400 x g a 4 °C durante 15 min, y luego filtre con una membrana filtrante microporosa de 0,22 μm (consulte la tabla de materiales).
- Añada una copa Oxford a una placa nueva de medio de ensayo de actividad antibacteriana y, a continuación, añada 50 μL de filtrado (sobrenadante de fermentación) a la copa Oxford (véase la tabla de materiales). Cultivo en incubadora a 37 °C durante 12 h. Después de la incubación, mida el diámetro de la zona inhibitoria con un calibrador vernier (consulte la tabla de materiales).
- Seleccionar las cepas y el sobrenadante de fermentación correspondiente con un diámetro de zona inhibitoria superior a 15 mm para experimentos posteriores.
4. Identificación de la bacitracina por cromatografía en capa fina
- Agregue 60 mg de bacitracina estándar y disuelva en EDTA-2Na al 1% (ver Tabla de Materiales) en un frasco volumétrico de 10 mL para hacer una solución de bacitracina de 6.0 mg/mL.
- Diluir 1 mL del sobrenadante de fermentación a 10 mL con EDTA-2Na al 1%. Localice 5 μL de muestra y 5 μL de solución estándar de bacitracina en la placa de capa delgada de gel de sílice activada (ver Tabla de Materiales).
- Agregue 100 mL de n-butanol-ácido acético-agua-piridina-etanol (60:15:10:6:5) al tanque cromatográfico (ver Tabla de Materiales). Coloque la placa de capa delgada de gel de sílice en el tanque cromatográfico. Tapa y deja reposar a temperatura ambiente durante 30 min.
- Saque la placa de capa fina de gel de sílice, rocíe la solución de butanol-piridina (99:1) que contenga ninhidrina al 1% (consulte la tabla de materiales) y caliente a 105 °C durante 5 minutos hasta que aparezcan manchas de color rojo parduzco. Calcule Rf (Valor del Factor de Retención) para el estándar y la muestra de acuerdo con la siguiente fórmula:
Rf = Distancia de recorrido puntual/Distancia de recorrido del solvente.
5. Detección de bacitracina por HPLC
- Añadir 0,3 mL de sobrenadante de fermentación y 1,2 mL de etanol al 50% en un tubo de microcentrífuga de 2 mL, agitar durante 5 min con la mano y dejar reposar a 4 °C durante 12 h.
- Centrifugar a 13.400 x g durante 15 min y filtrar en un frasco de muestra etiquetado como S1 con una membrana de filtro microporoso de 0,22 μm (ver Tabla de Materiales).
- Preparación de la solución madre de bacitracina: Añadir 0,4 g de bacitracina patrón (60 U/mg; ver Tabla de Materiales), 100 mL de 40 g/L de EDTA-2Na (ver Tabla de Materiales) en un matraz aforado de 100 mL para preparar 240 U/mL de solución madre de bacitracina.
- Agregue 3 mL de solución madre de bacitracina y 21, 9, 3, 1 y 0 mL de agua ultrapura a los tubos de ensayo marcados como A1, B1, C1, D1 y E1, respectivamente. Después de la filtración con una membrana de filtro microporoso de 0,22 μm, coloque el filtrado en botellas de muestra etiquetadas como A2, B2, C2, D2 y E2.
NOTA: Las concentraciones de la solución estándar de bacitracina son 30, 60, 120, 180 y 240 U/mL. - Coloque A2, B2, C2, D2, E2 y S1 en la bandeja de prueba del instrumento de HPLC. Coloque 1000 mL de formiato de amonio de 50 mM/L y 1000 mL de acetonitrilo en la bandeja de fase móvil y configúrelos como fases móviles A y B, respectivamente.
NOTA: El pH del formiato de amonio debe ajustarse a 4.0 con ácido fórmico. - Instale la columna de HPLC C18 (5 μm, 4,6 mm x 250 mm) en la dirección indicada en la columna (consulte la tabla de materiales).
- Ajuste los parámetros de la fase móvil como 0 min, 77% A y 23% B; 30 min, 70% A y 30% B; 40 min, 60% A y 40% B; 50 min, 60% A y 40% B; 51 min, 77% A y 23% B; 58 min, 77% A y 23% B. Ajuste el tamaño de la muestra a 100 μL; Caudal, 1,0 mL/min; Temperatura de la columna, 30 °C.
- Haga clic en el botón Ejecutar para ejecutar el programa.
6. Identificación morfológica
- Diluir y recubrir la cepa con el título más alto de bacitracina en una placa de cultivo LB y cultivar en una incubadora a 37 °C durante 48 h. Tiña y observa la morfología de la colonia como se describe a continuación.
- Agregue una gota de agua purificada estéril al portaobjetos, recoja una pequeña cantidad de colonias y agréguelas a la gota de agua. Unta uniformemente, deja que el portaobjetos se seque de forma natural y luego fíjalo sobre una llama.
- Agregue violeta cristalino durante 1 minuto para manchar la muestra y luego enjuague con agua del grifo. Agregue yodo durante 1 minuto para manchar la muestra y luego enjuague con agua destilada.
- Agregue alcohol al 95%, agite el portaobjetos para decolorar durante 1 minuto y luego enjuague con agua destilada.
- Agregue azafrán durante 1 minuto para manchar la muestra y luego enjuague con agua destilada. Deje que el portaobjetos se seque naturalmente y observe la morfología de la colonia bajo un microscopio con inmersión en aceite (ver Tabla de Materiales).
7. Identificación fisiológica y bioquímica
- Añadir 2 mL de solución salina estéril en el tubo de ensayo e inocular una sola colonia de la placa en la solución salina estéril utilizando un anillo de inoculación para obtener la suspensión bacteriana.
- Agregue 100 μL de la suspensión bacteriana en cada orificio para medir V-P, citrato, gelatina, cloruro de sodio al 7%, pH 5.7, reducción de nitrato e hidrólisis de almidón en la tira de identificación bioquímica de Bacillus (ver Tabla de Materiales).
- Use el anillo de inoculación para elegir otra colonia individual y trazarlas en el patrón en zigzag en el tubo bioquímico de crecimiento anaeróbico de la tira de identificación bioquímica de Bacillus .
- Use el anillo de inoculación para recoger las otras colonias y perforarlas verticalmente en los poros para la identificación de propionato, D-xilosa, L-arabinosa y D-manitol en la tira de identificación bioquímica de Bacillus .
8. Determinación de la secuencia génica de la cepa
- Extraiga el ADN de la cepa utilizando un kit de extracción de ADN de bacterias (consulte la tabla de materiales): Agregue 2 mL de líquido de semilla en un tubo de microcentrífuga de 5 mL y centrifugue a 11,500 x g durante 1 min. Deseche el sobrenadante y añada 110 μL de tampón (que contiene 20 mM de Tris, pH 8,0; 2 mM de Na,2-EDTA y 1,2% de Triton) y 70 μL de solución de lisozima de 50 mg/mL al pellet e incubar a 37 °C durante 30 min.
- Añadir 4 μL de 100 mg/mL de RNasa A durante 15 s y dejar actuar 5 min a temperatura ambiente. Añadir 20 μL de solución de proteinasa K y mezclar bien.
- Añadir 220 μL de tampón GB, agitar durante 15 s hasta que el pellet quede en suspensión, colocar a 70 °C durante 10 min para que la solución quede clara y realizar un breve centrifugado para eliminar las gotas de agua de la pared del tubo.
- Añadir 220 μL de etanol anhidro, choque completo durante 15 s, separación corta. Transfiera la solución y la precipitación de floculación a la columna de adsorción CB3 del tubo de recolección, centrifugue a 13.400 x g durante 30 s y deseche el sobrenadante.
- Añadir 500 μL de tampón GD en la columna de adsorción, centrifugar durante 30 s a 13.400 x g y desechar el sobrenadante. Añada 600 μL de PW a la columna, centrifugue durante 30 s a 13.400 x g y deseche el sobrenadante.
- Vuelva a colocar la columna de adsorción en el tubo de recolección, centrifugue durante 2 minutos a 13.400 x g y deseche el sobrenadante.
- Coloque la columna de adsorción a temperatura ambiente durante 10 minutos para que se seque. Transfiera la columna al tubo de centrífuga y agregue 100 μL de tampón de elución TE en el centro de la membrana de adsorción.
- Dejar a temperatura ambiente durante 5 min para recoger el flujo a través del tubo de centrífuga y centrifugar durante 2 min a 13.400 x g.
- Agregue 25 μL de mezcla maestra 2x (consulte la Tabla de materiales), 2,5 μL de muestra de ADN obtenida en el paso 8.8, 2 μL de cebador directo 27F, 2 μL de cebador inverso 1492R y 18,5 μL de H2O destilado doble a un tubo de PCR de 0,1 mL.
NOTA: Las secuencias génicas de los cebadores son 27F: 5'-AGAGTTTGATCCTGGCTCAG-3' y 1492R: 5'-GGTTACCTTGTTACGACTT-3'. - Coloque el tubo de PCR en la máquina de PCR (consulte la tabla de materiales) en las siguientes condiciones: predesnaturalización a 95 °C durante 10 min, desnaturalización a 95 °C durante 30 s, recocido a 55 °C durante 30 s, extensión a 72 °C durante 90 s, extensión a 72 °C durante 7 min. Ejecute el ciclo de tres pasos de desnaturalización, recocido y extensión durante 32x.
- Tomar 5 μL del producto y realizar electroforesis con gel de agarosa al 1% a 120 V durante 30 min.
- Disolver 500 mg de agarosa en 50 mL de 1x tampón TAE. Calienta la solución en el microondas durante 1-2 minutos hasta que la agarosa se disuelva por completo. Agregue 5 μL de tinte de ADN, luego vierta en una bandeja de gel e inserte la placa de orificio. Deje reposar a temperatura ambiente durante 30 minutos hasta que se solidifique; coloque el gel en el tanque de electroforesis y agregue 1x tampón TAE para sumergir el gel. Agregue 2 μL de escalera de ADN de 2 kb (10 mg/μL) en el primer pocillo y 5 μL de producto de PCR mezclado con 1 μL de colorante de carga a los pocillos restantes en el gel.
- Coloque el gel en el sistema de imágenes de gel y tome una fotografía. Corta las tiras de ADN rápidamente bajo luz ultravioleta y pésalas.
- Agregue tiras a un tubo de microcentrífuga y agregue un volumen igual de solución de PN. Mantenga el tubo en baño de agua a 50 °C hasta que el gel se disuelva por completo.
- Añadir 500 μL de BL líquido de equilibrio a la columna de adsorción CA2, centrifugar a 13.400 x g durante 1 min y desechar el sobrenadante.
- Añadir la solución de gel disuelta a la columna de adsorción CA2 y colocarla a temperatura ambiente durante 2 min, centrifugarla a 13.400 x g durante 30 s y desechar el sobrenadante.
- Añadir 600 μL de PW a la columna de adsorción CA2, centrifugar a 13.400 x g durante 1 min, desechar el sobrenadante y repetir 1 vez.
- Colocar la columna de adsorción CA2 en un tubo de recogida, centrifugar a 13.400 x g durante 2 min y desechar el sobrenadante.
- Coloque la columna de adsorción CA2 a temperatura ambiente durante 10 minutos para que se seque completamente y luego colóquela en un tubo de centrífuga limpio.
- Añadir 50 μL de tampón eluyente EB a la película de adsorción suspendida a temperatura ambiente durante 2 min, y recoger la solución de ADN por centrifugación a 13.400 x g durante 2 min.
NOTA: Las soluciones o reactivos mencionados anteriormente están incluidos en el Kit de Purificación (ver Tabla de Materiales).- Envíe la solución de ADN recolectada a una empresa de secuenciación profesional (consulte la Tabla de materiales) para su secuenciación. Compare los resultados de la secuenciación por Blast en la base de datos GenBank del NCBI. De acuerdo con la homología de secuencia, seleccione diferentes cepas y construya árboles filogenéticos mediante el método de máxima verosimilitud en MEGA-X para determinar las relaciones de especies de las cepas.
Resultados
En este experimento, se aislaron 48 cepas de Bacillus de heces frescas de cerdos sanos, numeradas de 1001 a 1048. Entre ellas, 15 cepas tuvieron actividad antibacteriana contra M. luteus. De las 15 cepas, los títulos de bacitracina se midieron mediante cromatografía líquida de alta resolución, como se muestra en la Tabla 1. Entre ellos, B. licheniformis Nº 1026 presentó el título más alto de bacitracina, 456,35 ± 21,75 U/mL, por lo que se seleccionó el Nº 1026 para experimentos posteriores.
Los resultados de la identificación por TLC se muestran en la Figura 2A. La posición de las manchas principales en el caldo de fermentación de la cepa No. 1026 y la solución patrón de bacitracina fue la misma, y el valor de Rf fue de 0,61. Para el análisis de HPLC, la ecuación de la curva estándar de bacitracina es y = 50,287x - 250,55, y el coeficiente de correlación R2 = 0,9968 (Figura 2B). El tiempo pico de fermentación del sobrenadante fue consistente con el estándar de bacitracina (Figura 2C), por lo que la sustancia bacteriostática se identificó como bacitracina, y el título de bacitracina fue de 456,35 ± 21,75 U/mL.
La colonia de la cepa Nº 1026 se cultivó en medio LB durante 12 h, como se muestra en la Figura 3A. La colonia era redonda y transparente en forma de gotas de agua, con protuberancias llenas y bordes limpios. De 12 h a 24 h, las bacterias entraron en las últimas etapas de crecimiento. Como se muestra en la Figura 3B, las colonias se extendieron en forma de ciruela, el centro se dobló y el color se profundizó gradualmente a blanco lechoso. Es consistente con la descripción de la morfología de la colonia de B. licheniformis16. Había una mucosidad transparente en el borde. Después de la tinción de Gram, se observó la cepa No. 1026 bajo el microscopio, como se muestra en la Figura 3C. Las células eran bastones de color púrpura, lo que indicaba bacterias Gram-positivas.
Como se muestra en la Tabla 2, la cepa No. 1026 podría crecer en un ambiente anaeróbico. La cepa dio positivo para la prueba V-P, la utilización de citrato, la reducción de nitratos y la hidrólisis del almidón. La cepa fue capaz de descomponerse y utilizar la mayoría de las fuentes de carbono. Tenía las mismas características fisiológicas y bioquímicas que B. licheniformis.
El tamaño del fragmento de ADNr 16S de la cepa No. 1026 tenía un tamaño de aproximadamente 1400 pb (Figura 4A). Los resultados de la secuenciación de la cepa No. 1026 mostraron una similitud del 99,58% con la de B. licheniformis DSM 13 en GenBank. A continuación, se construyó el árbol filogenético, como se muestra en la Figura 4B. La longitud evolutiva de la rama de B. licheniformis DSM 13 es de 0,000, lo que indica que se trata de B. licheniformis.
Sobre la base de las características morfológicas, fisiológicas y bioquímicas de la cepa Nº 1026 y el análisis de homología de la secuencia del gen ADNr 16S, la cepa Nº 1026 se identificó como B. licheniformis.

Figura 1: Diagrama esquemático de la inoculación de la cepa. El anillo de inoculación se utilizó para seleccionar las colonias y marcarlas en un patrón en zigzag en el medio de ensayo de actividad antibacteriana. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Identificación de sustancias bacteriostáticas. (A) Cromatografía en capa fina. (B) Curva estándar de HPLC de bacitracina. (C) Cromatograma de HPLC. Haga clic aquí para ver una versión más grande de esta figura.
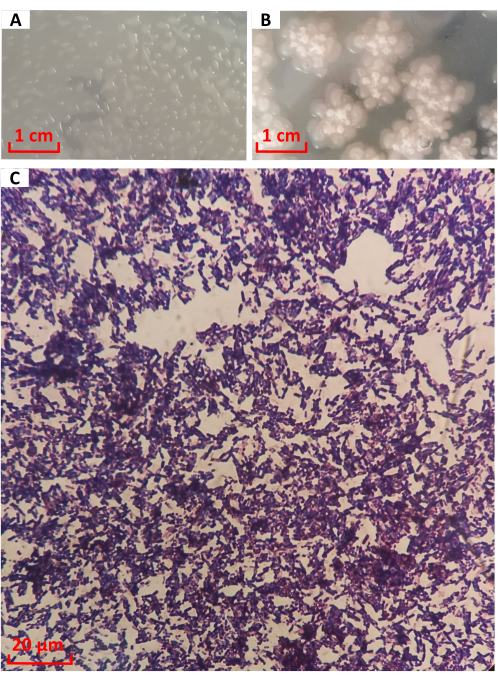
Figura 3: Características morfológicas y tinción de Gram de la cepa Nº 1026. Morfología de la colonia a (A) 12 h y (B) 24 h. (C) Tinción de Gram. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Identificación biológica molecular de la cepa Nº 1026. (A) Amplificación génica de la cepa Nº 1026 16S ADNr. B) Árbol filogenético de la cepa Nº 1026. Haga clic aquí para ver una versión más grande de esta figura.
| NO. | Título de bacitracina (U/mL) | NO. | Título de bacitracina (U/mL) |
| 1003 | 423.57±18.62 | 1021 | 317,46±13,46 |
| 1004 | 325.82±13.23 | 1026 | 456,35±21,75 |
| 1009 | 326.26±14.52 | 1027 | 435.57±19.18 |
| 1011 | 376,65±16,11 | 1030 | 382,48±17,64 |
| 1015 | 325.27±12.37 | 1031 | 215,37±11,73 |
| 1016 | 256,56±15,37 | 1039 | 353,67±16,16 |
| 1017 | 352,47±16,47 | 1041 | 342,36±14,36 |
| 1018 | 328.73±16.12 |
Tabla 1: Título de bacitracina de las cepas de actividad antibacteriana.
| Artículos | Resultados | Artículos | Resultados |
| Prueba de crecimiento anaeróbico | + | Prueba de D-manitol | + |
| Ensayo V.P | + | Prueba de gelatina | + |
| Prueba de utilización de citrato | + | Prueba de NaCl al 7% | + |
| Prueba de propionato | + | Prueba de pH5.7 | + |
| Prueba de D-xilosa | + | Prueba de reducción de nitratos | + |
| L-arabinosa | + | Prueba de hidrólisis del almidón | + |
Tabla 2: Identificación fisiológica y bioquímica de la cepa nº 1026.
Discusión
B. licheniformis crece rápidamente con condiciones de cultivo simples y consumo rápido de azúcar, y la tecnología de fermentación madura es útil para ahorrar costos de producción industrial13. La amplia aplicación de B. licheniformis y sus secreciones, la bacitracina, ha determinado su prometedor valor de mercado. En la agricultura, B. licheniformis se emplea como biofertilizante para mejorar el crecimiento de las plantas y la absorción de nutrientes al mejorar la fertilidad del suelo, promover el desarrollo de las raíces y ayudar en la degradación de la materia orgánica15. Para la producción industrial de enzimas, B. licheniformis produce una gama de enzimas como proteasas, amilasas, celulasas y lipasas, lo que determina su valor de mercado insustituible en el procesamiento de alimentos, la fabricación de detergentes, el procesamiento de cuero y la industria textil16. En vista de la actividad farmacológica antibacteriana superior de B. licheniformis y bacitracina, se ha utilizado en el campo de la medicina para tratar una variedad de enfermedades infecciosas inducidas por bacterias y hongos1. Mientras tanto, considerando el crecimiento de plantas herbáceas, así como la acumulación de ingredientes farmacológicamente activos en las plantas, B. licheniformis es un potenciador potencial del crecimiento de las plantas, así como útil para la producción de compuestos como el salidrósido derivado de Rhodiola 17,18. Las ventajas anteriores de B. licheniformis y bacitracina las hacen ampliamente útiles en la industria, la agricultura, la acuicultura, la biotecnología y las industrias médicas. Por lo tanto, la separación y purificación de B. licheniformis con un alto rendimiento de bacitracina es un factor decisivo para garantizar la posterior producción y aplicación a gran escala.
Aunque la bacitracina se puede preparar por síntesis química, los pasos son engorrosos y hay muchos subproductos. En la industria, la bacitracina se produce principalmente por el proceso metabólico secundario de la harina de maíz y la harina de soja fermentada por B. licheniformis. En la producción industrial moderna de bacitracina, el alto costo y el bajo rendimiento dificultan su aplicaciónposterior 10. Por lo tanto, el cribado de cepas de bacitracina de alto rendimiento y la mejora de la tasa de utilización de las materias primas son la clave para mejorar la producción de bacitracina.
En la actualidad, la cría de cepas de bacitracina de alto rendimiento se realiza principalmente mediante la cría natural en el suelo y otros entornos, la cría por mutación utilizando cepas productoras de bacitracina existentes o la cría basada en ingeniería genética. La operación de cría natural es simple y las cepas cribadas tienen una capacidad de producción estable, pero el proceso lleva mucho tiempo y la carga de trabajo es grande. La cría por mutación tiene una alta tasa de mutación y acorta el tiempo de reproducción, pero es posible que la mutación no pueda heredarse de manera estable en las generaciones posteriores16. El mejoramiento genético basado en la ingeniería genética está más dirigido a la obtención de cepas de alto rendimiento10, pero existen problemas de seguridad causados por la introducción de genes exógenos. Las heces de animales adultos sanos contienen abundantes recursos probióticos que pueden mantener el equilibrio de la flora.
En este trabajo, con base en las características de B. licheniformis para producir esporas latentes en ambientes extremos19, se colocó una dilución de heces de cerdo saludables en un ambiente de alta temperatura para matar las bacterias y hongos resistentes al calor que no producen esporas. Dado que M. luteus es sensible a la producción de péptidos bacteriostáticos por B. licheniformis en la etapa tardía del crecimiento y produce un pigmento amarillo para una fácil observación, se utiliza para detectar la actividad antibacteriana en función de la evaluación de la zona de inhibición. De acuerdo con la morfología de la colonia similar a la morfología de B. licheniformis, la morfología celular es en forma de bastoncillo corto, características grampositivas, fisiológicas y bioquímicas de B. licheniformis, el ARN 16 s está estrechamente relacionado con B. licheniformis, de manera que se determina que la cepa nº 1026 es B. licheniformis. La sustancia bacteriostática fue identificada por TLC y HPLC como bacitracina. Así, se obtuvo B. licheniformis productora de bacitracina. Este método también tiene deficiencias, como que el proceso de selección lleva mucho tiempo y la operación requiere cierta experiencia.
En resumen, este protocolo experimental introdujo de manera integral y detallada el proceso de adquisición e identificación rutinaria en laboratorio de B. licheniformis productor de bacitracina, que tiene una amplia perspectiva de aplicación y un valor de mercado inestimable20. Estos métodos son simples, factibles y fáciles de implementar, y sin duda serán una referencia efectiva para la producción a gran escala de B. licheniformis. Este artículo también proporciona una idea de cribado para la producción de cepas de otros péptidos antimicrobianos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este estudio contó con el apoyo del Programa Nacional de Investigación y Desarrollo Clave de China (No. 2022YFC2104800) y el Proyecto Six Talent Peaks en la provincia de Jiangsu (No. 2019-NY-058).
Materiales
| Name | Company | Catalog Number | Comments |
| 2 × Phanta Flash Master Mix | Nanjing Vazyme Biotechnology Co., Ltd., Nanjing,China | P252-01 | |
| 2kb DNA Marker | Beijing Trans Biotechnology Co., Ltd., Beijing, China | BM121-01 | |
| Acetonitrile | Shanghai Aladdin Biochemical Technology Co.,Ltd., Shanghai, China | A104443 | |
| Agar powder | Shanghai Macklin Biochemical Technology Co., Ltd., Shanghai, China | A800730 | |
| Agarose | Shanghai Aladdin Biochemical Technology Co.,Ltd., Shanghai, China | A104062 | |
| Ammonium sulfate ((NH4)2SO4) | Sinopharm Chemical Reagent Co., Ltd., Shanghai, China | 10002917 | |
| Autoclave sterilizer | Zealway Instrument Inc., Xiamen, China | GI36DWS | |
| Bacillus biochemical identification strip | Qingdao Haibo Biotechnology Co., Ltd., Qingdao, China | HBIG14 | |
| Bacitracin | Shanghai Yuanye Bio-Technology Co., Ltd., Shanghai, China | B65740 | |
| Bacteria DNA Extraction Kit | Tiangen Biochemical Technology Co., Ltd., Beijing, China | DP209 | |
| Breathable sealing film | Beijing Leiborun Biotechnology Co., Ltd. | BS-QM-01A | |
| Butanol | Shanghai Aladdin Biochemical Technology Co., Ltd., Shanghai, China | B433378 | |
| C18 (5 μm, 4.6 × 250 mm) HPLC column | Rizhao Kepuno New Material Co., Ltd., Rizhao, China | C1805-462510 | |
| Calcium carbonate (CaCO3) | Sinopharm Chemical Reagent Co., Ltd., Shanghai, China | 10005717 | |
| Centrifuge | New Brunswick Scientific Co., Inc., UK | 5452 | |
| Chromatographic tank | Nanjing Tenghui Experimental Technology Co., Ltd., Nanjing, China | P-1 | |
| Conical bottle | Sichuan Shubo Co., Ltd., Chengdu, China | 18012 | |
| Constant temperature incubator | Taist Instrument Co., Ltd., Tianjin, China | GH4500 | |
| Dipotassium phosphate (K2HPO4) | Xilong Chemical Co., Ltd., Guangdong, China | XL0015 | |
| EDTA-2Na | Shanghai Aladdin Biochemical Technology Co.,Ltd., Shanghai, China | E397526 | |
| Electronic balance | Mettler Toledo International Co., Ltd. | FA2104 | |
| Ethyl alcohol | Shanghai Aladdin Biochemical Technology Co.,Ltd., Shanghai, China | E130059 | |
| Gel Midi Purification Kit | Tiangen Biochemical Technology Co., Ltd., Beijing, China | DP302 | |
| Glass rod | Chengdu Yibang Kexi Instrument Co., Ltd. | 1294 | |
| Glucose | Shanghai Macklin Biochemical Technology Co., Ltd., Shanghai, China | D823520 | |
| Gram 's staining solution kit | Qingdao Haibo Biotechnology Co., Ltd., Qingdao, China | HB8278 | |
| High performance liquid chromatograph | Agilent Technologies, Inc., California, America | 1260 | |
| Horizontal electrophoresis apparatus | Beijing Liuyi Biotechnology Co., Ltd., Beijing, China | DYCP-31DN BIOMATE | |
| Inoculation ring | Shanghai Muchen Biotechnology Co., Ltd., Shanghai, China | 3171026 | |
| Magnetic stirrer | Wiggens GmbH Co., Ltd., Germany | WH220 PLUS | |
| Methyl alcohol | Shanghai Aladdin Biochemical Technology Co.,Ltd., Shanghai, China | M116115 | |
| Microcentrifuge tube | Shanghai Muchen Biotechnology Co., Ltd., Shanghai, China | 1351171 | |
| Micrococcus luteus | Bena Culture Collection, Suzhou, China | BNCC102589 | |
| Microporous filter membrane | Nantong Suri Experimental Equipment Co., Ltd. | PES0.22 | |
| Ninhydrin | Shanghai Aladdin Biochemical Technology Co., Ltd., Shanghai, China | N105629 | |
| Optical microscope | Optical Instrument Factory, Shanghai, China | DYS-108 | |
| Pig feces | Nanjing Quanfu Pig Farm, Nanjing, China | ||
| Polymerase chain reaction (PCR) Amplifier | Suzhou Dongsheng Xingye Scientific Instrument Co., Ltd., Suzhou, China | ETC811 | |
| Professional sequencing company | General Biology (Anhui) Co., Ltd., Anhui, China | ||
| Pyridine | Shanghai Aladdin Biochemical Technology Co., Ltd., Shanghai, China | P111516 | |
| Shaker | Taicang Qiangle Experimental Equipment Co., Ltd.,Taicang, China | HYL-C | |
| Silica gel GF254 thin layer plate | Yantai Huayang New Material Co., Ltd., Yantai, China | HPT-HSGF5025023 | |
| Sodium chloride (NaCl) | Shanghai Macklin Biochemical Technology Co., Ltd., Shanghai, China | S805275 | |
| Sodium citrate | Sinopharm Chemical Reagent Co., Ltd., Shanghai, China | C39197100001 | |
| Soluble starch | Shanghai Macklin Biochemical Technology Co., Ltd., Shanghai, China | S817547 | |
| Thermostat water bath | Shanghai Heheng Instrument Equipment Co., Ltd., Shanghai, China | DK-8D | |
| Tryptone | Shanghai Aladdin Biochemical Technology Co., Ltd., Shanghai, China | T139519 | |
| Ultra GelRed | Nanjing Vazyme Biotechnology Co., Ltd., Nanjing,China | GR501-01 | |
| Ultra pure water instrument | Merck KGaA Co., Ltd., Germany | Milli Direct-Q8 | |
| Ultrasonic cleaner | Jiangsu Huaguan Electric Appliance Group Co., Ltd., Jiangsu, China | SB-100DT | |
| Vernier caliper | Sanfeng Company, Japan | N20P | |
| Yeast extract powder | Vicbio Biotechnology Co., Ltd., Beijing, China | LP0021 |
Referencias
- Shleeva, M. O., Kondratieva, D. A., Kaprelyants, A. S. Bacillus licheniformis: A producer of antimicrobial substances, including antimycobacterials, which are feasible for medical applications. Pharmaceutics. 15 (7), 1893 (2023).
- Muras, A., Romero, M., Mayer, C., Otero, A. Biotechnological applications of Bacillus licheniformis. Crit. Rev. Biotechnol. 41 (4), 609-627 (2021).
- He, H., et al. Biotechnological and food synthetic biology potential of platform strain: Bacillus licheniformis. Syn Syst Biotechno. 8 (2), 281-291 (2023).
- Sun, Y., et al. Enhanced β-mannanase production by Bacillus licheniformis by optimizing carbon source and feeding regimes. Prep Biochem Biotech. 52 (7), 845-853 (2022).
- Trunet, C., et al. Suboptimal Bacillus licheniformis and Bacillus weihenstephanensis spore incubation conditions increase heterogeneity of spore outgrowth time. Appl Environ Microb. 86 (6), e02061-e02119 (2020).
- Lee, N. K., Kim, W. S., Paik, H. D. Bacillus strains as human probiotics: characterization, safety, microbiome, and probiotic carrier. Food Sci Biotechnol. 28 (5), 1297-1305 (2019).
- Yi, W., et al. Dietary novel alkaline protease from Bacillus licheniformis improves broiler meat nutritional value and modulates intestinal microbiota and metabolites. Anim Microbiome. 6 (1), 1-16 (2024).
- Vasileios, B., et al. Safety and efficacy of Bacillus licheniformis DSM 32457 as a silage additive for all animal species. EFSA Journal. 17 (8), e05787 (2019).
- Birgit, V., et al. The complete genome sequence of Bacillus licheniformis DSM13, an organism with great industrial potential. J Mol Microb Biotech. 7 (4), 204-211 (2004).
- Zhu, J., et al. Microbial synthesis of bacitracin: Recent progress, challenges, and prospects. Synth Syst Biotechnol. 8 (2), 314-322 (2023).
- Shleeva, M. O., Kondratieva, D. A., Kaprelyants, A. S. Bacillus licheniformis: A producer of antimicrobial substances, including antimycobacterials, which are feasible for medical applications. Pharmaceutics. 15 (7), 1893 (2023).
- Willdigg, J. R., et al. The Bacillus subtilis cell envelope stress-inducible ytpAB operon modulates membrane properties and contributes to bacitracin resistance. J Bacteriol. 206 (3), e0001524 (2024).
- Silva, K. G. S., et al. Effects of bacterial direct-fed microbial mixtures offered to beef cattle consuming finishing diets on intake, nutrient digestibility, feeding behavior, and ruminal kinetics/fermentation profile. J Anim Sci. 102, (2024).
- Jia, D., et al. Probiotic Bacillus licheniformis ZW3 alleviates DSS-induced colitis and enhances gut homeostasis. Int J Mol Sci. 25 (1), 561 (2024).
- Wang, X., et al. Dietary supplementation with Bacillus mixture modifies the intestinal ecosystem of weaned piglets in an overall beneficial way. J Appl Microbiol. 130 (1), 233-246 (2021).
- James, N., et al. Unravelling the potential plant growth activity of halotolerant Bacillus licheniformis NJ04 isolated from soil and its possible use as a green bioinoculant on Solanum lycopersicum L. Environ. Res. 216 (2), 114620 (2024).
- Shen, P., et al. Exploitation of ammonia-inducible promoters for enzyme overexpression in Bacillus licheniformis. J Ind Microbiol Biot. 48 (5-6), (2021).
- Hou, Y., et al. Rhodiola crenulata alleviates hypobaric hypoxia-induced brain injury by maintaining BBB integrity and balancing energy metabolism dysfunction. Phytomedicine. 128, 155529 (2024).
- Fan, B., Chen, T. Y., Zhang, S., Wu, B., He, B. F. Mining of efficient microbial UDP-glycosyltransferases by motif evolution cross plant kingdom for application in biosynthesis of salidroside. Sci Rep. 7 (1), 463 (2017).
- Hugo, R. O., Bernardo, R. B., Alejandra, C. S. R. Potential application of the probiotic Bacillus licheniformis as an adjuvant in the treatment of diseases in humans and animals: A systematic review. Front Microbiol. 13, 993451 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados