Method Article
عزل وتنقية وتحديد Bacillus licheniformis المنتجة للباسيتراسين من البراز الطازج للخنازير السليمة
In This Article
Summary
يوفر هذا البروتوكول وصفا كاملا وشاملا للعملية التفصيلية لعزل وتنقية وتحديد Bacillus licheniformis المنتجة للباسيتراسين من براز الخنازير السليمة.
Abstract
تتمتع Bacillus licheniformis و bacitracin بسوق تطبيقات ضخم وقيمة في مجالات الطب والكيمياء وتربية الأحياء المائية والمنتجات الزراعية والهامشية. لذلك ، فإن اختيار B. licheniformis مع إنتاج عال من الباسيتراسين له أهمية كبيرة. في هذا البروتوكول التجريبي ، تم عزل العصيات ذات الغلة العالية من الباسيتراسين وتنقيتها وتحديدها من البراز الطازج للخنازير السليمة. كما تم اختبار التأثير المثبط لباسيتراسين المستقلب الثانوي على Micrococcus luteus. تم استخدام الكروماتوغرافيا ذات الطبقة الرقيقة والكروماتوغرافيا السائلة عالية الأداء للكشف النوعي والكمي عن الباسيتراسين. تم تحديد الخصائص الفسيولوجية والكيميائية الحيوية ل B. licheniformis بواسطة المجموعات ذات الصلة. العلاقات التطورية ل B. licheniformis تم تحديدها وبناؤها باستخدام اكتشاف تسلسل الجينات. يصف هذا البروتوكول ويقدم عملية العزل والتنقية وتحديد B. licheniformis من براز الطازجة من وجهات نظر متعددة ، مما يوفر طريقة للاستخدام على نطاق واسع ل B. licheniformis و bacitracin في المصانع.
Introduction
Bacillus licheniformis هو نوع من Bacillus في عائلة Firmicutes ، والذي يتم توزيعه على نطاق واسع في بيئات مختلفة مثل الماء والتربة وأمعاء1. B. licheniformis له هيكل قصير وقوي يشبه القضيب ويتحرك بشكلفردي 2. المستعمرة مستديرة ومملة تقريبا ، مع انتفاخ مركزي وحواف أنيقة من الأبيض الرمادي3. لديها قدرة قوية على النمو والتكاثر ويمكنها امتصاص واستخدام العناصر الغذائية من مصادر الكربون المختلفة ، مثل السكريات الأحادية والسكريات والكيتوز والأحماض العضوية4. في المرحلة اللاحقة من النمو والتطور ، B. licheniformis يمكن أن توجد في شكل جراثيم نائمة وتنتج مواد مضادة للبكتيريا مثل الباسيتراسين واللحنة والسطح. يمكنه أيضا مقاومة نقص التغذية والبيئة الخارجية القاسية5. لا يوجد تفضيل واضح للكودون ، ويحدد نظام الإفراز الفعال إفراز البروتين غير المتجانس ل B. licheniformis ، وهو ضعف إفراز Bacillus subtilis6. غالبا ما يستخدم لإنتاج مستحضرات الإنزيم مثل البروتياز والأميليز والسيلولاز7. نظرا لافتقاره إلى السموم الداخلية ، فقد تم اعتماده كسلالة آمنة للطعام ومدرج في QPS من قبل EFSA8. لذلك ، هناك العديد من الاستخدامات المحتملة ، بما في ذلك إنتاج المركبات النشطة بيولوجيا ، والتي لها مجموعة واسعة من التطبيقات في تربية الأحياء المائية والزراعة والأغذية والطب الحيوي والصناعات الدوائية. أيضا ، B. licheniformis هو عنصر مهم في النباتات المعوية الحيوانية ، والتي يمكن أن تعزز لتحسين أداء الإنتاج ، وتحسين توازن الفلورا المعوية ، والوقاية من الأمراض. الجينوم الكامل ل B. licheniformis ATCC14580 تم تحليله في عام 2004 ، وتم فهم المعلومات الأساسية لترجمة النسخ وطي البروتين وآلية الإفرازتدريجيا 9. هذه المعلومات الجينية تجعلها مواتية للتعديل الجيني على المستوى الجزيئي ، مما يساهم في تسهيل إنتاج B . licheniformis على نطاق واسع.
Bacitracin هو مضاد حيوي الببتيد dodecacyclic الذي ينتجه سينثيتيز الببتيد غير الريبوزومي عن طريق التمثيل الغذائي الثانوي في B. subtilis و B. licheniformis. الباسيتراسين عبارة عن خليط يتكون من مكونات مختلفة مثل الباسيتراسين A و B و C ، حيث يختلف واحد أو اثنين من الأحماض الأمينية بين كل مكون. من بين هؤلاء ، يحتوي الباسيتراسين أ على أقوى نشاط بيولوجي10. يمكن أن يثبط الباسيتراسين البكتيريا موجبة الجرام مثل المكورات العنقودية والمكورات الدقيقة الزيرية وبعض البكتيريا سالبة الجرام عن طريق تثبيط تكوين جدار الخلية والتفاعل مع البروتينات المرتبطة بالغشاء11. وفي الوقت نفسه ، فإن الباسيتراسين آمن ومستقر ، وليس من السهل إنتاج مقاومة للأدوية ، ويمكن أن يكون متوافقا مع الأدوية الأخرى المضادةللبكتيريا 12. لذلك ، يستخدم الباسيتراسين في الممارسة الطبية والبيطرية. بالإضافة إلى ذلك ، نظرا لمعدل التخلص السريع ومعدل الامتصاص المنخفض ، يمكن استخدامه أيضا كمادة مضافة لتغذية13.
B. licheniformis يمكن أن تستعمر الأمعاء وتحسن البيئة المكروية المعدية المعوية. تختلف القدرة على الالتصاق والتكاثر والوظائف الفسيولوجية ذات الصلة للعصيات من مصادر مختلفة في الجهاز الهضمي للحيوانات المختلفة. المشتق من الخنازير B. licheniformis هو أكثر ملاءمة للاستعمار في أمعاء الخنازير والماشية الأخرى. هناك علاقة وثيقة بين الوفرة النسبية للبروبيوتيك المعوي والحالة الصحية للمضيف14. المكملات الغذائية مع B. licheniformis مزيج في الخنازير المفطومة يحسن النظام البيئي المعوي عن طريق تغيير تكوين الجراثيم والنشاط الأيضي ، ويؤثر أيضا على الغشاء المخاطي المعوي15. يمكن أن يعكس براز نوع وكمية النباتات المعوية الحيوانية. يصف هذا البروتوكول عزل وتنقية Bacillus spp. المنتجة للباسيتراسين من براز الخنازير السليمة. البراز مشتق من بذار Taihu التي لا تتغذى على الأعلاف المركبة ولها أداء إنتاج ممتاز في مزارع الخنازير. تم تحديد العزلات على أنها B. licheniformis بناء على خصائصها المورفولوجية وخصائصها الفيزيائية والكيميائية وتحديد الكيمياء الحيوية.
Protocol
تم توثيق جميع الإجراءات التجريبية والموافقة عليها من قبل لجنة الأخلاقيات بجامعة نانجينغ للتكنولوجيا. تم اشتقاق البراز من بذار Taihu يبلغ من العمر حوالي عامين (انظر جدول المواد) ، والتي تم تربيتها في مزارع الخنازير المهنية والقياسية.
1. إعداد وسائل الإعلام
- الوسط السائل Luria-Bertani (LB): أضف 10 جم من كلوريد الصوديوم ، و 5 جم من مسحوق مستخلص الخميرة ، و 10 جم من التربتون في زجاجة مخروطية ، أضف الماء المقطر إلى 1 لتر ، وحرك ، ثم قم بإذابة قضيب زجاجي. انقل 100 مل من الزجاجة المخروطية المتوسطة إلى زجاجة مخروطية سعة 500 مل واربطها بإحكام بغشاء مانع للتنفس. تعقيم عند 121 درجة مئوية في الأوتوكلاف لمدة 20 دقيقة (انظر جدول المواد).
- رطل صلب متوسط: أضف 10 جم كلوريد الصوديوم ، 5 جم من مسحوق مستخلص الخميرة ، 10 جم من التربتون ، 20 جم من مسحوق أجار إلى زجاجة مخروطية الشكل ، أضف الماء المقطر إلى 1 لتر ، ثم قم بإذابة بقضيب زجاجي ، واربطها بإحكام بغشاء مانع للتنفس تعقيم عند 121 درجة مئوية في الأوتوكلاف لمدة 20 دقيقة. عندما يبرد الوسط إلى 50 درجة مئوية ، اسكب 20 مل من الوسط في أطباق بتري ، واتركها لتبرد ، ثم قم بتخزينها رأسا على عقب.
- وسط تخمير الباسيتراسين: أضف 8 جم من دقيق فول الصويا ، و 4 جم من النشا القابل للذوبان ، و 0.1 جم (NH4) 2SO4 ، و 0.6 جم CaCO3 ، و 100 مل من الماء المقطر إلى زجاجة مخروطية سعة 500 مل ، وحركها بقضيب زجاجي لتذوب جيدا ، واربطها بإحكام بغشاء مانع للتنفس. تعقيم عند 121 درجة مئوية في الأوتوكلاف لمدة 20 دقيقة (انظر جدول المواد).
- تعليق M. luteus: حدد حلقة من M. luteus وتلقيح على لوحة ثقافة LB ، المحضرة في الخطوة 1.2 (انظر جدول المواد). استزراع في حاضنة درجة حرارة ثابتة عند 37 درجة مئوية لمدة 16 ساعة (انظر جدول المواد). أضف 5 مل من المحلول الملحي العادي إلى الطبق ورجه برفق لتصفية المستعمرات. قم بقياس OD600 وتخفيف المحلول في أنبوب اختبار للحصول على تعليق مع OD600 من 0.3-0.7. قم بتخزين معلق M. luteus عند 4 درجات مئوية لاستخدامه لاحقا.
- وسط فحص النشاط المضاد للبكتيريا: أضف 1 مل من معلق M. luteus ، المحضر في الخطوة 1.4 ، إلى 100 مل من الوسط الصلب السائل LB المحضر في الخطوة 1.2 ورجه قليلا. خذ على الفور 5 مل من هذا المحلول الذي يحتوي على M. luteus ووزعه بالتساوي على لوحة ثقافة LB.
2. عزل وتنقية العصيات من البراز الطازج للخنازير السليمة
- أضف 9 مل من المحلول الملحي العادي و 1.0 جم من براز الخنازير الطازجة في قارورة إرلينمايير سعة 150 مل. يقلب باستخدام محرك مغناطيسي (انظر جدول المواد) في درجة حرارة الغرفة عند 60 دورة في الدقيقة / دقيقة لمدة 15 دقيقة.
- ضع مستخلص البراز في حمام مائي ترموستات 80 درجة مئوية (انظر جدول المواد) لمدة 20 دقيقة لقتل البكتيريا غير المنتجة للأبواغ.
- أضف المعلق إلى 100 مل من الوسط السائل LB في قارورة Erlenmeyer سعة 250 مل وزراعته في شاكر (انظر جدول المواد) عند 180 دورة في الدقيقة / دقيقة عند 37 درجة مئوية لمدة 8 ساعات.
- إجراء التخفيف التسلسلي للمحلول البكتيري المزروع بمحلول ملحي عادي من 10-1 إلى 10-8. ضع 0.1 مل من 10-6 و 10-7 و 10-8 مخفف بكتيري على ألواح ثقافة LB الفردية واتركها تجف. بعد 10 دقائق ، ضع الأطباق رأسا على عقب في حاضنة درجة حرارة ثابتة عند 37 درجة مئوية لمدة 48 ساعة.
- استخدم حلقة التلقيح لاختيار المستعمرات التي تشبه B. licheniformis (اللون الأبيض الكريمي ، والاتساق الناعم ، والمظهر المخاطي ، والارتفاع المحدب ، والارتفاع المسطح ، والشكل غير المنتظم) 16وقم بخطها باستخدام نمط متعرج على وسط فحص النشاط المضاد للبكتيريا المحضر في الخطوة 1.5 (انظر الشكل 1).
- ضع الألواح في الحاضنة عند 37 درجة مئوية لمدة 48 ساعة ولاحظ ما إذا كانت هناك منطقة تثبيط حول المستعمرة.
3. فحص تثبيط نشاط المتفطرة الزهرية
- حدد مستعمرة واحدة ولدت منطقة مثبطة وأضفها إلى 100 مل من الوسط السائل LB ، وزراعت في شاكر عند 37 درجة مئوية و 180 دورة في الدقيقة / دقيقة لمدة 12 ساعة.
- تلقيح 5 مل من وسط الاستزراع في وسط تخمير الباسيتراسين المحضر في الخطوة 1.3 والزراعة عند 37 درجة مئوية لمدة 48 ساعة.
- اجمع مرق التخمير في أنبوب طرد مركزي وجهاز طرد مركزي عند 13،400 × جم عند 4 درجات مئوية لمدة 15 دقيقة ، ثم قم بالتصفية باستخدام غشاء مرشح صغير يسهل اختراقه 0.22 ميكرومتر (انظر جدول المواد).
- أضف كوب أكسفورد إلى صفيحة متوسطة لفحص النشاط المضاد للبكتيريا ثم أضف 50 ميكرولتر من المرشح (طافي التخمير) إلى كوب أكسفورد (انظر جدول المواد). استزراع في حاضنة عند 37 درجة مئوية لمدة 12 ساعة. بعد الحضانة ، قم بقياس قطر المنطقة المثبطة باستخدام الفرجار الورني (انظر جدول المواد).
- حدد السلالات والمادة الطافية للتخمير المقابلة بقطر منطقة مثبطة أكبر من 15 مم للتجارب اللاحقة.
4. تحديد العصيات عن طريق الكروماتوغرافيا ذات الطبقة الرقيقة
- أضف 60 مجم من معيار الباسيتراسين وقم بإذابة 1٪ EDTA-2Na (انظر جدول المواد) في زجاجة حجمية سعة 10 مل لصنع محلول 6.0 مجم / مل من العصيات.
- خفف 1 مل من المادة الطافية للتخمير إلى 10 مل باستخدام 1٪ EDTA-2Na. ضع 5 ميكرولتر من العينة و 5 ميكرولتر من محلول الباسيتراسين القياسي على صفيحة الطبقة الرقيقة من هلام السيليكا المنشط (انظر جدول المواد).
- أضف 100 مل من n-butanol-acetic acid-water-pyridine-ethanol (60:15:10:6:5) إلى الخزان الكروماتوغرافي (انظر جدول المواد). ضع صفيحة الطبقة الرقيقة من هلام السيليكا في الخزان الكروماتوجرافي. غطيها واتركيها في درجة حرارة الغرفة لمدة 30 دقيقة.
- أخرج صفيحة الطبقة الرقيقة من هلام السيليكا ، ورش محلول البيوتانول البيريدين (99: 1) الذي يحتوي على 1٪ نينهيدرين (انظر جدول المواد) ، وقم بتسخينه عند 105 درجة مئوية لمدة 5 دقائق حتى تظهر بقع حمراء بنية اللون. احسب Rf (قيمة عامل الاستبقاء) للمعيار والعينة وفقا للصيغة التالية:
Rf = مسافة السفر الفورية / مسافة سفر المذيب.
5. الكشف عن العصيات بواسطة HPLC
- أضف 0.3 مل من المادة الطافية للتخمير و 1.2 مل من الإيثانول بنسبة 50٪ في أنبوب طرد مركزي دقيق سعة 2 مل ، ورجه لمدة 5 دقائق باليد ، واتركه عند 4 درجات مئوية لمدة 12 ساعة.
- جهاز طرد مركزي عند 13,400 × جم لمدة 15 دقيقة وقم بالترشيح في زجاجة عينة تحمل علامة S1 مع غشاء مرشح صغير يسهل اختراقه 0.22 ميكرومتر (انظر جدول المواد).
- تحضير محلول الباسيتراسين الأم: أضف معيار الباسيتراسين 0.4 جم (60 وحدة / مجم ؛ انظر جدول المواد) ، 100 مل من 40 جم / لتر EDTA-2Na (انظر جدول المواد) في قارورة حجمية سعة 100 مل لتحضير محلول أم 240 وحدة / مل.
- أضف 3 مل من محلول الباسيتراسين الأم و 21 و 9 و 3 و 1 و 0 مل من الماء فائق النقاء لأنابيب الاختبار المسماة A1 و B1 و C1 و D1 و E1 ، على التوالي. بعد الترشيح باستخدام غشاء مرشح صغير يسهل اختراقه 0.22 ميكرومتر ، ضع المرشح في زجاجات عينات تحمل علامة A2 و B2 و C2 و D2 و E2.
ملاحظة: تركيزات محلول الباسيتراسين القياسي هي 30 و 60 و 120 و 180 و 240 وحدة / مل. - ضع A2 و B2 و C2 و D2 و E2 و S1 في درج الاختبار الخاص بأداة HPLC. ضع 1000 مل من فورمات الأمونيوم 50 ملي / لتر و 1000 مل من الأسيتونيتريل في درج الطور المتحرك وقم بتعيينهما كمرحلتين متنقلتين A و B ، على التوالي.
ملاحظة: يجب ضبط الرقم الهيدروجيني لفورمات الأمونيوم إلى 4.0 مع حمض الفورميك. - قم بتثبيت عمود HPLC C18 (5 ميكرومتر ، 4.6 مم × 250 مم) في الاتجاه الموضح على العمود (انظر جدول المواد).
- اضبط معلمات الطور المتنقل على أنها 0 دقيقة و 77٪ A و 23٪ B ؛ 30 دقيقة ، 70٪ أ و 30٪ ب ؛ 40 دقيقة ، 60٪ أ و 40٪ ب ؛ 50 دقيقة ، 60٪ أ و 40٪ ب ؛ 51 دقيقة ، 77٪ أ و 23٪ ب ؛ 58 دقيقة ، 77٪ أ و 23٪ ب. ضبط حجم العينة على أنه 100 ميكرولتر ؛ معدل التدفق ، 1.0 مل / دقيقة ؛ درجة حرارة العمود ، 30 درجة مئوية.
- انقر على تشغيل زر لتنفيذ البرنامج.
6. التحديد المورفولوجي
- قم بتخفيف السلالة وغلافها بأعلى عيارق للعصيات على صفيحة ثقافة LB وزراعتها في حاضنة عند 37 درجة مئوية لمدة 48 ساعة. تلطيخ ومراقبة مورفولوجيا المستعمرة كما هو موضح أدناه.
- أضف قطرة من الماء النقي المعقم إلى الشريحة ، والتقط كمية صغيرة من المستعمرات ، وأضفها إلى قطرة الماء. قم بتشويه بالتساوي ، واترك الشريحة تجف بشكل طبيعي ، ثم ثبتها على اللهب.
- أضف البنفسج الكريستالي لمدة 1 دقيقة لتلطيخ العينة ثم اشطفها بماء الصنبور. أضف اليود لمدة 1 دقيقة لتلطيخ العينة ثم اشطفها بالماء المقطر.
- أضف 95٪ كحول ، ورج الشريحة لإزالة اللون لمدة 1 دقيقة ، ثم اشطفها بالماء المقطر.
- يضاف الزعفران لمدة 1 دقيقة لتلطيخ العينة ثم يشطف بالماء المقطر. دع الشريحة تجف بشكل طبيعي وراقب مورفولوجيا المستعمرة تحت المجهر مع غمر الزيت (انظر جدول المواد).
7. التحديد الفسيولوجي والكيميائي الحيوي
- أضف 2 مل من المحلول الملحي المعقم في أنبوب الاختبار وقم بتلقيح مستعمرة واحدة من الصفيحة في المحلول الملحي المعقم باستخدام حلقة التلقيح للحصول على تعليق بكتيري.
- أضف 100 ميكرولتر من المعلق البكتيري في كل ثقب لقياس V-P ، والسترات ، والجيلاتين ، و 7٪ كلوريد الصوديوم ، ودرجة الحموضة 5.7 ، وتقليل النترات ، والتحلل المائي للنشا على شريط التعريف الكيميائي الحيوي Bacillus (انظر جدول المواد).
- استخدم حلقة التلقيح لاختيار مستعمرة واحدة أخرى وخطها في النمط المتعرج على الأنبوب الكيميائي الحيوي للنمو اللاهوائي لشريط التعريف الكيميائي الحيوي للعصية .
- استخدم حلقة التلقيح لاختيار المستعمرات الأخرى وثقبها عموديا في المسام لتحديد البروبيونات و D-xyllose و L-arabinose و D-mannitol على شريط تحديد الكيمياء الحيوية Bacillus .
8. تحديد تسلسل جين الإجهاد
- استخرج الحمض النووي للسلالة باستخدام مجموعة أدوات استخراج الحمض النووي للبكتيريا (انظر جدول المواد): أضف 2 مل من سائل البذور إلى أنبوب جهاز طرد مركزي دقيق سعة 5 مل وجهاز طرد مركزي بسعة 11,500 × جم لمدة دقيقة واحدة. تخلص من المادة الطافية ، وأضف 110 ميكرولتر من المخزن المؤقت (يحتوي على 20 ملي مولار تريس ، درجة الحموضة 8.0 ؛ 2 ملي مولار Na2-EDTA ، و 1.2٪ تريتون) و 70 ميكرولتر من محلول الليزوزيم 50 مجم / مل إلى الحبيبات واحتضانها عند 37 درجة مئوية لمدة 30 دقيقة.
- أضف 4 ميكرولتر من 100 مجم / مل RNase A لمدة 15 ثانية واتركه لمدة 5 دقائق في درجة حرارة الغرفة. أضف 20 ميكرولتر من محلول البروتيناز K واخلط جيدا.
- أضف 220 ميكرولتر من المخزن المؤقت GB ، ورجها لمدة 15 ثانية حتى يتم تعليق الحبيبات ، وضعها عند 70 درجة مئوية لمدة 10 دقائق لجعل المحلول واضحا ، وقم بإجراء دوران قصير لإزالة حبات الماء على جدار الأنبوب.
- أضف 220 ميكرولتر من الإيثانول اللامائي ، صدمة كاملة لمدة 15 ثانية ، فصل قصير. انقل المحلول وهطول التلبد إلى عمود الامتزاز CB3 لأنبوب التجميع ، وجهاز الطرد المركزي عند 13,400 × جم لمدة 30 ثانية ، وتخلص من المادة الطافية.
- أضف 500 ميكرولتر من المخزن المؤقت GD في عمود الامتزاز ، وجهاز الطرد المركزي لمدة 30 ثانية عند 13,400 × جم ، وتخلص من المادة الطافية. أضف 600 ميكرولتر من PW إلى العمود ، وجهاز الطرد المركزي لمدة 30 ثانية عند 13,400 × جم ، وتخلص من المادة الطافية.
- ضع عمود الامتزاز مرة أخرى في أنبوب التجميع ، وجهاز الطرد المركزي لمدة دقيقتين عند 13,400 × جم ، وتخلص من المادة الطافية.
- ضع عمود الامتزاز في درجة حرارة الغرفة لمدة 10 دقائق حتى يجف. انقل العمود إلى أنبوب الطرد المركزي وأضف 100 ميكرولتر من المخزن المؤقت المميء TE في منتصف غشاء الامتزاز.
- اتركيه في درجة حرارة الغرفة لمدة 5 دقائق لتجميع التدفق في أنبوب الطرد المركزي وجهاز الطرد المركزي لمدة دقيقتين عند 13,400 × جم.
- أضف 25 ميكرولتر من 2x مزيج رئيسي (انظر جدول المواد) ، و 2.5 ميكرولتر من عينة الحمض النووي التي تم الحصول عليها في الخطوة 8.8 ، و 2 ميكرولتر من التمهيدي الأمامي 27F ، و 2 ميكرولتر من التمهيدي العكسي 1492R ، و 18.5 ميكرولتر من H2O المقطر المزدوج إلى أنبوب PCR سعة 0.1 مل.
ملاحظة: التسلسلات الجينية للبادئات هي 27F: 5'-AGAGTTTGATCCTGGCTCAG-3' و 1492R: 5'-GGTTACCTTGTTACGACTT-3'. - ضع أنبوب PCR في جهاز PCR (انظر جدول المواد) في ظل الظروف التالية: التمسخ المسبق عند 95 درجة مئوية لمدة 10 دقائق ، والتمسخ عند 95 درجة مئوية لمدة 30 ثانية ، والتلدين عند 55 درجة مئوية لمدة 30 ثانية ، والتمديد عند 72 درجة مئوية لمدة 90 ثانية ، والتمديد عند 72 درجة مئوية لمدة 7 دقائق. قم بتشغيل دورة التمسخ والتلدين والتمديد ثلاث خطوات لمدة 32 ضعفا.
- خذ 5 ميكرولتر من المنتج وقم بإجراء الرحلان الكهربائي باستخدام هلام الاغاروز 1٪ عند 120 فولت لمدة 30 دقيقة.
- قم بإذابة 500 مجم من الاغاروز في 50 مل من 1x TAE عازلة. سخني المحلول في الميكروويف لمدة 1-2 دقيقة حتى يذوب الاغاروز تماما. أضف 5 ميكرولتر من صبغة تلطيخ الحمض النووي ، ثم اسكبها في صينية هلام وأدخل لوحة الفتحة. اتركيه في درجة حرارة الغرفة لمدة 30 دقيقة حتى يتماسك. ضع الجل في خزان الرحلان الكهربائي وأضف 1x عازلة TAE لغمر الجل. أضف 2 ميكرولتر من سلم الحمض النووي 2 كيلو بايت (10 مجم / ميكرولتر) في البئر الأول و 5 ميكرولتر منتج PCR ممزوج ب 1 ميكرولتر من صبغة التحميل إلى الآبار المتبقية في الجل.
- ضع الجل في نظام التصوير الهلامي والتقط صورة. قص شرائط الحمض النووي بسرعة تحت الأشعة فوق البنفسجية ووزنها.
- أضف شرائط إلى أنبوب الطرد المركزي الدقيق وأضف حجما متساويا من محلول PN. احتفظ بالأنبوب في حمام مائي عند 50 درجة مئوية حتى يذوب الجل تماما.
- أضف 500 ميكرولتر من BL السائل التوازني إلى عمود الامتزاز CA2 ، وجهاز الطرد المركزي عند 13,400 × جم لمدة دقيقة واحدة ، وتخلص من المادة الطافية.
- أضف محلول الجل المذاب إلى عمود الامتزاز CA2 وضعه في درجة حرارة الغرفة لمدة دقيقتين ، وقم بطرده عند 13,400 × جم لمدة 30 ثانية ، وتخلص من المادة الطافية.
- أضف 600 ميكرولتر من PW إلى عمود الامتزاز CA2 ، وجهاز الطرد المركزي عند 13,400 × جم لمدة دقيقة واحدة ، وتخلص من المادة الطافية ، وكرر 1x.
- ضع عمود الامتزاز CA2 في أنبوب تجميع ، وجهاز طرد مركزي عند 13,400 × جم لمدة دقيقتين ، وتخلص من المادة الطافية.
- ضع عمود الامتزاز CA2 في درجة حرارة الغرفة لمدة 10 دقائق حتى يجف تماما ثم ضعه في أنبوب طرد مركزي نظيف.
- أضف 50 ميكرولتر من المخزن المؤقت EB إلى فيلم الامتزاز المعلق في درجة حرارة الغرفة لمدة دقيقتين ، واجمع محلول الحمض النووي عن طريق الطرد المركزي عند 13,400 × جم لمدة دقيقتين.
ملاحظة: يتم تضمين المحاليل أو الكواشف المذكورة أعلاه في مجموعة التنقية (انظر جدول المواد).- أرسل حل الحمض النووي الذي تم جمعه إلى شركة تسلسل محترفة (انظر جدول المواد) للتسلسل. قارن نتائج التسلسل بواسطة Blast في قاعدة بيانات GenBank الخاصة ب NCBI. وفقا لتماثل التسلسل ، حدد سلالات مختلفة وقم ببناء أشجار النشوء والتطور بطريقة الاحتمالية القصوى في MEGA-X لتحديد علاقات الأنواع بين السلالات.
النتائج
في هذه التجربة ، تم عزل 48 سلالة من العصيات من البراز الطازج للخنازير السليمة ، والتي تم ترقيمها من 1001 إلى 1048. من بينها ، كان 15 سلالة لها نشاط مضاد للبكتيريا ضد M. luteus. من السلالات ال 15 ، تم قياس عيار الباسيتراسين بواسطة كروماتوغرافيا سائلة عالية الأداء ، كما هو موضح في الجدول 1. من بينها ، B. licheniformis رقم 1026 كان أعلى عيار للعصيات ، 456.35 ± 21.75 وحدة / مل ، لذلك تم اختيار رقم 1026 للتجارب اللاحقة.
تظهر نتائج التعريف بواسطة TLC في الشكل 2 أ. كان موضع البقع الرئيسية في مرق التخمير للسلالة رقم 1026 والمحلول القياسي للباسيتراسين هو نفسه ، وكانت قيمة Rf 0.61. بالنسبة لتحليل HPLC ، فإن معادلة المنحنى القياسية للباسيتراسين هي y = 50.287x - 250.55 ، ومعامل الارتباط R2 = 0.9968 (الشكل 2 ب). كان وقت الذروة للطافي التخمير متسقا مع معيار الباسيتراسين (الشكل 2 ج) ، لذلك تم تحديد المادة المضادة للجراثيم على أنها باسيتراسين ، وكان عيار الباسيتراسين 456.35 ± 21.75 وحدة / مل.
تمت زراعة مستعمرة السلالة رقم 1026 على وسط LB لمدة 12 ساعة ، كما هو موضح في الشكل 3 أ. كانت المستعمرة مستديرة وشفافة على شكل قطرات ماء ، مع نتوءات كاملة وحواف أنيقة. من 12 ساعة إلى 24 ساعة ، دخلت البكتيريا المراحل اللاحقة من النمو. كما هو موضح في الشكل 3 ب ، انتشرت المستعمرات في شكل برقوق ، وتشكل المركز مطويا ، وتعمق اللون تدريجيا إلى أبيض حليبي. يتوافق مع وصف مورفولوجيا مستعمرة B. licheniformis16. كان هناك مخاط شفاف على الحافة. بعد تلطيخ الجرام ، لوحظت السلالة رقم 1026 تحت المجهر ، كما هو موضح في الشكل 3 ج. كانت الخلايا قضبان أرجوانية ، مما يشير إلى البكتيريا موجبة الجرام.
كما هو موضح في الجدول 2 ، يمكن أن تنمو السلالة رقم 1026 في بيئة لاهوائية. تم اختبار السلالة إيجابية لاختبار V-P ، واستخدام السترات ، وتقليل النترات ، والتحلل المائي للنشا. كانت السلالة قادرة على التحلل واستخدام معظم مصادر الكربون. كان لها نفس الخصائص الفسيولوجية والكيميائية الحيوية مثل B. licheniformis.
كان حجم جزء 16S rDNA للسلالة رقم 1026 حوالي 1400 نقطة أساس في الحجم (الشكل 4 أ). أظهرت نتائج تسلسل السلالة رقم 1026 تشابها بنسبة 99.58٪ مع تلك الموجودة في B. licheniformis DSM 13 في بنك الجينر. ثم تم بناء شجرة النشوء والتطور ، كما هو موضح في الشكل 4 ب. طول الفرع التطوري ل B. licheniformis DSM 13 هو 0.000 ، مما يشير إلى أنه B. licheniformis.
بناء على الخصائص المورفولوجية والفسيولوجية والكيميائية الحيوية للسلالة رقم 1026 وتحليل التماثل لتسلسل جين 16S rDNA ، تم تحديد السلالة رقم 1026 على أنها B. licheniformis.

الشكل 1: رسم تخطيطي لتلقيح السلالة. تم استخدام حلقة التلقيح لاختيار المستعمرات وتمييزها بنمط متعرج على وسط فحص النشاط المضاد للبكتيريا. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تحديد المواد المضادة للجراثيم. (أ) كروماتوغرافيا الطبقة الرقيقة. (ب) منحنى HPLC القياسي للباسيتراسين. (ج) كروماتوجرام HPLC. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
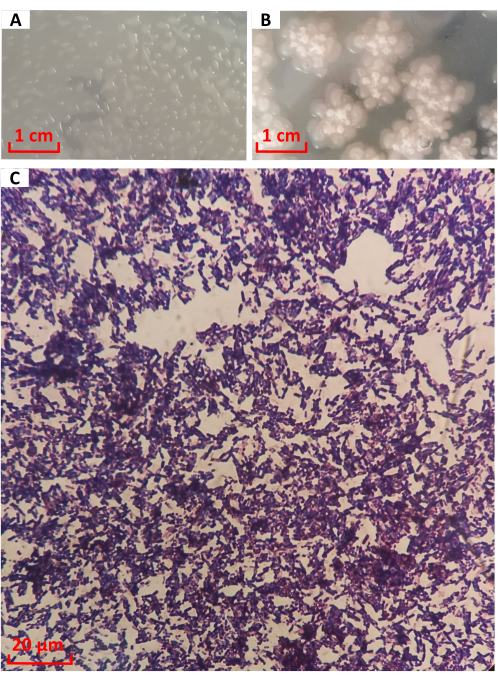
الشكل 3: الخصائص المورفولوجية وتلوين الجرام للسلالة رقم 1026. مورفولوجيا المستعمرة عند (أ) 12 ساعة و (ب) 24 ساعة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: التحديد البيولوجي الجزيئي للسلالة رقم 1026. (أ) تضخيم الجينات للسلالة رقم 1026 16S rDNA. (ب) شجرة النشوء والتطور للسلالة رقم 1026. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| لا. | عيار الباسيتراسين (U/مل) | لا. | عيار الباسيتراسين (U/مل) |
| 1003 | 423.57±18.62 | 1021 | 317.46±13.46 |
| 1004 | 325.82±13.23 | 1026 | 456.35±21.75 |
| 1009 | 326.26±14.52 | 1027 | 435.57±19.18 |
| 1011 | 376.65±16.11 | 1030 | 382.48±17.64 |
| 1015 | 325.27±12.37 | 1031 | 215.37±11.73 |
| 1016 | 256.56±15.37 | 1039 | 353.67±16.16 |
| 1017 | 352.47±16.47 | 1041 | 342.36±14.36 |
| 1018 | 328.73±16.12 |
الجدول 1: عيار الباسيتراسين لسلالات النشاط المضاد للبكتيريا.
| العناصر | النتائج | العناصر | النتائج |
| اختبار النمو اللاهوائي | + | اختبار D-manitol | + |
| فحص VP | + | اختبار الجيلاتين | + |
| اختبار استخدام السترات | + | 7٪ اختبار كلوريد الصوديوم | + |
| اختبار البروبيونات | + | اختبار الرقم الهيدروجيني 5.7 | + |
| اختبار D-xylose | + | اختبار تقليل النترات | + |
| ل-أرابينوز | + | اختبار التحلل المائي للنشا | + |
الجدول 2: التحديد الفسيولوجي والكيميائي الحيوي للسلالة رقم 1026.
Discussion
ينمو B. licheniformis بسرعة مع ظروف الاستزراع البسيطة والاستهلاك السريع للسكر ، وتقنية التخمير الناضجة مفيدة في توفير تكاليف الإنتاج الصناعي13. حدد التطبيق الواسع ل B. licheniformis وإفرازاته ، الباسيتراسين ، قيمته السوقية الواعدة. في الزراعة ، B. licheniformis يستخدم كسماد حيوي لتحسين نمو النبات وامتصاص المغذيات من خلال تعزيز خصوبة التربة ، وتعزيز نمو الجذور ، والمساعدة في تحلل الموادالعضوية 15. لإنتاج الإنزيمات الصناعية ، B. licheniformis ينتج مجموعة من الإنزيمات مثل البروتياز والأميليز والسيلولاز والليباز ، مما يحدد قيمته السوقية التي لا يمكن الاستغناء عنها في تجهيز الأغذية ، وتصنيع المنظفات ، ومعالجة الجلود ، وصناعةالنسيج 16. في ضوء النشاط الدوائي المضاد للبكتيريا المتفوق ل B. licheniformis و bacitracin ، فقد تم استخدامه في المجال الطبي لعلاج مجموعة متنوعة من الأمراض المعدية التي تسببها البكتيريا والفطريات1. وفي الوقت نفسه ، بالنظر إلى نمو النباتات العشبية وكذلك تراكم المكونات النشطة دوائيا في النباتات ، B. licheniformis هو محسن محتمل لنمو النبات وكذلك مفيد لإنتاج مركبات مثل ساليدروسيد المشتقة من رهوديولا 17،18. المزايا المذكورة أعلاه ل B. licheniformis و bacitracin تجعلها مفيدة على نطاق واسع في الصناعة والزراعة وتربية الأحياء المائية والتكنولوجيا الحيوية والصناعات الطبية. لذلك ، فإن فصل وتنقية B. licheniformis مع إنتاجية عالية من الباسيتراسين هو عامل حاسم في ضمان الإنتاج والتطبيق اللاحق على نطاق واسع.
على الرغم من أنه يمكن تحضير الباسيتراسين عن طريق التخليق الكيميائي ، إلا أن الخطوات مرهقة ، وهناك العديد من المنتجات الثانوية. في الصناعة ، يتم إنتاج الباسيتراسين بشكل أساسي عن طريق عملية التمثيل الغذائي الثانوية لدقيق الذرة ووجبة فول الصويا المخمرة بواسطة B. licheniformis. في الإنتاج الصناعي الحديث للباسيتراسين ، تعيق التكلفة العالية والعائد المنخفض تطبيقهالإضافي 10. لذلك ، فإن فحص سلالات الباسيتراسين عالية الإنتاجية وتحسين معدل استخدام المواد الخام هما المفتاح لتحسين إنتاج الباسيتراسين.
في الوقت الحاضر ، يتم تربية سلالات الباسيتراسين عالية الغلة بشكل أساسي من خلال التكاثر الطبيعي من التربة والبيئات الأخرى ، أو تربية الطفرات باستخدام السلالات المنتجة للباسيتراسين الحالية ، أو التربية القائمة على الهندسة الوراثية. عملية التربية الطبيعية بسيطة ، وتتمتع السلالات التي تم فحصها بقدرة إنتاجية مستقرة ، لكن العملية تستغرق وقتا طويلا ، وعبء العمل كبير. تكاثر الطفرات له معدل طفرات مرتفع ويقصر وقت التكاثر ، ولكن قد لا تكون الطفرة قادرة على التوريث بثبات في الأجيالاللاحقة 16. يتم استهداف التربية القائمة على الهندسة الوراثية بشكل أكبر للحصول على سلالات عالية الغلة10 ، ولكن هناك مخاوف تتعلق بالسلامة ناتجة عن إدخال الجينات الخارجية. يحتوي براز البالغة الصحي على موارد بروبيوتيك وفيرة يمكنها الحفاظ على توازن النباتات.
في هذه الورقة ، بناء على خصائص B. licheniformis لإنتاج جراثيم نائمة في البيئات القاسية19 ، تم وضع تخفيف براز الخنازير الصحي في بيئة ذات درجة حرارة عالية لقتل البكتيريا والفطريات المقاومة للحرارة غير المنتجة للأبواغ. نظرا لأن M. luteus حساس لإنتاج الببتيدات المضادة للجراثيم بواسطة B. licheniformis في المرحلة المتأخرة من النمو وينتج صبغة صفراء لسهولة الملاحظة ، فإنه يستخدم لفحص النشاط المضاد للبكتيريا بناء على تقييم منطقة التثبيط. وفقا لمورفولوجيا المستعمرة المشابهة لمورفولوجيا B. licheniformis ، فإن مورفولوجيا الخلية قصيرة الشكل ، موجبة الجرام ، الخصائص الفسيولوجية والكيميائية الحيوية ل B. licheniformis ، 16 s RNA يرتبط ارتباطا وثيقا ب B. licheniformis ، وذلك لتحديد أن السلالة رقم 1026 هي B. licheniformis. تم تحديد المادة المضادة للجراثيم بواسطة TLC و HPLC على أنها باسيتراسين. وهكذا ، المنتج للباسيتراسين B. licheniformis . تحتوي هذه الطريقة أيضا على أوجه قصور ، مثل عملية الفحص التي تستغرق وقتا طويلا وتتطلب العملية بعض الخبرة.
باختصار ، قدم هذا البروتوكول التجريبي بشكل شامل ومفصل عملية الاستحواذ وتحديد المختبر الروتيني ل B. licheniformis المنتج للباسيتراسين ، والذي له آفاق تطبيق واسعة وقيمة سوقية لا تقدر بثمن20. هذه الطرق بسيطة ومجدية وسهلة التنفيذ ، وستكون بلا شك مرجعا فعالا لإنتاج B . licheniformis على نطاق واسع. تقدم هذه الورقة أيضا فكرة فحص لإنتاج سلالات للببتيدات المضادة للميكروبات الأخرى.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذه الدراسة من قبل البرنامج الوطني للبحث والتطوير الرئيسي في الصين (رقم 2022YFC2104800) ، ومشروع قمم المواهب الست في مقاطعة جيانغسو (رقم 2019-NY-058).
Materials
| Name | Company | Catalog Number | Comments |
| 2 × Phanta Flash Master Mix | Nanjing Vazyme Biotechnology Co., Ltd., Nanjing,China | P252-01 | |
| 2kb DNA Marker | Beijing Trans Biotechnology Co., Ltd., Beijing, China | BM121-01 | |
| Acetonitrile | Shanghai Aladdin Biochemical Technology Co.,Ltd., Shanghai, China | A104443 | |
| Agar powder | Shanghai Macklin Biochemical Technology Co., Ltd., Shanghai, China | A800730 | |
| Agarose | Shanghai Aladdin Biochemical Technology Co.,Ltd., Shanghai, China | A104062 | |
| Ammonium sulfate ((NH4)2SO4) | Sinopharm Chemical Reagent Co., Ltd., Shanghai, China | 10002917 | |
| Autoclave sterilizer | Zealway Instrument Inc., Xiamen, China | GI36DWS | |
| Bacillus biochemical identification strip | Qingdao Haibo Biotechnology Co., Ltd., Qingdao, China | HBIG14 | |
| Bacitracin | Shanghai Yuanye Bio-Technology Co., Ltd., Shanghai, China | B65740 | |
| Bacteria DNA Extraction Kit | Tiangen Biochemical Technology Co., Ltd., Beijing, China | DP209 | |
| Breathable sealing film | Beijing Leiborun Biotechnology Co., Ltd. | BS-QM-01A | |
| Butanol | Shanghai Aladdin Biochemical Technology Co., Ltd., Shanghai, China | B433378 | |
| C18 (5 μm, 4.6 × 250 mm) HPLC column | Rizhao Kepuno New Material Co., Ltd., Rizhao, China | C1805-462510 | |
| Calcium carbonate (CaCO3) | Sinopharm Chemical Reagent Co., Ltd., Shanghai, China | 10005717 | |
| Centrifuge | New Brunswick Scientific Co., Inc., UK | 5452 | |
| Chromatographic tank | Nanjing Tenghui Experimental Technology Co., Ltd., Nanjing, China | P-1 | |
| Conical bottle | Sichuan Shubo Co., Ltd., Chengdu, China | 18012 | |
| Constant temperature incubator | Taist Instrument Co., Ltd., Tianjin, China | GH4500 | |
| Dipotassium phosphate (K2HPO4) | Xilong Chemical Co., Ltd., Guangdong, China | XL0015 | |
| EDTA-2Na | Shanghai Aladdin Biochemical Technology Co.,Ltd., Shanghai, China | E397526 | |
| Electronic balance | Mettler Toledo International Co., Ltd. | FA2104 | |
| Ethyl alcohol | Shanghai Aladdin Biochemical Technology Co.,Ltd., Shanghai, China | E130059 | |
| Gel Midi Purification Kit | Tiangen Biochemical Technology Co., Ltd., Beijing, China | DP302 | |
| Glass rod | Chengdu Yibang Kexi Instrument Co., Ltd. | 1294 | |
| Glucose | Shanghai Macklin Biochemical Technology Co., Ltd., Shanghai, China | D823520 | |
| Gram 's staining solution kit | Qingdao Haibo Biotechnology Co., Ltd., Qingdao, China | HB8278 | |
| High performance liquid chromatograph | Agilent Technologies, Inc., California, America | 1260 | |
| Horizontal electrophoresis apparatus | Beijing Liuyi Biotechnology Co., Ltd., Beijing, China | DYCP-31DN BIOMATE | |
| Inoculation ring | Shanghai Muchen Biotechnology Co., Ltd., Shanghai, China | 3171026 | |
| Magnetic stirrer | Wiggens GmbH Co., Ltd., Germany | WH220 PLUS | |
| Methyl alcohol | Shanghai Aladdin Biochemical Technology Co.,Ltd., Shanghai, China | M116115 | |
| Microcentrifuge tube | Shanghai Muchen Biotechnology Co., Ltd., Shanghai, China | 1351171 | |
| Micrococcus luteus | Bena Culture Collection, Suzhou, China | BNCC102589 | |
| Microporous filter membrane | Nantong Suri Experimental Equipment Co., Ltd. | PES0.22 | |
| Ninhydrin | Shanghai Aladdin Biochemical Technology Co., Ltd., Shanghai, China | N105629 | |
| Optical microscope | Optical Instrument Factory, Shanghai, China | DYS-108 | |
| Pig feces | Nanjing Quanfu Pig Farm, Nanjing, China | ||
| Polymerase chain reaction (PCR) Amplifier | Suzhou Dongsheng Xingye Scientific Instrument Co., Ltd., Suzhou, China | ETC811 | |
| Professional sequencing company | General Biology (Anhui) Co., Ltd., Anhui, China | ||
| Pyridine | Shanghai Aladdin Biochemical Technology Co., Ltd., Shanghai, China | P111516 | |
| Shaker | Taicang Qiangle Experimental Equipment Co., Ltd.,Taicang, China | HYL-C | |
| Silica gel GF254 thin layer plate | Yantai Huayang New Material Co., Ltd., Yantai, China | HPT-HSGF5025023 | |
| Sodium chloride (NaCl) | Shanghai Macklin Biochemical Technology Co., Ltd., Shanghai, China | S805275 | |
| Sodium citrate | Sinopharm Chemical Reagent Co., Ltd., Shanghai, China | C39197100001 | |
| Soluble starch | Shanghai Macklin Biochemical Technology Co., Ltd., Shanghai, China | S817547 | |
| Thermostat water bath | Shanghai Heheng Instrument Equipment Co., Ltd., Shanghai, China | DK-8D | |
| Tryptone | Shanghai Aladdin Biochemical Technology Co., Ltd., Shanghai, China | T139519 | |
| Ultra GelRed | Nanjing Vazyme Biotechnology Co., Ltd., Nanjing,China | GR501-01 | |
| Ultra pure water instrument | Merck KGaA Co., Ltd., Germany | Milli Direct-Q8 | |
| Ultrasonic cleaner | Jiangsu Huaguan Electric Appliance Group Co., Ltd., Jiangsu, China | SB-100DT | |
| Vernier caliper | Sanfeng Company, Japan | N20P | |
| Yeast extract powder | Vicbio Biotechnology Co., Ltd., Beijing, China | LP0021 |
References
- Shleeva, M. O., Kondratieva, D. A., Kaprelyants, A. S. Bacillus licheniformis: A producer of antimicrobial substances, including antimycobacterials, which are feasible for medical applications. Pharmaceutics. 15 (7), 1893 (2023).
- Muras, A., Romero, M., Mayer, C., Otero, A. Biotechnological applications of Bacillus licheniformis. Crit. Rev. Biotechnol. 41 (4), 609-627 (2021).
- He, H., et al. Biotechnological and food synthetic biology potential of platform strain: Bacillus licheniformis. Syn Syst Biotechno. 8 (2), 281-291 (2023).
- Sun, Y., et al. Enhanced β-mannanase production by Bacillus licheniformis by optimizing carbon source and feeding regimes. Prep Biochem Biotech. 52 (7), 845-853 (2022).
- Trunet, C., et al. Suboptimal Bacillus licheniformis and Bacillus weihenstephanensis spore incubation conditions increase heterogeneity of spore outgrowth time. Appl Environ Microb. 86 (6), e02061-e02119 (2020).
- Lee, N. K., Kim, W. S., Paik, H. D. Bacillus strains as human probiotics: characterization, safety, microbiome, and probiotic carrier. Food Sci Biotechnol. 28 (5), 1297-1305 (2019).
- Yi, W., et al. Dietary novel alkaline protease from Bacillus licheniformis improves broiler meat nutritional value and modulates intestinal microbiota and metabolites. Anim Microbiome. 6 (1), 1-16 (2024).
- Vasileios, B., et al. Safety and efficacy of Bacillus licheniformis DSM 32457 as a silage additive for all animal species. EFSA Journal. 17 (8), e05787 (2019).
- Birgit, V., et al. The complete genome sequence of Bacillus licheniformis DSM13, an organism with great industrial potential. J Mol Microb Biotech. 7 (4), 204-211 (2004).
- Zhu, J., et al. Microbial synthesis of bacitracin: Recent progress, challenges, and prospects. Synth Syst Biotechnol. 8 (2), 314-322 (2023).
- Shleeva, M. O., Kondratieva, D. A., Kaprelyants, A. S. Bacillus licheniformis: A producer of antimicrobial substances, including antimycobacterials, which are feasible for medical applications. Pharmaceutics. 15 (7), 1893 (2023).
- Willdigg, J. R., et al. The Bacillus subtilis cell envelope stress-inducible ytpAB operon modulates membrane properties and contributes to bacitracin resistance. J Bacteriol. 206 (3), e0001524 (2024).
- Silva, K. G. S., et al. Effects of bacterial direct-fed microbial mixtures offered to beef cattle consuming finishing diets on intake, nutrient digestibility, feeding behavior, and ruminal kinetics/fermentation profile. J Anim Sci. 102, (2024).
- Jia, D., et al. Probiotic Bacillus licheniformis ZW3 alleviates DSS-induced colitis and enhances gut homeostasis. Int J Mol Sci. 25 (1), 561 (2024).
- Wang, X., et al. Dietary supplementation with Bacillus mixture modifies the intestinal ecosystem of weaned piglets in an overall beneficial way. J Appl Microbiol. 130 (1), 233-246 (2021).
- James, N., et al. Unravelling the potential plant growth activity of halotolerant Bacillus licheniformis NJ04 isolated from soil and its possible use as a green bioinoculant on Solanum lycopersicum L. Environ. Res. 216 (2), 114620 (2024).
- Shen, P., et al. Exploitation of ammonia-inducible promoters for enzyme overexpression in Bacillus licheniformis. J Ind Microbiol Biot. 48 (5-6), (2021).
- Hou, Y., et al. Rhodiola crenulata alleviates hypobaric hypoxia-induced brain injury by maintaining BBB integrity and balancing energy metabolism dysfunction. Phytomedicine. 128, 155529 (2024).
- Fan, B., Chen, T. Y., Zhang, S., Wu, B., He, B. F. Mining of efficient microbial UDP-glycosyltransferases by motif evolution cross plant kingdom for application in biosynthesis of salidroside. Sci Rep. 7 (1), 463 (2017).
- Hugo, R. O., Bernardo, R. B., Alejandra, C. S. R. Potential application of the probiotic Bacillus licheniformis as an adjuvant in the treatment of diseases in humans and animals: A systematic review. Front Microbiol. 13, 993451 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved