Method Article
Medición del potencial de membrana mitocondrial in vivo utilizando un indicador de voltaje codificado genéticamente
En este artículo
Resumen
Este protocolo describe la aplicación de indicadores de voltaje codificados genéticamente (GEVI) dirigidos a mitocondrias. Estos GEVI ofrecen una ventaja significativa sobre los colorantes tradicionales de potencial de membrana mitocondrial al permitir el monitoreo específico, in vivo y en tiempo real del potencial de membrana mitocondrial.
Resumen
El potencial de membrana mitocondrial (MMP, ΔΨm) es crítico para las funciones mitocondriales, incluida la síntesis de ATP, el transporte de iones, la generación de especies reactivas de oxígeno (ROS) y la importación de proteínas codificadas por el núcleo. Los métodos existentes para medir ΔΨm suelen utilizar colorantes catiónicos lipofílicos, como la rodamina 800 y el éster metílico de tetrametilrodamina (TMRM), pero están limitados por su baja especificidad y no son adecuados para aplicaciones in vivo . Para abordar estas limitaciones, hemos desarrollado un protocolo novedoso que utiliza indicadores de voltaje codificados genéticamente (GEVI). Los indicadores de voltaje codificados genéticamente (GEVI), que generan señales fluorescentes en respuesta a cambios en el potencial de la membrana, han demostrado un potencial significativo para monitorear los potenciales de la membrana plasmática y neuronales. Sin embargo, su aplicación a las membranas mitocondriales sigue sin explorarse. Aquí, desarrollamos GEVI basados en proteínas dirigidos a mitocondriales capaces de detectar fluctuaciones de ΔΨm en las células y la corteza motora de animales vivos. El indicador de potencial mitocondrial (MPI) ofrece un enfoque no invasivo para estudiar la dinámica de ΔΨm en tiempo real, proporcionando un método para investigar la función mitocondrial tanto en condiciones normales como patológicas.
Introducción
Las mitocondrias son orgánulos esenciales en las células eucariotas, que sirven como proveedores primarios de energía a través de la generación de trifosfato de adenosina (ATP), al tiempo que realizan una variedad de otras funciones cruciales, como la síntesis de metabolitos, la amortiguación de iones de calcio, la producción de calor y la regulaciónde la supervivencia celular. Sus funciones son particularmente críticas en tejidos altamente metabólicos como el cerebro y el corazón, donde ayudan a mantener la homeostasis celular. El potencial de membrana mitocondrial (MMP, Ψm) es fundamental para estos procesos, incluyendo el impulso de la síntesis de ATP a través de la fosforilación oxidativa, facilitando el transporte de metabolitos e iones a través de las membranas mitocondriales y contribuyendo a la generación de especies reactivas de oxígeno (ROS)2,3. La MMP también influye en la morfología y dinámica mitocondrial4, incluyendo la mitofagia (la degradación selectiva de las mitocondrias)5y la apoptosis (muerte celular programada)6. Mantener un Ψm adecuado es esencial para la función celular; Su desregulación está relacionada con numerosas patologías, como enfermedades neurodegenerativas, insuficiencia cardíaca y cáncer. Los métodos actuales para medir Ψm se basaban principalmente en el uso de colorantes catiónicos lipofílicos, incluidos TMRM (éster metílico de tetrametilrodamina), TMRE (éster etílico de tetrametilrodamina), rodamina 123, safranina O, rodamina 800, DiOC6, JC-1, etc.7. Sin embargo, estas moléculas fluorescentes tienen varias limitaciones. Estos tintes carecen de especificidad celular, son susceptibles de extinción y algunos son tóxicos. Además, pueden difundirse con el tiempo, y cuando se pierde el ΔΨ mitocondrial, se fugan, lo que las hace incapaces de indicar el potencial de membrana de las mitocondrias despolarizadas. Además, los colorantes a base de rodamina como TMRM y TMRE son sensibles a la temperatura8, lo que requiere una consideración cuidadosa de los efectos de la temperatura en la fluorescencia del tinte, particularmente cuando se mide el voltaje de la membrana mitocondrial durante actividades fisiológicas que involucran termogénesis celular.
Los indicadores de voltaje codificados genéticamente (GEVI), proteínas capaces de detectar cambios en el potencial de membrana a través de señales fluorescentes 9,10, han surgido como herramientas poderosas para monitorear los potenciales de membrana en una variedad de contextos celulares11. Si bien los GEVI se han aplicado ampliamente para estudiar las membranas plasmáticas, ha habido poco progreso en su adaptación para medir los potenciales de membrana intracelular, particularmente para las mitocondrias. Este protocolo busca abordar esta brecha mediante el uso de GEVI dirigidos a mitocondrias que podrían monitorear el potencial de la membrana mitocondrial in vitro e in vivo. Al agregar la secuencia de señales mitocondriales a los GEVI existentes, se puede dirigir el GEVI apropiado a las mitocondrias12. Estos indicadores de potencial mitocondrial (MPI, por sus siglas en inglés) proporcionarían nuevos conocimientos sobre la fisiología mitocondrial y ofrecerían un potencial significativo para explorar la función mitocondrial en varios estados de enfermedad in vivo, mejorando nuestra comprensión de cómo la dinámica mitocondrial contribuye a los procesos celulares normales y patológicos.
Protocolo
Todos los cuidados y experimentos con animales se realizaron de acuerdo con las directrices del Comité Institucional de Cuidado y Uso de Animales de la Universidad de Zhengzhou. Esterilice todos los instrumentos quirúrgicos antes de usarlos. Siga técnicas asépticas para prevenir infecciones. Una vez obtenidos todos los datos, los animales fueron sacrificados mediante una sobredosis de anestesia inhalante seguida de la decapitación.
1. Aplicaciones in vitro
- Construcción de plásmidos
- Obtener el sensor acelerado de los genes de potenciales de acción 1 (ASAP1) y ASAP3 a partir de Addgene o sintetizando a partir de la secuencia. (ASAP1, ID de acceso NCBI: AHV90412.1, ID de Addgene: 52519; ASAP3, ID de Addgene: 132331).
- Utilice los cebadores enumerados en la Tabla 1 para construcciones de plásmidos.
- Para la expresión en células, utilice el vector EGFPN1 para la construcción.
- Inicialmente, sintetizar la secuencia del gen cox8 (NP_004065, aminoácidos 1-29) con cuatro repeticiones en tándem (4cox8) flanqueadas por sitios de restricción NheI y XhoI. Digiera tanto el fragmento 4cox8 sintetizado como el vector EGFPN1 con NheI y XhoI, seguido de la ligadura para generar el vector 4cox8-EGFP.
- Posteriormente, realice la amplificación por PCR de la secuencia ASAP1 con cebador 1 y cebador 2. Digiera el fragmento ASAP1 y el vector 4cox8-EGFP con SalI y NotI, seguido de la ligadura para generar el vector MPI-1 final (MPI significa indicador de potencial mitocondrial).
NOTA: El mapa vectorial de CMV-MPI-1 se muestra en la Figura 1. Se puede acceder a la secuencia detallada desde NCBI (ID de acceso: PQ678920).
- Para la expresión específica en neuronas, realice la amplificación por PCR de la secuencia promotora de hSyn del plásmido AAV-hSyn-EGFP (NCBI Accession ID: MH458079, Addgene ID: 50465) utilizando el cebador 3 y el cebador 4.
- Digiera tanto la secuencia hSyn como el vector 4cox8-EGFP con AseI y NheI, seguido de la ligadura para generar el vector hSyn-4cox8-EGFP. Posteriormente, realice la amplificación por PCR de la secuencia ASAP3 con cebador 1 y cebador 2.
- Digiera el vector hSyn-4cox8-EGFP y la secuencia ASAP3 con SalI y NotI, seguido de la ligadura para generar el vector hSyn-MPI-2.
NOTA: Las condiciones de PCR variarán en función de las enzimas específicas y las temperaturas de fusión del cebador (Tm). Una reacción típica de PCR implica un paso inicial de desnaturalización a 95 °C durante 30 s, seguido de 25-35 ciclos de desnaturalización (95 °C, 10 s), recocido (55 °C, 30 s) y extensión (72 °C, 30 s/kb). Un último paso de extensión a 72 °C durante 5 minutos garantiza una síntesis completa del producto, seguido de una retención a 4 °C. La temperatura de recocido debe estar aproximadamente 5 °C por debajo de la Tm de los cebadores. Consulte las instrucciones del fabricante para conocer los parámetros óptimos de PCR. Los cebadores para ASAP1 y ASAP3 son idénticos.
- Obtención de imágenes en células vivas
- Prepare el medio de cultivo DMEM añadiendo un 10% de suero fetal bovino y 100 mg/L de penicilina/estreptomicina al medio.
- Prepare reactivos de transfección Ca2+ : 2,5 mol/L CaCl2, 2x HEBS (274 mmol/L NaCl, 10 mmol/L KCl, 1,4 mmol/L Na2HPO4, 15 mmol/L D-glucosa, 42 mmol/L HEPES, pH 7,07).
- Prepare el tampón de Tyrode para mantener las células durante la obtención de imágenes (145 mmol/L de NaCl, 3 mmol/L de KCl, 10 mmol/L de HEPES, 10 mmol/L de glucosa, pH 7,4).
- Cultivo de células Hela en una placa de cultivo de 35 mm alimentada con medio de cultivo DMEM en una incubadora con una temperatura de 37 °C y una atmósfera de 5% CO2/95% de aire. Agregue 2-3 cubreobjetos por plato para permitir que las células crezcan en ellos.
- Transfectar las células Hela mediante el método de precipitación de fosfato de calcio.
- Para transfectar las células, comience por reemplazar el medio de cultivo antiguo con 2 mL de DMEM sin suero. Después de 35 minutos, prepare la solución de ADN/Ca2+ mezclando 10 μg de ADN, 4 μL de CaCl2 y ddH2O hasta un volumen final de 40 μL en un tubo de microcentrífuga.
- Añadir 40 μL de 2x HEBS a la solución de ADN/Ca2+ gota a gota mientras se agita vigorosamente. Burbuja aire con una pipeta en la mezcla para facilitar la precipitación de fosfato de calcio.
- Después de 25 minutos, agregue 80 μL de esta solución precipitada a la placa con las celdas y devuélvala a la incubadora durante otras 1-2 h. A continuación, retire el DMEM no sérico y enjuague las células con glicerol al 15% (disuelto en PBS) durante 2 minutos.
- Después de aspirar el glicerol, agregue 2 mL de DMEM que contenga un 10% de FBS y continúe cultivando las células durante 16-24 h.
- Coloque cubreobjetos con células en una placa de cultivo de 35 mm con 2 mL de tampón Tyrode y tiña las células con colorante de rodamina 800 añadiendo 20 μmol/L de rodamina 800 (disuelta en ddH2O) a la placa hasta una concentración final de 50 nmol/L.
- Prepare un microscopio de fluorescencia y configúrelo con los filtros y la fuente de luz adecuados para excitar la proteína con una fuente de luz de 488 nm y recoger la emisión entre 490-540 nm. Excite el tinte de rodamina 800 con una fuente de luz de 633 nm y recoja la emisión entre 650-720 nm.
- Prepare una solución de cianuro de carbonilo m-clorofenilhidrazona (CCCP) a 500 μM (stock) y agregue a las células hasta una concentración final de 5 μM durante la toma de imágenes.
NOTA: El pH de la solución 2x HEBS es crucial para la eficiencia de la transfección. El pH debe ajustarse cuidadosamente a 7.07 con hidróxido de sodio sólido. El pH no puede ser inferior a 7,01 ni superior a 7,12.

Figura 1: Mapa vectorial de CMV-MPI-1. Haga clic aquí para ver una versión más grande de esta figura.
2. Aplicaciones in vivo
- Construcción de plásmido
- Para la expresión in vivo , utilice el virus AAV para la transducción. Obtenga la columna vertebral de expresión para el empaquetado de AAV (Addgene ID: 46954 o 26968), que contiene secuencias de repeticiones terminales invertidas (ITR) para el empaquetado de virus AAV.
- Realice la amplificación por PCR del vector hSyn-MPI-2 (del paso 1.1.4) utilizando los cebadores 5 y 7 de la Tabla 1.
- Realice una segunda amplificación por PCR utilizando la misma plantilla y los cebadores 6 y 8 de la Tabla 1.
- Realice una PCR final utilizando el producto de la primera y la segunda PCR (pasos 2.1.2 y 2.1.3) como plantilla y los cebadores 5 y 8 de la Tabla 1, generando la secuencia final de hSyn-MPI-2.
- Digiera la secuencia hSyn-MPI-2 y la columna vertebral de pAAV con MluI y EcoRI, seguida de la ligadura para generar la construcción final de pAAV-hSyn-MPI-2. El mapa vectorial de pAAV-hSyn-MPI-2 se ilustra en la Figura 2. Se puede acceder a la secuencia detallada desde NCBI (ID de acceso: PQ678919).
NOTA: El vector hSyn-MPI-2 contiene un sitio EcoRI interno que se origina en la red troncal EGFPN1 original, que se elimina utilizando cebadores modificados en una estrategia de PCR superpuesta (pasos 2.1.2-2.1.4).
- Preparación y transducción de virus
- Cultivo de células HEK293t en una placa de cultivo de 100 mm alimentada con medio de cultivo FBS DMEM al 10% en una incubadora con una temperatura de 37 °C y una atmósfera de 5% de CO2/95% de aire para alcanzar una confluencia del 70%.
- Co-transfecte las células HEK293t con plásmido del gen AAV, cápside (pAAV-DJ o pAAV9) y plásmidos auxiliares (pHelper) utilizando el método de precipitación de fosfato de calcio. La cantidad de ADN para cada plásmido fue la siguiente: gen: 10 μg, pHelper: 11 μg, cápside: 9 μg. La cantidad de reactivo de transfección: 12 μL de CaCl2, 120 μL de 2x HEBS.
- Incubar las células transfectadas durante un período de 72 h para permitir la producción del virus.
- Después del período de incubación, recoja las células por centrífuga a 400 g. Enjuague las células con PBS 2 veces y vuelva a suspender la célula en 400 μL de PBS.
- Cosecha los virus de la suspensión celular con cuatro ciclos de métodos de congelación-descongelación (37 °C y -80 °C). Centrifugar el lisado a 13.500 × g a 4 °C y desechar el pellet. El sobrenadante contiene el virus AAV.
- Realice PCR en tiempo real para determinar la valoración del virus preparado. El protocolo detallado para la determinación de la valoración de AAV se puede encontrar en https://www.addgene.org/protocols/aav-titration-qpcr-using-sybr-green-technology/.
- Alícuota y almacene el virus AAV preparado a -80 °C.
- Inyección estereotáctica de virus
- Anestesiar un ratón macho adulto C57/BL de 24-26 g de peso con pentobarbital sódico al 3% mediante inyección intraperitoneal a una dosis de 30 mg/kg. Una vez anestesiados, fije los ratones en un aparato estereotáxico para mantener una posición estable durante todo el procedimiento.
- Aplique ungüento oftálmico veterinario para proteger los ojos del daño de la luz y para mantener los ojos húmedos.
- Use crema depilatoria para eliminar el vello de la cabeza del ratón y exponer el cuero cabelludo.
- Abra el cuero cabelludo con unas tijeras quirúrgicas y exponga el cráneo. Trate el cráneo con peróxido de hidrógeno al 3% para esterilizar y visualizar puntos de referencia clave como los sitios bregma y lambda.
- Ajuste la posición de la cabeza del ratón para asegurarse de que la calavera esté horizontal.
- Utilice un extractor de micropipetas programable para extraer las pipetas de vidrio de la forma y el tamaño deseados para obtener inyecciones precisas. Llene la micropipeta de vidrio con aceite de parafina.
- Coloque la micropipeta en el lugar de destino. En este protocolo, el objetivo es la región M2 en el lado derecho, utilizando las siguientes coordenadas: AP (antero-posterior), +1,94 mm; ML (mediolateral), +0,75 mm; DV (dorsoventral), -1,5 mm.
- Use un taladro eléctrico para hacer un pequeño agujero en el cráneo en el sitio objetivo.
- Aspire 500 nL de virus a un título de 1,5 x10 11 copias del genoma por mililitro (GC/mL) a través de la punta de la micropipeta. Inyecte 500 nL de virus en el sitio objetivo utilizando una bomba de inyección a un caudal de 100 nL/min.
- Después de la inyección, deje la pipeta en su lugar durante aproximadamente 5 minutos para permitir la difusión antes de retraerla con cuidado.
- Implante fibra óptica (200 μm de diámetro, 0,37 de apertura numérica, 2 mm de longitud) en el lugar de la inyección.
- Asegure la fibra óptica en su lugar con cemento dental.
- Suturar el cuero cabelludo del ratón con hilo de nylon 5-0 (aguja estética Δ1/2 4x12) y devolverlo a su jaula de origen.
- Coloque la jaula casera sobre una almohadilla térmica para mantener la temperatura corporal del ratón hasta que se recupere por completo de la anestesia.
- Apague la almohadilla térmica una vez que el animal comience a moverse. Espere otras 2 horas de aclimatación a la temperatura ambiente (RT) antes de transferir el mouse a la instalación de alojamiento.
- Ratón doméstico en un ciclo de 12 horas de luz/12 horas de oscuridad a 22 °C con acceso ad libitum a alimentos y agua durante 2-3 semanas para permitir la expresión viral.
- Fotometría de fibra
- Conecte la fibra óptica implantada en el ratón a un cable óptico.
- Conecte el otro extremo del cable óptico a un detector que se utilizará para capturar los datos de imagen.
- Para la obtención de imágenes, utilice una fuente de luz para excitar las proteínas a una longitud de onda de 488 nm. Configure el detector para recoger la luz emitida en longitudes de onda que van desde 490 nm hasta 540 nm.
- Ajuste la intensidad de la luz de excitación para optimizar la señal sin causar daño al tejido cerebral.
- Modifique las ganancias de la señal fluorescente para garantizar que el detector capture una señal clara y fuerte.
- Para evitar el blanqueo rápido de la fluorescencia, que reduciría la calidad de las imágenes, ajuste la intensidad de la luz y la ganancia de la señal fluorescente según sea necesario.
- Realice una prueba de comportamiento del mouse.
- Monitoree continuamente el proceso de imágenes durante la prueba de comportamiento.
- Análisis de datos
- Utilice Python y GNUplot para crear un mapa de calor de ensayos experimentales para una representación visual de los datos. Los códigos fuente se proporcionan en el Archivo Complementario 1.
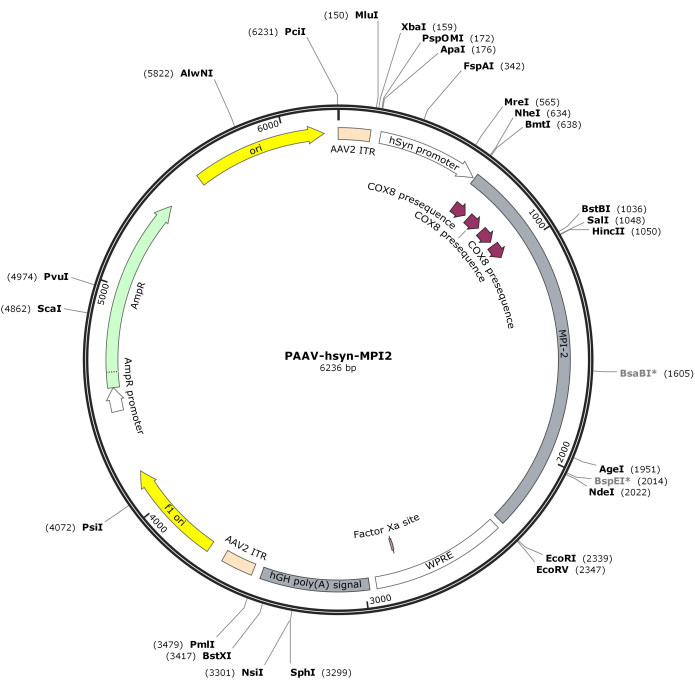
Figura 2: Mapa vectorial de AAV-hSyn-MPI-2. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Después de construir el plásmido CMV-MPI-1, se probó su capacidad para dirigirse a las mitocondrias en células Hela utilizando el marcador mitocondrial Rhodamine 800 para la tinción. Los experimentos de colocalización mostraron un alto grado de superposición entre la señal de fluorescencia de MPI-1 y la señal de Rhodamine 800, lo que indica que MPI-1 se localizó con éxito en las mitocondrias (Figura 3).

Figura 3: Colocalización de MPI-1 con mitocondrias en células Hela. El CMV-MPI-1 se transfectó en células Hela y se tiñó con rodamina 800, un colorante sensible al potencial de la membrana mitocondrial. Barra de escala: 5 μm. Haga clic aquí para ver una versión más grande de esta figura.
Después de la transfección de MPI-1 en las células HeLa, se probó la sensibilidad al voltaje de las células mediante la introducción de CCCP (cianuro de carbonilo m-clorofenil hidrazona), un desacoplador mitocondrial. La adición de CCCP a las células resultó en la despolarización de las mitocondrias. Se utilizó el colorante sensible al voltaje (rhodamin800), que se puede observar como una disminución en la fluorescencia de un colorante sensible al voltaje (rhodamin800) o MPI-1 (Figura 4).

Figura 4: Cambios de fluorescencia sensibles al voltaje en respuesta al tratamiento con CCCP. (A) Imágenes de fluorescencia de células HeLa que expresan MPI-1 de manera estable antes y después de la adición del desacoplador CCCP a una concentración de 5 μM. La rodamina 800 sirvió como un indicador tradicional del potencial de membrana mitocondrial. Barra de escala: 5 μm. (B) Cambios en la intensidad de fluorescencia de MPI-1 y rodamina 800 tras la aplicación de CCCP (n = 14 células). Abreviaturas: T: Tiempo. Esta figura ha sido modificada con permiso de Yang et al.12. Haga clic aquí para ver una versión más grande de esta figura.
Después de la inyección del virus hSyn-MPI-2 AAV en la corteza M2 del ratón, se monitorizó el cambio de fluorescencia durante la anestesia inducida por isoflurano. La fluorescencia de MPI-2 disminuyó con la anestesia (Figura 5), lo que sugiere una disminución de la MMP durante este proceso.

Figura 5: Fotometría de fibra in vivo de MPI-2 en la corteza M2 durante la anestesia inducida por isoflurano. (A) Imágenes que muestran la fluorescencia de secciones cerebrales después de la inyección del virus. El área donde se implantó la fibra está marcada con líneas blancas. La imagen fluorescente se combinó con un mapa cerebral de ratón para mostrar dónde se realizó la inyección. Barra de escala: 500 μm. (B) Cambios en la fluorescencia de MPI-2 observados en múltiples ensayos de anestesia inducida por isoflurano (n = 26 ensayos con 5 ratones). Abreviaturas: T: Tiempo. La línea discontinua muestra cuándo se aplicó el isoflurano. Esta figura ha sido modificada con permiso de Yang et al.12. Haga clic aquí para ver una versión más grande de esta figura.
| No. | Nombre del cebador | Secuencia (5'->3') | ||||
| 1 | ASAP(SalI)-FP | ACGCGTCGACGatggagacgactgtgaggtatgaacagg | ||||
| 2 | ASAP(NotI)-RP | AAAAGGAAAAGCGGCCGCttaggttaccacttcaagttcttctgtgaag | ||||
| 3 | hSyn(AseI)-FP | atgcattaattacagtgtctagactgcagagggc | ||||
| 4 | hSyn(NheI)-RP | ctaGCTAGCctgcgctctcaggcacgacacgactcc | ||||
| 5 | hsyn(MluI)-FP | agctacgcgtgtctagactgcagagggccctgcgt | ||||
| 6 | eliminar-internal_EcoRI-FP | GAGCTCAAGCTTCGAATACTGCAGTCGACG | ||||
| 7 | eliminar-internal_EcoRI-RP | CGTCGACTGCAGTATTCGAAGCTTGAGCTC | ||||
| 8 | ASAP (EcoRI)-RP | cggaattcttaggttaccacttcaagttcttctgtgaag | ||||
Tabla 1: Cebadores para construcciones de plásmidos.
Fichero complementario 1: Código fuente para el análisis de datos. Haga clic aquí para descargar este archivo.
Discusión
El voltaje de la membrana mitocondrial se mantiene entre -120 y 180 mV en condiciones de reposo y fluctúa con los cambios en el estado metabólico. Actualmente, la medición del potencial de membrana mitocondrial se puede realizar utilizando métodos electrofisiológicos y métodos de colorante de fluorescencia. El pinzamiento del parche mitocondrial requiere el aislamiento de las mitocondrias y la destrucción de las estructuras celulares13. Este enfoque puede conducir a mediciones que se desvían de las condiciones fisiológicas. El método de la sonda de fluorescencia es el enfoque común para la medición de MMP. Sin embargo, estas moléculas fluorescentes no pueden teñir células específicas, son propensas a enfriarse y algunos tintes son tóxicos. Además, estos tintes no son adecuados para aplicaciones in vivo debido a sus limitaciones inherentes, incluida la falta de especificidad y equilibrio celular en una escala de tiempo larga (~ 30 min).
Este protocolo proporciona un nuevo método de monitoreo de MMP, especialmente in vivo. La clave de este método es encontrar un GEVI adecuado que pueda dirigirse a las mitocondrias mediante la fusión de su N-terminal con una señal de orientación mitocondrial. Estudios previos demostraron que algunos de los GEVI, como Arclight y SomArchon, no lograron localizarse en las mitocondrias12. Sin embargo, las familias de proteínas del sensor acelerado de potenciales de acción (ASAP) pueden dirigirse a las mitocondrias fusionándolas con una señal de orientación mitocondrial12.
La fase inicial del protocolo consiste en la construcción de un plásmido con una secuencia repetitiva de cuatro veces de COX8, lo que no es factible mediante PCR debido a su naturaleza repetitiva. En su lugar, se emplean métodos de síntesis de ADN o de enlace enzimático para crear la secuencia 4cox8. Otras secuencias de diana mitocondrial14, también pueden ser adecuadas, lo que requirió un análisis de colocalización. El paquete de AAV es crucial para las siguientes aplicaciones in vivo . La titulación de AAV debe ser adecuada para garantizar una transfección eficaz sin causar toxicidad. Para mejorar la eficacia, son necesarias modificaciones como la optimización de las condiciones de transfección. Esto se puede lograr ajustando las cantidades de ADN y reactivos de transfección utilizados, mejorando así la eficiencia de la transfección. Para la transfección de la precipitación de calcio, el pH de HEBS es crucial. No puede ser inferior a 7,01 ni superior a 7,12.
El MPI supera a los tintes MMP tradicionales en varios aspectos. Permite el monitoreo en tiempo real de los cambios en MMP, una capacidad de la que carecen los tintes tradicionales debido a su requisito de tiempos de equilibrio. La codificación genética de MPI también permite la expresión específica del tipo de célula, evitando la no especificidad de los tintes tradicionales. Además, el MPI mantiene su focalización mitocondrial incluso tras la despolarización, a diferencia de los tintes tradicionales, que pierden su focalización mitocondrial en tales condiciones. Además, la focalización mitocondrial estable de MPI lo convierte en un excelente candidato para aplicaciones de imagen in vivo .
A pesar de sus ventajas, el MPI tiene ciertas limitaciones. El fotoblanqueo, un problema común con las proteínas fluorescentes, puede ser un problema con MPI. Esto se puede mitigar parcialmente minimizando la exposición a la luz durante la toma de imágenes. Además, existe la posibilidad de superposición espectral entre MPI y otros fluoróforos, lo que requiere la selección cuidadosa de filtros para imágenes multicolor. La fluorescencia de fondo es un factor que exige atención. Para hacer frente a esto, las células se pueden transfectar conjuntamente con un mCherry dirigido a las mitocondrias. Esta estrategia ayuda a distinguir las señales verdaderas de los falsos positivos durante el proceso de supervisión. La versión actual de los MPI, al igual que otros GEVI utilizados para detectar cambios en el voltaje de la membrana plasmática neuronal, solo puede monitorear las fluctuaciones en el potencial de la membrana mitocondrial, no los valores absolutos. Para calibrar las señales y convertirlas en valores reales de potencial de membrana en voltios, es prometedor un método métrico de relación15, que implica la fusión con otra proteína de fluorescencia. A medida que la familia de proteínas ASAP continúa evolucionando16, anticipamos nuevas mejoras en la sensibilidad. Esto ofrece interesantes posibilidades para el desarrollo de MPI más sensibles en el futuro.
El MPI es muy prometedor para la investigación en diversos campos, como la bioenergética, la dinámica mitocondrial y el modelado de enfermedades. En neurociencia, se puede utilizar para monitorear MMP en las neuronas, ofreciendo información sobre enfermedades neurodegenerativas relacionadas con la disfunción mitocondrial. En cardiología, la sensibilidad de alto voltaje de MPI lo hace adecuado para el estudio de las mitocondrias cardíacas en modelos de isquemia e insuficiencia cardíaca. Además, en la investigación del cáncer, la MPI puede emplearse para investigar los cambios bioenergéticos característicos de las células cancerosas, lo que contribuye a una mejor comprensión de esta compleja enfermedad.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos el apoyo de la Fundación Nacional de Ciencias Naturales (NSF) de China: JSK (32071137 y 92054103) y la financiación del Equipo de Investigación Científica e Innovación del Primer Hospital Afiliado de la Universidad de Zhengzhou: JSK (ZYCXTD2023014).
Materiales
| Name | Company | Catalog Number | Comments |
| BamHI | Thermo | FD0054 | |
| Calcium chloride | Sigma | C4901 | |
| CCCP | Sigma | C2759 | |
| Centrifuge | eppendorf | 5430R | |
| Centrifuge (cell culture) | eppendorf | 5810R | |
| CO2 cell incubator | ESCO | 170L IR Sensor | |
| Coverslips | Glaswarenfabrik Karl Hecht GmbH & Co.KG | 92100100030 | |
| Dental adhensive resin cement | Sun medical company, LTD. | Super-Bond C&B Kit | |
| D-glucose | Sigma | G7021 | |
| DNA Ligation Kit Ver. 2.1 | Takara | 6022 | |
| Dulbecco's modified Eagle medium | Gibco | 11965092 | |
| Electric drill | RWD Instruments | 78001 | |
| Fetal bovine serum | Gibco | A5670701 | |
| Fiber optic cannula | RWD Instruments | R-FOC-L200C-39NA | |
| Fiber photometry detector | Thinker | QAXK_FPS-TC-MC-LED | |
| Fluorescence microscope | Olympus | IX83 | |
| Glass pipette (for injection) | Drummond Scientific company | 3.5" Drummond # 3-000-203-G/X | |
| HEK293t | ATCC | Cat# CRL-3216 | |
| Hela cells | ATCC | Cat# CCL-2 | |
| HEPES | Sigma | H3375 | |
| Injection pump | Drummond Scientific company | 3-000-207 | |
| Isoflurane | RWD Instruments | R510-22 | |
| Laser scanning confocal microscope | Zeiss | LSM980 | |
| MluI | Thermo | FD0564 | |
| NheI | Thermo | FD0974 | |
| Optical fibers | RWD Instruments | R-FC-L-N3-200-L1 | |
| Paraffin oil | Sangon | B500301 | |
| PCR thermal Cycler | analytik jena | Biometra Tone 96G | |
| Pentobarbital sodium | Sinopharm Chemical Reagent Co.LTD | 57-33-0 | |
| Potassium chloride | Sigma | P5405 | |
| PrimeSTAR HS DNA Polymerase | Takara | R010A | |
| Programmable micropipette puller | Sutter Instruments | P2000 | |
| Quick self-curing acrylic resin | Yamahachi | V-PINK | |
| Real-time PCR thermal Cycler | analytik jena | qTOWER³ auto | |
| Rhodamine 800 | Sigma | 83701 | |
| SalI | Thermo | FD0644 | |
| Sodium chloride | Sigma | S9888 | |
| Sodium phosphate dibasic | Sigma | S9763 | |
| Stereotaxic apparatus | RWD Instruments | E06354 | |
| Veterinary ophthalmic ointment | Puralube | NA | |
| XhoI | Thermo | FD0694 |
Referencias
- Vyas, S., Zaganjor, E., Haigis, M. C. Mitochondria and cancer. Cell. 166 (3), 555-566 (2016).
- Dzbek, J., Korzeniewski, B. Control over the contribution of the mitochondrial membrane potential (ΔΨ) and proton gradient (ΔpH) to the protonmotive force (Δp): IN SILICO STUDIES. J Biol Chem. 283 (48), 33232-33239 (2008).
- O'Rourke, B., Cortassa, S., Aon, M. A. Mitochondrial ion channels: Gatekeepers of life and death. Physiology. 20 (5), 303-315 (2005).
- Chan, D. C. Mitochondrial fusion and fission in mammals. Annu Rev Cell Dev Biol. 22 (1), 79-99 (2006).
- Jin, S. M., Lazarou, M., Wang, C., Kane, L. A., Narendra, D. P., Youle, R. J. Mitochondrial membrane potential regulates PINK1 import and proteolytic destabilization by PARL. J Cell Biol. 191 (5), 933-942 (2010).
- Ly, J. D., Grubb, D. R., Lawen, A. The mitochondrial membrane potential (deltapsi(m)) in apoptosis; an update. Apoptosis. 8 (2), 115-128 (2003).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. Biotechniques. 50 (2), 98-115 (2011).
- Meng, X. -. Y., et al. A sensitive mitochondrial thermometry 2.0 and the availability of thermogenic capacity of brown adipocyte. Front Physiol. 13, 977431 (2022).
- Kaestner, L., et al. Genetically encoded voltage indicators in circulation research. Int J Mol Sci. 16 (9), 21626-21642 (2015).
- Yang, H. H., St-Pierre, F. Genetically encoded voltage indicators: Opportunities and challenges. J Neurosci. 36 (39), 9977 (2016).
- Sepehri Rad, M., Cohen, L. B., Braubach, O., Baker, B. J. Monitoring voltage fluctuations of intracellular membranes. Sci Rep. 8 (1), 6911 (2018).
- Yang, R. -. Z., Wang, D. -. D., Li, S. -. M., Liu, P. -. P., Kang, J. -. S. Development and application of a mitochondrial genetically encoded voltage indicator in narcosis. Neurosci Bull. 40 (10), 1529-1544 (2024).
- Kumari, A., Nguyen, D. M., Garg, V. Patch-clamp technique to study mitochondrial membrane biophysics. J Gen Physiol. 155 (8), e202313347 (2023).
- Bayne, A. N., Dong, J., Amiri, S., Farhan, S. M. K., Trempe, J. -. F. MTSviewer: A database to visualize mitochondrial targeting sequences, cleavage sites, and mutations on protein structures. PLoS One. 18 (4), e0284541 (2023).
- Kim, B. B., et al. A red fluorescent protein with improved monomericity enables ratiometric voltage imaging with ASAP3. Sci Rep. 12 (1), 3678 (2022).
- Evans, S. W., et al. A positively tuned voltage indicator for extended electrical recordings in the brain. Nat Methods. 20 (7), 1104-1113 (2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados