Method Article
قياس إمكانات غشاء الميتوكوندريا في الجسم الحي باستخدام مؤشر جهد مشفر وراثيا
In This Article
Summary
يصف هذا البروتوكول تطبيق مؤشرات الجهد المشفرة وراثيا (GEVIs) المستهدفة بالميتوكوندريا. توفر GEVIs هذه ميزة كبيرة على الأصباغ المحتملة لغشاء الميتوكوندريا التقليدية من خلال تمكين المراقبة المحددة في الجسم الحي وفي الوقت الفعلي لإمكانات غشاء الميتوكوندريا.
Abstract
تعد إمكانات غشاء الميتوكوندريا (MMP ، ΔΨm) أمرا بالغ الأهمية لوظائف الميتوكوندريا ، بما في ذلك تخليق ATP ، ونقل الأيونات ، وتوليد أنواع الأكسجين التفاعلية (ROS) ، واستيراد البروتينات المشفرة بواسطة النواة. عادة ما تستخدم الطرق الحالية لقياس ΔΨm أصباغ الكاتيون المحبة للدهون ، مثل Rhodamine 800 و tetramethylrhodamine methyl ester (TMRM) ، ولكنها محدودة بسبب الخصوصية المنخفضة وليست مناسبة تماما للتطبيقات في الجسم الحي . لمعالجة هذه القيود ، قمنا بتطوير بروتوكول جديد يستخدم مؤشرات الجهد المشفرة وراثيا (GEVIs). أظهرت مؤشرات الجهد المشفرة وراثيا (GEVIs) ، التي تولد إشارات الفلورسنت استجابة للتغيرات المحتملة في الغشاء ، إمكانات كبيرة لمراقبة غشاء البلازما وإمكانات الخلايا العصبية. ومع ذلك ، فإن تطبيقها على أغشية الميتوكوندريا لا يزال غير مستكشف. هنا ، قمنا بتطوير GEVIs تستهدف الميتوكوندريا القائمة على البروتين والقادرة على اكتشاف تقلبات ΔΨm في الخلايا والقشرة الحركية للحيوانات الحية. يوفر مؤشر إمكانات الميتوكوندريا (MPI)نهجا غير جراحي لدراسة ديناميكيات ΔΨm في الوقت الفعلي ، مما يوفر طريقة للتحقيق في وظيفة الميتوكوندريا في ظل كل من الظروف العادية والمرضية.
Introduction
الميتوكوندريا هي عضيات أساسية في الخلايا حقيقية النواة ، وتعمل كموردين أساسيين للطاقة من خلال توليد الأدينوسين ثلاثي الفوسفات (ATP) مع أداء مجموعة متنوعة من الوظائف الحاسمة الأخرى ، مثل تخليق المستقلب ، وتخزين أيونات الكالسيوم ، وإنتاج الحرارة ، وتنظيم بقاء الخلية1. أدوارهم حاسمة بشكل خاص في الأنسجة الأيضية العالية مثل الدماغ والقلب ، حيث يساعدون في الحفاظ على التوازن الخلوي. تعد إمكانات غشاء الميتوكوندريا (MMP ، Ψm) أمرا أساسيا لهذه العمليات ، بما في ذلك دفع تخليق ATP عن طريق الفسفرة المؤكسدة ، وتسهيل نقل المستقلبات والأيونات عبر أغشية الميتوكوندريا ، والمساهمة في توليد أنواع الأكسجين التفاعلية (ROS) 2،3. يؤثر MMP أيضا على مورفولوجيا الميتوكوندريا وديناميكياتها4 ، بما في ذلك الانقسام (التحلل الانتقائي للميتوكوندريا)5وموت الخلايا المبرمج (موت الخلايا المبرمج) 6. الحفاظ على Ψm مناسب ضروري للوظيفة الخلوية. يرتبط خلل تنظيمه بالعديد من الأمراض ، بما في ذلك الأمراض التنكسية العصبية وفشل القلب والسرطان. استندت الطرق الحالية لقياس Ψm بشكل أساسي إلى استخدام الأصباغ الموجبة المحبة للدهون ، بما في ذلك TMRM (إستر ميثيل رباعي ميثيل رودامين) ، TMRE (إستر إيثيل رباعي ميثيل رودامين) ، رودامين 123 ، سافرانين O ، رودامين 800 ، DiOC6 ، JC-1 ، إلخ.7. ومع ذلك ، فإن هذه الجزيئات الفلورية لها العديد من القيود. تفتقر هذه الأصباغ إلى خصوصية الخلية ، وهي عرضة للتبريد ، وبعضها سام. بالإضافة إلى ذلك ، يمكن أن تنتشر بمرور الوقت ، وعندما تفقد الميتوكوندريا ΔΨ ، فإنها تتسرب ، مما يجعلها غير قادرة على الإشارة إلى إمكانات الغشاء للميتوكوندريا منزوعة الاستقطاب. علاوة على ذلك ، فإن الأصباغ القائمة على الرودامين مثل TMRM و TMRE حساسة لدرجة الحرارة8 ، مما يستلزم دراسة متأنية لتأثيرات درجة الحرارة على مضان الصبغة ، لا سيما عند قياس جهد غشاء الميتوكوندريا أثناء الأنشطة الفسيولوجية التي تنطوي على توليد الحرارة الخلوي.
ظهرت مؤشرات الجهد المشفرة وراثيا (GEVIs) ، وهي بروتينات قادرة على اكتشاف التغيرات المحتملة للغشاء من خلال إشارات الفلورسنت9،10 ، كأدوات قوية لمراقبة إمكانات الغشاء في مجموعة متنوعة من السياقات الخلوية11. في حين تم تطبيق GEVIs على نطاق واسع لدراسة أغشية البلازما ، إلا أنه لم يكن هناك تقدم يذكر في تكييفها لقياس إمكانات الغشاء داخل الخلايا ، خاصة بالنسبة للميتوكوندريا. يسعى هذا البروتوكول إلى معالجة هذه الفجوة باستخدام GEVIs المستهدفة للميتوكوندريا والتي يمكنها مراقبة إمكانات غشاء الميتوكوندريا في المختبر وفي الجسم الحي. عن طريق إضافة تسلسل إشارة الميتوكوندريا إلى GEVIs الحالية ، يمكن استهداف GEVI المناسب للميتوكوندريا12. ستوفر مؤشرات إمكانات الميتوكوندريا (MPI) رؤى جديدة في فسيولوجيا الميتوكوندريا وتوفر إمكانات كبيرة لاستكشاف وظيفة الميتوكوندريا في حالات المرض المختلفة في الجسم الحي ، مما يعزز فهمنا لكيفية مساهمة ديناميكيات الميتوكوندريا في كل من العمليات الخلوية الطبيعية والمرضية.
Protocol
تم إجراء جميع رعاية والتجارب وفقا لإرشادات اللجنة المؤسسية لرعاية واستخدامه في جامعة تشنغتشو. تعقيم جميع الأدوات الجراحية قبل الاستخدام. اتبع تقنيات التعقيم للوقاية من العدوى. بعد الحصول على جميع البيانات ، تم القتل الرحيم للحيوانات باستخدام جرعة زائدة من التخدير المستنشق متبوعا بقطع الرأس.
1. التطبيقات في المختبر
- بناء البلازميد
- احصل على المستشعر المتسارع لإمكانات الفعل 1 (ASAP1) و ASAP3 الجينات من Addgene أو التوليف من التسلسل. (ASAP1 ، معرف انضمام NCBI: AHV90412.1 ، معرف Addgene: 52519 ؛ في أسرع وقت ممكن 3 ، معرف Addgene: 132331).
- استخدم الاشعال المدرجة في الجدول 1 لتركيبات البلازميد.
- للتعبير في الخلايا ، استخدم متجه EGFPN1 للبناء.
- في البداية ، قم بتجميع تسلسل جين cox8 (NP_004065 ، الأحماض الأمينية 1-29) مع أربعة تكرارات ترادفية (4cox8) محاطة بمواقع تقييد NheI و XhoI. استيعاب كل من جزء 4cox8 المركب ومتجه EGFPN1 مع NheI و XhoI ، متبوعا بالربط لتوليد متجه 4cox8-EGFP.
- بعد ذلك ، قم بإجراء تضخيم تفاعل البوليميراز المتسلسل لتسلسل ASAP1 باستخدام التمهيدي 1 والتمهيدي 2. استيعاب جزء ASAP1 ومتجه 4cox8-EGFP مع SalI و NotI ، متبوعا بالربط لتوليد متجه MPI-1 النهائي (MPI تعني مؤشر إمكانات الميتوكوندريا).
ملاحظة: تم تصوير خريطة المتجهات ل CMV-MPI-1 في الشكل 1. يمكن الوصول إلى التسلسل التفصيلي من NCBI (معرف الانضمام: PQ678920).
- للحصول على تعبير محدد في الخلايا العصبية ، قم بتضخيم تفاعل البوليميراز المتسلسل لتسلسل محفز hSyn من بلازميد AAV-hSyn-EGFP (معرف انضمام NCBI: MH458079 ، معرف Addgene: 50465) باستخدام التمهيدي 3 والتمهيدي 4.
- استيعاب كل من تسلسل hSyn ومتجه 4cox8-EGFP باستخدام AseI و NheI ، متبوعا بالربط لتوليد متجه hSyn-4cox8-EGFP. بعد ذلك ، قم بإجراء تضخيم تفاعل البوليميراز المتسلسل لتسلسل ASAP3 باستخدام التمهيدي 1 والتمهيدي 2.
- استيعاب متجه hSyn-4cox8-EGFP وتسلسل ASAP3 مع SalI و NotI ، متبوعا بالربط لتوليد متجه hSyn-MPI-2.
ملاحظة: ستختلف ظروف تفاعل البوليميراز المتسلسل بناء على الإنزيمات المحددة ودرجات حرارة انصهار التمهيدي (Tm). يتضمن تفاعل تفاعل البوليميراز المتسلسل النموذجي خطوة تمسخ أولية عند 95 درجة مئوية لمدة 30 ثانية ، تليها 25-35 دورة من التمسخ (95 درجة مئوية ، 10 ثوان) ، والتلدين (55 درجة مئوية ، 30 ثانية) ، والتمديد (72 درجة مئوية ، 30 ثانية / كيلو بايت). تضمن خطوة التمديد النهائية عند 72 درجة مئوية لمدة 5 دقائق تخليقا كاملا للمنتج ، متبوعا بثبات عند 4 درجات مئوية. يجب أن تكون درجة حرارة التلدين حوالي 5 درجات مئوية أقل من Tm من البادئات. راجع تعليمات الشركة المصنعة للحصول على معلمات PCR المثلى. بادئات ASAP1 و ASAP3 متطابقة.
- التصوير في الخلايا الحية
- تحضير وسط استزراع DMEM بإضافة 10٪ مصل بقري للجنين و 100 مجم / لتر بنسلين / ستربتومايسين إلى الوسط.
- تحضير كواشف تعداء الكالسيوميوم2+ : 2.5 مول / لتر كلوريد الكالسيوم2 ، 2 × سداسبايت (274 مليمول / لتر كلوريد الصوديوم ، 10 مليمول / لتر كلوريد الصوديوم ، 1.4 مليمول / لتر Na2HPO4 ، 15 مليمول / لتر D-glucose ، 42 مليمول / لتر HEPES ، درجة الحموضة 7.07).
- قم بإعداد عازلة Tyrode للحفاظ على الخلايا أثناء التصوير (145 مليمول / لتر كلوريد الصوديوم ، 3 مليمول / لتر كلوريد كلوريد ، 10 مليمول / لتر هيبلز ، 10 مليمول / لتر جلوكوز ، درجة الحموضة 7.4).
- زراعة خلايا هيلا في طبق استزراع 35 مم يتم تغذيته بوسط استزراع DMEM في حاضنة بدرجة حرارة 37 درجة مئوية وجو 5٪ ثاني أكسيد الكربون2/95٪ هواء. أضف 2-3 أغطية لكل طبق للسماح للخلايا بالنمو عليها.
- قم بنقل خلايا Hela عبر طريقة ترسيب فوسفات الكالسيوم.
- لنقل الخلايا ، ابدأ باستبدال وسط المزرعة القديم ب 2 مل من DMEM الخالي من المصل. بعد 35 دقيقة ، قم بإعداد محلول DNA / Ca2+ عن طريق خلط 10 ميكروغرام من الحمض النووي ، و 4 ميكرولتر من CaCl2 ، و ddH2O إلى حجم نهائي قدره 40 ميكرولتر في أنبوب طرد مركزي دقيق.
- أضف 40 ميكرولتر من 2x HEBS إلى محلول DNA / Ca2+ بالتنقيط مع التقليب بقوة. قم بفقاعة الهواء مع ماصة في الخليط لتسهيل ترسيب فوسفات الكالسيوم.
- بعد 25 دقيقة ، أضف 80 ميكرولتر من هذا المحلول المرسب إلى الطبق مع الخلايا وأعده إلى الحاضنة لمدة 1-2 ساعة أخرى. ثم قم بإزالة DMEM غير المصل واشطف الخلايا بنسبة 15٪ من الجلسرين (المذاب في PBS) لمدة دقيقتين.
- بعد شفط الجلسرين ، أضف 2 مل من DMEM الذي يحتوي على 10٪ FBS واستمر في زراعة الخلايا لمدة 16-24 ساعة.
- ضع أغطية مع الخلايا في طبق استزراع 35 مم مع 2 مل من عازلة Tyrode وقم بتلطيخ الخلايا بصبغة الرودامين 800 عن طريق إضافة 20 ميكرولتر / لتر من الرودامين 800 (المذاب في ddH2O) إلى الطبق إلى تركيز نهائي يبلغ 50 نانومول / لتر.
- قم بإعداد مجهر مضان وإعداده بالمرشحات المناسبة ومصدر الضوء لإثارة البروتين بمصدر ضوء 488 نانومتر وجمع الانبعاث بين 490-540 نانومتر. قم بإثارة صبغة الرودامين 800 بمصدر ضوء 633 نانومتر واجمع الانبعاث بين 650-720 نانومتر.
- قم بإعداد محلول الكربونيل سيانيد m-chlorophenyl hydrazone (CCCP) عند 500 ميكرومتر (مخزون) وأضفه إلى الخلايا إلى تركيز نهائي يبلغ 5 ميكرومتر أثناء التصوير.
ملاحظة: يعد الرقم الهيدروجيني لمحلول 2x HEBS أمرا بالغ الأهمية لكفاءة التعداد. يجب ضبط الرقم الهيدروجيني بعناية إلى 7.07 باستخدام هيدروكسيد الصوديوم الصلب. لا يمكن أن يكون الرقم الهيدروجيني أقل من 7.01 أو أعلى من 7.12.

الشكل 1: خريطة متجهة CMV-MPI-1. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
2. تطبيقات في الجسم الحي
- بناء البلازميد
- للتعبير في الجسم الحي ، استخدم فيروس AAV للتحويل. احصل على العمود الفقري للتعبير عن عبوات AAV (معرف Addgene: 46954 أو 26968) ، والذي يحتوي على تسلسلات التكرارات الطرفية المقلوبة (ITR) لتغليف فيروس AAV.
- قم بإجراء تضخيم تفاعل البوليميراز المتسلسل لمتجه hSyn-MPI-2 (من الخطوة 1.1.4) باستخدام البادئات 5 و 7 في الجدول 1.
- قم بإجراء تضخيم تفاعل البوليميراز المتسلسل الثاني باستخدام نفس القالب والبادئات 6 و 8 في الجدول 1.
- قم بإجراء تفاعل البوليميراز المتسلسل النهائي باستخدام المنتج من تفاعل البوليميراز المتسلسل الأول والثاني (الخطوتان 2.1.2 و 2.1.3) كقالب والبادئات 5 و 8 في الجدول 1 ، مما يؤدي إلى إنشاء تسلسل hSyn-MPI-2 النهائي.
- استيعاب تسلسل hSyn-MPI-2 والعمود الفقري ل pAAV باستخدام MluI و EcoRI ، متبوعا بالربط لإنشاء بناء pAAV-hSyn-MPI-2 النهائي. يتم توضيح خريطة المتجهات ل pAAV-hSyn-MPI-2 في الشكل 2. يمكن الوصول إلى التسلسل التفصيلي من NCBI (معرف الانضمام: PQ678919).
ملاحظة: يحتوي متجه hSyn-MPI-2 على موقع EcoRI داخلي ينشأ من العمود الفقري الأصلي EGFPN1 ، والذي تمت إزالته باستخدام بادئات معدلة في استراتيجية تفاعل البوليميراز المتسلسل المتداخلة (الخطوات 2.1.2-2.1.4).
- تحضير الفيروس ونقله
- استزراع خلايا HEK293t في طبق استزراع 100 مم يتم تغذيته بوسط استزراع FBS DMEM بنسبة 10٪ في حاضنة بدرجة حرارة 37 درجة مئوية وجو من 5٪ ثاني أكسيد الكربون2/95٪ هواء للوصول إلى التقاء 70٪.
- شارك في نقل خلايا HEK293t مع بلازميد جين AAV ، القفيصة (pAAV-DJ أو pAAV9) ، والبلازميدات المساعدة (pHelper) باستخدام طريقة ترسيب فوسفات الكالسيوم. كانت كمية الحمض النووي لكل بلازميد على النحو التالي: الجين: 10 ميكروغرام ، pHelper: 11 ميكروغرام ، القفيصة: 9 ميكروغرام. كمية كاشف التعداد: 12 ميكرولتر من كلوريدالكالسيوم 2 ، 120 ميكرولتر من 2x HEBS.
- احتضان الخلايا المنقولة لمدة 72 ساعة لتمكين إنتاج الفيروس.
- بعد فترة الحضانة ، قم بحصاد الخلايا عن طريق أجهزة الطرد المركزي عند 400 جم. شطف الخلايا مع PBS 2 مرات وإعادة تعليق الخلية في 400 ميكرولتر من PBS.
- حصاد الفيروسات من معلق الخلية بأربع دورات من طرق التجميد والذوبان (37 درجة مئوية و -80 درجة مئوية). جهاز الطرد المركزي للمحللة عند 13,500 × جم عند 4 درجات مئوية وتخلص من الحبيبات. يحتوي المادة الطافية على فيروس AAV.
- قم بإجراء تفاعل البوليميراز المتسلسل في الوقت الفعلي لتحديد معايرة الفيروس المحضر. يمكن العثور على بروتوكول مفصل لتحديد المعايرة بالتحليل الحجمي AAV على https://www.addgene.org/protocols/aav-titration-qpcr-using-sybr-green-technology/.
- Aliquot وتخزين فيروس AAV المحضر عند -80 درجة مئوية.
- حقن الفيروسات التجسيمية
- تخدير فأر ذكر C57 / BL بالغ يزن 24-26 جم مع 3٪ بنتوباربيتال الصوديوم عن طريق الحقن داخل الصفاق بجرعة 30 مجم / كجم. بمجرد التخدير ، قم بتثبيت الفئران على جهاز تجسيمي للحفاظ على وضع مستقر طوال العملية.
- ضع مرهم بيطري للعيون لحماية العينين من التلف الضوئي وللحفاظ على رطوبة العينين.
- استخدم كريم إزالة الشعر لإزالة الشعر من رأس الفأر وفضح فروة الرأس.
- افتح فروة الرأس باستخدام مقص الجراحة وكشف الجمجمة. عالج الجمجمة بنسبة 3٪ بيروكسيد الهيدروجين لتعقيم وتصور المعالم الرئيسية مثل مواقع بريجما ولامدا.
- اضبط موضع رأس الماوس للتأكد من أن الجمجمة أفقية.
- استخدم مجتذب ماصات دقيقة قابلة للبرمجة لسحب الماصات الزجاجية إلى الشكل والحجم المطلوبين لإجراء حقن دقيق. املأ الماصة الدقيقة الزجاجية بزيت البارافين.
- ضع الماصة الدقيقة في الموقع المستهدف. في هذا البروتوكول ، الهدف هو منطقة M2 على الجانب الأيمن ، باستخدام الإحداثيات التالية: AP (الأمامي الخلفي) ، +1.94 مم ؛ مل (متوسط الجانب) ، +0.75 مم ؛ DV (ظهري بطني) ، -1.5 مم.
- استخدم مثقابا كهربائيا لعمل ثقب صغير في الجمجمة في الموقع المستهدف.
- أستفير 500 نانولتر من الفيروس بعيار 1.5 × 1011 نسخة جينوم لكل مليلتر (GC / مل) من خلال طرف الماصة الدقيقة. حقن 500 نانولتر من الفيروس في الموقع المستهدف باستخدام مضخة حقن بمعدل تدفق 100 نانولتر / دقيقة.
- بعد الحقن، اترك الماصة في مكانها لمدة 5 دقائق تقريبا للسماح بالانتشار قبل سحبها بعناية.
- زرع الألياف الضوئية (قطر 200 ميكرومتر ، فتحة عددية 0.37 ، طول 2 مم) في موقع الحقن.
- قم بتثبيت الألياف الضوئية في مكانها باستخدام أسمنت الأسنان.
- خياطة فروة رأس الفأر بخيط نايلون 5-0 (إبرة جمالية Δ1 / 2 4x12) وأعيدها إلى قفص منزلها.
- ضع قفص المنزل على وسادة تدفئة للحفاظ على درجة حرارة جسم الماوس حتى يتعافى تماما من التخدير.
- قم بإيقاف تشغيل وسادة التدفئة بمجرد أن يبدأ في الحركة. اترك ساعتين أخريين من التأقلم مع درجة حرارة الغرفة (RT) قبل نقل الماوس إلى منشأة الإسكان.
- فأر المنزل في دورة إضاءة مدتها 12 ساعة / 12 ساعة في 22 درجة مئوية مع إمكانية الوصول إلى الطعام والماء لمدة 2-3 أسابيع للسماح بالتعبير الفيروسي.
- قياس ضوئي الألياف
- قم بتوصيل الألياف الضوئية المزروعة في الماوس بكابل بصري.
- قم بتوصيل الطرف الآخر من الكبل البصري بكاشف سيتم استخدامه لالتقاط بيانات التصوير.
- للتصوير ، استخدم مصدر ضوء لإثارة البروتينات بطول موجي يبلغ 488 نانومتر. قم بإعداد الكاشف لجمع الضوء المنبعث بأطوال موجية تتراوح من 490 نانومتر إلى 540 نانومتر.
- اضبط شدة ضوء الإثارة لتحسين الإشارة دون التسبب في تلف أنسجة المخ.
- قم بتعديل مكاسب إشارة الفلورسنت لضمان التقاط إشارة واضحة وقوية بواسطة الكاشف.
- لتجنب التبييض السريع للتألق ، مما يقلل من جودة التصوير ، قم بضبط شدة الضوء واكتساب إشارة الفلورسنت حسب الضرورة.
- إجراء اختبار سلوك الماوس.
- راقب عملية التصوير باستمرار أثناء اختبار السلوك.
- تحليل البيانات
- استخدم Python و GNUplot لإنشاء خريطة حرارية للتجارب التجريبية لتمثيل مرئي للبيانات. يتم توفير الرموز المصدرية في الملف التكميلي 1.
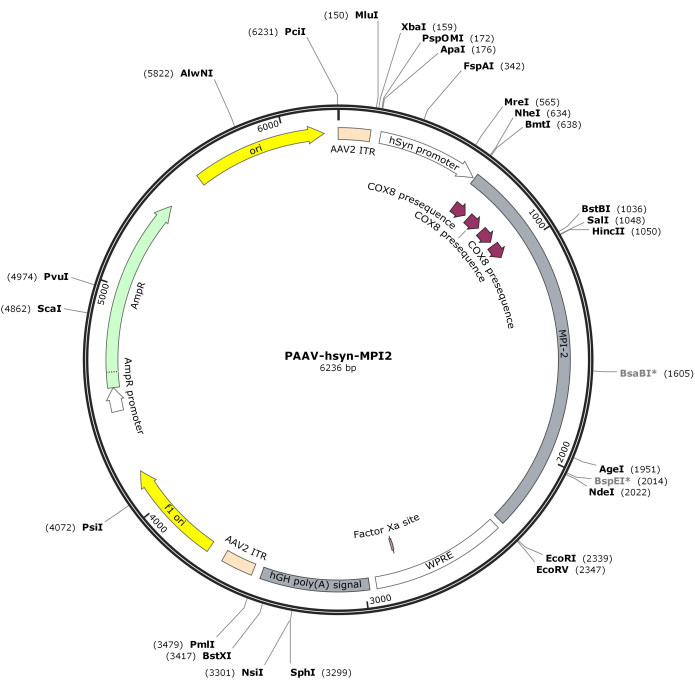
الشكل 2: خريطة متجهة ل AAV-hSyn-MPI-2. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
النتائج
بعد بناء بلازميد CMV-MPI-1 ، تم اختبار قدرته على استهداف الميتوكوندريا في خلايا هيلا باستخدام علامة الميتوكوندريا Rhodamine 800 للتلوين. أظهرت تجارب التحديد المشترك درجة عالية من التداخل بين إشارة التألق ل MPI-1 والإشارة من Rhodamine 800 ، مما يشير إلى أن MPI-1 تم توطينه بنجاح في الميتوكوندريا (الشكل 3).

الشكل 3: تحديد موقع MPI-1 مع الميتوكوندريا في خلايا هيلا. تم نقل CMV-MPI-1 في خلايا هيلا وتلطيخه بالرودامين 800 ، وهي صبغة حساسة لغشاء الميتوكوندريا. شريط المقياس: 5 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
بعد تعدي MPI-1 إلى خلايا HeLa ، تم اختبار حساسية الجهد للخلايا عن طريق إدخال CCCP (كربونيل سيانيد m-chlorophenyl hydrazone) ، وهو مفك الاقتران في الميتوكوندريا. أدت إضافة CCCP إلى الخلايا إلى إزالة استقطاب الميتوكوندريا. تم استخدام الصبغة الحساسة للجهد (rhodamin800) ، والتي يمكن ملاحظتها على أنها انخفاض في مضان صبغة حساسة للجهد (rhodamin800) أو MPI-1 (الشكل 4).

الشكل 4: التغيرات الفلورية الحساسة للجهد استجابة لمعالجة CCCP. (أ) صور مضان لخلايا HeLa التي تعبر بثبات عن MPI-1 قبل وبعد إضافة CCCP المنفصل بتركيز 5 ميكرومتر. شريط المقياس: 5 ميكرومتر. (B) تغيرات شدة التألق ل MPI-1 و rhodamine 800 عند تطبيق CCCP (ن = 14 خلية). الاختصارات: T: الوقت. تم تعديل هذا الرقم بإذن من Yang et al.12. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
بعد حقن فيروس hSyn-MPI-2 AAV في قشرة M2 للفأر ، تمت مراقبة تغير التألق أثناء التخدير الناجم عن الأيزوفلوران. تم تقليل تألق MPI-2 عند التخدير (الشكل 5) ، مما يشير إلى انخفاض في MMP خلال هذه العملية.

الشكل 5: القياس الضوئي للألياف في الجسم الحي ل MPI-2 في قشرة M2 أثناء التخدير الناجم عن الأيزوفلوران. (أ) صور توضح تألق أقسام الدماغ بعد حقن الفيروس. تم تمييز المنطقة التي تم فيها زرع الألياف بخطوط بيضاء. تم دمج صورة الفلوريس مع خريطة دماغ الفأر لإظهار مكان إجراء الحقن. شريط المقياس: 500 ميكرومتر. (ب) لوحظت التغيرات في تألق MPI-2 عبر تجارب متعددة للتخدير الناجم عن الأيزوفلوران (ن = 26 تجربة شملت 5 فئران). الاختصارات: T: الوقت. يظهر الخط المتقطع متى تم تطبيق الأيزوفلوران. تم تعديل هذا الرقم بإذن من Yang et al.12. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| لا. | اسم التمهيدي | التسلسل (5'->3') | ||||
| 1 | في أسرع وقت ممكن (SalI) - FP | ACGCGTCGACGatggagacgactgtgaggtgaggtatgaacagg | ||||
| 2 | في أسرع وقت ممكن (NotI) -RP | AAAAGGAAAAGCGGCCGCttaggttaccacttcaagttgtttcttctgtgaag | ||||
| 3 | hSyn (AseI) -FP | atgcattaattgtacagtgtctagactgcagagggc | ||||
| 4 | hSyn (NheI) -RP | ctaGCTAGCctgcgctcaggcacgacacgactcccc | ||||
| 5 | hsyn (MluI) -FP | AGCTACGCGTGTGTCTAGACTGCAGAGGGCCCTGCGT | ||||
| 6 | حذف internal_EcoRI-FP | GAGCTCAAGCTTCGAATACTGCAGTCGACG | ||||
| 7 | حذف internal_EcoRI-RP | CGTCGACTGCAGTATTCGAAGCTTGAGCTC | ||||
| 8 | في أسرع وقت ممكن (EcoRI) -RP | cggaattcttaggttaccacttcaagttgtttctctgtgaag | ||||
الجدول 1: بادئات لإنشاءات البلازميد.
الملف التكميلي 1: الكود المصدري لتحليل البيانات. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
يتم الحفاظ على جهد غشاء الميتوكوندريا عند -120-180 مللي فولت في ظل ظروف الراحة ويتقلب مع التغيرات في حالة التمثيل الغذائي. حاليا ، يمكن إجراء قياس إمكانات غشاء الميتوكوندريا باستخدام طرق الفيزيولوجيا الكهربية وطرق صبغ الفلورة. يتطلب تثبيت رقعة الميتوكوندريا عزل الميتوكوندريا وتدمير الهياكل الخلوية13. قد يؤدي هذا النهج إلى قياسات تنحرف عن الظروف الفسيولوجية. طريقة مسبار التألق هي الطريقة الشائعة لقياس MMP. ومع ذلك ، لا يمكن لهذه الجزيئات الفلورية تلطيخ خلايا معينة ، وهي عرضة للتبريد ، وبعض الأصباغ سامة. علاوة على ذلك ، فإن هذه الأصباغ غير مناسبة للتطبيقات في الجسم الحي بسبب قيودها المتأصلة ، بما في ذلك نقص خصوصية الخلية وتوازنها على مدى فترة زمنية طويلة (~ 30 دقيقة).
يوفر هذا البروتوكول طريقة جديدة لمراقبة MMP ، خاصة في الجسم الحي. مفتاح هذه الطريقة هو العثور على GEVI مناسب يمكن استهدافه للميتوكوندريا عن طريق دمج طرفه N مع إشارة استهداف الميتوكوندريا. أظهرت الدراسات السابقة أن بعض GEVIs ، مثل Arclight و SomArchon ، فشلت في التوطين في الميتوكوندريا12. ومع ذلك ، يمكن استهداف عائلات بروتين المستشعر المتسارع لإمكانات العمل (ASAP) للميتوكوندريا عن طريق دمجها في إشارة استهداف الميتوكوندريا12.
تتضمن المرحلة الأولى من البروتوكول إنشاء بلازميد بتسلسل متكرر أربع مرات من COX8 ، وهو أمر غير ممكن من خلال تفاعل البوليميراز المتسلسل نظرا لطبيعته المتكررة. بدلا من ذلك ، يتم استخدام تخليق الحمض النووي أو الطرق المرتبطة بالإنزيم لإنشاء تسلسل 4cox8. قد تكون تسلسلات استهداف الميتوكوندرياالأخرى 14 مناسبة أيضا ، الأمر الذي يتطلب تحليل التحديد المشترك. تعد حزمة AAV ضرورية للتطبيقات اللاحقة في الجسم الحي . يجب أن يكون معايرة AAV مناسبا لضمان تعداء فعال دون التسبب في تسمم. لتعزيز الفعالية ، من الضروري إجراء تعديلات مثل تحسين ظروف التعداد. يمكن تحقيق ذلك عن طريق ضبط كميات الحمض النووي وكواشف التعداء المستخدمة ، وبالتالي تحسين كفاءة التعداد. بالنسبة لتعداء ترسيب الكالسيوم ، فإن الرقم الهيدروجيني ل HEBS أمر بالغ الأهمية. لا يمكن أن يكون أقل من 7.01 أو أعلى من 7.12.
يتفوق MPI على أصباغ MMP التقليدية بعدة طرق. يسمح بالمراقبة في الوقت الفعلي لتغييرات MMP ، وهي القدرة التي تفتقر إليها الأصباغ التقليدية بسبب متطلباتها لأوقات التوازن. يتيح الترميز الجيني ل MPI أيضا التعبير الخاص بنوع الخلية ، متجاوزا عدم خصوصية الأصباغ التقليدية. بالإضافة إلى ذلك ، تحافظ MPI على استهداف الميتوكوندريا حتى عند إزالة الاستقطاب ، على عكس الأصباغ التقليدية ، التي تفقد استهدافها للميتوكوندريا في ظل هذه الظروف. علاوة على ذلك ، فإن استهداف الميتوكوندريا المستقر ل MPI يجعلها مرشحا ممتازا لتطبيقات التصوير في الجسم الحي .
على الرغم من مزاياها ، فإن مؤشر MPI له قيود معينة. يمكن أن يكون التبييض الضوئي ، وهو مشكلة شائعة مع بروتينات الفلورسنت ، مصدر قلق مع MPI. يمكن التخفيف من ذلك جزئيا عن طريق تقليل التعرض للضوء أثناء التصوير. علاوة على ذلك ، هناك احتمال للتداخل الطيفي بين MPI والفلوروفورات الأخرى ، مما يستلزم الاختيار الدقيق للمرشحات للتصوير متعدد الألوان. تألق الخلفية هو عامل يتطلب الاهتمام. لمعالجة هذا ، يمكن نقل الخلايا مع mCherry الذي يستهدف الميتوكوندريا. تساعد هذه الإستراتيجية في التمييز بين الإشارات الحقيقية والإيجابيات الخاطئة أثناء عملية المراقبة. يمكن للإصدار الحالي من MPIs ، مثل GEVIs الأخرى المستخدمة للكشف عن تغيرات جهد غشاء البلازما العصبية ، مراقبة التقلبات في إمكانات غشاء الميتوكوندريا فقط ، وليس القيم المطلقة. لمعايرة الإشارات وتحويلها إلى قيم جهد الغشاء الفعلية بالفولت ، فإن طريقة النسبةالمترية 15 ، والتي تتضمن الاندماج مع بروتين مضان آخر ، واعدة. مع استمرار تطور عائلة البروتين في أسرع وقت ممكن16 ، نتوقع مزيدا من التحسينات في الحساسية. يوفر هذا إمكانيات مثيرة لتطوير مؤشرات MPI أكثر حساسية في المستقبل.
يحمل مؤشر MPI وعدا كبيرا للبحث في مختلف المجالات ، بما في ذلك الطاقة الحيوية وديناميكيات الميتوكوندريا ونمذجة الأمراض. في علم الأعصاب ، يمكن استخدامه لمراقبة MMP في الخلايا العصبية ، مما يوفر نظرة ثاقبة للأمراض التنكسية العصبية المرتبطة بخلل الميتوكوندريا. في أمراض القلب ، فإن حساسية الجهد العالي ل MPI تجعله مناسبا لدراسة الميتوكوندريا القلبية في نماذج نقص التروية وفشل القلب. علاوة على ذلك ، في أبحاث السرطان ، يمكن استخدام MPI للتحقيق في التحولات ذات الطاقة الحيوية المميزة للخلايا السرطانية ، مما يساهم في فهم أفضل لهذا المرض المعقد.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
نشكر دعم المؤسسة الوطنية للعلوم الطبيعية (NSF) في الصين: JSK (32071137 و 92054103) وتمويل فريق البحث العلمي والابتكار في أول مستشفى تابع لجامعة تشنغتشو: JSK (ZYCXTD2023014).
Materials
| Name | Company | Catalog Number | Comments |
| BamHI | Thermo | FD0054 | |
| Calcium chloride | Sigma | C4901 | |
| CCCP | Sigma | C2759 | |
| Centrifuge | eppendorf | 5430R | |
| Centrifuge (cell culture) | eppendorf | 5810R | |
| CO2 cell incubator | ESCO | 170L IR Sensor | |
| Coverslips | Glaswarenfabrik Karl Hecht GmbH & Co.KG | 92100100030 | |
| Dental adhensive resin cement | Sun medical company, LTD. | Super-Bond C&B Kit | |
| D-glucose | Sigma | G7021 | |
| DNA Ligation Kit Ver. 2.1 | Takara | 6022 | |
| Dulbecco's modified Eagle medium | Gibco | 11965092 | |
| Electric drill | RWD Instruments | 78001 | |
| Fetal bovine serum | Gibco | A5670701 | |
| Fiber optic cannula | RWD Instruments | R-FOC-L200C-39NA | |
| Fiber photometry detector | Thinker | QAXK_FPS-TC-MC-LED | |
| Fluorescence microscope | Olympus | IX83 | |
| Glass pipette (for injection) | Drummond Scientific company | 3.5" Drummond # 3-000-203-G/X | |
| HEK293t | ATCC | Cat# CRL-3216 | |
| Hela cells | ATCC | Cat# CCL-2 | |
| HEPES | Sigma | H3375 | |
| Injection pump | Drummond Scientific company | 3-000-207 | |
| Isoflurane | RWD Instruments | R510-22 | |
| Laser scanning confocal microscope | Zeiss | LSM980 | |
| MluI | Thermo | FD0564 | |
| NheI | Thermo | FD0974 | |
| Optical fibers | RWD Instruments | R-FC-L-N3-200-L1 | |
| Paraffin oil | Sangon | B500301 | |
| PCR thermal Cycler | analytik jena | Biometra Tone 96G | |
| Pentobarbital sodium | Sinopharm Chemical Reagent Co.LTD | 57-33-0 | |
| Potassium chloride | Sigma | P5405 | |
| PrimeSTAR HS DNA Polymerase | Takara | R010A | |
| Programmable micropipette puller | Sutter Instruments | P2000 | |
| Quick self-curing acrylic resin | Yamahachi | V-PINK | |
| Real-time PCR thermal Cycler | analytik jena | qTOWER³ auto | |
| Rhodamine 800 | Sigma | 83701 | |
| SalI | Thermo | FD0644 | |
| Sodium chloride | Sigma | S9888 | |
| Sodium phosphate dibasic | Sigma | S9763 | |
| Stereotaxic apparatus | RWD Instruments | E06354 | |
| Veterinary ophthalmic ointment | Puralube | NA | |
| XhoI | Thermo | FD0694 |
References
- Vyas, S., Zaganjor, E., Haigis, M. C. Mitochondria and cancer. Cell. 166 (3), 555-566 (2016).
- Dzbek, J., Korzeniewski, B. Control over the contribution of the mitochondrial membrane potential (ΔΨ) and proton gradient (ΔpH) to the protonmotive force (Δp): IN SILICO STUDIES. J Biol Chem. 283 (48), 33232-33239 (2008).
- O'Rourke, B., Cortassa, S., Aon, M. A. Mitochondrial ion channels: Gatekeepers of life and death. Physiology. 20 (5), 303-315 (2005).
- Chan, D. C. Mitochondrial fusion and fission in mammals. Annu Rev Cell Dev Biol. 22 (1), 79-99 (2006).
- Jin, S. M., Lazarou, M., Wang, C., Kane, L. A., Narendra, D. P., Youle, R. J. Mitochondrial membrane potential regulates PINK1 import and proteolytic destabilization by PARL. J Cell Biol. 191 (5), 933-942 (2010).
- Ly, J. D., Grubb, D. R., Lawen, A. The mitochondrial membrane potential (deltapsi(m)) in apoptosis; an update. Apoptosis. 8 (2), 115-128 (2003).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. Biotechniques. 50 (2), 98-115 (2011).
- Meng, X. -. Y., et al. A sensitive mitochondrial thermometry 2.0 and the availability of thermogenic capacity of brown adipocyte. Front Physiol. 13, 977431 (2022).
- Kaestner, L., et al. Genetically encoded voltage indicators in circulation research. Int J Mol Sci. 16 (9), 21626-21642 (2015).
- Yang, H. H., St-Pierre, F. Genetically encoded voltage indicators: Opportunities and challenges. J Neurosci. 36 (39), 9977 (2016).
- Sepehri Rad, M., Cohen, L. B., Braubach, O., Baker, B. J. Monitoring voltage fluctuations of intracellular membranes. Sci Rep. 8 (1), 6911 (2018).
- Yang, R. -. Z., Wang, D. -. D., Li, S. -. M., Liu, P. -. P., Kang, J. -. S. Development and application of a mitochondrial genetically encoded voltage indicator in narcosis. Neurosci Bull. 40 (10), 1529-1544 (2024).
- Kumari, A., Nguyen, D. M., Garg, V. Patch-clamp technique to study mitochondrial membrane biophysics. J Gen Physiol. 155 (8), e202313347 (2023).
- Bayne, A. N., Dong, J., Amiri, S., Farhan, S. M. K., Trempe, J. -. F. MTSviewer: A database to visualize mitochondrial targeting sequences, cleavage sites, and mutations on protein structures. PLoS One. 18 (4), e0284541 (2023).
- Kim, B. B., et al. A red fluorescent protein with improved monomericity enables ratiometric voltage imaging with ASAP3. Sci Rep. 12 (1), 3678 (2022).
- Evans, S. W., et al. A positively tuned voltage indicator for extended electrical recordings in the brain. Nat Methods. 20 (7), 1104-1113 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved