Method Article
Consejos y trucos quirúrgicos para realizar un trasplante de páncreas porcino
En este artículo
Resumen
El artículo en video resume la técnica de pancreatectomía y alotrasplante de páncreas en un modelo porcino de supervivencia de 3 días con una descripción paso a paso del método y énfasis en los consejos y trucos quirúrgicos para lidiar con la precaria y delicada anatomía visceral porcina.
Resumen
A pesar de los resultados prometedores del trasplante de páncreas en la diabetes mellitus tipo 1 y el síndrome metabólico, la mayor preocupación en torno a esta técnica de vanguardia sigue siendo la escasez de órganos considerados aptos para el trasplante. La alta resistencia intravascular, el delicado marco capilar intraparenquimatoso y la compleja anatomía lobular alrededor de la vasculatura mesentérica son lo que hace que este órgano sea más susceptible a las lesiones y menos tolerante al trauma trivial en comparación con órganos como el hígado y el riñón. La disección quirúrgica meticulosa y el manejo juicioso del tejido forman la piedra angular de todo el ejercicio del trasplante de páncreas. Debido a la similitud morfológica entre la anatomía del páncreas porcino con los vasos mesentéricos circundantes y los órganos en comparación con la anatomía humana, la demostración de la técnica en el modelo porcino podría ayudar a extrapolar con mayor precisión esto a un entorno humano. El presente artículo tiene como objetivo describir los consejos y trucos quirúrgicos esenciales que deben seguirse, con el fin de garantizar una mayor tasa de éxito del trasplante de este órgano altamente susceptible en un modelo de supervivencia porcina de 3 días.
Introducción
En las últimas décadas, ha habido avances significativos en las estrategias de manejo perioperatorio y las técnicas quirúrgicas que conducen a la evolución del trasplante de páncreas en una de las estrategias más prometedoras para el tratamiento de la diabetes mellitus con enfermedad renal terminal (generalmente en combinación con el trasplante renal)1 . Sin embargo, las complicaciones como la pancreatitis del injerto, la lesión por isquemia-reperfusión y la trombosis vascular siguen siendo los mayores desafíos a superar para garantizar resultados exitosos, más aún en los injertos de criterios extendidos más dañados2. Además, los injertos de páncreas son los injertos más comúnmente descartados de la obtención y tienen las tasas de utilización más bajas (9%) para cualquier órgano3. Por lo tanto, la máquina de perfusión tiene como objetivo proporcionar un medio homeostático óptimo al injerto de páncreas con el objetivo de aumentar la tasa de utilización del injerto, similar a lo que se ha logrado en el trasplante de hígado, riñón y pulmón4. La anatomía pancreática porcina es compleja en términos de su arquitectura lobular (que comprende tres lóbulos), sus extensiones alrededor del eje mesentérico-portal, sus variaciones vasculares mesentéricas (en 40%-50%) y sus delicados canales vasculares a lo largo del asa C del duodeno5. Estos atributos anatómicos contribuyen a una disección desafiante tanto en la recuperación del injerto pancreato-duodenal como en la pancreatectomía receptora para inducir un estado de diabetes apancreática iatrogénica, es decir, un estado de diabetes mellitus inducido quirúrgicamente con un nivel de glucosa en ayunas superior a 8 mmol / L. Con base en estas características, la pancreatectomía porcina con trasplante proporciona la replicación más cercana posible de la técnica que podría realizarse en humanos como tratamiento definitivo contra la etapa terminal. diabetes mellitus. El presente artículo tiene como objetivo cubrir los siguientes aspectos: (i) esquema de la atención porcina perioperatoria durante la pancreatectomía receptora y el implante de injerto de páncreas; (ii) detalles técnicos paso a paso de la pancreatectomía receptora e implantación del injerto pancreato-duodenal y (iii) consejos y trucos de operación pancreática donante y receptora en modelos porcinos para minimizar la lesión del injerto y del receptor.
Protocolo
El protocolo recibió la aprobación ética del Comité de Cuidado de Animales, Instituto General de Investigación de Toronto. Los animales recibieron atención humanitaria de conformidad con la Sociedad Nacional de Investigación Médica y Guía para el cuidado de animales de laboratorio, Instituto Nacional de Salud (NIH), Ontario, Canadá. Para este estudio, se utilizaron cerdos machos de Yorkshire no relacionados de 15 semanas de edad, con un peso de 40-50 kg.
NOTA: Todo el protocolo del estudio se divide en los siguientes pasos principales: (i) recuperación de órganos y preparación de la mesa posterior; (ii) Pancreatectomía total del receptor y (iii) Implantación del injerto. Toda la cirugía del donante y del receptor se realiza en 1 día.
1. Recuperación de órganos de donantes y preparación de la mesa posterior
NOTA: El método para la recuperación de órganos se ha descrito en un protocolo separado6. Sin embargo, el protocolo, en resumen, se describe aquí junto con algunos puntos adicionales específicos de la técnica quirúrgica (consejos quirúrgicos relevantes para la operación del donante).
- En resumen, anestesiar al cerdo donante y asegurar la vía aérea y el catéter venoso central (descrito a continuación en la sección de pancreatectomía del receptor). Incisa y expone las vísceras. Realizar disección y movilización de la aortocaval hasta la bifurcación en vasos ilíacos.
- Manejo intestinal: El intestino delgado porcino es largo y tortuoso, y el intestino grueso está mayormente distendido. Asegúrese de reposicionar los asas intestinales en su posición anatómica después de cada paso de la operación del donante para garantizar una perfusión adecuada y evitar la posibilidad de torsión mesentérica.
- Disección hiliar: Ligate y divide las ramas arteriales y el conducto biliar para exponer la vena porta. Diseccionar el hilio (ligamento hepato-duodenal) lo más alto/distal posible para evitar el riesgo de lesionar los pequeños canales vasculares que perfunden el aspecto superior de la región pancreato-duodenal. Comience a esqueletizar los vasos en una secuencia de derecha a izquierda, hasta que la superficie anterior de la vena porta quede desnuda.
- Disección aorto-cava: Exponga la parte infradiafragmática suprahepática de la aorta dividiendo la crura diafragmática. Evite la disección de la vena cava inferior alrededor de la arboleda pancreato-duodenal. Use las arterias renales en ambos lados como el límite superior marcado de la disección.
- Exponga el páncreas abriendo el saco menor. Ligar y dividir las arterias renales. Canular la aorta infrarrenal y conectarse con la solución de la Universidad de Wisconsin (UW) para el lavado.
- Ligate la aorta suprahepática y la pinza. Enjuague con 1.5 L-2 L de solución UW para asegurar un lavado adecuado del intestino y el páncreas (evidente por la apariencia visual de palidez). Durante el lavado in situ del órgano, vuelva a colocar el intestino delgado y el intestino grueso en secuencia a la línea media asegurándose de que no haya torsión mesentérica. Este paso asegura un lavado uniforme del intestino y el páncreas con la solución de la UW (Universidad de Wisconsin) y es importante recordarlo.
- Incise la vena porta y la vena cava infrahepática simultáneamente después de iniciar el lavado para dejar salir el efluente venoso. Cubra el abdomen con hielo para asegurar la perfusión en frío. Diseccionar el órgano (injerto pancreatoduodenal con partes de retroperitoneo, psoas, bazo y suprarrenales) en masa.
- Disección en frío: Iniciar la movilización del injerto de dirección lateral a medial, desde la cola del páncreas hasta la unión entre la cabeza y el cuerpo, mediante una disección aguda de la fascia entre el páncreas y el intestino grueso. Mientras realiza este paso, sostenga el páncreas por su cubierta retroperitoneal con fórceps y pídale al asistente que le dé tracción contraria en el intestino grueso hacia el pie.
- Pinzamiento mesentérico: Después de dividir el tejido delgado alrededor del cuerpo del páncreas, el asa duodenoyeyunal y el intestino grueso, pídale al asistente que gire alrededor del pedículo mesentérico y tire del asa del intestino grueso caudalmente. Esto asegurará la delineación del mesenterio y la colocación segura de la pinza para dividir los vasos principales mesentéricos en secuencia sin dañar el parénquima pancreático.
- Disección extraperitoneal completa del injerto: Después de dividir los vasos mesentéricos, comience a recuperar el injerto por disección de medial a lateral en sentido contrario a las agujas del reloj, dividiendo los tejidos extrapancreáticos, incluida la fascia pararrenal, la glándula suprarrenal, el manguito de la VCI, el músculo psoas y el crus diafragmático. Asegurar un plano adecuado lejos de la aorta para evitar lesionar las arterias mesentérica y celíaca superiores.
- Realice la preparación de la mesa posterior sobre hielo. Guarde el órgano en una nevera (tiempo de isquemia fría de 5 h).
2. Pancreatectomía del receptor
- Preparación preoperatoria
- Ayunar el animal durante al menos 6 h antes del tiempo de inducción estipulado. Administrar una inyección que contenga midazolam (0,15 mg/kg), atropina (0,04 mg/kg) y ketamina (25 mg/kg) por vía subcutánea (SC), 15 min antes de transportar al animal al quirófano (quirófano). Administrar buprenorfina 0,3 mg inyección de liberación sostenida SC 15 min antes del transporte al quirófano.
- Posicionamiento: Coloque al animal en decúbito supino en la mesa de operaciones y arnée las extremidades anteriores para asegurar una posición estable durante la cirugía.
- Vía aérea e inducción: Ventilar al animal usando una bolsa y mascarilla con 3%-5% de isoflurano y 2-3 L de oxígeno por min, mientras se conecta la sonda del oxímetro de pulso y se monitoriza la frecuencia cardíaca y la saturación deO2 .
- Después de una relajación adecuada, confirmada por la relajación de las mandíbulas y la saturación estable de oxígeno y la frecuencia cardíaca, pídale al asistente que mantenga abierta la boca con la tracción adecuada en las mandíbulas superior e inferior relajadas del animal, y visualice las cuerdas vocales con el laringoscopio. Rocíe lidocaína al 2% para relajar las cuerdas vocales y prevenir los espasmos inducidos por la intubación (¡las cuerdas vocales porcinas son altamente vasculares y frágiles!).
- Intubar con un tubo endotraqueal de 7 mm e inflar el manguito con 3-5 ml de aire. Asegure la posición del tubo utilizando la sonda deCO2 espirado final (ETCO2) y conecte el tubo al ventilador, con 14-16 respiraciones por minuto para lograr un volumen corriente de 10-15 ml / kg. Bajar el isoflurano al 2,5% como dosis de mantenimiento de anestesia inhalatoria.
- Línea intravenosa: preparar asépticamente el sitio quirúrgico con betadine y colocar un paño estéril. Luego, identifique el punto de referencia para colocar el catéter venoso central, que es el centroide del triángulo formado entre el proceso mastoideo, el proceso acromion y la cabeza de la clavícula. Use una aguja de 16 G para perforar la vena; después de asegurar el flujo libre de sangre venosa, aparente por el color y la falta de pulsatilidad, introducir un alambre guía utilizando la técnica de Seldinger.
- Dilate el tracto usando el dilatador provisto. Reemplace el alambre guía y el dilatador con un catéter de 8.5 x 10 Fr y asegúrelos en su lugar suturando con una aguja de corte de sutura de seda 0-0. Conecte la vía IV a los antibióticos intravenosos que contienen cefazolina (1 g) y metronidazol (500 mg) seguido de anestesia intravenosa realizada por infusión de propofol a razón de 10 ml / h.
- Monitorización invasiva de la presión arterial: Después de preparar asépticamente el sitio quirúrgico con betadina, coloque un paño estéril y haga una incisión paralela a la tráquea a 2 cm de la línea media. Diseccionar las fibras del músculo esternomatoideo y la fascia paratraqueal mediante disección roma utilizando fórceps en ángulo recto y fórceps hemostáticos de Lahey.
- Identifique la vena yugular lateral a las fibras de los músculos de la correa y diseccione a lo largo del músculo compartimentándola desde la arteria carótida medialmente usando disección roma como se describió anteriormente. Identificar la arteria por su pulsación, textura (similar a un cordón) y plexo perivascular. Movilizar el recipiente y lanzarlo con dos lazos de seda 2-0.
- Perforar el vaso con un angiocatéter de 16 G con una punta biselada apuntando hacia arriba y retirar el estilete interno una vez dentro del vaso. Deslice la vaina externa del catéter utilizando la técnica de Seldinger y conecte la salida al sistema de medición de la presión arterial (PA). Antes de conectar el monitor de presión arterial invasivo, calibre la lectura a cero para garantizar un registro preciso y asegurar el catéter en su lugar utilizando las bridas de seda a través.
- Monitoreo de temperatura y calentamiento: Coloque la sonda de registro de temperatura por vía oral. Cubra al animal con el edredón calefactor Bair-hugger y asegúrese de una temperatura de 37-38 °C. Lubrique los ojos con un gel lubricante neutro para los ojos. Pintar y cubrir el campo quirúrgico
- Procedimiento quirúrgico
NOTA: La piel se prepara asépticamente para todos los procedimientos quirúrgicos con exfoliantes betadine seguidos de la colocación de cortinas estériles.- Incisión y exposición: Haga una incisión en la línea media desde el xiphisternum hasta la sínfisis del pubis utilizando el modo de corte puro de la electrocauterización de Bovie. Asegúrese de mantener lateral a la uretra en la parte inferior de la incisión más allá del falo para evitar lesiones. Coloque el retractor de la pared abdominal autoretenible teniendo cuidado de no lesionar el bazo y el hígado, para optimizar la exposición del campo quirúrgico.
- Movilización de la cabeza del páncreas: Con el asistente que proporciona contratracción a la arboleda pancreato-duodenal, comience por diseccionar a lo largo del plano fascial avascular entre el parénquima pancreático (lóbulo duodenal) y la VCI infrahepática.
- Movilización del anillo pancreático: El páncreas porcino forma un anillo alrededor del eje mesentérico-portal (lóbulo de conexión). Diseccionar a lo largo de la fascia en cada aspecto de la vena porta (PV) para asegurar la movilización completa del lóbulo de conexión de la PV suprayacente. La forma más segura es comenzar la disección a lo largo de cada lado de la vena porta y separar los tejidos circunferencialmente en sentido horario o antihorario.
- Movilización de la cola pancreática: A continuación, identifique la unión entre los tejidos pancreáticos y pararrenales (visto como una línea blanca) y comience a diseccionar la cola de la vena esplénica subyacente que permanece cerca del parénquima. Ligate y divide los pequeños afluentes venosos al parénquima, teniendo cuidado de no dañar la vena esplénica usando lazos de seda 3/0.
- Movilización del cuerpo pancreático: Diseccionar a lo largo de la capa delgada de tejido que separa el parénquima del intestino grueso y el estómago, teniendo cuidado de preservar la delgada arcada vascular a lo largo de la región infrapilórica.
- Movilización pancreato-duodenal: A continuación, separe el parénquima del asa C del duodeno mediante disección aguda en la arboleda pancreato-duodenal mediante tracción-contratracción, teniendo cuidado de preservar la delgada arcada vascular a lo largo del asa C del duodeno.
- División del conducto pancreático: Identificar el conducto pancreático, ligar con lazos de seda 2-0 y dividir manteniendo alrededor de 3-5 mm el muñón del conducto en el asa C duodenal, manteniéndose alejado de la arcada vascular duodenal (en estrecha relación con el conducto).
- Extracción de la muestra: Complete la última parte de la movilización diseccionando el parénquima de la unión entre el lóbulo de conexión, el duodeno y el colon a cada lado de la vena porta. Extraiga la muestra en masa (Figura 1) dividiendo el lóbulo de conexión en la cara anterior de la PV. Se requiere la división del parénquima para extraer la muestra debido a su ubicación circunferencial alrededor de la PV.
- Asegurar la hemostasia a lo largo de las áreas de disección e inspeccionar el duodeno para detectar cualquier lesión y congestión vascular (Figura 2).
- Implantación del injerto pancreato-duodenal
- Preparación del injerto: Prepare el injerto PV y el extremo aórtico proximal recortando los bordes para la anastomosis. Coloque el injerto preparado en la bolsa de órganos con solución UW en un baño de hielo. Tome biopsias con aguja gruesa de la cola pancreática: almacene formalina, congele rápidamente y extraiga ARN en una etapa posterior. Suturar el sitio de la biopsia usando Prolene 6-0 en una figura de 8 manera.
- Disección aorto-cava: Comience identificando el uréter derecho y disecte a lo largo de la fascia que separa el uréter de la cubierta retroperitoneal sobre la vena cava inferior. Diseccionar a lo largo del borde lateral de la aorta para exponerla desde el músculo psoas subyacente. Luego, disecciona a lo largo de la arboleda interaortocaval para separar la aorta de la IVC.
- Prueba de pinza: Asegurar la movilización adecuada de la aorta y la VCI mediante un ensayo de colocación de pinza vascular de Satinsky. Cambie de posición con el primer asistente y prepare el campo quirúrgico retrayendo los asas intestinales en el lado izquierdo para exponer los vasos principales para la anastomosis. Coloque las pinzas de prueba en la VCI y la aorta para volver a evaluar una movilización adecuada de ambos vasos para la anastomosis.
- Anastomosis venosa: Después de colocar la pinza de mordida lateral vascular en la VCI, haga una pequeña abertura en la pared anterior del vaso y extiéndala a un tamaño adecuado (emparejado con el vaso del injerto) craneal y caudalmente usando las tijeras de Pott. Enjuague la luz con solución salina heparinizada usando la vaina flexible de una cánula intravenosa.
- Con Prolene 6-0 de doble aguja, haga suturas de esquina en la VCI (de adentro hacia afuera) y la vena porta del injerto (de adentro hacia afuera). Asegure la sutura de la esquina caudal y pase una de las agujas a lo largo de la pared posterior del injerto y la vena receptora de manera continua. Asegure la pared anterior de manera similar (de afuera en forma continua) y asegure el nudo en el centro de la pared anterior después de enjuagar la luz de la anastomosis con solución salina heparinizada.
- Despinzamiento de la vena: coloque la pinza vascular de un Bulldog en la vena porta del injerto, lejos de la anastomosis y libere lentamente la pinza de mordida lateral de la VCI receptora. Verifique si hay relleno venoso y cualquier sangrado importante de la anastomosis.
- Anastomosis arterial: coloque la pinza de mordida lateral en la aorta teniendo cuidado de no lesionar las ramas lumbares a lo largo de la pared posteromedial del vaso. Indique al anestesista que inyecte heparina (100 U/kg de peso corporal) y metilprednisolona (500 mg) a través del catéter venoso central.
- Haga una abertura en la pared anterior del vaso y extiéndala craneal y caudalmente teniendo cuidado de no diseccionar a lo largo de la pared del vaso. Enjuague la luz con solución salina heparinizada y utilizando la doble aguja Prolene 6-0, suture el extremo proximal de la aorta del injerto a la abertura aórtica receptora de manera continua mediante la técnica del paracaídas. Enjuague la luz con solución salina heparinizada antes de atar el nudo final en la pared anterior del vaso.
- Reperfusión: Cuide los siguientes dos aspectos mientras realiza este paso. En primer lugar, las alteraciones hemodinámicas donde se produce una caída drástica de la PA media. Controle la PA invasiva minuto a minuto y realice un ajuste de la dosis del vasopresor (infusión de norepinefrina) y la precarga de líquidos para mantener la PA media objetivo entre 45-50 mmHg.
- En segundo lugar, mantener la hemostasia. Después de retirar la pinza bulldog de la vena, evaluar cualquier sangrado importante del parénquima, la región paraaórtica y el área periportal; Luego, suelte la pinza aórtica y verifique si hay sangrado del sitio anastomótico arterial. Asegure los puntos de sangrado con ligaduras y sutura hemostática. Pídale al anestesista que inyecte un vial de ácido tranexámico a través del catéter venoso central.
NOTA: Una regla importante es minimizar la manipulación agresiva del páncreas durante esta fase de reperfusión (para evitar el edema del injerto y el hematoma). - Anastomosis intestinal: Después de asegurarse de que no haya torsión mesentérica, aísle un asa de yeyuno, a 40-50 cm de la unión duodenojeunal, y acerque al injerto. Anastomosar el duodeno del injerto al yeyuno receptor de forma continua de lado a lado utilizando la sutura Polydioxanone 4-0, teniendo cuidado de asegurar un diámetro luminal adecuado de 1,5-2 cm.
- Hemostasia y biopsia post-reperfusión: Asegurar la hemostasia alrededor del injerto y en los sitios de anastomosis. Tome tres biopsias con aguja gruesa de la cola pancreática1 h después de la reperfusión, almacene formalina, congele rápidamente y extraiga ARN en una etapa posterior. Suturar el sitio de la biopsia con Prolene 6-0 en una figura de 8 manera.
- Cierre de la pared abdominal: Después de evaluar si hay trapeadores retenidos y asegurar la hemostasia, suture el recto abdominal de manera continua utilizando la aguja de polidioxanona 0 teniendo cuidado en la línea media inferior para mantenerla alejada de la uretra. Cerrar la piel con sutura de seda 0 de forma continua.
NOTA: Idealmente, se recomiendan suturas de monofilamento (Nylon); Sin embargo, dado que este es un modelo de supervivencia de 3 días, la seda es aceptable en estos modelos experimentales. - Amarre del catéter venoso central: cree un túnel subcutáneo en el cuello y asegure el catéter venoso central enterrándolo debajo del túnel y suturando la piel suprayacente con una aguja de corte de seda 0-0.
- Extracción del catéter arterial: Después de asegurar una PA media estable (40-50 mmHg) y una tendencia mejorada de los niveles de pH y lactato en el análisis de gases en sangre, retire el catéter arterial y liga el vaso para asegurar la hemostasia en el cuello. Cierre la piel suprayacente con la sutura de seda 0 de forma continua.
- Coloque al animal y extubación: Bajo todas las precauciones necesarias, gire el esternón del animal en un carro de transporte. Observe la saturación de O2 y la inversión de la anestesia (movimiento de extremidades, esfuerzos respiratorios espontáneos, SpO2 >95% de descuento enO2 y soporte del ventilador) y extubar al animal. Transporte al corral y coloque el esternón del animal y controle el estado hemodinámico hasta que esté estable.

Figura 1: Muestra de pancreatectomía resecada en masa. Tenga en cuenta el anillo de tejido pancreático que rodea la vena porta in vivo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Imagen del duodeno. El asa C del duodeno con una arcada vascular preservada (punta de flecha) comparada con el asa yeyunal circundante y evaluada para la congestión. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Los parámetros bioquímicos perioperatorios y postoperatorios, de hasta 3 días, de los cinco modelos de supervivencia de trasplante de páncreas se resumen a continuación (numerados como PTX 1 a 5 en la cronología). De los cinco trasplantes de páncreas totales, a todos les fue bien durante el período de supervivencia de 3 días, como lo demuestra su bienestar general y las pruebas de lesión pancreática y función endocrina. Los resultados que se muestran a continuación son representativos de la experiencia de un modelo de supervivencia de 3 días de pancreatectomía receptora seguida de alotrasplante de páncreas después del almacenamiento estático en frío del injerto.
El tiempo quirúrgico promedio para la pancreatectomía fue de 52 min (45-64 min). Dado que este era un modelo de latidos cardíacos con muerte cerebral, no hubo fase de isquemia cálida asistólica en el donante. El tiempo promedio de isquemia caliente del receptor desde la aplicación de la pinza de cava de mordida lateral hasta la reperfusión del injerto fue de 49,5 min (40-55 min). Los cinco injertos tuvieron un tiempo de isquemia fría de 5 horas (300 minutos) según el protocolo del estudio. Todos los animales recibieron inmunosupresión en forma de 300 mg de ciclosporina Syp, dos veces al día.
Parámetros clínicos y bioquímicos perioperatorios
La frecuencia cardíaca media 1 h después de la reperfusión fue de 135 latidos/min (120-170 latidos/min). La presión arterial media fue de 37 mmHg (30-55 mmHg), generalmente mantenida bajo la cubierta de una dosis alta de infusión de norepinefrina. En los cinco casos, la norepinefrina podría reducirse y suspenderse antes de volver a trasladar al animal a su corral. Los niveles de lactato fueron monitoreados en el quirófano durante 3 h después de la reperfusión. La tendencia se representa en la Figura 3.
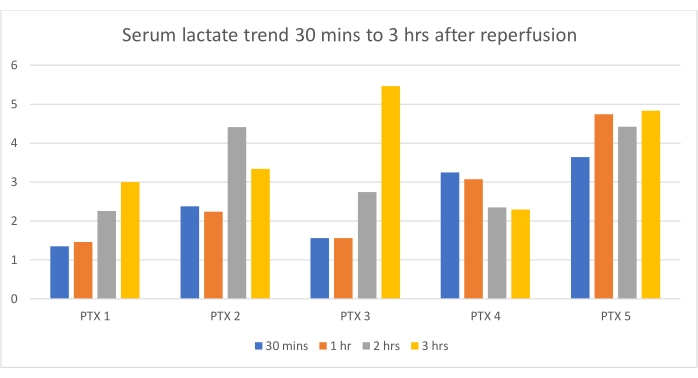
Figura 3: Niveles séricos de lactato después de la reperfusión del injerto. La tendencia se midió durante las primeras 3 h de reperfusión. El eje Y representa los valores de lactato (en mmol/L). Haga clic aquí para ver una versión más grande de esta figura.
Parámetros bioquímicos clínicos y de lesión pancreática postoperatoria
Los cinco animales estaban clínicamente alerta, evidente por el movimiento activo de las extremidades y los patrones de respiración, dentro de las 5-6 h de la reperfusión. Todos ellos estaban activos, aceptaban alimentos orales y medicamentos, y orinaban y defecaban en la mañana del día 1 postoperatorio.
Los niveles de amilasa postoperatoria durante los primeros 3 días se resumen en la Figura 4.

Figura 4: Niveles séricos de amilasa después de la reperfusión del injerto. La tendencia se midió durante los primeros 3 días después del trasplante. El eje Y representa los niveles de amilasa (U/L). Haga clic aquí para ver una versión más grande de esta figura.
Los niveles de lipasa sérica postoperatoria durante los primeros 3 días se resumen en la Figura 5.

Figura 5: Niveles séricos de lipasa después de la reperfusión del injerto. La tendencia se midió durante los primeros 3 días después del trasplante. El eje Y representa los niveles de lipasa (U/L). Haga clic aquí para ver una versión más grande de esta figura.
Los niveles séricos postoperatorios de lactato deshidrogenasa (LDH) se resumen a continuación en la Figura 6.
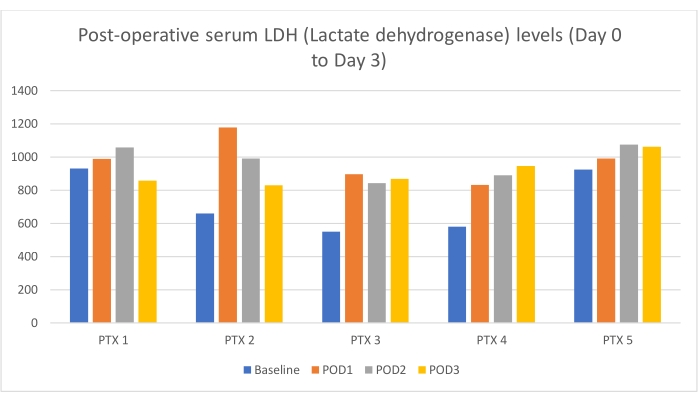
Figura 6: Niveles séricos de LDH después de la reperfusión del injerto. La tendencia se midió durante los primeros 3 días después del trasplante. El eje Y representa los niveles de LDH (U/L). Haga clic aquí para ver una versión más grande de esta figura.
Prueba postoperatoria de tolerancia a la glucosa
Se realizó una prueba de tolerancia a la glucosa IV de 120 min en el tercer día postoperatorio. Se inyectó una dosis de 50 ml que contenía 50% de dextrosa a través del catéter venoso central y el tiempo se registró como 0 min. Las muestras de sangre se extrajeron posteriormente a los 2 min, 5 min, 10 min, 20 min, 30 min, 60 min, 90 min y 120 min y se procesaron para determinar los niveles de glucosa. El resto de la muestra se centrifuga a 8.000 x g durante 10 min y el sobrenadante se almacena en tres tubos de microcentrífuga a -80 °C. La figura 7 representa la tendencia de la prueba de tolerancia a la glucosa para los cinco casos (PTX 1-5).

Figura 7: Niveles de glucosa sérica evaluados por la prueba de tolerancia a la glucosa IV. Los niveles de glucosa sérica se evaluaron 0-120 min mediante la prueba de tolerancia a la glucosa IV y se compararon entre PTX 1-5. El eje Y representa los niveles de glucosa (mmol/L). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El protocolo actual se ha realizado para demostrar la técnica y la viabilidad de la pancreatectomía y el alotrasplante de páncreas en modelos porcinos. Los animales fueron observados durante un período de 3 días después del trasplante para demostrar la fiabilidad de la técnica de pancreatectomía y el alotrasplante. Todos los animales fueron monitoreados y amamantados durante 3 días después de la cirugía utilizando un protocolo estandarizado de cuidado animal de antibióticos, líquidos, analgésicos, nutrición suplementaria e inmunosupresores (es decir, ciclosporina). Fueron sacrificados al tercer día postoperatorio (después de 72 h o antes si así lo exige el deterioro clínico) mediante una técnica humanitaria éticamente aprobada. Las biopsias se tomaron de la cola, el cuerpo, la cabeza y el duodeno y se enviaron para análisis histopatológico, y las secciones restantes se almacenaron en tampón de aislamiento de ARN y se congelaron a presión (- 80 ° C) para su uso posterior.
Uno de los primeros intentos de demostrar con éxito la inducción de diabetes mellitus iatrogénica en el modelo porcino por pancreatectomía fue publicado por Chaiba et al. en 2011 en una cohorte de 10 cerdos machos blancos que pesaban 27-33 kg7. El grupo demostró los planos anatómicos y los puntos de referencia que establecen una hoja de ruta para la pancreatectomía exitosa en modelos porcinos. Prudhomme et al. en 2020 demostraron la viabilidad de la inducción de diabetes y el alotrasplante de páncreas en su cohorte de tres cerdos machos de Susscrofa8. La inducción de diabetes se evaluó mediante niveles de péptido C 3 h después de la pancreatectomía total. La inducción médica de diabetes mellitus en cerdos de Yorkshire fue demostrada con éxito por Grussner et al. en 1993 con una tasa de mortalidad del 0% en una cohorte de 67 cerdos autóctonos de Yorkshire9. La inducción exitosa de la diabetes por pancreatectomía fue evaluada utilizando los niveles de glucosa sérica, guiada por el bienestar clínico del animal por nuestro grupo (Mazilescu et al.) en 202210. Tras el establecimiento de una inducción exitosa, nuestro grupo procedió con el alotrasplante de páncreas después de la pancreatectomía en la fase posterior del protocolo.
Una limitación importante del estudio es garantizar la replicabilidad uniforme en todas las cohortes de animales. Esto se debe principalmente a la fragilidad del modelo porcino en términos de ser propenso a la gripe estacional, zoonosis, etc. Estos factores pueden contribuir a sesgar negativamente los resultados, independientemente de la técnica que se utilice para la cirugía.
Los factores que afectan el resultado del trasplante de páncreas incluyen condiciones preoperatorias como bienestar general, estado cardiopulmonar, infección estacional y condiciones perioperatorias como el estado del injerto al final de la máquina de perfusión, manejo del injerto durante la cirugía, alteraciones hemodinámicas en la reperfusión11. Desde el punto de vista quirúrgico, minimizar el manejo del injerto in vivo y ex situ juega un papel importante para asegurar la implantación de un injerto mínimamente dañado en este modelo de trasplante altamente precario12. Las modificaciones en la composición de la solución de perfusión, la solución dializante y los parámetros fisiológicos durante la perfusión de la máquina también podrían determinar el resultado del trasplante y actualmente están siendo evaluados por el grupo. El establecimiento de un modelo exitoso de alotrasplante en injertos perfundidos con máquina podría allanar aún más el camino para injertos de criterios extendidos, como la donación después de la muerte cardíaca (DCD) y el almacenamiento en frío prolongado (ECS) de páncreas en el futuro.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Ninguno.
Materiales
| Name | Company | Catalog Number | Comments |
| Belzer UW Cold storage solution | Bridge to life Ltd (Columbia, SC, USA) | 4055 | |
| Calcium gluconate (10%) | Fresenius Kabi Canada Ltd (Toronto, ON) | C360019 | |
| Composelect (blood collection bags) | Fresenius Kabi Canada Ltd (Toronto, ON) | PQ31555 | |
| Heparin (10000 IU/10 ml) | Fresenius Kabi Canada Ltd (Toronto, ON) | C504710 | |
| Lactated Ringer's | Baxter (Mississauga, ON, Canada) | JB2324 | |
| Percutaneous Sheath Introducer Set with Integral Hemostasis Valve/side Port for use with 7-7.5 Fr Catheters | Arrow International LLC | SI-09880 | |
| Sodium bicarbonate (8.4%) | Fresenius Kabi Canada Ltd (Toronto, ON) | C908950 | |
| Solu-Medrol | Pfizer Canada Inc. | 52246-14-2 | |
| Surgical retreival and transplant instrument set |
Referencias
- Gruessner, R. W., Gruessner, A. C. The current state of pancreas transplantation. Nature Reviews. Endocrinology. 9 (9), 555-562 (2013).
- Redfield, R. R., Rickels, M. R., Naji, A., Odorico, J. S. Pancreas transplantation in the modern era. Gastroenterology Clinics of North America. 45 (1), 145-166 (2016).
- Canadian Institute for Health Information. Annual Statistics on Organ Replacement in Canada: Dialysis, Tranplantation and Donation, 2009 to 2018. Canadian Institute for Health Information. , Ottawa, ON: CIHI. (2019).
- Prudhomme, T., et al. Ex-situ perfusion of pancreas for whole-organ transplantation: Is it safe and feasible?A systematic review. Journal of Diabetes Science and Technology. 14 (1), 120-134 (2020).
- Ferrer, J., et al. Pig pancreas anatomy: Implications for pancreas procurement, preservation, and islet isolation. Transplantation. 86 (11), 1503-1510 (2008).
- Parmentier, C., et al. Normothermic ex vivo pancreas perfusion for the preservation of pancreas allografts before transplantation. Journal of Visualized Experiments. , (2022).
- Chaib, E., et al. Total pancreatectomy: Porcine model for inducing diabetes - Anatomical assessment and surgical aspects. European Surgical Research. 46 (1), 52-55 (2011).
- Prudhomme, T., et al. Total pancreatectomy and pancreatic allotransplant in a porcine experimental model. Experimental and Clinical Transplantation. 18 (3), 353-358 (2022).
- Grussner, R., et al. Streptozotocin-induced diabetes mellitus in pigs. Hormone and Metabolic Research. 25 (4), 199-203 (1993).
- Mazilescu, L. I., et al. Normothermic ex situ pancreas perfusion for the preservation of porcine pancreas grafts. American Journal of Transplantation. 22 (5), 1339-1349 (2022).
- Kumar, R., et al. Ex vivo normothermic porcine pancreas: A physiological model for preservation and transplant study. International Journal of Surgery. 54, 206-215 (2018).
- Kaths, J. M., et al. Normothermic ex vivo kidney perfusion for the preservation of kidney grafts prior to transplantation. Journal of Visualized Experiments. (101), e52909(2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados