Method Article
Glikan Analizi için Microglia'dan Mitokondriyal Hazırlık
Bu Makalede
Özet
Mikroglial hücrelerden saflaştırılmış mitokondrinin hazırlanması, N-glikan salınımı için mitokondriyal proteinlerin izolasyonu ve yüksek çözünürlüklü doğru kütle analizörü kütle spektrometresine bağlı kızılötesi matris destekli lazer desorpsiyon elektrosprey iyonizasyonu kullanılarak hücre altı, mitokondriyal glikanların hızlı tespiti için bir protokol geliştirilmiştir.
Özet
Mikrogliadaki mitokondriyal proteinlerin glikozilasyon modellerini anlamak, nörodejeneratif hastalıklardaki rollerini belirlemek için kritik öneme sahiptir. Burada, kültürlenmiş mikrogliadan izole edilen mitokondriyal proteinlerin glikomik analizi için yeni ve yüksek verimli bir metodoloji sunuyoruz. Bu yöntem, mikroglial kültürlerden mitokondrinin izolasyonunu, mitokondriyal örneklerin kalite değerlendirmesini, ardından glikan tespitini en üst düzeye çıkarmak için optimize edilmiş bir protein ekstraksiyonunu ve mitokondriyal glikozilasyonun ayrıntılı profillerini sağlamak için kızılötesi matris destekli lazer desorpsiyon elektrosprey iyonizasyonu (IR-MALDESI) yüksek çözünürlüklü doğru kütle (HRAM) kütle spektrometresini içerir.
Bu protokol, izolasyon sırasında mitokondriyal bütünlüğün korunmasının önemini vurgular ve ekstraksiyondan sonra mitokondriyal saflığın ölçülmesi de dahil olmak üzere tekrarlanabilirliği sağlamak için sıkı kalite kontrolü kullanır. Bu yaklaşım, nörodejeneratif hastalıklarla ilişkili mitokondriyal değişiklikler hakkında fikir veren in vitro çeşitli deneysel koşullar altında mikroglial mitokondrideki glikozilasyon değişikliklerinin kapsamlı bir şekilde profillenmesine izin verir. Bu yaklaşım, diğer in vitro tedavilere, diğer kültürlenmiş hücre tiplerine veya birincil hücrelere uyarlanabilir. Bu standartlaştırılmış yaklaşım sayesinde, mikroglial mitokondriyal glikanların anlaşılmasını ilerletmeyi ve daha geniş nörodejeneratif araştırma alanına katkıda bulunmayı amaçlıyoruz.
Giriş
Mikroglia, beyindeki baskın yerleşik doğuştan gelen bağışıklık hücreleridir ve yetişkin beynindeki hücrelerin %10-15'ini oluşturur 1,2. Beyin mikro çevresini dinamik olarak izlemek ve beyin homeostazını sürdürmek için normal beyin fonksiyonunu düzenlemek için reseptör repertuarlarını kullanırlar3. Mikroglia, mikro çevrelerindeki değişikliklere karşı çok hassastır ve hücre morfolojisinde, immünofenotip ve fonksiyonda patolojik durumlar veya çeşitli stimülasyonlarla değişikliklere uğrar. Mikroglial aktivasyon durumları, fagositoz, sitokin üretimi veya doku onarımı gibi işlevleri için gerekli olan hücresel enerji taleplerinden etkilenir. Bu nedenle, hücresel enerji metabolizması, mikroglial fonksiyondaki değişikliklerin düzenlenmesinde çok önemli bir rol oynar4. Mikroglial disregülasyon, proinflamatuar sitokinlerin (ör., IL-1β, TNF-α) ve reaktif oksijen türlerinin (ROS) aşırı salınımına yol açarak beyni nöroinflamasyona yatkın hale getirir 5,6. Kronik mikroglial düzensizlik ve bunun sonucunda ortaya çıkan nöroinflamatuar ortam, nörodejenerasyon için bir temel oluşturur7.
Beyin, vücut ağırlığının sadece %2'sini, ancak vücudun toplam enerji tüketiminin %20'sini oluşturur. Mitokondri, beyin hücrelerinde birincil enerji kaynağıdır ve hem akut hem de kronik beyin bozukluklarının patogenezinde kilit oyuncular olarak işlev görür8. Önceki çalışmalar, yaşlanmada9 mikroglial aktivasyon ile metabolik işlev bozukluğu ile Alzheimer hastalığı10,11 gibi yaşa bağlı bozukluklar arasında güçlü bir ilişki kurmuş ve mitokondrinin hücresel yaşlanma ve nörodejenerasyondaki önemli rolünü vurgulamıştır. Bozulmuş mitokondriyal fonksiyon, yaşlanma ve yaşa bağlı hastalıklar sırasında enerji üretiminin azalmasına, oksidatif stresin artmasına ve nöroinflamasyonun artmasına neden olur.
Kapsamlı araştırmalar mitokondrinin enerji metabolizması, yaşlanma ve beyin bozukluklarındaki rolünü aydınlatmış olsa da, mitokondriyal biyoloji ve fonksiyonda glikosilasyon gibi yaygın translasyon sonrası modifikasyonların rolü yeterince araştırılmamıştır. Glikan adı verilen şeker parçalarının glikozilasyon enzimleri tarafından proteinlere enzimatik olarak eklenmesi olan glikozilasyon, mikroglia da dahil olmak üzere çoğu beyin hücresinde en yaygın translasyon sonrası modifikasyondur. Aktive edilmiş mikroglia, hücre içi veya hücre yüzeyi glikan ekspresyonunu düzenleyerek enflamatuar uyaranlar altında bağışıklık fonksiyonlarını modüle eder12. Stimülasyon sonrası mikroglia tarafından sergilenen pro- ve anti-enflamatuar tepkiler de glikanlar13 tarafından düzenlenir. Mitokondriyal proteinler ayrıca işlevlerini ve lokalizasyonlarını düzenleyen bu glikan modifikasyonlarına sahiptir. Bununla birlikte, mikrogliadaki hücreye özgü mitokondriyal glikozilasyon modellerinin ayrıntılı analizi, hücre altı glikozilasyonun araştırılmasındaki teknik zorluklar nedeniyle eksiktir. Mikroglial fenotipi modüle etmede glikozilasyonun iyi karakterize edilmiş rollerine rağmen, glikanların mitokondriyal fonksiyonu ve ardından mikrogliadaki hücresel immünofenotip modüle etmedeki rolü tam olarak anlaşılamamıştır.
Mitokondriyal protein glikozilasyonunu araştıran sınırlı çalışmalar, öncelikle glikosilasyon paternlerinin lektin bazlı tanımlanmasına odaklanmıştır. Lektinler, glikan bileşimi hakkında ayrıntılı bilgi sağlama özgüllüğü ve yeteneğinden yoksun olan biyomoleküler glikan kısımlarını14,15 bağlayan glikan bağlayıcı proteinlerdir. Kütle spektrometrik modaliteleri, lektin analizinin sunduğu analitik zorlukların üstesinden gelmek için glikan bileşimlerinin ayrıntılı bir şekilde tanımlanmasını sağlar. Böyle bir modalite, kızılötesi matris destekli lazer desorpsiyon elektrosprey iyonizasyonu (IR-MALDESI), nötr türleri desorbe etmek ve onları ortogonal bir elektrosprey tüyüne tabi tutmak için biyolojik numunelerde16 bulunan suyu rezonans olarak uyarmak için bir orta IR lazer kullanarak hibrit bir iyonizasyon stratejisi kullanır, ardından yüksek çözünürlüklü doğru kütle Orbitrap kütle spektrometresi kullanılarak analiz edilir. IR-MALDESI daha önce doku metabolitlerinin17 doğrudan analizi için, hızlı analiz18, yumuşak iyonizasyon yöntemi ve klorlu glikan eklentilerinin19 izotopik dağılım modellerine dayalı olarak N-bağlı glikanların sialik asit içeriğinin tahmin edilebilirliği gibi belirgin avantajları ile gösterilmiştir. Bununla birlikte, bu platformun hücre altı glikanların doğrudan analizi için adaptasyonu gösterilmemiştir.
Burada, mikroglial hücrelerden mitokondriyal izolasyon, mitokondriyal N-glikanların izolasyonu ve IR-MALDESI kütle spektrometresi kullanılarak mitokondriyal N-glikan tespiti ve analizi için yüksek verimli bir protokol bildiriyoruz. Bu protokol, mitokondriyal fonksiyonda glikozilasyonun rolüne ilişkin yeni içgörülerin ortaya çıkarılmasında ve potansiyel olarak nöroinflamatuar ve nörodejeneratif bozukluklar için yeni terapötik hedeflerin belirlenmesinde temel olacaktır.
Protokol
1. BV2 Mikroglial hücre hattı kültürü
- BV-2 hücrelerini (C57BL / 6 farelerinden türetilen mikroglial hücreler) %10 Fetal Sığır serumu (FBS), %1 Penicillium-Streptomisin (PenStrep) ve %1 Esansiyel Olmayan Amino Asitler (NEAA) ile desteklenmiş DMEM düşük glikoz ortamında koruyun.
- Hücreleri T-175 şişelerinde büyütün ve% 70-80 birleşmeye ulaşmalarına izin verin.
- % 5 CO2 içinde 37 ° C'de 5 dakika boyunca hücre ayrışma enzimleri ile inkübe ederek hücreleri bölün, ardından enzimlerin eşit hacimde hücre ortamı ile inaktivasyonu ve hücrelerin oda sıcaklığında (RT) 500 × g'da 5 dakika santrifüjlenmesi ile hücreler bölün.
NOT: Burada kullanılan hücre ayrışma enzimleri, BV2 hücrelerinde tripsin'den daha naziktir ve hücre yüzeyi antijen ekspresyonunu korumak için kullanılabilir. - Ortamı aspire edin, hücre peletini 1 mL büyüme ortamında yeniden süspanse edin ve tripan mavisi kullanarak hücreleri sayın ( Malzeme Tablosuna bakınız).
NOT: Bu adımda hücreleri saymak için otomatik bir hücre sayacı kullandık. - Mitokondriyal izolasyonu gerçekleştirmek için, hücre peleti 2 × 107 (20 milyon hücre/topak) içeriyorsa devam edin.
2. Mitokondrinin mikroglial hücrelerden izolasyonu
NOT: İşlem boyunca her şeyi buz üzerinde tutarak hızlı çalışın. Mitokondriyal izolasyon için kullanılan mitokondriyal izolasyon kitinin üç bileşeni vardır: Reaktif A (hücre lizis tamponu), Reaktif B (stabilize edici tampon) ve Reaktif C (mitokondriyal yıkama tamponu). Kullanmadan hemen önce reaktif A'ya ve reaktif C'ye proteaz inhibitörleri ekleyin.
- Pelet 2 × 107 hücre, hasat edilen hücreleri 2.0 mL'lik bir mikrosantrifüj tüpünde 500 × g'da 5 dakika santrifüjleyerek santrifüjleyin. Süpernatanı dikkatlice aspire edin ve atın.
- 800 μL mitokondriyal izolasyon reaktifi A (hücre lizis tamponu) ekleyin, orta hızda 5 saniye girdap yapın ve tüpü tam olarak 2 dakika buz üzerinde inkübe edin.
NOT: 2 dakikalık inkübasyon süresini aşmayın. - 10 μL mitokondriyal izolasyon reaktifi B (stabilize edici tampon) ekleyin, 5 saniye boyunca maksimum hızda girdap yapın ve tüpü 5 dakika boyunca buz üzerinde inkübe edin, her dakika maksimum hızda girdap yapın.
- 800 μL mitokondri izolasyon reaktifi C (mitokondriyal yıkama tamponu) ekleyin, karıştırmak için tüpü birkaç kez ters çevirin ve tüpü 700 × g'da 4 ° C'de 10 dakika santrifüjleyin.
NOT: Girdap yapmayın. - Süpernatanı 2.0 mL'lik yeni bir tüpe aktarın ve 4 ° C'de 15 dakika boyunca 3.000 × g'da döndürün.
- Süpernatanı (sitozolik kısımlar) yeni bir tüpe aktarın. Pelet, izole edilmiş mitokondriyi içerir.
- Pelete 500 μL Mitokondri izolasyon reaktifi C ekleyin ve 5 dakika boyunca 12.000 × g'da santrifüjleyin.
- Peleti protein miktar tayini ve işlenmesi için kullanın veya daha fazla kullanıma kadar peleti -80 °C'de saklayın.
3. MikroBCA testi kullanılarak protein tahmini
NOT: Bu protokol için protein tahmini, farklı reaktifler ve tahliller kullanılarak gerçekleştirilebilir. Sitozolik veya mitokondriyal proteinlerin miktar tayini, tahlilde kullanılan toplam protein konsantrasyonuna karşı normalleştirilerek gerçekleştirilebilir.
- 0 μg/mL ile 200 μg/mL (0 μg/mL, 0.5 μg/mL, 1 μg/mL, 2.5 μg/mL, 5 μg/mL, 10 μg/mL, 20 μg/mL, 40 μg/mL, 200 μg/mL) arasında sığır serum albümini (BSA) standartlarını ve sadece lizis tamponu ile boşlukları hazırlayın.
- Numuneleri içeren düz tabanlı 96 oyuklu plakaya her standarttan 150 μL ekleyin.
- 25 kısım Mikro BCA Reaktifi MA (bikinkoninik asit (BCA) çözeltisi) ve 24 kısım Reaktif MB (bakır sülfat çözeltisi) ile 1 kısım Reaktif MC (stabilize edici tampon) (25:24:1, Reaktifler MA:MB:MC) karıştırın çalışan bir reaktif oluşturmak için. Her numuneye ve standarda 150 μL karışık BCA reaktifi ekleyin.
- 37 °C'de 2 saat inkübe edin.
- 562 nm'de absorbansı ölçmek için bir plaka okuyucu kullanın ve protein konsantrasyonunu standart eğri ile ölçün. Numune protein konsantrasyonlarını elde etmek için boş standart absorbansı diğer tüm bireysel standartların ve bilinmeyen numune replikasyonlarının absorbans ölçümünden çıkarın.
4. Mitokondriyal preparat kalite kontrolü (western blot)
- Protein miktar tayinini gerçekleştirmek için radyoimmünopresipitasyon test tamponu (RIPA) tamponundaki mitokondriyal peleti yeniden süspanse edin. Mikro BCA testini kullanarak her numune için protein konsantrasyonunu belirleyin.
- Numuneleri numune tamponunda 94 ° C'de5 dakika denatüre edin.
- Moleküler ağırlık işaretleyicisi ile birlikte prekast jellere eşit miktarda (20 μg) mitokondriyal protein yükleyin (Malzeme Tablosuna bakınız).
- Jeli 100 V'ta 50 dakika çalıştırın.
NOT: Çalışma süresi değişebilir, bu nedenle proteinler numune tamponundaki boya ile gösterilen jelin sonuna ulaştığında jeli durdurduğunuzdan emin olun. - 20 V'ta 7 dakika boyunca bir western blot transfer sisteminde kuru transfer protokolünü kullanarak proteinleri jelden bir poliviniliden florür (PVDF) membranına aktarın.
- Membranı çıkarın ve oda sıcaklığında 1 saat boyunca bloke edici solüsyonu (Tablo 1) kullanarak bloke edin.
- 4 oC'de gece boyunca bloke edici tamponda membrana uygun primer antikor dilüsyonları ekleyin (COXIV = 1: 3.000, GAPDH = 1: 3.000).
NOT: Mitokondriyal preparatta nükleer, endoplazmik retikulum (ER) kontaminasyonunun yokluğu, batı lekelerinde lamin (nükleer belirteç) ve ERp57 (ER belirteç) gibi ek belirteçler kullanılarak test edilebilir. - Membranı yıkama tamponu ile 3 x 15 dakika yıkayın (Tablo 1).
- Membranı, HRP konjuge ikincil antikorun uygun seyreltilmesi ile oda sıcaklığında oda sıcaklığında bloke edici tampon içinde inkübe edin
- Membranı yıkama tamponu ile 3 x 15 dakika yıkayın.
- Geliştirme için bir kemilüminesan substrat kiti kullanın.
- Bir jel ve membran görüntüleyici kullanarak membranı tarayın.
5. Mikrogliadan N-glikan ekstraksiyonu için mitokondriyal protein izolasyonu
- İzole edilmiş mitokondriyi 50 μL protein izolasyon tamponunda (Tablo 1) yeniden süspanse edin ve 20 dakika buz üzerinde bırakın.
- Üç kez aspire edin ve dağıtın ve buz üzerinde 20 dakika bırakın (kullanmadan önce girdap). Mitokondriyal pelet tamamen çözünmemişse, 50 μL daha izolasyon tamponu ekleyin ve aynı tüpe toplayın.
- 13.000 × g'da 10 dakika santrifüjleyin.
- Süpernatanı geri kazanın, -80 °C'de en az 1 saat dondurun ve bir vakum yoğunlaştırıcıda mümkün olduğunca kurutun.
- IR-MALDESI için PNGase özet tamponunu (Tablo 1) kullanarak glikan izolasyonundan önce yeniden askıya alın.
6. IR-MALDESI için mitokondriyal N-glikan preparatı
- 25-250 μg protein (maksimum 250 μL hacimde) izole edilmiş mitokondriyal proteinleri 10 kDa'lık bir moleküler ağırlık kesme (MWCO) filtresine yükleyin.
- Filtredeki her numuneye 2 μL 1 M ditiotreitol (DTT) ekleyerek glikan kısımlarını açığa çıkarmak için protein numunelerini azaltın.
- Numuneyi 200 μL PNGase sindirim tamponu ile seyreltin ve filtreyi bozmamak için hafifçe girdaplayın.
- Numuneyi 56 °C'de 30 dakika inkübe ederek mitokondriyal proteinleri denatüre edin.
- Mitokondriyi ~200 mM'lik bir nihai konsantrasyon verecek şekilde alkillemek için 50 μL 1 M iyodoasetamid kullanın ve 37 ° C'de 60 dakika inkübe edin.
- Denatüre mitokondriyal yöntemleri daha da konsantre etmek için, numuneleri 40 dakika boyunca 14.000 × g'da santrifüjleyin. Akışı atın.
- Numuneyi 100 μL PNGase sindirim tamponu ile yıkayın.
- Glikoproteini filtre üzerinde 14.000 × g'da 20 dakika boyunca konsantre edin ve akışı atın. Yıkama ve konsantre adımını 2x, toplam 3x olacak şekilde tekrarlayın ve filtrenin ölü hacminde (~5 μL) bir konsantre elde edin. Tüm akışları atın.
- Yıkama işlemi tamamlandıktan sonra toplama şişesini atın. Gelecekteki tüm eluentler ve yıkamalar için yeni bir toplama şişesi kullanın.
- Glikanları denatüre mitokondriyal glikopatlardan ayırmak için taze bir toplama şişesine aktarın ve filtreye 2 μL gliserol içermeyen PNGase (75.000 birim / mL) ekleyin. 98 μL PNGase digest tamponu ekleyin, toplam hacmi 100 μL'ye getirin ve filtre üzerinde yukarı ve aşağı hafifçe pipetleyerek karıştırın.
- Mitokondriyal proteinlerden tüm N-glikanları enzimatik olarak parçalamak için numuneleri 37 ° C'de 18 saat inkübe edin.
- Numuneyi 20 ° C'de 20 dakika boyunca 14.000 × g'da santrifüjleyerek salınan mitokondriyal N-glikanları elute edin.
- Filtreye 100 μL PNGase sindirim tamponu ekleyerek mitokondriyal glikanları yıkayın ve 20 °C'de 20 dakika boyunca 14.000 × g'da santrifüjleyin. Kalan N-glikanları içeren yıkamayı, eluent ile aynı toplama şişesinde toplayın. 2x tekrarlayın ve filtreyi toplama şişesinden çıkarın.
- Mitokondriyal glikan örneklerini -80 °C dondurucuda donana kadar (30-60 dakika) inkübe edin ve bir vakum yoğunlaştırıcıda (400 μL için 4-6 saat) oda sıcaklığında tamamlanana kadar kurutun.
NOT: N-glikanlar, analizden önce 6 aya kadar -20 ° C'de saklanabilir. - Kurutulmuş N-bağlı glikanları IR-MALDESI analizinden hemen önce 50 μL LC / MS dereceli suda yeniden süspanse edin.
7. IR-MALDESI kütle spektrometresi ile salınan glikanların tespiti
- Deneyin her günü kütle kalibrasyonu yapın. Kalibrasyon solüsyonunu bir şırınga pompasına yükleyin ve 1,2 μL/dk hızında itin. Hem pozitif hem de negatif modlarda kütle kalibrasyonu için kararlı bir elektrosprey bulutu elde etmek için 3,5 kV'luk bir voltaj uygulayın.
- 5 μL yeniden süspanse edilmiş mitokondriyal glikanları bir Teflon mikrokuyu slaytı üzerindeki bir numune noktasına pipetleyin.
- Patlama başına 1,8 mJ enerji ile ablasyon için 2,97 μm dalga boyunda çalışan bir orta IR lazer kullanın.
- Negatif iyonizasyon modunda N-glikanları iyonize edin ve tespit edin. 3,2 kV voltajda 2 μL/dk akış hızına sahip stabil bir elektrosprey tüyü oluşturmak için %60 asetonitril ve 1 mM asetik asitten oluşan elektrosprey solvent kullanın.
- Analizi gerçekleştirmek için, IR-MALDESI'yi m/z 200'de 240.000FWHM'lik bir kütle çözme gücüne ayarlanmış bir HRAM kütle spektrometresine bağlayın ve negatif iyonizasyon modunda 500 ila 2.000 m/z arasında analiz edin.
- Otomatik kazanç kontrolünü (AGC) kapatın ve 90 ms'lik sabit bir enjeksiyon süresi ayarlayın. Yüksek kütle ölçüm doğruluğu (MMA) elde etmek için her spektrumun gerçek zamanlı dahili kalibrasyonu için EasyIC kaynağını kullanın.
8. Mitokondriyal N-glikan veri analizi
- Minimum iyon akısı eşiği 1.000 iyon/s olan çift ve üç yüklü iyonları belirlemek için monoizotopik kütleleri arayarak ve izotopik dağılımları onaylayarak N'ye bağlı glikanları manuel olarak tanımlayın.
- Ham kütle spektrumlarını m/z oranlarından nötr monoizotopik kütlelere dönüştürün.
- Potansiyel glikan bileşimlerini belirlemek için monoizotopik kütleleri çevrimiçi bir oligosakkarit yapı tahmin aracına yükleyin. Deneysel olarak seçilmiş bir glikomik veritabanı20 kullanarak ek açıklamaları onaylayın; her tanımlamanın 2,5 ppm MMA marjı içinde olduğundan, çekirdek N-bağlı glikan yapısını (Hex3HexNAc2) içerdiğinden ve pentoz, KDN veya HexA monosakkaritlerini hariç tuttuğundan emin olun.
- SNFG isimlendirme21'i kullanarak onaylanmış glikan yapılarını çizin.
- Ham kütle spektrumlarından glikanların nispi bolluğunu elde edin ve iyonlar/s/μg elde etmek için μg cinsinden mitokondriyal protein miktarına karşı normalleştirin.
- Klor eklentilerinin sayısını belirlemek için N-bağlı glikanların teorik ve deneysel dağılımları arasındaki uyumun iyiliğini test etmek için Ki-kare analizini kullanın. Bu, sialik asitlerin19 sayısının doğrudan belirlenmesine izin verir.
Sonuçlar
Şekil 1, kütle spektrometrik glikan analizi için BV2 mikroglial hücre hattından mitokondrinin izolasyonunda yer alan adımların şematik bir taslağını temsil etmektedir. Mikroglial hücrelerin aynı başlangıç yoğunluğundan farklı mitokondriyal preparatlar arasındaki mitokondriyal protein izolasyonunun tekrarlanabilirliği, mikro BCA testi kullanılarak tahmin edilen mitokondriyal protein konsantrasyonu arasında önemli bir fark göstermeyen Şekil 2'de temsil edilmektedir.
Şekil 3, COX IV ve GAPDH'nin western blot analizini kullanarak mitokondriyal izolasyonların saflığını temsil etmektedir. Burada, protokolde kullanılan reaktif bazlı izolasyonun son adımında izole edilen mitokondriyal fraksiyonda mitokondriyal protein COX IV'ün ekspresyonunu görüyoruz. İmmünoblotlar, izole edilmiş mitokondriyal fraksiyonda belirgin bir COX IV bandı gösterirken, GAPDH sadece aynı maruziyette sitoplazmik fraksiyonda tespit edilir. Daha uzun maruz kalma süreleri, zayıf bir GAPDH bandının algılanmasına neden olabilir. Mitokondriyal olmayan belirteç GAPDH'nin ekspresyonu, mitokondrinin izolasyonundan sonra, CoxIV bantları olmadan tüm hücre lizatında belirgindir, bu da mitokondriyal fraksiyonun tam bir izolasyonunu ve minimum mitokondriyal olmayan kontaminasyonu gösterir. Mitokondriyal fraksiyonlardaki COX IV ekspresyonu, 2 × 107 hücreli benzer başlangıç hücre yoğunluğuna sahip farklı preparatlar arasında tutarlıdır.
Şekil 4'te IR-MALDESI kullanılarak tespit edilen salınan salınan N-glikanların temsili kütle spektrumları, PNGase tedavisi kullanılarak mitokondriyal protein ekstraktından salınan birkaç fosforillenmiş, sülfatlanmış ve sialile yüklü N-glikan'ın varlığını göstermektedir. Tablo 2, tüm spektrumlarda tanımlanan ancak GlyConnect'te bildirilmeyen tüm glikan bileşimlerini bildirmektedir. Bir uyum iyiliğini test eden ki-kare değerleri, bir ve iki klor eklentisi ile N-bağlı glikanların tespitini doğrular ve Şekil 5'te IR-MALDESI kullanılarak bu glikan bileşimlerinin tespitini doğrular.
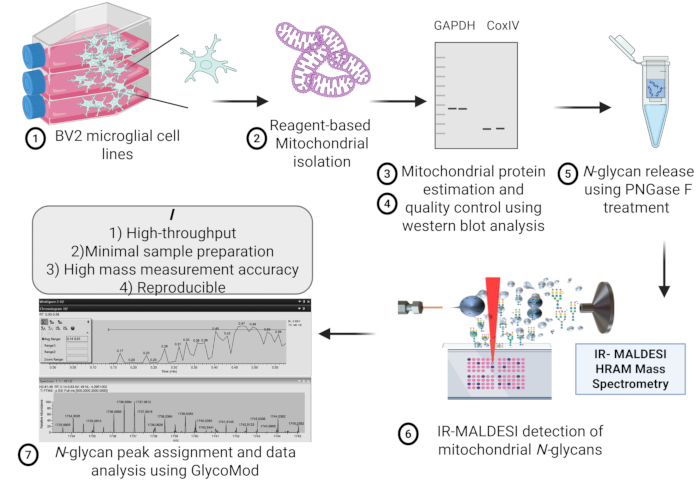
Şekil 1: Protokol taslağı. Mitokondriyal N-glikanların yüksek verimli tespiti için BV2 mikroglial hücre hattından IR-MALDESI HRAM kütle spektrometresi kullanılarak mitokondriyal izolasyon, kalite kontrol, protein ekstraksiyonu, N-glikan salınımı ve tahmininin şematik taslağı. Kısaltma: IR-MALDESI HRAM = Kızılötesi Matris Destekli Lazer Desorpsiyon Elektrosprey İyonizasyon Yüksek Çözünürlüklü Doğru Kütle Analiz Cihazı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: BV2 hücrelerinden mitokondriyal protein izolasyonu. (A) Farklı BSA konsantrasyonları kullanan mikro BCA testi için standart eğri. (B) Altı bağımsız mitokondriyal preparatta 2 × 107 hücreden tutarlı protein içeriği ile temsil edilen mitokondriyal protein izolasyonunun tekrarlanabilirliği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Mitokondriyal preparatın saflığı. Sitoplazmik fraksiyon için temsili western blot ve BV2 mikroglial hücrelerden izole edilmiş mitokondri. Şekil, sitoplazmik fraksiyonun ve izole edilmiş mitokondrinin COX IV antikoru (mitokondriyal markör) ve GAPDH antikoru (sitoplazmik kontrol) ile immünoblotlanmasını temsil eder. İzole edilmiş mitokondride GAPDH bantlarının olmaması, minimum çapraz kontaminasyonu ve sonraki N-glikan analizi için mitokondriyal preparatın saflığını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: IR-MALDESI HRAM kütle spektrometresi kullanılarak mitokondriyal N-glikan tanımlama bileşimi tayini. 1.700-2.000 m/z aralığındaki glikan kütle spektrumları, Glycomod kullanılarak belirlenen açıklamalı yapılarla önemli sayıda çoklu yüklü tepe noktası gösterir. Kısaltma: IR-MALDESI HRAM = Kızılötesi Matris Destekli Lazer Desorpsiyon Elektrosprey İyonizasyon Yüksek Çözünürlüklü Doğru Kütle Analiz Cihazı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Tespit edilen mitokondriyal N-glikanların doğrulanması. Dört (AD) mitokondriyal N-bağlı glikan için temsili izotopik dağılımlar, klor ve protondan arındırılmış eklentilerin teorik dağılımları ile gözlemlenen dağılımın bir kaplamasını gösterir. Üst üste binen spektrumlardaki ki-kare değerleri, uyumun iyiliğini temsil eder ve bir ve iki klor eklentisi ile N-bağlı glikanların tespitini doğrular. Bu, IR-MALDESI kullanılarak bu glikan bileşimlerinin tespitinin daha fazla doğrulanmasıdır. Kısaltma: IR-MALDESI = Kızılötesi Matris Destekli Lazer Desorpsiyon Elektrosprey İyonizasyonu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: Protokolde kullanılan çözelti ve tampon reçeteleri. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 2: Glycomod'da yüksek kütle ölçüm doğruluğu ile mitokondride tespit edilen M ultiply yüklü protondan arındırılmış N-bağlı Glikanlar. Glikan kısa el gösterimi: H = heksoz; N = N-asetilglukozamin; F = fukoz; S = N-asetilnöraminik asit; Fos = fosfat; Kükürt = sülfat modifikasyonu. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Mikroglia, beynin yerleşik bağışıklık hücreleridir ve glikan modifikasyonları, mikroglia'nın immünofenotipini ve işlevini modüle eder. Bu bağışıklık fonksiyonları, ağırlıklı olarak mitokondri tarafından sağlanan önemli hücresel enerji gerektirir. Özellikle, mitokondriyal proteinler ayrıca, hücre altı glikozilasyonun araştırılmasındaki teknolojik zorluklar nedeniyle önemli ölçüde az çalışılmış olan glikan modifikasyonları da sunar. Mitokondriyal glikozilasyonu araştıran çoğu çalışma, glikan paternlerinin22 lektin bazlı tanımlamasına dayanır, ancak bu yaklaşımlar lektinlerin zayıf bağlanma özgüllüğü ile sınırlıdır. Bu çalışmada sunulan teknik yaklaşımın temel ilerlemeleri, i) mitokondriyal N-glikanların mikroglial hücrelerden tekrarlanabilir izolasyonu ve ii) IR-MALDESI HRAM kütle spektrometresi kullanılarak mitokondriyal N-glikanların tespiti ve tanımlanmasıdır. Burada açıklanan iş akışı, mikroglial hücrelerde fizyolojik seviyelerde eksprese edilen mitokondriyal glikoproteinlerden salınan N-glikanların tespitinin ilk raporudur.
Mevcut protokolde, reaktif bazlı izolasyon yöntemi kullanılarak mitokondriyal izolasyon maksimize edilmiştir. Bu, mitokondriyal verimi artırmak için Dounce homojenizasyon yöntemi ile birleştirilebilir. Reaktif bazlı izolasyona kıyasla homojenizatör kullanmanın bir dezavantajı, operatörler arasındaki havaneli kuvvet ve hızındaki değişikliktir, bu da deneysel varyasyonun artmasına ve tekrarlanabilirliğin azalmasına neden olur. Önceki çalışmalar23,24, bu yöntemin kullanıldığını ve mitokondriyal fraksiyonda nükleer (lamin, histon H3) ve ER belirteçlerinin (calnexin, Erp57) bulunmadığını göstermiştir, bu da mitokondriyal fraksiyonun saflığını gösterir. Protokolün potansiyel bir sınırlaması, mitokondri izolasyonu için bir başlangıç materyali olarak 20 milyon hücrenin gerekliliğidir. Bununla birlikte, çalışmamızda gözlenen yüksek mitokondriyal protein konsantrasyonu, önceki çalışmalarda25,26 (25-250 μg protein) yapılan optimizasyona dayalı olarak mitokondriyal izolasyon için ilk mikroglial hücre sayısının on kat azaltılmasına izin verir. Ayrıca, mitokondriyal izolasyon için daha yüksek hücre sayıları elde etmek için biyolojik örneklerin bir araya getirilmesi, verimli glikan tespiti için dokular gibi birincil kaynaklardan daha düşük hücre sayılarına sınırlı protokol ölçeklenebilirliği durumunda gerçekleştirilebilir. Ek olarak, glikan salınım adımı bu protokolde kritik öneme sahiptir. N-glikosidaz F (PNGase F), en içteki N-asetilglukozamin (GlcNAc) ile asparagin kalıntısı27 arasındaki amid bağını hidrolize ederek tam ve bozulmamış N-bağlı glikanları serbest bırakmak için kullanılır. N-glikan analizi için, mitokondriyal proteinlerin tam de-glikosilasyonunu elde etmek için PNGase F'nin aktivitesini optimize etmek kritik öneme sahiptir. Solvent maruziyeti ve fazla enzim kullanılarak protein denatürasyonu, N-glikanların mitokondriyal proteinlerden verimli ve tam bölünmesini ve salınmasını sağlamaya yardımcı olur. PNGase F reaksiyonunu26 tamamlayarak N-glikan salınımı için 18-20 saatlik bir sindirim süresi en uygunudur.
Bu protokolün potansiyel bir sınırlaması, bu yöntemde glikoproteinler için mitokondriyal ekstraktın zenginleştirilmemesidir. Düşük bolluktaki glikoproteinler analizde tespit edilemeyebilirken, bu yöntem lektin afinitesi saflaştırması veya kimyasal zenginleştirmeden kaynaklanan hata ve yanlılığı en aza indirir. IR-MALDESI, tanımlanan glikanların bileşiminin yüksek güvenilirlikli bir şekilde tanımlanmasını sağlarken, glikan kalıntıları arasındaki bağlantılar hakkında kesin bilgiler, çapraz halka bölünmelerini28 veya ekzoglikozidaz sindirimlerini geliştirmek için lityum addükte glikanların tandem kütle spektrometresi kullanılarak daha fazla araştırma yapılmasını gerektirir. Alternatif olarak, LC-MS/MS, daha yapısal ayrıntılarla daha derin glikan kapsamı sağlayabilen IR-MALDESI yaklaşımına ek olarak veya alternatif olarak kullanılabilir. Bununla birlikte, önceki çalışmalar, metabolitler için IR-MALDESI'den elde edilen ortalama iyon bolluğu ile LC-MS/MS29 tarafından belirlenen mutlak miktarlar arasındaki korelasyonu göstermiş ve IR-MALDESI kullanılarak metabolitlerin doğrudan kantitasyonu için bir temel oluşturmuştur. IR-MALDESI'nin yüksek verimli doğası ve MS2 analizi gerçekleştirme yeteneği ile yüksek güvenilirlikli yapısal doğrulama, potansiyel glikan biyobelirteçleri ve hastalık teşhisi için klinik öncesi ve klinik örneklerin hızlı bir şekilde taranması için etkilidir. Ek olarak, nükleer sonrası süpernatantın 12.000 × g yerine 3000 × g'da santrifüjlenmesinin peroksizomal ve lizozomal kirleticileri en aza indirmesine rağmen, mitokondriyal preparatta hala bu proteinlerin izleri olabileceğine dikkat edilmelidir.
Sonuç olarak, bu çalışma, mikroglial hücrelerde mitokondriyal glisin analizi için minimum numune hazırlığı ve nörodejeneratif hastalıklar için yeni glikan bazlı terapötik hedeflerin belirlenmesinde büyük uygulama potansiyeli ile basit, yüksek verimli bir yöntem sunmaktadır. Bu protokol, mikrogliadan mitokondriyal izolasyon için analitik yöntemlerin kapsamlı bir değerlendirmesini ve standardizasyonunu ve ardından büyük ölçekli preklinik ve klinik çalışmalar için ölçek büyütmeyi mümkün kılmak için mitokondriyal glisin analizini sunar. Bu protokol, N-glikan izolasyonu ve tespiti için çeşitli avantajlar sunar: i) reaktif bazlı protokol için mitokondriyal izolasyon süresi düşüktür (≤40 dakika); ii) glikan salınımı için proteinlerin verimi yüksektir; iii) N-glikan analizi için hazırlanan aynı mitokondriyal numuneler, proteomik analiz, lektin analizi ve mitokondriyal akış analizi gibi diğer moleküler biyolojik araştırmalar için kullanılabilir; ve iv) IR-MALDESI HRAM kütle spektrometresi, sialoglikanlar ve sülfoglikanlar30 gibi yüklü glikanların kimyasal türevlendirilmesine gerek kalmadan hibrit ve yumuşak iyonizasyon stratejisi28 nedeniyle N-glikanların hızlı ve gelişmiş bir şekilde tespit edilmesini sağlar.
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Yazarlar, NCSU'daki Muddiman Laboratuvarı'nda yüksek lisans öğrencisi olan Seth Eisenberg'e kütle spektrometrik protokolünün video kaydına yardımcı olduğu için teşekkür eder. Bu araştırma kısmen, Birmingham'daki Alabama Üniversitesi'ndeki Mühendislik Okulu İnovasyon Üyeleri Programı tarafından desteklenmiştir, AG068309 D.J.T.'ye ve R01GM087964-12'den DCM'ye kadar. Bu el yazmasındaki şemalar BioRender kullanılarak çizilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Amersham 600 imager | Cytvia | 29194217 | Gel and membrane imager |
| Countess 3 automated cell counter | Fisher Scientific | X003SZ1LY9 | |
| Dry Bath Stdrd 4 blck 100-120V | Thermofisher scientific | 88870003 | |
| i-Blot2 Gel Transfer Device | Invitrogen | IB21001 | Western blot transfer system |
| Inverted microscope | Cell Treat | 04355223EA | |
| Microplate reader | 82050-760 | ||
| Mini gel tank | Invitrogen | A25977 | |
| Open Air Rocker | Fisher Brand | 88861025 | |
| Pipet boy | BioTek | 229310 | |
| Vortex mixer | Integra- VWR | ||
| Mitochondria isolation reagents | |||
| Mitochondrial Isolation kit | Thermofisher scientific | 89874 | |
| Phosphotase Inhibitor | Thermofisher scientific | 1861274 | |
| Protease Inhibitor | Thermofisher scientific | 1861281 | |
| N-glycan isolation and IR-MALDESI reagents | |||
| Acetic acid | Fisher Scientific | A11350 | 50% in ESI solvent |
| Acetonitrile | Sigma Aldrich | 34851-4L | 1 mM in ESI solvent |
| Ammonium bicarbonate | Fisher Scientific | A643500 | 100 mM |
| Calibration Solution | Thermofisher Scientific | A39239 | Pierce FlexMix |
| Dithiothreitol | Sigma Aldrich | AC426380100 | 1 M |
| Iodoacetamide | Sigma Aldrich | A322-10VL | |
| LC/MS grade water | Thermofisher Scientific | 047146.M6 | |
| PNGase F | Bulldog Bio | NZPP010 | 75000 U/mL, enzyme for N-glycan release |
| N-glycan isolation and IR-MALDESI consumables | |||
| Amicon centrifugal filters | Fisher Scientific | UFC501024 | 10 kDa MWCO |
| Mass spectrometer | Orbitrap Exploris 240 | ||
| Mid-IR Laser | JGM Associates, Burlington, MA, USA | ||
| Teflon microwell slide | Prosolia, Indianapolis, IN, USA | ||
| N-glycan analysis softwares | |||
| GlycoMod | Expasy | https://web.expasy.org/glycomod/ | |
| GlyConnect | Expasy | https://glyconnect.expasy.org/ | |
| Protein isolation and western blot consumables | |||
| Basix gel loading tips ( 10 µL) | Basix | 13-611-102 | |
| Basix gel loading tips ( 200 µL) | Basix | 13-611-116 | |
| Cell scrapper | VWR labs | 14-388-100 | |
| i-Blot NC regular stacks | Invitrogen | IB23001 | |
| i-Blot2 PVDF Regular Stacks | Invitrogen | IB24001 | |
| 10 µL micropipette | Fisher Scientific | FBE00010 | |
| 20 µL micropipette | Invitrogen | FBE00020 | |
| 200 µL micropipette | Fisher Brand | FBE00200 | |
| 1000 µL micropipette | Fisher brand | FBE01000 | |
| 10 µL pipet tips | VWR labs | 76322-528 | |
| 20 µL pipet tips | VWR labs | 76322-134 | |
| 200 µL pipet tips | VWR labs | 76322-150 | |
| 1000 µL pipet tips | VWR labs | 76322-154 | |
| Well plate | Fisher brand | 14-388-100 | |
| Protein isolation and western blot reagents | |||
| Actin antibody ( Host : Rabbit ) | Cell Signaling Technologies | 8457T | |
| Anti-Rabbit IgG HRP Linked | Cell Signaling Technologies | 7074S | |
| Bolt 4-12% Bis-Tris Plus | Invitrogen | NW04120BOX | |
| Bovine Serum Albumin | Fisher bioreagents | BP9700-100 | |
| COXIV antibody ( Host : Rabbit) | Cell Signaling Technologies | 4844S | |
| GAPDH antibody ( Host : Rabbit) | Cell Signaling Technologies | 2118S | |
| MicroBCA protein assay Kit | Thermofisher scientific | 23235 | |
| Nupage MOPS SDS Runing Buffer [20x] | Thermofisher scientific | NP0001 | |
| PAGE Ruler prestained protein ladder | Thermofisher scientific | 815-968-0747 | Dilution= Use 7 µL to load onto first well |
| Phosphate buffered saline | Aniara Diagnostics | A12-9423-5 | Prepare 1x PBS from 10x powder |
| Pierce ECL Western Blotting Substrate | Thermofisher scientific | 32106 | Chemiluminescent substrate kit |
| RIPA Buffer | Thermofisher scientific | 89901 | |
| Sample Buffer | Novex | B0007 | The bolt LDS sample buffer is prepared in 3:1 ratio of sample to sample buffer |
| Tween-20 | MP Biomedicals | TWEEN201 | |
| Tissue culture consumables | |||
| Countess Slides | Avantor | 229411 | |
| Eppendorf tubes | Cell Treat | 414004-265612-5884 | |
| 2 mL aspirating pipet | Vista lab | 5090-0010E | |
| 5 mL serological pipet | Fisher Scientific | 13-678-11D | |
| 10 mL serological pipet | Basix | 13-678-11E | |
| 25 mL serological pipet | Vista lab | FB012937 | |
| 50 mL serological pipet | Vista lab | 14955233 | |
| 15 mL Conical tube | Avantor | 229225A | |
| 50 mL conical tube | Cell treat | 4190-0050 | |
| T-75 cm2 Tissue culture flask | Fisher Scientific | FB012937 | |
| T-180 cm2 Tissue culture flask | Fisher Scientific | FB012939 | |
| Tissue culture reagents | |||
| BV2 microglial cell line | Creative Bioarray | CSC-I2227Z | Immortalized Mouse Microglia (BV2) derived from C57/BL6 neonatal microglia |
| Cell dissociation enzymes | Thermofisher scientific | 12563029 | TrypLE |
| Dulbecco's Modified Eagle Medium (DMEM) Low Glucose Media | Gibco | 10567014 | |
| Fetal Bovine Serum | Cytiva | SH30071.03HI | |
| Minimum Essential Medium (MEM) Non-essential Amino Acids | Gibco | 11140050 | |
| Penicillium Streptomycin | Cytivia | SV30010 | |
| Phosphate buffer saline | Corning | 21-040-CV | |
| Trypan Blue stain 0.4% | Invitrogen | T10282 |
Referanslar
- Dos Santos, S. E., et al. Similar microglial cell densities across brain structures and mammalian species: Implications for brain tissue function. J Neurosci. 40 (24), 4622-4643 (2020).
- Shao, F., Wang, X., Wu, H., Wu, Q., Zhang, J. Microglia and neuroinflammation: Crucial pathological mechanisms in traumatic brain injury-induced neurodegeneration. Front Aging Neurosci. 14, 825086(2022).
- Arcuri, C., Mecca, C., Bianchi, R., Giambanco, I., Donato, R. The pathophysiological role of microglia in dynamic surveillance, phagocytosis and structural remodeling of the developing cns. Front Mol Neurosci. 10, 191(2017).
- Cheng, J., et al. Early glycolytic reprogramming controls microglial inflammatory activation. J Neuroinflammation. 18 (1), 129(2021).
- Cătălin, B., Cupido, A., Iancău, M., Albu, C. V., Kirchhoff, F. Microglia: First responders in the central nervous system. Rom J Morphol Embryol. 54 (3), 467-472 (2013).
- Cai, Y., Liu, J., Wang, B., Sun, M., Yang, H. Microglia in the neuroinflammatory pathogenesis of alzheimer's disease and related therapeutic targets. Front Immunol. 13, 856376(2022).
- Hickman, S., Izzy, S., Sen, P., Morsett, L., El Khoury, J. Microglia in neurodegeneration. Nat Neurosci. 21 (10), 1359-1369 (2018).
- Norat, P., et al. Mitochondrial dysfunction in neurological disorders: Exploring mitochondrial transplantation. NPJ Regen Med. 5 (1), 22(2020).
- Picca, A., et al. Age-associated glia remodeling and mitochondrial dysfunction in neurodegeneration: Antioxidant supplementation as a possible intervention. Nutrients. 14 (12), 2406(2022).
- Mcavoy, K., Kawamata, H. Glial mitochondrial function and dysfunction in health and neurodegeneration. Mol Cell Neurosci. 101, 103417(2019).
- Fairley, L. H., Wong, J. H., Barron, A. M. Mitochondrial regulation of microglial immunometabolism in alzheimer's disease. Front Immunol. 12, 624538(2021).
- Starossom, S. C., et al. Galectin-1 deactivates classically activated microglia and protects from inflammation-induced neurodegeneration. Immunity. 37 (2), 249-263 (2012).
- Puigdellívol, M., Allendorf, D. H., Brown, G. C. Sialylation and galectin-3 in microglia-mediated neuroinflammation and neurodegeneration. Front Cell Neurosci. 14, 162(2020).
- Gerlach, J. Q., Kilcoyne, M., Eaton, S., Bhavanandan, V., Joshi, L. Non-carbohydrate-mediated interaction of lectins with plant proteins. Adv Exp Med Biol. 705, 257-269 (2011).
- Cummings, R. D., Pierce, J. M. The challenge and promise of glycomics. Chem Biol. 21 (1), 1-15 (2014).
- Robichaud, G., Barry, J. A., Muddiman, D. C. IR-MALDESI mass spectrometry imaging of biological tissue sections using ice as a matrix. J Am Soc Mass Spectrom. 25 (3), 319-328 (2014).
- Barry, J. A., Groseclose, M. R., Robichaud, G., Castellino, S., Muddiman, D. C. Assessing drug and metabolite detection in liver tissue by uv-maldi and ir-maldesi mass spectrometry imaging coupled to ft-icr ms. Int J Mass Spectrom. 377, 448-155 (2015).
- Pace, C. L., Muddiman, D. C. Direct analysis of native N-linked glycans by IR-MALDESI. J Am Soc Mass Spectrom. 31 (8), 1759-1762 (2020).
- Palomino, T. V., Muddiman, D. C. Predicting sialic acid content of N-linked glycans using the isotopic pattern of chlorine. J Am Soc Mass Spectrom. 34 (7), 1392-1399 (2023).
- Mariethoz, J., et al. Glycomics@expasy: Bridging the gap. Mol Cell Proteomics. 17 (11), 2164-2176 (2018).
- Varki, A., et al. Symbol nomenclature for graphical representations of glycans. Glycobiology. 25 (12), 1323-1324 (2015).
- Yu, H., et al. Comparison of the glycopattern alterations of mitochondrial proteins in cerebral cortex between rat alzheimer's disease and the cerebral ischemia model. Sci Rep. 7 (1), 39948(2017).
- Dixit, B., Vanhoozer, S., Anti, N. A., O'Connor, M. S., Boominathan, A. Rapid enrichment of mitochondria from mammalian cell cultures using digitonin. MethodsX. 8, 101197(2021).
- Kalathil, A. A., et al. New pathway for cisplatin prodrug to utilize metabolic substrate to overcome cancer intrinsic resistance. central science. 9, 1297-1312 (2023).
- Hecht, E. S., McCord, J. P., Muddiman, D. C. Definitive screening design optimization of mass spectrometry parameters for sensitive comparison of filter and solid phase extraction purified, inlight plasma N-glycans. Anal Chem. 87 (14), 7305-7312 (2015).
- Hecht, E. S., McCord, J. P., Muddiman, D. C. A quantitative glycomics and proteomics combined purification strategy. J Vis Exp. (109), e53735(2016).
- Fischler, D. A., Orlando, R. N-linked glycan release efficiency: A quantitative comparison between NaOCl and PNGase F release protocols. J Biomol Tech. 30 (4), 58-63 (2019).
- Tu, A., Muddiman, D. C. Internal energy deposition in infrared matrix-assisted laser desorption electrospray ionization with and without the use of ice as a matrix. J Am Soc Mass Spectrom. 30 (11), 2380-2391 (2019).
- Barry, J. A., et al. Mapping antiretroviral drugs in tissue by IR-MALDESI MSI coupled to the Q exactive and comparison with LC-MS/MS SRM assay. J Am Soc Mass Spectrom. 25 (12), 2038-2047 (2014).
- Samal, J., Palomino, T. V., Chen, J., Muddiman, D. C., Segura, T. Enhanced detection of charged N-glycans in the brain by infrared matrix-assisted laser desorption electrospray ionization mass spectrometric imaging. Anal Chem. 95 (29), 10913-10920 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır