Method Article
Митохондриальный препарат из микроглии для анализа гликанов
В этой статье
Резюме
Разработан протокол подготовки очищенных митохондрий из клеток микроглии, выделения митохондриальных белков для высвобождения N-гликанов и быстрого детектирования субклеточных митохондриальных гликанов с помощью лазерной десорбционной ионизации с помощью инфракрасной матрицы в сочетании с точной масс-спектрометрией масс-анализатора высокого разрешения.
Аннотация
Понимание закономерностей гликозилирования митохондриальных белков в микроглии имеет решающее значение для определения их роли в нейродегенеративных заболеваниях. В данной работе мы представляем новую и высокопроизводительную методологию гликомического анализа митохондриальных белков, выделенных из культивируемой микроглии. Этот метод включает в себя выделение митохондрий из культур микроглии, оценку качества образцов митохондрий с последующей оптимизированной экстракцией белка для максимального обнаружения гликана и масс-спектрометрию высокого разрешения (HRAM) с помощью лазерной десорбции электроспрея с помощью инфракрасной матрицы (IR-MALDESI) для получения подробных профилей митохондриального гликозилирования.
Этот протокол подчеркивает важность поддержания целостности митохондрий во время выделения и использует строгий контроль качества для обеспечения воспроизводимости, включая измерение чистоты митохондрий после экстракции. Этот подход позволяет всесторонне профилировать изменения гликозилирования в микроглиальных митохондриях в различных экспериментальных условиях in vitro, что дает представление о митохондриальных изменениях, связанных с нейродегенеративными заболеваниями. Этот подход может быть адаптирован к другим методам лечения in vitro , другим типам культивируемых клеток или первичным клеткам. С помощью этого стандартизированного подхода мы стремимся улучшить понимание микроглиальных митохондриальных гликанов, внося свой вклад в более широкую область нейродегенеративных исследований.
Введение
Микроглия является доминирующей резидентной клеткой врожденного иммунитета в головном мозге и составляет 10-15%клеток мозга взрослого человека1,2. Они используют свой рецепторный репертуар для динамического мониторинга микроокружения мозга и регуляции нормальной функции мозга для поддержания гомеостазамозга. Микроглия очень чувствительна к изменениям в микроокружении и претерпевает изменения морфологии клеток, иммунофенотипа и функции при патологических состояниях или различных стимуляциях. На состояния активации микроглии влияют потребности клеток в энергии, необходимые для их функционирования, такие как фагоцитоз, выработка цитокинов или восстановление тканей. Таким образом, клеточный энергетический метаболизм играет решающую роль в регулировании изменений функции микроглии4. Нарушение регуляции микроглии приводит к чрезмерному высвобождению провоспалительных цитокинов (например, IL-1β, TNF-α) и активных форм кислорода (АФК), предрасполагая мозг к нейровоспалению 5,6. Хроническая дисрегуляция микроглии и возникающая в результате нейровоспалительная среда закладывают основу для нейродегенерации7.
На мозг приходится всего 2% массы тела, но 20% от общего потребления энергии организмом. Митохондрии являются основным источником энергии в клетках мозга и выступают в качестве ключевых игроков в патогенезе как острых, так и хронических заболеваний мозга8. Предыдущие исследования установили сильную корреляцию между активацией микроглии и метаболической дисфункцией в возрасте9 лет и возрастными расстройствами, такими как болезнь Альцгеймера10,11, подчеркивая ключевую роль митохондрий в клеточном старении и нейродегенерации. Нарушение функции митохондрий приводит к снижению выработки энергии, повышенному окислительному стрессу и усилению нейровоспаления при старении и возрастных заболеваниях.
В то время как обширные исследования прояснили роль митохондрий в энергетическом обмене, старении и расстройствах мозга, роль общих посттрансляционных модификаций, таких как гликозилирование, в биологии и функции митохондрий остается недостаточно изученной. Гликозилирование, ферментативное добавление сахарных фрагментов, называемых гликанами, к белкам с помощью ферментов гликозилирования, является наиболее распространенной посттрансляционной модификацией в большинстве клеток мозга, включая микроглию. Активированные микроглии модулируют свою иммунную функцию под действием воспалительных стимулов, регулируя внутриклеточную или поверхностную экспрессию гликанов12. Про- и противовоспалительные реакции, проявляемые микроглией после стимуляции, также регулируются гликанами13. Митохондриальные белки также имеют эти модификации гликанов, которые регулируют их функцию и локализацию. Тем не менее, детальный анализ специфичных для клеток паттернов митохондриального гликозилирования в микроглии отсутствует из-за технических сложностей в исследовании субклеточного гликозилирования. Несмотря на хорошо описанную роль гликозилирования в модуляции фенотипа микроглии, роль гликанов в модуляции митохондриальной функции и, следовательно, клеточного иммунофенотипа в микроглии остается плохо изученной.
Ограниченные исследования, изучающие гликозилирование митохондриальных белков, были сосредоточены в основном на идентификации паттернов гликозилирования на основе лектина. Лектины представляют собой гликан-связывающие белки, связывающие биомолекулярные гликановые фрагменты14,15, которым не хватает специфичности и способности предоставлять подробную информацию о составе гликанов. Масс-спектрометрические методы обеспечивают детальную идентификацию составов гликанов для решения аналитических проблем, возникающих при лектиновом анализе. Один из таких методов, инфракрасная матричная лазерная десорбционная электрораспыляемая ионизация (IR-MALDESI), использует гибридную стратегию ионизации, используя лазер среднего инфракрасного диапазона для резонансного возбуждения воды, обнаруженной в биологических образцах16, для десорбции нейтральных веществ и воздействия на них ортогонального шлейфа электрораспыления с последующим анализом с использованием точного масс-спектрометра Orbitrap с высоким разрешением. Ранее было продемонстрировано применение IR-MALDESI для прямого анализа тканевых метаболитов17 с явными преимуществами экспресс-анализа18, метода мягкой ионизации и предсказуемости содержания сиаловых кислот в N-связанных гликанах на основе изотопных схем распределения хлорированных гликанов19. Тем не менее, адаптация этой платформы для прямого анализа субклеточных гликанов не была продемонстрирована.
В данной работе мы сообщаем о высокопроизводительном протоколе для выделения митохондрий из клеток микроглии, выделения митохондриальных N-гликанов, а также обнаружения и анализа митохондриальных N-гликанов с помощью масс-спектрометрии IR-MALDESI. Этот протокол будет иметь основополагающее значение для раскрытия новых идей о роли гликозилирования в функции митохондрий, потенциально выявляя новые терапевтические мишени для нейровоспалительных и нейродегенеративных заболеваний.
протокол
1. Культура микроглиальной клеточной линии BV2
- Поддерживайте клетки BV-2 (микроглиальные клетки, полученные от мышей C57BL/6) в среде DMEM с низким содержанием глюкозы с добавлением 10% фетальной сыворотки крупного рогатого скота (FBS), 1% Penicillium-Streptomycin (PenStrep) и 1% заменимых аминокислот (NEAA).
- Выращивайте клетки в колбах Т-175 и дайте им достичь 70-80% конфлюенции.
- Расщепляют клетки путем инкубации с ферментами диссоциации клеток в течение 5 мин при 37 °C в 5%CO2 с последующей инактивацией ферментов с равным объемом клеточной среды и центрифугированием клеток в течение 5 мин при 500 × г при комнатной температуре (RT).
Используемые здесь ферменты диссоциации клеток более щадящие по отношению к клеткам BV2, чем трипсин, и могут использоваться для защиты экспрессии антигена на клеточной поверхности. - Отсадите среду, ресуспендируйте клеточную гранулу в 1 мл питательной среды и подсчитайте клетки с помощью трипанового синего (см. Таблицу материалов).
ПРИМЕЧАНИЕ: На этом шаге для подсчета ячеек мы использовали автоматический счетчик ячеек. - Чтобы провести митохондриальную изоляцию, действуйте, если клеточная гранула содержит 2 × 107 (20 миллионов клеток/гранулу).
2. Выделение митохондрий из клеток микроглии
ПРИМЕЧАНИЕ: Работайте быстро, держа все на льду на протяжении всей процедуры. Набор для митохондриальной изоляции, используемый для митохондриальной изоляции, состоит из трех компонентов: реагенты А (буфер для лизиса клеток), реагент В (стабилизирующий буфер) и реагент С (митохондриальный буфер для промывки). Добавляйте ингибиторы протеазы в реагент А и реагент С непосредственно перед применением.
- Пеллеты 2 × 107 клеток путем центрифугирования собранных клеток в микроцентрифужной пробирке объемом 2,0 мл при давлении 500 × г в течение 5 мин. Осторожно аспирируйте и выбросьте надосадочную жидкость.
- Добавьте 800 мкл реагента для выделения митохондрий А (буфер для лизиса клеток), переведите вихрь на средней скорости в течение 5 с и инкубируйте пробирку на льду ровно 2 мин.
ПРИМЕЧАНИЕ: Не превышайте 2-минутную инкубацию. - Добавьте 10 мкл реагента митохондриальной изоляции В (стабилизирующего буфера), сделайте вихрь на максимальной скорости в течение 5 с и инкубируйте пробирку на льду в течение 5 минут, совершая вихревые операции с максимальной скоростью каждую минуту.
- Добавьте 800 мкл реагента для выделения митохондрий C (митохондриальный буфер для промывки), переверните пробирку несколько раз для перемешивания и центрифугируйте пробирку при 700 × г в течение 10 мин при 4 °C.
ПРИМЕЧАНИЕ: Не делайте вихрей. - Перенесите надосадочную жидкость в новую пробирку объемом 2,0 мл и вращайте при 3 000 × г в течение 15 минут при 4 °C.
- Перенесите надосадочную жидкость (цитозольные порции) в новую пробирку. Гранула содержит изолированные митохондрии.
- Добавьте в гранулу 500 μл реагента для выделения митохондрий C и центрифугируйте при 12 000 × г в течение 5 минут.
- Используйте гранулу для количественного определения и обработки белка или храните гранулу при температуре -80 °C до дальнейшего использования.
3. Оценка белка с помощью анализа microBCA
ПРИМЕЧАНИЕ: Оценка белка для этого протокола может быть выполнена с использованием различных реагентов и анализов. Количественное определение цитозольных или митохондриальных белков может быть выполнено путем нормализации по отношению к общей концентрации белка, используемой в анализе.
- Приготовьте стандарты бычьего сывороточного альбумина (БСА) в диапазоне от 0 мкг/мл до 200 мкг/мл (0 мкг/мл, 0,5 мкг/мл, 1 г/мл, 2,5 мкг/мл, 5 мкг/мл, 10 мкг/мл, 20 мкг/мл, 40 мкг/мл, 200 мкг/мл) и заготовки только с буфером для лизиса.
- Добавьте по 150 мкл каждого стандарта в 96-луночный планшет с плоским дном, содержащий образцы.
- Смешайте 25 частей реагента Micro BCA MA (раствор бицинхониновой кислоты (BCA)) и 24 части реагента MB (раствор сульфата меди) с 1 частью реагента MC (стабилизирующий буфер) (25:24:1, реагенты MA:MB:MC) для создания рабочего реагента. Добавьте 150 мкл смешанного реагента BCA к каждому образцу и стандарту.
- Выдерживать при 37 °C в течение 2 ч.
- Используйте планшетный ридер для измерения абсорбции при 562 нм и количественного определения концентрации белка с помощью стандартной кривой. Вычтите полную стандартную абсорбцию из измерения абсорбции всех других отдельных стандартов, и неизвестный образец будет реплицирован для получения концентраций белка в образце.
4. Контроль качества митохондриального препарата (вестерн-блоттинг)
- Ресуспендируйте митохондриальную гранулу в буфере радиоиммунопреципитационного анализа (RIPA) для количественного определения белка. Определите концентрацию белка для каждого образца с помощью микроанализа BCA.
- Денатурируйте образцы в буфере для проб при 94 °C в течение 5 минут.
- Загрузите равное количество (20 мкг) митохондриального белка в сборные гели (см. Таблицу материалов) вместе с маркером молекулярной массы.
- Влейте гель в течение 50 минут при 100 В.
ПРИМЕЧАНИЕ: Время работы может варьироваться, поэтому обязательно остановите гель, когда белки достигнут конца геля, указанного красителем в буфере для образца. - Перенесите белки из геля на мембрану из поливинилиденфторида (PVDF) с использованием протокола сухого переноса в системе переноса вестерн-блоттинга в течение 7 мин при 20 В.
- Выньте мембрану и заблокируйте с помощью блокирующего раствора (Таблица 1) на 1 час при комнатной температуре.
- Добавьте соответствующие разведения первичного антитела к мембране в блокирующий буфер на ночь при 4 °C (COXIV = 1:3,000, GAPDH = 1:3,000).
Примечание: Отсутствие ядерного загрязнения эндоплазматического ретикулума (ER) в митохондриальном препарате можно проверить, используя дополнительные маркеры, такие как lamin (ядерный маркер) и ERp57 (маркер ER) в западных блоттингах. - Промойте мембрану в течение 3 x 15 минут с помощью буфера для промывки (Таблица 1).
- Инкубировать мембрану с соответствующим разведением HRP-конъюгированного вторичного антитела в блокирующем буфере при комнатной температуре в течение 1 ч
- Промойте мембрану в течение 3 х 15 минут с помощью буфера для промывки.
- Для проявки используйте набор хемилюминесцентных подложек.
- Отсканируйте мембрану с помощью геля и мембранного тепловизора.
5. Выделение митохондриального белка для экстракции N-гликана из микроглии
- Ресуспендируйте выделенные митохондрии в 50 мкл буфера для изоляции белка (табл. 1) и оставьте на льду на 20 минут.
- Отсадить и дозировать три раза и оставить на 20 минут на льду (вихре перед использованием). Если митохондриальная гранула не полностью растворена, добавьте еще 50 μL изоляционного буфера и объедините в ту же пробирку.
- Центрифугируйте при 13 000 × г в течение 10 мин.
- Восстановите надосадочную жидкость, заморозьте при -80 °C в течение минимум 1 часа и высушите как можно больше в вакуумном концентраторе.
- Ресуспендию перед выделением гликана с использованием буфера для расщепления PNGазы (Таблица 1) для IR-MALDESI.
6. Митохондриальный N-гликановый препарат для IR-MALDESI
- Загрузите 25-250 мкг белка (в максимальном объеме 250 мкл) выделенных митохондриальных белков в фильтр с молекулярной массой 10 кДа (MWCO).
- Уменьшите количество образцов белка, чтобы обнажить гликановые фрагменты, добавив 2 мкл 1 М дитиотреитола (DTT) в каждый образец фильтра.
- Разбавьте образец 200 μL буфера для расщепления PNGазы и слегка перемешайте, чтобы не нарушить работу фильтра.
- Денатурируйте митохондриальные белки путем инкубации образца при 56 °C в течение 30 минут.
- Используйте 50 мкл 1 М йодоацетамида для алкилирования митохондрий до конечной концентрации ~200 мМ и инкубируйте при 37 °C в течение 60 минут.
- Для дальнейшей концентрации денатурированных митохондриальных методов центрифугируйте образцы при 14 000 × г в течение 40 минут. Откажитесь от проточной части.
- Промойте образец 100 μL буфера для расщепления PNGase.
- Сконцентрируйте гликопротеин на фильтре при концентрации 14 000 × г в течение 20 минут и выбросьте проточный. Повторите шаг промывки и концентрации 2 раза, в общей сложности 3 раза, в результате чего концентрат попадет в мертвый объем фильтра (~5 μл). Отбрасывайте все проточные.
- Выбросьте флакон для сбора после завершения стирки. Используйте флакон нового сбора для всех будущих элюентов и смывок.
- Чтобы отделить гликаны от денатурированных митохондриальных гликоструктур, переложите в свежий флакон для сбора и добавьте в фильтр 2 мкл PNGазы без глицерина (75 000 единиц/мл). Добавьте 98 μL буфера для расщепления PNGase, доведя общий объем до 100 μЛ, и перемешайте, аккуратно пипетируя вверх и вниз на фильтре.
- Инкубируйте образцы при 37 °C в течение 18 ч для ферментативного расщепления всех N-гликанов из митохондриальных белков.
- Элюируйте высвобождающиеся митохондриальные N-гликаны путем центрифугирования образца при 14 000 × г в течение 20 мин при 20 °C.
- Промойте митохондриальные гликаны, добавив 100 мкл буфера для расщепления PNGазы в фильтр и центрифугируйте при 14 000 × г в течение 20 мин при 20 °C. Соберите раствор, содержащий оставшиеся N-гликаны, в тот же флакон для сбора, что и элюент. Повторите 2 раза и снимите фильтр с флакона для сбора.
- Образцы митохондриального гликана инкубировать в морозильной камере при температуре -80 °C до замерзания (30-60 минут) и высушить до полной сушки при комнатной температуре в вакуумном концентраторе (4-6 часов для 400 μл).
ПРИМЕЧАНИЕ: N-гликаны могут храниться при температуре -20 °C до 6 месяцев до анализа. - Ресуспендируйте высушенные N-связанные гликаны в 50 мкл воды класса LC/MS непосредственно перед анализом IR-MALDESI.
7. Детектирование высвобождаемых гликанов с помощью масс-спектрометрии IR-MALDESI
- Выполняйте калибровку гири каждый день эксперимента. Загрузите калибровочный раствор в шприцевой насос и протолкните его со скоростью 1,2 мкл/мин. Подайте напряжение 3,5 кВ для достижения стабильного шлейфа электрораспыления для калибровки массы как в положительном, так и в отрицательном режимах.
- Пипеткой 5 мкл ресуспендированных митохондриальных гликанов в место отбора образца на тефлоновом микролуночном стекле.
- Используйте лазер среднего ИК-диапазона, работающий на длине волны 2,97 мкм для абляции с энергией 1,8 мДж на пакет.
- Ионизируйте и детектируйте N-гликаны в режиме отрицательной ионизации. Используйте растворитель электрораспыления, состоящий из 60% ацетонитрила и 1 мМ уксусной кислоты, для создания стабильного шлейфа электроспрея с расходом 2 μл/мин при напряжении 3,2 кВ.
- Для выполнения анализа подключите IR-MALDESI к масс-спектрометру HRAM, настроенному на разрешающую способность по массе 240 000FWHM при m/z 200, анализируя от 500 до 2000 м/з в режиме отрицательной ионизации.
- Отключите автоматическую регулировку усиления (АРУ) и установите фиксированное время инжекции 90 мс. Используйте источник EasyIC для внутренней калибровки каждого спектра в режиме реального времени для достижения высокой точности измерения массы (MMA).
8. Анализ данных митохондриального N-гликана
- Ручная идентификация N-связанных гликанов путем поиска моноизотопных масс и подтверждения изотопных распределений с использованием интервала m/z для определения дважды и трижды заряженных ионов с минимальным порогом потока ионов 1000 ионов/с.
- Преобразуйте необработанные масс-спектры из соотношений m/z в массы нейтральных моноизотопов.
- Загрузите моноизотопные массы в онлайн-инструмент прогнозирования структуры олигосахаридов, чтобы определить потенциальные составы гликанов. Подтверждение аннотаций с использованием экспериментально подобранной гликомной базы данных20; Убедитесь, что каждая идентификация находится в пределах 2,5 ppm MMA, содержит основную N-связанную гликановую структуру (Hex3HexNAc2) и исключает пентозу, KDN или моносахариды HexA.
- Нарисуйте подтвержденные гликановые структуры с использованием номенклатуры SNFG21.
- Получить относительное содержание гликанов из исходных масс-спектров и нормализовать по количеству митохондриального белка в мкг для получения ионов/с/мкг.
- Используйте анализ хи-квадрат для проверки соответствия между теоретическим и экспериментальным распределениями N-связанных гликанов для определения количества аддуктов хлора. Это позволяет напрямую определить количество сиаловых кислот19.
Результаты
На рисунке 1 представлена схематическая схема этапов выделения митохондрий из линии микроглиальных клеток BV2 для масс-спектрометрического анализа гликанов. Воспроизводимость выделения митохондриальных белков между различными митохондриальными препаратами из одинаковой начальной плотности клеток микроглии представлена на рисунке 2, где не показано существенной разницы между концентрацией митохондриального белка, оцененной с помощью анализа микро БЦА.
На рисунке 3 представлена чистота митохондриальных изоляций с использованием вестерн-блоттинга ЦОГ IV и GAPDH. Здесь мы видим экспрессию митохондриального белка COX IV в митохондриальной фракции, выделенной на заключительном этапе выделения на основе реагентов, используемых в протоколе. Иммуноблоттинги показывают заметную полосу ЦОГ IV в изолированной митохондриальной фракции, в то время как GAPDH обнаруживается только в цитоплазматической фракции при той же экспозиции. Более длительное время экспозиции может привести к обнаружению слабой полосы GAPDH. Экспрессия немитохондриального маркера GAPDH очевидна во всей клеточном лизате после выделения митохондрий, без полос CoxIV, что указывает на полную изоляцию митохондриальной фракции и минимальную немитохондриальную контаминацию. Экспрессия ЦОГ IV в митохондриальных фракциях постоянна между различными препаратами с одинаковой плотностью исходных клеток 2 × 107 клеток.
Репрезентативные масс-спектры высвобожденных N-гликанов, обнаруженных с помощью IR-MALDESI на рисунке 4, показывают присутствие нескольких фосфорилированных, сульфатированных и сиатилированных заряженных N-гликанов, высвобождаемых из экстракта митохондриального белка при обработке PNGase. В таблице 2 представлены все гликановые композиции, которые были идентифицированы во всех спектрах, но не были зарегистрированы в GlyConnect. Значения хи-квадрат, проверяющие хорошую посадку, подтверждают обнаружение N-связанных гликанов с одним и двумя аддуктами хлора, подтверждая обнаружение этих гликанов с помощью IR-MALDESI на рисунке 5.
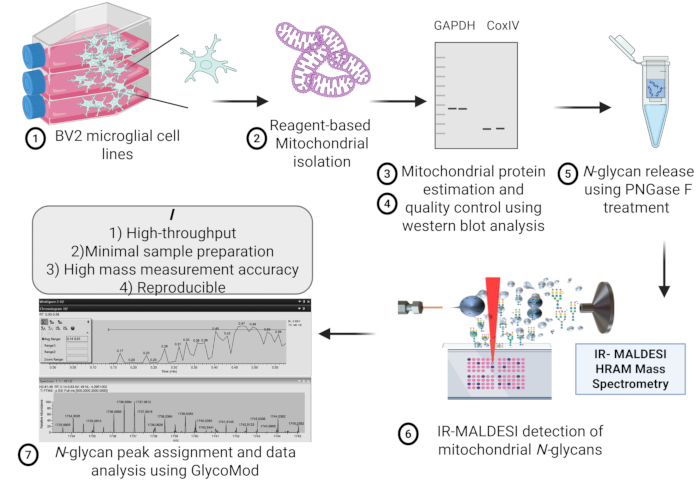
Рисунок 1: Схема протокола. Схематическая схема выделения митохондрий, контроля качества, экстракции белка, высвобождения N-гликанов и оценки с помощью масс-спектрометрии IR-MALDESI HRAM из линии микроглиальных клеток BV2 для высокопроизводительного обнаружения митохондриальных N-гликанов. Аббревиатура: IR-MALDESI HRAM = инфракрасный матричный лазерный десорбционный электроспрей ионизационный высокоразрешающий точный масс-анализатор. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Выделение митохондриального белка из клеток BV2. (A) Стандартная кривая для микроанализа BCA с использованием различных концентраций BSA. (B) Воспроизводимость выделения митохондриального белка, представленная постоянным содержанием белка из 2 × 107 клеток в шести независимых митохондриальных препаратах. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Чистота митохондриального препарата. Репрезентативный вестерн-блоттинг для цитоплазматической фракции, а также выделенные митохондрии из микроглиальных клеток BV2. На рисунке представлен иммуноблоттинг цитоплазматической фракции и выделенных митохондрий антителом к ЦОГ IV (митохондриальный маркер) и антителом к GAPDH (цитоплазматический контроль). Отсутствие полос GAPDH в изолированных митохондриях свидетельствует о минимальной перекрестной контаминации и чистоте митохондриального препарата для последующего анализа N-гликанов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Определение идентификационного состава митохондриального N-гликана с помощью масс-спектрометрии IR-MALDESI HRAM. Масс-спектры гликана в диапазоне 1700-2000 м/з показывают значительное количество многозарядных пиков с аннотированными структурами, определенными с помощью Гликомода. Аббревиатура: IR-MALDESI HRAM = инфракрасный матричный лазерный десорбционный электроспрей ионизационный высокоразрешающий точный масс-анализатор. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Верификация обнаруженных митохондриальных N-гликанов. Репрезентативные изотопные распределения для четырех (A-D) митохондриальных N-связанных гликанов, показывающие наложение наблюдаемого распределения с теоретическими распределениями хлора и депротонированных аддуктов. Значения хи-квадрат на наложенных спектрах представляют собой хорошее соответствие и подтверждают обнаружение N-связанных гликанов с одним и двумя аддуктами хлора. Это является еще одним подтверждением обнаружения этих гликановых композиций с помощью IR-MALDESI. Аббревиатура: IR-MALDESI = инфракрасная матрица с лазерной десорбцией электроспрей ионизация. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Таблица 1: Рецепты растворов и буферов, используемые в протоколе. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Mультипически заряженные депротонированные N-связанные гликаны, обнаруженные в митохондриях с высокой точностью измерения массы в гликомоде. Сокращенное обозначение гликаном: H = гексоза; N = N-ацетилглюкозамин; F = фукоза; S = N-ацетилнейраминовая кислота; Phos = фосфат; Сульфат = модификация сульфата. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
Микроглия является резидентными иммунными клетками головного мозга, а модификации гликана модулируют иммунофенотип и функцию микроглии. Эти иммунные функции требуют значительного количества клеточной энергии, которая в основном поставляется митохондриями. Примечательно, что митохондриальные белки также представляют модификации гликанов, которые остаются в значительной степени малоизученными из-за технологических сложностей в исследовании субклеточного гликозилирования. Большинство исследований, изучающих митохондриальное гликозилирование, основаны на лектиновой идентификации гликановых паттернов22, хотя эти подходы ограничены низкой специфичностью связывания лектинов. Существенными достижениями технического подхода, представленного в этом исследовании, являются: i) воспроизводимое выделение митохондриальных N-гликанов из клеток микроглии и ii) обнаружение и идентификация митохондриальных N-гликанов с помощью масс-спектрометрии IR-MALDESI HRAM. Описанный здесь рабочий процесс является первым сообщением об обнаружении N-гликанов, высвобождаемых из митохондриальных гликопротеинов, экспрессируемых на физиологических уровнях в клетках микроглии.
В настоящем протоколе митохондриальная изоляция максимизируется за счет использования метода выделения на основе реагентов. Это можно сочетать с методом гомогенизации Dounce для улучшения митохондриального выхода. Недостатком использования гомогенизатора по сравнению с изоляцией на основе реагентов является разброс силы и скорости движения пестика между операторами, что приводит к увеличению экспериментальной вариативности и снижению воспроизводимости. Предыдущие исследования23,24 указывали на использование этого метода и отсутствие ядерных (ламин, гистон H3) и ER-маркеров (кальнексин, Erp57) в митохондриальной фракции, что указывает на чистоту митохондриальной фракции. Потенциальным ограничением протокола является требование 20 миллионов клеток в качестве исходного материала для выделения митохондрий. Тем не менее, высокая концентрация митохондриальных белков, наблюдаемая в нашем исследовании, позволяет в десять раз уменьшить исходное количество микроглиальных клеток для выделения митохондрий на основе оптимизации, выполненной в предыдущих исследованиях25,26 (25-250 мкг белков) без потери N-гликановых сигналов. Кроме того, объединение биологических образцов для получения большего количества клеток для выделения митохондрий может быть выполнено в случае ограниченной масштабируемости протокола для снижения количества клеток из первичных источников, таких как ткани, для эффективного обнаружения гликанов. Кроме того, этап высвобождения гликана имеет решающее значение в этом протоколе. N-гликозидаза F (PNGase F) используется для высвобождения полных и интактных N-связанных гликанов путем гидролиза амидной связи между самым внутренним N-ацетилглюкозамином (GlcNAc) и остатком аспарагина27. Для анализа N-гликанов крайне важно оптимизировать активность PNGазы F для достижения полного дегликозилирования митохондриальных белков. Денатурация белков с использованием растворителя и избытка фермента помогает обеспечить эффективное и полное расщепление и высвобождение N-гликанов из митохондриальных белков. Время разложения 18-20 ч является оптимальным для высвобождения N-гликана путем завершения реакции PNGase F26.
Потенциальным ограничением этого протокола является недостаточное обогащение митохондриального экстракта гликопротеинами в этом методе. Несмотря на то, что гликопротеины с низким содержанием могут быть не обнаружены при анализе, этот метод сводит к минимуму погрешность и систематическую ошибку, вызванные очисткой сродства к лектину или химическим обогащением. В то время как IR-MALDESI обеспечивает высокую степень достоверности идентификации состава идентифицированных гликанов, точная информация о связях между остатками гликанов требует дальнейших исследований с использованием тандемной масс-спектрометрии гликанов, аддуцированных литием, для усиления перекрестных кольцевых расщеплений28 или расщепления экзогликозидазы. В качестве альтернативы можно использовать ЖХ-МС/МС в дополнение или в качестве альтернативы подходу IR-MALDESI, который может обеспечить более глубокое покрытие гликанами с большим количеством структурных деталей. Тем не менее, предыдущие исследования показали корреляцию между средним содержанием ионов в IR-MALDESI для метаболитов и абсолютными величинами, определенными с помощью LC-MS/MS29, что создает основу для прямого количественного определения метаболитов с использованием IR-MALDESI. Высокая пропускная способность IR-MALDESI с возможностью проведения анализа MS2 для обеспечения структурного подтверждения с высокой степенью достоверности играет важную роль в быстром скрининге доклинических и клинических образцов на потенциальные биомаркеры гликана и диагностику заболевания. Кроме того, следует отметить, что, хотя центрифугирование постядерной надосадочной жидкости при 3000 × г вместо 12 000 × г минимизирует пероксисомальные и лизосомальные загрязнители, следы этих белков все же могут присутствовать в митохондриальном препарате.
В заключение, в этом исследовании представлен простой, высокопроизводительный метод с минимальной подготовкой образцов для анализа митохондриального гликома в клетках микроглии и большим потенциалом для применения в идентификации новых терапевтических мишеней на основе гликана для лечения нейродегенеративных заболеваний. Этот протокол представляет собой всестороннюю оценку и стандартизацию аналитических методов выделения митохондрий из микроглии и последующего анализа митохондриальной железы для масштабирования крупномасштабных доклинических и клинических исследований. Этот протокол имеет ряд преимуществ для выделения и обнаружения N-гликанов: i) время выделения митохондрий для протокола на основе реагентов низкое (≤40 мин); ii) выход белков для высвобождения гликана высок; iii) одни и те же митохондриальные образцы, подготовленные для анализа N-гликанов, могут быть использованы для других молекулярно-биологических исследований, таких как протеомный анализ, анализ лектинов и анализ митохондриального потока; и iv) масс-спектрометрия IR-MALDESI HRAM позволяет быстро и лучше обнаруживать N-гликаны благодаря стратегии гибридной и мягкой ионизации28 без необходимости химической дериватизации заряженных гликанов, таких как сиалогликаны и сульфогликаны30.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Авторы хотели бы поблагодарить Сета Айзенберга, аспиранта лаборатории Маддимана в NCSU, за его помощь в видеозаписи масс-спектрометрического протокола. Это исследование было частично поддержано Программой стипендиатов Школы инженерных инноваций при Университете Алабамы в Бирмингеме, AG068309 до D.J.T. и R01GM087964-12 до D.C.M. Схемы в этой рукописи были нарисованы с помощью BioRender.
Материалы
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Amersham 600 imager | Cytvia | 29194217 | Gel and membrane imager |
| Countess 3 automated cell counter | Fisher Scientific | X003SZ1LY9 | |
| Dry Bath Stdrd 4 blck 100-120V | Thermofisher scientific | 88870003 | |
| i-Blot2 Gel Transfer Device | Invitrogen | IB21001 | Western blot transfer system |
| Inverted microscope | Cell Treat | 04355223EA | |
| Microplate reader | 82050-760 | ||
| Mini gel tank | Invitrogen | A25977 | |
| Open Air Rocker | Fisher Brand | 88861025 | |
| Pipet boy | BioTek | 229310 | |
| Vortex mixer | Integra- VWR | ||
| Mitochondria isolation reagents | |||
| Mitochondrial Isolation kit | Thermofisher scientific | 89874 | |
| Phosphotase Inhibitor | Thermofisher scientific | 1861274 | |
| Protease Inhibitor | Thermofisher scientific | 1861281 | |
| N-glycan isolation and IR-MALDESI reagents | |||
| Acetic acid | Fisher Scientific | A11350 | 50% in ESI solvent |
| Acetonitrile | Sigma Aldrich | 34851-4L | 1 mM in ESI solvent |
| Ammonium bicarbonate | Fisher Scientific | A643500 | 100 mM |
| Calibration Solution | Thermofisher Scientific | A39239 | Pierce FlexMix |
| Dithiothreitol | Sigma Aldrich | AC426380100 | 1 M |
| Iodoacetamide | Sigma Aldrich | A322-10VL | |
| LC/MS grade water | Thermofisher Scientific | 047146.M6 | |
| PNGase F | Bulldog Bio | NZPP010 | 75000 U/mL, enzyme for N-glycan release |
| N-glycan isolation and IR-MALDESI consumables | |||
| Amicon centrifugal filters | Fisher Scientific | UFC501024 | 10 kDa MWCO |
| Mass spectrometer | Orbitrap Exploris 240 | ||
| Mid-IR Laser | JGM Associates, Burlington, MA, USA | ||
| Teflon microwell slide | Prosolia, Indianapolis, IN, USA | ||
| N-glycan analysis softwares | |||
| GlycoMod | Expasy | https://web.expasy.org/glycomod/ | |
| GlyConnect | Expasy | https://glyconnect.expasy.org/ | |
| Protein isolation and western blot consumables | |||
| Basix gel loading tips ( 10 µL) | Basix | 13-611-102 | |
| Basix gel loading tips ( 200 µL) | Basix | 13-611-116 | |
| Cell scrapper | VWR labs | 14-388-100 | |
| i-Blot NC regular stacks | Invitrogen | IB23001 | |
| i-Blot2 PVDF Regular Stacks | Invitrogen | IB24001 | |
| 10 µL micropipette | Fisher Scientific | FBE00010 | |
| 20 µL micropipette | Invitrogen | FBE00020 | |
| 200 µL micropipette | Fisher Brand | FBE00200 | |
| 1000 µL micropipette | Fisher brand | FBE01000 | |
| 10 µL pipet tips | VWR labs | 76322-528 | |
| 20 µL pipet tips | VWR labs | 76322-134 | |
| 200 µL pipet tips | VWR labs | 76322-150 | |
| 1000 µL pipet tips | VWR labs | 76322-154 | |
| Well plate | Fisher brand | 14-388-100 | |
| Protein isolation and western blot reagents | |||
| Actin antibody ( Host : Rabbit ) | Cell Signaling Technologies | 8457T | |
| Anti-Rabbit IgG HRP Linked | Cell Signaling Technologies | 7074S | |
| Bolt 4-12% Bis-Tris Plus | Invitrogen | NW04120BOX | |
| Bovine Serum Albumin | Fisher bioreagents | BP9700-100 | |
| COXIV antibody ( Host : Rabbit) | Cell Signaling Technologies | 4844S | |
| GAPDH antibody ( Host : Rabbit) | Cell Signaling Technologies | 2118S | |
| MicroBCA protein assay Kit | Thermofisher scientific | 23235 | |
| Nupage MOPS SDS Runing Buffer [20x] | Thermofisher scientific | NP0001 | |
| PAGE Ruler prestained protein ladder | Thermofisher scientific | 815-968-0747 | Dilution= Use 7 µL to load onto first well |
| Phosphate buffered saline | Aniara Diagnostics | A12-9423-5 | Prepare 1x PBS from 10x powder |
| Pierce ECL Western Blotting Substrate | Thermofisher scientific | 32106 | Chemiluminescent substrate kit |
| RIPA Buffer | Thermofisher scientific | 89901 | |
| Sample Buffer | Novex | B0007 | The bolt LDS sample buffer is prepared in 3:1 ratio of sample to sample buffer |
| Tween-20 | MP Biomedicals | TWEEN201 | |
| Tissue culture consumables | |||
| Countess Slides | Avantor | 229411 | |
| Eppendorf tubes | Cell Treat | 414004-265612-5884 | |
| 2 mL aspirating pipet | Vista lab | 5090-0010E | |
| 5 mL serological pipet | Fisher Scientific | 13-678-11D | |
| 10 mL serological pipet | Basix | 13-678-11E | |
| 25 mL serological pipet | Vista lab | FB012937 | |
| 50 mL serological pipet | Vista lab | 14955233 | |
| 15 mL Conical tube | Avantor | 229225A | |
| 50 mL conical tube | Cell treat | 4190-0050 | |
| T-75 cm2 Tissue culture flask | Fisher Scientific | FB012937 | |
| T-180 cm2 Tissue culture flask | Fisher Scientific | FB012939 | |
| Tissue culture reagents | |||
| BV2 microglial cell line | Creative Bioarray | CSC-I2227Z | Immortalized Mouse Microglia (BV2) derived from C57/BL6 neonatal microglia |
| Cell dissociation enzymes | Thermofisher scientific | 12563029 | TrypLE |
| Dulbecco's Modified Eagle Medium (DMEM) Low Glucose Media | Gibco | 10567014 | |
| Fetal Bovine Serum | Cytiva | SH30071.03HI | |
| Minimum Essential Medium (MEM) Non-essential Amino Acids | Gibco | 11140050 | |
| Penicillium Streptomycin | Cytivia | SV30010 | |
| Phosphate buffer saline | Corning | 21-040-CV | |
| Trypan Blue stain 0.4% | Invitrogen | T10282 |
Ссылки
- Dos Santos, S. E., et al. Similar microglial cell densities across brain structures and mammalian species: Implications for brain tissue function. J Neurosci. 40 (24), 4622-4643 (2020).
- Shao, F., Wang, X., Wu, H., Wu, Q., Zhang, J. Microglia and neuroinflammation: Crucial pathological mechanisms in traumatic brain injury-induced neurodegeneration. Front Aging Neurosci. 14, 825086(2022).
- Arcuri, C., Mecca, C., Bianchi, R., Giambanco, I., Donato, R. The pathophysiological role of microglia in dynamic surveillance, phagocytosis and structural remodeling of the developing cns. Front Mol Neurosci. 10, 191(2017).
- Cheng, J., et al. Early glycolytic reprogramming controls microglial inflammatory activation. J Neuroinflammation. 18 (1), 129(2021).
- Cătălin, B., Cupido, A., Iancău, M., Albu, C. V., Kirchhoff, F. Microglia: First responders in the central nervous system. Rom J Morphol Embryol. 54 (3), 467-472 (2013).
- Cai, Y., Liu, J., Wang, B., Sun, M., Yang, H. Microglia in the neuroinflammatory pathogenesis of alzheimer's disease and related therapeutic targets. Front Immunol. 13, 856376(2022).
- Hickman, S., Izzy, S., Sen, P., Morsett, L., El Khoury, J. Microglia in neurodegeneration. Nat Neurosci. 21 (10), 1359-1369 (2018).
- Norat, P., et al. Mitochondrial dysfunction in neurological disorders: Exploring mitochondrial transplantation. NPJ Regen Med. 5 (1), 22(2020).
- Picca, A., et al. Age-associated glia remodeling and mitochondrial dysfunction in neurodegeneration: Antioxidant supplementation as a possible intervention. Nutrients. 14 (12), 2406(2022).
- Mcavoy, K., Kawamata, H. Glial mitochondrial function and dysfunction in health and neurodegeneration. Mol Cell Neurosci. 101, 103417(2019).
- Fairley, L. H., Wong, J. H., Barron, A. M. Mitochondrial regulation of microglial immunometabolism in alzheimer's disease. Front Immunol. 12, 624538(2021).
- Starossom, S. C., et al. Galectin-1 deactivates classically activated microglia and protects from inflammation-induced neurodegeneration. Immunity. 37 (2), 249-263 (2012).
- Puigdellívol, M., Allendorf, D. H., Brown, G. C. Sialylation and galectin-3 in microglia-mediated neuroinflammation and neurodegeneration. Front Cell Neurosci. 14, 162(2020).
- Gerlach, J. Q., Kilcoyne, M., Eaton, S., Bhavanandan, V., Joshi, L. Non-carbohydrate-mediated interaction of lectins with plant proteins. Adv Exp Med Biol. 705, 257-269 (2011).
- Cummings, R. D., Pierce, J. M. The challenge and promise of glycomics. Chem Biol. 21 (1), 1-15 (2014).
- Robichaud, G., Barry, J. A., Muddiman, D. C. IR-MALDESI mass spectrometry imaging of biological tissue sections using ice as a matrix. J Am Soc Mass Spectrom. 25 (3), 319-328 (2014).
- Barry, J. A., Groseclose, M. R., Robichaud, G., Castellino, S., Muddiman, D. C. Assessing drug and metabolite detection in liver tissue by uv-maldi and ir-maldesi mass spectrometry imaging coupled to ft-icr ms. Int J Mass Spectrom. 377, 448-155 (2015).
- Pace, C. L., Muddiman, D. C. Direct analysis of native N-linked glycans by IR-MALDESI. J Am Soc Mass Spectrom. 31 (8), 1759-1762 (2020).
- Palomino, T. V., Muddiman, D. C. Predicting sialic acid content of N-linked glycans using the isotopic pattern of chlorine. J Am Soc Mass Spectrom. 34 (7), 1392-1399 (2023).
- Mariethoz, J., et al. Glycomics@expasy: Bridging the gap. Mol Cell Proteomics. 17 (11), 2164-2176 (2018).
- Varki, A., et al. Symbol nomenclature for graphical representations of glycans. Glycobiology. 25 (12), 1323-1324 (2015).
- Yu, H., et al. Comparison of the glycopattern alterations of mitochondrial proteins in cerebral cortex between rat alzheimer's disease and the cerebral ischemia model. Sci Rep. 7 (1), 39948(2017).
- Dixit, B., Vanhoozer, S., Anti, N. A., O'Connor, M. S., Boominathan, A. Rapid enrichment of mitochondria from mammalian cell cultures using digitonin. MethodsX. 8, 101197(2021).
- Kalathil, A. A., et al. New pathway for cisplatin prodrug to utilize metabolic substrate to overcome cancer intrinsic resistance. central science. 9, 1297-1312 (2023).
- Hecht, E. S., McCord, J. P., Muddiman, D. C. Definitive screening design optimization of mass spectrometry parameters for sensitive comparison of filter and solid phase extraction purified, inlight plasma N-glycans. Anal Chem. 87 (14), 7305-7312 (2015).
- Hecht, E. S., McCord, J. P., Muddiman, D. C. A quantitative glycomics and proteomics combined purification strategy. J Vis Exp. (109), e53735(2016).
- Fischler, D. A., Orlando, R. N-linked glycan release efficiency: A quantitative comparison between NaOCl and PNGase F release protocols. J Biomol Tech. 30 (4), 58-63 (2019).
- Tu, A., Muddiman, D. C. Internal energy deposition in infrared matrix-assisted laser desorption electrospray ionization with and without the use of ice as a matrix. J Am Soc Mass Spectrom. 30 (11), 2380-2391 (2019).
- Barry, J. A., et al. Mapping antiretroviral drugs in tissue by IR-MALDESI MSI coupled to the Q exactive and comparison with LC-MS/MS SRM assay. J Am Soc Mass Spectrom. 25 (12), 2038-2047 (2014).
- Samal, J., Palomino, T. V., Chen, J., Muddiman, D. C., Segura, T. Enhanced detection of charged N-glycans in the brain by infrared matrix-assisted laser desorption electrospray ionization mass spectrometric imaging. Anal Chem. 95 (29), 10913-10920 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены