Method Article
İzole Pankreas Adacık Tedavisi ve Apoptoz Ölçümü
Bu Makalede
Özet
Bu çalışma, pankreas adacıklarında sitokin kaynaklı apoptozu ve β hücreye özgü ölümü değerlendirmek için konfokal mikroskopi ile birlikte hücre ölümü ve apoptozun çok boyamalı floresan bazlı belirteçlerini kullanmaktadır. Hücre dışı uyaranlara yanıt olarak hücre ölümü ve apoptozdaki mekansal ve zamansal değişiklikleri ortaya çıkarır.
Özet
Bu çalışma, proinflamatuar sitokinlerin pankreas adacıkları, özellikle insülin üreten β hücreleri üzerindeki etkisini, hücre canlılığını, apoptozu ve β hücreye özgü ölümü değerlendirmek için floresan boyama teknikleri ve konfokal mikroskopi kombinasyonu kullanarak araştırmaktadır. İzole fare adacıkları, tip 1 diyabet gelişimi sırasında bağışıklık aracılı apoptozu taklit etmek için TNF-α, IL-1β ve IFN-γ dahil olmak üzere değişen konsantrasyonlarda bir sitokin kokteyli ile tedavi edildi. Adacık hücrelerinin canlılığı, FDA'nın floreseine dönüşümünün canlı hücreleri gösterdiği ve PI ile işaretlenmiş membran baskılanmış hücrelerin bulunduğu FDA/PI ikili boyama ile değerlendirildi. YOPRO-1 ve nükleer boyama, erken apoptotik hücreleri doğrulayan Annexin-V ile apoptoz hakkında ek veriler sağladı. Kantitatif analiz, sitokin ile tedavi edilen adacıklarda apoptoz ve hücre ölüm oranlarında önemli artışlar olduğunu ortaya koydu. β hücreleri üzerindeki etkileri spesifik olarak değerlendirmek için, insülin üreten hücreleri insülin granüllerindeki çinko ilişkisi yoluyla etiketlemek için Zn2 + seçici gösterge boyaması kullanıldı ve adacıkların 24 saat boyunca pro-inflamatuar sitokinlerle tedavisini takiben önemli β hücre kaybı ortaya çıktı. Bu çoklu boyama protokolleri, adacıklarda sitokin kaynaklı hasarın derecesini etkili bir şekilde yakalar ve ölçer ve erken tip 1 diyabette β hücreli apoptozu önlemek için tasarlanmış terapötikleri değerlendirmek için kullanılabilir.
Giriş
Langerhans adacıkları olarak da bilinen pankreas adacıkları, pankreas içinde bulunan endokrin hücrelerin bir koleksiyonudur. İnsülin üreten β hücreleri, pankreas adacıklarının en bol ve işlevsel olarak önemli bileşenidir. Bu β hücreler, glikoz homeostazınınkorunmasında kritik bir rol oynayan bir hormon olan insülini salgılar 1. Tip 1 diyabette (T1D), bağışıklık sistemi pankreas adacıklarını hedefler ve sızar, insülin üreten β hücrelerini yok eder. Bu otoimmün saldırıya öncelikle interlökin-1β (IL-1β), tümör nekroz faktörü-alfa (TNF-α) ve interferon-gama (IFN-γ)2 dahil olmak üzere proinflamatuar sitokinler aracılık eder. Bu sitokinler, sonuçta apoptoz3'ü tetikleyen β hücreleri içinde bir dizi sinyal olayı başlatır. Programlanmış hücre ölümü olan apoptoz, kaspazların aktivasyonunu, DNA parçalanmasını ve hücresel parçalanmayı içeren sıkı bir şekilde düzenlenmiş bir süreçtir. T1D3'ün başlangıcı sırasında β hücreli kütle ve fonksiyonun kademeli olarak kaybına katkıda bulunur.
β hücreli apoptozu yönlendiren moleküler mekanizmaları anlamak, T1D'de β hücre yıkımını önlemek veya hafifletmek için stratejilerin belirlenmesi için kritik öneme sahiptir. Bunu başarmak için, deneysel modellerden veya insan kadavralarından izole edilmiş pankreas adacıkları, β hücreli patolojiyi incelemek için sağlam ve köklü bir model sistem görevi görür 2,3. Araştırmacılar, bu izole adacıkları pro-inflamatuar sitokinlerle tedavi ederek, erken T1D'yi karakterize eden ortamı çoğaltabilir ve β hücre disfonksiyonu ve ölümün in vitro 4,5 ayrıntılı çalışmasına izin verebilir. Bu deneyler, hastalıkla ilişkili koşullar altında β hücrelerinin savunmasızlığı ve hayatta kalması hakkında önemli bilgiler sağlar ve ayrıca β hücreleri sitokin kaynaklı apoptozdan korumayı veya kurtarmayı amaçlayan terapötik müdahaleleri test etmek için bir platform görevi görür. Bu in vitro sistemi kullanarak, farklı türlerden adacıkların çeşitli koşullara nasıl tepki verdiğini etkili bir şekilde analiz edebilir ve türler arasındaki fonksiyonel ve apoptotik varyasyonların daha iyi anlaşılmasını sağlayabiliriz.
Önceki çalışmalar, fare ve insan kaynaklı sitokinlerden oluşan bir kokteyl (sırasıyla 1x = 10 ng/mL TNF-α, 5 ng/mL IL-1β ve 100 ng/mL IFN-γ) ile 24 saat boyunca tedavi edilen fare ve insan adacıklarının, adacık hücrelerinin önemli ölümüne yol açtığını göstermiştir 4,5,6. Sitokin ile muamele edilen hücrelerin floresein diasetat (FDA) ve propidyum iyodür (PI) ile boyanmasıyla adacık canlılığı doğrulandı5,6. Küresel olarak, adacık canlılığı, FDA ve PI7 ile standart deoksiribonükleik asit (DNA) bağlayıcı boya dışlama tekniği kullanılarak değerlendirilir. Floresan lekeler veya boya konjuge substratlar, zar bütünlüğüne ve geçirgenliğine dayalı olarak hücre canlılığını değerlendirir. Hücre geçirgen bir boya olan FDA, canlı hücreler tarafından yeşil floresansa (floresein) dönüştürülür. Buna karşılık, hücre geçirimsiz bir boya olan PI, yalnızca ölü hücrelerin çekirdeklerini riskli zarlarla lekeler7. Hücreler daha sonra, yeşil ve kırmızı floresanların sırasıyla canlı ve ölü hücreleri işaretlediği konfokal bir mikroskopta iki renkli görüntüleme yoluyla analiz edilir.
FDA / PI boyama protokolünün sınırlaması, PI'nin yalnızca zar seçiciliğini kaybetmiş hücrelere girmesidir, bu da erken apoptotik hücreleri ayırt edemediği anlamına gelir. Ayrıca, bu yöntem hücre alt kümeleri arasında ayrım yapamaz, bu da onu β hücre canlılığını seçici olarak değerlendirmek için uygun hale getirmez. Annexin V / PI protokolü, apoptotik hücreleri incelemek için yaygın olarak kullanılır ve protokol, doğruluğunu artırmak için modifiye edilmiştir8. Apoptozun erken evreleri, fosfatidilserinin plazma zarının iç tabakasından dış tabakasına translokasyonunu içerir. Kalsiyuma bağımlı bir protein olan Annexin V, bu açıkta kalan fosfatidilserine yüksek afinite ile bağlanır. PI ile boyama, apoptotik hücreleri (sadece eklin V-pozitif) nekrotik hücrelerden (hem eklik-V hem de PI için pozitif) ayırt etmek için ekin-V ile birlikte gerçekleştirilir, çünkü nekrotik hücreler ayrıca bozulmuş membran bütünlüğü nedeniyle fosfatidilseringösterir 9. YOPRO-1 gibi diğer boyalar da adacık hücrelerinin apoptozunu ölçmek için kullanılır. Canlı hücrelerin hücre zarı, apoptoz geçiren canlı hücreleri ölçemeyen annexin-V'den farklı olarak YOPRO-1'e karşı geçirimsizdir.
Pankreas β hücre ölümünü değerlendirmek için, sadece insülin üreten hücreleri hedef alan spesifik boyalara ihtiyaç vardır. Pankreas β hücrelerinin belirgin bir özelliği, hücre içi Zn2 + 'nın bir kısmının veziküllerde bir Zn2 + - insülin kompleksi (2: 1 oranı) olarak depolanmasıdır10. Serbest Zn2+ ayrıca β hücrelerinin etrafındaki ekstra granüler boşlukta rezervuar olarak bulunur. Salgı granüllerinde insüline gevşek bir şekilde bağlanan serbest Zn2+ ve Zn2+, çinko bağlayıcı boyalar kullanılarak görselleştirilebilir. Çinko bağlayıcı bir boya olan ditizon, adacık saflığını değerlendirmek için yaygın olarak kullanılır, ancak β hücre canlılığını ve işlevini değerlendirmek için kullanılan floresan boyalarla birleştirilemez11. Zn2 + 'ya karşı oldukça seçici olan TSQ ve Zinquin gibi UV probları, serbest hücre içi Zn2 + 'nın görüntülenmesi ve ölçülmesi yoluyla β hücreleri ölçmek için geliştirilmiştir; 12,13. Bununla birlikte, kullanımları zayıf çözünürlük, düzensiz hücre yüklemesi, UV uyarma gereksinimi ve asidik veziküllerebölme ile sınırlıdır 14. Newport yeşili ve Zn2+ seçici gösterge gibi görünür dalga boylu floresan problar da bu sınırlamaların üstesinden gelmek için geliştirilmiştir ve şu anda izole insan adacıklarındaki β hücreleri tespit etmek için yaygın olarak kullanılmaktadır15,16. FluoZin-3 (Zn2+ seçici gösterge), Newport Green'den daha yüksek Zn2+ afiniteye ve üstün kuantum verimine sahiptir ve izoleadacıklarda (14,17) insülin ile birlikte salınan Zn2 + 'nın görüntülenmesi için etkili olduğu kanıtlanmıştır.
FDA, PI, Annexin V, YOPRO-1 ve Zn2+ seçici indikatör gibi floresan boyaların kullanılması, canlı, apoptotik ve toplam ölü hücreler arasında ölçüm ve ayrım yapılmasını sağlar. Uyumlu ve son derece seçici probların birleştirilmesi, diyabet araştırmalarında ve ilaç geliştirmede β hücre yıkımını anlamak ve azaltmak için kritik olan β hücre canlılığını ve apoptozu değerlendirmek ve ölçmek için hedefli bir yöntem de sunar.
Protokol
Farelerle yapılan tüm deneyler, Colorado Üniversitesi Denver Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (Protokol 000929) tarafından onaylandı. Bu deney için kullanılan C57Bl / 6 fareleri, Jackson Laboratuvarı'ndan satın alındı ve yiyecek ve suya ad libitum erişimi olan 12 saatlik bir aydınlık / karanlık döngüsünde sıcaklık kontrollü bir tesise yerleştirildi. İzole edilen fare adacıkları, daha önce tarif edilen kollajenaz sindirim protokolü kullanılarak elde edildi 5,18.
1. Çözeltilerin ve kültür ortamının hazırlanması
NOT: Kültür ortamı, sitokin stokları ve diğer reaktifler steril koşullar altında hazırlanmalıdır.
- 500 mL 1640 RPMI Ortamına %10 fetal sığır serumu (FBS), 10.000 U/mL penisilin ve 10.000 μg/mL streptomisin ekleyerek bir adacık kültürü ortamı hazırlayın.
- 1x fosfat tamponlu tuzlu su çözeltisi (PBS), pH 7.4 hazırlayın. % 0.1 sığır serum albümini (BSA) içeren steril PBS'de 10 μg / mL TNF-α 10μg / mL, 5 μg / mL IL-1β ve 100 μg / mL IFN-γ 1000x fare sitokin kokteyli stok çözeltisi hazırlayın ve çözeltiyi -20 ° C'de 10 μL alikotlarda saklayın.
- Aseton içinde 46 μM (50x) FDA stok çözeltisi hazırlayın ve -20 ° C'de 1 mL alikotlarda saklayın. PBS'de 1.434 mM (50x) PI stok çözeltisi hazırlayın ve 4 ° C'de 1 mL alikotlarda saklayın.
- 500 mL NaCl, 5.7 mM KCl, 2.5 mM CaCl 2, 1.2 mM MgCl2 ve 10 mM HEPES ile 125 mM NaCl, 5.7 mM KCl, 2.5 mM CaCl2 ve 10 mM HEPES ile 500 mL Bikarbonat Modifiye Krebs-Henseleit HEPES (BMHH) tamponu hazırlayın 500 mL dH2O'da pH'ı 7.4'e ayarlayın.
- 100 mL dH2O içinde 10 mM HEPES, 140 mM NaCl ve 2.5 mM CaCl2 ile 100 mL Annexin-V bağlayıcı tampon hazırlayın pH'ı 7.4'e ayarlayın.
- DMSO'da 1mMZn 2+ seçici indikatör stok çözeltisi hazırlayın ve -20 ° C'de 10 μL'lik alikotlarda saklayın.
NOT: Floresan boyalar ışığa duyarlıdır, bu nedenle depolama ve inkübasyon karanlıkta olmalıdır.
2. İzole adacıkların sitokinlerle tedavisi
- Fare adacıklarını 10 μL'lik bir mikropipet ile kültür ortamına izole edin ve sitokinlerle tedaviden önce izolasyon stresinden kurtulmak için gece boyunca 37 °C ve% 5 CO2'de inkübe edin.
- 35 mm'lik doku kültürü ile muamele edilmemiş Petri kaplarına 2 mL sterilize adacık kültürü ortamı ekleyin ve sitokin ile muamele edilmiş ve siokin içermeyen muamele edilmemiş kapları ayırt etmek için bunları uygun şekilde etiketleyin.
- Sitokin ile muamele edilmiş yemekler için, 6 μL kültür ortamını çıkarın ve 10 ng / mL, 5 ng / mL IL-1β ve 100 ng / mL IFN-γ (1x RCC) nihai nispi sitokin konsantrasyonu vermek için stok çözeltisinden her bir sitokinin 2 μL'si ile değiştirin.
NOT: 0.5x ve 0.1x'lik daha düşük RCC, stok çözeltilerinin sırasıyla 1: 1 ve 1: 9'da% 0.1 BSA içeren steril PBS ile seyreltilmesiyle hazırlanabilir. - İzolasyondan 12 saat-24 saat sonra, ışık mikroskobu altında bir mikropipet kullanarak 10-20 adacık alın ve bulaşıklara aktarın ve nemlendirilmiş 37 ° C,% 5 CO2 inkübatörde 24 saat inkübe edin.
NOT: Kuluçka süresi, belirli deneysel hedeflere bağlı olarak değişebilir.
3. FDA / PI ile adacık canlılığı ölçümü
- Sırasıyla 0.46 μM ve 14.34 μM floresan boyaların nihai konsantrasyonunu vermek için% 0.1 BSA içeren 960 μL BMHH tamponuna 20 μL FDA ve PI stok çözeltileri ekleyin.
- 100 μL boyama solüsyonunu 7 mm'lik cam tabanlı doku kültürü ile muamele edilmemiş bir Petri kabına alın.
- Sitokinlerle inkübasyondan 24 saat sonra, her tedaviden en az 6 adacığı cam tabanlı Petri kabına dikkatlice aktarın. Karanlıkta oda sıcaklığında 5-10 dakika inkübe edin (folyo ile örtün).
- 40x suya daldırma objektifi ile floresan mikroskobu kullanarak görüntü çekin. FDA / PI boyamadan sonraki 15 dakika içinde fotoğraf çekin.
- FDA (520 nm) ve PI (620 nm) için floresan emisyonlarını tespit etmek için sırasıyla 488 nm ve 514 nm'de uyarma lazerleri kullanın.
- 10 μm aralıklı üç görüntüden oluşan bir z yığını olarak görüntü adacıkları. Adacıktaki ışık saçılımı sorunlarından kaynaklanan sinyal kaybını azaltmak için adacığın yalnızca alt 1/3 - 1/2'sini görüntüleyin.
- Canlı yeşil (FDA pozitif) ve ölü kırmızı (PI pozitif) hücreleri ImageJ'de (NIH) fare başına en az 5 adacık için manuel olarak sayın (n = 3). Hücre ölümünün yüzdesini aşağıdaki gibi hesaplayın:
adacık ölüm yüzdesi = ölü hücre sayısı/ (ölü hücre sayısı + canlı hücre sayısı) x %100
4. Boyama ile apoptoz ölçümü
- 0,8 μM'lik bir nihai konsantrasyon için 992 μL BMHH görüntüleme tamponuna 8 μL YOPRO-1 (1 mM çözelti) ekleyin.
- 500 μL boyama solüsyonunu 14 mm'lik cam tabanlı doku kültürü ile muamele edilmemiş bir Petri kabına alın.
- Sitokinlerle inkübasyondan 24 saat sonra, her tedaviden en az 6 adacığı dikkatlice cam tabanlı Petri kabına aktarın ve karanlıkta 37 ° C'de 1 saat inkübe edin (folyo ile örtün).
- 20 dakikalık inkübasyondan sonra, her cam tabanlı Petri kabına bir damla NucBlue (nükleer leke, 20 μL) ekleyin ve inkübasyona devam edin. Toplam inkübasyon süresi YOPRO-1 için 1 saat ve nükleer leke için 40 dakikadır.
- 1 saatlik inkübasyondan sonra, adacıkları 7 mm'lik cam tabanlı doku kültürü ile muamele edilmemiş bir Petri kabında %0.1 BSA (100 μL) içeren taze bir BMHH görüntüleme tamponuna aktarın.
- 40x suya daldırma objektifi ile floresan mikroskobu kullanarak görüntü çekin. Nükleer leke (460 nm) ve YOPRO-1'in (509 nm) floresan emisyonlarını tespit etmek için sırasıyla 405 nm ve 488 nm'de uyarma lazerleri kullanın.
- 10 μm aralıklı üç görüntüden oluşan bir z yığını olarak görüntü adacıkları. Adacıktaki ışık saçılımı sorunlarından kaynaklanan sinyal kaybını azaltmak için adacığın yalnızca alt 1/3 - 1/2'sini görüntüleyin.
- Canlı mavi (nükleer leke pozitif) ve apoptotik yeşil (YOPRO-1-pozitif) hücreleri ImageJ'de (NIH) fare başına en az 5 adacık için manuel olarak sayın (n = 3). Apoptotik adacık hücrelerinin yüzdesini aşağıdaki gibi hesaplayın:
apoptotik adacık hücrelerinin yüzdesi = apoptotik hücre sayısı / (apoptotik hücre sayısı + canlı hücre sayısı) x %100
5. Annexin V / nükleer leke ile apoptoz ölçümü
- 1 mL Annexin bağlayıcı tampona 2 damla nükleer leke (40 μL) ekleyin. 100 μL çözeltiyi 7 mm cam tabanlı doku kültürü ile muamele edilmemiş bir Petri kabına alın.
- Sitokinlerle inkübasyondan 24 saat sonra, 10 μl mikropipet kullanarak üç kez yukarı ve aşağı pipetleyerek PBS'deki her tedaviden en az 6 adacık 3 kez yukarı ve aşağı pipetleyerek dikkatlice durulayın. Adacıkları nükleer leke solüsyonu ile cam tabanlı Petri kabına aktarın ve karanlıkta 37 ° C'de 40 dakika inkübe edin (folyo ile örtün).
- 25 dakikalık inkübasyondan sonra, her bir cam tabanlı petri kabına 5 μL Annexin V Alexa Flour 488 konjugatı ekleyin ve inkübasyona devam edin. Toplam inkübasyon süresi nükleer leke için 40 dakika ve Annexin V için 15 dakikadır.
- 40 dakikalık inkübasyondan sonra, adacıkları 7 mm'lik cam tabanlı bir Petri kabında taze bir BMHH görüntüleme tamponuna (Annexin V veya nükleer leke olmadan) aktarın.
- 40x suya daldırma objektifi ile floresan mikroskobu kullanarak görüntü çekin. Nükleer leke (460 nm) ve Annexin V konjugatının (515 nm) floresan emisyonlarını tespit etmek için sırasıyla 405 nm ve 488 nm'de uyarma lazerleri kullanın.
- 10 μm aralıklı üç görüntüden oluşan bir z yığını olarak görüntü adacıkları. Adacıktaki ışık saçılımı sorunlarından kaynaklanan sinyal kaybını azaltmak için adacığın yalnızca alt 1/3 - 1/2'sini görüntüleyin.
- Canlı mavi (nükleer leke pozitif) ve apoptotik yeşil (Annexin V-pozitif) hücreleri ImageJ'de (NIH) fare başına en az 5 adacık için manuel olarak sayın (n = 3). Apoptotik adacık hücrelerinin yüzdesini aşağıdaki gibi hesaplayın:
apoptotik hücrelerin yüzdesi = apoptotik hücrelerin sayısı / (apoptotik hücre sayısı + canlı hücre sayısı) x %100
6. Zn2 + seçici gösterge / nükleer leke / PI kullanarak β hücreli ölüm ölçümü
- 0.2 μM'lik bir nihai konsantrasyon elde etmek için 998 μL BMHH görüntüleme tamponuna 2 μL Zn2+ seçici indiatör stok çözeltisi ekleyin. 500 μL boyama solüsyonunu 14 mm cam tabanlı doku kültürü ile muamele edilmemiş bir Petri kabına ekleyin.
- Sitokinlerle inkübasyondan 24 saat sonra, her tedaviden en az 6 adacığı cam tabanlı Petri kabına dikkatlice aktarın. Zn2+ seçici indikatör çözeltisi (folyo ile örtün) ile karanlıkta 37 ° C'de 1 saat inkübe edin.
- 20 dakikalık inkübasyondan sonra, üreticinin talimatlarına göre her cam tabanlı Petri kabına bir damla nükleer leke (20 μl) ekleyin ve inkübasyona devam edin. Toplam inkübasyon süresi Zn2+ seçici indikatör için 1 saat ve nükleer leke için 40 dakikadır.
- 1 saatlik inkübasyondan sonra, adacıkları 7 mm'lik cam tabanlı doku kültürü ile muamele edilmemiş bir Petri kabında %0.1 BSA (100 μL) içeren taze bir BMHH görüntüleme tamponuna aktarın. 20 μg / mL'lik bir nihai konsantrasyon elde etmek için 10 dakika boyunca 2 μL PI stok çözeltisi ekleyin.
- 40x suya daldırma objektifi ile floresan mikroskobu kullanarak PI boyamadan sonraki 15 dakika içinde görüntü çekin. Nükleer leke (405 nm), Zn488 + seçici gösterge (514 nm) ve PI'nin (460 nm) floresan emisyonlarını tespit etmek için 2 nm, 516 nm ve 620 nm'de uyarma lazerleri kullanın.
- 10 μm aralıklı üç görüntüden oluşan bir z yığını olarak görüntü adacıkları. Adacıktaki ışık saçılımı sorunlarından kaynaklanan sinyal kaybını azaltmak için adacığın yalnızca alt 1/3 - 1/2'sini görüntüleyin.
- Fare başına en az 5 adacık (n = 3) için ImageJ'de (NIH) canlı mavi (nükleer leke pozitif), Çinko yeşili (Zn2+ seçici gösterge-pozitif) ve ölü kırmızı (PI pozitif) hücreleri manuel olarak sayın. β hücreli ölümün yüzdesini aşağıdaki gibi hesaplayın:
β hücre ölümünün yüzdesi = çinko pozitif ve PI pozitif hücre sayısı / (ölü + canlı adacık hücrelerinin sayısı) x% 100
veya
β hücre ölümünün yüzdesi = çinko pozitif ve PI pozitif hücre sayısı / (çinko pozitif hücre sayısı) x %100
Sonuçlar
Sitokinlerle muamele edilen adacıkların canlılığını değerlendirmek için FDA ve PI ile ikili boyama kullanıldı. Tüm deneyler üç nüsha (n = 3) halinde gerçekleştirildi ve veriler, tedavi edilen ve edilmeyen adacıklar arasında tekrarlanabilirlik ve istatistiksel karşılaştırma sağlamak için her biri 5 veya 6 adacıktan ortalama veri içeren 10 μm aralıklı çoklu z-yığını görüntüsünden üretildi. Şekil 1A , FDA'nın enzimatik olarak aktif hücreler tarafından floreseine dönüştürülmesi nedeniyle farklı yeşil floresan sergileyen tedavi edilmemiş kontrol grubundan sağlıklı adacıkları göstermektedir. Kırmızı floresanın yokluğu veya minimal varlığı, bu adacıkların canlılığını doğrular ve sağlam hücre zarlarını gösterir. Buna karşılık, Şekil 1B , sitokin ile muamele edilmiş adacıklarda, zar bütünlüğü bozulmuş ölü veya ölmekte olan hücreleri işaretleyen önemli kırmızı floresan göstermektedir. Kırmızı floresandaki bu artış, zar bozulması olan canlı olmayan hücrelerde çekirdeklerin PI boyamasını vurgular. Sitokin konsantrasyonunun adacık canlılığı üzerindeki etkisi Şekil 1C'de gösterilmiştir. Kantitatif veriler, adacık ölüm hızı ile artan sitokin konsantrasyonları (0.1x-1x RCC) arasında pozitif bir korelasyon olduğunu ortaya koymaktadır. Bu doza bağlı yanıt, daha yüksek sitokin maruziyetine sahip PI ile boyanmış hücrelerde artan kırmızı floresan ile kanıtlandığı gibi, sitokinlerin adacık hücreleri üzerindeki sitotoksik etkilerinin altını çizer.
Sitokin ile indüklenen apoptozu ölçmek için, tedavi edilmemiş ve sitokin ile tedavi edilmiş adacık hücreleri, apoptotik ve canlı hücreleri ölçmek için YOPRO-1 ve nükleer boyama ile boyandı. Şekil 2A, çekirdekte güçlü mavi floresansın gözlendiği, yeşil floresan olmayan, canlı, apoptotik olmayan bir hücreyi gösteren, işlenmemiş kontrol kabından apoptotik olmayan bir hücrenin temsili bir görüntüsünü göstermektedir. Şekil 2B, mavi nükleer boyamanın yanı sıra YOPRO-1'den farklı yeşil floresan ile sitokin ile muamele edilmiş adacıkları sunmaktadır. Bu ikili floresan, YOPRO-1 stresli hücre zarlarına nüfuz ettiği için apoptozu doğrular. Kantitasyon, pankreas adacıklarının %30'undan fazlasının sitokin maruziyetinden sonraki 24 saat içinde apoptoz gösterdiğini ortaya koydu (Şekil 2C). Apoptozu daha da doğrulamak için Annexin-V boyaması yapıldı, bu da adacıkların yaklaşık% 40'ının Annexin-V için pozitif olarak boyandığını ve hem erken apoptotik hücreleri hem de apoptoz yoluyla ilerleyenleri yakaladığını gösterdi (Şekil 2D-F).
Son olarak, sitokinlere yanıt olarak pankreas β hücre ölüm oranını değerlendirmek için, tedavi edilmemiş ve sitokin ile tedavi edilmiş adacıkları Zn2+ seçici indikatör, nükleer boyama ve PI ile boyadık (Şekil 3A,B). Sonuçlarımız, Zn2 + seçici göstergesi ile ayrı bir noktasal boyama modeli gösterdi, bu da Zn2 + seçici göstergesinin salgı granüllerinde insülin ile ilişkili serbest ve gevşek bağlı çinkoya bağlı olduğunu gösterdi. Ek olarak, bu boyalarla üçlü boyama, farklı floresan kanallarının (nükleer boyama için mavi, PI için kırmızı ve Zn2+ seçici gösterge için yeşil) kombinasyonuna izin vererek, bir floresan mikroskobu altında hassas, çoğullanmış görselleştirmeyi mümkün kılar, sadece canlı hücreleri ölü hücrelerden değil, aynı zamanda insülin üreten β hücrelerinin spesifik ölümünü de ayırt etmeyi kolaylaştırır. Ayrıca, β hücreli ölümün, toplam β hücreli, ölü hücreli veya adacık hücresi sayısının bir kısmı olarak tanımlayıcı nicelleştirilmesi için veri sağlar. Şekil 3C, sitokinlerin β hücrelerinde daha fazla tahribata neden olduğunu ve sağlıklı adacıklarla ko-kültürden 24 saat sonra insülin üreten hücrelerin yaklaşık% 63'ünü yok ettiğini göstermektedir.

Şekil 1: Sitokin aracılı ölümü değerlendirmek için floresein diasetat (yeşil) ve propidyum iyodür (kırmızı) ile adacıkların ikili boyanması. (A) İşlenmemiş fare adacıklarının ve (B) floresein diasetat (yeşil) ve propidyum iyodür (kırmızı) ile boyanmış sitokin ile muamele edilmiş adacıkların temsili floresan mikroskobu görüntüleri. (C) Değişen nispi sitokin konsantrasyonları (0.1x kırmızı kareler, 0.5x yeşil üçgenler ve 1x RCC mavi üçgenler) ve işlenmemiş adacıklar (siyah daireler) ile muamele edilen fare adacıklarının yüzde canlılığı. 1x RCC = 10 ng/mL TNF-α, 5 ng/mL IL-1β ve 100 ng/mL IFN-γ. Ölçek çubuğu = 10 μm. Her veri noktası bir adacıktır. Veriler ortalama ± SEM olarak sunulmuştur. *p < 0.05 ve ***p < 0.001, Tukey'in post-hoc analizi ile ANOVA'ya dayalı istatistiksel anlamlılığı göstermektedir (n=3). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
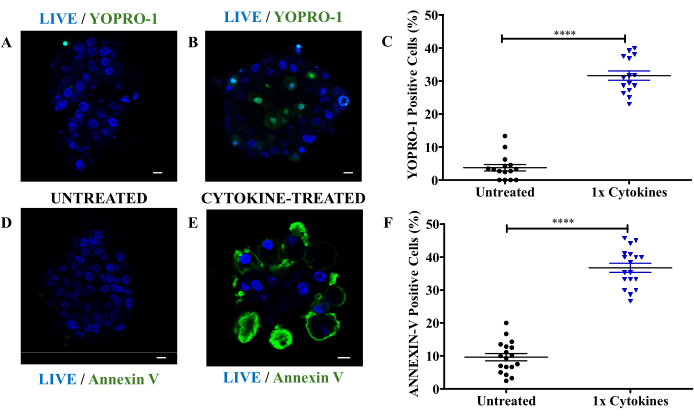
Şekil 2: Sitokin kaynaklı apoptozun belirteçleri olarak YOPRO-1 ve Annexin-V ile adacıkların boyanması. (A) İşlenmemiş fare adacıklarının ve (B) nükleer leke (mavi) ve YOPRO-1 (yeşil) ile boyanmış sitokin ile muamele edilmiş adacıkların temsili floresan mikroskobu görüntüleri. Ölçek çubuğu = 10 μm. (C) Sitokin ile muamele edilmiş adacıklardaki (1x RCC mavi üçgenler) ve işlenmemiş adacıklardaki (siyah daireler) YOPRO-1 pozitif hücrelerin yüzdesi. (D) İşlenmemiş fare adacıklarının ve (E) nükleer leke (mavi) ve Annexin V (yeşil) ile boyanmış sitokin ile muamele edilmiş adacıkların temsili floresan mikroskobu görüntüleri. (F) Sitokin ile muamele edilmiş adacıklardaki (1x RCC mavi üçgenler) ve işlenmemiş adacıklardaki (siyah daireler) Annexin-V pozitif hücrelerin yüzdesi. 1x RCC = 10 ng/mL TNF-α, 5 ng/mL IL-1β ve 100 ng/mL IFN-γ. Ölçek çubuğu = 10 μm. Her veri noktası bir adacıktır. Veriler ortalama ± SEM olarak sunulmuştur. ****p<0.0001, bağımsız Welch t-testine (n = 3) dayalı istatistiksel anlamlılığı göstermektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
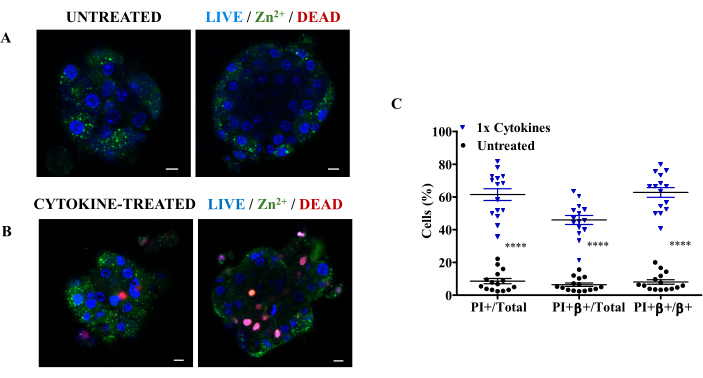
Şekil 3: Spesifik pankreas β hücre ölümünün değerlendirilmesi için nükleer leke (mavi), Zn2+ seçici gösterge (yeşil) ve propidyum iyodür (Kırmızı) ile adacıkların üçlü boyanması. (A) (A) işlenmemiş fare adacıklarının ve (B) sitokin ile tedavi edilmiş adacıkların 10 μm aralıklı farklı z-yığınlarında temsili floresan mikroskobu görüntüleri. (C) Sitokin ile tedavi edilmiş adacıklarda β hücresinin yüzde ölümü (1x RCC). 1x RCC = 10 ng/mL TNF-α, 5 ng/mL IL-1β ve 100 ng/mL IFN-γ. Ölçek çubuğu = 10 μm. PI+ = Toplam ölü hücreler, PI+β+ = Ölü β hücreleri ve β+ = Toplam (ölü ve canlı) β hücreleri. Her veri noktası bir adacıktır. Veriler ortalama ± SEM olarak sunulmuştur. ****p<0.0001, bağımsız Welch t-testine (n = 3) dayalı istatistiksel anlamlılığı göstermektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Floresan Probu | Eski/Em (nm) | Belirtilen hücre durumu |
| Floresein diasetat (FDA) | 488/520 | Canlı hücreler |
| Propidyum iyodür (PI) | 535/620 | Ölü hücreler |
| Ek V AlexaFluor 488 | 488/515 | Apoptotik hücreler |
| YO-PRO-1 Serisi | 488/509 | Erken apoptotik hücreler |
| Nükleer leke (Hoechst 33342) | 360/460 | Canlı hücreler |
| Zn2+ seçici gösterge | 488/516 | Çinko içeren hücreler |
Tablo 1: Bu protokolde kullanılan floresan probların listesi, uyarılmaları/emisyonları ve pozitif boyama ile gösterilen hücre durumu.
Tartışmalar
Bu çalışma, sitokin kaynaklı stres altında adacık hücresi canlılığını, apoptozu ve β hücre sağkalımını değerlendirmede floresan boyalar ve konfokal mikroskopi ile çoklu boyama yöntemlerinin etkinliğini göstermektedir. FDA / PI boyama, sitokinlerin hücre canlılığı üzerindeki sitotoksik etkisini doğrulayan, zarla baskılanmış hücreleri işaretleyen kırmızı floresan ile açıkça görüldüğü gibi, sitokinlere maruz kalan adacıklar içinde hücre ölümünde doza bağlı bir artış ortaya çıkardı. FDA / PI boyama ayrıca insan adacıklarındaki canlı ve ölü hücreleri tanımlar ve insan adacık hazırlama canlılığının hızlı bir kalitatif değerlendirmesini sunar7. Bu nedenle, bu boyama yöntemi, enflamatuar koşullarda hücre canlılığını değerlendirmek için güvenilirdir. Bu sonuç aynı zamanda, uzun süreli sitokin maruziyetinin β hücre fonksiyonu ve sağkalım için zararlı olduğu diyabet patofizyolojisinde sitokinlerin rolünü de güçlendirmektedir 5,19.
YOPRO-1 / nükleer lekeleri ve Annexin-V / nükleer lekeleri, sitokin kaynaklı apoptoz hakkında ek bilgiler sağlamıştır. Sitokin ile tedavi edilen adacıklar, apoptotik hücrelerle ilişkili ölü hücrelerin göstergesi olan artmış yeşil floresan gösterdi. Annexin-V ayrıca erken ve ilerleyen apoptotik hücrelerin varlığını da doğruladı. Birlikte, bu boyama teknikleri, β hücrelerinde apoptozu etkili bir şekilde karakterize eder ve apoptozu proinflamatuar sitokinlere maruz kaldığında adacık hücresi ölümünün birincil mekanizması olarak doğrular3.
Apoptotik sinyal iletim yollarını bozabilen protein kinaz inhibitörlerinin yanı sıra proinflamatuar sitokinlerin etkilerine karşı antikorlar ve antagonistler, β hücreli apoptozu önleyebilecek umut verici terapötikler olarak araştırılmaktadır 5,20,21. Bu araştırma faaliyetleri, diyabet modellerinde β hücre fonksiyonunu korumaya odaklanarak, sitokin kaynaklı apoptozu hafifletmek için potansiyel müdahaleleri değerlendirmek için floresan tabanlı mikroskopi kullanır. Zn2 + seçici indikatör boyamayı daha da dahil ederek, bu yaklaşım, insülin üreten β hücrelerinin çinko birleşmesi yoluyla seçici olarak görselleştirilmesini sağlar, adacıklar içindeki β hücre popülasyonları üzerindeki sitokin etkilerinin hedefli bir görünümünü sağlar ve analizinözgüllüğünü arttırır 16. Bu yaklaşım, β hücreleri diğer adacık hücrelerinden ayırdı ve çalışmamızda sitokin maruziyetinden sonra β hücrelerinin yaklaşık %63'ü ile önemli β hücre yıkımı ortaya çıkardı. Bu özgüllük, β hücreli korumayı değerlendirmek için kritik öneme sahiptir ve diyabet yönetiminde koruyucu stratejilere olan ihtiyacı daha da vurgulamaktadır.
Bu sonuçlar, adacık ölümünü değerlendirmede FDA/PI, YOPRO-1/nükleer leke ve Zn2+ seçici gösterge/nükleer boya/PI boyamanın çok yönlülüğünün altını çizmektedir. Bu protokoldeki kritik bir adım, veri toplamada spektral örtüşmeyi en aza indirmek için uygun floresan prob kombinasyonunun seçilmesidir. Tablo 1, bu protokolde gösterilen tüm floresan probları, ilgili uyarma ve emisyon maksimumları ve her bir lekenin gösterdiği hücre durumu (canlı/ölü/apoptotik) ile birlikte özetlemektedir. Canlı, ölü veya apoptotik hücreleri doğru bir şekilde ölçmek için boyalar arasındaki spektral örtüşmeyi en aza indirmek için uyarma ve emisyon filtrelerinin optimizasyonu gerekebilir. Ek olarak, izole edilmiş adacıkların canlılığı zamanla hızla azalır, bileşiklerin adacık canlılığı üzerindeki etkilerini analiz etmede en iyi sonuçlar için, deneyler izolasyondan sonraki 72 saat içinde yapılmalıdır. Bu çalışma, hücre canlılığı, apoptoz ve β hücreye özgü ölüm hakkında kesin, tekrarlanabilir veriler sağlayarak, bu tekniklerin diyabette sitokin toksisitesini azaltmayı ve β hücre fonksiyonunu korumayı amaçlayan terapötik müdahaleler geliştirmedeki potansiyelini göstermektedir. Laboratuvarımızdan yayınlanan çalışmalar, küçük bir molekül inhibitörü 5,21 varlığında β hücre canlılığı ve apoptoza karşı koruma hakkında nicel veriler sağlamak için bu yaklaşımı kullanmıştır.
Bu protokolün bir sınırlaması, beta hücresi apoptotik ölümünün boyanmasının yalnızca YOPRO-1 veya Annexin-V floresan boyaları ile spektral olarak örtüşmeyen ek beta hücresine özgü belirteçler kullanılarak elde edilebilmesidir. Alternatif olarak, apoptoza özgü promotörlere sahip insülin-cre raportör fareler gibi daha sağlam ancak pahalı raportör fare hatları da benimsenebilir. Bu nakavt modeli, insülin eksprese eden pankreas beta hücrelerinde apoptozu görselleştirmek için insülin promotörü güdümlü bir Cre-rekombinazı tdTomato ve GFP gibi bir raportör sistemle birleştirir. Diğer bir sınırlama, adacık görüntülerinin manuel olarak sayılmasının zaman alıcı olması ve düşük verime sahip olmasıdır. Laboratuvarımızda otomatik canlı/ölü hücre ölçümü sağlamak için uygun bir ImageJ eklentisi geliştirme çabaları devam ederken, ImageJ (NIH) veya diğer ticari olarak mevcut hücre sayma yazılımlarını kullanan şu anda mevcut olan hücre sayım eklentileri, hücre çekirdeklerini tanımlayan ve tek tek hücreler arasında ayırt edilebilir sınırlara sahip nükleer leke ve PI gibi boyalarla en iyi şekilde çalışır. FDA ve AnnexinV gibi boyalar daha seyrek zorlanmaya sahiptir, bu da otomatik yazılımla sayım yaparken hücreler arasındaki sınırları belirlemeyi zorlaştırır.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Aşağıdaki hibeler bu çalışma için fon sağlamıştır: NIDDK ödülü R01 DK137221, JDRF 3-SRA-2023-1367-S-B'den NLF'ye ve ADA 7-20-JDF-020'den NLF'ye Yazarlar, Colorado Üniversitesi Anschutz Kampüsü P30-DK116073'daki Diyabet Araştırma Merkezi'nden ve bu çalışmayı desteklemek için kullanılan ilgili temel tesislerden destek almak isterler.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 14 mm glass-bottom Petri dish | Mattek | P35G-1.5-14-C | |
| 1640 RPMI | Corning | 10-041-CV | |
| 35 mm Petri dish | Celltreat | 229638 | |
| 7 mm glass-bottom Petri dish | Mattek | P35G-1.5-7-C | |
| Annexin V, Alexa Flour 488 | Thermo Fisher (Invitrogen) | A13201 | ex488/em515 |
| Calcium Chloride Dihydrate | Fisher | C79 | |
| Dimethyl Sulfoxide Anhydrous | Sigma | 276855 | |
| Fetal Bovine Serum | Thermo Fisher (Gibco) | 26140079 | |
| Flouzin-3, AM | Thermo Fisher (Invitrogen) | F24195 | ex488/em516 |
| Fluorescein Diacetate (FDA) | Thermo Fisher (Invitrogen) | F1303 | ex488/em520 |
| HEPES | Sigma | 54457 | |
| Image processing software | NIH | ImageJ | |
| Magnesium Chloride | Sigma | M8266 | |
| NucBlue Live ReadyProbes Reagent (Hoechst 33342) | Thermo Fisher (Invitrogen) | R37605 | ex360/em460 |
| Penicillin-Streptomycin | Thermo Fisher (Gibco) | 15-140-122 | |
| Phosphate-buffered Saline Tablets | Fisher | BP2944-100 | |
| Potassium Chloride, Granular | Macron | 6858-04 | |
| Propidium iodide | Thermo Fisher (Invitrogen) | P1304MP | ex535/em620 |
| Protein Recombinant Mouse IFN-gamma Protein | R&D Systems | 485-MI-100/CF | |
| Recombinant Mouse IL-1 beta/IL-1F2 | R&D Systems | 401-ML-100/CF | |
| Recombinant Mouse TNF-alpha (aa 80-235) Protein | R&D Systems | 410-MT-100/CF | |
| Sodium Chloride, Crystal | Macron | 7581-12 | |
| Stellaris Confocal microcope with spectral detectors | Leica | DMI-8 | 40x water immersion objective. |
| Yopro-1 Iodide | Thermo Fisher (Invitrogen) | Y3603 | ex488/em509 |
Referanslar
- Da Silva Xavier, G. The cells of the islets of Langerhans. J Clinical medicine. 7 (3), 54 (2018).
- Grunnet, L. G., et al. Proinflammatory cytokines activate the intrinsic apoptotic pathway in β-cells. Diabetes. 58 (8), 1807-1815 (2009).
- Delaney, C. A., Pavlovic, D., Hoorens, A., Pipeleers, D. G., Eizirik, D. c. L. Cytokines induce deoxyribonucleic acid strand breaks and apoptosis in human pancreatic islet cells. Endocrinology. 138 (6), 2610-2614 (1997).
- Farnsworth, N. L., et al. Modulation of gap junction coupling within the islet of langerhans during the development of type 1 diabetes. Front Physiol. 13, 913611 (2022).
- Collins, J., et al. Cleavage of protein kinase c δ by caspase-3 mediates proinflammatory cytokine-induced apoptosis in pancreatic islets. J Biol Chem. 300 (9), 107611 (2024).
- Farnsworth, N. L., Walter, R., Piscopio, R. A., Schleicher, W. E., Benninger, R. K. Exendin-4 overcomes cytokine-induced decreases in gap junction coupling via protein kinase A and Epac2 in mouse and human islets. J Physiol. 597 (2), 431-447 (2019).
- NIH CIT Consortium Chemistry Manufacturing Controls Monitoring Committee. Purified human pancreatic islet-viability estimation of islet using fluorescent dyes (FDA/PI): Standard operating procedure of the NIH clinical islet transplantation consortium. CellR4 Repair Replace Regen Reprogram. 3 (1), e1378 (2015).
- Vermes, I., Haanen, C., Steffens-Nakken, H., Reutellingsperger, C. A novel assay for apoptosis flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled annexin V. J Immunol Meth. 184 (1), 39-51 (1995).
- Rieger, A. M., Nelson, K. L., Konowalchuk, J. D., Barreda, D. R. Modified annexin V/propidium iodide apoptosis assay for accurate assessment of cell death. J Vis Exp. (50), e2597 (2011).
- Emdin, S., Dodson, G., Cutfield, J., Cutfield, S. Role of zinc in insulin biosynthesis: some possible zinc-insulin interactions in the pancreatic B-cell. Diabetologia. 19, 174-182 (1980).
- ZA, L. A simple method of staining fresh and cultured islets. Transplantation. 45 (4), 827-830 (1988).
- Zalewski, P. D., et al. Video image analysis of labile zinc in viable pancreatic islet cells using a specific fluorescent probe for zinc. J Histochem Cytochem. 42 (7), 877-884 (1994).
- Jindal, R. M., Taylor, R. P., Gray, D. W., Esmeraldo, R., Morris, P. J. A new method for quantification of islets by measurement of zinc content. Diabetes. 41 (9), 1056-1062 (1992).
- Jayaraman, S. A novel method for the detection of viable human pancreatic beta cells by flow cytometry using fluorophores that selectively detect labile zinc, mitochondrial membrane potential and protein thiols. Cytometry A. 73 (7), 615-625 (2008).
- Lukowiak, B., et al. Identification and purification of functional human β-cells by a new specific zinc-fluorescent probe. J Histochem Cytochem. 49 (4), 519-527 (2001).
- Gee, K. R., Zhou, Z. L., Qian, W. J., Kennedy, R. Detection and imaging of zinc secretion from pancreatic β-cells using a new fluorescent zinc indicator. J Am Chem Soc. 124 (5), 776-778 (2002).
- Gyulkhandanyan, A. V., Lee, S. C., Bikopoulos, G., Dai, F., Wheeler, M. B. The Zn2+-transporting pathways in pancreatic β-cells: a role for the L-type voltage-gated Ca2+ channel. J Biol Chem. 281 (14), 9361-9372 (2006).
- Chen, J., et al. A murine pancreatic islet cell-based screening for diabetogenic environmental chemicals. J Vis Exp. (136), e57327 (2018).
- Farnsworth, N. L., Walter, R. L., Hemmati, A., Westacott, M. J., Benninger, R. K. Low level pro-inflammatory cytokines decrease connexin36 gap junction coupling in mouse and human islets through nitric oxide-mediated protein kinase Cδ. J Biol Chem. 291 (7), 3184-3196 (2016).
- Dalle, S., Abderrahmani, A., Renard, E. Pharmacological inhibitors of β-cell dysfunction and death as therapeutics for diabetes. Front Endocrinol. 14, 1076343 (2023).
- Collins, J., et al. Peptide-coated polycaprolactone-Benzalkonium chloride nanocapsules for targeted drug delivery to the pancreatic β-Cell. ACS Appl Bio Mater. 7 (10), 6451-6466 (2024).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır