Method Article
Trattamento isolato delle isole pancreatiche e misurazione dell'apoptosi
In questo articolo
Riepilogo
Questo studio utilizza marcatori di morte cellulare e apoptosi basati sulla fluorescenza multi-colorazione combinati con la microscopia confocale per valutare l'apoptosi indotta da citochine e la morte specifica delle cellule β nelle isole pancreatiche. Rivela cambiamenti spaziali e temporali nella morte cellulare e nell'apoptosi in risposta a stimoli extracellulari.
Abstract
Questo studio indaga l'effetto delle citochine pro-infiammatorie sulle isole pancreatiche, in particolare sulle cellule β produttrici di insulina, utilizzando una combinazione di tecniche di colorazione a fluorescenza e microscopia confocale per valutare la vitalità cellulare, l'apoptosi e la morte specifica per β cellule. Le isole di topo isolate sono state trattate con concentrazioni variabili di un cocktail di citochine, tra cui TNF-α, IL-1β e IFN-γ, per imitare l'apoptosi immuno-mediata durante lo sviluppo del diabete di tipo 1. La vitalità delle cellule insulari è stata valutata con la doppia colorazione FDA/PI, dove la conversione della FDA in fluoresceina indicava cellule vitali e cellule compromesse dalla membrana marcate con PI. YOPRO-1 e la colorazione nucleare hanno fornito ulteriori dati sull'apoptosi, con l'annessina-V che conferma le cellule apoptotiche precoci. L'analisi quantitativa ha rivelato aumenti significativi dei tassi di apoptosi e di mortalità cellulare nelle isole trattate con citochine. Per valutare in modo specifico gli effetti sulle cellule β, è stata utilizzata la colorazione selettiva con indicatore Zn2+ per marcare le cellule produttrici di insulina attraverso l'associazione zinco nei granuli di insulina, rivelando una sostanziale perdita di cellule β dopo il trattamento delle isole con citochine pro-infiammatorie per 24 ore. Questi protocolli multi-colorazione catturano e quantificano efficacemente l'entità del danno indotto dalle citochine nelle isole e possono essere utilizzati per valutare le terapie progettate per prevenire l'apoptosi β cellulare nel diabete di tipo 1 precoce.
Introduzione
Le isole pancreatiche, note anche come isole di Langerhans, sono un insieme di cellule endocrine situate all'interno del pancreas. Le cellule β produttrici di insulina sono il componente più abbondante e funzionalmente significativo delle isole pancreatiche. Queste cellule β secernono insulina, un ormone che svolge un ruolo fondamentale nel mantenimento dell'omeostasi del glucosio1. Nel diabete di tipo 1 (T1D), il sistema immunitario prende di mira e si infiltra nelle isole pancreatiche, distruggendo le cellule β produttrici di insulina. Questo attacco autoimmune è mediato principalmente da citochine pro-infiammatorie, tra cui l'interleuchina-1β (IL-1β), il fattore di necrosi tumorale-alfa (TNF-α) e l'interferone-gamma (IFN-γ)2. Queste citochine avviano una cascata di eventi di segnalazione all'interno delle cellule β che alla fine innescano l'apoptosi3. L'apoptosi, la morte cellulare programmata, è un processo strettamente regolato che coinvolge l'attivazione delle caspasi, la frammentazione del DNA e la disintegrazione cellulare. Contribuisce alla graduale perdita della massa e della funzione delle cellule β durante l'insorgenza del T1D3.
Comprendere i meccanismi molecolari che guidano l'apoptosi β cellulare è fondamentale per identificare strategie per prevenire o mitigare la distruzione delle cellule β nel T1D. Per raggiungere questo obiettivo, le isole pancreatiche isolate da modelli sperimentali o cadaveri umani fungono da sistema modello robusto e consolidato per lo studio della patologia β-cellulare 2,3. Trattando queste isole isolate con citochine pro-infiammatorie, i ricercatori possono replicare l'ambiente che caratterizza il T1D precoce, consentendo lo studio dettagliato della disfunzione e della morte delle cellule β in vitro 4,5. Questi esperimenti forniscono informazioni chiave sulla vulnerabilità e la sopravvivenza delle cellule β in condizioni associate alla malattia e servono anche come piattaforma per testare interventi terapeutici volti a proteggere o salvare le cellule β dall'apoptosi indotta dalle citochine. Utilizzando questo sistema in vitro, possiamo analizzare efficacemente come le isole di diverse specie rispondono a varie condizioni, fornendo una migliore comprensione delle variazioni funzionali e apoptotiche tra le specie.
Studi precedenti hanno dimostrato che le isole di topo e umane trattate per 24 ore con un cocktail (1x = 10 ng/mL di TNF-α, 5 ng/mL di IL-1β e 100 ng/mL di IFN-γ) di citochine di topo e di derivazione umana, rispettivamente, hanno provocato una morte significativa delle cellule insulari 4,5,6. La vitalità delle isole è stata confermata colorando le cellule trattate con citochine con fluoresceina diacetato (FDA) e ioduro di propidio (PI)5,6. A livello globale, la vitalità delle isole viene valutata utilizzando la tecnica standard di esclusione del colorante legante l'acido desossiribonucleico (DNA) con FDA e PI7. I coloranti fluorescenti o i substrati coniugati con colorante valutano la vitalità cellulare in base all'integrità e alla permeabilità della membrana. FDA, un colorante permeabile alle cellule, viene convertito dalle cellule viventi in fluorescenza verde (fluoresceina). Al contrario, il PI, un colorante cellulo-imponente, colora solo i nuclei delle cellule morte con membrane compromesse7. Le cellule vengono quindi analizzate attraverso l'imaging a due colori su un microscopio confocale, dove le lampade fluorescenti verdi e rosse contrassegnano rispettivamente le cellule vitali e quelle morte.
Il limite del protocollo di colorazione FDA/PI è che il PI entra solo nelle cellule che hanno perso la selettività della membrana, il che significa che non è in grado di distinguere le cellule apoptotiche precoci. Inoltre, questo metodo non è in grado di differenziare tra sottogruppi cellulari, il che lo rende inadatto per valutare selettivamente la vitalità β-cellulare. Il protocollo Annexin V/PI è comunemente usato per lo studio delle cellule apoptotiche e il protocollo è stato modificato per migliorarne l'accuratezza8. Le prime fasi dell'apoptosi comportano la traslocazione della fosfatidilserina dallo strato interno a quello esterno della membrana plasmatica. L'annessina V, una proteina calcio-dipendente, si lega con elevata affinità a questa fosfatidilserina esposta. La colorazione con PI viene condotta insieme all'annessina-V per distinguere le cellule apoptotiche (solo annessina V-positiva) dalle cellule necrotiche (positive sia per l'annessina-V che per il PI), poiché le cellule necrotiche mostrano anche fosfatidilserina a causa della compromissione dell'integrità della membrana9. Altri coloranti, come YOPRO-1, vengono utilizzati anche per quantificare l'apoptosi delle cellule insulari. La membrana cellulare delle cellule vitali è impermeabile a YOPRO-1, a differenza dell'annessina-V, che non è in grado di quantificare le cellule viventi in fase di apoptosi.
Per valutare la morte delle cellule β pancreatiche, sono necessari coloranti specifici che mirano solo alle cellule produttrici di insulina. Una caratteristica distintiva delle cellule β pancreatiche è che una porzione di Zn2+ intracellulare è immagazzinata in vescicole come un complesso Zn2+-insulina (rapporto 2:1)10. Lo Zn2+ libero esiste anche nello spazio extragranulare attorno alle celle β come serbatoi. Lo Zn2+ e lo Zn2+ liberi legati all'insulina in granuli secretori possono essere visualizzati utilizzando coloranti leganti lo zinco. Il ditizone, un colorante legante lo zinco, è comunemente usato per valutare la purezza delle isole, ma non può essere combinato con coloranti fluorescenti utilizzati per valutare la vitalità e la funzione delle cellule β11. Sonde UV come TSQ e Zinquin, che sono altamente selettive nei confronti dello Zn2+, sono state sviluppate per quantificare le cellule β mediante imaging e misurazione dello Zn2+ intracellulare libero; 12,13. Tuttavia, il loro uso è limitato dalla scarsa solubilità, dal carico irregolare delle cellule, dai requisiti di eccitazione UV e dalla compartimentazione in vescicole acide14. Anche le sonde fluorescenti a lunghezza d'onda visibile, come il verde di Newport e l'indicatore selettivo Zn2+, sono state sviluppate per superare queste limitazioni e sono ora ampiamente utilizzate per rilevare le cellule β in isole umane isolate15,16. FluoZin-3 (indicatore selettivo Zn2+) ha un'affinità per Zn2+ più elevata e una resa quantica superiore rispetto a Newport Green e si è dimostrato efficace per l'imaging di Zn2+ co-rilasciato con insulina in isole isolate14,17.
L'utilizzo di coloranti fluorescenti come FDA, PI, Annexina V, YOPRO-1 e Zn2+ consente la misurazione e la differenziazione tra cellule morte vitali, apoptotiche e totali. La combinazione di sonde compatibili e altamente selettive offre anche un metodo mirato per valutare e quantificare la vitalità e l'apoptosi delle cellule β, che è fondamentale per comprendere e mitigare la distruzione delle cellule β nella ricerca sul diabete e nello sviluppo di farmaci.
Protocollo
Tutti gli esperimenti con i topi sono stati approvati dal Comitato istituzionale per la cura e l'uso degli animali dell'Università del Colorado di Denver (Protocolli 000929). I topi C57Bl/6 utilizzati per questo esperimento sono stati acquistati dal Jackson Laboratory e alloggiati in una struttura a temperatura controllata con un ciclo luce/buio di 12 ore con accesso a cibo e acqua ad libitum. Le isole isolate di topo sono state ottenute utilizzando il protocollo di digestione della collagenasi, che è stato precedentemente descritto 5,18.
1. Preparazione di soluzioni e terreni di coltura
NOTA: I terreni di coltura, le scorte di citochine e altri reagenti devono essere preparati in condizioni sterili.
- Preparare un terreno di coltura delle isole aggiungendo il 10% di siero fetale bovino (FBS), 10.000 U/mL di penicillina e 10.000 μg/mL di streptomicina a 500 mL di terreno 1640 RPMI.
- Preparare 1 soluzione salina tamponata con fosfato (PBS), pH 7,4. Preparare una soluzione madre 1000x di cocktail di citochine di topo, 10 μg/mL di TNF-α 10μg/mL, 5 μg/mL di IL-1β e 100 μg/mL di IFN-γ in PBS sterile contenente lo 0,1% di albumina sierica bovina (BSA) e conservare la soluzione in aliquote da 10 μL a -20 °C.
- Preparare una soluzione madre FDA da 46 μM (50x) in acetone e conservarla in aliquote da 1 mL a -20°C. Preparare una soluzione madre di PI da 1,434 mM (50x) in PBS e conservarla in aliquote da 1 mL a 4 °C.
- Preparare 500 mL di tampone Krebs-Henseleit HEPES (BMHH) modificato con bicarbonato con 125 mM di NaCl, 5,7 mM di KCl, 2,5 mM di CaCl2, 1,2 mM di MgCl2 e 10 mM di HEPES in 500 mL di dH2O. Regolare il pH a 7,4.
- Preparare 100 mL di tampone legante l'Annessina-V con 10 mM di HEPES, 140 mM di NaCl e 2,5 mM di CaCl2 in 100 mL di dH2O. Regolare il pH a 7,4.
- Preparare 1 mM di soluzione madre per indicatore selettivo Zn2+ in DMSO e conservare in aliquote da 10 μl a -20 °C.
NOTA: I coloranti fluorescenti sono sensibili alla luce, quindi la conservazione e l'incubazione devono essere al buio.
2. Trattamento di isole isolate con citochine
- Isolare le isole di topo con una micropipetta da 10 μL nel terreno di coltura e incubare per una notte a 37 °C e 5% di CO2 per riprendersi dallo stress da isolamento prima del trattamento con citochine.
- Aggiungere 2 mL del terreno di coltura delle isole sterilizzato a piastre di Petri non trattate con colture tissutali da 35 mm ed etichettarle in modo appropriato per differenziare le piastre trattate con citochine e quelle non trattate senza citochine.
- Per le piastre trattate con citochine, rimuovere 6 μL di terreno di coltura e sostituirlo con 2 μL di ciascuna citochina dalla soluzione madre per ottenere una concentrazione relativa finale di citochine di 10 ng/mL, 5 ng/mL di IL-1β e 100 ng/mL di IFN-γ (1x RCC).
NOTA: L'RCC inferiore di 0,5x e 0,1x può essere preparato diluendo le soluzioni madre con PBS sterile contenente lo 0,1% di BSA rispettivamente a 1:1 e 1:9. - Alle 12 h-24 h dopo l'isolamento, prelevare 10-20 isole utilizzando una micropipetta al microscopio ottico e trasferirle nelle piastre e incubarle in un incubatore umidificato a 37 °C, CO2 al 5% per 24 h.
NOTA: Il tempo di incubazione può variare a seconda degli specifici obiettivi sperimentali.
3. Misurazione della vitalità delle isole con FDA/PI
- Aggiungere 20 μl di soluzioni madre FDA e PI a 960 μl del tampone BMHH contenente lo 0,1% di BSA per ottenere una concentrazione finale di 0,46 μM e 14,34 μM di coloranti fluorescenti, rispettivamente.
- Aliquotare 100 μl della soluzione colorante in una piastra di Petri non trattata con colture tissutali con fondo di vetro da 7 mm.
- A 24 ore dopo l'incubazione con citochine, trasferire con cura almeno 6 isole da ciascun trattamento nella capsula di Petri con fondo di vetro. Incubare per 5 - 10 minuti a temperatura ambiente al buio (coprire con un foglio).
- Scatta immagini utilizzando la microscopia a fluorescenza con un obiettivo a immersione in acqua 40x. Scatta le immagini entro 15 minuti dalla colorazione FDA/PI.
- Utilizzare laser di eccitazione a 488 nm e 514 nm per rilevare le emissioni di fluorescenza rispettivamente per FDA (520 nm) e PI (620 nm).
- Immagini di isolotti come z-stack composto da tre immagini, distanti 10 μm l'una dall'altra. Fotografare solo la parte inferiore 1/3 - 1/2 dell'isolotto per ridurre la perdita di segnale dovuta a problemi di dispersione della luce nell'isolotto.
- Contare manualmente le cellule verdi vive (FDA-positive) e rosse morte (PI-positive) in ImageJ (NIH) per almeno 5 isole per topo (n = 3). Calcola la percentuale di morte cellulare come segue:
percentuale di morte delle isole = numero di cellule morte/ (numero di cellule morte + numero di cellule vive) x 100%
4. Misurazione dell'apoptosi mediante colorazione
- Aggiungere 8 μL di YOPRO-1 (soluzione 1mM) a 992 μL di tampone di imaging BMHH per una concentrazione finale di 0,8 μM.
- Aliquotare 500 μl della soluzione colorante in una piastra di Petri da 14 mm con fondo di vetro non trattato con coltura tissutale.
- A 24 ore dall'incubazione con citochine, trasferire con cura almeno 6 isole di ciascun trattamento nella capsula di Petri con fondo di vetro e incubare per 1 ora a 37 °C al buio (coprire con un foglio).
- Dopo 20 minuti di incubazione, aggiungere una goccia di NucBlue (colorazione nucleare, 20 μL) a ciascuna capsula di Petri con fondo di vetro e continuare l'incubazione. Il tempo totale di incubazione è di 1 ora per YOPRO-1 e di 40 minuti per la colorazione nucleare.
- Dopo 1 ora di incubazione, trasferire le isole in un tampone di imaging BMHH fresco contenente lo 0,1% di BSA (100 μL) in una piastra di Petri da 7 mm con fondo di vetro non trattata con coltura tissutale.
- Scatta immagini utilizzando la microscopia a fluorescenza con un obiettivo a immersione in acqua 40x. Utilizzare laser di eccitazione a 405 nm e 488 nm per rilevare le emissioni di fluorescenza della colorazione nucleare (460 nm) e di YOPRO-1 (509 nm), rispettivamente.
- Immagini di isolotti come z-stack composto da tre immagini, distanti 10 μm l'una dall'altra. Fotografare solo la parte inferiore 1/3 - 1/2 dell'isolotto per ridurre la perdita di segnale dovuta a problemi di dispersione della luce nell'isolotto.
- Contare manualmente le cellule vive blu (positive alla colorazione nucleare) e verdi apoptotiche (YOPRO-1-positive) in ImageJ (NIH) per almeno 5 isole per topo (n = 3). Calcola la percentuale di cellule insulari apoptotiche come segue:
Percentuale di cellule insulari apoptotiche = Numero di cellule apoptotiche / (numero di cellule apoptotiche + numero di cellule vive) x 100%
5. Misurazione dell'apoptosi con annessina V/colorazione nucleare
- Aggiungere 2 gocce di colorante nucleare (40 μL) a 1 mL di tampone legante l'annessina. Aliquotare 100 μl della soluzione in una piastra di Petri non trattata con colture tissutali con fondo di vetro da 7 mm.
- A 24 ore dopo l'incubazione con citochine, sciacquare accuratamente pipettando su e giù almeno 3 volte almeno 6 isole da ciascun trattamento in PBS pipettando su e giù tre volte utilizzando la micropipetta da 10 μl. Trasferire le isole nella capsula di Petri con fondo di vetro con la soluzione di colorante nucleare e incubarle per 40 minuti a 37 °C al buio (coprire con un foglio).
- Dopo 25 minuti di incubazione, aggiungere 5 μL di Annessina V Alexa Flour 488 coniugato a ciascuna capsula di Petri con fondo di vetro e continuare l'incubazione. Il tempo totale di incubazione è di 40 minuti per la colorazione nucleare e di 15 minuti per l'annessina V.
- Dopo 40 minuti di incubazione, trasferire le isole in un tampone di imaging BMHH fresco (senza annessina V o colorazione nucleare) in una capsula di Petri con fondo di vetro da 7 mm.
- Scatta immagini utilizzando la microscopia a fluorescenza con un obiettivo a immersione in acqua 40x. Utilizzare laser di eccitazione a 405 nm e 488 nm per rilevare le emissioni di fluorescenza della colorazione nucleare (460 nm) e del coniugato di annessina V (515 nm), rispettivamente.
- Immagini di isolotti come z-stack composto da tre immagini, distanti 10 μm l'una dall'altra. Fotografare solo la parte inferiore 1/3 - 1/2 dell'isolotto per ridurre la perdita di segnale dovuta a problemi di dispersione della luce nell'isolotto.
- Contare manualmente le cellule vive blu (colorazioni nucleari positive) e verdi apoptotiche (annessina V-positiva) in ImageJ (NIH) per almeno 5 isole per topo (n = 3). Calcola la percentuale di cellule insulari apoptotiche come segue:
Percentuale di cellule apoptotiche = numero di cellule apoptotiche / (numero di cellule apoptotiche + numero di cellule vive) x 100%
6. Misurazione della morte β cellulare utilizzando l'indicatore selettivo Zn2+ / colorazione nucleare/PI
- Aggiungere 2 μL di soluzione madre per indicatore selettivo Zn2+ AM a 998 μL di tampone di imaging BMHH per ottenere una concentrazione finale di 0,2 μM. Aliquotare 500 μL della soluzione colorante in una piastra di Petri da 14 mm con fondo di vetro non trattata con coltura tissutale.
- A 24 ore dopo l'incubazione con citochine, trasferire con cura almeno 6 isole da ciascun trattamento nella capsula di Petri con fondo di vetro. Incubare per 1 ora a 37 °C al buio con la soluzione AM di indicatore selettivo Zn2+ (coprire con un foglio).
- Dopo 20 minuti di incubazione, aggiungere una goccia di colorante nucleare (20 μl) a ciascuna capsula di Petri con fondo di vetro, secondo le istruzioni del produttore e continuare l'incubazione. Il tempo totale di incubazione è di 1 ora per l'indicatore selettivo Zn2+ e di 40 minuti per la colorazione nucleare.
- Dopo 1 ora di incubazione, trasferire le isole in un tampone di imaging BMHH fresco contenente lo 0,1% di BSA (100 μL) in una piastra di Petri da 7 mm con fondo di vetro non trattata con coltura tissutale. Aggiungere 2 μL di soluzione madre PI per 10 minuti per ottenere una concentrazione finale di 20 μg/mL.
- Scatta immagini entro 15 minuti dalla colorazione PI utilizzando la microscopia a fluorescenza con un obiettivo a immersione in acqua 40x. Utilizzare laser di eccitazione a 405 nm, 488 nm e 514 nm per rilevare le emissioni di fluorescenza della colorazione nucleare (460 nm), dell'indicatore selettivo Zn2+ (516 nm) e del PI (620 nm), rispettivamente.
- Immagini di isolotti come z-stack composto da tre immagini, distanti 10 μm l'una dall'altra. Fotografare solo la parte inferiore 1/3 - 1/2 dell'isolotto per ridurre la perdita di segnale dovuta a problemi di dispersione della luce nell'isolotto.
- Contare manualmente le cellule vive blu (colorazione nucleare positiva), verde di zinco (Zn2+ indicatore selettivo positivo) e rosso morto (PI-positivo) in ImageJ (NIH) per almeno 5 isole per topo (n = 3). Calcola la percentuale di morte delle cellule β come segue:
percentuale di morte delle cellule β = numero di cellule zinco-positive e PI-positive / (numero di cellule insulari morte + cellule insulari vive) x 100%
o
percentuale di morte delle cellule β = numero di cellule zinco-positive e PI-positive / (numero di cellule zinco-positive) x 100%
Risultati
La doppia colorazione con FDA e PI è stata utilizzata per valutare la vitalità delle isole trattate con citochine. Tutti gli esperimenti sono stati condotti in triplicato (n = 3) e i dati sono stati generati da più immagini z-stack a 10 μm di distanza, con ciascuna replica contenente dati medi da 5 o 6 isole, per garantire la riproducibilità e il confronto statistico tra le isole trattate e non trattate. La Figura 1A mostra le isole sane del gruppo di controllo non trattato che mostrano una distinta fluorescenza verde dovuta alla conversione di FDA in fluoresceina da parte di cellule enzimaticamente attive. L'assenza o la minima presenza di fluorescenza rossa conferma la vitalità di queste isole, indicando la presenza di membrane cellulari intatte. Al contrario, la Figura 1B mostra una significativa fluorescenza rossa nelle isole trattate con citochine, marcando cellule morte o morenti con integrità della membrana compromessa. Questo aumento della fluorescenza rossa evidenzia la colorazione PI dei nuclei in cellule non vitali con rottura della membrana. L'impatto della concentrazione di citochine sulla vitalità delle isole è mostrato nella Figura 1C. I dati quantitativi rivelano una correlazione positiva tra il tasso di mortalità delle isole e l'aumento delle concentrazioni di citochine (0,1x-1x RCC). Questa risposta dose-dipendente sottolinea gli effetti citotossici delle citochine sulle cellule insulari, come evidenziato dall'aumento della fluorescenza rossa nelle cellule colorate con PI con maggiore esposizione alle citochine.
Per misurare l'apoptosi indotta da citochine, le cellule insulari non trattate e trattate con citochine sono state colorate con YOPRO-1 e colorante nucleare per quantificare le cellule apoptotiche e vitali. La Figura 2A mostra un'immagine rappresentativa di una cellula non apoptotica dalla capsula di controllo non trattata, dove si osserva una forte fluorescenza blu nel nucleo, senza fluorescenza verde, che indica una cellula vitale e non apoptotica. La Figura 2B presenta le isole trattate con citochine con una distinta fluorescenza verde da YOPRO-1 insieme a colorazione nucleare blu. Questa doppia fluorescenza conferma l'apoptosi, poiché YOPRO-1 permea le membrane cellulari stressate. La quantificazione ha rivelato che oltre il 30% delle isole pancreatiche ha mostrato apoptosi entro 24 ore dall'esposizione alle citochine (Figura 2C). La colorazione con annessina-V è stata eseguita per convalidare ulteriormente l'apoptosi, dimostrando che circa il 40% delle isole si colorava positivamente per l'annessina-V, catturando sia le cellule apoptotiche precoci che quelle che progredivano attraverso l'apoptosi (Figura 2D-F).
Infine, per valutare il tasso di mortalità pancreatica delle cellule β in risposta alle citochine, abbiamo colorato le isole non trattate e trattate con citochine con indicatore selettivo Zn2+ , colorazione nucleare e PI (Figura 3A, B). I nostri risultati hanno mostrato un discreto pattern di colorazione puntato con l'indicatore selettivo Zn2+ , indicando che l'indicatore selettivo Zn2+ è legato allo zinco libero e debolmente legato associato all'insulina nei granuli secretori. Inoltre, la tripla colorazione con questi coloranti consente la combinazione di canali di fluorescenza distinti (blu per la colorazione nucleare, rosso per PI e verde per l'indicatore selettivo Zn2+ ), consentendo una visualizzazione precisa e multiplex al microscopio a fluorescenza, facilitando la distinzione non solo delle cellule vive da quelle morte, ma anche della morte specifica delle cellule β produttrici di insulina. Fornisce inoltre dati per la quantificazione descrittiva della morte delle cellule β come frazione del numero totale di cellule β, cellule morte o cellule insulari. La Figura 3C mostra che le citochine causano una maggiore distruzione delle cellule β, distruggendo circa il 63% delle cellule produttrici di insulina entro 24 ore dalla co-coltura con isole sane.

Figura 1: Doppia colorazione delle isole con fluoresceina diacetato (verde) e ioduro di propidio (rosso) per valutare la morte mediata da citochine. (A) Immagini rappresentative al microscopio a fluorescenza di isole di topo non trattate e (B) isole trattate con citochine colorate con fluoresceina diacetato (verde) e ioduro di propidio (rosso). (C) Percentuale di vitalità delle isole di topo trattate con concentrazioni relative variabili di citochine (0,1x quadrati rossi, 0,5x triangoli verdi e 1x triangoli blu RCC) e isole non trattate (cerchi neri). 1x RCC = 10 ng/mL di TNF-α, 5 ng/mL di IL-1β e 100 ng/mL di IFN-γ. Barra di scala = 10 μm. Ogni punto dati è un'isoletta. I dati sono presentati come media ± SEM. *p < 0,05 e ***p < 0,001 indicano una significatività statistica basata sull'ANOVA con l'analisi post-hoc di Tukey (n = 3). Clicca qui per visualizzare una versione più grande di questa figura.
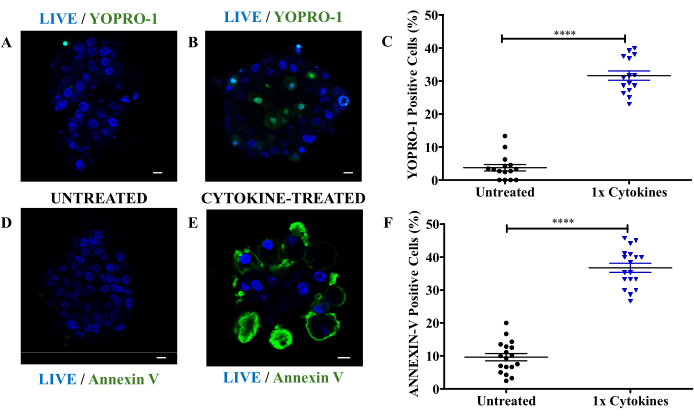
Figura 2: Colorazione di isole con YOPRO-1 e Annexina-V come marcatori di apoptosi indotta da citochine. (A) Immagini rappresentative al microscopio a fluorescenza di isole di topo non trattate e (B) isole trattate con citochine colorate con colorazione nucleare (blu) e YOPRO-1 (verde). Barra della scala = 10 μm. (C) Percentuale di cellule positive per YOPRO-1 nelle isole trattate con citochine (1x triangoli blu RCC) e nelle isole non trattate (cerchi neri). (D) Immagini rappresentative al microscopio a fluorescenza di isole di topo non trattate e (E) isole trattate con citochine colorate con colorazione nucleare (blu) e annessina V (verde). (F) Percentuale di cellule positive all'annessina-V nelle isole trattate con citochine (1x triangoli blu RCC) e nelle isole non trattate (cerchi neri). 1x RCC = 10 ng/mL di TNF-α, 5 ng/mL di IL-1β e 100 ng/mL di IFN-γ. Barra di scala = 10 μm. Ogni punto dati è un'isoletta. I dati sono presentati come media ± SEM. ****p<0,0001 indica la significatività statistica basata sul test t di Welch indipendente (n = 3). Clicca qui per visualizzare una versione più grande di questa figura.
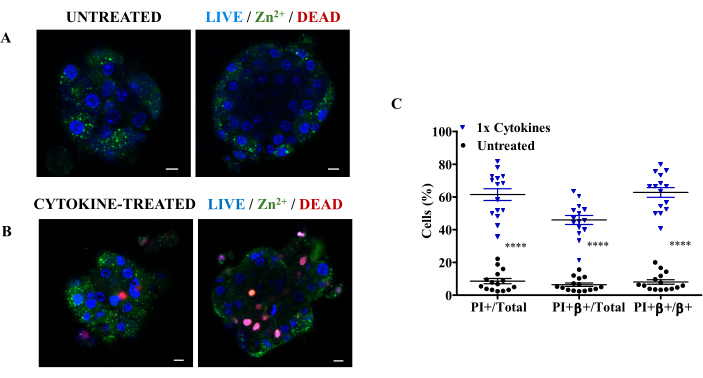
Figura 3: Tripla colorazione delle isole con colorazione nucleare (blu), indicatore selettivo Zn2+ (verde) e ioduro di propidio (rosso) per la valutazione della morte specifica delle cellule β pancreatiche. (A) Immagini rappresentative al microscopio a fluorescenza di (A) isole di topo non trattate e (B) isole trattate con citochine a diverse pile z di 10 μm di distanza. (C) Percentuale di morte delle cellule β nelle isole trattate con citochine (1x RCC). 1x RCC = 10 ng/mL di TNF-α, 5 ng/mL di IL-1β e 100 ng/mL di IFN-γ. Barra della scala = 10 μm. PI+ = Totale cellule morte, PI+β+ = Cellule β morte e β+ = Totale (morte e viva) β-cellule. Ogni punto dati è un'isoletta. I dati sono presentati come media ± SEM. ****p<0,0001 indica la significatività statistica basata sul test t di Welch indipendente (n = 3). Clicca qui per visualizzare una versione più grande di questa figura.
| Sonda fluorescente | Ex/Em (nm) | Stato della cella indicato |
| Fluoresceina diacetato (FDA) | 488/520 | Cellule vive |
| Ioduro di propidio (PI) | 535/620 | Cellule morte |
| Annexin V AlexaFluor 488 | 488/515 | Cellule apoptotiche |
| YO-PRO-1 | 488/509 | Cellule apoptotiche precoci |
| Colorante nucleare (Hoechst 33342) | 360/460 | Cellule vive |
| Indicatore selettivo Zn2+ | 488/516 | Cellule contenenti zinco |
Tabella 1: Elenco delle sonde fluorescenti utilizzate in questo protocollo, la loro eccitazione/emissione e lo stato cellulare indicato dalla colorazione positiva.
Discussione
Questo studio dimostra l'efficacia dei metodi di colorazione multipla con coloranti fluorescenti e microscopia confocale nella valutazione della vitalità delle cellule insulari, dell'apoptosi e della sopravvivenza delle cellule β in condizioni di stress indotto da citochine. La colorazione FDA/PI ha rivelato un aumento dose-dipendente della morte cellulare all'interno delle isole esposte alle citochine, come evidente dalla fluorescenza rossa che contrassegna le cellule compromesse dalla membrana, confermando l'effetto citotossico delle citochine sulla vitalità cellulare. La colorazione FDA/PI identifica anche le cellule vitali e morte nelle isole umane, offrendo una rapida valutazione qualitativa della vitalità della preparazione delle isole umane7. Pertanto, questo metodo di colorazione è affidabile per valutare la vitalità cellulare in condizioni infiammatorie. Questo risultato rafforza anche il ruolo delle citochine nella fisiopatologia del diabete, dove l'esposizione prolungata alle citochine è dannosa per la funzione delle cellule β e la sopravvivenza 5,19.
Le colorazioni nucleari YOPRO-1/ e le colorazioni nucleari Annexin-V/ hanno fornito ulteriori informazioni sull'apoptosi indotta da citochine. Le isole trattate con citochine hanno mostrato un aumento della fluorescenza verde indicativo di cellule morte associate a cellule apoptotiche. L'annessina-V ha anche confermato la presenza di cellule apoptotiche precoci e in progressione. Insieme, queste tecniche di colorazione caratterizzano efficacemente l'apoptosi nelle cellule β, convalidando l'apoptosi come meccanismo primario di morte delle cellule insulari quando esposte a citochine pro-infiammatorie3.
Gli inibitori delle protein chinasi che potrebbero interrompere le vie di trasduzione del segnale apoptotico, così come gli anticorpi e gli antagonisti contro le azioni delle citochine pro-infiammatorie, sono in fase di studio come terapie promettenti che potrebbero prevenire l'apoptosi βcellulare 5,20,21. Queste attività di ricerca impiegano la microscopia basata sulla fluorescenza per valutare potenziali interventi per mitigare l'apoptosi indotta da citochine, concentrandosi sulla conservazione della funzione delle cellule β nei modelli di diabete. Incorporando ulteriormente la colorazione selettiva dell'indicatore Zn2+, questo approccio consente la visualizzazione selettiva delle cellule β produttrici di insulina attraverso l'associazione dello zinco, fornendo una visione mirata degli effetti delle citochine sulle popolazioni di cellule β all'interno delle isole e migliorando la specificità dell'analisi16. Questo approccio ha distinto le cellule β dalle altre cellule insulari e ha rivelato una significativa distruzione delle cellule β, con circa il 63% della morte delle cellule β dopo l'esposizione alle citochine nel nostro studio. Questa specificità è fondamentale per valutare la conservazione delle cellule β e sottolinea ulteriormente la necessità delle sue strategie protettive nella gestione del diabete.
Questi risultati sottolineano la versatilità della colorazione FDA/PI, YOPRO-1/nucleare e dell'indicatore selettivo Zn2+/colorazione nucleare/PI nella valutazione della morte delle isole. Un passaggio critico in questo protocollo è la selezione della combinazione appropriata di sonde fluorescenti per ridurre al minimo la sovrapposizione spettrale nella raccolta dei dati. La Tabella 1 delinea tutte le sonde fluorescenti dimostrate in questo protocollo, insieme ai rispettivi massimi di eccitazione ed emissione e allo stato cellulare (vivo/morto/apoptotico) indicato da ciascuna colorazione. Potrebbe essere necessaria l'ottimizzazione dei filtri di eccitazione e di emissione per ridurre al minimo la sovrapposizione spettrale tra i coloranti per quantificare con precisione le cellule vive, morte o apoptotiche. Inoltre, la vitalità delle isole isolate diminuisce rapidamente nel tempo, per ottenere i migliori risultati nell'analisi degli effetti dei composti sulla vitalità delle isole, gli esperimenti dovrebbero essere eseguiti entro 72 ore dall'isolamento. Fornendo dati precisi e riproducibili sulla vitalità cellulare, l'apoptosi e la morte β-cellule-specifica, questo studio illustra il potenziale di queste tecniche nello sviluppo di interventi terapeutici volti a ridurre la tossicità delle citochine e preservare la funzione β-cellulare nel diabete. Gli studi pubblicati dal nostro laboratorio hanno utilizzato questo approccio per fornire dati quantitativi sulla vitalità delle cellule β e sulla protezione contro l'apoptosi in presenza di un inibitore di piccole molecole 5,21.
Una limitazione di questo protocollo è che la colorazione della morte apoptotica delle cellule beta può essere ottenuta solo utilizzando marcatori specifici delle cellule beta aggiuntivi che non si sovrappongono spettralmente con i coloranti a fluorescenza YOPRO-1 o Annexin-V. In alternativa, possono essere adottate anche linee di topi reporter più robuste ma costose, come i topi reporter insulin-cre con promotori specifici per l'apoptosi. Questo modello knockout combina una Cre-ricombinasi guidata dal promotore dell'insulina con un sistema reporter come tdTomato e GFP per visualizzare l'apoptosi nelle cellule beta pancreatiche che esprimono insulina. Un'altra limitazione è che il conteggio manuale delle immagini delle isole richiede molto tempo e ha una bassa produttività. Mentre nel nostro laboratorio sono in corso sforzi per sviluppare un plug-in ImageJ adatto a fornire la quantificazione automatizzata delle cellule vive/morte, i plug-in di conteggio cellulare attualmente disponibili che utilizzano ImageJ (NIH) o altri software di conteggio delle cellule disponibili in commercio funzionano meglio con coloranti come la colorazione nucleare e il PI, che identificano i nuclei cellulari e hanno confini distinguibili tra le singole cellule. I coloranti come FDA e AnnexinV hanno una tensione più scarsa, rendendo difficile identificare i confini tra le cellule durante il conteggio con software automatizzato.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Le seguenti sovvenzioni hanno fornito fondi per questo lavoro: premio NIDDK R01 DK137221, JDRF 3-SRA-2023-1367-S-B a N.L.F. e ADA 7-20-JDF-020 a N.L.F. Gli autori desiderano ringraziare il supporto del Diabetes Research Center presso l'Università del Colorado Anschutz Campus P30-DK116073 e le strutture di base associate utilizzate per supportare questo lavoro.
Materiali
| Name | Company | Catalog Number | Comments |
| 14 mm glass-bottom Petri dish | Mattek | P35G-1.5-14-C | |
| 1640 RPMI | Corning | 10-041-CV | |
| 35 mm Petri dish | Celltreat | 229638 | |
| 7 mm glass-bottom Petri dish | Mattek | P35G-1.5-7-C | |
| Annexin V, Alexa Flour 488 | Thermo Fisher (Invitrogen) | A13201 | ex488/em515 |
| Calcium Chloride Dihydrate | Fisher | C79 | |
| Dimethyl Sulfoxide Anhydrous | Sigma | 276855 | |
| Fetal Bovine Serum | Thermo Fisher (Gibco) | 26140079 | |
| Flouzin-3, AM | Thermo Fisher (Invitrogen) | F24195 | ex488/em516 |
| Fluorescein Diacetate (FDA) | Thermo Fisher (Invitrogen) | F1303 | ex488/em520 |
| HEPES | Sigma | 54457 | |
| Image processing software | NIH | ImageJ | |
| Magnesium Chloride | Sigma | M8266 | |
| NucBlue Live ReadyProbes Reagent (Hoechst 33342) | Thermo Fisher (Invitrogen) | R37605 | ex360/em460 |
| Penicillin-Streptomycin | Thermo Fisher (Gibco) | 15-140-122 | |
| Phosphate-buffered Saline Tablets | Fisher | BP2944-100 | |
| Potassium Chloride, Granular | Macron | 6858-04 | |
| Propidium iodide | Thermo Fisher (Invitrogen) | P1304MP | ex535/em620 |
| Protein Recombinant Mouse IFN-gamma Protein | R&D Systems | 485-MI-100/CF | |
| Recombinant Mouse IL-1 beta/IL-1F2 | R&D Systems | 401-ML-100/CF | |
| Recombinant Mouse TNF-alpha (aa 80-235) Protein | R&D Systems | 410-MT-100/CF | |
| Sodium Chloride, Crystal | Macron | 7581-12 | |
| Stellaris Confocal microcope with spectral detectors | Leica | DMI-8 | 40x water immersion objective. |
| Yopro-1 Iodide | Thermo Fisher (Invitrogen) | Y3603 | ex488/em509 |
Riferimenti
- Da Silva Xavier, G. The cells of the islets of Langerhans. J Clinical medicine. 7 (3), 54 (2018).
- Grunnet, L. G., et al. Proinflammatory cytokines activate the intrinsic apoptotic pathway in β-cells. Diabetes. 58 (8), 1807-1815 (2009).
- Delaney, C. A., Pavlovic, D., Hoorens, A., Pipeleers, D. G., Eizirik, D. c. L. Cytokines induce deoxyribonucleic acid strand breaks and apoptosis in human pancreatic islet cells. Endocrinology. 138 (6), 2610-2614 (1997).
- Farnsworth, N. L., et al. Modulation of gap junction coupling within the islet of langerhans during the development of type 1 diabetes. Front Physiol. 13, 913611 (2022).
- Collins, J., et al. Cleavage of protein kinase c δ by caspase-3 mediates proinflammatory cytokine-induced apoptosis in pancreatic islets. J Biol Chem. 300 (9), 107611 (2024).
- Farnsworth, N. L., Walter, R., Piscopio, R. A., Schleicher, W. E., Benninger, R. K. Exendin-4 overcomes cytokine-induced decreases in gap junction coupling via protein kinase A and Epac2 in mouse and human islets. J Physiol. 597 (2), 431-447 (2019).
- NIH CIT Consortium Chemistry Manufacturing Controls Monitoring Committee. Purified human pancreatic islet-viability estimation of islet using fluorescent dyes (FDA/PI): Standard operating procedure of the NIH clinical islet transplantation consortium. CellR4 Repair Replace Regen Reprogram. 3 (1), e1378 (2015).
- Vermes, I., Haanen, C., Steffens-Nakken, H., Reutellingsperger, C. A novel assay for apoptosis flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled annexin V. J Immunol Meth. 184 (1), 39-51 (1995).
- Rieger, A. M., Nelson, K. L., Konowalchuk, J. D., Barreda, D. R. Modified annexin V/propidium iodide apoptosis assay for accurate assessment of cell death. J Vis Exp. (50), e2597 (2011).
- Emdin, S., Dodson, G., Cutfield, J., Cutfield, S. Role of zinc in insulin biosynthesis: some possible zinc-insulin interactions in the pancreatic B-cell. Diabetologia. 19, 174-182 (1980).
- ZA, L. A simple method of staining fresh and cultured islets. Transplantation. 45 (4), 827-830 (1988).
- Zalewski, P. D., et al. Video image analysis of labile zinc in viable pancreatic islet cells using a specific fluorescent probe for zinc. J Histochem Cytochem. 42 (7), 877-884 (1994).
- Jindal, R. M., Taylor, R. P., Gray, D. W., Esmeraldo, R., Morris, P. J. A new method for quantification of islets by measurement of zinc content. Diabetes. 41 (9), 1056-1062 (1992).
- Jayaraman, S. A novel method for the detection of viable human pancreatic beta cells by flow cytometry using fluorophores that selectively detect labile zinc, mitochondrial membrane potential and protein thiols. Cytometry A. 73 (7), 615-625 (2008).
- Lukowiak, B., et al. Identification and purification of functional human β-cells by a new specific zinc-fluorescent probe. J Histochem Cytochem. 49 (4), 519-527 (2001).
- Gee, K. R., Zhou, Z. L., Qian, W. J., Kennedy, R. Detection and imaging of zinc secretion from pancreatic β-cells using a new fluorescent zinc indicator. J Am Chem Soc. 124 (5), 776-778 (2002).
- Gyulkhandanyan, A. V., Lee, S. C., Bikopoulos, G., Dai, F., Wheeler, M. B. The Zn2+-transporting pathways in pancreatic β-cells: a role for the L-type voltage-gated Ca2+ channel. J Biol Chem. 281 (14), 9361-9372 (2006).
- Chen, J., et al. A murine pancreatic islet cell-based screening for diabetogenic environmental chemicals. J Vis Exp. (136), e57327 (2018).
- Farnsworth, N. L., Walter, R. L., Hemmati, A., Westacott, M. J., Benninger, R. K. Low level pro-inflammatory cytokines decrease connexin36 gap junction coupling in mouse and human islets through nitric oxide-mediated protein kinase Cδ. J Biol Chem. 291 (7), 3184-3196 (2016).
- Dalle, S., Abderrahmani, A., Renard, E. Pharmacological inhibitors of β-cell dysfunction and death as therapeutics for diabetes. Front Endocrinol. 14, 1076343 (2023).
- Collins, J., et al. Peptide-coated polycaprolactone-Benzalkonium chloride nanocapsules for targeted drug delivery to the pancreatic β-Cell. ACS Appl Bio Mater. 7 (10), 6451-6466 (2024).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon