Method Article
Farelerde İnsitülin Klerensinin Yerinde Karaciğer Perfüzyonu ile Değerlendirilmesi
Bu Makalede
Özet
Hepatik insülin klerensi, glikoz homeostazını düzenlemek için kritik öneme sahiptir. Bu makale, farelerde yerinde karaciğer insülin klerens oranını doğrudan değerlendirmek için kullanıcı dostu bir hepatik perfüzyon prosedürünü açıklamaktadır.
Özet
Hepatik insülin klerensi, glikoz homeostazını korumak için gereklidir ve obezite, insülin direnci ve diyabet gibi metabolik bozukluklarla yakından bağlantılıdır. İnsülin klerensinin doğru ölçümü, bu koşulların altında yatan mekanizmaları anlamak için hayati önem taşır. Bu protokol, farelerde hepatik insülin klerens oranını doğrudan değerlendirmek için özel olarak tasarlanmış basit ve kullanıcı dostu bir hepatik perfüzyon prosedürü sunar. Yöntem, fizyolojik koşulları taklit eden bir in situ perfüzyon sistemi oluşturmak için portal ven ve suprahepatik inferior vena kava'nın hassas kanülasyonunu içerir. Protokol, araştırmacılara cerrahi hazırlık ve perfüzyon sisteminin kurulumundan numune toplama ve analizine kadar prosedürün her aşamasında rehberlik eder. Ayrıntılı talimatların yanı sıra, temsili sonuçlar ve prosedürü optimize etmek için önemli ipuçları verilmiştir. Yazılı protokole eşlik eden, görsel olarak derinlemesine talimatlar ve çizimler sunan bir video eğitimi, onu hepatik insülin metabolizması ve klerensinin arkasındaki moleküler mekanizmaları araştıran bilim adamları için erişilebilir ve kapsamlı bir referans haline getirir.
Giriş
İnsülinin keşfi, geçen yüzyılın kilometre taşlarından biri haline geldi. Metabolik dokularda insülin sentezinin, sekresyonunun ve fizyolojik fonksiyonlarının düzenlenmesi hakkında çok şey bilinmektedir. Bununla birlikte, insülin bozulması ve düzenleyici mekanizmalarına daha az odaklanılmıştır. İnsülin metabolizması, beta hücre fonksiyonu, insülin direnci (IR) veya duyarlılık ve insülin klerensi arasındaki etkileşim olarak anlaşılabilir. İnsülin sekresyonunun yanı sıra, hepatik insülin klerensi, periferik hedef dokulara ulaşmak için gerekli olan homeostatik insülin seviyesinin korunmasında ve uygun insülin etkisinin kolaylaştırılmasında çok önemli bir rol oynar1. Çok sayıda çalışma, metabolik sendromda ve ayrıca tip 2 diyabet 2,3, alkolsüz steatohepatit4 ve polikistik over sendromu5 gibi diğer durumlarda hiperinsülinemi patogenezinde önemli bir faktör olarak bozulmuş insülin klerensini tanımlamıştır. Bu nedenle, azalmış klerense sekonder hiperinsülinemi metabolik hastalığın patogenezinde rol oynayabilir. İnsülin klerensini iyileştiren stratejiler, bu bireylerde hiperinsülineminin olumsuz etkilerini tersine çevirme potansiyeline sahiptir.
İnsülinin kendine özgü bir dağılım şekli vardır. Dolaşımdaki plazma insülin seviyesi, insülinin sekresyonu ve uzaklaştırılması arasındaki dengeye bağlıdır. Pankreas, portal ven içine pulsatil bir şekilde insülin salgılar ve onu hepatositlere yönlendirir. İnsülin salgısı ile ilk karşılaşan organ olan karaciğer, ilk geçişi sırasında insülinin çoğunu bozar ve toplam insülinin %60-70'ini oluşturur6. Kalan insülin, karaciğerden hepatik ven yoluyla çıkar ve sistemik dolaşıma girer, burada kısmen periferik dokular (öncelikle kas, yağ dokusu ve böbrekler) tarafından kullanılır ve hepatik arterden ikinci geçişi sırasında karaciğer tarafından daha fazla ekstrakte edilir7.
İnsülin klerensinin hassas ölçümü çok önemlidir. İnsan çalışmalarında hepatik insülin klerensini doğrudan ölçmek zordur çünkü portaldan ve hepatik damarlardan kan örnekleri almak zordur. İnsanlarda ve hayvan modellerinde insülin klerensini tahmin etmek için hem doğrudan hem de dolaylı yöntemler kullanılır. İnsülin klerensini dolaylı olarak ölçmek için yaklaşık üç strateji kullanılır. Klinik uygulamada en sık kullanılan değerlendirmeler, C-peptid / insülin molar oranına dayanan yöntemleri içerir8. Bu yaklaşım, her iki peptitin eşmolar salgılanmasına ve karaciğer9 tarafından C-peptit ekstraksiyonunun olmamasına dayanır. İkinci grup yöntemler, hormonun dolaşıma bilinen ve spesifik bir girişinden sonra insülinin plazma bozunma eğrilerinin matematiksel analizine dayanır 2,10,11. Üçüncü yöntem, insülinin sabit bir oranda infüzyonunun, kandaki hormonun stabil seviyelerine yol açması ve çıkarma oranının uygulama oranıyla12 eşleşmesi gerçeğine dayanmaktadır. Bu dolaylı yöntemler öncelikle vücuttaki genel insülin klerensini yansıtır. Karaciğerin insülin klerensinin birincil bölgesi olduğu ve bu süreçte çok önemli bir rol oynadığı göz önüne alındığında, hepatik insülin klerensinin doğrudan değerlendirilmesi önemlidir.
Önceki çalışmalar, sağlıklı köpeklerde hepatik insülin ekstraksiyonunu doğrudan ölçmüştür13,14. Çalışmalar ayrıca karaciğerden insülin ekstraksiyonunu değerlendirmek için izole edilmiş bir perfüze sıçan karaciğeri modeli kullanmıştır15,16. Genetik olarak değiştirilmiş suşların yüksek mevcudiyeti nedeniyle, fareler moleküler yolları araştırmak için değerli modeller olarak hizmet eder. Birkaç çalışma17, bir fare modelinde hepatik insülin klerensini doğrudan değerlendirmek için karaciğer perfüzyonunu kullanmıştır. Bu çalışmalarda, insan insülini içeren bir perfüzat portal ven içine infüze edilir ve inferior vena kavadan toplanır. Karaciğer tarafından emilen insülin oranı, klirensini gösterir. Karaciğer perfüzyon tekniği, karaciğer damar sistemi boyunca ılık, oksijenli ve besin açısından zenginleştirilmiş bir perfüzat dolaştırarak karaciğeri fizyolojik koşullara yakın koşullar altında tutar. Bununla birlikte, bu tekniği ilerletmek ve yaymak için yeterli pratik rehberlik ve temel ipuçları yoktur.
Bu nedenle, hepatik insülin klerensi artan bir ilgi görürken, bozukluklardaki rolü ve moleküler mekanizmaları belirsizliğini korumaktadır18. Bu nedenle, bilimsel araştırma alanında ileri tekniklere büyük ölçüde ihtiyaç duyulmaktadır. Bu protokol, hepatik insülin klerensini değerlendirmek için farelerde ayrıntılı bir modifiye hepatik perfüzyon prosedürü oluşturur. Ek olarak, bu yöntem, ilk geçiş etkisi, ilaç taşıma süreçleri ve diğer çeşitli yönler dahil olmak üzere ilaçların karaciğer üzerindeki etkilerini incelemek için de kullanılabilir.
Protokol
Bu protokol Nanjing Tıp Üniversitesi Hayvan Bakımı ve Kullanımı Komitesi (IACUC-2105018) tarafından onaylandı ve Kurumsal Hayvan Bakımı ve Kullanımı Komitesi'nin yönergelerini takip etti. Tüm C57BL / 6N fareleri, yiyecek ve suya ücretsiz erişim ile 12 saatlik bir aydınlık / karanlık döngüsünde tutuldu. Altı haftalık fareler rastgele bir Chow diyeti (CD) grubuna ve bir Yüksek yağlı diyet (HFD) grubuna ayrıldı. HFD grubu %60 oranında yüksek yağlı bir diyetle beslendi ve bu diyete 10 haftalık olana kadar devam etti. Ortalama vücut ağırlığı HFD grubu için 28.55 g ± 1.2 g ve kontrol grubu için 24.3 g ± 0.48 g idi. Bu çalışmada kullanılan reaktiflerin ve ekipmanların detayları Malzeme Tablosunda listelenmiştir.
1. Hazırlık
- Otoklavlama yoluyla cerrahi aletlerin ve sarf malzemelerinin gerekli sterilizasyonunu gerçekleştirin.
- Cerrahi aletleri, 6-0 ipek dikiş, steril küçük pamuk aplikatörü, sodyum klorür enjeksiyonu (500 mL), pamuklu çubukları ve süngerleri ameliyat masasına uygun şekilde yerleştirin.
- Nihai konsantrasyon 200 IU / mL olan 30 mL heparinize salin hazırlayın.
- İç çapı 0,31 mm ve dış çapı 0,64 mm olan iki silikon tüp hazırlayın; Biri portal ven kateteri olarak kullanım için 4 cm uzunluğunda, diğeri inferior vena kava kateteri olarak kullanım için 10 cm uzunluğundadır.
- 5.0 mmol/L glikoz ve %0.25 BSA içeren Krebs-Henseleit (KRBH) perfüzyon tamponunu hazırlayın.
- 5.0 mmol/L glikoz, %0.25 BSA ve 4.0 ng/mL insan insülini içeren Krebs-Henseleit (KRBH) perfüzyon tamponunu hazırlayın.
- Karaciğer perfüzyon sistemini kurun. Şekil 1 , karaciğer perfüzyon sisteminin ana bileşenlerini göstermektedir.
2. Cerrahi kateterizasyon
- Aşağıdaki adımları izleyerek anestezik karışımı hazırlayın:
- Zoletil 50'yi (250 mg / 5 mL)% 0.9 sodyum klorür çözeltisi ile 10 kez seyreltin.
- Ksilazin hidroklorürü (200 mg / 2 mL)% 0.9 sodyum klorür çözeltisi ile 10 kez seyreltin.
- % 0.5 Zoletil 50 çözeltisini% 1 Ksilazin hidroklorür çözeltisi ile 1: 1 oranında karıştırın.
- Fareleri uyuşturun.
- Farenin vücut ağırlığını kontrol edin ve kaydedin. Anestezik karışımı, 5 mL / kg vücut ağırlığı (2.5 mg / mL Zoletil 50; 5 mg / mL Ksilazin hidroklorür) dozunda intraperitoneal enjeksiyon yoluyla uygulayın. Anestezinin başlangıcı tipik olarak enjeksiyondan 5-10 dakika sonra ortaya çıkar, bu da doğrultma refleksinin kaybı ve dış uyaranlara yanıtın azalması ile gösterilir.
- Fareyi çalışma masasına aktarın. Uzuvları yapışkan bant kullanarak sabitleyin. Heparinizasyon sağlamak için intraperitoneal olarak 2.5 U / g heparin uygulayın.
- Karın derisindeki kürkü kesmek için elektrikli bir tıraş makinesi kullanın ve bölgeyi bir povidon-iyot çözeltisi ile dezenfekte edin.
- Portal ven kateterizasyonu gerçekleştirin.
- Alt karın bölgesinden orta karın çizgisi boyunca ksifoid sürecine doğru 4 cm uzunlamasına bir kesi yapın. İç organlara zarar vermemek için peritonu makasla dikkatlice kesin. Cerrahi alanı ortaya çıkarmak için fare abdominal ekartörünü yerleştirin.
- Portal veni, sağ böbreği ve inferior vena kava'yı ortaya çıkarmak için bağırsakları sağa doğru hareket ettirin (Şekil 2A). Böbreğin üst kenarındaki vena kava'yı klemplemek için arter forseps kullanın.
- Portal veni izole edin (Şekil 2A) ve distal ucu 6-0 ipek sütür ile bağlayın. Açıkta kalan damarın proksimal ucuna gevşek bir şekilde başka bir dikiş atın.
- Yaylı makasla bağlanan uca yakın bir kesi yapın ve kateteri yerleştirin. Kateteri insizyondan portal bifurkasyon seviyesine kadar ilerletin.
- Her iki bağı da kateterin etrafına sabitleyin ve kateterin serbest ucunu bir örnekleme şırıngasına bağlayarak uygun örneklemeyi onaylayın. Heparinize salin ile yıkayın ve kateteri klempleyin (Şekil 2C).
- Çekiş cihazını çıkarın ve bağırsakları sıfırlayın. Cerrahi bölgeyi tuzlu suya batırılmış steril gazlı bez veya pamukla örtün.
- Suprahepatik inferior vena kava kateterizasyonu yapın.
- Sternumu açığa çıkaran ksifoid işleminden sternum boyunca bir kesi yapın.
- Sternumu dikey olarak kesin, açın ve göğüs boşluğunu ortaya çıkarmak için kaburga kenarı boyunca diyaframı kesin.
- Suprahepatik inferior vena kava'yı açığa çıkarın ve izole edin (Şekil 2B). Distal ucu 6-0 ipek sütür ile dikkatlice bağlayın. Damarın proksimal ucuna gevşek bir şekilde başka bir dikiş atın.
- Yaylı makasla bağlanan ucun hemen altından bir kesi yapın ve 10 cm'lik bir kateter yerleştirin. Kateterin ucu karaciğere yakın olana kadar kateteri ilerletin ve her iki ligatürü de güvenli bir şekilde bağlayın. Uygun örneklemeyi onaylayın ve kateterin serbest ucunu klempleyin (Şekil 2D).
- Cerrahi bölgeyi tuzlu su çözeltisi ile durulayın. Yüzeyi tuzlu suya batırılmış steril gazlı bezle örtün.
3. Karaciğer perfüzyonu
- Hayvan bakımı ve kullanımı için kurumsal yönergelere uygun olarak aşırı dozda anestezik ve torakotomi kullanarak fareye ötenazi yapın ve tüm prosedürlerin acıyı en aza indirecek şekilde yapıldığından emin olun.
- Şekil 1'de gösterildiği gibi bir oksijenatör, bir sıcaklık modülasyon cihazı, bir infüzyon pompası ve infüzyon tüpleri içeren karaciğer perfüzyon sistemini kurun.
- Oksijenatöre sürekli %95 oksijen ve %5 karbondioksit gaz akışı sağlayın.
- Su banyosunu açın ve organ haznesini 37 °C'ye ısıtın.
- KRBH perfüzyon tamponunu insülinli ve insülinsiz hazırlayın. Boru sistemini 37 °C'de bir su banyosunda inkübe edilmiş perfüzyon tamponu ile astarlayın.
NOT: KRBH, BSA ve glikoz içermez. İnsan insülini içermeyen KRBH perfüzyon tamponu 5.0 mmol/L glikoz ve %0.25 BSA içerirken, insan insülini içeren KRBH perfüzyon tamponu 5.0 mmol/L glikoz, %0.25 BSA ve 4.0 ng/mL insan insülini içerir. - Fareyi, ortam sıcaklığı yaklaşık 37 °C'de tutulan bir kaba yerleştirin. Vücut ısısını 37 °C'de tutmak için bir ısıtma pedi kullanın.
- KRBH tamponunu portal ven kateterinden infüze edin. İnfüzyon hızını bir mini pompa ile 0.2 mL / dk'ya ayarlayın.
- Karaciğerin saniyeler içinde soluklaştığını gözlemleyin, bu da perfüzyon tamponunun karaciğerden aktığını gösterir. Karaciğerde kalan daha fazla kan hücresini temizlemek için, perfüzyonun başlangıcında zamanlamayı başlatarak infüzyonu 4 dakika ve 8 dakikalık zaman noktalarında 1 dakika duraklatın.
- Karaciğeri KRBH tamponu ile toplam 10 dakika (iki 1 dakikalık duraklama hariç) perfüze edin, bu da dengeleme süresini temsil eder. Bazal numuneyi inferior vena kava kateterinden toplayın.
- Karaciğeri insülin (4.0 ng/mL insan insülini) ile zenginleştirilmiş aynı solüsyonla 30 dakika daha perfüze edin.
- İnferior vena kava tüpünden tüm örnekleri her 2 dakikada bir toplayın.
- Perfüzyondan sonra karaciğer ağırlığını kaydedin. Farklı loblardan karaciğer örnekleri toplayın, hemen sıvı nitrojen içinde dondurun ve ardından saklamak için -80 ° C'ye aktarın.
- Toplanan tüm perfüzyon örneklerini ~ 1.000 x g'da 4 ° C'de 10 dakika boyunca santrifüjleyin. Süpernatantları toplayın ve depolama için -80 °C'ye aktarın.
NOT: Perfüzyon örneklerindeki insülin konsantrasyonu, insan insülin enzimine bağlı immünosorbent test (ELISA) kitleri kullanılarak ölçülür. - İşlem sonrası, tüm biyolojik atıkların güvenlik yönetmeliklerine göre bertaraf edildiğinden emin olun.
4. Veri analizi
- Verileri, zaman içindeki insülin konsantrasyonu çıktısını gösteren XY grafiklerinde sunun.
- Aşağıdaki formülü kullanarak ortalama hepatik insülin klerens oranını (HICRAVE) hesaplayın:
HICRAVE = (1−Cf/Ci) × %100
burada Ci = infüzyon tamponunun ilk insülin konsantrasyonu, Cf = suprahepatik inferior vena kavadan son 10 dakikadaki nihai ortalama insülin konsantrasyonu.
Sonuçlar
Bu protokol, hepatik insülin klerensini doğrudan hesaplamak için karaciğer infüzyonu prosedürünü ana hatlarıyla belirtir. Bu model güvenilir ve tekrarlanabilir. Bir deneyden elde edilen sonuçların bir örneği Şekil 3'te gösterilmiştir. 10 dakikalık bir dengeleme periyodundan sonra, 4.0 ng / mL insan insülini ile takviye edilmiş KRBH tamponu, portal venden 30 dakika boyunca perfüze edildi. Suprahepatik inferior vena kavadaki kateterden 2 dakika aralıklarla perfüzyon sıvısı toplandı ve perfüzyon sıvısındaki insan insülin konsantrasyonu ölçüldü. Sonuçlar burada ortalama ± SEM olarak sunulmuştur. Kontrol diyetindeki (CD) fareleri yüksek yağlı diyet (HFD) uygulayan farelerle karşılaştıran bir karaciğer perfüzyon deneyi örneği Şekil 3'te gösterilmiştir. Hepatik insülin klerens oranı (HICRAVE) CD grubu için %55.57 ± %4.43 ve HFD grubu için %25.37 ± %6.83 idi (Şekil 3B). Sonuçlar, yüksek yağlı beslenmenin insülin klerensinin bozulmasına yol açtığını göstermektedir.
Perfüzyon sonrası hematoksilen ve eozin (HE) boyaması ve tüm slayt taraması için karaciğer örnekleri alındı; İyi perfüze edilmiş bir karaciğer, zayıf perfüze edilmiş bir karaciğer ve normal bir fareden bir kontrol karaciğer örneği toplandı. Daha iyi perfüzyon koşulları altında, karaciğer doku yapısı normaldi, karaciğer kordonları radyal ve düzgün bir şekilde düzenlenmişti, hepatositler şekil olarak sağlamdı, sitoplazma düzgün bir şekilde boyanmıştı ve çekirdek berrak ve yuvarlaktı, normal karaciğerinkinden neredeyse ayırt edilemeyecek durumdaydı (Şekil 4A,B). Perfüzyon zayıf olduğunda, hepatositler ödemli ve belirgin şekilde gevşekti, merkezi venler etrafında noktasal nekroz, sitoplazmada vakuolar dejenerasyon, nükleer piknoz ve vasküler dekolman vardı (Şekil 4C). Perfüzattaki alanin aminotransferaz (ALT) ve aspartat aminotransferaz (AST) seviyeleri, hepatosit fonksiyonunu değerlendirmek için başlangıçta ve perfüzyondan sonra ölçüldü. Sonuçlar, ALT ve AST düzeylerinde anlamlı bir fark olmadığını gösterdi (Şekil 4D).

Şekil 1: Perfüzyon sistemi bileşenleri. Perfüzyon sistemi, bir infüzyon pompası, bir sıcaklık kontrol ünitesi ve bir oksijenatör dahil olmak üzere temel bileşenlerden oluşur. Değişken sıcaklık cihazı, perfüzyon sıvısını 37 °C'de tutarken, membran oksijenatörü etkili gaz değişimi için polipropilen içi boş lifler kullanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Anatomik lokalizasyon ve kateterizasyon. (A,B) Portal ven ve inferior vena kava'nın anatomik konumlarını gösterir. (C) Portal ven kateteri, intrahepatik inferior vena kavaya uygulanan bir damar klempi ile sol ve sağ hepatik dallara bifurkasyonun hemen altına yerleştirilir. (D) Kateter suprahepatik inferior vena kavaya yerleştirilir ve karaciğerin üst kenarına yakın bir yere yerleştirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
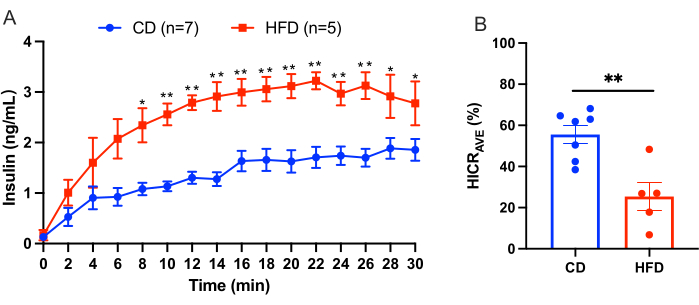
Şekil 3: Karaciğer perfüzyon deneyi sonuçları. Kontrol diyetindeki (CD) fareleri yüksek yağlı diyetteki (HFD) farelerle karşılaştıran bir karaciğer perfüzyon deneyinden elde edilen sonuçlar. (A) CD farelerinde (mavi, n = 7) ve HFD farelerinde (kırmızı, n = 5) karaciğer perfüzyonu sırasında insülin konsantrasyonları. (B) Ortalama hepatik insülin klerens oranı (HICRAVE). Tüm veriler ortalama ± SEM olarak sunulmuştur. İstatistiksel anlamlılık şu şekilde belirtilmiştir: *p < 0.05, **p < 0.01 ve eşleşmemiş bir t-testi kullanılarak analiz edilen CD farelerine göre. Sonuçlar, yüksek yağlı beslenmenin insülin klerensinin bozulmasına yol açtığını göstermektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Perfüzyonun hepatik histoloji ve fonksiyon üzerindeki etkisi. (A) Normal fare karaciğer morfolojisi (kontrol). (B) Gelişmiş perfüzyon koşulları altında karaciğer morfolojisi. (C) Suboptimal perfüzyon koşulları altında karaciğer morfolojisi. Kırmızı ok damar ayrılmasını, siyah ok vakuolizasyonu ve yeşil ok çekirdeğin piknozunu gösterir. Büyütme: 40x. (D) Perfüzattaki alanin aminotransferaz (ALT) ve aspartat aminotransferaz (AST) seviyeleri, başlangıçta ve perfüzyonu takiben ölçülür. Analiz için eşli t-testi yöntemi kullanılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Protokoldeki kritik adımlar
Yukarıda açıklanan cerrahi prosedürler, karaciğerde herhangi bir lezyon oluşturmamak için nazik bir özenle yapılmalıdır. Ayrıca, karaciğer damar damarı duvarının kırılgan yapısı, kanülasyon sırasında dikkatli bir şekilde ele alınmazsa delinmeye ve ardından kanamaya karşı savunmasız hale getirir. Bu protokolde kan damarlarına verilen zararı en aza indirmek için daha yumuşak silikon tüpler kullanılır. Entübasyonun başarı oranını artırmak ve işlem süresini en aza indirmek için kateterizasyonun sık sık pratik yapması gereken deneyimli bir cerrah tarafından yapılması önerilir.
Hepatosit canlılığını korumak için cerrahi alan ara sıra ılık tuzlu su ile sulanmalıdır. Perfüzyon sırasında cerrahi alan steril gazlı bez veya pamuk ile korunmalıdır. Bu uygulama, hepatosit fonksiyonunu potansiyel olarak bozabilecek uzun süreli havaya maruz kalmayı önler.
Zorluklar ve çözümler
Kateterin ucunun, portal venin sol ve sağ hepatik portal venlere dallandığı noktadan hemen önce konumlandırılması çok önemlidir. Kateter çok derine yerleştirilirse, karaciğer lobları arasında eşit olmayan perfüzyon meydana gelebilir. Ek olarak, karaciğerde hava embolisine neden olma potansiyeline sahip olduklarından, infüzyon işlemi sırasında hava kabarcıklarından dikkatli bir şekilde kaçınılmalıdır. Bu, hepatositlere ulaşan sıvının perfüzyonunu önemli ölçüde etkileyebilir ve daha sonra insülin klerensini etkileyebilir.
KH tampon infüzyonunun ilk 10 dakikası, artık kan hücrelerini mümkün olduğunca hepatik sinüzoide akıtmak için perfüzyonun her seferinde 2 dakika boyunca 1-2 kez askıya alınabildiği denge periyodunu oluşturur. 15 dakikalık sürekli perfüzyondan sonra toplanan örnekte kan gözlenirse, bu, hepatik inferior vena kava üzerindeki vasküler forsepslerin uygun şekilde yerleştirilmediğini ve kontrol edilmesi gerektiğini gösterebilir19. İnfüzyon duraklatılırsa, hepatik sinüzoidlerdeki kalıntı kan hücreleri nedeniyle infüzyon yeniden başlatıldığında toplanan örnekte kırmızı kan hücreleri görünebilir. Kırmızı kan hücreleri, insülin ölçümlerinden önce santrifüjleme yoluyla ayrılmalıdır, çünkü bu hücrelerde insülin parçalayıcı enzimlerin varlığı potansiyel olarak insülin seviyelerini etkileyebilir.
Cerrahi kateterizasyon süresi, karaciğer iskemi-reperfüzyon süresi ve perfüzyon sırasında portal vene giren gaz miktarının tümü hepatositlerin işlevini ve dolayısıyla karaciğer tarafından insülin temizleme oranını etkileyebilir. Karaciğer fonksiyon bozukluğunun derecesi, alanin aminotransferaz (ALT), aspartat aminotransferaz (AST), laktat dehidrojenaz (LDH) ve alkalin fosfataz (ALP) içeriğinin yanı sıra H&E boyama ile ölçülerek izlenebilir. Araştırmalar, başarılı bir ameliyattan sonra karaciğerin en az 3 saat boyunca çalışmaya ve yanıt vermeye devam ettiğini göstermiştir19.
Fare karaciğer perfüzyonunun önemi ve potansiyel uygulamaları
Fareler, insanlara genetik benzerlikleri, kısa üreme döngüleri ve gelişmiş genetik mühendisliği araçlarının mevcudiyeti nedeniyle ideal araştırma konularıdır20. Fare modellerinde, insülin klerensi çeşitli yöntemler kullanılarak değerlendirilebilir. İntraperitoneal glukoz tolerans testi (IPGTT) sırasında, hepatik insülin klerensi, C-peptidin eğrisi altındaki alanın (AUC) (trapezoidal yöntemle hesaplanan) insülin21'e oranı olarak ölçülür. Öglisemik-hiperinsülinemi kıskpı sırasında, eksojen insülin infüzyon hızı ile ortaya çıkan kararlı durum plazma insülin konsantrasyonu arasındaki oran, insülin klerensini dolaylı olarak tahmin etmek için bir yöntem olarak kullanılabilir22. Bununla birlikte, bu yöntemlerin tümü dolaylı olarak hepatik insülin klerensini değerlendirir.
Bazı araştırmacılar ayrıca insülin bozulmasını değerlendirmek için hücre bazlı tahliller kullanır. Farelerden alınan HepG2 hücreleri veya primer hepatositler kültür plakalarına ekilir ve uygun bir insan insülini konsantrasyonu eklenir. Kültür ortamının numuneleri, insan insülin konsantrasyonunu ölçmek ve zaman içindeki bozulmasını değerlendirmek için belirli aralıklarla toplanır17. Bu protokolde, hepatik insülin klerens oranını doğrudan değerlendirmek için farelerde kullanıcı dostu bir in situ hepatik perfüzyon prosedürü tanımlanmıştır. İzole hepatositlerin kullanıldığı in vitro çalışmalarla karşılaştırıldığında, karaciğer perfüzyonunun karaciğer mimarisini, bölgesel bölünmeyi, polariteyi ve vasküler bütünlüğü koruma faydaları vardır.
Fare karaciğer perfüzyon sistemi, hepatik insülin metabolizmasının dinamiklerini ve moleküler mekanizmalarını araştırmak için değerli bir araçtır. Ek olarak, bu protokol sadece önceden indüklenmiş hastalık modellerinde değil, aynı zamanda akut meydan okuma uyaran testinde de yaygın olarak kullanılabilir. Bununla birlikte, bu teknik yerinde yapılması gerektiği için sınırlıdır. Bu protokol, yaralanmayı en aza indiren ve karaciğerin anatomik bütünlüğünü mümkün olan en üst düzeyde koruyan modifiye bir cerrahi kateterizasyon tekniğini içerir. Özellikle insülin direnci ile ilişkili metabolik hastalıklarda insülin klerens mekanizmalarını aydınlatmak için bu teknolojinin en iyi şekilde kullanılması için daha fazla çaba sarf edilmesi gerekmektedir.
Açıklamalar
Herhangi bir çıkar çatışması ilan edilmedi.
Teşekkürler
Bu çalışma Çin Ulusal Doğa Bilimleri Vakfı (82200948, 82270921, 82170882) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 60% high-fat diet | Research Diets, USA | D12492 | |
| Alanine aminotransferase Assay Kit | Nanjing Jiancheng Bioengineering Institute | C009-2-1 | |
| Anhydrous Glucose | Sangon Biotech | 50-99-7 | 500 G |
| Aspartate aminotransferase Assay Kit | Nanjing Jiancheng Bioengineering Institute | C010-2-1 | |
| Bovine Serum Albumin | GeminiBio | 700-107P | Fatty Acid-Free |
| Contour TS Blood Glucose Meter | Bayer | PH220800019 | |
| Contour TS Blood Glucose Test Strips | Bayer | DP38M3F05A | |
| Heparin Sodium | Changzhou Qian hong Bio-pharma | H32022088 | 12500 U/2mL |
| Human insulin | Novo Nordisk | S20191007 | 300 U/3mL |
| Human insulin immunoassay kit | Ezassay Biotechnology | HM200 | |
| KRBH buffer (Sugar, BSA free) | coolaber | SL65501 | 500 mL |
| Membrane oxygenator | Xi'an Xijing Medical Appliance | 5 | |
| Microscopic scissors | Shanghai Jinzhong | YBC020 | |
| Micro-serrefine clamp | Ningbo Medical Needle | 180709 | |
| Microsurgery forceps | Shanghai Jinzhong | WA3010, WA3020 | |
| Needle type filter | N-buliv | LG05-133-2 | |
| Povidone-iodine Solution | Shanghai likang Disinfectant Hi-Tech | 20231016J | |
| pump 11 Elite | Harvard Apparatus | PC5 70-4500 | |
| Retractor | Globalebio (Beijing) Technology | GEKK-10mm | 10 mm |
| Silicone Tubing | scientific commodities | #BB518-12 | 0.31 mm × 0.64 mm |
| Silicone Tubing | Fisher Scientific | #11-189-15A | ID 0.5 mm |
| Sodium Chloride Injection | Baxter | S2402023 | 4.5 g/500 mL |
| Surgical silk suture | Yangzhou Huanyu Medical Equipment | 6-0 | |
| Temperature modulation | Xi'an Xijing Medical Appliance | 6 | |
| Thermostatic water bath | Jiaxing Junsi Electronics | HIH-1 | 220 V 50 HZ |
| Three-way Joint | YISAI | AQTCY1.6 | ID 0.4 mm |
| Xylazine Hydrochloride Injection | ShengXin | 20240106 | 200 mg/2mL |
| Zoletil 50 | Virbac | WK001 | 250 mg/5mL |
Referanslar
- Najjar, S. M., Perdomo, G. Hepatic insulin clearance: Mechanism and physiology. Physiology (Bethesda). 34 (3), 198-215 (2019).
- Fu, Z., et al. Impaired insulin clearance as the initial regulator of obesity-associated hyperinsulinemia: Novel insight into the underlying mechanism based on serum bile acid profiles. Diabetes Care. 45 (2), 425-435 (2022).
- Koh, H. E., Cao, C., Mittendorfer, B. Insulin clearance in obesity and type 2 diabetes. Int J Mol Sci. 23 (2), 596 (2022).
- Bril, F., et al. Relationship between disease severity, hyperinsulinemia, and impaired insulin clearance in patients with nonalcoholic steatohepatitis. Hepatology. 59 (6), 2178-2187 (2014).
- Herman, R., Sikonja, J., Jensterle, M., Janez, A., Dolzan, V. Insulin metabolism in polycystic ovary syndrome: Secretion, signaling, and clearance. Int J Mol Sci. 24 (4), 3140 (2023).
- Najjar, S. M., Caprio, S., Gastaldelli, A. Insulin clearance in health and disease. Annu Rev Physiol. 85, 363-381 (2023).
- Polidori, D. C., Bergman, R. N., Chung, S. T., Sumner, A. E. Hepatic and extrahepatic insulin clearance are differentially regulated: Results from a novel model-based analysis of intravenous glucose tolerance data. Diabetes. 65 (6), 1556-1564 (2016).
- Castillo, M. J., Scheen, A. J., Letiexhe, M. R., Lefebvre, P. J. How to measure insulin clearance. Diabetes Metab Rev. 10 (2), 119-150 (1994).
- Rubenstein, A. H., Pottenger, L. A., Mako, M., Getz, G. S., Steiner, D. F. The metabolism of proinsulin and insulin by the liver. J Clin Invest. 51 (4), 912-921 (1972).
- Terris, S., Steiner, D. F. Binding and degradation of 125i-insulin by rat hepatocytes. J Biol Chem. 250 (21), 8389-8398 (1975).
- Ooms, H. A., Arnould, Y., Rosa, U., Pennisi, G. F., Franckson, J. R. Total metabolic clearance of crystalline insulin and radio-iodide substitued insulin. Pathol Biol. 16 (5), 241-245 (1968).
- Defronzo, R. A., Tobin, J. D., Andres, R. Glucose clamp technique: A method for quantifying insulin secretion and resistance. Am J Physiol. 237 (3), E214-E223 (1979).
- Asare-Bediako, I., et al. Assessment of hepatic insulin extraction from in vivo surrogate methods of insulin clearance measurement. Am J Physiol Endocrinol Metab. 315 (4), E605-E612 (2018).
- Kim, S. P., Ellmerer, M., Kirkman, E. L., Bergman, R. N. Beta-cell "rest" accompanies reduced first-pass hepatic insulin extraction in the insulin-resistant, fat-fed canine model. Am J Physiol Endocrinol Metab. 292 (6), E1581-E1589 (2007).
- Kotsis, T., et al. Insulin metabolism and assessment of hepatic insulin extraction during liver regeneration. A study in a rat model. J Invest Surg. 33 (1), 69-76 (2020).
- Mondon, C. E., Olefsky, J. M., Dolkas, C. B., Reaven, G. M. Removal of insulin by perfused rat liver: Effect of concentration. Metabolism. 24 (2), 153-160 (1975).
- Tamaki, M., et al. The diabetes-susceptible gene SLC30A8/ZnT8 regulates hepatic insulin clearance. J Clin Invest. 123 (10), 4513-4524 (2013).
- Ghadieh, H. E., Gastaldelli, A., Najjar, S. M. Role of insulin clearance in insulin action and metabolic diseases. Int J Mol Sci. 24 (8), 7156 (2023).
- Winther-Sorensen, M., Kemp, I. M., Bisgaard, H. C., Holst, J. J., Wewer Albrechtsen, N. J. Hepatic glucose production, ureagenesis, and lipolysis quantified using the perfused mouse liver model. J Vis Exp. 200, e65596 (2023).
- Rydell-Tormanen, K., Johnson, J. R. The applicability of mouse models to the study of human disease. Methods Mol Biol. 1940, 3-22 (2019).
- Zaidi, S., et al. Loss of ceacam1 in hepatocytes causes hepatic fibrosis. Eur J Clin Invest. 54 (7), e14177 (2024).
- Piccinini, F., Bergman, R. N. The measurement of insulin clearance. Diabetes Care. 43 (9), 2296-2302 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır