Method Article
Evaluación del aclaramiento de insulina en ratones mediante perfusión hepática in situ
En este artículo
Resumen
El aclaramiento hepático de insulina es fundamental para regular la homeostasis de la glucosa. Este artículo describe un procedimiento de perfusión hepática fácil de usar para evaluar directamente la tasa de aclaramiento de insulina hepática in situ en ratones.
Resumen
El aclaramiento hepático de insulina es esencial para mantener la homeostasis de la glucosa y está estrechamente relacionado con trastornos metabólicos como la obesidad, la resistencia a la insulina y la diabetes. La medición precisa del aclaramiento de insulina es vital para comprender los mecanismos subyacentes de estas afecciones. Este protocolo presenta un procedimiento de perfusión hepática sencillo y fácil de usar en ratones, diseñado específicamente para evaluar directamente la tasa de aclaramiento de insulina hepática. El método implica una canulación precisa de la vena porta y la vena cava inferior suprahepática para crear un sistema de perfusión in situ que imita las condiciones fisiológicas. El protocolo guía a los investigadores a través de cada etapa del procedimiento, desde la preparación quirúrgica y la configuración del sistema de perfusión hasta la recolección y el análisis de muestras. Se proporcionan instrucciones detalladas, junto con resultados representativos y consejos importantes para optimizar el procedimiento. Un video tutorial acompaña al protocolo escrito, ofreciendo instrucciones e ilustraciones visualmente detalladas, lo que lo convierte en una referencia accesible y completa para los científicos que exploran los mecanismos moleculares detrás del metabolismo y la eliminación de la insulina hepática.
Introducción
El descubrimiento de la insulina se ha convertido en uno de los hitos del último siglo. Se sabe mucho sobre la regulación de la síntesis y secreción de insulina y sus funciones fisiológicas en los tejidos metabólicos. Sin embargo, se ha prestado menos atención a la degradación de la insulina y sus mecanismos reguladores. El metabolismo de la insulina puede entenderse como la interacción entre la función de las células beta, la resistencia o sensibilidad a la insulina y la eliminación de la insulina. Junto con la secreción de insulina, el aclaramiento hepático de insulina desempeña un papel crucial en el mantenimiento del nivel homeostático de insulina necesario para llegar a los tejidos diana periféricos y facilitar la acción adecuada de la insulina1. Múltiples estudios han identificado el deterioro del aclaramiento de insulina como un factor crucial en la patogénesis de la hiperinsulinemia en el síndrome metabólico, así como en otras afecciones comola diabetes tipo 2,3, la esteatohepatitis no alcohólica4 y el síndrome de ovario poliquístico5. Por lo tanto, la hiperinsulinemia secundaria a un aclaramiento reducido puede desempeñar un papel en la patogénesis de la enfermedad metabólica. Las estrategias que mejoran la eliminación de insulina tienen el potencial de revertir los impactos desfavorables de la hiperinsulinemia en estos individuos.
La insulina tiene un patrón único de distribución. El nivel de insulina plasmática circulante depende del equilibrio entre la secreción y la eliminación de insulina. El páncreas segrega insulina en la vena porta de forma pulsátil, dirigiéndola a los hepatocitos. Como el primer órgano en encontrar la secreción de insulina, el hígado degrada la mayor parte de la insulina durante su primer paso, lo que representa el 60%-70% de la insulina total6. La insulina restante sale del hígado a través de la vena hepática, entrando en la circulación sistémica, donde es parcialmente utilizada por los tejidos periféricos (principalmente músculo, tejido adiposo y riñones) antes de ser extraída por el hígado durante su segundo paso a través de la arteria hepática7.
La medición precisa del aclaramiento de insulina es crucial. La medición directa del aclaramiento de insulina hepática en estudios en humanos es un desafío porque es difícil obtener muestras de sangre de las venas portal y hepática. Se utilizan métodos directos e indirectos para estimar el aclaramiento de insulina en humanos y modelos animales. Se emplean aproximadamente tres estrategias para medir el aclaramiento de insulina de forma indirecta. Las evaluaciones más utilizadas en la práctica clínica involucran métodos basados en la relación molar péptido C/insulina8. Este enfoque se basa en la secreción equimolar de ambos péptidos y en la ausencia de extracción de péptido C por parte del hígado9. El segundo grupo de métodos depende del análisis matemático de las curvas de decaimiento plasmático de la insulina después de un aporte conocido y específico de la hormona a la circulación 2,10,11. El tercer método se basa en el hecho de que la infusión de insulina a una tasa constante conduce a niveles estables de la hormona en la sangre, donde la tasa de eliminación coincide con la tasa de administración12. Estos métodos indirectos reflejan principalmente la eliminación general de insulina en el cuerpo. Dado que el hígado es el sitio principal de aclaramiento de insulina y desempeña un papel crucial en este proceso, es esencial evaluar directamente el aclaramiento de insulina hepático.
Estudios previos han medido directamente la extracción de insulina hepática en perros sanos13,14. Los estudios también han utilizado un modelo aislado de hígado de rata perfundida para evaluar la extracción de insulina del hígado15,16. Debido a la alta disponibilidad de cepas modificadas genéticamente, los ratones sirven como modelos valiosos para investigar las vías moleculares. Algunos estudios17 han utilizado la perfusión hepática para evaluar directamente el aclaramiento de insulina hepática en un modelo de ratón. En estos estudios, se infunde una perfusión que contiene insulina humana en la vena porta y se recoge de la vena cava inferior. La proporción de insulina absorbida por el hígado indica su eliminación. La técnica de perfusión hepática mantiene el hígado en condiciones casi fisiológicas mediante la circulación de una perfusión caliente, oxigenada y enriquecida con nutrientes a través de la vasculatura hepática. Sin embargo, no hay suficiente orientación práctica y consejos esenciales para avanzar y difundir esta técnica.
Por lo tanto, si bien el aclaramiento de la insulina hepática ha recibido cada vez más atención, su papel en los trastornos, así como sus mecanismos moleculares, siguen sin estar claros18. Por lo tanto, las técnicas avanzadas son muy necesarias en el campo de la investigación científica. Este protocolo establece un procedimiento detallado de perfusión hepática modificada en ratones para evaluar el aclaramiento de insulina hepática. Además, este método también se puede utilizar para estudiar los efectos de los fármacos en el hígado, incluido el efecto de primer paso, los procesos de transporte de fármacos y otros aspectos.
Protocolo
Este protocolo fue aprobado por el Comité de Cuidado y Uso de Animales de la Universidad Médica de Nanjing (IACUC-2105018) y siguió las directrices del Comité Institucional de Cuidado y Uso de Animales. Todos los ratones C57BL/6N se mantuvieron en un ciclo de luz/oscuridad de 12 horas con libre acceso a alimentos y agua. Los ratones de seis semanas de edad se dividieron aleatoriamente en un grupo de dieta Chow (CD) y un grupo de dieta alta en grasas (HFD). El grupo de HFD fue alimentado con una dieta alta en grasas al 60% y continuó con esta dieta hasta las 10 semanas de edad. El peso corporal promedio fue de 28,55 g ± 1,2 g para el grupo HFD y de 24,3 g ± 0,48 g para el grupo control. Los detalles de los reactivos y equipos utilizados en este estudio se enumeran en la Tabla de Materiales.
1. Preparación
- Realice la esterilización necesaria de instrumentos quirúrgicos y consumibles a través de autoclave.
- Coloque los instrumentos quirúrgicos, la sutura de seda 6-0, el aplicador de algodón pequeño estéril, la inyección de cloruro de sodio (500 mL), los hisopos de algodón y las esponjas de manera adecuada en la mesa de operaciones.
- Preparar 30 mL de suero fisiológico heparinizado con una concentración final de 200 UI/mL.
- Prepare dos tubos de silicona con un diámetro interior de 0,31 mm y un diámetro exterior de 0,64 mm; uno de 4 cm de longitud para su uso como catéter de vena porta, y el otro de 10 cm de longitud para su uso como catéter de vena cava inferior.
- Prepare el tampón de perfusión Krebs-Henseleit (KRBH) que contiene 5,0 mmol/L de glucosa y 0,25% de BSA.
- Prepare el tampón de perfusión Krebs-Henseleit (KRBH) que contiene 5,0 mmol/L de glucosa, 0,25% de BSA y 4,0 ng/mL de insulina humana.
- Configurar el sistema de perfusión hepática. En la figura 1 se muestran los principales componentes del sistema de perfusión hepática.
2. Cateterismo quirúrgico
- Prepare la mezcla anestésica siguiendo los pasos a continuación:
- Diluya Zoletil 50 (250 mg/5 mL) 10 veces con una solución de cloruro de sodio al 0,9%.
- Diluya el clorhidrato de xilacina (200 mg/2 mL) 10 veces con una solución de cloruro de sodio al 0,9%.
- Mezcle la solución de Zoletil 50 al 0,5 % con la solución de clorhidrato de xilacina al 1 % en una proporción de 1:1.
- Anestesiar a los ratones.
- Compruebe y registre el peso corporal del ratón. Administrar la mezcla anestésica mediante inyección intraperitoneal a una dosis de 5 mL/kg de peso corporal (2,5 mg/mL Zoletil 50; 5 mg/mL de clorhidrato de xilacina). El inicio de la anestesia suele producirse entre 5 y 10 minutos después de la inyección, lo que se indica por la pérdida del reflejo de enderezamiento y la reducción de la respuesta a los estímulos externos.
- Transfiera el mouse a la mesa de operaciones. Asegure las extremidades con cinta adhesiva. Administrar 2,5 U/g de heparina por vía intraperitoneal para lograr la heparinización.
- Use una afeitadora eléctrica para recortar el pelaje de la piel abdominal y desinfecte el área con una solución de povidona yodada.
- Realizar un cateterismo de vena porta.
- Hacer una incisión longitudinal de 4 cm desde la parte inferior del abdomen hacia la apófisis xifoides a lo largo de la línea abdominal media. Cortar cuidadosamente el peritoneo con unas tijeras para evitar dañar los órganos viscerales. Inserte el retractor abdominal del ratón para exponer el campo quirúrgico.
- Mueva los intestinos hacia la derecha para revelar la vena porta, el riñón derecho y la vena cava inferior (Figura 2A). Use pinzas arteriales para sujetar la vena cava en el borde superior del riñón.
- Aislar la vena porta (Figura 2A) y ligar el extremo distal con una sutura de seda 6-0. Ate sin apretar otra sutura en el extremo proximal del vaso expuesto.
- Haga una incisión cerca del extremo ligado con unas tijeras de resorte e inserte el catéter. Avance el catéter a través de la incisión hasta el nivel de la bifurcación portal.
- Asegure ambas ligaduras alrededor del catéter y confirme la toma de muestras adecuada conectando el extremo libre del catéter a una jeringa de muestreo. Enjuague con solución salina heparinizada y pinza el catéter (Figura 2C).
- Retire el dispositivo de tracción y reinicie los intestinos. Cubra el área quirúrgica con gasa estéril empapada en solución salina o algodón.
- Realizar cateterismo suprahepático de vena cava inferior.
- Haga una incisión a lo largo del esternón desde la apófisis xifoides, exponiendo el esternón.
- Corta verticalmente el esternón y corta a través del diafragma a lo largo del margen de la costilla para exponer la cavidad torácica.
- Exponer y aislar la vena cava inferior suprahepática (Figura 2B). Ligar cuidadosamente el extremo distal con una sutura de seda 6-0. Ate sin apretar otra sutura en el extremo proximal del vaso.
- Haga una incisión justo debajo del extremo ligado con unas tijeras de resorte e inserte un catéter de 10 cm. Avance el catéter hasta que la punta del catéter esté cerca del hígado y ate ambas ligaduras de forma segura. Confirme la toma de muestras adecuada y sujete el extremo libre del catéter (Figura 2D).
- Enjuague el área quirúrgica con solución salina. Cubra la superficie con una gasa estéril empapada en solución salina.
3. Perfusión hepática
- Sacrificar al ratón mediante el uso de una sobredosis de anestésico y toracotomía de acuerdo con las pautas institucionales para el cuidado y uso de los animales, asegurando que todos los procedimientos se realicen de una manera que minimice el sufrimiento.
- Configure el sistema de perfusión hepática, que incluye un oxigenador, un dispositivo de modulación de temperatura, una bomba de infusión y tubos de infusión, como se muestra en la Figura 1.
- Proporcionan un flujo continuo de gas de 95% de oxígeno y 5% de dióxido de carbono al oxigenador.
- Abra el baño de agua y precaliente la cámara del órgano a 37 °C.
- Prepare el tampón de perfusión KRBH con y sin insulina. Prepare el sistema de tubos con el tampón de perfusión incubado en un baño de agua a 37 °C.
NOTA: El KRBH está libre de BSA y glucosa. El tampón de perfusión KRBH sin insulina humana contiene 5,0 mmol/L de glucosa y 0,25% de BSA, mientras que el tampón de perfusión KRBH con insulina humana contiene 5,0 mmol/L de glucosa, 0,25% de BSA y 4,0 ng/mL de insulina humana. - Coloque el ratón en un recipiente con la temperatura ambiente mantenida en aproximadamente 37 °C. Utilice una almohadilla térmica para mantener la temperatura corporal a 37 °C.
- Infundir el tampón KRBH a través del catéter de la vena porta. Ajuste la velocidad de infusión a 0,2 mL/min a través de una mini bomba.
- Observe que el hígado se vuelve pálido en segundos, lo que indica que el tampón de perfusión está fluyendo a través del hígado. Para eliminar más células sanguíneas restantes en el hígado, detenga la infusión durante 1 minuto en los puntos de tiempo de 4 y 8 minutos, comenzando el tiempo al comienzo de la perfusión.
- Perfundir el hígado con tampón KRBH durante un total de 10 minutos (excluyendo las dos pausas de 1 minuto), lo que representa el período de equilibrio. Recoger la muestra basal del catéter de la vena cava inferior.
- Perfundir el hígado con la misma solución enriquecida con insulina (4,0 ng/mL de insulina humana) durante 30 minutos adicionales.
- Recoja todas las muestras del tubo de la vena cava inferior cada 2 min.
- Registre el peso del hígado después de la perfusión. Recoja muestras de hígado de diferentes lóbulos, congélelas inmediatamente en nitrógeno líquido y luego transfiéralas a -80 °C para su almacenamiento.
- Centrifugar todas las muestras de perfusión recogidas a ~1.000 x g durante 10 min a 4 °C. Recoja los sobrenadantes y transfiéralos a -80 °C para su almacenamiento.
NOTA: La concentración de insulina en las muestras de perfusión se mide utilizando kits de ensayo de inmunoabsorción enzimática (ELISA) de insulina humana. - Después del procedimiento, asegúrese de que todos los desechos biológicos se eliminen de acuerdo con las normas de seguridad.
4. Análisis de datos
- Presente los datos en gráficos XY que muestren la concentración de insulina a lo largo del tiempo.
- Calcule la tasa media de aclaramiento de insulina hepática (HICR AVE) utilizando la siguiente fórmula:
HICRAVE = (1−Cf/Ci) × 100%
donde Ci = concentración inicial de insulina del tampón de infusión, Cf = concentración media final de insulina en los últimos 10 min de la vena cava inferior suprahepática.
Resultados
Este protocolo describe el procedimiento para la infusión hepática para calcular directamente el aclaramiento de insulina hepática. Este modelo es fiable y reproducible. En la Figura 3 se muestra un ejemplo de los resultados obtenidos de un experimento. Después de un período de equilibrio de 10 minutos, el tampón KRBH suplementado con 4,0 ng/ml de insulina humana se perfundió a través de la vena porta durante 30 minutos. Se recolectó líquido de perfusión del catéter en la vena cava inferior suprahepática a intervalos de 2 minutos, y se midió la concentración de insulina humana en el líquido de perfusión. Los resultados se presentan aquí como la media ± SEM. En la Figura 3 se muestra un ejemplo de un experimento de perfusión hepática en el que se comparan ratones con una dieta de control (CD) con ratones con una dieta alta en grasas (HFD). La tasa de aclaramiento de insulina hepática (HICR AVE) fue del 55,57% ± 4,43% para el grupo de EC y del 25,37% ± 6,83% para el grupo de HFD (Figura 3B). Los resultados indican que la alimentación con alto contenido de grasa conduce a un deterioro de la eliminación de insulina.
Después de la perfusión, se obtuvieron muestras de hígado para la tinción de hematoxilina y eosina (HE) y la exploración de portaobjetos completos; Se recolectó un hígado bien perfundido, un hígado mal perfundido y una muestra de hígado de control de un ratón normal. En mejores condiciones de perfusión, la estructura del tejido hepático era normal, los cordones hepáticos estaban dispuestos radialmente y ordenadamente, los hepatocitos tenían una forma intacta, el citoplasma estaba teñido uniformemente y el núcleo era claro y redondo, casi indistinguible del del hígado normal (Figura 4A,B). Cuando la perfusión era escasa, los hepatocitos estaban edematosos y marcadamente sueltos, con necrosis punteada alrededor de las venas centrales, degeneración vacuolar en el citoplasma, picnosis nuclear y desprendimiento vascular (Figura 4C). Los niveles de alanina aminotransferasa (ALT) y aspartato aminotransferasa (AST) en la perfusión se midieron al inicio y después de la perfusión para evaluar la función de los hepatocitos. Los resultados indicaron que no hubo diferencia significativa en los niveles de ALT y AST (Figura 4D).

Figura 1: Componentes del sistema de perfusión. El sistema de perfusión consta de componentes clave, que incluyen una bomba de infusión, una unidad de control de temperatura y un oxigenador. El dispositivo de temperatura variable mantiene el líquido de perfusión a 37 °C, mientras que el oxigenador de membrana utiliza fibras huecas de polipropileno para un intercambio de gases efectivo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Localización anatómica y cateterismo. (A,B) Representa las ubicaciones anatómicas de la vena porta y la vena cava inferior. (C) El catéter de la vena porta se coloca justo debajo de la bifurcación en las ramas hepáticas izquierda y derecha, con una pinza vascular aplicada a la vena cava inferior intrahepática. (D) El catéter se inserta en la vena cava inferior suprahepática y se coloca cerca del margen superior del hígado. Haga clic aquí para ver una versión más grande de esta figura.
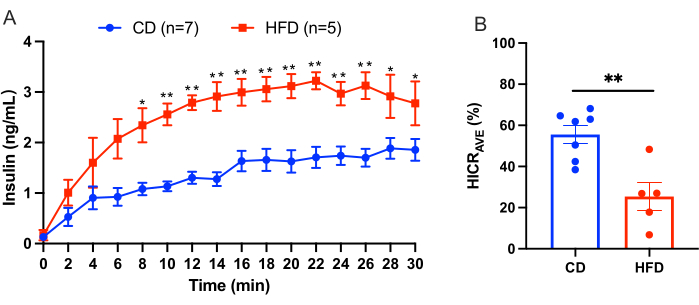
Figura 3: Resultados del experimento de perfusión hepática. Resultados de un experimento de perfusión hepática en el que se compararon ratones con una dieta de control (CD) con ratones con una dieta alta en grasas (HFD). (A) Concentraciones de insulina durante la perfusión hepática en ratones CD (azul, n = 7) frente a ratones HFD (rojo, n = 5). (B) Tasa media de aclaramiento de insulina hepática (HICR AVE). Todos los datos se presentan como media ± SEM, con significación estadística *p < 0,05, **p < 0,01 frente a los ratones CD, analizados mediante una prueba t no apareada. Los resultados sugieren que la alimentación con alto contenido de grasa conduce a un deterioro de la eliminación de insulina. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Impacto de la perfusión en la histología y función hepática. (A) Morfología normal del hígado de ratón (control). (B) Morfología hepática en condiciones de perfusión mejorada. (C) Morfología hepática en condiciones de perfusión subóptimas. La flecha roja indica desprendimiento del vaso, la flecha negra denota vacuolización y la flecha verde resalta la picnosis del núcleo. Aumento: 40x. (D) Niveles de alanina aminotransferasa (ALT) y aspartato aminotransferasa (AST) en la perfusión, medidos al inicio y después de la perfusión. Para el análisis se empleó el método de prueba t pareada. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Pasos críticos en el protocolo
Los procedimientos quirúrgicos descritos anteriormente deben realizarse con cuidado suave para evitar la creación de lesiones en el hígado. Además, la frágil estructura de la pared de los vasos de la vena hepática la hace vulnerable a la punción y al sangrado posterior si no se maneja con cuidado durante la canulación. En este protocolo se utilizan tubos de silicona más blandos para minimizar el daño a los vasos sanguíneos. Se recomienda que el cateterismo sea realizado por un cirujano experimentado que debe practicar con frecuencia para aumentar la tasa de éxito de la intubación y minimizar la duración del procedimiento.
El campo quirúrgico debe irrigarse ocasionalmente con solución salina tibia para mantener la viabilidad de los hepatocitos. Durante la perfusión, el área quirúrgica debe protegerse con gasa estéril o algodón. Esta práctica evita la exposición prolongada al aire, que puede afectar potencialmente la función de los hepatocitos.
Retos y soluciones
Es crucial colocar la punta del catéter justo antes del punto en el que la vena porta se ramifica en las venas portas hepáticas izquierda y derecha. Si el catéter se inserta demasiado profundamente, puede producirse una perfusión desigual entre los lóbulos del hígado. Además, las burbujas de aire deben evitarse cuidadosamente durante el proceso de infusión, ya que tienen el potencial de inducir embolia gaseosa en el hígado. Esto puede afectar significativamente la perfusión del líquido que llega a los hepatocitos y, posteriormente, afectar el aclaramiento de insulina.
Los primeros 10 minutos de infusión del tampón KH constituyen el período de equilibrio, durante el cual la perfusión puede suspenderse 1-2 veces durante 2 minutos cada vez para eliminar las células sanguíneas residuales en la sinusoide hepática tanto como sea posible. Si se observa sangre en la muestra recolectada después de 15 min de perfusión continua, esto puede indicar que las pinzas vasculares en la vena cava inferior hepática no están correctamente colocadas y deben ser revisadas19. Si se pausa la infusión, pueden aparecer glóbulos rojos en la muestra recolectada cuando se reinicia la infusión debido a los glóbulos sanguíneos residuales en los sinusoides hepáticos. Los glóbulos rojos deben separarse mediante centrifugación antes de las mediciones de insulina, ya que la presencia de enzimas degradadoras de insulina dentro de estas células puede afectar potencialmente los niveles de insulina.
La duración del cateterismo quirúrgico, el tiempo de isquemia-reperfusión hepática y la cantidad de gas que ingresa a la vena porta durante la perfusión pueden afectar la función de los hepatocitos y, por lo tanto, la tasa de eliminación de insulina por parte del hígado. El grado de la disfunción hepática se puede controlar midiendo los niveles de alanina aminotransferasa (ALT), aspartato aminotransferasa (AST), lactato deshidrogenasa (LDH) y fosfatasa alcalina (ALP), así como mediante tinción de H&E. Las investigaciones han demostrado que después de una operación exitosa, el hígado continúa funcionando y respondiendo durante al menos 3 h19.
Importancia y posibles aplicaciones de la perfusión hepática de ratón
Los ratones son sujetos de investigación ideales debido a su similitud genética con los humanos, sus cortos ciclos reproductivos y la disponibilidad de herramientas avanzadas de ingeniería genética20. En modelos de ratón, el aclaramiento de insulina se puede evaluar utilizando varios métodos. Durante la prueba de tolerancia a la glucosa intraperitoneal (IPGTT), el aclaramiento hepático de insulina se mide como la relación entre el área bajo la curva (AUC) (calculada por el método trapezoidal) del péptido C y la insulina21. Durante el clamp de hiperinsulinemia euglucémica, la relación entre la tasa de infusión de insulina exógena y la concentración de insulina plasmática en estado estacionario resultante se puede utilizar como método para estimar el aclaramiento de insulina indirectamente22. Sin embargo, todos estos métodos evalúan indirectamente el aclaramiento de insulina hepática.
Algunos investigadores también utilizan ensayos basados en células para evaluar la degradación de la insulina. Las células HepG2 o hepatocitos primarios de ratones se siembran en placas de cultivo y se añade una concentración adecuada de insulina humana. Se recogen muestras del medio de cultivo a intervalos específicos para medir la concentración de insulina humana y evaluar su degradación a lo largo del tiempo17. En este protocolo, se describe un procedimiento de perfusión hepática in situ fácil de usar en ratones para evaluar directamente la tasa de aclaramiento de insulina hepática. En comparación con los estudios in vitro con hepatocitos aislados, la perfusión hepática tiene los beneficios de preservar la arquitectura hepática, la división zonal, la polaridad y la integridad vascular.
El sistema de perfusión hepática de ratón es una herramienta valiosa para investigar la dinámica y los mecanismos moleculares del metabolismo de la insulina hepática. Además, este protocolo podría ser ampliamente utilizado no solo en modelos de enfermedad preinducida, sino también en pruebas de estímulo de desafío agudo. Sin embargo, esta técnica es limitada en el sentido de que debe realizarse in situ. Este protocolo implica una técnica de cateterismo quirúrgico modificada que minimiza la lesión y preserva la integridad anatómica del hígado en la mayor medida posible. Se necesitan más esfuerzos para hacer el mejor uso de esta tecnología para dilucidar los mecanismos de eliminación de la insulina, especialmente en las enfermedades metabólicas asociadas con la resistencia a la insulina.
Divulgaciones
No se declararon conflictos de interés.
Agradecimientos
Este trabajo fue apoyado por la Fundación Nacional de Ciencias Naturales de China (82200948, 82270921, 82170882).
Materiales
| Name | Company | Catalog Number | Comments |
| 60% high-fat diet | Research Diets, USA | D12492 | |
| Alanine aminotransferase Assay Kit | Nanjing Jiancheng Bioengineering Institute | C009-2-1 | |
| Anhydrous Glucose | Sangon Biotech | 50-99-7 | 500 G |
| Aspartate aminotransferase Assay Kit | Nanjing Jiancheng Bioengineering Institute | C010-2-1 | |
| Bovine Serum Albumin | GeminiBio | 700-107P | Fatty Acid-Free |
| Contour TS Blood Glucose Meter | Bayer | PH220800019 | |
| Contour TS Blood Glucose Test Strips | Bayer | DP38M3F05A | |
| Heparin Sodium | Changzhou Qian hong Bio-pharma | H32022088 | 12500 U/2mL |
| Human insulin | Novo Nordisk | S20191007 | 300 U/3mL |
| Human insulin immunoassay kit | Ezassay Biotechnology | HM200 | |
| KRBH buffer (Sugar, BSA free) | coolaber | SL65501 | 500 mL |
| Membrane oxygenator | Xi'an Xijing Medical Appliance | 5 | |
| Microscopic scissors | Shanghai Jinzhong | YBC020 | |
| Micro-serrefine clamp | Ningbo Medical Needle | 180709 | |
| Microsurgery forceps | Shanghai Jinzhong | WA3010, WA3020 | |
| Needle type filter | N-buliv | LG05-133-2 | |
| Povidone-iodine Solution | Shanghai likang Disinfectant Hi-Tech | 20231016J | |
| pump 11 Elite | Harvard Apparatus | PC5 70-4500 | |
| Retractor | Globalebio (Beijing) Technology | GEKK-10mm | 10 mm |
| Silicone Tubing | scientific commodities | #BB518-12 | 0.31 mm × 0.64 mm |
| Silicone Tubing | Fisher Scientific | #11-189-15A | ID 0.5 mm |
| Sodium Chloride Injection | Baxter | S2402023 | 4.5 g/500 mL |
| Surgical silk suture | Yangzhou Huanyu Medical Equipment | 6-0 | |
| Temperature modulation | Xi'an Xijing Medical Appliance | 6 | |
| Thermostatic water bath | Jiaxing Junsi Electronics | HIH-1 | 220 V 50 HZ |
| Three-way Joint | YISAI | AQTCY1.6 | ID 0.4 mm |
| Xylazine Hydrochloride Injection | ShengXin | 20240106 | 200 mg/2mL |
| Zoletil 50 | Virbac | WK001 | 250 mg/5mL |
Referencias
- Najjar, S. M., Perdomo, G. Hepatic insulin clearance: Mechanism and physiology. Physiology (Bethesda). 34 (3), 198-215 (2019).
- Fu, Z., et al. Impaired insulin clearance as the initial regulator of obesity-associated hyperinsulinemia: Novel insight into the underlying mechanism based on serum bile acid profiles. Diabetes Care. 45 (2), 425-435 (2022).
- Koh, H. E., Cao, C., Mittendorfer, B. Insulin clearance in obesity and type 2 diabetes. Int J Mol Sci. 23 (2), 596 (2022).
- Bril, F., et al. Relationship between disease severity, hyperinsulinemia, and impaired insulin clearance in patients with nonalcoholic steatohepatitis. Hepatology. 59 (6), 2178-2187 (2014).
- Herman, R., Sikonja, J., Jensterle, M., Janez, A., Dolzan, V. Insulin metabolism in polycystic ovary syndrome: Secretion, signaling, and clearance. Int J Mol Sci. 24 (4), 3140 (2023).
- Najjar, S. M., Caprio, S., Gastaldelli, A. Insulin clearance in health and disease. Annu Rev Physiol. 85, 363-381 (2023).
- Polidori, D. C., Bergman, R. N., Chung, S. T., Sumner, A. E. Hepatic and extrahepatic insulin clearance are differentially regulated: Results from a novel model-based analysis of intravenous glucose tolerance data. Diabetes. 65 (6), 1556-1564 (2016).
- Castillo, M. J., Scheen, A. J., Letiexhe, M. R., Lefebvre, P. J. How to measure insulin clearance. Diabetes Metab Rev. 10 (2), 119-150 (1994).
- Rubenstein, A. H., Pottenger, L. A., Mako, M., Getz, G. S., Steiner, D. F. The metabolism of proinsulin and insulin by the liver. J Clin Invest. 51 (4), 912-921 (1972).
- Terris, S., Steiner, D. F. Binding and degradation of 125i-insulin by rat hepatocytes. J Biol Chem. 250 (21), 8389-8398 (1975).
- Ooms, H. A., Arnould, Y., Rosa, U., Pennisi, G. F., Franckson, J. R. Total metabolic clearance of crystalline insulin and radio-iodide substitued insulin. Pathol Biol. 16 (5), 241-245 (1968).
- Defronzo, R. A., Tobin, J. D., Andres, R. Glucose clamp technique: A method for quantifying insulin secretion and resistance. Am J Physiol. 237 (3), E214-E223 (1979).
- Asare-Bediako, I., et al. Assessment of hepatic insulin extraction from in vivo surrogate methods of insulin clearance measurement. Am J Physiol Endocrinol Metab. 315 (4), E605-E612 (2018).
- Kim, S. P., Ellmerer, M., Kirkman, E. L., Bergman, R. N. Beta-cell "rest" accompanies reduced first-pass hepatic insulin extraction in the insulin-resistant, fat-fed canine model. Am J Physiol Endocrinol Metab. 292 (6), E1581-E1589 (2007).
- Kotsis, T., et al. Insulin metabolism and assessment of hepatic insulin extraction during liver regeneration. A study in a rat model. J Invest Surg. 33 (1), 69-76 (2020).
- Mondon, C. E., Olefsky, J. M., Dolkas, C. B., Reaven, G. M. Removal of insulin by perfused rat liver: Effect of concentration. Metabolism. 24 (2), 153-160 (1975).
- Tamaki, M., et al. The diabetes-susceptible gene SLC30A8/ZnT8 regulates hepatic insulin clearance. J Clin Invest. 123 (10), 4513-4524 (2013).
- Ghadieh, H. E., Gastaldelli, A., Najjar, S. M. Role of insulin clearance in insulin action and metabolic diseases. Int J Mol Sci. 24 (8), 7156 (2023).
- Winther-Sorensen, M., Kemp, I. M., Bisgaard, H. C., Holst, J. J., Wewer Albrechtsen, N. J. Hepatic glucose production, ureagenesis, and lipolysis quantified using the perfused mouse liver model. J Vis Exp. 200, e65596 (2023).
- Rydell-Tormanen, K., Johnson, J. R. The applicability of mouse models to the study of human disease. Methods Mol Biol. 1940, 3-22 (2019).
- Zaidi, S., et al. Loss of ceacam1 in hepatocytes causes hepatic fibrosis. Eur J Clin Invest. 54 (7), e14177 (2024).
- Piccinini, F., Bergman, R. N. The measurement of insulin clearance. Diabetes Care. 43 (9), 2296-2302 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados