Method Article
Hepatosellüler Karsinomda Neoadjuvan Tedavi Olarak Y-90 Radyoembolizasyonu ve PD-1 İnhibitörü
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu çalışma, başlangıçta nüks riski yüksek olan hepatosellüler karsinom (HCC) hastalarında hepatektomiye yol açan etkili bir neoadjuvan strateji olarak İtriyum-90 Trans-Arteriyel Radyoembolizasyonu (Y-90 TARE) ile anti-PD-1 monoklonal antikoru birleştirmenin metodolojik potansiyelini göstermektedir. Bu yaklaşımın güvenliğini, fizibilitesini ve adım adım prosedürel rehberliğini vurgular.
Özet
Bu çalışma, neoadjuvan tedavi olarak Y-90 transarteriyel radyoembolizasyon (TARE) ve Programlanmış Hücre Ölümü-1 (PD-1) inhibitörlerinin kombine kullanımına odaklanan, yüksek riskli hepatosellüler karsinom (HCC) hastaları için kapsamlı bir tedavi protokolü göstermektedir. Bir vaka raporu ile vurgulanan, benzer terapötik müdahaleler için adım adım bir referans sunar. Y-90 TARE ve PD-1 inhibitörü tedavisi sonrası hepatektomi yapılan bir hasta retrospektif olarak incelendi. Önemli demografik ve klinik detaylar, rehber tedavi seçimine başvuru sırasında kaydedildi. Y-90 TARE uygunluğu ve dozaj hesaplaması Teknesyum-99m (Tc-99m) makroagrege albümin (MAA) perfüzyon haritalama testlerine dayanıyordu. Y-90 mikroküreleri ile lezyon kapsamı, tek foton emisyonlu bilgisayarlı tomografi/bilgisayarlı tomografi (SPECT/BT) füzyon görüntülemesi ile doğrulandı ve advers reaksiyonlar ve takip sonuçları titizlikle belgelendi. Sağ karaciğer lobunda 7.2 cm HCC (T1bN0M0, BCLC A, CNLC Ib) ve başlangıç alfa-fetoprotein (AFP) düzeyi 66.840 ng/mL olan hasta, yüksek nüks riski ve ilk cerrahi reddi nedeniyle Y-90 TARE tercih etti. Akciğer şant fraksiyonu (LSF) ve tümör olmayan oran (TNR) dahil olmak üzere tedavinin parametreleri terapötik sınırlar içindeydi. Toplam 1.36 GBq Y-90 uygulandı. Tedaviden 1 ay sonra, tümör kısmi nekrozla 6 cm'ye küçüldü ve AFP seviyeleri 21.155 ng / mL'ye düştü ve 3 ay boyunca stabil kaldı. 3 ay sonra, PD-1 inhibitörü tedavisi, tümörün 4 cm'ye daha fazla azalmasına ve AFP'nin 1.84 ng / mL'ye düşmesine neden oldu. Hastaya daha sonra hepatektomi uygulandı; Histopatoloji tam tümör nekrozunu doğruladı. Ameliyattan 12 ay sonra, takip seanslarında tümör nüksü veya metastazı gözlenmedi. Bu protokol, Y-90 TARE ve PD-1 inhibitörünün yüksek nüks riski taşıyan HCC hastaları için cerrahiye bir köprü stratejisi olarak etkili kombinasyonunu gösterir ve bu yaklaşımın uygulanması için pratik bir rehber sağlar.
Giriş
Hepatosellüler karsinom (HCC), dünya çapında primer karaciğer kanseri vakalarının %85-90'ını oluşturur ve sindirim sisteminin yaygın malign bir tümörüdür1 . Sorun, HCC'ninen sık görülen 4. malignite ve kansere bağlı mortalitenin ikinci önde gelen nedeniolduğu Çin'de daha da kötüdür 2,3. Bu zorluğu bir araya getiren, 2 yıl içinde önemli bir hasta alt kümesinde gözlenen hepatektomi sonrası yüksek nüks oranıdır. Bu nüksler sıklıkla terapötik olarak dirençli ve agresif olarak malign formlara dönüşür ve hızla ölümcül sonuçlara yol açar. Sonuç olarak, hepatektomi sonrası nüksün azaltılması, HCC hastaları arasında sağkalım oranlarının uzatılması için çok önemlidir 4,5.
Neoadjuvan tedavi, tümörün tam olarak çıkarılma oranını (R0 rezeksiyonu) arttırmayı, görüntülemede gözle görülemeyen mikrometastatik hastalığı ortadan kaldırmayı, postoperatif nüks riskini azaltmayı ve hastanın uzun süreli sağkalımını uzatmayı amaçlayan, cerrahi öncesi yapılan kapsamlı bir dizi tedaviyi ifade eder6. Anatomik olmayan rezeksiyon, mikroskobik vasküler invazyon, 32 ng/mL'yi aşan yüksek serum AFP seviyeleri, 5 cm'den büyük tümör boyutları, çoklu tümörler ve altta yatan siroz gibi yüksek risk faktörleri sunan HCC hastaları için özellikle uygundur7. Neoadjuvan tedavi repertuarı, transkateter arteriyel kemoembolizasyon (TACE), hepatik arteriyel infüzyon kemoterapisi (HAIC) ve seçici internal radyasyon tedavisi (SIRT) gibi çeşitli teknikleri kapsar. Bunlar genellikle tek başına veya kombinasyon halinde uygulanan hedefe yönelik immünoterapilerle entegre edilir8.
Selektif internal radyasyon tedavisinin (SIRT) özel bir şekli olan itriyum-90 transarteriyel radyoembolizasyon (Y-90 TARE), ameliyat edilemeyen primer karaciğer kanserleri ve karaciğer metastazları için önemli bir tedavi seçeneği olarak durmaktadır. Olağanüstü lokal kontrol oranları ile tanınan Y-90 TARE, hedeflenen yüksek doz β radyasyonu doğrudan tümör bölgesine iletirken, sadece 2,5 mm'lik sınırlı ortalama penetrasyon mesafesi, bitişik sağlıklı dokuların korunmasına yardımcı olur9. İtriyum-90 mikroküre seçici iç radyasyon tedavisi (90Y-SIRT), 1970'den bu yana 50 yılı aşkın bir süredir karaciğer malignitelerinin tedavisinde klinik olarak kullanılmaktadır ve büyük ölçekli klinik uygulama yirmi yıldan fazla bir süredir onaylanmıştır10. Güvenliği ve etkinliği, geçen yüzyılda Avrupa ve Amerika Birleşik Devletleri'nde onaylanmasından bu yana kanıtlanmıştır. İtriyum-90 radyoterapisi birkaç on yıldır uluslararası olarak yürütülmekte ve bol miktarda klinik veri sağlamıştır 11,12,13. Ek olarak, periyodik tabloda 39. sırada yer alan sentetik bir radyoaktif element olan İtriyum-90, yüksek enerjili yüksek saflıkta beta ışınları yayar. Kısa bir yarı ömre (64.2 saat) ve sınırlı doku penetrasyon mesafesine sahiptir, bu da ameliyat sonrası izolasyon ihtiyacını ortadan kaldırır 14,15,16. Ayrıca, vasküler teknoloji ve çürüme ürünleri insan vücuduna zararsızdır15,17. Aynı zamanda, anti-PD-1 monoklonal antikorlar, bağışıklık hücrelerinin kanser hücrelerine karşı sitotoksik potansiyelini gençleştirir. Erken evre HCC hastalarında daha sağlam bağışıklık profilleri kaydedildiğinden, PD-1 inhibitörleri neoadjuvan ortamlarda giderek daha fazla kullanılmaktadır. İşlevsel olarak, bu PD-1 monoklonal antikorlar, Y-90 TARE tarafından indüklenen immünojenik hücre ölümünü arttırır ve bağışıklık sisteminin tümör hücrelerini tanıma ve ortadan kaldırma yeteneğini artırır. Y-90 TARE'nin mekanizması, tümör heterojenliğini ve immün kaçmayı ele alan ve böylece PD-1 monoklonal antikorlarının etkisini artıran β-radyasyon yoluyla doğrudan tümör hücresi yıkımını içerir. Bununla birlikte, şu an itibariyle, neoadjuvan tedavide Y-90 TARE ve PD-1 inhibitörlerinin kombine kullanımı ile ilgili kapsamlı çalışmaların nispeten az olduğunu belirtmek önemlidir 18,19,20.
Bu vaka çalışması, hepatektomiye yol açan neoadjuvan bir tedavi olarak PD-1 inhibitörü ile kombine edilen Y-90 TARE'nin sürecini, güvenliğini ve potansiyelini gösteren pratik bir rehber görevi görür. Bu neoadjuvan tedavi ve ardından hepatektomi ile tedavi edilen bir HCC hastasının retrospektif değerlendirmesini yaparak, terapötik adımları detaylandırıyor, advers olayları yönetiyor ve sonuçları değerlendiriyoruz. Bulgularımız, yüksek riskli HCC hastalarının yönetiminde Y-90 TARE ve PD-1 inhibitör tedavisinin uygulanmasında klinisyenler için kapsamlı bir plan sağlamayı amaçlamaktadır.
OLGU SUNUMU:
49 yaşında erkek olan hasta 168 cm boyunda, 62 kg ağırlığında ve toplam karaciğer hacmi (VOI) 1236 mL, tümör hacmi 157 mL ve hedef tümör perfüzyon hacmi 246 mL idi. Toplam akciğer hacmi 2124 mL olup, LSF %17.17 ve TNR 8.2 idi. Sağ hepatik lobda 7.2 cm büyüklüğünde HCC (T1bN0M0, BCLC A, CNLC Ib) ve başlangıç alfa-fetoprotein (AFP) düzeyi 66.840 ng/mL idi. Hastanın ameliyat öncesi ECOG-PS (Eastern Cooperative Oncology Group Performance Status) değeri 0 olarak skorlandı. Nüks riskinin yüksek olması ve ilk ameliyatın reddedilmesi nedeniyle seçilen Y-90 TARE'yi seçmeden önce herhangi bir farmakolojik tedavi almamıştı.
Protokol
Tedavi prosedürü, Jinan Üniversitesi Birinci Bağlı Hastanesi'nin kurumsal inceleme kurulu tarafından onaylandı. Çalışmaya dahil edilen katılımcıdan bilgilendirilmiş onam alındı.
1. Neoadjuvan tedavi için hasta seçimi
- Dahil edilme kriterleri
- Cerrahi olarak çıkarılması tamamlamaya uygun lezyonları olan hastaları seçin (R0 rezeksiyonu).
- Anatomik olmayan rezeksiyon, vasküler invazyon, 32 ng/mL'yi aşan yüksek serum AFP seviyeleri, 5 cm'den büyük tümör boyutları, çoklu tümör varlığı ve altta yatan siroz dahil olmak üzere nüks için yüksek risk faktörleri sergileyen seçilmiş hastalar.
- Hariç tutma kriterleri
- İlk tanı sırasında cerrahi tedavi gerektiren yüksek riskli nüks faktörleri olan hastaları hariç tutun. Y90 tedavisini karşılayamayan hastaları hariç tutun.
2. Y-90 endikasyonları ve doz değerlendirmesi
- Tümöral kan akımını belirlemek için DSA anjiyografi
- Hastadan işlem için sırtüstü yatmasını isteyin. Rutin dezenfeksiyon ve örtü işlemi yapın. Anestezi için femoral arter ponksiyon bölgesinde lokal olarak% 4'lük bir lidokain solüsyonu uygulayın.
- Rutin el yıkama prosedürlerine uyun, cerrahi kıyafetler giyin ve steril eldivenler giyin.
- Seldinger tekniğini kullanarak sağ ortak femoral artere bir mikropunktur iğnesi yerleştirin. Bunu, bir tuzlu su yıkama sistemine bağlı bir kılıfın yerleştirilmesiyle takip edin.
- Femoral arter ponksiyonu ve kateter yerleştirme başarılı olduğunda (parlak kırmızı arteriyel kan gözlenir), anjiyografik kateteri çölyak gövdesine ilerletin. Görüntüleme, hepatik arter dışında tümör sağlayan damarların varlığını gösteriyorsa, tümör besleyen damarları tanımlamak için superior mezenterik arter, infra-diyafragmatik arter vb. üzerinde anjiyografi yapın.
- Hepatik tümörün yalnızca sağ hepatik arterin tek bir dalı tarafından sağlanıp sağlanmadığını belirlemek için çölyak gövdesinin kökeninde anjiyografi yapın.
- Sağ hepatik arterin sağ inferior dalında süper seçici kateterizasyon için koaksiyel mikrokateter tekniğini kullanın. Tedarik eden damarın yerini doğrulamak için anjiyografi yapın.
- Teknesyum-99m (Tc-99m) MAA enjeksiyonu ve görüntüleme
- Mikrokateter yoluyla 2 mCi Tc-99m MAA'yı besleme arterlerine enjekte edin.
NOT: Bu prosedür, Amerikan Tıp Fizikçileri Derneği'nin Hepatik Malignitelerin Tedavisinde 90Y Mikroküre Brakiterapi için Dozimetri, Görüntüleme ve Kalite Güvence Prosedürlerine İlişkin Tavsiyelerine uygun olarak yürütülür. Önerilen Tc-99m MAA dozu 2-4 mCi (74-148 MBq) olarak ayarlanmıştır16. Tc-99m MAA dozajının sabit olduğunu ve hastanın kilosuna, vücut yüzey alanına veya lezyonun boyutuna göre değişmediğini not etmek önemlidir. - İntrahepatik Tc-99m MAA dağılımının hedeflenen tümör bölgesini tanımlamak için konik ışınlı bilgisayarlı tomografi (CBCT) yapın. Arteriyel faz sırasında bölgeyi sagital, koronal ve eksenel görünümlerde manuel olarak ana hatlarıyla belirtin.
- CBCT'deki SEG4 Özellikleri seçeneğini kullanarak hedeflenen tümör bölgesinin hacmini hesaplayın.
- Mikrokateter yoluyla 2 mCi Tc-99m MAA'yı besleme arterlerine enjekte edin.
- LSF, TNR ve Y90 mikroküre dozimetri hesaplamaları
- Tarayıcıda tarama modları (SPECT ve BT) parametrelerini yapılandırın ve Tc-99m MAA infüzyonundan 1-2 saat sonra hasta üzerinde SPECT/BT görüntülemesi gerçekleştirin. Tc-99m MAA'nın karaciğer, akciğer ve diğer organlardaki dağılımını belirlemek üzere SPECT ve CT görüntülerini birleştirmek için Füzyon işlevini seçin.
- Düzlemsel görüntüleme kullanarak akciğer şant fraksiyonunu (LSF) hesaplayın.
- Düzlemsel görüntülerde karaciğer, sağ akciğer ve sol akciğerin ön ve arka görünümlerinde Tc-99m MAA dağılımının ayırt edilebildiği karaciğer ve akciğerler içindeki farklı alanları işaretleyerek ilgilenilen bölgeleri (ROI'ler) manuel olarak çizin. Bu adım bir nükleer tıp teknisyeni tarafından gerçekleştirilir.
NOT: Akciğer Şant Fraksiyonu (LSF), karaciğerden her iki akciğere şant eden 99mTc-MAA fraksiyonunu temsil eder. Düzlemsel görüntülemeyi kullanan nükleer tıp teknisyeni, hem ön hem de arka görünümlerde karaciğer ve akciğerlerin etrafına (sol ve sağ akciğer için ayrı ayrı) ROI'leri manuel olarak çizer. Her parça için sayım sonucu daha sonra bu iş istasyonundan elde edilir. - Standart bir nükleer tıp iş istasyonu kullanarak her bir yatırım getirisi için sayıları hesaplayın. Aşağıdaki formülü kullanın:
Akciğer sayıları =
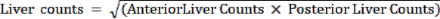
- Aşağıdaki denklemi kullanarak LSF'yi hesaplayın:

- Düzlemsel görüntülerde karaciğer, sağ akciğer ve sol akciğerin ön ve arka görünümlerinde Tc-99m MAA dağılımının ayırt edilebildiği karaciğer ve akciğerler içindeki farklı alanları işaretleyerek ilgilenilen bölgeleri (ROI'ler) manuel olarak çizin. Bu adım bir nükleer tıp teknisyeni tarafından gerçekleştirilir.
- SPECT/BT görüntülemenin üç boyutlu (3D) segmentasyon uygulamasını kullanarak tümör-normal karaciğer oranını (TNR) hesaplayın.
- Bilgisayarlı tomografi dilimlerine dayalı olarak hem tümör hem de normal karaciğer alanlarını kapsayacak şekilde aynı boyutta ayrı ROI'leri manuel olarak çizin.
- Bir iş istasyonu kullanarak her bir ROI'de normal karaciğerin birim hücre başına ortalama sayısı üzerinden tümörün birim hücre başına ortalama sayısını hesaplayın.
- Aşağıdaki denklemi kullanarak TNR oranını hesaplayın:

- Öngörülen aktiviteyi (Gbq) ve dozu (Gy) elde etmek için hesaplamalardan elde edilen sonuçlara dayalı olarak Y-90 RE (DAVYR) uygulaması için doz ve aktivite görselleştiricisinde Bölme modeli denklemini kullanın.
3. Y-90 Dara tedavisi
- Adım 2'de açıklanan yaklaşımı izleyin ve ardından adım 2.1'de tanımlanan kan sağlayan arterler üzerinde doğrudan bir anjiyogram yapın.
- Besleme arterlerinin konumunu daha kesin bir şekilde doğrulamak için mevcut anjiyografik görüntüyü 2. adımdaki görüntüyle karşılaştırın.
- Süper seçici kateterizasyondan sonra kateteri sağlayan arterlere ilerletin ve ardından önceden hesaplanmış doz ve aktivite ile Y90 mikrokürelerini sağlayan arterlere enjekte edin.
- Y-90 Dara için, göğüsten pelvisin hemen üstüne kadar özel tüm vücut PET/CT taramaları alın. Aşağıdaki parametreleri kullanarak PET-CT gerçekleştirin: 80 s ila 110 s, 120 kVp, 40 mA, 1 s tüp dönüşü, 4 mm kesit kolimasyonu ve 8 mm/s (yani adım, 2) yatak hızı.
- PET / CT görüntüleri üzerine çizilen bir hacim ROI'sinden TNR'yi değerlendirin ve ardından Y-90'ın dağılımını doğrulamak için Tc-99m MAA dağılımının SPECT / CT görüntülerinden elde edilen bir TNR ile karşılaştırın.
- Tc-99m MAA ve Y-90 mikrokürelerini dağıtırken ve enjekte ederken, kurşun önlükler, göz siperleri ve kurşun eldivenler gibi uygun koruyucu ekipman kullanın.
- Y-90 TARE tedavisinden sonra herhangi bir özel tedavi uygulamayın ve radyasyon riskini en aza indirmek için Y-90 tedavisi alan hastalardan 7 gün boyunca başkalarıyla yakın temastan kaçınmalarını isteyin.
4. Y90 tedavisinden sonra sıralı PD-1 inhibitörü tedavisi
- Y90 tedavisini takiben en az 2 ay boyunca lezyon stabilitesini gözlemleyin. Tutarlı izleme için uygun görüntüleme yöntemlerini kullanın. Nüks için herhangi bir yüksek risk faktörünün varlığını belirlemek için hastayı yeniden değerlendirin.
- Yüksek risk faktörleri belirlenirse, herhangi bir kontrendikasyon olmadığından emin olarak hastanın immünoterapi için uygunluğunu değerlendirin. Hastanın finansal hususlarına bağlı olarak Nivolumab veya Pembrolizumab gibi uygun bir PD-1 inhibitörü seçin.
- Seçilen inhibitörü, her biri 21 gün arayla 1-2 döngüde uygulayın. 2 mg / mL'de 100 mL fizyolojik salin kullanılarak hazırlanan PD-1 inhibitörünü 1 saat boyunca periferik intravenöz enjeksiyon yoluyla uygulayın, böylece bir PD-1 inhibitör tedavisi döngüsü tamamlayın.
- Tedavi sonrası değerlendirme ve takip
- PD-1 inhibitör tedavisi tamamlandıktan sonra, takip görüntüleme çalışmaları ve tümör belirteç çalışmaları ön tedavi için kullanılanlarla aynıdır.
- Standart değerlendirme kriterleri21'i kullanarak hastanın PD-1 inhibitör tedavisine aylık yanıtını değerlendirin.
5. Y90 TARE ve PD-1 inhibitörünü takiben hepatektomi
- Hepatektomi kararı: PD-1 inhibitör tedavisinden en az 2 ay sonra lezyonun stabilitesini değerlendirmek için daha önce uygulanan aynı radyolojik teknikleri kullanarak tedavi bölgesini değerlendirin ve nüks için yüksek risk faktörlerinin bulunmadığından emin olun.
- Hepatektomi için ameliyat öncesi hazırlıklar: Tümör rezeksiyon sınırlarını doğru bir şekilde tanımlamak ve olası metastatik lezyonları incelemek için hastaya ameliyattan 3 gün önce İndosiyanin yeşili uygulayın.
- Cerrahi prosedür
- Sırtüstü pozisyonda bulunan hastaya genel anestezi için trakeal entübasyon yapın. Üst karın bölgesi için meme ucu çizgisine üstün, kasık simfizine ve lateral olarak orta aksiller çizgiye uzanan cerrahi dezenfeksiyon yapın.
- Periton boşluğuna girdikten sonra, herhangi bir anormallik veya metastatik odak için karaciğer ve çevresindeki yapıları kapsamlı bir şekilde incelemek için bir laparoskop kullanın.
- Karaciğerin 6. segmentinde (S6) bulunan tümörü ortaya çıkarmak için sağ karaciğerin alt sınırını kavrayıcılarla yükseltin.
- İndosiyanin yeşilini intravenöz olarak enjekte ettikten sonra, tümörün boyutunu dikkatlice değerlendirmek için floresan görüntüleme moduna geçin ve bitişik dokulara istila veya önemli yapışmalar olmamasını sağlayın.
- Harmonik bir neşter kullanarak sağ karaciğerin alt sınırı, arka periton ve sağ böbrek arasındaki bağ dokularını inceleyin. Sağ üçgen ve koroner bağları üstün bir şekilde diseksiyon yaparak ilerleyin, böylece ikinci porta hepatis'i ortaya çıkarın.
- Sağ lobu tamamen ortaya çıkarmak için karaciğeri sola çekmek için ördek gagası forseps kullanmak.
- Tümör ile bitişik sağlıklı doku arasındaki marjı net bir şekilde belirlemek için floresan görüntüleme modunu kullanın.
- Monopolar koter kancası kullanarak rezeksiyon kılavuz çizgilerini tümör kenarından yaklaşık 1-2 cm uzakta işaretleyin.
- İntraoperatif kanamayı azaltmak için portal ven ve hepatik arterden vasküler akışı geçici olarak kesin. Turnikeleri 15 dakikalık oklüzyon ve ardından 5 dakikalık reperfüzyon döngülerinde sıkın.
- Karaciğer parankimini harmonik neşter ile kılavuz çizgiler boyunca dikkatlice geçirin. Küçük safra kanallarını ve damarları neşter ile pıhtılaştırın, önce kelepçeleyin ve sonra daha büyük yapıları kesin.
- Tümör örneğini eksize ettikten sonra histopatolojik değerlendirme için gönderin.
- Hepatik kesim yüzeyini ılık normal tuzlu su ile durulayın, ardından bipolar pıhtılaşma ile hemostaz elde edin. Tüm kesileri kapatmak için emilebilir dikiş kullanın. Hastanın ameliyat sonrası hastanede kalış süresi 10 gün sürdü. Ameliyat sonrası ağrı yönetimi için, Tramadol'ü kas içi enjeksiyon yoluyla uygulayın.
- Hepatektomi sonrası takip
- Herhangi bir potansiyel postoperatif nüks veya metastatik lezyonu derhal tespit etmek için, ameliyattan sonraki ilk 3 ay boyunca aylık olarak takip muayeneleri yapın. Bu süreyi takiben, önümüzdeki 2 yıl boyunca her 3 ayda bir ve sonraki 3 yıl boyunca her 6 ayda bir, ameliyattan sonra toplam 5 yıla kadar muayeneler planlayın.
Sonuçlar
MRG, bu çalışmada karaciğer hacminde bir azalma, dalgalı bir karaciğer yüzeyi ve genişlemiş karaciğer çatlakları ortaya çıkardı. Karaciğerin sağ arka lobunda yaklaşık 7.2 cm x 5.6 cm x 6.6 cm boyutlarında, neredeyse küresel bir kitle tespit edildi. Kitle, T1 ağırlıklı görüntülemede (T1WI) karışık düşük sinyaller, T2 ağırlıklı görüntülemede (T2WI) karışık yüksek sinyaller ve difüzyon ağırlıklı görüntülemede (DWI) yüksek sinyaller sergiledi. Karaciğer sirozu ve HCC olasılığını düşündüren belirgin sınırlar ve heterojen arteriyel faz artışı sergiledi (Şekil 1).
Kateter manevrası sırasında, abdominal aort, diyafragmatik arterler ve süperior mezenterik arterden kaynaklanan tümör besleyici damarların olmadığını doğrulamak için anjiyografik değerlendirme yapıldı. Çölyak gövdesinin kökenindeki anjiyografide, sağ hepatik arterin segmental dalı (S6 veya sağ alt dal) belirgin kıvrımlılık ve genişleme sergiledi. Bu gözlem, hepatik tümörün vasküler beslemeyi yalnızca bu tekil arteriyel daldan aldığını ortaya koymuştur (Şekil 2A). Y-90 TARE için temel bir ön değerlendirme, Tc-99m MAA ve Y-90 mikroküreleri arasındaki karşılaştırılabilir doz dağılımından yararlanan Tc-99m MAA perfüzyonu kullanılarak haritalama testlerini içerir. Tc-99m MAA enjeksiyonu sonrası, Tc-99m MAA için perfüzyon zonu tanımlandı ve hedef tümör için hesaplanan perfüzyon hacmi 246.27 mL idi (Şekil 2A). % 20'den daha yüksek bir LSF gösteren hastalar, radyasyona bağlı akciğer hasarı için yüksek risk altındadır ve bu da onları Y-90 tedavisi için tipik olarak uygun olmayan adaylar haline getirir22. Yüksek bir TNR, izin verilen maksimum karaciğer radyasyon dozuna bağlı kalırken daha güçlü bir tümör öldürücü etki anlamına gelir. Hesaplanan LSF %17.17 ve TNR 8.2 olarak kaydedildi (Şekil 2B).
Bölme modeli, Tıbbi Dahili Radyasyon Dozu (MIRD) ve Vücut Yüzey Alanı (BSA) yöntemleriyle karşılaştırıldığında, TNR'yi hesaba katarak üstün kişiselleştirilmiş radyasyon dozu tahmini sağlar ve kişiselleştirilmiş tedavi planlamasını geliştirir. Bölme modelinden elde edilen sonuçlar, normal karaciğer için 36.6 Gy (40 Gy eşiğinin altında), akciğer dokusu için 17.6 Gy (20 Gy sınırı dahilinde) ve tümör için 300 Gy'lik bir tepe dozu olan radyasyon dozlarını gösterir ve 1.36 GBq'lik bir Y-90 mikroküre aktivitesi gerektirir (Şekil 3A). Y-90 TARE tedavisinden sonra (Şekil 3B), hedef dışı yayılma veya kapsama tutarsızlığı olmadığını gösteren bir PET / BT taraması yapıldı (Şekil 3C).
Y-90 TARE tedavisinden 1 ay sonra tümör 6 cm'ye düşürüldü ve AFP seviyesi 21.155 ng/mL'ye düştü. Tedaviden 3 ay sonra, tümör önemli bir değişiklik göstermedi. Kalıcı yüksek nüks riski göz önüne alındığında, bir PD-1 inhibitörü ile tedaviye başlanmıştır. Y-90 TARE tedavisinden 5 ay sonra (PD-1 inhibitörü tedavisine başladıktan 2 ay sonra), lezyon 4 cm'ye daha da azalmış ve AFP seviyesi dramatik olarak 1.84 ng / mL'ye düşmüştür (Şekil 4 ve Tablo 1).
Hepatektomi sırasında hem beyaz ışık hem de floresan altında tümörün görüntüleri sunulmuştur (Şekil 5A). Hepatektomi ile elde edilen tümör örnekleri gross patoloji için frozen kesitlere dönüştürüldü. Mikroskobik olarak incelendiğinde, tümör hücresi yok, Y-90 mikrokürelerinin birikmesi, önemli lenfositik infiltrasyon ve bitişik normal karaciğer dokusunda sirotik değişiklikler ortaya çıktı23 (Şekil 5B). Ameliyattan 12 ay sonra, takip ve nüks değerlendirmesi yapıldı ve MRG görüntülemede nüks veya metastaz belirtisi görülmedi (Şekil 5C).
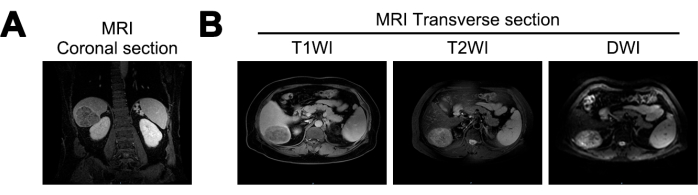
Şekil 1: İlk tanıda Manyetik Rezonans Görüntüleme (MRG) görüntüleme. (A) MRG T1 Ağırlıklı Görüntüleme (T1WI) sinyalinin koronal kesiti, (B) MRG T1WI'nin enine kesitleri, T2 Ağırlıklı Görüntüleme (T2WI) ve Difüzyon Ağırlıklı Görüntüleme (DWI) sinyalleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Teknesyum-99m Makroagrege Albümin (Tc-99m MAA) enjeksiyonu ve dağıtımı. (A) Teknesyum-99m makroagrege albüminin (Tc-99m MAA) enjeksiyon işleminin gösterimi. (B) Karaciğerde 99mTc MAA'nın doz dağılımının sunumu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: İtriyum-90 Transarteriyel Radyoembolizasyon (Y-90 TARE) tedavi süreci. (A) Bölme modeli kullanılarak hesaplanan verilerin tasviri. (B) Y-90 mikro küreciklerinin paketlenmesi ve enjeksiyonu. (C) Y-90 mikrokürelerinin dozaj dağılımını doğrulamak için Tek Foton Emisyonlu Bilgisayarlı Tomografi / Bilgisayarlı Tomografi (SPECT / BT). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Tümör karşılaştırması. (A) İlk tanıda MRG görüntüsünün sunumu, (B) MRG görüntülerini Y-90 TARE ile tedaviden 1, 3 ve 5 ay sonra gösterir. Programlanmış Hücre Ölümü-1 (PD-1) inhibitörü tedavisi Y-90 TARE'den 3 ay sonra yapıldı. Hastaya Y-90 TARE işleminden 3 ay sonra PD-1 inhibitörü ile tedavi edildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Hepatektomi ve sonraki takip. (A) İntraoperatif olarak gözlenen tümörün sunumu. (B) Postoperatif tümör örneğinin ve Hematoksilen ve Eozin (H & E) boyamanın gösterimi. (C) Ameliyattan 2 ve 12 ay sonra MRI görüntüleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Y-90 TARE ile tedavi sonrası | |||||
| İlk tanı | 1 aylar | 3 aylar | 5 aylar | ||
| AFP (ng/mL) | 66840 | 21155 | 19535 | 1.84 | |
Tablo 1: Tedavi sonrası AFP seviyesi ölçümü.
Tartışmalar
Yüksek riskli nüks faktörleri ile başvuran HCC hastaları için, küratif hepatektomiden sonra bile olumsuz bir prognoz devam eder ve sağkalım oranlarını artırmak için etkili neoadjuvan tedavinin önemini vurgular24,25. Girişimsel tedavilere göre, Y-90 TARE üstün bir yerel kontrol oranınasahiptir 26. Y-90 TARE vücudun anti-tümör tepkisini22 aktive edebilirken, karaciğer kanseri için neoadjuvan tedavide Y-90'ın PD-1 inhibitörleri ile birlikte kullanımı henüz bildirilmemiştir. Bu çalışmada, yüksek riskli nüks faktörleri olan ve tam remisyon elde edilen bir HCC hastasında neoadjuvan Y-90 TARE olgusu ve ardından anti-PD-1 monoklonal antikor tedavisi retrospektif olarak gözden geçirilmiştir. Referans için ayrıntılı bir tedavi protokolü sunar.
Bu çalışmanın protokolündeki birkaç önemli nokta dikkat çekmektedir. İlk olarak, MAA99'un bozulma ve yeniden yayılma potansiyeli göz önüne alındığında, MA99 Enjeksiyonundan 1-2 saat sonra SPECT / BT görüntüleme yapılmalıdır. İkinci olarak, karaciğer ve akciğer hasarına yol açabilecek ektopik yerleşimi ve aşırı dozu önlemek için Y-90 mikrokürelerinin dozunu titizlikle hesaplamak zorunludur. Son olarak, neoadjuvan sonrası cerrahi göz önüne alındığında, cerrahi süreyi kısaltmak ve cerrahiye bağlı immünosupresyonu en aza indirmek için net sınırlar sağlayan anatomik olmayan bir rezeksiyon tercih edilebilir.
Bu çalışmada, hasta neoadjuvan tedaviyi takiben uyku bozuklukları ve kabızlık semptomları sergiledi. Bunlar, uyku bozuklukları için eszopiklon ve kabızlık için bisakodyl enterik kaplı tabletler kullanılarak ele alındı. Bu, Y-90 TARE ve PD-1 inhibitörü ile ilişkili advers reaksiyonların minimal olduğunu ve farmakolojik olarak tedavi edilebileceğini düşündürmektedir. Ayrıca, Y-90 TARE ve PD-1 inhibitörü, karaciğer dokusu veya lezyon ödemi, ciddi yapışma veya artan kırılganlığa neden olmadı, bunların ikincisi sonraki cerrahi çıkarma sırasında önemli kanama veya eksik rezeksiyonu hızlandırabilir. Sonuç olarak, Y-90 TARE sonraki cerrahi prosedürlere müdahale etmedi veya etkilemedi.
AFP düzeylerine ve lezyondaki değişikliklere bağlı olarak, Y-90 TARE'yi takiben sırayla anti-PD-1 monoklonal antikor tedavisi uygulandı. 5 ay sonra, lezyon patolojik bir tam yanıt (pCR) elde etti, bu da zamanlamanın ve tedavi seçiminin uygun olduğunu gösterdi. Y-90 TARE'de medyan yanıt süresinden önce tedavi stratejisinin ayarlanması, hastalığın ilerlemesi riskini etkili bir şekilde azaltabilir27. Bununla birlikte, lezyon rezolüsyonunun derecesi, hepatik karsinom rezeksiyonu sonrası sağkalım28 ile belirgin bir şekilde ilişkili olsa da, Y-90 TARE tarafından indüklenen pCR vakaları için müteakip cerrahi müdahalenin gerekli olup olmadığı daha fazla araştırma için bir konu olmaya devam etmektedir. Ayrıca, Y-90 TARE ve anti-PD-1 monoklonal antikor tedavisinin optimal zamanlaması ve dozu ile sonraki cerrahi için en iyi zamanlama ve yaklaşım daha fazla doğrulanmayı beklemektedir. Ek olarak, tüm tedavi sürecinin maliyetinin yüksek olması, hastalara önemli bir mali yük getirebilir.
Olgumuzda Y-90 TARE ve PD-1 inhibitörü tedavisini takiben pCR ortaya çıkmasının mevcut çalışmada çeşitli faktörlerle ilişkili olduğu varsayılmaktadır. Başlangıçta, tümör içi radyasyon dozu göz önünde bulundurulur; Y-90 tedavi dozu24'ü değerlendirmek için Tc-99m MAA'ya (bölme modeli) dayalı geleneksel bir metodoloji kullandık. Özellikle, hastanın yüksek TNR'si nedeniyle, bu çalışmada lezyona nüfuz eden radyasyon dozu yükseldi, Y-90 mikroküreleri tümörü kapsamlı bir şekilde kapladı ve böylece iyileştirici bir etki elde etti. İkinci olarak, tümör içinde önemli immün hücre infiltrasyonu, hastanın pCR'ye karşı anti-tümör bağışıklığının önemli bir rolünü gösterir, göz ardı edilemez. Bunun hastanın ilk tanısı olduğu ve tümörün ileri evrede olmadığı göz önüne alındığında, intrinsik anti-tümör bağışıklığı devam etti. Y-90 TARE ve PD-1 inhibitörünün neden olduğu tümör hücresi ölümünün ardından, tümör antijen maruziyetini artıran, konak anti-tümör bağışıklığını aktive eden ve bağışıklık hücresi infiltrasyonu ve bunun sonucunda ortaya çıkan tümör öldürücü etki ile sonuçlanan bir inflamatuar yanıt tetiklenebilir29. Ek olarak, önceki araştırmamız, peritümöral hepatik inflamasyon ile tümör direnci arasında bir korelasyon olduğunu ve bu da hepatik immün toleransı potansiyel olarak şiddetlendirebileceğini tespit etti30,31. Bu çalışmada hastanın peritümöral dokusunda karaciğer sirotik değişiklikler olmasına rağmen, anlamlı bir inflamatuar yanıt gözlenmedi ve hepatit B ile ilişkili tüm incelemeler dikkat çekici değildi. Bu, hastanın hepatik immün mikroçevresinin, Y-90 TARE ve PD-1 inhibitörünün hepatik immün mikroçevreyi arttırmada çok önemli bir stratejiyi temsil ettiği potansiyel olarak değiştirilebilir bir alt gruba ait olduğunu göstermektedir.
Y-90 TARE tedavisinin uygulanması, nükleer tıp, girişimsel radyoloji, hepatobiliyer cerrahi, görüntüleme ve onkoloji dahil olmak üzere birden fazla departmanda sıkı koşullar ve işbirlikçi çabalar gerektirir. Pnömoni, mide ülseri ve akut pankreatit gibi radyasyona bağlı komplikasyon potansiyeli, titiz doz hesaplamalarına duyulan ihtiyacın altını çizmektedir. Nükleer tıp departmanı tarafından yürütülen ameliyat öncesi simülasyon değerlendirmeleri ve doz tahminleri, Y90 TARE tedavi döngüsünü uzatabilir ve potansiyel olarak tümör ilerlemesine yol açabilir. Y90 TARE, tümör alanlarını normal karaciğer dokusundan ayırt etmedeki zorluklar nedeniyle, özellikle çoklu intrahepatik metastazı ve yaygın veya küçük çaplı (<0,5 cm) karaciğer kanserleri olanlar olmak üzere tüm karaciğer kanserleri için uygun olmayabilir, bu da doz yanlış tahminine yol açabilir. Hepatosellüler karsinomda neoadjuvan tedavi için PD-1 inhibitörleri ile birlikte Y90'ın kullanımına ilişkin raporlar sınırlıdır. Etkinliğini ve terapötik detaylarını doğrulamak için hala büyük ölçekli klinik çalışmalara ihtiyaç vardır.
Özetle, Y-90 TARE ve PD-1 inhibitörünün kombinasyonu, HCC hastalarının neoadjuvan tedavisi için güvenli ve etkili bir yaklaşım sunmaktadır. Bu strateji sadece lokal tümör yükünü hafifletmek ve mikro metastazları mümkün olan en aza indirmekle kalmaz, aynı zamanda bunu hastalığın ilerlemesi riskini artırmadan da yapar. Sonuç olarak, hastalar için ameliyat sonrası nükssüz dönemi uzatma potansiyeline sahiptir. Yüksek riskli HCC'li hastaların neoadjuvan tedavisi için tekrarlanabilir ve uygulanabilir bir protokol sunuyoruz.
Açıklamalar
Yazarlar, araştırmanın potansiyel bir çıkar çatışması olarak yorumlanabilecek herhangi bir ticari veya finansal ilişkinin yokluğunda yapıldığını beyan ederler.
Teşekkürler
Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı (82303287), Guangdong Temel ve Uygulamalı Temel Araştırma Vakfı (2021A1515110083), Guangzhou'daki Bilim ve Teknoloji Projeleri (202201010267), Merkezi Üniversiteler için Temel Araştırma Fonları (21621058) tarafından finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| ARTIS pheno Cutting-edge robotic imaging system | SIEMENS HEALTHINEERS | 10849000 | |
| DISPOSABLE LAPAROSCOPIC INSTRUMENT | Hangzhou Kangji Medical Instruments | 108Y series | |
| Endoscopic fluorescence camera system | Stryker | PC9000 | |
| ENSEAL G2 Curved Tissue Sealer | Ethicon from Johnson | NSLG2C14 | |
| Fluorescent laparoscopic lens | Stryker | SC9534 | |
| laparoscopic stapler | Ethicon from Johnson | PCEE45A | |
| Optima NM/CT 640 SPECT/CT | GE healthcare | 200439 | |
| SURGICEL FIBRILLAR Hemostat | Ethicon from Johnson | 1962 | |
| Tc-99m macroaggregated albumin [MAA](DAXIMAGE-MAA) | JUBILANT RADIOPHARMA | 877003-93-5 | |
| Tislelizumab Injection(PD-1 inhibitor) | BeiGene, Ltd | 10-848 | |
| ultrasound knife | Ethicon from Johnson | HARHD36 | |
| Xeleris Functional Imaging Workstation | GE healthcare | 5436592-22 | |
| Y-90 resin microspheres(SIR-Spheres) | Sirtex Medical Limited | SIR-Y001 |
Referanslar
- Su, H., et al. Molecular mechanism of CK19 involved in the regulation of postoperative recurrence of HBV-associated primary hepatocellular carcinoma in Guangxi. Ann Transl Med. 9 (24), 1780 (2021).
- Zheng, R., et al. Cancer incidence and mortality in China, 2016. J Natl Cancer Center. 2 (1), 1-9 (2022).
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA. 71 (3), 209-249 (2021).
- Heimbach, J. K., et al. AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology (Baltimore, Md.). 67 (1), 358-380 (2018).
- Sato, T., et al. A prospective study of fully covered metal stents for different types of refractory benign biliary strictures. Endoscopy. 52 (5), 368-376 (2020).
- Zhou, H., Song, T. Conversion therapy and maintenance therapy for primary hepatocellular carcinoma. Biosci Trends. 15 (3), 155-160 (2021).
- Xu, X. F., et al. Risk factors, patterns, and outcomes of late recurrence after liver resection for hepatocellular carcinoma. JAMA Surg. 154 (3), 209-217 (2019).
- Song, T., Lang, M., Ren, S., Gan, L., Lu, W. The past, present, and future of conversion therapy for liver cancer. Am J Cancer Res. 11 (10), 4711-4724 (2021).
- Sangro, B., Salem, R., Kennedy, A., Coldwell, D., Wasan, H. Radioembolization for hepatocellular carcinoma: A review of the evidence and treatment recommendations. Am J Clin Oncol. 34 (4), 422 (2011).
- Chinese Medical Doctor Association, Clinical Guidelines Committee of Chinese College of Interventionalists, Chinese Research Hospital Association, Society for Hepatopancreatobiliary Surgery. Expert consensus on the standardized procedure of selective internal radiation therapy with Yttrium-90 microspheres for liver malignancies (2024 edition). Zhonghua Yi Xue Za Zhi. 104 (7), 486-498 (2024).
- Vilgrain, V., et al. Efficacy and safety of selective internal radiotherapy with yttrium-90 resin microspheres compared with sorafenib in locally advanced and inoperable hepatocellular carcinoma (SARAH): an open-label randomised controlled phase 3 trial. Lancet Oncol. 18 (12), 1624-1636 (2017).
- Villalobos, A., et al. Safety and efficacy of concurrent Atezolizumab/Bevacizumab or Nivolumab combination therapy with Yttrium-90 radioembolization of advanced unresectable hepatocellular carcinoma. Curr Oncol (Toronto, Ont.). 30 (12), 10100-10110 (2023).
- Kulik, L. M., et al. Safety and efficacy of 90Y radiotherapy for hepatocellular carcinoma with and without portal vein thrombosis. Hepatology (Baltimore, Md.). 47 (1), 71-81 (2008).
- Singh, P., Anil, G. Yttrium-90 radioembolization of liver tumors: what do the images tell us. Cancer Imaging. 13 (4), 645 (2013).
- Kim, Y. C., et al. Radiation safety issues in Y-90 microsphere selective hepatic radioembolization therapy: Possible radiation exposure from the patients. Nuc Med Mol Imag. 44 (4), 252-260 (2010).
- Kennedy, A., et al. Recommendations for radioembolization of hepatic malignancies using yttrium-90 microsphere brachytherapy: a consensus panel report from the radioembolization brachytherapy oncology consortium. Int J Radiation Oncol, Biol, Phys. 68 (1), 13-23 (2007).
- Molvar, C., Lewandowski, R. Yttrium-90 radioembolization of hepatocellular carcinoma-performance, technical advances, and future concepts. Semin Intervent Radiol. 32 (4), 388-397 (2015).
- Aliseda, D., et al. Liver resection and transplantation following Yttrium-90 radioembolization for primary malignant liver tumors: A 15-year single-center experience. Cancers. 15 (3), 733 (2023).
- Wehrenberg-Klee, E., Goyal, L., Dugan, M., Zhu, A. X., Ganguli, S. Y-90 radioembolization combined with a PD-1 inhibitor for advanced hepatocellular carcinoma. Cardiovas Intervent Radiol. 41 (11), 1799-1802 (2018).
- Maleux, G., et al. Predictive factors for adverse event outcomes after transarterial radioembolization with Yttrium-90 resin microspheres in Europe: Results from the prospective observational CIRT study. Cardiovas Intervent Radiol. 46 (7), 852-867 (2023).
- Lencioni, R., Llovet, J. M. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis. 30 (1), 52-60 (2010).
- Yu, Q., Khanjyan, M., Fidelman, N., Pillai, A. Contemporary applications of Y90 for the treatment of hepatocellular carcinoma. Hepatol Comm. 7 (10), e0288 (2023).
- Zhou, J., et al. Guidelines for the diagnosis and treatment of primary liver cancer (2022 Edition). Liver Cancer. 12 (5), 405 (2023).
- Pasciak, A. S., Erwin, W. D. Effect of voxel size and computation method on Tc-99m MAA SPECT/CT-based dose estimation for Y-90 microsphere therapy. IEEE Trans Med Imag. 28 (11), 1754-1758 (2009).
- Sun, H. C., Zhu, X. D. Downstaging conversion therapy in patients with initially unresectable advanced hepatocellular carcinoma: An overview. Front Oncol. 11, 772195 (2021).
- Dhondt, E., et al. 90Y radioembolization versus drug-eluting bead chemoembolization for unresectable hepatocellular carcinoma: Results from the TRACE phase II randomized controlled trial. Radiology. 303 (3), 699-710 (2022).
- Taswell, C. S., et al. For hepatocellular carcinoma treated with Yttrium-90 microspheres, dose volumetrics on post-treatment Bremsstrahlung SPECT/CT predict clinical outcomes. Cancers. 15 (3), 645 (2023).
- Xu, L., Chen, L., Zhang, W. Neoadjuvant treatment strategies for hepatocellular carcinoma. World J Gastrointes Surg. 13 (12), 1550-1566 (2021).
- Chew, V., et al. Immune activation underlies a sustained clinical response to Yttrium-90 radioembolisation in hepatocellular carcinoma. Gut. 68 (2), 335-346 (2019).
- Jiang, Y., et al. Inflammatory microenvironment of fibrotic liver promotes hepatocellular carcinoma growth, metastasis and sorafenib resistance through STAT3 activation. J Cell Mol Med. 25 (3), 1568-1582 (2021).
- Jiang, Y., et al. TANK-binding kinase 1 (TBK1) serves as a potential target for hepatocellular carcinoma by enhancing tumor immune infiltration. Front Immunol. 12, 612139 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır