Method Article
Y-90 放射栓塞和 PD-1 抑制剂作为肝细胞癌的新辅助治疗
* 这些作者具有相同的贡献
摘要
本研究说明了钇 90 经动脉放射栓塞术 (Y-90 TARE) 与抗 PD-1 单克隆抗体相结合的方法学潜力,作为一种有效的新辅助策略,导致初始复发风险高的肝细胞癌 (HCC) 患者进行肝切除术。它强调这种方法的安全性、可行性和分步程序指导。
摘要
本研究展示了高危肝细胞癌 (HCC) 患者的综合治疗方案,重点是联合使用 Y-90 经动脉放射栓塞术 (TARE) 和程序性细胞死亡 1 (PD-1) 抑制剂作为新辅助治疗。通过病例报告突出显示,它为类似的治疗干预措施提供了分步参考。对 Y-90 TARE 和 PD-1 抑制剂治疗后接受肝切除术的患者进行了回顾性分析。入院时记录关键的人口统计学和临床细节,以指导治疗选择。Y-90 去皮适用性和剂量计算基于锝-99m (Tc-99m) 大聚集白蛋白 (MAA) 灌注标测测试。通过单光子发射计算机断层扫描/计算机断层扫描 (SPECT/CT) 融合成像确认 Y-90 微球的病灶覆盖,并详细记录不良反应和随访结果。该患者右肝叶 HCC 为 7.2 cm (T1bN0M0、BCLC A、CNLC Ib),初始甲胎蛋白 (AFP) 水平为 66,840 ng/mL,由于复发风险高和初始拒绝手术,选择了 Y-90 TARE。该疗法的参数,包括肺分流分数 (LSF) 和非肿瘤比值 (TNR),都在治疗范围内。总共注射了 1.36 GBq Y-90。治疗后 1 个月,肿瘤缩小至 6 cm,部分坏死,AFP 水平降至 21,155 ng/mL,保持稳定 3 个月。3 个月后,PD-1 抑制剂治疗导致肿瘤进一步缩小至 4 cm,AFP 降低至 1.84 ng/mL。患者随后接受了肝切除术;组织病理学证实肿瘤完全坏死。术后 12 个月,在随访中未观察到肿瘤复发或转移。该方案证明了 Y-90 TARE 和 PD-1 抑制剂的有效组合作为高复发风险 HCC 患者手术的过渡策略,为实施该方法提供了实用指南。
引言
肝细胞癌 (HCC) 占全球原发性肝癌病例的 85%-90%,是一种普遍的消化系统恶性肿瘤1 。中国的问题甚至更严重,HCC 在最常见的恶性肿瘤中排名第四,也是癌症相关死亡的第二大原因 2,3。使这一挑战更加复杂的是肝切除术后的高复发率,在 2 年内在很大一部分患者中观察到。这些复发通常会演变成治疗耐药性和侵袭性恶性形式,迅速导致致命的后果。因此,减轻肝切除术后复发对于延长 HCC 患者的生存率至关重要 4,5。
新辅助治疗是指在手术前进行的一套全面的治疗,旨在提高肿瘤完全切除率(R0 切除),消除影像学上不可见的微转移性疾病,降低术后复发风险,延长患者的长期生存期6。它特别适用于存在高危因素的 HCC 患者,包括非解剖性切除、显微镜下血管侵犯、血清 AFP 水平升高超过 32 ng/mL、肿瘤尺寸大于 5 cm、多发肿瘤和潜在的肝硬化7。新辅助治疗的曲目包括各种技术,例如经导管动脉化疗栓塞术 (TACE)、肝动脉输注化疗 (HAIC) 和选择性内放疗 (SIRT)。这些通常与靶向免疫疗法相结合,单独或联合应用8。
钇-90 经动脉放射栓塞术 (Y-90 TARE) 是选择性内放射治疗 (SIRT) 的一种特殊形式,是无法手术的原发性肝癌和肝转移的重要治疗选择。Y-90 TARE 以其卓越的局部控制率而闻名,擅长将有针对性的高剂量β辐射直接输送到肿瘤部位,而其仅 2.5 毫米的有限平均穿透距离有助于保护邻近的健康组织9。自 1970 年以来,钇 90 微球选择性内放射治疗 (90Y-SIRT) 已在临床上用于治疗肝脏恶性肿瘤 50 多年,并有二十多年的大规模临床应用证实10。其安全性和有效性自上个世纪在欧美获得批准以来已得到证实。钇 90 放疗已在国际上进行了几十年,产生了丰富的临床数据 11,12,13。此外,钇 90 是一种在元素周期表中排名第 39 位的合成放射性元素,可发射高能量的高纯度 β 射线。它的半衰期短(64.2 小时)和有限的组织穿透距离,无需术后隔离 14,15,16。此外,血管技术和衰变产物对人体无害15,17。同时,抗 PD-1 单克隆抗体可恢复免疫细胞对癌细胞的细胞毒潜力。随着早期 HCC 患者观察到更强大的免疫特征,PD-1 抑制剂越来越多地用于新辅助治疗。在功能上,这些 PD-1 单克隆抗体增强了 Y-90 TARE 诱导的免疫原性细胞死亡,增强了免疫系统识别和消除肿瘤细胞的能力。Y-90 TARE 的机制涉及通过β辐射直接破坏肿瘤细胞,解决了肿瘤异质性和免疫逃避问题,从而增强了 PD-1 单克隆抗体的影响。然而,重要的是要注意,截至目前,关于 Y-90 TARE 和 PD-1 抑制剂在新辅助治疗中联合使用的综合研究相对较少 18,19,20。
本案例研究可作为实用指南,展示了 Y-90 TARE 联合 PD-1 抑制剂作为导致肝切除术的新辅助治疗的过程、安全性和潜力。通过对接受这种新辅助治疗后进行肝切除术的 HCC 患者进行回顾性评估,我们详细说明了治疗步骤、管理不良事件并评估结果。我们的研究结果旨在为临床医生应用钇 90 TARE 和 PD-1 抑制剂治疗高危 HCC 患者提供全面的蓝图。
案例介绍:
患者,男性 49 岁,身高 168 cm,体重 62 kg,肝脏总体积 (VOI) 为 1236 mL,肿瘤体积为 157 mL,靶肿瘤灌注量为 246 mL。肺总容积为 2124 mL,LSF 为 17.17%,TNR 为 8.2。他的右肝叶 (T1bN0M0、BCLC A、CNLC Ib) 为 7.2 cm 大小的 HCC,初始甲胎蛋白 (AFP) 水平为 66,840 ng/mL。患者术前 ECOG-PS (Eastern Cooperative Oncology Group Performance Status) 评分为 0。在选择 Y-90 TARE 之前,他没有接受过任何药物治疗,选择 Y-90 TARE 是由于复发风险高和初始拒绝手术。
研究方案
该治疗程序由暨南大学第一附属医院机构审查委员会批准。获得研究参与者的知情同意。
1. 新辅助治疗的患者选择
- 纳入标准
- 选择适合手术切除(R0 切除)的病灶患者。
- 选择表现出复发高危因素的患者,包括非解剖性切除术、血管浸润、血清 AFP 水平升高超过 32 ng/mL、肿瘤尺寸大于 5 cm、存在多发性肿瘤和潜在的肝硬化。
- 排除标准
- 排除在初始诊断时需要手术治疗的高风险复发因素患者。排除无力负担 Y90 治疗的患者。
2. Y-90 适应症和剂量评估
- 用于确定肿瘤血供的 DSA 血管造影术
- 要求患者仰卧进行手术。进行常规消毒和悬垂。在股动脉穿刺部位局部涂抹 4% 利多卡因溶液进行麻醉。
- 遵守常规洗手程序,穿上手术服,并戴无菌手套。
- 使用 Seldinger 技术将微穿刺针插入右侧股总动脉。然后放置连接到盐水冲洗系统的护套。
- 股动脉穿刺和导管放置成功后(观察到鲜红色的动脉血),将血管造影导管推进到腹腔干。如果影像学检查显示存在除肝动脉以外的肿瘤供血血管,则对肠系膜上动脉、膈下动脉等进行血管造影,以识别任何肿瘤供血血管。
- 在腹腔干的起点进行血管造影,以确定肝肿瘤是否完全由右肝动脉的孤立分支供应。
- 利用同轴微导管技术在右肝动脉右下支进行超选择性导管插入术。进行血管造影以确认供应容器的位置。
- 锝 99m (Tc-99m) MAA 注射和成像
- 通过微导管将 2 mCi 的 Tc-99m MAA 注入供血动脉。
注意:该程序是根据美国医学物理学家协会关于治疗肝脏恶性肿瘤的 90Y 微球近距离放射治疗的剂量学、成像和质量保证程序的建议进行的。Tc-99m MAA 的推荐剂量设定为 2-4 mCi (74-148 MBq)16。需要注意的是,Tc-99m MAA 的剂量是固定的,不会根据患者的体重、体表面积或病变的大小而变化。 - 进行锥形束计算机断层扫描 (CBCT) 以描绘肝内 Tc-99m MAA 分布的目标肿瘤区域。在动脉期的矢状位、冠状位和轴位位上手动勾勒出该区域。
- 使用 CBCT 中的 SEG4 属性选项计算目标肿瘤区域的体积。
- 通过微导管将 2 mCi 的 Tc-99m MAA 注入供血动脉。
- LSF、TNR 和 Y90 微球剂量测定计算
- 在扫描仪上配置扫描模式(SPECT 和 CT)参数,并在 Tc-99m MAA 输注后 1-2 小时内对患者进行 SPECT/CT 成像。选择 Fusion 功能以合并 SPECT 和 CT 图像,以确定 Tc-99m MAA 在肝脏、肺和其他器官中的分布。
- 使用平面成像计算肺分流分数 (LSF)。
- 手动绘制感兴趣区域 (ROI),标记肝脏和肺内的不同区域,其中 Tc-99m MAA 的分布在平面图像上的肝脏、右肺和左肺的前后视图中可以辨别。此步骤由核医学技术人员执行。
注:肺分流分数 (LSF) 代表从肝脏分流到双肺的 99mTc-MAA 分数。利用平面成像,核医学技术人员在前视图和后视图的肝脏和肺部(分别为左肺和右肺)周围手动绘制 ROI。然后从该工作站获得每个零件的计数结果。 - 使用标准核医学工作站计算每个 ROI 的计数。使用公式:
肺计数 =
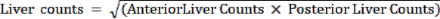
- 使用以下公式计算 LSF:

- 手动绘制感兴趣区域 (ROI),标记肝脏和肺内的不同区域,其中 Tc-99m MAA 的分布在平面图像上的肝脏、右肺和左肺的前后视图中可以辨别。此步骤由核医学技术人员执行。
- 使用 SPECT/CT 成像的三维 (3D) 分割应用程序计算肿瘤与正常肝脏比率 (TNR)。
- 根据计算机断层扫描切片手动绘制相同大小的离散 ROI,以包含肿瘤和正常肝脏区域。
- 使用工作站计算每个 ROI 中肿瘤每个单位细胞的平均计数超过正常肝脏的每个单位细胞的平均计数。
- 使用以下等式计算 TNR 比率:

- 根据计算结果,在 Y-90 RE (DAVYR) 应用的剂量和活性可视化器中使用 Partition 模型方程,以获得规定的活性 (Gbq) 和剂量 (Gy)。
3. Y-90 去皮重处理
- 按照步骤 2 中描述的方法,然后直接在步骤 2.1 中确定的供血动脉上进行血管造影。
- 将当前的血管造影图像与步骤 2 中的图像进行比较,以更精确地确认供血动脉的位置。
- 超选择性导管插入后将导管推进至供血动脉,然后将 Y90 微球以已经计算的剂量和活性注射到供血动脉中。
- 对于 Y-90 去皮重,从胸部到骨盆上方进行专门的全身 PET/CT 扫描。使用以下参数进行 PET-CT:80 秒至 110 秒、120 kVp、40 mA、1 秒管旋转、4 mm 切片准直和 8 mm/s(即间距,2)柱床速度。
- 根据 PET/CT 图像上绘制的体积 ROI 评估 TNR,然后将其与从 Tc-99m MAA 分布的 SPECT/CT 图像获得的 TNR 进行比较,以确认 Y-90 的分布。
- 分配和注射 Tc-99m MAA 和 Y-90 微球时,应佩戴适当的防护设备,例如铅围裙、眼罩和铅手套。
- Y-90 TARE治疗后不要进行任何特殊治疗,并要求接受Y-90治疗的患者在7天内避免与他人密切接触,以尽量减少辐射风险。
4. Y90 治疗后序贯 PD-1 抑制剂治疗
- Y90 治疗后至少 2 个月观察病灶稳定性。使用适当的影像学检查方式进行持续监测。重新评估患者以确定是否存在任何复发的高危因素。
- 如果确定高危因素,评估患者是否适合免疫治疗,确保不存在禁忌证。根据患者的经济考虑选择合适的 PD-1 抑制剂,如 Nivolumab 或 Pembrolizumab。
- 分 1-2 个周期施用所选的抑制剂,每个周期间隔 21 天。在 1 小时内通过外周静脉注射施用 100 mL 生理盐水以 2 mg/mL 制备的 PD-1 抑制剂,从而完成一个周期的 PD-1 抑制剂治疗。
- 治疗后评估和随访
- 完成 PD-1 抑制剂治疗后,随访影像学研究和肿瘤标志物研究与治疗前相同。
- 使用标准评估标准21 评估患者每月对 PD-1 抑制剂治疗的反应。
5. Y90 TARE 和 PD-1 抑制剂后的肝切除术
- 肝切除术的决定:使用先前用于评估 PD-1 抑制剂治疗后至少 2 个月病灶稳定性的相同放射学技术评估治疗部位,确保不存在复发的高危因素。
- 肝切除术的术前准备: 为了准确定义肿瘤切除边缘并检查可能的转移病灶,请在手术前 3 天给患者服用吲哚菁绿。
- 手术
- 对仰卧位的患者进行气管插管进行全身麻醉。对上腹部区域进行手术消毒,该区域向上延伸到线,向下延伸到耻骨联合,外侧延伸到腋中线。
- 进入腹膜腔后,使用腹腔镜彻底检查肝脏和周围结构是否有任何异常或转移灶。
- 用抓手抬高右肝的下缘,露出位于肝脏第 6 段 (S6) 的肿瘤。
- 静脉注射吲哚菁绿后,切换到荧光成像模式以仔细评估肿瘤的范围,确保没有侵入邻近组织或明显的粘连。
- 使用谐波手术刀解剖右肝下缘、后腹膜和右肾之间的结缔组织。进展顺利地解剖了右侧三角韧带和冠状韧带,从而暴露了第二肝门。
- 使用鸭嘴镊将肝脏向左缩回,以完全露出右叶。
- 采用荧光成像模式清晰描绘肿瘤与邻近健康组织之间的边缘。
- 使用单极烧灼钩在距肿瘤边缘约 1-2 cm 处标记切除引导线。
- 暂时中断来自门静脉和肝动脉的血管流入,以减少术中出血。以 15 分钟闭塞和 5 分钟再灌注的周期收紧止血带。
- 用谐波手术刀沿引导线小心地横切肝实质。用手术刀凝固小胆管和血管,先夹住,然后横切较大的结构。
- 切除肿瘤标本后,将其送去进行组织病理学评估。
- 用温热的生理盐水冲洗肝脏切口表面,然后通过双极凝血实现止血。使用可吸收缝合线闭合所有切口。患者术后住院时间为 10 天。对于术后疼痛管理,通过肌肉注射给予曲马多。
- 肝切除术后的随访
- 为了及时发现任何潜在的术后复发或转移病灶,术后前 3 个月每月进行一次随访检查。在此期间,在接下来的 2 年内每 3 个月安排一次检查,然后在接下来的 3 年内每 6 个月安排一次检查,直到术后总共 5 年。
结果
MRI 显示本研究中患者的肝脏体积减少、肝表面呈波浪状,肝裂扩大。在肝脏的右后叶发现了一个近球形的肿块,尺寸约为 7.2 cm x 5.6 cm x 6.6 cm。质量在 T1 加权成像 (T1WI) 上表现出混合低信号,在 T2 加权成像 (T2WI) 上表现出混合高信号,在弥散加权成像 (DWI) 上表现出高信号。它表现出清晰的边界和异质性动脉期增强,表明肝硬化和 HCC 的可能性(图 1)。
在导管作期间,进行血管造影评估以确认不存在源自腹主动脉、膈动脉和肠系膜上动脉的肿瘤供血血管。在腹腔干起点的血管造影中,右肝动脉的节段分支(S6 或右下支)表现出明显的迂曲和扩张。这一观察结果确定肝肿瘤仅从这个单一的动脉分支获得血管供应(图 2A)。Y-90 TARE 的基础预评估涉及使用 Tc-99m MAA 灌注进行标测测试,利用 Tc-99m MAA 和 Y-90 微球之间的可比剂量分布。Tc-99m MAA 注射后,划定了 Tc-99m MAA 的灌注区,计算出的目标肿瘤的灌注量为 246.27 mL(图 2A)。表现出 LSF 大于 20% 的患者发生辐射引起的肺损伤的风险增加,使他们通常不适合 Y-90 治疗22。较高的 TNR 意味着在遵守最大允许肝脏辐射剂量的同时具有更强的肿瘤杀灭作用。计算出的 LSF 为 17.17%,TNR 为 8.2(图 2B)。
与医疗内辐射剂量 (MIRD) 和体表面积 (BSA) 方法相比,分区模型通过考虑 TNR 提供卓越的个性化辐射剂量估计,从而增强个体化治疗计划。分区模型的结果表明,正常肝脏的辐射剂量为 36.6 Gy(低于 40 Gy 阈值),肺组织为 17.6 Gy(在 20 Gy 限制内),肿瘤的峰值剂量为 300 Gy,需要 Y-90 微球活性为 1.36 Gbq(图 3A)。Y-90 去皮治疗后(图 3B),进行了 PET/CT 扫描,表明没有脱靶扩散或覆盖差异(图 3C)。
Y-90 TARE 治疗后 1 个月,肿瘤缩小至 6 cm,AFP 水平降至 21,155 ng/mL。治疗后 3 个月,肿瘤无明显变化。鉴于持续的高复发风险,开始使用 PD-1 抑制剂治疗。Y-90 TARE 治疗后 5 个月 (开始 PD-1 抑制剂治疗后 2 个月),病灶进一步缩小至 4 cm,AFP 水平急剧下降至 1.84 ng/mL(图 4 和 表 1)。
显示了肝切除术期间在白光和荧光下肿瘤的图像(图 5A)。将从肝切除术获得的肿瘤标本转化为冰冻切片进行大体病理学检查。当显微镜检查时,他们发现没有肿瘤细胞、Y-90 微球沉积、明显的淋巴细胞浸润和邻近正常肝组织的肝硬化变化23 (图 5B)。术后 12 个月,进行随访和复发评估,MRI 成像显示无复发或转移的证据(图 5C)。
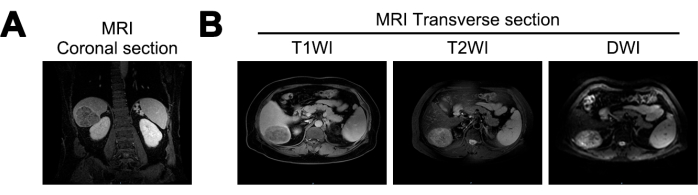
图 1:初步诊断时的磁共振成像 (MRI) 成像。(A) MRI T1 加权成像 (T1WI) 信号的冠状切片, (B) MRI T1WI、T2 加权成像 (T2WI) 和弥散加权成像 (DWI) 信号的横切面。 请单击此处查看此图的较大版本。

图 2:锝-99m 大聚集白蛋白 (Tc-99m MAA) 的注射和分布。(A) 锝-99m 大聚集白蛋白 (Tc-99m MAA) 的注射过程图示。 (B) 99mTc MAA 在肝脏中的剂量分布。 请单击此处查看此图的较大版本。

图 3:钇 90 经动脉放射栓塞术 (Y-90 TARE) 治疗过程。(A) 使用 Partition 模型计算的数据的描述。 (B) 钇 90 微球的包装和注射。 (C) 单光子发射计算机断层扫描/计算机断层扫描 (SPECT/CT) 验证 Y-90 微球的剂量分布。 请单击此处查看此图的较大版本。

图 4:肿瘤比较。(A) 初步诊断时的 MRI 图像显示,而 (B) 显示 Y-90 TARE 治疗后 1 、 3 和 5 个月的 MRI 图像。Y-90 TARE 后 3 个月进行程序性细胞死亡 1 (PD-1) 抑制剂治疗。患者在 Y-90 TARE 手术后 3 个月接受了 PD-1 抑制剂治疗。 请单击此处查看此图的较大版本。

图 5:肝切除术和后续随访。(A) 术中观察到的肿瘤表现。 (B) 术后肿瘤标本和苏木精和伊红 (H&E) 染色图示。 (C) 术后 2 个月和 12 个月的 MRI 图像。 请单击此处查看此图的较大版本。
| 使用 Y-90 去皮重进行后处理 | |||||
| 初步诊断 | 1 个月 | 3 个月 | 5 个月 | ||
| 甲胎蛋白 (ng/mL) | 66840 | 21155 | 19535 | 1.84 | |
表 1:治疗后 AFP 水平测量。
讨论
对于表现为高危复发因素的 HCC 患者,即使在根治性肝切除术后,不良预后仍然存在,这强调了有效的新辅助治疗对提高生存率的重要性24,25。相对于介入治疗,Y-90 TARE 拥有卓越的局部控制率26。虽然 Y-90 TARE 可以激活机体的抗肿瘤反应22,但 Y-90 与 PD-1 抑制剂联合用于肝癌新辅助治疗尚未见报道。本研究回顾性回顾了一例新辅助 Y-90 TARE 后抗 PD-1 单克隆抗体治疗病例,该病例涉及完全缓解的高危复发因素的 HCC 患者。它提出了详细的治疗方案以供参考。
本研究方案中的几个关键点值得关注。首先,鉴于 MAA99 降解和重新分布的可能性,应在 MA99 注射后 1-2 小时内进行 SPECT/CT 成像。其次,必须仔细计算 Y-90 微球的剂量,以防止异位放置和剂量过量,这可能导致肝和肺损伤。最后,考虑到新辅助手术后,确保边缘清晰的非解剖性切除可能更可取,以缩短手术时间并最大限度地减少与手术相关的免疫抑制。
在本研究中,患者在新辅助治疗后表现出睡眠障碍和便秘的症状。使用艾司佐匹克隆治疗睡眠障碍和比沙可啶肠溶片剂治疗便秘解决了这些问题。这表明与 Y-90 TARE 和 PD-1 抑制剂相关的不良反应很小,可以进行药物控制。此外,Y-90 TARE 和 PD-1 抑制剂不会诱导肝组织或病变水肿、严重粘连或脆性增加,后者可在随后的手术切除过程中诱发大量出血或不完全切除。因此,Y-90 去皮机不会干扰或影响后续的外科手术。
根据 AFP 水平和病灶的变化,我们在 Y-90 TARE 后序贯给予抗 PD-1 单克隆抗体治疗。5 个月后,病灶达到病理完全缓解 (pCR),表明治疗的时机和选择是合适的。在 Y-90 TARE 的中位缓解期之前调整治疗策略可以有效降低疾病进展的风险27。然而,尽管病变消退的程度与肝癌切除术后的生存率明显相关28,但对于 Y-90 TARE 诱导的 pCR 病例,是否需要后续手术干预仍是一个进一步研究的主题。此外,Y-90 TARE 和抗 PD-1 单克隆抗体治疗的最佳时机和剂量,以及后续手术的最佳时机和方法,仍有待进一步验证。此外,整个治疗过程的高成本可能会给患者带来沉重的经济负担。
在我们的病例中,Y-90 TARE 和 PD-1 抑制剂治疗后 pCR 的发生被假定与当前研究中的几个因素相关。最初,考虑肿瘤内辐射剂量;我们采用基于 Tc-99m MAA (分区模型) 的常规方法来评估 Y-90 治疗剂量24。值得注意的是,由于患者的 TNR 较高,本研究中渗透病灶的辐射剂量升高,钇-90 微球全面覆盖肿瘤,从而达到疗效。其次,肿瘤内显着的免疫细胞浸润,表明患者抗肿瘤免疫对 pCR 的关键作用,不容忽视。考虑到这是患者的初步诊断,肿瘤未处于晚期,内在的抗肿瘤免疫仍然存在。在 Y-90 TARE 和 PD-1 抑制剂诱导的肿瘤细胞死亡后,可能会触发炎症反应,增强肿瘤抗原暴露,激活宿主抗肿瘤免疫,并最终导致免疫细胞浸润及其随之而来的杀瘤作用29。此外,我们之前的研究发现了瘤周肝脏炎症与肿瘤耐药性之间的相关性,这可能会加剧肝脏免疫耐受30,31。虽然本研究患者瘤周组织存在肝硬化改变,但未观察到明显的炎症反应,所有乙型肝炎相关检查均无明显异常。这表明患者的肝脏免疫微环境属于一个潜在的可改变的亚组,其中 Y-90 TARE 和 PD-1 抑制剂代表了增强肝脏免疫微环境的关键策略。
Y-90 TARE 治疗的实施需要严格的条件和多个部门的协作努力,包括核医学、介入放射学、肝胆外科、影像学和肿瘤学。放射诱发并发症(如肺炎、胃溃疡和急性胰腺炎)的可能性强调了仔细计算剂量的必要性。核医学科进行的术前模拟评估和剂量估计可以延长 Y90 TARE 治疗周期,可能导致肿瘤进展。Y90 TARE 可能并不适合所有肝癌,尤其是那些具有多发性肝内转移和弥漫性或小直径 (<0.5 cm) 肝癌的肝癌,因为难以区分肿瘤区域与正常肝组织,这可能导致剂量估计错误。关于 Y90 与 PD-1 抑制剂联合肝细胞癌新辅助治疗的报道有限。仍需要大规模的临床研究来证实其疗效和治疗细节。
综上所述,Y-90 TARE 和 PD-1 抑制剂的组合为 HCC 患者的新辅助治疗提供了一种安全有效的方法。这种策略不仅可以减轻局部肿瘤负荷并最大程度地减少微转移,而且不会增加疾病进展的风险。因此,它有可能延长患者的术后无复发期。我们为高危 HCC 患者的新辅助治疗提供可复制且可行的方案。
披露声明
作者声明,该研究是在没有任何可能被解释为潜在利益冲突的商业或财务关系的情况下进行的。
致谢
本研究由国家自然科学基金 (82303287)、广东省基础与应用基础研究基金 (2021A1515110083)、广州市科技项目 (202201010267)、中央高校基本科研业务费 (21621058) 资助。
材料
| Name | Company | Catalog Number | Comments |
| ARTIS pheno Cutting-edge robotic imaging system | SIEMENS HEALTHINEERS | 10849000 | |
| DISPOSABLE LAPAROSCOPIC INSTRUMENT | Hangzhou Kangji Medical Instruments | 108Y series | |
| Endoscopic fluorescence camera system | Stryker | PC9000 | |
| ENSEAL G2 Curved Tissue Sealer | Ethicon from Johnson | NSLG2C14 | |
| Fluorescent laparoscopic lens | Stryker | SC9534 | |
| laparoscopic stapler | Ethicon from Johnson | PCEE45A | |
| Optima NM/CT 640 SPECT/CT | GE healthcare | 200439 | |
| SURGICEL FIBRILLAR Hemostat | Ethicon from Johnson | 1962 | |
| Tc-99m macroaggregated albumin [MAA](DAXIMAGE-MAA) | JUBILANT RADIOPHARMA | 877003-93-5 | |
| Tislelizumab Injection(PD-1 inhibitor) | BeiGene, Ltd | 10-848 | |
| ultrasound knife | Ethicon from Johnson | HARHD36 | |
| Xeleris Functional Imaging Workstation | GE healthcare | 5436592-22 | |
| Y-90 resin microspheres(SIR-Spheres) | Sirtex Medical Limited | SIR-Y001 |
参考文献
- Su, H., et al. Molecular mechanism of CK19 involved in the regulation of postoperative recurrence of HBV-associated primary hepatocellular carcinoma in Guangxi. Ann Transl Med. 9 (24), 1780 (2021).
- Zheng, R., et al. Cancer incidence and mortality in China, 2016. J Natl Cancer Center. 2 (1), 1-9 (2022).
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA. 71 (3), 209-249 (2021).
- Heimbach, J. K., et al. AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology (Baltimore, Md.). 67 (1), 358-380 (2018).
- Sato, T., et al. A prospective study of fully covered metal stents for different types of refractory benign biliary strictures. Endoscopy. 52 (5), 368-376 (2020).
- Zhou, H., Song, T. Conversion therapy and maintenance therapy for primary hepatocellular carcinoma. Biosci Trends. 15 (3), 155-160 (2021).
- Xu, X. F., et al. Risk factors, patterns, and outcomes of late recurrence after liver resection for hepatocellular carcinoma. JAMA Surg. 154 (3), 209-217 (2019).
- Song, T., Lang, M., Ren, S., Gan, L., Lu, W. The past, present, and future of conversion therapy for liver cancer. Am J Cancer Res. 11 (10), 4711-4724 (2021).
- Sangro, B., Salem, R., Kennedy, A., Coldwell, D., Wasan, H. Radioembolization for hepatocellular carcinoma: A review of the evidence and treatment recommendations. Am J Clin Oncol. 34 (4), 422 (2011).
- Chinese Medical Doctor Association, Clinical Guidelines Committee of Chinese College of Interventionalists, Chinese Research Hospital Association, Society for Hepatopancreatobiliary Surgery. Expert consensus on the standardized procedure of selective internal radiation therapy with Yttrium-90 microspheres for liver malignancies (2024 edition). Zhonghua Yi Xue Za Zhi. 104 (7), 486-498 (2024).
- Vilgrain, V., et al. Efficacy and safety of selective internal radiotherapy with yttrium-90 resin microspheres compared with sorafenib in locally advanced and inoperable hepatocellular carcinoma (SARAH): an open-label randomised controlled phase 3 trial. Lancet Oncol. 18 (12), 1624-1636 (2017).
- Villalobos, A., et al. Safety and efficacy of concurrent Atezolizumab/Bevacizumab or Nivolumab combination therapy with Yttrium-90 radioembolization of advanced unresectable hepatocellular carcinoma. Curr Oncol (Toronto, Ont.). 30 (12), 10100-10110 (2023).
- Kulik, L. M., et al. Safety and efficacy of 90Y radiotherapy for hepatocellular carcinoma with and without portal vein thrombosis. Hepatology (Baltimore, Md.). 47 (1), 71-81 (2008).
- Singh, P., Anil, G. Yttrium-90 radioembolization of liver tumors: what do the images tell us. Cancer Imaging. 13 (4), 645 (2013).
- Kim, Y. C., et al. Radiation safety issues in Y-90 microsphere selective hepatic radioembolization therapy: Possible radiation exposure from the patients. Nuc Med Mol Imag. 44 (4), 252-260 (2010).
- Kennedy, A., et al. Recommendations for radioembolization of hepatic malignancies using yttrium-90 microsphere brachytherapy: a consensus panel report from the radioembolization brachytherapy oncology consortium. Int J Radiation Oncol, Biol, Phys. 68 (1), 13-23 (2007).
- Molvar, C., Lewandowski, R. Yttrium-90 radioembolization of hepatocellular carcinoma-performance, technical advances, and future concepts. Semin Intervent Radiol. 32 (4), 388-397 (2015).
- Aliseda, D., et al. Liver resection and transplantation following Yttrium-90 radioembolization for primary malignant liver tumors: A 15-year single-center experience. Cancers. 15 (3), 733 (2023).
- Wehrenberg-Klee, E., Goyal, L., Dugan, M., Zhu, A. X., Ganguli, S. Y-90 radioembolization combined with a PD-1 inhibitor for advanced hepatocellular carcinoma. Cardiovas Intervent Radiol. 41 (11), 1799-1802 (2018).
- Maleux, G., et al. Predictive factors for adverse event outcomes after transarterial radioembolization with Yttrium-90 resin microspheres in Europe: Results from the prospective observational CIRT study. Cardiovas Intervent Radiol. 46 (7), 852-867 (2023).
- Lencioni, R., Llovet, J. M. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis. 30 (1), 52-60 (2010).
- Yu, Q., Khanjyan, M., Fidelman, N., Pillai, A. Contemporary applications of Y90 for the treatment of hepatocellular carcinoma. Hepatol Comm. 7 (10), e0288 (2023).
- Zhou, J., et al. Guidelines for the diagnosis and treatment of primary liver cancer (2022 Edition). Liver Cancer. 12 (5), 405 (2023).
- Pasciak, A. S., Erwin, W. D. Effect of voxel size and computation method on Tc-99m MAA SPECT/CT-based dose estimation for Y-90 microsphere therapy. IEEE Trans Med Imag. 28 (11), 1754-1758 (2009).
- Sun, H. C., Zhu, X. D. Downstaging conversion therapy in patients with initially unresectable advanced hepatocellular carcinoma: An overview. Front Oncol. 11, 772195 (2021).
- Dhondt, E., et al. 90Y radioembolization versus drug-eluting bead chemoembolization for unresectable hepatocellular carcinoma: Results from the TRACE phase II randomized controlled trial. Radiology. 303 (3), 699-710 (2022).
- Taswell, C. S., et al. For hepatocellular carcinoma treated with Yttrium-90 microspheres, dose volumetrics on post-treatment Bremsstrahlung SPECT/CT predict clinical outcomes. Cancers. 15 (3), 645 (2023).
- Xu, L., Chen, L., Zhang, W. Neoadjuvant treatment strategies for hepatocellular carcinoma. World J Gastrointes Surg. 13 (12), 1550-1566 (2021).
- Chew, V., et al. Immune activation underlies a sustained clinical response to Yttrium-90 radioembolisation in hepatocellular carcinoma. Gut. 68 (2), 335-346 (2019).
- Jiang, Y., et al. Inflammatory microenvironment of fibrotic liver promotes hepatocellular carcinoma growth, metastasis and sorafenib resistance through STAT3 activation. J Cell Mol Med. 25 (3), 1568-1582 (2021).
- Jiang, Y., et al. TANK-binding kinase 1 (TBK1) serves as a potential target for hepatocellular carcinoma by enhancing tumor immune infiltration. Front Immunol. 12, 612139 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。