Method Article
X-ışını fazı kontrast görüntüleme için aktif olarak olgunlaşan sığır eklem kıkırdak eksplantlarının in vitro hazırlanması
Bu Makalede
Özet
Bu protokol, X ışınları ile yüksek çözünürlükte görüntüleme için in vitro sığır eklem kıkırdağının hazırlanmasını açıklar. Bu eksplantlar aktif olarak doğum sonrası olgunlaşmaya uğrar. Burada biyopsiden 3D X-ışını faz kontrast görüntülemenin veri analizine, eksplant kültüründen geçerek, doku fiksasyonu ve senkrotron hazırlığına kadar gerekli adımları anlatıyoruz.
Özet
Eklem kıkırdağının doğum sonrası olgunlaşmasını destekleyen mekanizmaları anlamak, yeni nesil doku mühendisliği stratejilerini tasarlamak ve hastalıklı veya hasarlı kıkırdağı potansiyel olarak onarmak için çok önemlidir. Genel olarak, organizmanın büyümesine uyum sağlamak için dokunun kollajen yapısında ve işlevinde toptan bir değişiklik olan eklem kıkırdağının doğum sonrası olgunlaşması, aylar ila yıllar arasında değişen bir zaman ölçeğinde gerçekleşir. Tersine, uzun zaman ölçeklerinde de meydana gelen kıkırdağın yapısal organizasyonunun çözülmesi, doku dejenerasyonunun ayırt edici özelliğidir. Bu biyolojik süreçleri ayrıntılı olarak inceleme yeteneğimiz, büyüme faktörlerinin olgunlaşmamış eklem kıkırdağının erken in vitro olgunlaşmasını indükleyebileceği bulgularıyla geliştirilmiştir. Eklemde meydana gelen gelişimsel ve hastalıkla ilgili değişiklikler kemik ve kıkırdağı içerir ve bu dokuları birlikte görüntüleme yeteneği, iç içe geçmiş rolleri hakkındaki anlayışımızı önemli ölçüde artıracaktır.
Yumuşak doku, kıkırdak ve kemik değişikliklerinin eş zamanlı görüntülenmesi, günümüzde eklem hastalıklarının takibi için kullanılan geleneksel preklinik görüntüleme yöntemleri için üstesinden gelinmesi gereken bir zorluktur. Üç boyutlu X-ışını Faz-Kontrast Görüntüleme yöntemleri (PCI), düşük yoğunluklu nesnelerin görüntülenmesi için yüksek performans ve geleneksel X-ışını görüntülemeye kıyasla ek bilgi sağlama yetenekleri nedeniyle 20 yıldır sürekli olarak geliştirilmektedir.
Bu protokolde, kıkırdak biyopsisi, in vitro olgunlaşmış kıkırdak üretimi, X-ışını faz kontrast görüntüleme kullanılarak toplanan görüntünün veri analizine kadar deneylerimizde kullanılan prosedürü detaylandırıyoruz.
Giriş
İmmatür eklem kıkırdağı, erişkin ekleme özgü bir fonksiyon elde etmek için morfolojik, yapısal ve biyomoleküler değişiklikleri1 başlatmak için yeterli bir destektir. Temel değişiklik, kollajen fibrillerinin olgunlaşmamış kıkırdakta yüzeye göre paralel bir yönelim gösteren bir kıkırdaktan, dokuda daha derin fibrillerin olgun kıkırdakta dik olduğu bir yere yeniden düzenlenmesidir. Yetişkin kıkırdağının yalancı tabakalaşması, yerleşik kondrositlerin kollajen fibril oryantasyon yönü boyunca yeniden düzenlenmesi, yüzeydeki hücrelerin disk benzeri ve yüzeye paralel olması ve daha derin bölgelerdeki hücrelerin giderek daha büyük ve sütunlar halinde organize hale gelmesiyle belirgindir. Doğum sonrası olgunlaşmanın birçok ay içinde gerçekleştiği ve esasen ergenliğin sonunda tamamlandığı bilinmektedir, uzun zaman ölçeğinin bu önemli gelişimsel geçişi incelemeyi en iyi ihtimalle zor veya teknik olarak ayrıntılı olarak incelenmesi imkansız hale getirdiği düşünülmektedir2. Fibroblast büyüme faktörü-2 ve transforme edici büyüme faktörü-β1'in birlikte eklem kıkırdağı olgunlaşmasını 2,3 kopyalayan önemli fizyolojik ve morfolojik değişiklikleri indükleyebildiği bulgusu ile bu sorunun çözümüne yönelik bazı ilerlemeler kaydedilmiştir (Şekil 1). Büyüme faktörünün neden olduğu in vitro olgunlaşma üç hafta içinde gerçekleşir ve herhangi bir biyomekanik girdi gerektirmez. Kültürden sonra, kollajen tip II ekspresyonu önemli ölçüde azalır ve olgunlaşan kıkırdakta görüldüğü gibi olgun üç değerlikli kollajen çapraz bağlarının olgunlaşmamış iki değerlikli kollajen çapraz bağlarının oranı artar. Ayrıca, hücre dışı matriks ve kollajen fibrillerinin organizasyonu, olgun kıkırdakta görülene daha yakındır, ancak bu geçiş faseti tam değildir. Biyokimyasal olarak, büyüme faktörü ile tedavi edilen kıkırdağın bileşimi yetişkin bir eklem kıkırdağını taklit eder3.
Makalede kullanılan model bir in vitro Olgunlaşmamış erkek (7 günlük) sığır dümenlerinden metakarpofalangeal eklem medial kondilinin lateral yönünden steril koşullar altında eksize edilen 4 veya 6 mm çapında eksplantların kültürü. Her eksplantın bazal yüzünde ince bir kalsifiye kıkırdak ve subkondral kemik tabakası tutuldu. Eklem kıkırdağı, insülin-transferrin-selenyum (ITS), 10 mM HEPES tampon pH 7.4, askorbik asit ve 50 μg/mL gentamisin ilave edildiği klasik serum içermeyen bir ortam olan Dulbecco'nun modifiye Eagles besiyerinde (yüksek glikoz 4.5 g/L) kültürlendi. Bu kültür ortamı, her üç günde bir ortam değişiklikleri ile yenilenen 100 ng/mL fibroblast büyüme faktörü 2 (FGF-2) ve 10 ng/mL dönüştürücü büyüme faktörü β1 (TGF-β1) ile desteklenir2. Yüksek derecede hızlandırılmış kıkırdak olgunlaşması, büyüme faktörlerinin birleştirilmesiyle indüklenir. Bu değişiklikler 21 gün içinde gerçekleşir. Büyüme faktörü stimülasyonu ayrıca bazal yönden apoptoz ve rezorpsiyona ve yüzey kondrositlerinde hücresel proliferasyona neden olur3. Kültür ortamı bileşimi şurada tarif edilmiştir: Tablo 1. Khan ve ark. 2011 tarafından geliştirilen modeli takiben2, eklem kıkırdak eksplantları 10 ng/μL konsantrasyonda TGF-β1 ve 100 ng/μL konsantrasyonda FGF2 ile kültürlenir (stok konsantrasyonları 10 μg/mL ve 100 μg/mL fosfat tamponlu salin/%0.1 BSA içinde çözülür). Ortamın 1 mL'si için her bir büyüme faktörünün 1 μL'si kullanılır. L-glutamin ve yüksek glikozlu DMEM-F12, insülin, transferrin ve selenyum (ITS), askorbik asit, gentamisin ve HEPES ile desteklendikten sonra, farklı hücre hatlarına ve eksplant kültürlerine özgü tüm fizyolojik büyüme gereksinimleri ile tam bir ortam takviyesi sağlayan yapay bir ortamdır. DMEM-F12, birkaç farklı inorganik tuzdan (yani NaCl, KCl, CaCl) oluşur.2, MgCl2, NaH2PO4), glikoz, amino asitler (azot kaynakları), vitaminler, kofaktörler ve su. Bu tuzlar, kültürde hücresel sağkalımı ve normal büyümeyi sürdürmek için yeterli enerjik girdiler sağlar. Mineral iyonları, doğal fizyolojik ortama yakın ozmolaritenin korunmasına katkıda bulunur. Daha yüksek glikoz konsantrasyonu (4.5 g / L), kondrositler esas olarak glikoliz yoluyla solunum yaptığı için kullanılır. F12 ortam takviyesi, çok sayıda sülfat kaynağı, CuSO sunduğu için kullanılır4, FeSO4, ZnSO4 ve MgSO4 sülfatlanmış glikozaminoglikan sentezi için gereklidir. Renkli göstergeler (burada fenol kırmızısı) ve CO ile kontrol edildiği gibi2/HCO-3 fosfatlarla birleştirilen tampon, pH 7.4'e yakın bir değerde sabit kalır. Kondrositler tarafından kullanılan ana solunum yolu, laktik asidin pH'da bir artışa neden olan son ürün olduğu glikolizdir, bu nedenle, yerel olarak üretilen laktik asidin uzaklaştırılmasına yardımcı olacak biyomekanik kuvvetlerin yokluğunda, HEPES fizyolojik süreçler için tamponlu bir ortam sağlamak için hareket eder. Gentamisin, büyümenin inhibisyonu yoluyla dış bakteriyel kontaminasyonu kontrol eden bir aminoglikozit antibiyotiktir. Askorbik asit, antioksidan etkisi için orta tamamlayıcı olarak kullanılır4. Askorbik asit, kollajendeki prolin kalıntılarını hidroksilatlamak ve üçlü sarmal yapısını stabilize etmek için işlev gören enzimler, prolil hidroksilazlar için bir kofaktördür. Transferrin genellikle hücre dışı antioksidan görevi görür (toksisite ve ROS azalmaları)5,6. Ayrıca, hücre kültüründe hücre dışı demir depolaması ve taşınmasını sağlama ve kolaylaştırma kabiliyeti nedeniyle kültür ortamına eklenir. Transferrin, fizyolojik koşullar altında demiri o kadar sıkı bağlar ki, serbest radikallerin üretimini katalize etmek için neredeyse hiç serbest demir yoktur7. Bağlı reseptöründen gelen insülin hormonu sinyali, glikoz, amino asitler gibi çeşitli elementlerin emilimini artırır. Ayrıca hücre içi taşıma, lipogenez, protein ve nükleik asit sentezleri gibi çeşitli süreçlerde yer alır. İnsülinin büyümeyi teşvik edici bir etkisi vardır. Selenyum ayrıca "insülin-transferrin-selenyum" kompozit çözeltisinde sodyum selenit olarak bulunur. Esas olarak, kültürde ek antioksidan ajan olarak gluthatione peroksidaz (GPX) gibi (seleno-) proteinler için bir kofaktör olarak kullanılır. İçinde in vitro eklem kondrositleri, ITS, hücresel farklılaşma ve hipertrofik farklılaşma ile ilgili gen ekspresyonunu inhibe ederek hücresel proliferasyonu ve fenotip korumasını artırıyor gibi görünmektedir8. Fibroblast büyüme faktörü-2 ve transforme edici büyüme faktörü-β1 gibi büyüme faktörleri kültür ortamına eklenir. Hücre farklılaşmasını, büyümesini, iyileşmesini ve gelişmesini indüklemek ve düzenlemek için kullanılırlar2,3. FGF-2 ve TGF-β1 kombinasyon halinde ayrıca kültürlenmiş hücrelerde ve dokularda hücresel proliferasyonu güçlü bir şekilde teşvik eder9.
Eklem kıkırdağının bu in vitro olgunlaşma modeli üç ana nedenden dolayı yararlıdır. İlk olarak, bu modeldeki hızlandırılmış gelişimsel faz geçişi, olgunlaşma10 sırasında lizl oksidaz-L1'in yüksek ekspresyonu gibi in vivo modellerde aylar boyunca meydana gelen algılanamayan değişiklikleri incelememize izin verir. İkinci olarak, eklem kıkırdağının doku mühendisliği, fokal kusurları onarmak için eklemlere nakledildiğinde fonksiyonel olarak eksik olan izotropik bir morfoloji ve yapıya sahip kıkırdağın üretilmesinden muzdariptir. Olgunlaşma değişikliklerinin nasıl indükleneceğini anlamak, tamamen işlevsel implante edilebilir cihazların geliştirilmesini hızlandıracaktır. Üçüncüsü ve bu çalışmayla ilgili olarak, çocukluk döneminde ortaya çıkan ve yetişkinlikte ciddi eklem deformitelerine yol açan Kashin-Beck hastalığı gibi dejeneratif eklem durumları vardır. Bu özel hastalık, selenyum ve iyot açısından endemik eksiklikleri olan ve potansiyel olarak on milyonlarca nüfusu etkileyen coğrafi bölgelerle (Çin) güçlü bir şekilde ilişkilidir 11,12,13. Kashin-Beck hastalığında iskelet kusurlarının incelenmesi, iskelet olgunlaşma süreçlerinin bozulmasını ima eden peri-pubertal olarak ortaya çıktığını göstermektedir. Bu nedenle, selenyumun eklem kıkırdağındaki (AC) rolünü daha iyi anlamak için kıkırdak büyümesi ve gelişimi için sağlam bir model gereklidir. İn vitro büyüme faktörünün neden olduğu bir olgunlaşma modeli, selenyum iyonlarının varlığında veya yokluğunda olgunlaşma sırasında eklem kıkırdağının büyümesi ve metabolizması üzerine çalışmalar için yararlı bir başlangıç noktası sağlar 14,15,16. Selenyum (Se) eksikliğinin karmaşık ve birbiriyle ilişkili biyolojik süreçler üzerindeki etkileri hakkındaki bilgilerimiz çok zayıftır. Asıl sorun, selenyumun kısıtlayıcı etki aralığı (40 ila 400 μg/kg17 arasında gerekli konsantrasyon) ve ilgili çok düşük konsantrasyon nedeniyle incelenmesi gereken bir element olmaya devam etmesinde yatmaktadır. Olgunlaşmamış sığır kıkırdağı kullanan hızlandırılmış olgunlaşma modeli, gelişimin önemli bir aşamasında meydana gelen biyolojik değişikliklere bakmak için benzeri görülmemiş bir yetenek sunar. Organizmalardaki Se konsantrasyonu sıkı bir şekilde kontrol edilir ve bu model, olgunlaşma sırasında hassas bir şekilde izlenmesini sağlayan görüntüleme tekniklerinin geliştirilmesi için bir başlangıç noktasıdır. Bu teknikler daha sonra AC bozulmasını önleme stratejilerini incelemek ve potansiyel olarak yeni rejeneratif tıp temelli tedavilerin temelini geliştirmek için güçlü bir araç olabilir.
Yumuşak doku, kıkırdak ve kemik değişikliklerinin eş zamanlı görüntülenmesi, konvansiyonel preklinik görüntüleme yöntemlerinde önemli bir zorluktur. Bu gerçekten eklem hastalıklarının takibi için önemli bir yardımcı olacaktır18,19 . Örnek olarak, konvansiyonel X-ışını mikro Bilgisayarlı Tomografi (μBT), kullanımını kemik defektleri, osteofitler ve kıkırdağın dolaylı olarak görüntülenmesi ile sınırlayan yumuşak doku için düşük performans sunar. Öte yandan Manyetik Rezonans Görüntüleme (MRG), hastalıkların ilk aşamalarında kemikteki değişiklikleri (örneğin mikro kalsifikasyonlar) hassas bir şekilde işleme yeteneğinin zayıf olmasına rağmen, geleneksel olarak yumuşak doku görüntüleme için kullanılır. Kemiklere ve kıkırdaklara duyarlı olma ve kıkırdağın kurucu hücrelerini, kondrositleri ayırt etme yeteneği çok önemlidir. Faz Kontrast Görüntüleme (PCI), malzemelerin X-ışınları kırılma indisinin, hafif elementler için absorpsiyon indeksinden bin kat daha büyük olabilmesi özelliğine dayanır. Bu, tek absorpsiyona dayalı geleneksel yöntemlere kıyasla yumuşak dokular için daha yüksek bir kontrast oluşturur. Bu nedenle, PCI, hem yüksek emici (örneğin kemikler) hem de daha az emici dokuların (örneğin, fibröz kıkırdak, bağlar, tendonlar, menisküs ve ilişkili yumuşak dokuların (sinovyal membranlar ve kas) eşzamanlı temsiline sahip eklemi oluşturan tüm dokuları görüntüleyebilir18,19,20,21.
Ref.20'de gösterildiği gibi, X-ışını PCI, kıkırdak için diğer klinik öncesi görüntüleme modalitelerinden daha iyi performans gösterir. Bu protokolün amacı, prosedürü detaylandırmak ve bazı temsili sonuçları göstermektir. Büyüme faktörlerinin olgunlaşmamış kıkırdak eksplantı üzerindeki etkisinin şeması Şekil 1'de gösterilmiştir.
Protokol
Burada açıklanan tüm yöntemler Swansea Üniversitesi Etik Araştırma Komitesi tarafından onaylanmıştır ve biyopsi materyalleri Birleşik Krallık Çevre, Gıda ve Köy İşleri Bakanlığı'ndan (DEFRA) lisans altında alınmıştır. Bu protokol, kurumlarımızın hayvan bakım yönergelerini takip eder.
1. Eksplant Kültürleri
- Sığır bacakları kafa derisinden eksplantların hazırlanması
- Emici koruyucu ve bir neşter, # 10 neşter bıçağı ile standart cerrahi neşter hazırlayın.
- Tüm malzemelere %70 etanol çözeltisi püskürtün.
- Sığır bacağını (veteriner onayı ile mezbahadan temin edilen 7 günlük erkek sığır danaları) tüm kan ve çamuru temizlemek için su ile ıslatın.
- Bacağını sabunla temizleyin ve bir fırça ile ovalayın.
- Yeterince temiz olduğunda, bacağa %70 etanol püskürtün.
- Emici bir kağıda koyun.
- Bir neşter ile ayakların etrafını kesin.
- Bacağın uzunluğu boyunca hassas bir çizgi izleyin.
- Eklem bölgesinde ekstra özen gösterin.
- Bacak derisini uzunlamasına neşter çizgisi boyunca dikkatlice çıkarın.
- Atıkları (cilt, kullanılmış mendil, kağıt ve eldivenler) bir klinik atık torbasına koyun.
- Bacağı sabunla temizleyin/fırçalayın ve cilt çıkarıldığında tekrar etanol ile sterilize edin.
- Eklem boşluğuna yakın bölgeye zarar vermeyin. Kavite kan sızması ile açılır veya hasar görürse artık steril değildir ve bacak kullanılamaz.
- Bacağı% 70 etanol püskürtülmüş bir Al-folyoya yerleştirin.
- Proksimal uçtan kan çıkışını veya tırnaktan olası kontaminasyonu önlemek için uygun boyuttaki lateks eldivenleri bacağın uçlarına yerleştirin.
- Atık malzemeleri kurum kurallarına uygun şekilde bertaraf edin.
- Eksplant ekstraksiyonu ve kültürü
NOT: Eksplantlar, eklemin iç kısmından (Şekil 2, iki ilk aşama). Karşılaştırılabilir koşullara sahip olmak için, hemen hemen aynı şekil ve özelliklere sahip numuneler üzerinde dört (veya altı) farklı işlemi uygulamak için aynı bölgeden dört (veya altı) eksplant delinmelidir.- Kullanmadan 25 dakika önce laminer akış başlığını açın, %70 alkol ile temizleyin.
- Kültür ortamını bir su banyosunda ısıtmak için koyun.
- Her oyukta 1,5 mL bazik ortam, sadece DMEM-F12 (yıkama ortamı) içeren 24 oyuklu bir plaka hazırlayın.
- 1.5 mL tam kültür ortamı içeren başka bir kuyu plakası hazırlayın. Kullanana kadar 37 ° C'de kültür inkübatöründe saklayın
- Malzemeyi bir rafta hazırlayın:% 70 etanol içeren bir üniversal tüp ve yıkama ortamlı başka bir üniversal tüp.
- Bir neşter ve 4 veya 6 mm'lik bir biyopsi zımbası hazırlayın (alkol üniversal tüpüne yerleştirilir).
- Tüpleri ve malzemeleri kaputun altına koyun.
- Kaputun altına% 70 etanol püskürtülmüş emici bir koruyucu koyun.
- % 70 etanol püskürtülmüş bazı dokuları hazırlayın.
- Bir diseksiyon plakası alın, Al-folyo ile örtün.
- Önceden hazırlanmış ayakları buzdolabından (4 °C) çıkarın ve üzerlerine %70 etanol püskürtün.
- Atıkları daha sonra otoklavlamak için tehlikeli ve klinik torbaları davlumbazın yakınına atın.
- Ayağına% 70 etanol püskürtün.
- Kesinin yapılması gereken eklemin orta hattını bulmak için eklemi hareket ettirin. Bunu kaputun altında yapın.
- Steril neşteri alın.
- Eklem kenarlarının konturunu takip ederek orta hat boyunca dikkatlice kesin. Metakarpofalangeal eklem medial kondil kıkırdağına dokunmayın.
- Eklem açıldığında bağı dikkatlice kesin.
- Ayakların alt kısmını otoklav torbasına atın.
- Eklemin tüm kıkırdağını ortaya çıkarmak için diğer tüm dokuları çıkarın (Şekil 2).
NOT: Ayaklarla hiçbir şeye dokunmamaya dikkat edin. - Neşter ve biyopsi zımbasını alkole ve ardından yıkama ortamına yerleştirin.
- Bu zımba ile (yüz başına 4-5) kemiklerin iç yüzleri boyunca biraz kuvvetle bazı daireler çizin.
- Temizlemek için bittiğinde biyo-zımbayı alkole koyun.
- Bir neşter alın ve her daire arasında ve kemiğin merkezi çizgisi boyunca kesin (bir çizgi çizin).
- Kıkırdak ekstansiyi çıkarmak için, daire biyopsisinin sınırlarından birinde dikey olarak kesin, daha sonra subkondral kemik üzerinde yatay olarak çok dikkatli bir şekilde kesin.
- Subkondral kemik ve kalsifiye kıkırdak boyunca punch çizgisinin altında yatay olarak kesilen kıkırdak eksplantını çıkarmak için eksplantlar dışarı çıkacaktır.
NOT: Eksplantlar mümkünse düzgün bir kalınlığa sahip olmalıdır. - Eksplantı, 1,5 mL yıkama ortamı ile doldurulmuş kuyu plakasına yerleştirin.
NOT: Eklemde aynı yerden gelen eksplantların her zaman deneysel kontrolünü ve tedavisini gerçekleştirin. - Eksplantın doğru yönlendirildiğini kontrol edin. Eksplantın yüzeyi yukarı bakacak şekilde olmalı ve eksplantın subkondral kemik kısmı kuyu plakasının dibine bakmalıdır.
- Her biyopsi arasında kuyu plakasını kapalı tutun.
- Yıkama ortamını çıkarın.
- Yıkama ortamı ile tekrar yıkayın. Yıkama ortamında 2-3 saat bekletin. Kemik artıkları, kanın ortamda dışarı akması için zamana sahip olacaktır.
- Eksplantları, tam kültür ortamını içeren yeni bir kuyu plakasına aktarın. Dikkatli olun: pipetle hiçbir şeye dokunmayın.
- Eksplantların hala doğru konumda olup olmadığını kontrol edin (kemik, kuyu plakasının alt kısmına bakacak şekilde).
- Her şeyi temizleyin ve klinik atıkları uygun bir yere atın.
- Eksplantlar,% 5 CO2 ile 37 ° C'de bir inkübatörde kültüre yerleştirildikten sonra, hücrelerin / dokuların farklı ihtiyaçlarını karşılamak için eksplant kültür ortamını her iki günde bir ılık taze ortam ile değiştirin. Eksplantların hala doğru konumda olup olmadığını kontrol edin (kemik, kuyu plakasının alt kısmına bakacak şekilde).
- Numune fiksasyonu (isteğe bağlı)
NOT: Bu adımı sadece hücre kültürünün sonunda, yani 3 haftalık kültürden sonra gerçekleştirin. Eksplantlar daha sonra olgunlaşmış aşamaya ulaşmıştır.- Eksplantları DMEM-F12 ile doku kültürü başlığının altında bir pipetle yıkayın.
- Eksplantları PBS ile iki kez, doku kültürü başlığının altında bir pipetle yıkayın.
- %10 NBFS (Nötr Tampon Formalin Salin) içine batırarak gece boyunca 4 °C'de sabitleyin.
- PBS'deki sabit eksplantları bir mikrosantrifüj tüpüne yerleştirin
- Eksplantları 4 °C'de saklayın. Sabit eksplantlar bu koşullarda 6 aya kadar kalabilir.
2. Görüntüleme oturumu için numune hazırlama
- Numuneye ve kamera görüş alanına göre uygun boyutta (genellikle 1 mL uç) konik plastik uçlar kullanın.
- Su geçirmez bir numune kabına sahip olmak için koni ucunu (alevle ısıtarak) kapatın.
- Ucu PBS ile doldurun. Numuneyi cımbızla tutun ve tüpe yerleştirin. Yavaş sallayarak hava kabarcığını çıkarın.
- Tüpü tomografi aşamasına monte edin ve basit radyografiler çekerek hizalayın.
3. X-ışını Faz Kontrast görüntüleme seansı
- Dedektörü numuneden 2.5 m uzağa yerleştirin
- Bragg-Bragg geometrisi içinde bir çift Silikon kristal sistemi kullanarak X-ışını foton enerjisini 17 keV'ye ayarlayın.
- Mount Imaging dedektörü, 3D görüntüde 3,5 μm ile sonuçlanan izotropik voksel boyutuna sahip bir optik üzerinde bilimsel bir CMOS kamera22'den oluşuyordu.
- X-ışınını görünür ışığa dönüştürmek için 60 μm kalınlığında bir Gadolinyum Oksisülfür sintilatör ekranı kullanın
- Veri toplama: Numunenin 360° taraması sırasında, her projeksiyon için 2 sn maruz kalma süresiyle 2000 projeksiyon elde edin.
- Ref.23'te açıklandığı gibi faz sinyalini çıkarmak için bir faz alma algoritması kullanın. Algoritma, numune içindeki karmaşık kırılma indisi dağılımı hakkında a priori bir bilgi kullanır. Burada doğrulanmayan ana hipotez, yeniden yapılandırılacak tek bir malzeme olduğudur. Bu özel durumda, kırılma ve emilim indeksi arasındaki oran, kemik ve kıkırdak görselleştirmesi için deneysel olarak en iyi uzlaşma olarak gözlemlenen 1.200'e ayarlanmıştır.
- PyHST2 kodu24'ün açık kaynaklı, Grafik İşleme Birimi (GPU) tabanlı bir uygulamasını kullanarak standart filtrelenmiş geri projeksiyon CT yeniden yapılandırma algoritmasını kullanın.
Sonuçlar
Şekil 3'te çizildiği gibi basit bir yayılım tabanlı görüntüleme düzeneği25 kullanıldı. Senkrotron yayılım tabanlı görüntülemede, tutarlı bir X-ışını demeti nesneyi aydınlatır ve uzamsal olarak değişen faz kaymalarınayol açar 19. X-ışını ışını numuneden sonra yayılırken, bozulmuş dalga cephesi karakteristik model oluşturur. Bu karakteristik kalıpları özel algoritmalar23 ile analiz ederek, numunenin neden olduğu faz kaymaları sayısal olarak alınır.
Açıklanan metodolojiyi kullanan temsili faz kontrast görüntüleme dilimleri Şekil 4 ve Şekil 5'te gösterilmektedir.
3 haftalık kültürden sonra, eksplantlar daha önce tarif edildiği gibi sabitlendi. Tespit edildikten sonra, eksplantlar 4 °C'de 6 aya kadar tutulabilir. Bu deney, fiksasyonlarından yaklaşık 30 gün sonra gerçekleştirilmiştir. Şekil 4 , numunenin kıkırdak kısmı içinde 3.5 μm kalınlığında bir eksenel düzlem kesitidir. Burada, kondrositler (ince siyah yuvarlak yapılar), osteositlere (daha küçük beyaz yuvarlak yapılar) dönüşen bazı spesifik kondrosit hücreleri ve hücre dışı kıkırdak matrisinin yoğunluğundaki değişiklikler açıkça görülür. Ayrıca, kemik oluşumunu destekleyen vasküler kanallar olan seyrek daha büyük tübüler yapılar ayırt edilebilir. Bazı halka eserleri özellikle görüntünün merkezinde görülebilir. Halka artefaktları, dedektörün piksele bağlı tepkisinden kaynaklanır ve bu, gelişmiş görüntü işleme teknikleri26 kullanılarak veya sinyal-gürültü oranını artıran daha uzun bir alım süresi ile çözülebilir. Bu çalışma için bu artefakt hücre dışı matriks analizini etkilememiştir.
Şekil 5 , faz kontrast görüntülemenin tüm farklı dokuları işleme yeteneğini vurgulamak için farklı gri seviye pencerelerine sahip sagital düzlem kesitlerini göstermektedir. Şekil 5A'da kemik görselleştirme için gri değerler seçilirken, Şekil 5B,C panellerinde kıkırdak gösterimi için gri değerler ayarlanmıştır. Panel C, biyopsi sırasında yapılan bir yaraya odaklanan panel B'nin bir yakınlaştırma ekidir. Bu görüntülerde subkondral kemiğin trabeküler yapısı gözlenmektedir (panel A). Kıkırdak kısmında (Şekil 5B) sarı oklar damar kanallarını göstermektedir. Beklendiği gibi, kondrositlerin boyutu kemik plakasından kıkırdağın yüzeysel bölgesine kadar azalmıştır. Kıkırdak tıkacının ortalanmış kısmı bir nekroz (matris yoğunluğunun azalması) gösterdi. Kıkırdak ekstra hücresel matris içindeki yoğunlukta bir miktar değişiklik de gözlendi. İlginçtir ki, yaradan 21 gün sonra, bu kırığın onarımı için aktif olarak çalışan hücreler gözlenmiştir (Şekil 5C). Ek olarak, kırığın etrafında, yüksek bir yoğunluğa karşılık gelen ekstra hücresel matrisin bir hipersinyali ortaya çıktı.
Şekil 6 , iki numune koşulunun eksenel ve sagital düzlemlerini göstermektedir (Durum 1: Kültür ortamına herhangi bir büyüme faktörü eklenmeden ITS kontrolü ve koşul 2: ITS FT ile tedavi edilmiş, kültür ortamında büyüme faktörleri mevcuttu, ayrıntılar için protokole bakınız). Görüntüler, kıkırdak matrislerindeki değişiklikleri vurgulamak için aynı gri seviye penceresi ile ölçeklendirildi. Kontrol numunesi sol sütundadır ve büyüme faktörleri ile muamele edilen numune sağda gösterilmiştir. Bu görüntülerde, büyüme faktörünün kıkırdak ekstra hücresel matrikste kontrol faktöründen daha fazla hücresel matrikste değişikliklere neden olduğu açıktır. Kontrol numunesindeki kanallar boştu ve tedavi edilen numune kanallarında yoğun materyal görülebiliyordu. Kemik yapılarına yakın bazı hücreler sadece büyüme faktörü ile tedavi edilen kıkırdakta görülebiliyordu.
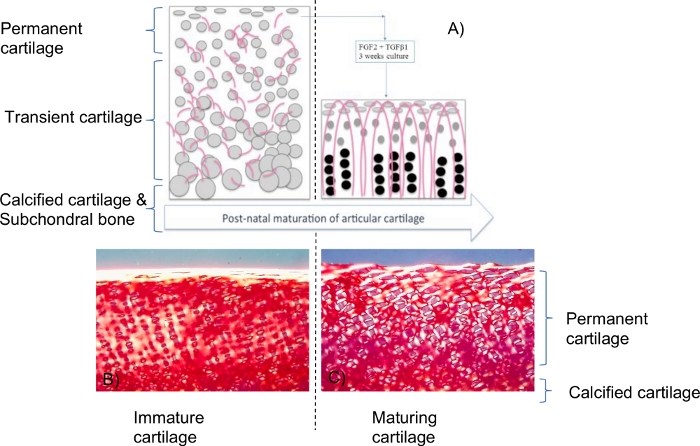
Şekil 1: Olgunlaşmamış kıkırdak eksplantları üzerindeki büyüme faktörlerinin etkilerinin şeması.
(A). FGF-2 ve TGF-β1, su içeriği, kollajen ve proteoglikan içeriği ve biyomekanik özellikler dahil olmak üzere olgun kıkırdak için aynı biyofiziksel profile yol açan olgunlaşma benzeri değişiklikleri indükler. Ek olarak, eksplantın tabanından önemli bir rezorpsiyon vardı ve bu da yükseklik2'de bir azalmaya yol açtı. Gri küreler kondrositlerdir ve pembemsi eğri çizgiler kollajen fibrilleridir. Bu çizim, referans2'den bir özettir. Olgunlaşmamış bir durumda, kondrositler ve kollajen fibriller doku içinde rastgele dağıldı. Olgun bir aşamada, kondrositler, farklı boyut ve morfolojiye sahip (literatürde iyi tanımlandığı gibi) arkadiyen yapı benzeri kollajen fibrilleri boyunca dağıtıldı. Pikro-sirius kırmızı lekeli kesitlerin (B,C) polarize ışık mikroskobu, yüzeye dik olarak hizalanmış daha yoğun ve daha fazla kollajen fibrilleri dahil olmak üzere kollajen organizasyonunda önemli değişiklikler gösterdi, ancak bu değişiklikler periselüler bölgelerle sınırlıydı. FGF-2 ve TGF-β1 (C) tarafından indüklenen olgunlaşma, kollajen fibril oryantasyonunun kıkırdağın orta / derin katmanlarındaki yüzeye dik olduğu son faza kıyasla bir ara değişim durumu gibi görünmektedir. Bu biyolojik model hakkında daha fazla ayrıntı ve bilgi için lütfen 2,3,14,15,16 maddelerini okuyun. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Eksplant kültüründen analizlere kadar deneysel prosedürün akış şeması.
Solda metakarpofalangeal eklemden alınan sığır eklem kıkırdağının (AK) 6 mm çapında biyopsileri. Burada, olgunlaşmamış AC'nin (7 günlük direksiyon) steril koşulları altında açılmış bir eklem gösterilmektedir. Ek parçada, bazı biyopsilerde bazı kıkırdakların yukarı, bazı biyopsilerde ise kıkırdakların aşağı baktığı görüldü. İmmatür eksplant biyopsileri, kıkırdağa karşılık gelen beyaz parlak bir kısım ve kalsifiye kıkırdak ve subkrondral kemiğe karşılık gelen başka bir pembemsi kısım sunar). Ortada, eksplantlar uygun tedavilerle 3 hafta boyunca kültüre yerleştirildi. Daha sonra çeşitli analizlere tabi tutulurlar. Şeklin sağında bazı örnekler gösterilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Reaktif | Miktar |
| DMEM F12 | 440 mL |
| Askorbik asit | 50 mg |
| Gentamisin | 500 μL |
| HEPES ÜNİVERSİTESİ | 5 mL |
| ONUN | 5 mL |
Tablo 1: Selenyum Ortamı Reaktifleri.
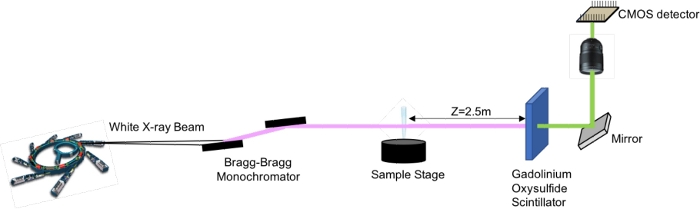
Şekil 3: X-ışını Faz Kontrast Yayılımına Dayalı Görüntüleme Kurulumu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
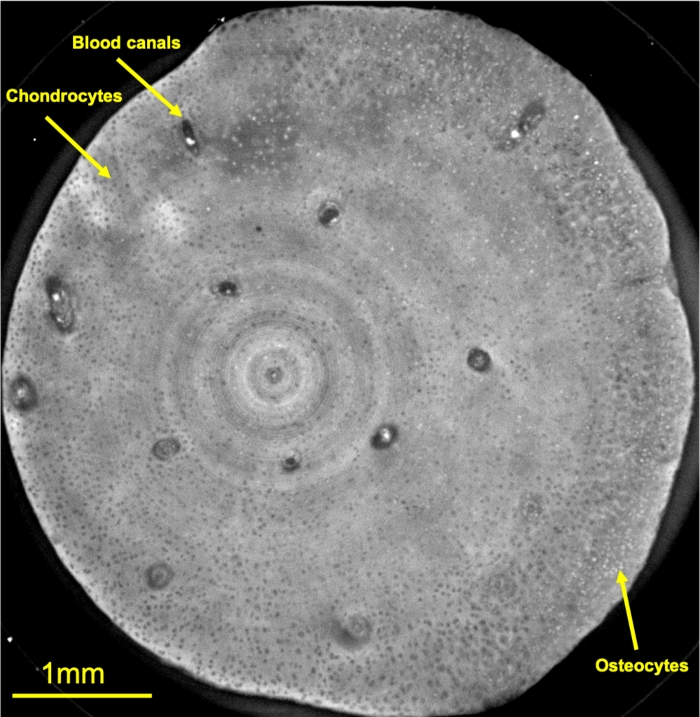
Şekil 4: Tedavi edilen kıkırdak eksplantının ince eksenel faz kontrast kesiti görüntülemesi.
Kayda değer yapılar ve hücre tipleri sarı oklarla belirtilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
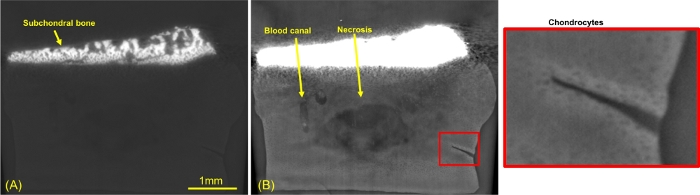
Şekil 5: Olgunlaşan kıkırdağın sagital ince kesit faz kontrast görüntülemesi.
(A) Kemik penceresi (B) kıkırdak penceresi (C) kıkırdak matrisine yerleştirilmiş, bir kırık üzerine merkezlenmiş. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
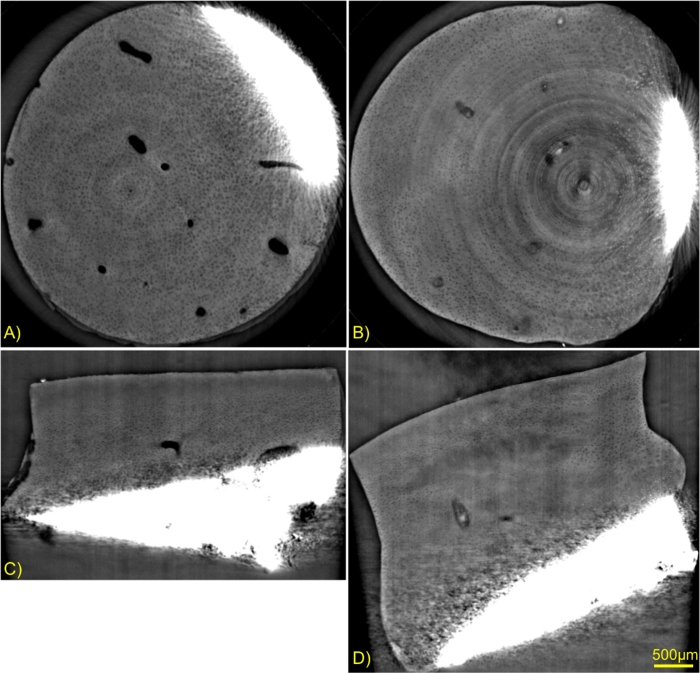
Şekil 6: İki numunenin Faz Kontrast görüntülemesinin karşılaştırılması.
Eksplant (A ve C) ve büyüme faktörü muamelesi (B ve D) ile kültürlenmiş eksplantı kontrol edin. Eksenel dilimler (A ve B) ve sagital dilimler (C ve D). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
İn vitro hızlı olgunlaşan eklem kıkırdağı çalışması için numune hazırlamadan veri toplama protokolleri de dahil olmak üzere görüntü görselleştirmeye kadar eksiksiz bir çalışma sunduk. Bir senkrotron görüntüleme seansının sonuçları, modelin iyiliğini gösterdi.
Burada sunulan modelde bazı gözlem ve sınırlardan bahsetmek gerekir. Bu "hızlandırılmış olgunlaşma", kültürden sonraki 21 gün içinde gerçekleşir. Daha uzun kültür dönemleri için, eksplant tıkaçları, ref.27'de detaylandırıldığı gibi hücresel metabolizma ve kıkırdak ECM bileşenleri (yani kollajenler ve proteoglikanlar) içeriğindeki değişiklikle bozulmaya başlar. Yine de bizim modelimizde 21 gün sınırı içerisinde doku stabil kalmaktadır 2,3. Modelin karmaşık yeniden modelleme dinamikleri değerlendirilebilir. Olgunlaşmış kıkırdak, biyokimyasal ve biyomekanik özellikler açısından yetişkin bir kıkırdağı taklit ederken, sunulan model, olgun kıkırdakta görülene benzer şekilde kollajen oryantasyonunun tam yeniden düzenlenmesini göstermez. Bunun, doku içinde çapraz bağlanmayı indükleyen ve dolayısıyla daha fazla kollajen yeniden organizasyonunu inhibe eden lizil oksidaz-L1 (LOXL1) izoformunun aşırı ekspresyonundan kaynaklandığına inanıyoruz10. Kıkırdak büyümesinin mekaniği, bir süreklilik karışımı modeli28 ile modellenmiştir. Örneklerimizin kültürlendiği mekanik uyaranların bulunmadığı statik ortam, başka bir potansiyel açıklama olabilir. Bu, selenyum eksikliği olan bir ortama maruz kalan AC için araştırılması gereken önemli bir parametreyi temsil eder.
Numune hazırlama, her biri numune şartlandırma için önemli olan steril koşullarda gerçekleştirilmelidir. Bununla birlikte, görüntüleme seansı için numune fiksasyonu zorunlu değildir. Fiksasyon olmadan, numuneler üç haftalık kültürden sonra doğrudan görüntülenmelidir. Bu model üç haftalık kültür seanslarında kullanılmaya uygundur. Bu durumda hiçbir gecikme kabul edilemez, çünkü kültürün sonunda, eksplantların merkezi çekirdeğinde hafif nekroz gibi başka rahatsızlıklar ortaya çıkabilir. Numune sabit olmadığından, biyolojik bozunmayı sınırlamak için dikkatli bir şekilde ele alınmalıdır. Örneğin PCR, ICP-MS ve histoloji gibi diğer deneyler için kullanılabilir. Bununla birlikte, bizim durumumuzda, numuneler, aynı eksplantlar üzerinde farklı görüntüleme modalitelerini (burada sunulmamıştır) test etmek için kimyasal olarak sabitlendi. Synchrotron ışın süreleri kısıtlı erişimler sunar. Numuneler daha sonra daha iyi kolaylıklar için analiz edilmeye hazır olmalıdır. Numune hazırlamada karşılaşılan ana zorluk, herhangi bir bakteriyel kontaminasyonu önlemek için eklemin steril bir başlık altında açılması gereken eksplant kültürüdür. Biyopsi sırasında, kontaminasyona neden olabilecek tüm kan hücrelerini uzaklaştırmak için eksplant kültüre yerleştirilmeden önce birkaç kez durulanmalıdır. Burada kullanılan hızlı olgunlaşma protokolü, günler içinde geçerli numunelerin oluşturulmasına ve biyolojik olarak ilgili özelliklerin sunulmasına izin verdi. Numune çaplarının değişkenliği, bağlantı boyutu ile en iyi uzlaşma ve statik olarak ilgili olabilecek bir numune boyutuna sahip olma ile açıklanmaktadır. 4 mm'nin altında, bir eksplant kültürünü sürdürmek için yeterli maddeye sahip değiliz ve 6 mm'den fazla zımba, eklem boyutundan daha büyüktür. Bu çözünürlükteki görüntü görüş alanı rekonstrüksiyon düzleminde 14 x 14mm2'ye kadar olabileceğinden, bu görüntüleme oturumunu etkilemez. Numunenin yüksekliği de bir sınırlama değildir, çünkü birkaç alımı istifleyebiliriz. X-ışını PCI için, rekonstrüksiyonların kalitesi önemli parametrelerden etkilenebilir. X-ışını Faz kontrast Görüntüleme, numunenin dinlendiği çevredeki sıvı ortamda oluşabilecek hava kabarcıklarına karşı oldukça hassastır. İyi bir rekonstrüksiyon için hem kıkırdak hem de kemik içeren minimum sayıda dilim gereklidir. Bu nedenle numuneyi kemik plakası kiriş yayılma düzlemine paralel olacak şekilde yerleştiriyoruz.
Bu deneyin temel amacı, X-ışını PCI'nin kıkırdak olgunlaşma sürecini takip etmek için uygun bir görüntüleme adayı olup olmadığını araştırmaktı. Histolojik teknikler muhtemelen daha iyi bir özgüllüğe sahip olacaktır, ancak bunlar yıkıcıdır ve kesinlikle 2D araştırma ile sınırlıdır, burada kullanılan teknik ise hızlı ve invaziv değildir. Burada sunulan görüntüleme prosedürü, verilerin sayısal olarak işlenmesi ile oldukça basittir. Tekniğin ana dezavantajı, yalnızca senkrotronlarda veya karmaşık X-ışını kaynaklarında mevcut olan gerekli büyük enine tutarlılık ve ışın kolimasyonudur. Bununla birlikte, senkrotron görüntüleme ışın hatlarına erişim, kamu teklifinin kabulü ile tüm dünyada mümkündür. Enerjinin seçimi kritiktir. Seçilen enerjiye bağlı olarak, kemik metal benzeri artefaktları indükleyebilir. Bu çalışmada, kıkırdak matrisinde çok iyi bir kontrasta sahipken, kemiğin güçlü artefaktlara neden olabileceği 17 keV'lik bir enerji seçtik. Enerjiyi yükseltmek, kıkırdak matrisinin görüntü kalitesini düşürürken kemik artefaktlarını çözecektir. Kıkırdak ana seçim olduğu için bu uzlaşmayı yapmak zorunda kaldık. Kullanılan bu görüntüleme protokolü sayesinde, hücre dışı matriksteki bazı ince değişiklikleri ve diğer modalitelerle görselleştirilemeyen hücre morfolojisini 3D olarak ortaya çıkarabildik. Sonuçlar, X-ışını Faz Kontrast Görüntülemenin (PCI) tek bir edinim içinde kemik ve kıkırdak dokularını nispeten hızlı bir edinim süresinde (yaklaşık 1 saat) oluşturabildiğini göstermektedir. Ayrıca, her iki hücre tipi (kondrositler ve osteositler) aynı anda görülebilir, ayrıca kıkırdak hücre dışı matris içindeki varyasyonlar da görülebilir. Bu protokol ve elde edilen tipik sonuçlar, kıkırdak mekaniği ve biyolojisi hakkında daha kapsamlı çalışmalara sahip olma olasılığını açmaktadır. Bu yöntemin, eklemler içindeki kondrositlerin davranışlarını incelemek için dinamik olarak uygulanabileceği varsayılabilir. Eklemlerin in situ ve in vivo olarak 3D makro ve mikroskobik incelemesinin perspektifleri oldukça heyecan vericidir ve X-ışını kaynaklarındaki gelişmeler ve X-ışını fazı kontrast görüntüleme29,30 sayesinde mümkün görünmektedir. Sonuçta, bu, bir sır olarak kalan yükleme koşulları altında kondrositlerin işlevini keşfetmeye izin verecektir. Bu yeni PCI yeteneklerinden yararlanmak için aynı hazırlık protokolünü takiben büyük bir örnek veri tabanında daha fazla çalışma yapılacaktır.
Açıklamalar
Hiç kimse.
Teşekkürler
Yazarlar, kurum içi ışın süresi sağladığı için ESRF'ye teşekkür eder. Yazarlar bilimsel tartışmalar için Eric Ziegler'e teşekkür eder. Açıklanan PCI deneyi, Fransa'nın Grenoble kentindeki Avrupa Sinkrotron Radyasyon Tesisi'nin (ESRF) BM05 ışın hattında gerçekleştirildi. CB, bu çalışmanın bir bölümünü finanse ettiği için Explora'doc Auvergne Rhone Alpes'e ve Swansea Üniversitesi ve Université Grenoble Alpes'ten burslara teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Material : Biological products | |||
| DMEM/F-12 (1:1) (1X) + GlutaMAX Dulbecco's Modified Eagle Medium F-12 Nutriment Mixture (Ham) 500mL | Gibco by life technologies | 31331-028 | |
| Gentamicin Reagent Solution, 50 mg/mL | Gibco by life technologies | 15750-060 | |
| HEPES, special preparation, 1M, pH 7.5 filtered | Sigma | H-3375 | |
| ITS, Insulin-Transferrin-Selenium | Gibco by life technologies | 51500-057 | |
| L-Ascorbic Acid-2-Phosphate, sesquimagnesium salf hydrate, 95% | Sigma | A8960-5G | |
| Neutral Buffer Formalin (NBF) | Sigma Aldrich | HT501128 | |
| phosphate buffered saline (PBS) pH 7.4 | Gibco by life technologies | 10010023 | |
| Culture equipments: | |||
| Absordent Protector,Benchkote | WhatmanTM | Cat No. 2300731, | Polysterene Backed, 460cm*50m |
| Accurpette VWR | |||
| Autoclavable Disposal Bag | For disposal of contamined plastic laboratory ware neck should be left open to allow penetration of steam, Hazardous Waste, STERILIN (white bag) | ||
| biopsy punches | MILTEX by KAI | ref 33-36 | 4 & 6 mm diameter |
| Clinical waste for alternative treatment Medium Duty | (UN-approved weight 5kg, Un-closure methods, UN- SH4/Y5/S/II/GB/4/06 (orange bag) | ||
| Eppendorf tubes | 0.5mL and 1.5 mL | ||
| Falcon tubes | 15mL and 50 mL | ||
| free of detectable RNase, DNase, DNA&Pyrogens 1000ul Bevelled Graduated, filter tip | Starlab, TipOne (sterile) | S1122-1830 | |
| free of detectable RNase, DNase, DNA&Pyrogens 20µl Bevelled Graduated, filter tip | Starlab, TipOne (sterile) | S1120-1810 | |
| free of detectable RNase, DNase, DNA&Pyrogens 200ul Bevelled Graduated, filter tip | Starlab, TipOne (sterile) | S1110-1810 | |
| Incubator | Incubator at 37°C, humidified atmosphere with 5% CO2 | ||
| Optical microscope | |||
| Pipette-boy | 25mL-, 10mL-, and 5mL sterile plastic-pipettes | ||
| Pipettes (25-10-5 ml) | CellStar, Greiner Bio-one | ||
| Plastic tweezers | Oxford Instrument | AGT 5230 | |
| Scalpel | |||
| Tips | P1000, P200 and P10 with P1000, P200 and P10 tips (sterile) | ||
| Tissue culture hood | |||
| Vacuum pump | |||
| Water bath 37°C | |||
| well plates | 12 & 24 well plates | ||
| Protection equipment: | |||
| face shield | |||
| gloves | |||
| lab coat | |||
| safety goggles | |||
| Data acquisition equipment: | |||
| Fiji software | open source Software | ||
| PyHST reconstruction toolkit | open source Software |
Referanslar
- Little, C. B., Ghosh, P. Variation in proteoglycan metabolism by articular chondrocytes in different joint regions is determined by post-natal mechanical loading. Osteoarthritis and Cartilage. 5 (1), 49-62 (1997).
- Khan, I. M., et al. Fibroblast growth factor 2 and transforming growth factor β1 induce precocious maturation of articular cartilage. Arthritis and Rheumatology. 63 (11), 3417-3427 (2011).
- Khan, I. M., et al. In vitro growth factor-induced bio engineering of mature articular cartilage. Biomaterials. 34 (5), 1478-1487 (2013).
- McNulty, A. L., Vail, T. P., Kraus, V. B. Chondrocyte transport and concentration of ascorbic acid is mediated by SVCT2. Biochimica et Biophysica Acta - Biomembrane. 1712 (2), 212-221 (2005).
- Clark, A. G., Rohrbaugh, A. L., Otterness, I., Kraus, V. B. The effects of ascorbic acid on cartilage metabolism in guinea pig articular cartilage explants. Matrix Biology. 21 (2), 175-184 (2002).
- Liu, X., et al. Role of insulin-transferrin-selenium in auricular chondrocyte proliferation and engineered cartilage formation in Vitro. International Journal of Molecular Sciences. 15 (1), 1525-1537 (2014).
- French, M. M., Athanasiou, K. A., Ashammakhi, N., Ferretti, P. Differentiation Factors and Articular Cartilage Regeneration. Topics in Tissue Engineering. , (2003).
- Zhang, Y., et al. Platelet-rich plasma induces post-natal maturation of immature articular cartilage and correlates with LOXL1 activation. Science Reports. 7 (1), 3699 (2017).
- Schepman, K., Engelbert, R. H. H., Visser, M. M., Yu, C., De Vos, R. Kashin Beck Disease: More than just osteoarthrosis - A cross-sectional study regarding the influence of body function-structures and activities on level of participation. International Orthopedics. 35 (5), 767-776 (2011).
- Sudre, P., Mathieu, F. Kashin-Beck disease: From etiology to prevention or from prevention to etiology. International Orthopedics. 25 (3), 175-179 (2001).
- Allander, E. Kashin-Beck Disease. An analysis of Research and public health activities based on a bibliography 1849-1992. Scandinavian Journal of Rheumatology. 23 (99), 1-36 (1994).
- Bissardon, C., et al. Sub-ppm level high energy resolution fluorescence detected X-ray absorption spectroscopy of selenium in articular cartilage. Analyst. 144 (11), (2019).
- . Role of Selenium in Articular Cartilage Metabolism, Growth and Maturation Available from: https://tel.archives-ouvertes.fr/tel-01942169 (2020)
- Bissardon, C., Charlet, L., Bohic, S., Khan, I. Role of the selenium in articular cartilage metabolism, growth, and maturation. Global Advances in Selenium Research from Theory to Application - Proceedings of the 4th International Conference on Selenium in the Environment and Human Health, 2015. , (2016).
- Winkel, L. H. E., et al. Environmental selenium research: From microscopic processes to global understanding. Environment Science Technology. 46 (2), 571-579 (2012).
- Bravin, A., Coan, P., Suortti, P. X-ray phase-contrast imaging: From pre-clinical applications towards clinics. Physics in Medicine and Biology. 87 (1034), 20130606 (2014).
- Horng, A., et al. Cartilage and soft tissue imaging using X-rays: Propagation-based phase-contrast computed tomography of the Human Knee in comparison with clinical imaging techniques and histology. Investigative Radiology. 49 (9), 627-634 (2014).
- Labriet, H., et al. High-Resolution X-Ray Phase Contrast Imaging of Maturating Cartilage. Microscopy and Microanalysis. 24, 382-383 (2018).
- Rougé-Labriet, H., et al. X-ray Phase Contrast osteo-articular imaging: a pilot study on cadaveric human hands. Science Reports. 10 (1911), 41598 (2020).
- Mittone, A., et al. Characterization of a sCMOS-based high-resolution imaging system. Journal of Synchrotron Radiation. 24 (6), 1226-1236 (2017).
- Paganin, D., Mayo, S. C., Gureyev, T. E., Miller, P. R., Wilkins, S. W. Simultaneous phase and amplitude extraction from a single defocused image of a homogeneous object. Journal of Microscopy. 206 (1), 33-40 (2002).
- Mirone, A., Brun, E., Gouillart, E., Tafforeau, P., Kieffer, J. The PyHST2 hybrid distributed code for high speed tomographic reconstruction with iterative reconstruction and a priori knowledge capabilities. Nuclear Instruments and Methods in Physics Research Section B: Beam Interactions with Materials and Atoms. 324, 41-48 (2014).
- Bravin, A., Coan, P., Suortti, P. X-ray phase-contrast imaging: from pre-clinical applications towards clinics. Physics in Medicine and Biology. 58 (1), 1-35 (2013).
- Vo, N. T., Atwood, R. C., Drakopoulos, M. Superior techniques for eliminating ring artifacts in X-ray micro-tomography. Optic Express. 26 (22), 28396 (2018).
- Moo, E. K., Osman, N. A. A., Pingguan-Murphy, B. The metabolic dynamics of cartilage explants over a long-term culture period. Clinics. 66 (8), 1431-1436 (2011).
- Stender, M. E., et al. Integrating qPLM and biomechanical test data with an anisotropic fiber distribution model and predictions of TGF-β1 and IGF-1 regulation of articular cartilage fiber modulus. Biomechanics and Modeling in Mechanobiology. 12 (6), 1073-1088 (2013).
- Labriet, H., Bosmans, H., Chen, G. H., Gilat Schmidt, T., et al. 3D histopathology speckle phase contrast imaging: from synchrotron to conventional sources. Medical Imaging 2019: Physics of Medical Imaging. , (2019).
- Zdora, M. C., et al. X-ray Phase-Contrast Imaging and Metrology through Unified Modulated Pattern Analysis. Physics Review Letters. 118 (20), 203903 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır