Method Article
Preparación in vitro de explantes de cartílago articular bovino en maduración activa para la obtención de imágenes con contraste en fase de rayos X
En este artículo
Resumen
Este protocolo describe la preparación del cartílago articular bovino in vitro para la obtención de imágenes en alta resolución con rayos X. Estos explantes se someten activamente a la maduración postnatal. Describimos aquí los pasos necesarios desde la biopsia hasta el análisis de datos de las imágenes de contraste de fase de rayos X en 3D, pasando por el cultivo de explantes, la fijación de tejidos y la preparación del sincrotrón.
Resumen
Comprender los mecanismos que sustentan la maduración postnatal del cartílago articular es de crucial importancia para diseñar la próxima generación de estrategias de ingeniería de tejidos y potencialmente reparar el cartílago enfermo o dañado. En general, la maduración postnatal del cartílago articular, que es un cambio total en la estructura del colágeno y la función del tejido para acomodar el crecimiento del organismo, ocurre en una escala de tiempo que va de meses a años. Por el contrario, la disolución de la organización estructural del cartílago, que también se produce a lo largo de largos períodos de tiempo, es el sello distintivo de la degeneración de los tejidos. Nuestra capacidad para estudiar estos procesos biológicos en detalle se ha visto reforzada por los hallazgos de que los factores de crecimiento pueden inducir una maduración precoz in vitro del cartílago articular inmaduro. Los cambios relacionados con el desarrollo y la enfermedad que ocurren en la articulación involucran hueso y cartílago, y la capacidad de co-imagen de estos tejidos aumentaría significativamente nuestra comprensión de sus funciones entrelazadas.
La visualización simultánea de los cambios en los tejidos blandos, cartílagos y huesos es hoy en día un reto a superar para las modalidades convencionales de imagen preclínica utilizadas para el seguimiento de las enfermedades articulares. Los métodos tridimensionales de imágenes de contraste de fase (PCI) de rayos X han estado en constante desarrollo durante 20 años debido al alto rendimiento para obtener imágenes de objetos de baja densidad y su capacidad para proporcionar información adicional en comparación con las imágenes de rayos X convencionales.
En este protocolo detallamos el procedimiento utilizado en nuestros experimentos, desde la biopsia del cartílago, la generación de cartílago maduro in vitro hasta el análisis de los datos de la imagen recogida mediante contraste de fase de rayos X.
Introducción
El cartílago articular inmaduro es un soporte adecuado para iniciar cambios morfológicos, estructurales y biomoleculares1 con el fin de obtener una función articular adulta específica. El cambio principal es la reorganización de las fibrillas de colágeno, que pasan de una que muestra una orientación paralela con respecto a la superficie en el cartílago inmaduro a una en la que las fibrillas más profundas del tejido son perpendiculares en el cartílago maduro. La pseudoestratificación del cartílago adulto es evidente a través de la reorganización de los condrocitos residentes a lo largo de la dirección de la orientación de las fibrillas de colágeno, con células en la superficie en forma de disco y paralelas a la superficie, y en las zonas más profundas, las células se vuelven progresivamente más grandes y organizadas en columnas. Se sabe que la maduración postnatal ocurre a lo largo de muchos meses y se completa esencialmente al final de la pubertad, se pensó que la larga escala de tiempo hacía que el estudio de esta importante transición del desarrollo en el mejor de los casos fuera difícil o técnicamente imposible de estudiar en detalle2. Algunos avances en la solución de este problema se han realizado a través del hallazgo de que el factor de crecimiento de fibroblastos-2 y el factor de crecimiento transformante-β1 juntos son capaces de inducir cambios fisiológicos y morfológicos importantes que replican la maduración del cartílago articular 2,3 (Figura 1). La maduración in vitro inducida por el factor de crecimiento se produce en tres semanas y no requiere ningún aporte biomecánico. Después del cultivo, la expresión de colágeno tipo II se reduce significativamente y la proporción de enlaces cruzados de colágeno trivalente maduro a divalente inmaduro aumenta, como se observa en el cartílago maduro. Además, la organización de la matriz extracelular y las fibrillas de colágeno es más cercana a la observada en el cartílago maduro, aunque esta faceta de transición no está completa. Bioquímicamente, la composición del cartílago tratado con factor de crecimiento es similar a la de un cartílago articular adulto3.
El modelo utilizado en el artículo se basa en un in vitro Cultivo de explantes de 4 o 6 mm de diámetro que fueron extirpados en condiciones estériles de la cara lateral del cóndilo medial de la articulación metacarpofalángica de novillos bovinos machos inmaduros (7 días de edad). Se mantuvo una fina capa de cartílago calcificado y hueso subcondral en la cara basal de cada explante. El cartílago articular se cultivó en un medio clásico sin suero, Dulbecco's Eagles, modificado (glucosa alta 4,5 g/L), en el que se añadieron insulina-transferrina-selenio (ITS), 10 mM de tampón HEPES, pH 7,4, ácido ascórbico y gentamicina 50 μg/mL. Este medio de cultivo se complementa con 100 ng/mL de factor de crecimiento de fibroblastos 2 (FGF-2) y 10 ng/mL de factor de crecimiento transformante β1 (TGF-β1) que se reponen cada tercer día con cambios de medio2. La maduración altamente acelerada del cartílago es inducida por la combinación de factores de crecimiento. Estos cambios se producen en un plazo de 21 días. La estimulación del factor de crecimiento induce adicionalmente la apoptosis y la resorción del aspecto basal y la proliferación celular en los condrocitos de superficie3. La composición del medio de cultivo se describe en Tabla 1. Siguiendo el modelo desarrollado por Khan et al. 20112, los explantes de cartílago articular se cultivan con TGF-β1 a una concentración de 10 ng/μL y FGF2 a una concentración de 100 ng/μL (concentraciones de stock de 10 μg/mL y 100 μg/mL disueltos en solución salina tamponada con fosfato/0,1% BSA). Se utiliza 1 μL de cada factor de crecimiento por 1 mL del medio. DMEM-F12 con L-glutamina y alta glucosa es un medio artificial que, una vez suplementado con insulina, transferrina y selenio (ITS), ácido ascórbico, gentamicina y HEPES, proporciona una suplementación completa del medio con todos los requerimientos fisiológicos de crecimiento específicos de las diferentes líneas celulares y cultivos de explantes. DMEM-F12 se compone de varias sales inorgánicas diversas (es decir, NaCl, KCl, CaCl2, MgCl2, NaH2PO4), glucosa, aminoácidos (fuentes de nitrógeno), vitaminas, cofactores y agua. Esas sales proporcionan insumos energéticos adecuados para sostener la supervivencia celular y el crecimiento normal en cultivo. Los iones minerales contribuyen a mantener la osmolaridad cerca del entorno fisiológico natural. La mayor concentración de glucosa (4,5 g/L) se utiliza ya que los condrocitos respiran principalmente a través de la glucólisis. La suplementación con medio F12 se utiliza porque ofrece varias fuentes de sulfato, CuSO4, FeSO4, ZnSO4 y MgSO4 necesario para la síntesis de glicosaminoglicanos sulfatados. Como se verifica mediante indicadores de colores (aquí rojo fenol) y CO2/HCO-3 tampón combinado con fosfatos, el pH permanece constante a un valor cercano a 7,4. La principal vía respiratoria utilizada por los condrocitos es la glucólisis, donde el ácido láctico es el producto final que provoca un aumento del pH, por lo tanto, en ausencia de fuerzas biomecánicas que ayudarían a eliminar el ácido láctico producido localmente, HEPES actúa para mantener un entorno amortiguado para los procesos fisiológicos. La gentamicina es un antibiótico aminoglucósido que controla la contaminación bacteriana externa mediante la inhibición del crecimiento. El ácido ascórbico se utiliza como complemento medio por su acción antioxidante4. El ácido ascórbico es un cofactor de las enzimas, las prolil hidroxilasas, que funcionan para hidroxilar los residuos de prolina en el colágeno, estabilizando su estructura triple helicoidal. La transferrina suele servir como antioxidante extracelular (toxicidad y reducciones de ROS)5,6. También se añade al medio de cultivo por su capacidad para proporcionar y facilitar el almacenamiento y transporte de hierro extracelular en el cultivo celular. La transferrina se une al hierro tan fuertemente en condiciones fisiológicas que prácticamente no existe hierro libre para catalizar la producción de radicales libres7. La señalización de la hormona insulina desde su receptor unido aumenta la absorción de varios elementos como la glucosa y los aminoácidos. También interviene en varios procesos, como el transporte intracelular, la lipogénesis, la síntesis de proteínas y ácidos nucleicos. La insulina tiene un efecto promotor del crecimiento. El selenio está presente adicionalmente en la solución compuesta "insulina-transferrina-selenio", como selenito de sodio. Se utiliza principalmente como cofactor para proteínas (seleno-) como la gluthationa peroxidasa (GPX), como agente antioxidante suplementario en el cultivo. En in vitro condrocitos articulares, ITS parece mejorar la proliferación celular y la preservación del fenotipo al inhibir la expresión génica relacionada con la desdiferenciación celular y la diferenciación hipertrófica8. Al medio de cultivo se añaden factores de crecimiento como el factor de crecimiento de fibroblastos-2 y el factor de crecimiento transformante β1. Se utilizan para inducir y regular la diferenciación, el crecimiento, la curación y el desarrollo celular2,3. FGF-2 y TGF-β1 en combinación también promueven potentemente la proliferación celular en células y tejidos cultivados9.
Este modelo de maduración in vitro del cartílago articular es útil por tres razones principales. En primer lugar, la transición acelerada de la fase de desarrollo en este modelo nos permite estudiar cambios imperceptibles que ocurren a lo largo de muchos meses en modelos in vivo, como la expresión elevada de lysl oxidasa-L1 durante la maduración10. En segundo lugar, la ingeniería de tejidos del cartílago articular se ve afectada por el hecho de que se produce un cartílago con una morfología y estructura isotrópica que es funcionalmente deficiente cuando se trasplanta a las articulaciones para reparar defectos focales. Comprender cómo inducir cambios madurativos acelerará el desarrollo de dispositivos implantables completamente funcionales. En tercer lugar, y pertinente para este estudio, existen afecciones articulares degenerativas, como la enfermedad de Kashin-Beck, que ocurren durante la infancia y que conducen a deformidades articulares graves en la edad adulta. Esta enfermedad en particular está fuertemente asociada a áreas geográficas (China) con deficiencias endémicas de selenio y yodo que pueden afectar a decenas de millones de habitantes 11,12,13. El examen de los defectos esqueléticos en la enfermedad de Kashin-Beck muestra que ocurre peripuberal, lo que implica una perturbación de los procesos de maduración esqueléticos. Por lo tanto, para comprender mejor el papel del selenio en el cartílago articular (CA), se requiere un modelo sólido para el crecimiento y desarrollo del cartílago. Un modelo de maduración inducido por el factor de crecimiento in vitro proporciona un punto de partida útil para los estudios sobre el crecimiento y el metabolismo del cartílago articular durante la maduración en presencia o ausencia de iones de selenio 14,15,16. Nuestro conocimiento de los efectos de la deficiencia de selenio (Se) en procesos biológicos complejos e interrelacionados sigue siendo muy escaso. El principal problema radica en el hecho de que el selenio sigue siendo un elemento a estudiar debido a su rango de acción restrictiva (concentración requerida entre 40 y 400 μg/kg17) y a la muy baja concentración involucrada. El modelo de maduración acelerada que utiliza cartílago bovino inmaduro ofrece una capacidad sin precedentes para observar los cambios biológicos que ocurren durante una fase importante del desarrollo. La concentración de SS en los organismos está estrictamente controlada, y este modelo es un punto de partida para desarrollar técnicas de imagen que permitan su seguimiento preciso durante la maduración. Estas técnicas podrían ser una herramienta poderosa para estudiar estrategias para prevenir la degradación de la CA y, potencialmente, para desarrollar la base de nuevas terapias basadas en la medicina regenerativa.
La visualización simultánea de los cambios en los tejidos blandos, cartílagos y huesos es un desafío importante en las modalidades convencionales de imágenes preclínicas. De hecho, esto sería una ayuda importante para el seguimiento de las enfermedades articulares18,19 . Por ejemplo, la microtomografía computarizada de rayos X (μCT) convencional presenta un rendimiento deficiente para los tejidos blandos que limita su uso a la representación de defectos óseos, osteofitos y visualización indirecta del cartílago. Por otro lado, la resonancia magnética (RMN) se emplea convencionalmente para obtener imágenes de tejidos blandos a pesar de su escasa capacidad para reproducir con precisión los cambios en el hueso (por ejemplo, microcalcificaciones) durante las etapas iniciales de las enfermedades. La capacidad de ser sensible a los huesos y cartílagos, y de distinguir las células constitutivas del cartílago, los condrocitos, es de tremenda importancia. Las imágenes de contraste de fase (PCI) se basan en la propiedad de que el índice de refracción de los rayos X de los materiales puede ser mil veces mayor que el índice de absorción de los elementos ligeros. Esto genera un mayor contraste para los tejidos blandos en comparación con los métodos convencionales basados en la absorción única. Por lo tanto, la ICP es capaz de obtener imágenes de todos los tejidos que constituyen la articulación teniendo representación concurrente de tejidos de alta absorción (p. ej., huesos) y menos absorbentes (p. ej., cartílago fibroso, ligamentos, tendones, meniscos y tejidos blandos asociados (membranas sinoviales y músculo))18,19,20,21.
Como se ha demostrado en la ref.20, la ICP de rayos X supera a las otras modalidades de imagen preclínica para el cartílago. El propósito de este protocolo es detallar el procedimiento y mostrar algunos resultados representativos. En la Figura 1 se muestra el esquema del efecto de los factores de crecimiento en el explante de cartílago inmaduro.
Protocolo
Todos los métodos descritos aquí han sido aprobados por el Comité de Investigación Ética de la Universidad de Swansea y los materiales de biopsia se adquirieron bajo licencia del Departamento de Medio Ambiente, Alimentación y Asuntos Rurales (DEFRA) del Reino Unido. Este protocolo sigue los lineamientos de cuidado animal de nuestras instituciones.
1. Explantar cultivos
- Preparación de los explantes de cuero cabelludo de patas bovinas
- Prepare un protector absorbente y un bisturí, bisturí quirúrgico estándar con hoja de bisturí # 10.
- Rocíe todos los materiales con una solución de etanol al 70%.
- Remojar la pierna bovina (novillos bovinos machos de 7 días obtenidos del matadero con autorización veterinaria) con agua para eliminar toda la sangre y el barro.
- Limpie la pierna con jabón y frote con un cepillo.
- Cuando esté adecuadamente limpio, rocíe la pierna con etanol al 70%.
- Colócalo sobre un papel absorbente.
- Corta alrededor de los pies con un bisturí.
- Traza una línea delicada a lo largo de la pierna.
- Tenga especial cuidado en la zona de las articulaciones.
- Retire la piel de la pierna con cuidado a lo largo de la línea de bisturí a lo largo.
- Coloque los residuos (piel, pañuelos usados, papel y guantes) en una bolsa de residuos clínicos.
- Limpiar/cepillar la pierna con jabón y esterilizar con etanol de nuevo cuando se haya retirado la piel.
- No dañe la región cercana a la cavidad articular. Si la cavidad se abre o se daña con la infiltración de sangre, ya no es estéril y no se puede usar la pierna.
- Coloque la pierna en un papel de aluminio que haya sido rociado con etanol al 70%.
- Coloque los guantes de látex del tamaño adecuado sobre los extremos de la pierna para evitar la salida de sangre por el extremo proximal o la posible contaminación del casco.
- Eliminar los materiales de desecho de la manera adecuada siguiendo las normas institucionales.
- Extracción y cultivo de explantes
NOTA: Los explantes deben obtenerse de la parte interna de la junta (Figura 2, dos primeras etapas). Para que las condiciones sean comparables, se deben perforar cuatro (o seis) explantes de la misma zona para aplicar los cuatro (o seis) tratamientos diferentes en muestras que posean casi la misma forma y características.- Abra la campana de flujo laminar 25 min antes de usar, limpie con alcohol al 70%.
- Ponga el medio de cultivo a calentar en un baño de agua.
- Prepare una placa de 24 pocillos con 1.5 mL de medio básico, solo DMEM-F12 (medio de lavado) en cada pocillo.
- Prepare otra placa de pocillo con 1,5 mL de medio de cultivo completo. Almacenar en incubadora de cultivo a 37 °C hasta su uso
- Prepare el material en una rejilla: un tubo universal con etanol al 70% y otro tubo universal con medio de lavado.
- Prepare un bisturí y un punzón de biopsia de 4 o 6 mm (colocado en el tubo universal con alcohol).
- Coloque los tubos y los materiales debajo del capó.
- Coloque un protector absorbente rociado con etanol al 70% debajo del capó.
- Prepare algunos pañuelos rociados con etanol al 70%.
- Tome una placa de disección, cúbrala con papel de aluminio.
- Saca de la nevera los mismos pies previamente preparados (4 °C) y rocíalos con etanol al 70%.
- Deseche las bolsas peligrosas y clínicas cerca de la campana para esterilizar los desechos en autoclave más tarde.
- Rocíe el pie con etanol al 70%.
- Mueva la articulación para encontrar la línea media de la articulación donde se debe hacer la incisión. Hazlo bajo el capó.
- Toma el bisturí estéril.
- Corte con cuidado a lo largo de la línea media siguiendo el contorno de los bordes de la junta. No toque el cartílago del cóndilo medial de la articulación metacarpofalángica.
- Cortar con cuidado el ligamento cuando se abra la articulación.
- Tira la parte inferior de los pies en una bolsa de autoclave.
- Retirar todos los demás tejidos para exponer todo el cartílago de la articulación (Figura 2).
NOTA: Tenga cuidado de no tocar nada con los pies. - Coloque el bisturí y el punzón de biopsia en alcohol y luego en el medio de lavado.
- Haz algunos círculos con este puñetazo (4-5 por cara) con algo de fuerza a lo largo de las caras internas de los huesos.
- Coloque el bio-punch en alcohol cuando termine para limpiarlo.
- Toma un bisturí y corta (traza una línea) entre cada círculo y a lo largo de la línea central del hueso.
- Para extraer el explante de cartílago, corte verticalmente en uno de los bordes de la biopsia circular, luego corte horizontalmente en el hueso subcondral con mucho cuidado.
- Para eliminar el explante de cartílago, corte horizontalmente debajo de la línea de punzón a lo largo del hueso subcondral y el cartílago calcificado, los explantes saldrán.
NOTA: Los explantes deben tener un grosor uniforme, si es posible. - Coloque el explante en la placa de pocillo llena con 1,5 mL de medio de lavado.
NOTA: Realizar siempre el control experimental y el tratamiento de los explantes procedentes de la misma ubicación en la unión. - Comprobar que el explante está bien orientado correctamente. La superficie del explante debe estar hacia arriba y la parte ósea subcondral del explante debe mirar hacia el fondo de la placa del pocillo.
- Mantenga la placa del pocillo cerrada entre cada biopsia.
- Retire el medio de lavado.
- Lavar de nuevo con medio de lavado. Dejar en medio de lavado durante 2-3 h. Residuos óseos, la sangre tendrá tiempo de fluir en el medio.
- Transfiera los explantes a una nueva placa de pocillo que contenga el medio de cultivo completo. Tenga cuidado: no toque nada con la pipeta.
- Compruebe que los explantes siguen en la posición correcta (hueso orientado hacia la parte inferior de la placa del pocillo).
- Limpie todo y deseche los desechos clínicos en un lugar adecuado.
- Una vez que los explantes se colocan en cultivo en una incubadora a 37 °C con 5% de CO2, cambie el medio de cultivo del explante cada dos días con medio fresco y tibio para satisfacer las diversas necesidades de las células/tejidos. Compruebe que los explantes siguen en la posición correcta (hueso orientado hacia la parte inferior de la placa del pocillo).
- Fijación de la muestra (opcional)
NOTA: Realice este paso solo después del final del cultivo celular, es decir, después de 3 semanas de cultivo. Los explantes han alcanzado entonces la etapa de maduración.- Lave los explantes con DMEM-F12 con una pipeta debajo de la campana de cultivo de tejidos.
- Lave los explantes dos veces con PBS con una pipeta debajo de la campana de cultivo de tejidos.
- Fijarlos durante la noche a 4 °C sumergiéndolos en un 10% de NBFS (Neutral Buffer Formalin Saline).
- Coloque los explantes fijos en PBS en un tubo de microcentrífuga
- Almacenar los explantes a 4 °C. Los explantes fijos pueden permanecer en estas condiciones hasta 6 meses.
2. Preparación de la muestra para la sesión de imágenes
- Utilice puntas cónicas de plástico de un tamaño adecuado (generalmente punta de 1 mL) con respecto a la muestra y al campo de visión de la cámara.
- Selle la punta del cono (calentándola con una llama) para tener un recipiente de muestra a prueba de agua.
- Llene la punta con PBS. Sostenga la muestra con pinzas e insértela en el tubo. Retire las burbujas de aire agitando lentamente.
- Monte el tubo en la platina de tomografía y alinéelo tomando radiografías simples.
3. Sesión de imágenes de contraste de fase de rayos X
- Coloque el detector a 2,5 m de la muestra
- Establezca la energía del fotón de rayos X en 17 keV utilizando un sistema de doble cristal de silicio dentro de una geometría de Bragg-Bragg.
- El detector de imágenes de montaje consistió en una cámara CMOScientífica 22 en una óptica con un tamaño de vóxel isotrópico resultante de 3,5 μm en la imagen 3D.
- Utilice una pantalla centelleadora de oxisulfuro de gadolinio de 60 μm de grosor para convertir los rayos X en luz visible
- Recopilación de datos: Adquiera 2000 proyecciones durante un escaneo de 360° de la muestra con un tiempo de exposición de 2 s para cada proyección.
- Utilice el algoritmo de recuperación de fase para extraer la señal de fase como se describe en la ref.23. El algoritmo utiliza un conocimiento a priori de la compleja distribución del índice de refracción dentro de la muestra. La hipótesis principal, no verificada aquí, es que hay un material a reconstruir. En este caso particular, la relación entre la refracción y el índice de absorción se estableció en 1.200, lo que se observó experimentalmente como el mejor compromiso para la visualización de hueso y cartílago.
- Utilice el algoritmo estándar de reconstrucción de TC de retroproyección filtrada mediante una implementación de código abierto basada en la unidad de procesamiento de gráficos (GPU) del códigoPyHST2 24.
Resultados
Se utilizó una configuración sencilla de imágenes basada en la propagación25 como se muestra en la Figura 3. En las imágenes basadas en la propagación de sincrotrón, un haz coherente de rayos X ilumina el objeto, dando lugar a cambios de fase que varían espacialmente19. A medida que el haz de rayos X se propaga después de la muestra, el frente de onda distorsionado genera un patrón de características. Mediante el análisis de estos patrones característicos con algoritmos dedicados23, se recuperan numéricamente los cambios de fase causados por la muestra.
En la Figura 4 y la Figura 5 se muestran cortes representativos de imágenes de contraste de fase utilizando la metodología descrita.
Después de las 3 semanas de cultivo, los explantes se fijaron como se describió anteriormente. Una vez fijados, los explantes pueden mantenerse a 4 °C hasta 6 meses. Este experimento se ha realizado aproximadamente 30 días después de sus fijaciones. La figura 4 es una sección de plano axial de 3,5 μm de espesor dentro de la parte de cartílago de la muestra. Allí, se ven claramente los condrocitos (estructuras redondas negras delgadas), algunas células condrocitas específicas que se transforman en osteocitos (estructuras redondas blancas más pequeñas), así como variaciones en la densidad de la matriz del cartílago extracelular. Además, se pueden distinguir estructuras tubulares más grandes y dispersas que son los canales vasculares que sostienen la formación ósea. Algunos artefactos de anillo se pueden ver especialmente en el centro de la imagen. Los artefactos de anillo son causados por la respuesta dependiente del píxel del detector que puede resolverse mediante el uso de técnicas avanzadas de procesamiento de imágenes26 o con un tiempo de adquisición más largo que aumenta la relación señal/ruido. Para el presente estudio, este artefacto no afectó el análisis de la matriz extracelular.
La Figura 5 muestra secciones del plano sagital con diferentes ventanas de nivel de gris para resaltar la capacidad de las imágenes de contraste de fase para representar todos los diferentes tejidos. En la Figura 5A, se eligieron valores de gris para la visualización ósea, mientras que en los paneles de la Figura 5B,C, se establecieron valores de gris para la representación del cartílago. El panel C es un recuadro de zoom del panel B centrado en una herida hecha durante la biopsia. En estas imágenes se puede observar la estructura trabecular del hueso subcondral (panel A). En la parte del cartílago (Figura 5B), las flechas amarillas indican los canales vasculares. Como era de esperar, el tamaño de los condrocitos disminuyó desde la placa ósea hasta la zona superficial del cartílago. La parte centrada del tapón cartilaginoso presentaba una necrosis (reducción de la densidad de la matriz). También se observó cierta variación en la densidad dentro de la matriz extracelular del cartílago. Es interesante notar que 21 días después de la herida, se observaron células trabajando activamente para la reparación de esta fractura (Figura 5C). Además, se reveló una hiperseñal de la matriz extracelular alrededor de la fractura, correspondiente a una alta densidad.
La Figura 6 muestra los planos axial y sagital de dos muestras en condiciones (Condición 1: Control ITS, sin ningún factor de crecimiento agregado al medio de cultivo y condición 2: Tratados con ITS FT, los factores de crecimiento estaban presentes en el medio de cultivo, ver protocolo para más detalles). Las imágenes se escalaron con la misma ventana de nivel de gris para resaltar los cambios en las matrices del cartílago. La muestra de control se encuentra en la columna de la izquierda y la muestra tratada con factores de crecimiento se muestra a la derecha. En estas imágenes se ve claramente que el factor de crecimiento indujo cambios en la matriz extracelular del cartílago que la del control. Los canales de la muestra de control estaban vacíos, mientras que se puede ver material denso dentro de los canales de las muestras tratadas. Cerca de las estructuras óseas, algunas células especificadas solo eran visibles en el cartílago tratado con factor de crecimiento.
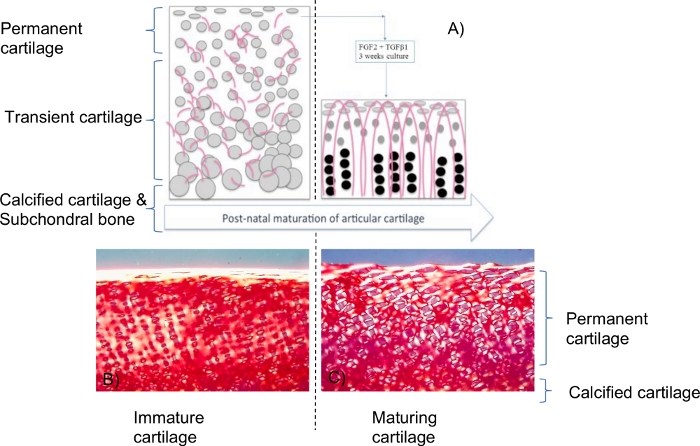
Figura 1: Esquema de los efectos de los factores de crecimiento en explantes de cartílago inmaduro.
FGF-2 y TGF-β1 inducen cambios similares a la maduración que conducen a un perfil biofísico idéntico al cartílago maduro, incluido el contenido de agua, el contenido de colágeno y proteoglicanos y las propiedades biomecánicas. Además, hubo una reabsorción significativa desde la base del explante, lo que llevó a una reducción en la altura2. Las esferas grises son los condrocitos y las líneas curvas rosáceas son las fibrillas de colágeno. Este croquis es un resumen de la referencia2. En un estado inmaduro, los condrocitos y las fibrillas de colágeno se distribuyeron aleatoriamente dentro del tejido. En una etapa madura, los condrocitos se distribuyeron a lo largo de las fibrillas de colágeno similares a la estructura arcádica con diferente tamaño y morfología (como bien se describe en la literatura). La microscopía de luz polarizada de secciones teñidas con rojo picro-sirius (B,C) mostró cambios significativos en la organización del colágeno, incluidas fibrillas de colágeno más densas y alineadas perpendicularmente a la superficie, pero estos cambios se limitaron a las regiones pericelulares. La maduración inducida por FGF-2 y TGF-β1 (C) parece ser un estado intermedio de cambio en comparación con la fase final en la que la orientación de las fibrillas de colágeno es perpendicular a la superficie en las capas medias/profundas del cartílago. Para más detalles e información sobre este modelo biológico, lea los artículos 2,3,14,15,16. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Diagrama de flujo del procedimiento experimental desde el cultivo de explantes hasta los análisis.
Biopsias de cartílago articular bovino (CA) de 6 mm de diámetro de la articulación metacarpofalángica izquierda. Aquí se muestra una junta abierta en condiciones estériles de CA inmaduro (novillo de 7 días de edad). En el inserto, algunas biopsias mostraron algunos cartílagos hacia arriba, otras biopsias cartílagos hacia abajo. Las biopsias de explantes inmaduros presentan una parte blanca brillante correspondiente al cartílago y otra parte rosácea correspondiente al cartílago calcificado y al hueso subcrondral). En el medio, los explantes se colocaron en cultivo durante 3 semanas con los tratamientos adecuados. Luego, se someten a diversos análisis. Algunos ejemplos se muestran a la derecha de la figura. Haga clic aquí para ver una versión más grande de esta figura.
| Reactivos | Cantidades |
| DMEM F12 | 440 mL |
| Ácido ascórbico | 50 mg |
| Gentamicina | 500 μL |
| HEPES | 5 mL |
| SU | 5 mL |
Tabla 1: Reactivos del medio de selenio.
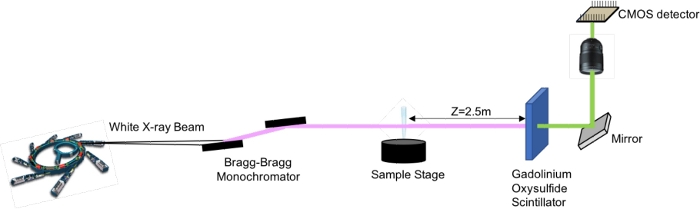
Figura 3: Configuración de imágenes basada en la propagación del contraste de fase de rayos X. Haga clic aquí para ver una versión más grande de esta figura.
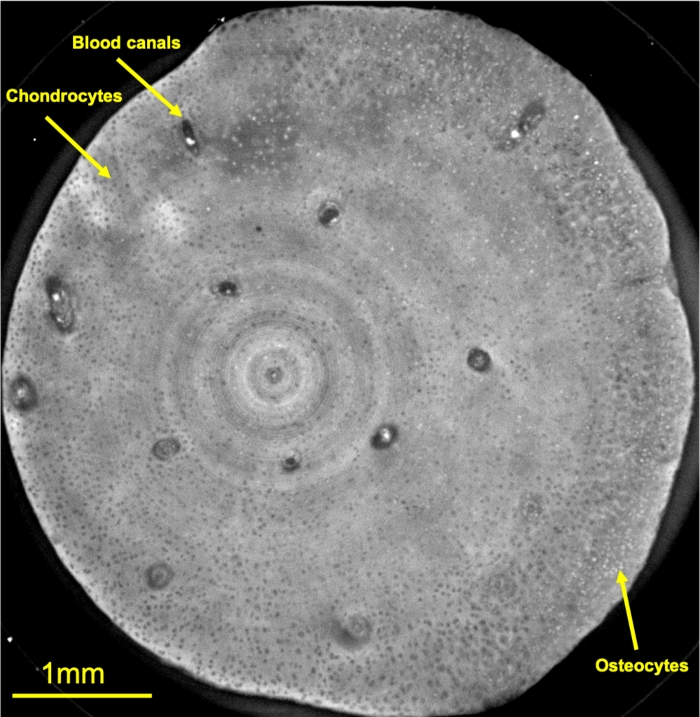
Figura 4: Imagen de contraste de fase de corte axial fino del explante de cartílago tratado.
Las estructuras y los tipos de células notables se indican con flechas amarillas. Haga clic aquí para ver una versión más grande de esta figura.
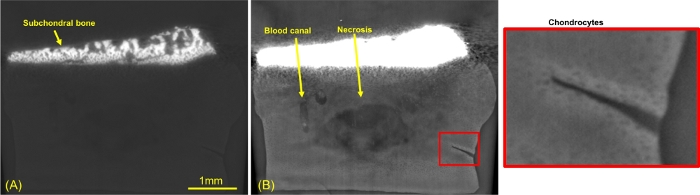
Figura 5: Imagen sagital de contraste de fase en corte fino de cartílago en maduración.
(A) Ventana ósea (B) ventana de cartílago (C) insertada en la matriz del cartílago centrada en una fractura. Haga clic aquí para ver una versión más grande de esta figura.
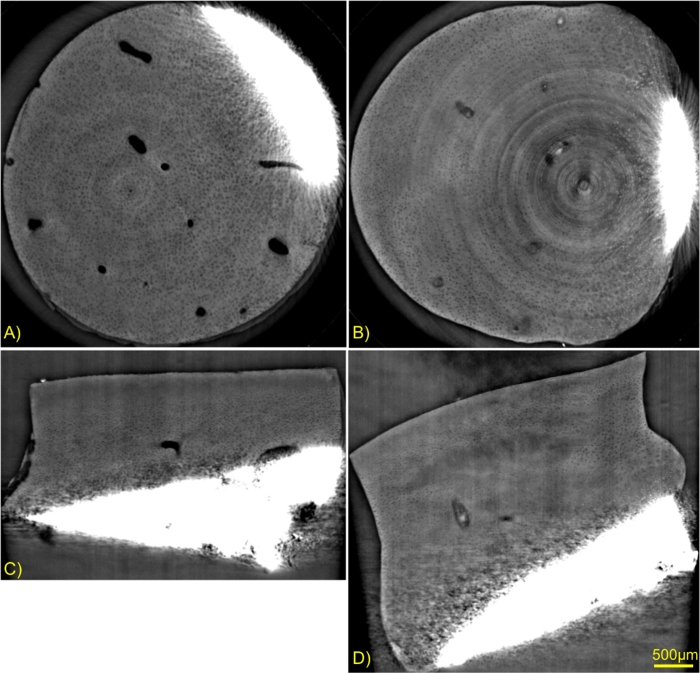
Figura 6: Comparación de imágenes de contraste de fase de dos muestras.
Explante testigo (A y C) y explante cultivado con tratamiento con factor de crecimiento (B y D). Cortes axiales (A y B) y cortes sagitales (C y D). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Presentamos un estudio completo desde la preparación de la muestra hasta la visualización de la imagen, incluyendo los protocolos de adquisición de datos, para el estudio del cartílago articular de maduración rápida in vitro . Los resultados de una sesión de imágenes de sincrotrón mostraron la bondad del modelo.
En el modelo que aquí se presenta, hay que mencionar algunas observaciones y límites. Esta "maduración acelerada" ocurre dentro de los 21 días posteriores al cultivo. Durante períodos de cultivo más largos, los tapones de explante comienzan a degradarse con el cambio en el metabolismo celular y el contenido de los componentes de la ECM del cartílago (es decir, colágenos y proteoglicanos) como se detalla en la ref.27. Aun así, en nuestro modelo, dentro del límite de 21 días, el tejido se mantiene estable 2,3. Se puede evaluar la compleja dinámica de remodelación del modelo. Si bien el cartílago maduro imita a un cartílago adulto con respecto a las propiedades bioquímicas y biomecánicas, el modelo presentado no muestra la reorganización completa de la orientación del colágeno similar a la observada en el cartílago maduro. Creemos que esto se debe a la sobreexpresión de la isoforma de lisil oxidasa-L1 (LOXL1), que induce la reticulación dentro del tejido y, por lo tanto, inhibe cualquier reorganización adicional del colágeno10. La mecánica del crecimiento del cartílago ha sido modelada por un modelo de mezcla continua28. El entorno estático con falta de estímulos mecánicos en el que se cultivaron nuestras muestras puede ser otra posible explicación. Esto representa un parámetro importante que debe investigarse para la CA expuesta a un entorno con deficiencia de selenio.
La preparación de la muestra debe llevarse a cabo en condiciones estériles, siendo cada una de ellas importante para el acondicionamiento de la muestra. Sin embargo, la fijación de la muestra no es obligatoria para la sesión de imagen. Sin fijación, las muestras deben ser fotografiadas directamente después de las tres semanas de cultivo. Este modelo es adecuado para ser utilizado en sesiones de cultivo de tres semanas. No se puede aceptar entonces ningún retraso porque al final del cultivo pueden aparecer otros inconvenientes como una ligera necrosis en el núcleo central de los explantes. Al no estar fijada la muestra, debe manipularse con cuidado para limitar la degradación biológica. Se puede utilizar para otros experimentos como PCR, ICP-MS e histología, por ejemplo. Sin embargo, en nuestro caso, las muestras se fijaron químicamente con el fin de probar diferentes modalidades de imagen (no presentadas aquí) en los mismos explantes. Los tiempos de haz de sincrotrón presentan accesos restringidos. Las muestras deben estar listas para ser analizadas para mayor comodidad. La principal dificultad encontrada en la preparación de la muestra es el cultivo del explante, ya que la junta debe abrirse bajo una campana estéril para evitar cualquier contaminación bacteriana. Durante la biopsia, el explante también debe enjuagarse varias veces antes de colocarlo en cultivo para eliminar todas las células sanguíneas que puedan inducir contaminación. El protocolo de maduración rápida empleado aquí permitió generar muestras válidas en cuestión de días y que presentaban características biológicamente relevantes. La variabilidad de los diámetros de la muestra se explica por el mejor compromiso con el tamaño de la junta y por tener un tamaño de muestra que pueda ser estáticamente relevante. Por debajo de 4 mm no tenemos suficiente materia para sostener un cultivo de explante y por encima de 6 mm el punzón es mayor que el tamaño de la junta. Esto no afecta a la sesión de imagen, ya que el campo de visión de la imagen a esta resolución puede ser de hasta 14 x 14mm2 en el plano de reconstrucción. La altura de la muestra tampoco es una limitación, ya que podemos apilar varias adquisiciones. En el caso de la ICP radiográfica, la calidad de las reconstrucciones puede verse afectada por parámetros importantes. Las imágenes de contraste de fase de rayos X son muy sensibles a las burbujas de aire que pueden formarse en el entorno líquido circundante donde descansa la muestra. Para una buena reconstrucción, es necesario un número mínimo de cortes con cartílago y hueso. Por esta razón, colocamos la muestra con la placa ósea paralela al plano de propagación del haz.
El objetivo principal de este experimento fue estudiar si la PCI de rayos X es un candidato adecuado para el seguimiento del proceso de maduración del cartílago. Las técnicas histológicas probablemente tendrían una mejor especificidad, pero son destructivas y se limitan estrictamente a la investigación en 2D, mientras que la técnica empleada aquí es rápida y no invasiva. El procedimiento de imagen presentado aquí es bastante simple con el procesamiento numérico de los datos. El principal inconveniente de la técnica es la gran coherencia transversal requerida y la colimación del haz, disponible únicamente en sincrotrones o fuentes de rayos X sofisticadas. Sin embargo, el acceso a las líneas de luz de imágenes de sincrotrón es factible en todo el mundo con la aceptación de la propuesta pública. La elección de la energía es fundamental. Dependiendo de la energía elegida, el hueso puede inducir artefactos similares a los metales. En este estudio, elegimos una energía de 17 keV a la que el hueso puede causar artefactos fuertes, mientras que tenemos un muy buen contraste en la matriz del cartílago. El aumento de la energía resolvería los artefactos óseos mientras que disminuiría la calidad de la imagen de la matriz del cartílago. Como el cartílago era la opción principal, tuvimos que hacer este compromiso. Gracias a este protocolo de imagen empleado, pudimos revelar en 3D algunos cambios sutiles en la matriz extracelular, así como en la morfología celular que no se pueden visualizar con otras modalidades. Los resultados demuestran que las imágenes de contraste de fase de rayos X (PCI) pueden representar, en una sola adquisición, tejidos óseos y cartilaginosos en un tiempo de adquisición relativamente rápido (aproximadamente 1 h). Además, ambos tipos de células (condrocitos y osteocitos) son visibles simultáneamente, así como variaciones dentro de la matriz extracelular del cartílago. Este protocolo y los resultados típicos obtenidos abren la posibilidad de tener mejores estudios exhaustivos de la mecánica y la biología del cartílago. Se puede suponer que este método se puede aplicar dinámicamente para examinar el comportamiento de los condrocitos dentro de las articulaciones. Las perspectivas de la investigación macro y microscópica en 3D de las articulaciones in situ e in vivo son muy emocionantes y parecen factibles gracias a los avances en las fuentes de rayos X y las imágenes de contraste de fase de rayos X29,30. En última instancia, esto permitiría explorar la función de los condrocitos en condiciones de carga que siguen siendo un misterio. Se llevarán a cabo más estudios para explotar estas nuevas capacidades de PCI en una gran base de datos de muestras siguiendo el mismo protocolo de preparación.
Divulgaciones
Ninguno.
Agradecimientos
Los autores agradecen al ESRF por proporcionar tiempo de transmisión interno. Los autores desean agradecer a Eric Ziegler por las discusiones científicas. El experimento PCI descrito se llevó a cabo en la línea de luz BM05 de la Instalación Europea de Radiación Sincrotrón (ESRF), Grenoble, Francia. CB agradece a Explora'doc Auvergne Rhône Alpes y a las becas de la Universidad de Swansea y la Université Grenoble Alpes por financiar parte de este estudio.
Materiales
| Name | Company | Catalog Number | Comments |
| Material : Biological products | |||
| DMEM/F-12 (1:1) (1X) + GlutaMAX Dulbecco's Modified Eagle Medium F-12 Nutriment Mixture (Ham) 500mL | Gibco by life technologies | 31331-028 | |
| Gentamicin Reagent Solution, 50 mg/mL | Gibco by life technologies | 15750-060 | |
| HEPES, special preparation, 1M, pH 7.5 filtered | Sigma | H-3375 | |
| ITS, Insulin-Transferrin-Selenium | Gibco by life technologies | 51500-057 | |
| L-Ascorbic Acid-2-Phosphate, sesquimagnesium salf hydrate, 95% | Sigma | A8960-5G | |
| Neutral Buffer Formalin (NBF) | Sigma Aldrich | HT501128 | |
| phosphate buffered saline (PBS) pH 7.4 | Gibco by life technologies | 10010023 | |
| Culture equipments: | |||
| Absordent Protector,Benchkote | WhatmanTM | Cat No. 2300731, | Polysterene Backed, 460cm*50m |
| Accurpette VWR | |||
| Autoclavable Disposal Bag | For disposal of contamined plastic laboratory ware neck should be left open to allow penetration of steam, Hazardous Waste, STERILIN (white bag) | ||
| biopsy punches | MILTEX by KAI | ref 33-36 | 4 & 6 mm diameter |
| Clinical waste for alternative treatment Medium Duty | (UN-approved weight 5kg, Un-closure methods, UN- SH4/Y5/S/II/GB/4/06 (orange bag) | ||
| Eppendorf tubes | 0.5mL and 1.5 mL | ||
| Falcon tubes | 15mL and 50 mL | ||
| free of detectable RNase, DNase, DNA&Pyrogens 1000ul Bevelled Graduated, filter tip | Starlab, TipOne (sterile) | S1122-1830 | |
| free of detectable RNase, DNase, DNA&Pyrogens 20µl Bevelled Graduated, filter tip | Starlab, TipOne (sterile) | S1120-1810 | |
| free of detectable RNase, DNase, DNA&Pyrogens 200ul Bevelled Graduated, filter tip | Starlab, TipOne (sterile) | S1110-1810 | |
| Incubator | Incubator at 37°C, humidified atmosphere with 5% CO2 | ||
| Optical microscope | |||
| Pipette-boy | 25mL-, 10mL-, and 5mL sterile plastic-pipettes | ||
| Pipettes (25-10-5 ml) | CellStar, Greiner Bio-one | ||
| Plastic tweezers | Oxford Instrument | AGT 5230 | |
| Scalpel | |||
| Tips | P1000, P200 and P10 with P1000, P200 and P10 tips (sterile) | ||
| Tissue culture hood | |||
| Vacuum pump | |||
| Water bath 37°C | |||
| well plates | 12 & 24 well plates | ||
| Protection equipment: | |||
| face shield | |||
| gloves | |||
| lab coat | |||
| safety goggles | |||
| Data acquisition equipment: | |||
| Fiji software | open source Software | ||
| PyHST reconstruction toolkit | open source Software |
Referencias
- Little, C. B., Ghosh, P. Variation in proteoglycan metabolism by articular chondrocytes in different joint regions is determined by post-natal mechanical loading. Osteoarthritis and Cartilage. 5 (1), 49-62 (1997).
- Khan, I. M., et al. Fibroblast growth factor 2 and transforming growth factor β1 induce precocious maturation of articular cartilage. Arthritis and Rheumatology. 63 (11), 3417-3427 (2011).
- Khan, I. M., et al. In vitro growth factor-induced bio engineering of mature articular cartilage. Biomaterials. 34 (5), 1478-1487 (2013).
- McNulty, A. L., Vail, T. P., Kraus, V. B. Chondrocyte transport and concentration of ascorbic acid is mediated by SVCT2. Biochimica et Biophysica Acta - Biomembrane. 1712 (2), 212-221 (2005).
- Clark, A. G., Rohrbaugh, A. L., Otterness, I., Kraus, V. B. The effects of ascorbic acid on cartilage metabolism in guinea pig articular cartilage explants. Matrix Biology. 21 (2), 175-184 (2002).
- Liu, X., et al. Role of insulin-transferrin-selenium in auricular chondrocyte proliferation and engineered cartilage formation in Vitro. International Journal of Molecular Sciences. 15 (1), 1525-1537 (2014).
- French, M. M., Athanasiou, K. A., Ashammakhi, N., Ferretti, P. Differentiation Factors and Articular Cartilage Regeneration. Topics in Tissue Engineering. , (2003).
- Zhang, Y., et al. Platelet-rich plasma induces post-natal maturation of immature articular cartilage and correlates with LOXL1 activation. Science Reports. 7 (1), 3699 (2017).
- Schepman, K., Engelbert, R. H. H., Visser, M. M., Yu, C., De Vos, R. Kashin Beck Disease: More than just osteoarthrosis - A cross-sectional study regarding the influence of body function-structures and activities on level of participation. International Orthopedics. 35 (5), 767-776 (2011).
- Sudre, P., Mathieu, F. Kashin-Beck disease: From etiology to prevention or from prevention to etiology. International Orthopedics. 25 (3), 175-179 (2001).
- Allander, E. Kashin-Beck Disease. An analysis of Research and public health activities based on a bibliography 1849-1992. Scandinavian Journal of Rheumatology. 23 (99), 1-36 (1994).
- Bissardon, C., et al. Sub-ppm level high energy resolution fluorescence detected X-ray absorption spectroscopy of selenium in articular cartilage. Analyst. 144 (11), (2019).
- . Role of Selenium in Articular Cartilage Metabolism, Growth and Maturation Available from: https://tel.archives-ouvertes.fr/tel-01942169 (2020)
- Bissardon, C., Charlet, L., Bohic, S., Khan, I. Role of the selenium in articular cartilage metabolism, growth, and maturation. Global Advances in Selenium Research from Theory to Application - Proceedings of the 4th International Conference on Selenium in the Environment and Human Health, 2015. , (2016).
- Winkel, L. H. E., et al. Environmental selenium research: From microscopic processes to global understanding. Environment Science Technology. 46 (2), 571-579 (2012).
- Bravin, A., Coan, P., Suortti, P. X-ray phase-contrast imaging: From pre-clinical applications towards clinics. Physics in Medicine and Biology. 87 (1034), 20130606 (2014).
- Horng, A., et al. Cartilage and soft tissue imaging using X-rays: Propagation-based phase-contrast computed tomography of the Human Knee in comparison with clinical imaging techniques and histology. Investigative Radiology. 49 (9), 627-634 (2014).
- Labriet, H., et al. High-Resolution X-Ray Phase Contrast Imaging of Maturating Cartilage. Microscopy and Microanalysis. 24, 382-383 (2018).
- Rougé-Labriet, H., et al. X-ray Phase Contrast osteo-articular imaging: a pilot study on cadaveric human hands. Science Reports. 10 (1911), 41598 (2020).
- Mittone, A., et al. Characterization of a sCMOS-based high-resolution imaging system. Journal of Synchrotron Radiation. 24 (6), 1226-1236 (2017).
- Paganin, D., Mayo, S. C., Gureyev, T. E., Miller, P. R., Wilkins, S. W. Simultaneous phase and amplitude extraction from a single defocused image of a homogeneous object. Journal of Microscopy. 206 (1), 33-40 (2002).
- Mirone, A., Brun, E., Gouillart, E., Tafforeau, P., Kieffer, J. The PyHST2 hybrid distributed code for high speed tomographic reconstruction with iterative reconstruction and a priori knowledge capabilities. Nuclear Instruments and Methods in Physics Research Section B: Beam Interactions with Materials and Atoms. 324, 41-48 (2014).
- Bravin, A., Coan, P., Suortti, P. X-ray phase-contrast imaging: from pre-clinical applications towards clinics. Physics in Medicine and Biology. 58 (1), 1-35 (2013).
- Vo, N. T., Atwood, R. C., Drakopoulos, M. Superior techniques for eliminating ring artifacts in X-ray micro-tomography. Optic Express. 26 (22), 28396 (2018).
- Moo, E. K., Osman, N. A. A., Pingguan-Murphy, B. The metabolic dynamics of cartilage explants over a long-term culture period. Clinics. 66 (8), 1431-1436 (2011).
- Stender, M. E., et al. Integrating qPLM and biomechanical test data with an anisotropic fiber distribution model and predictions of TGF-β1 and IGF-1 regulation of articular cartilage fiber modulus. Biomechanics and Modeling in Mechanobiology. 12 (6), 1073-1088 (2013).
- Labriet, H., Bosmans, H., Chen, G. H., Gilat Schmidt, T., et al. 3D histopathology speckle phase contrast imaging: from synchrotron to conventional sources. Medical Imaging 2019: Physics of Medical Imaging. , (2019).
- Zdora, M. C., et al. X-ray Phase-Contrast Imaging and Metrology through Unified Modulated Pattern Analysis. Physics Review Letters. 118 (20), 203903 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados