Method Article
Минимально инвазивная инъекционная модель Cisterna Magna для изучения лептоменингеальных метастазов у мышей
В этой статье
Резюме
Протокол описывает метод введения опухолевых клеток через чрескожную пункцию в большую цистерну, который надежно индуцирует лептоменингеальные метастазы у мышей, уменьшая травматическую и экстракраниальную опухолевую нагрузку.
Аннотация
Лептоменингеальное метастазирование (ЛМ), распространение раковых клеток в лептоменинги, наполненные спинномозговой жидкостью (СМЖ), является редким, но разрушительным осложнением прогрессирующих солидных опухолей. Пациенты с ЛМ часто имеют плохой прогноз, при этом выживаемость измеряется от нескольких недель до нескольких месяцев. Разработка моделей in vivo , которые точно воспроизводят сложность ЛМ, имеет важное значение для понимания ее клеточных и патологических механизмов и оценки потенциальных методов лечения. Мышиные модели LM обычно создаются путем внутрисердечной, сонной артерии или большой цистерны опухолевых клеток. Тем не менее, внутрисердечные или сонные инъекции часто приводят к значительной экстракраниальной нагрузке и опухолям головного мозга, осложняя биолюминесцентную визуализацию и приводя к смертности, не связанной с ЛМ. Между тем, обычная инъекция cisterna magna требует инвазивных процедур, таких как разрез кожи и рассечение мышц, что делает ее одновременно травматичной и ресурсоемкой. В данной статье мы описываем минимально инвазивную процедуру введения опухолевых клеток в лептоменингеальное пространство через большую цистерну без необходимости разреза кожи. Такой подход уменьшает образование экстракраниальных опухолей, сводит к минимуму хирургическую травму и сокращает время и необходимый послеоперационный уход по сравнению с другими хирургическими методами. Важно отметить, что он последовательно индуцирует ЛМ с минимальной инфильтрацией паренхимы мозга, что подтверждается двухфотонной микроскопией и гистологическим анализом. Этот оптимизированный подход предлагает эффективную и надежную модель для изучения ЛМ в доклинических исследованиях.
Введение
Метастатическое заболевание остается самой большой проблемой для пациентов с прогрессирующим раком. Лептоменингеальное метастазирование (ЛМ) относится к распространению раковых клеток на пятую мозговую оболочку, паутинную оболочку и субарахноидальное пространство. ЛМ, вызванные солидными опухолями, становятся все более распространенными при раке легких (9–25%), раке молочной железы (5–20%) и меланоме (6–18%)1,2, в основном благодаря более длительной выживаемости и усовершенствованным методам диагностики. Раковые клетки могут проникать в лептоменингеальное пространство несколькими путями, в том числе: 1) прямой инвазией через периферические структуры, такие как твердая мозговая оболочка, кости и нервы; 2) гематогенное распространение по венозной системе; и 3) попадание через артериальный кровоток, где раковые клетки проскальзывают через фенестрированные сосуды в сосудистое сплетение и впоследствии в наполненные спинномозговой жидкостью желудочки 3,4,5. Опухолевые клетки, попадающие в лептоменингеальное пространство, сталкиваются с многочисленными проблемами, включая лишение факторов роста, ограниченные метаболические промежуточные продукты и гипоксические условия6. Однако из-за отсутствия соответствующих инструментов и методов плохо изучено, как опухолевые клетки ориентируются по этим путям и преодолевают негостеприимные условия для колонизации лептоменингеального пространства. Несмотря на достижения в области мультимодальной терапии, включая лучевую терапию, системное лечение и интратекальную инъекционную терапию, прогноз для пациентов с ЛМ остается плохим, при этом выживаемость обычно составляет от 2 до 4 месяцев 3,7,8,9. Таким образом, существует острая необходимость в более глубоком понимании биологии лептоменингеального метастазирования для улучшения существующих методов лечения и разработки новых, таргетных методов лечения. Достижение этой цели требует разработки моделей in vivo, которые повторяют сложные особенности LM.
В отличие от метастазов в таких органах, как печень, кости и мозг, ЛМ обычно развивается спустя годы после постановки диагноза первичной опухоли 10,11,12. Аналогичным образом, в моделях мышей со спонтанным метастазированием ЛМ встречается редко из-за его низкой частоты и того факта, что мыши обычно поддаются метастазам в других местах. Экспериментальные мышиные модели LM могут быть созданы с помощью различных методов, включая внутрисердечную, внутрисонную артерию или, в качестве альтернативы, прямую инъекцию в большую цистерну или желудочки головного мозга. В то время как внутрисердечная инъекция раковых клеток широко используется9, она часто приводит к значительному увеличению экстракраниальной опухолевой нагрузки, вызывая смертность, не связанную с LM. Альтернативные подходы, такие как введение опухолевых клеток через сонную артерию13,14, требуют обширных специализированных ресурсов и приводят к большим хирургическим разрезам, которые являются травматичными. Более того, этот метод также в первую очередь приводит к метастазированию в самих тканях мозга, а не в лептоменингах, и является трудоемким и неэффективным длясоздания LM-моделей. Инъекция в большую цистерну обеспечивает прямую доставку опухолевых клеток в лептоменингеальное пространство. В нескольких исследованиях этот подход использовался для изучения механизмов ЛМ и оценки новых методов лечения 6,16,17.
В этой рукописи мы представляем удобный протокол транс-цистерны magna инъекции, включающий прямую чрескожную пункцию для быстрого и стабильного получения большего количества мышей с ЛМ. Этот метод обходит мозговой барьер и кровь и, следовательно, позволяет эффективно ксенотрансплантировать опухолевые клетки в лептоменинговом пространстве. Это также значительно сокращает хирургическую травму и время процедуры, надежно индуцируя LM у мышей. Нами подтверждена встречаемость ЛМ с минимальной инфильтрацией в паренхиму головного мозга, что подтверждено с помощью двухфотонной микроскопии и гистологического анализа. Таким образом, полученная модель точно воспроизводит сложное микроокружение LM, предоставляя ценный инструмент для изучения связанных с заболеванием клеточных и патологических механизмов и оценки потенциальных методов лечения.
протокол
Все процедуры на животных, описанные в данной рукописи, были проверены и одобрены Комитетом по благополучию и этике лабораторных животных ZJU (ZJU20230155). Мыши C57BL/6J и NSG были получены и размещены в условиях, свободных от специфических патогенов, в Центре лабораторных животных ZJU. В этом протоколе используется клеточная линия рака легких мышей, карцинома легких Льюиса (LLC1), и клеточная линия рака легких человека, A549, обе мечены GFP и люциферазой светлячков. Обе клеточные линии любезно предоставлены доктором Сян Х. Ф. Чжаном (Медицинский колледж Бейлора, США)18. В качестве примера мы используем ячейки LLC1. Процедура введения клеток A549 практически идентична, за исключением того, что мышам NSG было введено 6 x 104 A549 клеток.
1. Подготовка раковых клеток к инъекциям
- Культивирование 1,0 x 106 клеток LLC1 в DMEM с добавлением 10% фетальной бычьей сыворотки (FBS) и 0,1 мг/мл пенициллин-стрептомицина при 37 °C в инкубаторе с 5%CO2 . Когда клетки достигнут 70%-90% конфлюенции, трипсинизируйте их в течение 1 мин, используя 2 мл 0,25% раствора трипсина/ЭДТА. Центрифугируйте клетки при 300 x g в течение 3 минут, промойте их 2 раза ледяным PBS и повторно суспендируйте в 1 мл фосфатно-солевого буфера (PBS).
- Оценивают концентрацию жизнеспособных клеток с помощью раствора Трипана Синего и гемоцитометра19. Убедитесь, что жизнеспособность клеток превышает 90%, при этом большинство клеток являются одиночными. Отрегулируйте концентрацию клеток до 2 x 106 клеток/мл при ледяном PBS.
- Аликвотировать 50 мкл клеточной суспензии в отдельные микроцентрифужные пробирки во избежание многократного пипетирования.
- Держите клеточные суспензии на льду до тех пор, пока они не будут готовы к инъекции. Введите 10 мкл меченых GFP-люциферазой клеток LLC1 на мышь в этом протоколе, что соответствует 2 x 104 клеткам на мышь.
ПРИМЕЧАНИЕ: При необходимости отрегулируйте количество клеток в зависимости от кинетики метастатических линий вводимых клеток.
2. Подготовка мышей
ПРИМЕЧАНИЕ: В этом исследовании использовались самцы мышей C57BL/6J в возрасте 6-8 недель.
- Автоклав всех хирургических инструментов и перчаток упакован хирургическими простынями. Продезинфицируйте настольное и нехирургическое оборудование с помощью этанола на 75%, затем накройте рабочую зону водонепроницаемыми портьерами.
- Подготовьте чистую клетку для содержания животных и согревающую подушку для восстановления после процедуры.
- Обезболивайте мышь путем подкожного введения 2% трибромэтанола (200 мг/кг). Прежде чем продолжить, проверьте глубину анестезии с помощью щипкового теста. Нанесите стерильную офтальмологическую мазь, чтобы защитить глаза от повреждения роговицы после обезболивания мыши.
- Сбрейте шерсть с задней затылочной области с помощью машинок для стрижки с последующим нанесением кремов для депиляции для полного удаления шерсти в той же области.
- Расположите мышь в положении лежа так, чтобы ее горлышко было помещено на центрифужную пробирку объемом 15 мл. Зафиксируйте голову и поясницу лентой и пропальпируйте пространство между затылком и позвонком С1 указательным пальцем (рисунок 1).
- Продезинфицируйте заднюю затылочную область тремя циклами протирания стерильными ватными тампонами, смоченными на 75% этанолом, а затем хирургическим скрабом бетадином. Накройте нестерильные части тела животного стерильной простыней.
3. Инъекция цистерны магна
ПРИМЕЧАНИЕ: Асептические методы необходимы для следующих этапов, включая использование средств индивидуальной защиты и стерильных перчаток.
- Аккуратно пипетируйте клеточную суспензию и аспирируйте 10 мкл для инъекции с помощью шприца с инсулином 31G, 8 мм.
- Пальпируйте область между затылком и С1 мыши указательным пальцем, чтобы определить точное место прокола на нижнем срединном крае заднего затылочного черепа. При необходимости отметьте этот сайт.
- Введите иглу под углом 45°-50° в цистерну через выявленное место прокола, продвигаясь на глубину до 4 мм. Отчетливое ощущение прорыва указывает на то, что игла успешно вошла в цистерну магна.
- Если место прокола трудно обнаружить, сделайте небольшой разрез 3-5 мм на уровне уха, чтобы обнажить заднюю среднюю линию. Если требуется хирургический разрез, введите мелоксикам (5 мг/кг/сут) и бупренорфин (0,1 мг/кг) подкожно за 1 ч до операции.
- Медленно вводите клеточную суспензию, продвигая поршень шприца, удерживая шприц в неподвижном положении рукой, лежащей на столе.
- После прививки удерживайте шприц на месте еще 10 секунд, чтобы внутричерепное давление сбалансировалось. Затем извлеките иглу и прижмите место прокола стерильным ватным тампоном на 1-2 минуты.
4. Постинъекционный уход
- Пересадите животных в чистые клетки на грелке и внимательно следите за ними, пока они полностью не выздоровеют.
- В случае разреза закройте рану с помощью тканевого клея и зажимов. Принимайте дополнительные обезболивающие препараты в течение 2-3 дней после операции, чтобы контролировать боль и способствовать выздоровлению.
- Внимательно наблюдайте за мышами в течение 7 дней после процедуры и ежедневно проверяйте физическую активность животных и внешний вид вокруг места инъекции.
5. Оценка роста лептоменингеальной опухоли
- Биолюминесцентная визуализация
- Обезболите мышь и введите D-люциферин (150 мкг/г) в ретроорбитальную вену. Поместите мышей в камеру визуализации, расположив их в специальном носовом конусе на анестезиологическом коллекторе. Используйте световые перегородки между животными, чтобы свести к минимуму помехи сигнала.
- Немедленно визуализируйте животных с помощью системы IVIS с временем экспозиции от 0,5 с до 2 мин6. Подтвердите успешную инокуляцию опухолевых клеток в лептоменингеальном пространстве с помощью дисперсионного биолюминесцентного сигнала через голову и спинной мозг (рис. 2A).
- Контролируйте прогрессирование ЛМ с помощью биолюминесцентной визуализации каждые 4 дня. Корректируйте интервалы визуализации в зависимости от кинетики роста опухоли.
- Гистологический анализ
- Обезболивайте мышей, когда они были значительно менее активны или потеряли 20% массы тела, и разрезали кожу и ребра, чтобы обнажить их грудную полость. Осторожно введите канюлю с тупым концом в левый желудочек и продвигайте канюлю в восходящую аорту. Медленно прополните животное 20 мл PBS через канюлю.
- С помощью ножниц удалите голову и сделайте разрез по средней линии кожи головы, чтобы обнажить череп. Иссекаем окружающие мягкие ткани. Разрежьте вдоль орбитального гребня, затем вставьте ножницы в большое затылочное отверстие, и осторожно продвигайтесь вдоль внутренней поверхности черепа с надавливанием вверх, чтобы избежать повреждения тканей.
- Удалите кости черепа, а затем аккуратно извлеките мозг. Зафиксируйте мозг в 4% параформальдегиде при 4 °C в течение 24 ч, а затем уравновесьте его в 15% раствор сахарозы PBS на 24 ч, а затем 30% раствор сахарозы PBS еще на 24 ч при 4 °C.
- Поместите ткань в криомолд, наполненный составом для оптимальной температуры резки (OCT), а затем храните ее на сухом льду в течение 30 минут20 минут.
- Разрежьте встроенный в ОКТ мозг на участки толщиной 10 мкм с помощью криостата. Храните секции в морозильной камере при температуре -80 °C до дальнейшего применения.
- Выполнение окрашивания гематоксилином/эозином (H&E) на предметных стеклах головного мозга21. Наличие опухолевых клеток на краю мозга свидетельствует о том, что метастазирование происходит исключительно в лептоменингеальном пространстве (рисунок 3 и таблица 1).
- Двухфотонная микроскопия
- Обезболите мышей с помощью LM. Снимите скальпы, покрывающие спинную поверхность черепа, щипцами и ножницами. С помощью лезвия скальпеля удалите тонкую надкостницу с поверхности черепа.
- Утончите череп с помощью абразивного сверла до тех пор, пока через истонченный череп не будут видны сосуды пиала. Стабилизируйте зону наблюдения головки мыши с помощью треугольного головного передатчика, закрепленного тканевым клеем22,23.
- Ввести 0,025 мл 5% (w/v) TRITC-декстрана в подглазничную вену для мечения кровеносных сосудов22.
- Проведите двухфотонную микроскопию через окна визуализации и реконструируйте лептоменингеальное пространство (рис. 4). Определение кости методом флуоресценции второй гармоники при излучении 450 нм с возбуждением 900 нм24. Визуализируйте меченые GFP опухолевые клетки и меченые декстрана сосуды путем сбора флуоресцентных сигналов с длиной волны 507 нм и 572 нм с возбуждением 900 нм и 1000 нм соответственно.
- Стереофлуоресцентный микроскоп
- Извлеките мозг мыши и поместите его под стереомикроскоп. Визуализируйте ячейки, помеченные GFP, с помощью набора фильтров, специфичного для GFP (рисунок 5).
Результаты
На рисунке 1 показано положение мыши для инъекции и место прокола с бокового и переднего видов. На рисунке 2 представлены репрезентативные биолюминесцентные изображения in vivo животных, протестированных на генерацию LM с помощью различных подходов. Меченые GFP-люциферазой клетки LLC1 вводили животным различными путями с последующей биолюминесцентной визуализацией. Как показано на рисунке 2А, через 10 дней после внутрицистерновой инъекции магна биолюминесцентный сигнал присутствовал в головном мозге мыши и распространялся по спинному мозгу, что свидетельствует об успешном приживлении опухолевых клеток в лептоменингеальном пространстве. Напротив, инъекции опухолевых клеток в сонную артерию преимущественно генерировали метастазы в паренхиматозный мозг без существенного участия лептоменингов через 21 день после инъекции (рис. 2B). При внутрисердечном методе инъекции биолюминесцентная визуализация из положения лежа на спине показывает, что большинство метастазов растут во внечерепных органах (слева), а изображения из положения лежа подтвердили, что ни у одной из трех мышей не развилась ЛМ (справа; Рисунок 2В). Такое же распределение опухолевых клеток наблюдалось через 10 дней после введения в цистерну магна 6 x 104 (10 μл) GFP-люциферазы меченых A549 у мышей NSG (рисунок 2D), что позволяет предположить, что такой подход надежно генерирует LM у разных линий мышей с разными клеточными линиями.
На рисунке 3 представлены репрезентативные изображения гистологического и иммунофлуоресцентного окрашивания тканей головного мозга после 14 дней введения опухолевых клеток через большую цистерну. Окрашивание гематоксилин-эозином (H&E) показывает большинство опухолевых участков, расположенных в лептоменингеальном пространстве (рисунок 3A). На рисунке 3B показано, что большинство меченых GFP опухолевых клеток были сгруппированы в мозговых оболочках и желудочках, в то время как опухолевые клетки в области паренхимы в основном представляют собой одиночные клетки. На рисунке 4 представлены репрезентативные двухфотонные изображения лептоменингеального пространства мыши с ЛМ. Черепная кость (синяя) была обнаружена путем сбора флуоресценции второй гармоники с частотой излучения 450 нм и возбуждением 900 нм24. Сосудистая сеть (красного цвета) была помечена TRITC-декстрана (70 кДа). Меченые GFP опухолевые клетки (зеленые) были обнаружены между черепной костью (синий) и паренхимой мозга, в частности, в лептоменингеальной области. На рисунке 5 показано присутствие меченых GFP опухолевых клеток на поверхности мозга, визуализированных с помощью стереофлуоресцентного микроскопа. В таблице 1 показано сравнение трех методов.

Рисунок 1: Подготовка животного и место прокола для инъекции внутрь цистерны magna. (A) Мышь помещается в положение лежа, ее шея накидывается на центрифужную пробирку объемом 15 мл. Голова и поясница фиксируются скотчем. Игла вводится под углом 45°-50° в большую цистерну по срединному нижнему краю. (В) Игла вводится в срединный нижний край заднего затылочного черепа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
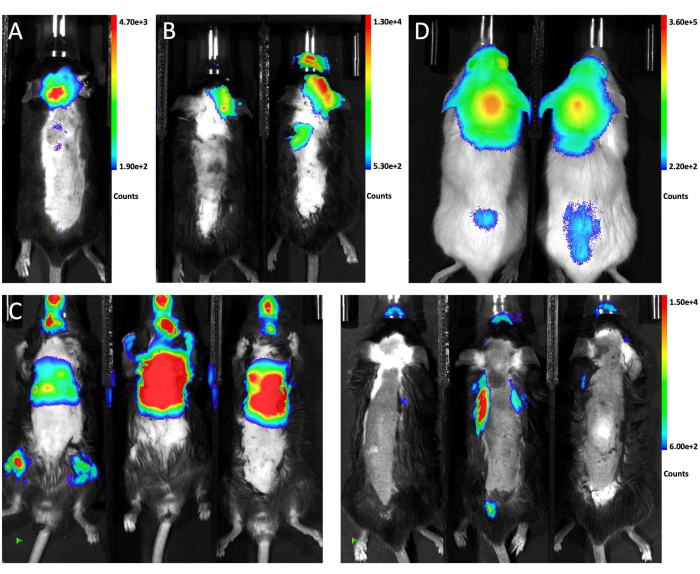
Рисунок 2: Репрезентативные биолюминесцентные изображения in vivo мышей, получающих различные методы инъекции. (А)Сигнал биолюминесценции in vivo всего животного после внутрицистенального введения клеток LLC1 внутрь цистерны. (B) Биолюминесцентное изображение in vivo мышей после инъекции клеток LLC1 во внутрисонную артерию. (C) Сигнал биолюминесценции in vivo у мышей после внутрисердечной инъекции клеток LLC1. С левой стороны показан вид лежа на спине, а с правой стороны - вид лежа. (D) Биолюминесцентное изображение мышей NSG после инъекции клеток A549 через cisterna magna.a Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
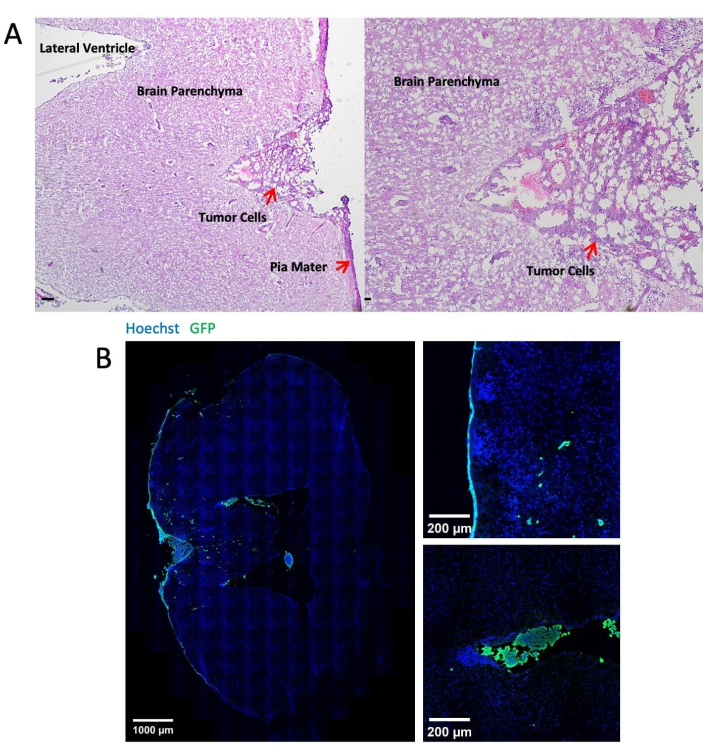
Рисунок 3: Репрезентативные изображения гистологического и иммунофлуоресцентного окрашивания. (А) Репрезентативное окрашивание H&E показывает, что клетки LLC1 откладываются в основном на поверхности мозговых оболочек и в желудочках. Масштабная линейка = 25 мкм. (B) Иммунофлуоресцентные окрашивающие изображения мозга LLC1, несущего опухоль. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
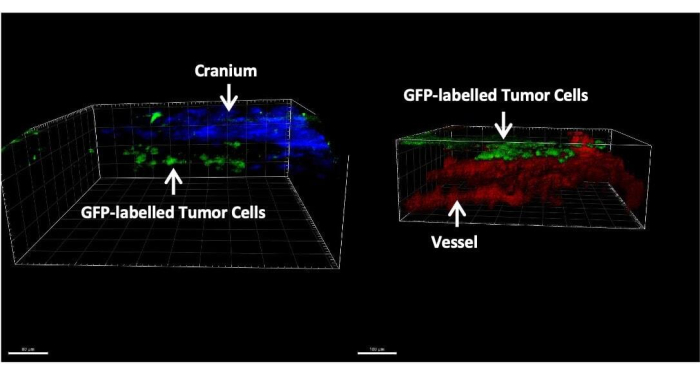
Рисунок 4: Репрезентативные двухфотонные изображения мыши с LM. Опухолевые клетки, помеченные GFP (зеленым цветом), находятся исключительно между черепом (синий) и паренхимой мозга (красный). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Репрезентативные изображения с помощью стереофлуоресцентного микроскопа. (А) Глобальное поле зрения мозга мыши под микроскопом. (B) На поверхности мозга были представлены меченые GFP опухолевые клетки, которые излучают зеленую флуоресценцию. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Продолжительность процедуры/мин | Частота возникновения ЛМ наблюдается через 14 дней после инъекции | Частота экстракраниальных опухолей | Частота крупных паренхиматозных опухолей головного мозга | |
| Инъекция в цистерну magna | ~5 | 100% (15/15) | 0 (0/15) | 0 (0/15) |
| Инъекция внутрисонной артерии | ~20 | 0 (0/15) | 100% (15/15) | 100% (15/15) |
| Внутрисердечная инъекция | ~5 | 0 (0/3) | 100% (3/3) | 0(0/3) |
Таблица 1: Сравнение трех различных инъекционных методов с точки зрения продолжительности операции, частоты лептоменингеальных метастазов, экстракраниальных опухолей и частоты больших паренхиматозных опухолей головного мозга.
Обсуждение
ЛМ является агрессивным и смертельным заболеванием. Как только опухолевые клетки метастазируют в пространство, заполненное спинномозговой жидкостью, они быстро распространяются по всей центральнойнервной системе. Эти клетки оседают и проникают в головной, спинной, черепно-мозговой и спинномозговой нервы, что в конечном итоге приводит к быстрому неврологическому ухудшению и в конечномитоге к смерти. Чтобы лучше понять лежащие в основе патофизиологические механизмы и оценить потенциальные терапевтические стратегии, крайне важно разработать эффективную модель in vivo , которая повторяет метастатический процесс и окружающее микроокружение при лептоменингеальном метастазировании.
Предыдущее исследование показало, что LM может быть индуцирована на мышиных моделях путем прямого введения опухолевых клеток в правое полушарие мозжечка15. Тем не менее, этот подход часто не приводит к образованию метастазирования в субфронтальной области или дистальном отделе спинного мозга у некоторых субъектов. Недавнее исследование показало, что опухоли, происходящие из мутировавших клеток мелкоклеточного рака легкого, при подкожной имплантации могут спонтанно распространяться в лептоменингеальное пространство после длительного латентногопериода. После in vitro экспансии опухолевых клеток из спонтанного ЛМ, авторы успешно установили клеточную сублинию, способную развивать ЛМ с минимальной инфильтрацией паренхимы мозга путем инъекции внутрисонной артерии. Несмотря на то, что эта процедура отражает естественный ход метастатической диссеминации в лептоменингеальное пространство, она неэффективна и занимает много времени, так как большинство мышей умирают от метастазов в других органах до того, как ЛМ может полностью развиться. Кроме того, такой подход требует сложной микрохирургии, которая наносит значительный травматический урон субъекту. В качестве альтернативы, прямое введение опухолевых клеток в большую цистерну приводило к обширному лептоменингеальному поражению, которое очень похоже на состояние, наблюдаемое у пациентов с ЛМ15. Тем не менее, некоторые методы интрацистернальных инъекций требуют рассечения кожи и мышц, что приводит к значительной травме и повышенному риску внутричерепной инфекции, которая может изменить патофизиологические особенности ЛМ.
Здесь мы описали минимально инвазивный метод введения опухолевых клеток в большую цистерну через чрескожный путь пункции. В отличие от других хирургических подходов, чрескожные инъекции позволяют избежать инвазивных этапов, таких как разрез кожи, тем самым сводя к минимуму риск инфекции. При точном позиционировании процедура может быть завершена всего за несколько минут, что значительно сокращает время как операционного, так и послеоперационного ухода. Кроме того, прямое введение опухолевых клеток в большую цистерну улучшает приживление опухолевых клеток в лептоменингеальном пространстве, снижая частоту колонизации экстракраниальных органов (табл. 1).
В нем содержатся некоторые критически важные соображения и информация по устранению неполадок в протоколе. Несмотря на то, что мы ожидаем, что нынешняя процедура уменьшит потребность в высококвалифицированном персонале и упростит весь процесс, для оператора по-прежнему крайне важно точно определить место прокола. Операторы должны быть знакомы с анатомией мыши, особенно с задней черепной ямкой и шейным отделом, чтобы обеспечить точное позиционирование. Если игла сталкивается с костной поверхностью во время введения, место прокола может быть слишком высоким и должно быть соответствующим образом скорректировано вниз. Чтобы обеспечить успешную инъекцию, мы размещаем и фиксируем животных над центрифужной трубкой объемом 15 мл, чтобы полностью обнажить место инъекции. Мы также обнаружили, что инсулиновый шприц 31 г, 8 мм, работает лучше, чем обычный шприц Гамильтона для прокола цистерны магна. Вероятно, это связано с тем, что игла шприца Гамильтона менее эффективна при проникновении в толстые слои тканей и обеспечивает меньший контроль во время введения. Глубина (4 мм) и угол (45°-50°) введения иглы имеют решающее значение. Чрезмерная глубина может привести к росту опухоли в стволе мозга, в то время как недостаточная глубина может привести к подкожным опухолям. Таким образом, чтобы свести к минимуму риск случайной смерти от резкого повышения внутричерепного давления, инъекцию следует проводить как можно медленнее.
Однако этот протокол не лишен ограничений. В отличие от традиционных методов, описанная процедура основана на точном позиционировании животного и сенсационной обратной связи оператора, которая вносит определенную степень вариативности. При тщательном контроле глубины инъекции и повторном опыте можно достичь высокого уровня успеха. Еще одним существенным недостатком данной процедуры является то, что она обходит ранние стадии метастатического каскада и, следовательно, не способна повторить весь ход ЛМ у пациентов. В целом, представленная процедура технически проста и высокоэффективна для создания мышиных моделей ЛМ, представляя собой ценную доклиническую платформу для исследований, связанных с ЛМ.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Авторы благодарят сотрудников лаборатории Чжана за их ценные обсуждения и помощь на протяжении всего этого исследования. W.Z. поддерживается Фондами фундаментальных исследований для университетов провинции Чжэцзян (2023QZJH60), Программой Научного фонда для выдающихся молодых ученых от Национального фонда естественных наук Китая (588020-X42306/041) и стартап-фондом от Института наук о жизни Чжэцзянского университета.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5ml Eppendorf tubes | Biosharp | BS-15-M-S | |
| 15ml centrifuge tube | LABSELECT | CT-002-15A | |
| 31G x 8mm insulin syringe(0.3ml) | Promisemed | / | |
| Abrasive drill | GLOBALEBIO | GEGZ-AM1 | |
| Animal heat mat | woggee | / | |
| Cryomold | Supin | SP-AB-7 x 7 x 5 | |
| Depilatory creams | Nair | 1.00023E+11 | |
| D-Luciferin | Gold Biology | LUCK-1G | |
| DMEM | Gibco | C11995500CP | |
| FBS | Gibco | 10270-106 | |
| IVIS Spectrum | Caliper | / | |
| Optimal Cutting Temperature | Sakura | 4583-1 | |
| Paraformaldehyde | SCR | 80096618 | |
| PBS | Servicebio | G4202-500ML | |
| Pen/Strep Amphotericin B | Gibco | 15140122 | |
| Shaver | Hipidog | 2103CGMJ3373-GQ22N526 | |
| Stereo fluorescence microscope | Olympus | / | |
| Straight forceps | Beyotime | FS019 | Need to be autoclaved |
| Surgical scissors | Beyotime | FS001 | Need to be autoclaved |
| Triangular mouse fixation head piece | Transcend vivoscope | TVS-FDM-027 | |
| Tribromoethanol | Macklin | C14432922 | |
| TRITC-dextran, MW 70000 | MedChemExpress | HY-158082C | |
| Trypsin/EDTA solution | Gibco | 25200056 | |
| Two-photon laser scanning microscopy | Olympus | / | |
| Vetbond Tissue Adhesives | 3M | 1469SB |
Ссылки
- Wilcox, J. A., et al. Leptomeningeal metastases from solid tumors: A Society for Neuro-Oncology and American Society of Clinical Oncology consensus review on clinical management and future directions. Neuro Oncol. 26 (10), 1781-1804 (2024).
- Wasserstrom, W. R., Glass, J. P., Posner, J. B. Diagnosis and treatment of leptomeningeal metastases from solid tumors: experience with 90 patients. Cancer. 49 (4), 759-772 (1982).
- Remsik, J., Boire, A. The path to leptomeningeal metastasis. Nat Rev Cancer. 24 (7), 448-460 (2024).
- Kokkoris, C. P. Leptomeningeal carcinomatosis. How does cancer reach the pia-arachnoid. Cancer. 51 (1), 154-160 (1983).
- Remsik, J., et al. Leptomeningeal metastatic cells adopt two phenotypic states. Cancer Rep. 5 (4), e1236(2022).
- Chi, Y., et al. Cancer cells deploy lipocalin-2 to collect limiting iron in leptomeningeal metastasis. Science. 369 (6501), 276-282 (2020).
- Yin, K., et al. A molecular graded prognostic assessment (molGPA) model specific for estimating survival in lung cancer patients with leptomeningeal metastases. Lung Cancer. 131, 134-138 (2019).
- Li, Y. S., et al. Leptomeningeal Metastases in Patients with NSCLC with EGFR Mutations. J Thorac Oncol. 11 (11), 1962-1969 (2016).
- Li, Y. S., et al. Unique genetic profiles from cerebrospinal fluid cell-free DNA in leptomeningeal metastases of EGFR-mutant non-small-cell lung cancer: a new medium of liquid biopsy. Ann Oncol. 29 (4), 945-952 (2018).
- Posner, J. B., Chernik, N. L. Intracranial metastases from systemic cancer. Adv Neurol. 19, 579-592 (1978).
- Kuiper, J. L., et al. Treatment and survival of patients with EGFR-mutated non-small cell lung cancer and leptomeningeal metastasis: A retrospective cohort analysis. Lung Cancer. 89 (3), 255-261 (2015).
- Tsukada, Y., Fouad, A., Pickren, J. W., Lane, W. W. Central nervous system metastasis from breast carcinoma. Autopsy study. Cancer. 52 (12), 2349-2354 (1983).
- Singh, M., Bakhshinyan, D., Venugopal, C., Singh, S. K. Preclinical Modeling and Therapeutic Avenues for Cancer Metastasis to the Central Nervous System. Front Oncol. 7, 220(2017).
- Shi, M. X., et al. PROTAC EZH2 degrader-1 overcomes the resistance of podophyllotoxin derivatives in refractory small cell lung cancer with leptomeningeal metastasis. BMC Cancer. 24 (1), 504(2024).
- Choi, S. A., et al. In vivo bioluminescence imaging for leptomeningeal dissemination of medulloblastoma in mouse models. BMC Cancer. 16 (1), 723(2016).
- Zhao, J., et al. Dura immunity configures leptomeningeal metastasis immunosuppression for cerebrospinal fluid barrier invasion. Nat Cancer. 5 (12), 1940-1961 (2024).
- Boire, A., et al. Complement Component 3 Adapts the Cerebrospinal Fluid for Leptomeningeal Metastasis. Cell. 168 (6), 1101-1113.e13 (2017).
- Zhang, W., et al. Metastasis Initiation Is Coupled with Bone Remodeling through Osteogenic Differentiation of NG2+ Cells. Cancer Discov. 13 (2), 474-495 (2023).
- Louis, K. S., Siegel, A. C. Cell viability analysis using trypan blue: manual and automated methods. Methods Mol Biol. 740, 7-12 (2011).
- Green, T. R. F., Ortiz, J. B., Harrison, J. L., Lifshitz, J., Rowe, R. K. Simultaneous Cryosectioning of Multiple Rodent Brains. J Vis Exp. (139), e58513(2018).
- Feldman, A. T., Wolfe, D. Tissue Processing and Hematoxylin and Eosin Staining. Methods Mol Biol. 1180, 31-43 (2014).
- Shih, A. Y., Mateo, C., Drew, P. J., Tsai, P. S., Kleinfeld, D. A polished and reinforced thinned-skull window for long-term imaging of the mouse brain. J Vis Exp. (61), e3742(2012).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. J Cereb Blood Flow Metab. 32 (7), 1277-1309 (2012).
- Drew, P. J., et al. Chronic optical access through a polished and reinforced thinned skull. Nat Methods. 7 (12), 981-984 (2010).
- Wilcox, J. A., Li, M. J., Boire, A. A. Leptomeningeal Metastases: New Opportunities in the Modern Era. Neurotherapeutics. 19 (6), 1782-1798 (2022).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid Cancer Cell Injection to Produce Mouse Models of Brain Metastasis. J Vis Exp. (120), e55085(2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены