Method Article
نموذج حقن Cisterna Magna طفيف التوغل لدراسات ورم خبيث البريماني السحائي في الفئران
In This Article
Summary
يصف البروتوكول طريقة لحقن الخلايا السرطانية من خلال طريق البزل عن طريق الجلد في صهريج ماجنا الذي يحفز بقوة ورم خبيث في الفئران ، مما يقلل من الصدمة وعبء الورم خارج الجمجمة.
Abstract
ورم خبيث للسحائية البريمية (LM) ، وهو انتشار الخلايا السرطانية في السائل الدماغي النخاعي المملوء بالسائل النخاعي (CSF) ، هو أحد المضاعفات النادرة والمدمرة للأورام الصلبة المتقدمة. غالبا ما يكون لدى المرضى الذين يعانون من LM تشخيص ضعيف ، حيث يقاس البقاء على قيد الحياة من أسابيع إلى شهور. يعد تطوير نماذج في الجسم الحي التي تكرر بدقة تعقيدات LM أمرا ضروريا لفهم آلياته الخلوية والمرضية وتقييم العلاجات المحتملة. عادة ما يتم إنشاء نماذج الفئران LM من خلال حقن الخلايا السرطانية داخل القلب أو الشريان السباتي أو الصهريج. ومع ذلك ، غالبا ما تؤدي الحقن داخل القلب أو الشريان السباتي إلى عبء كبير من أورام خارج الجمجمة والمخ ، مما يعقد التصوير المضيء بيولوجيا ويؤدي إلى وفيات لا علاقة لها بالمحور المحوري. وفي الوقت نفسه ، يتطلب حقن الصهريج التقليدي إجراءات جراحية ، مثل شق الجلد وتشريح العضلات ، مما يجعله مؤلما وكثيف الموارد. هنا ، نصف إجراء طفيف التوغل لحقن الخلايا السرطانية في الفضاء السحائي البريمي من خلال الصهريج الماغنا دون الحاجة إلى شق جلدي. يقلل هذا النهج من تكوين الورم خارج الجمجمة ، ويقلل من الصدمات الجراحية ، ويقصر الوقت والرعاية المطلوبة بعد الجراحة مقارنة بالطرق الجراحية الأخرى. الأهم من ذلك ، أنه يحفز LM باستمرار مع الحد الأدنى من تسلل حمة الدماغ ، كما يؤكده الفحص المجهري ثنائي الفوتون والتحليل النسيجي. يقدم هذا النهج المبسط نموذجا فعالا وموثوقا لدراسة LM في البحوث قبل السريرية.
Introduction
لا يزال المرض النقيلي هو التحدي الأكبر للمرضى الذين يعانون من السرطانات المتقدمة. يشير ورم خبيث سحائي (LM) إلى انتشار الخلايا السرطانية إلى الأم ، والأم العنكبوتية ، والفضاء تحت العنكبوتية. أصبح LM من الأورام الصلبة شائعا بشكل متزايد في سرطان الرئة (9٪ -25٪) وسرطان الثدي (5٪ -20٪) والورم الميلانيني (6٪ -18٪) 1،2 ، ويرجع ذلك إلى حد كبير إلى البقاء على قيد الحياة لفترة أطول وتقنيات التشخيص المحسنة. يمكن للخلايا السرطانية أن تغزو الفضاء السحائي البريماني بطرق متعددة ، بما في ذلك 1) الغزو المباشر من خلال الهياكل الطرفية مثل الأم الجافية والعظام والأعصاب. 2) انتشار الدم من خلال الجهاز الوريدي. و 3) الدخول من خلال الدورة الدموية الشريانية ، حيث تنزلق الخلايا السرطانية عبر الأوعية المحشوقة إلى الضفيرة المشيمية ثم إلى البطينين المملوءين بالسائل النخاعي3،4،5. تواجه الخلايا السرطانية التي تدخل الفضاء السحائي البريماني تحديات متعددة ، بما في ذلك الحرمان من عوامل النمو ، والمواد الوسيطة الأيضية المحدودة ، وحالات نقص الأكسجين6. ومع ذلك ، نظرا لعدم وجود الأدوات والتقنيات المناسبة ، فإن كيفية تنقل الخلايا السرطانية في هذه المسارات والتغلب على الظروف غير المضيافة لاستعمار الفضاء البريماني السحائي غير مفهومة جيدا. على الرغم من التقدم في العلاجات متعددة الوسائط ، بما في ذلك العلاج الإشعاعي والعلاج الجهازي والعلاج بالحقن داخل القراب ، إلا أن تشخيص مرضى LM لا يزال ضعيفا ، حيث يتراوح البقاء على قيد الحياة عادة من 2 إلى 4 أشهر3،7،8،9. وبالتالي ، هناك حاجة ملحة لفهم أعمق لبيولوجيا ورم خبيث البريماني السحائي لتحسين العلاجات الحالية وتطوير علاجات جديدة مستهدفة. يتطلب تحقيق ذلك تطوير نماذج في الجسم الحي تلخص السمات المعقدة ل LM.
على عكس النقائل في أعضاء مثل الكبد والعظام والدماغ ، عادة ما يتطور LM بعد سنوات من تشخيص الورم الأولي10،11،12. وبالمثل ، في نماذج الفئران المصابة بالورم الخبيث التلقائي ، فإن LM نادر بسبب انخفاض حدوثه وحقيقة أن الفئران عادة ما تستسلم للنقائل في مواقع أخرى. يمكن إنشاء نماذج LM التجريبية للفئران من خلال طرق مختلفة ، بما في ذلك داخل القلب ، أو الشريان السباتي ، أو بدلا من ذلك ، الحقن المباشر في صهريج الصهريج أو البطينين الدماغيين. بينما يستخدم الحقن داخل القلب للخلايا السرطانيةعلى نطاق واسع 9 ، فإنه غالبا ما يؤدي إلى عبء كبير من الورم خارج الجمجمة ، مما يتسبب في وفيات لا علاقة لها بالمحور المحور. تتطلب الأساليب البديلة ، مثل حقن الخلايا السرطانية من خلال الشريان السباتي13 ، 14 ، موارد متخصصة واسعة النطاق وتؤدي إلى شقوق جراحية كبيرة ، وهي مؤلمة. علاوة على ذلك ، تؤدي هذه الطريقة أيضا في المقام الأول إلى ورم خبيث داخل أنسجة المخ نفسها ، بدلا من leptomenings ، وتستغرق وقتا طويلا وغير فعالة لإنشاء نماذج LM15. يتيح الحقن في صهريج ماجنا التوصيل المباشر للخلايا السرطانية إلى الفضاء السحائي البريمي. استخدمت العديد من الدراسات هذا النهج للتحقيق في آليات LM وتقييم العلاجات الجديدة6،16،17.
في هذه المخطوطة ، نقدم بروتوكول حقن مناسب عبر الصهاريج الماغنا يتضمن ثقبا مباشرا عن طريق الجلد لتوليد كمية أكبر من الفئران ذات المحور المحور وراثيا بسرعة وثبات. تتجاوز هذه الطريقة حاجز الدماغ والدم ، وبالتالي تتيح الطعم الفعال للخلايا السرطانية في مساحة السحيات البريمية. كما أنه يقلل بشكل كبير من الصدمة الجراحية ووقت الإجراء مع تحفيز LM بشكل موثوق في الفئران. أكدنا حدوث LM مع الحد الأدنى من التسلل إلى حمة الدماغ ، كما تم التحقق منه بواسطة الفحص المجهري ثنائي الفوتون والتحليل النسيجي. لذلك ، فإن النموذج الناتج يكرر بأمانة البيئة المكروية المعقدة للمحور المحور ، مما يوفر أداة قيمة لدراسة الآليات الخلوية والمرضية المرتبطة بالأمراض وتقييم العلاجات المحتملة.
Protocol
تمت مراجعة جميع الإجراءات الحيوانية في هذه المخطوطة والموافقة عليها من قبل لجنة مراجعة رعاية والأخلاقيات في مختبر ZJU (ZJU20230155). تم الحصول على الفئران C57BL / 6J و NSG من ظروف محددة خالية من مسببات الأمراض وإيوائها في مركز مختبر ZJU. يستخدم هذا البروتوكول خط خلايا سرطان الرئة الفئران ، وسرطان الرئة لويس (LLC1) ، وخط خلايا سرطان الرئة البشري ، A549 ، وكلاهما مصنف ب GFP و Firefly luciferase. يتم توفير كلا الخطين الخلويين من قبل الدكتور شيانغ إتش إف تشانغ (كلية بايلور للطب ، الولايات المتحدة الأمريكية) 18. هنا ، نستخدم خلايا LLC1 كمثال. إجراء حقن خلايا A549 متطابق تقريبا ، باستثناء أنه تم حقن 6 × 104 خلايا A549 في فئران NSG.
1. تحضير الخلايا السرطانية للحقن
- استزراع 1.0 × 106 خلايا LLC1 في DMEM مكملة بمصل بقري جنيني 10٪ و0.1 ملغم/مل بنسلين ستربتومايسين عند 37 درجة مئوية في حاضنة ثاني أكسيد الكربون5 ٪. عندما تصل الخلايا إلى التقاء 70٪ -90٪ ، قم بتسخينها لمدة دقيقة واحدة باستخدام 2 مل من محلول التربسين / EDTA بنسبة 0.25٪. قم بالطرد المركزي للخلايا عند 300 × جم لمدة 3 دقائق ، واغسلها مرتين باستخدام PBS المثلج ، وأعد تعليقها في 1 مل من محلول ملحي مخزن بالفوسفات (PBS).
- قم بتقييم تركيز الخلايا القابلة للحياة باستخدام محلول Trypan Blue ومقياس كثافة الدم19. تأكد من أن صلاحية الخلية أكبر من 90٪ ، مع كون غالبية الخلايا مفردة. اضبط تركيز الخلية على 2 × 106 خلايا / مل في PBS المثلج.
- Aliquot 50 ميكرولتر من تعليق الخلية في أنابيب منفصلة للطرد المركزي الدقيق لتجنب سحب العينات بشكل متكرر.
- احتفظ بتعليق الخلية على الجليد حتى تصبح جاهزة للحقن. حقن 10 ميكرولتر من خلايا LLC1 المسماة GFP-Luciferase لكل فأر في هذا البروتوكول ، بما يعادل 2 × 104 خلايا لكل ماوس.
ملاحظة: اضبط رقم الخلية حسب الحاجة بناء على الحركية النقيلية لخطوط الخلايا المحقونة.
2. تحضير الفئران
ملاحظة: في هذه الدراسة ، تم استخدام ذكور الفئران C57BL / 6J ، الذين تتراوح أعمارهم بين 6-8 أسابيع.
- الأوتوكلاف جميع الأدوات الجراحية والقفازات المليئة بالستائر الجراحية. قم بتعقيم المعدات غير الجراحية التي توضع على الطاولة بنسبة 75٪ من الإيثانول ، ثم قم بتغطية منطقة العمل بستائر مقاومة للماء.
- قم بإعداد قفص سكن حيواني نظيف ووسادة تدفئة للتعافي بعد العملية.
- تخدير الفأر عن طريق حقن 2٪ ثلاثي البروم إيثانول تحت الجلد (200 مجم / كغ). تحقق من عمق التخدير باستخدام اختبار القرص قبل المتابعة. ضع مرهما معقما للعيون لحماية العينين من تلف القرنية بمجرد تخدير الفأر.
- احلق الفراء من المنطقة القذالية الخلفية باستخدام المقص ، متبوعا بوضع كريمات إزالة الشعر لإزالة الفراء تماما في نفس المنطقة.
- ضع الماوس عرضة مع وضع رقبته فوق أنبوب طرد مركزي سعة 15 مل. قم بتأمين الرأس وأسفل الظهر بشريط لاصق والمس المسافة بين القفاة والفقرة C1 بإصبع السبابة (الشكل 1).
- قم بتطهير المنطقة القذالية الخلفية بثلاث جولات من المسح باستخدام 75٪ من القطن المعقم المنقوع بالإيثانول ، متبوعا بمقشر الجراحي من البيتادين. قم بتغطية الأجزاء غير المعقمة من بستارة معقمة.
3. حقن صهريج ماجنا
ملاحظة: التقنيات المعقمة مطلوبة للخطوات التالية ، بما في ذلك استخدام معدات الحماية الشخصية والقفازات المعقمة.
- قم بسحب معلق الخلية برفق وشفط 10 ميكرولتر للحقن باستخدام حقنة أنسولين 31 جم ، 8 مم.
- ملامسة المنطقة الواقعة بين القفا و C1 من الفأر بإصبع السبابة لتحديد موقع البزل الدقيق في الهامش المتوسط السفلي للجمجمة القذالية الخلفية. ضع علامة على هذا الموقع إذا لزم الأمر.
- أدخل الإبرة بزاوية 45 درجة -50 درجة في الصهريج من خلال موقع البزل المحدد ، مع التقدم إلى عمق 4 مم. يشير الإحساس المميز بالاختراق إلى أن الإبرة قد دخلت بنجاح صهريج ماجنا.
- إذا كان من الصعب تحديد موقع البزل ، فقم بعمل شق صغير بطول 3-5 مم على مستوى الأذن لكشف خط الوسط الخلفي. في حال الحاجة إلى شق جراحي، يتم تطبيق ميلوكسيكام (5 ملغ/كغ/يوم) وبوبرينورفين (0.1 ملغ/كغ) تحت الجلد قبل ساعة واحدة من الجراحة.
- قم بحقن تعليق الخلية ببطء عن طريق دفع مكبس المحقنة ، مع الحفاظ على ثبات المحقنة مع وضع اليد على الطاولة.
- بعد التلقيح ، أمسك المحقنة في مكانها لمدة 10 ثوان إضافية للسماح للضغط داخل الجمجمة بالتوازن. ثم اسحب الإبرة واضغط على موقع البزل بقطعة قطن معقمة لمدة 1-2 دقيقة.
4. رعاية ما بعد الحقن
- انقل لتنظيف الأقفاص على وسادة التدفئة وراقبها عن كثب حتى تتعافى تماما.
- في حالة إجراء شق ، أغلق الجرح باستخدام غراء المناديل والمشابك. قم بإعطاء مسكنات إضافية للألم لمدة 2-3 أيام بعد الجراحة للسيطرة على الألم والمساعدة في الشفاء.
- راقب الفئران عن كثب لمدة 7 أيام بعد الإجراء وتحقق من الأنشطة البدنية للحيوانات والمظهر المحيط بموقع الحقن يوميا.
5. تقييم نمو الورم السحائي
- التصوير الحيوي
- تخدير الفأر وإعطاء D-luciferin (150 ميكروغرام / جم) في الوريد خلف الحجاج. ضع الفئران في غرفة التصوير ، وضعها في مخروط أنف مخصص على مشعب التخدير. استخدم حواجز الضوء بين لتقليل تداخل الإشارة.
- قم بتصوير على الفور باستخدام نظام IVIS مع وقت التعرض بين 0.5 ثانية إلى 2 دقيقة6. تأكد من نجاح تلقيح الخلايا السرطانية في الفضاء السحائي البريماني عن طريق إشارة مضيئة بيولوجية مشتتة عبر الرأس والحبل الشوكي (الشكل 2 أ).
- مراقبة تطور LM عن طريق التصوير الحيوي كل 4 أيام. اضبط فترات التصوير بناء على حركية نمو الورم.
- التحليل النسيجي
- قم بتخدير الفئران عندما كانت أقل نشاطا بشكل ملحوظ أو فقدت 20٪ من وزن جسمها وقطع الجلد والأضلاع لفضح تجويف الصدر. أدخل قنية ذات رأس حاد بعناية في البطين الأيسر وتقدم القنية إلى الشريان الأورطي الصاعد. قم بتفريف ب 20 مل من PBS من خلال القنية ببطء.
- استخدم المقص لإزالة الرأس وعمل شق في خط الوسط لفروة الرأس لكشف الجمجمة. استئصال الأنسجة الرخوة المحيطة. اقطع على طول التلال المدارية ، ثم أدخل المقص في الثقبة العظمى ، وتقدم بعناية على طول السطح الداخلي للجمجمة بضغط تصاعدي لتجنب تلف الأنسجة.
- قم بإزالة عظام الجمجمة ، ثم استخرج الدماغ برفق. قم بإصلاح الدماغ في 4٪ بارافورمالدهيد عند 4 درجات مئوية لمدة 24 ساعة ثم قم بتوازنه في محلول PBS من السكروز بنسبة 15٪ لمدة 24 ساعة ، متبوعا بمحلول PBS من السكروز بنسبة 30٪ لمدة 24 ساعة أخرى عند 4 درجات مئوية.
- ضع الأنسجة في مادة كريومولد مملوءة بمركب درجة حرارة القطع المثلى (OCT) ثم قم بتخزينها على الثلج الجاف لمدة 30 دقيقةو 20.
- قم بقص الدماغ المضمن في OCT إلى أقسام بسمك 10 ميكرومتر باستخدام ناظم البرد. قم بتخزين الأقسام في فريزر -80 درجة مئوية حتى مزيد من التطبيق.
- قم بإجراء تلطيخ الهيماتوكسيلين / الإيوزين (H & E) على شرائح الدماغ21. يشير وجود الخلايا السرطانية على حافة الدماغ إلى أن ورم خبيث يحدث حصريا في الفضاء البريماني السحائي (الشكل 3 والجدول 1).
- الفحص المجهري ثنائي الفوتون
- تخدير الفئران باستخدام LM. قم بإزالة فروة الرأس التي تغطي سطح الجمجمة الظهرية بالملقط والمقص. استخدم شفرة مشرط لإزالة السمحاق الرقيق من سطح الجمجمة.
- قم بترقيق الجمجمة باستخدام مثقاب كاشطة حتى تظهر أوعية الحفر من خلال الجمجمة الرقيقة. قم بتثبيت منطقة المراقبة لرأس الماوس بغطاء رأس مثلث مؤمن بمادة لاصقة للأنسجة22،23.
- يجب تطبيق 0.025 مل من 5٪ (وزن/حجم) TRITC-dextran، في الوريد تحت الحجاج لتوسيم الأوعية الدموية22.
- قم بإجراء فحص مجهري ثنائي الفوتون من خلال نوافذ التصوير وإعادة بناء الفضاء البريماني السحائي (الشكل 4). اكتشف العظم عن طريق التألق التوافقي الثاني عند انبعاث 450 نانومتر مع إثارة 900 نانومتر24. تصور الخلايا السرطانية المسماة GFP والأوعية المسماة بالديكستران عن طريق جمع إشارات التألق عند انبعاث 507 نانومتر و 572 نانومتر مع إثارة 900 نانومتر و 1000 نانومتر ، على التوالي.
- مجهر فلوري ستيريو
- قم بإزالة دماغ الفأر وضعه تحت مجهر مجسم. تصور الخلايا المسماة ب GFP باستخدام مجموعة مرشحات خاصة ب GFP (الشكل 5).
النتائج
يوضح الشكل 1 وضع الماوس للحقن وموقع البزل من المناظر الجانبية والأمامية. يوضح الشكل 2 صورا تمثيلية للتلألؤ البيولوجي في الجسم الحي للحيوانات التي تم اختبارها لتوليد LM من خلال مناهج مختلفة. تم حقن خلايا LLC1 المسماة GFP-luciferase في من خلال طرق مختلفة ، تليها التصوير الحيوي. كما هو موضح في الشكل 2 أ ، بعد 10 أيام من حقن ماجنا داخل الخزان ، كانت إشارة الإضاءة الحيوية موجودة في دماغ الفأر وموزعة على طول الحبل الشوكي ، مما يشير إلى النقش الناجح للخلايا السرطانية في الفضاء البريمياتي السحائية. في المقابل ، أدت الحقن داخل الشريان السباتي للخلايا السرطانية في الغالب إلى حدوث ورم خبيث متني في الدماغ مع عدم وجود مشاركة كبيرة في السحايا البريمائية بعد 21 يوما من الحقن (الشكل 2 ب). بالنسبة لطريقة الحقن داخل القلب ، يظهر التصوير الحيوي من وضع الاستلقاء أن معظم النقائل تنمو في الأعضاء خارج الجمجمة (على اليسار) ، وأكدت الصور من المنظر المبطح أن أيا من الفئران الثلاثة لم يطور LM (يمين. الشكل 2 ج). لوحظ نفس التوزيع للخلايا السرطانية بعد 10 أيام من حقن الصهريج ماجنا لخلايا A549 المسماة ب GFP-Luciferase في فئران NSG (الشكل 2D) ، مما يشير إلى أن مثل هذا النهج يولد LM بقوة في سلالات الفئران المختلفة ذات خطوط الخلايا المختلفة.
يوضح الشكل 3 صورا تمثيلية للتلوين النسيجي والفلوري المناعي لأنسجة المخ بعد 14 يوما من حقن الخلايا السرطانية من خلال صهريج الماغنا. يظهر تلطيخ الهيماتوكسيلين يوزين (H & E) غالبية المناطق السرطانية الموجودة في الفضاء البريماني السحائي (الشكل 3 أ). يوضح الشكل 3 ب أن معظم الخلايا السرطانية المسماة GFP كانت متجمعة في السحايا والبطينين ، في حين أن الخلايا السرطانية في منطقة الحمة هي في الغالب خلايا مفردة. يعرض الشكل 4 صورا تمثيلية ثنائية الفوتون لمساحة البريميات السحائية للفأر مع LM. تم الكشف عن عظم الجمجمة (الأزرق) عن طريق جمع التألق التوافقي الثاني عند انبعاث 450 نانومتر مع إثارة 900 نانومتر24. تم تصنيف الأوعية الدموية (الحمراء) بواسطة TRITC-dexterrn (70 كيلو دالتون). تم العثور على خلايا سرطانية تحمل علامة GFP (خضراء) بين عظم الجمجمة (الأزرق) وحمة الدماغ ، وتحديدا داخل منطقة البريميات السحائية. يوضح الشكل 5 وجود خلايا سرطانية تحمل علامة GFP على سطح الدماغ ، يتم تصورها باستخدام مجهر مضان مجسم. ويعرض الجدول 1 المقارنة بين الطرائق الثلاث.

الشكل 1: موقع تحضير والثقب للحقن داخل الصهريج. (أ) يوضع الفأر في وضع الانبطاح ، مع لف رقبته فوق أنبوب طرد مركزي سعة 15 مل. يتم تأمين الرأس وأسفل الظهر بشريط لاصق. يتم إدخال الإبرة بزاوية 45 درجة -50 درجة في صهريج ماجنا عند الهامش السفلي المتوسط. (ب) يتم إدخال الإبرة في الهامش السفلي المتوسط للجمجمة القذالية الخلفية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
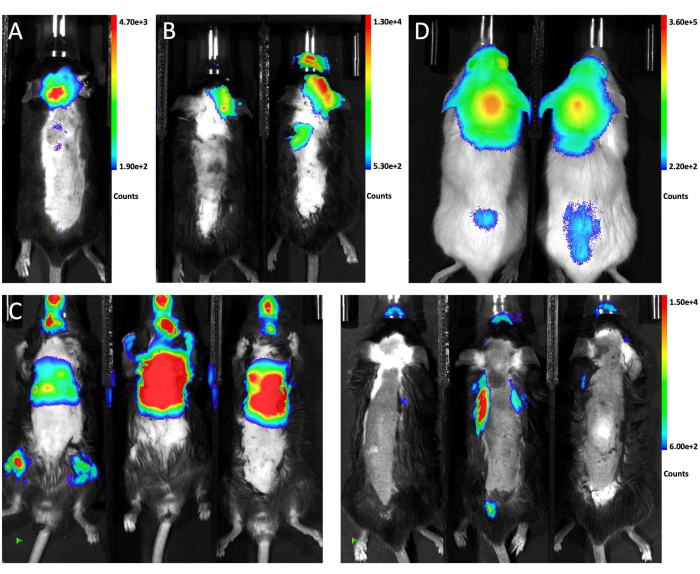
الشكل 2: صور التلألؤ البيولوجي التمثيلية في الجسم الحي للفئران التي تتلقى طرق حقن مختلفة. (أ)إشارة التلألؤ البيولوجي في الجسم الحي للحيوان بأكمله بعد حقن خلايا LLC1 داخل الصهريج. (ب) صورة التلألؤ البيولوجي في الجسم الحي للفئران بعد حقن الشريان السباتي لخلايا LLC1. (ج) إشارة التلألؤ البيولوجي في الجسم الحي للفئران بعد الحقن داخل القلب لخلايا LLC1. يظهر الجانب الأيسر المنظر المستلق والجانب الأيمن يظهر المنظر الانبطاح. (د) صورة التلألؤ البيولوجي لفئران NSG بعد حقن خلايا A549 من خلال الصهريج magna.a الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
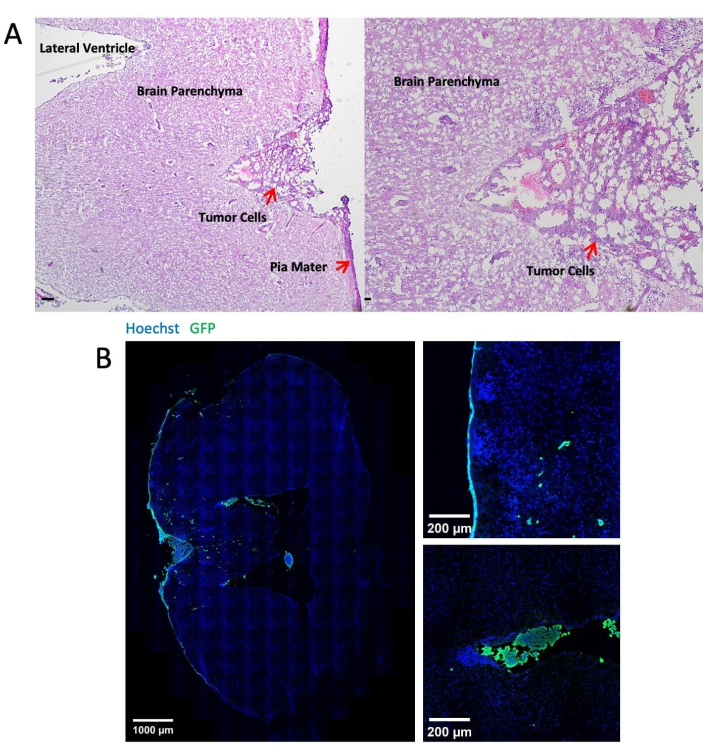
الشكل 3: صور تمثيلية للتلطيخ النسيجي والفلوري المناعي. (أ) يظهر تلطيخ H & E التمثيلي خلايا LLC1 المترسبة بشكل رئيسي على سطح السحايا وفي البطينين. شريط المقياس = 25 ميكرومتر. (ب) صور تلطيخ الفلورسنت المناعي للدماغ الحامل للورم LLC1. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
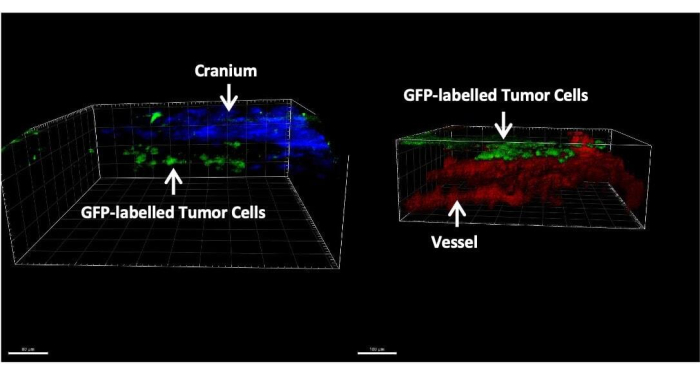
الشكل 4: صور تمثيلية ثنائية الفوتون لفأر مع LM. تم العثور على الخلايا السرطانية المسماة ب GFP (الأخضر) حصريا بين الجمجمة (الأزرق) وحمة الدماغ (الأحمر). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: صور تمثيلية لمجهر مضان الاستريو. (أ) المجال البصري العالمي لدماغ الفأر تحت المجهر. (ب) تم تقديم الخلايا السرطانية المسماة GFP على سطح الدماغ ، والتي تنبعث منها مضان أخضر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مدة الإجراء / دقيقة | لوحظ حدوث LM بعد 14 يوما من الحقن | معدل الإصابة بالورم خارج الجمجمة | معدل الأورام المتني الكبيرة في الدماغ | |
| حقن ماجنا داخل الخزان | ~ 5 | 100% (15/15) | 0 (0/15) | 0 (0/15) |
| حقن الشريان السباتي داخل الشريان السباتي | ~ 20 | 0 (0/15) | 100% (15/15) | 100% (15/15) |
| الحقن داخل القلب | ~ 5 | 0 (0/3) | 100% (3/3) | 0(0/3) |
الجدول 1: مقارنة بين ثلاث طرق حقن مختلفة من حيث مدة العملية ، وحدوث ورم خبيث في السحاء البريماني ، والأورام خارج الجمجمة ، ومعدل الأورام المتني في الدماغ الكبيرة.
Discussion
LM هو حالة عدوانية ومميتة. بمجرد أن تنتشر الخلايا السرطانية إلى الفضاء المملوء بالسائل النخاعي ، فإنها تنتشر بسرعة في جميع أنحاء الجهاز العصبي المركزيبأكمله 25. تستقر هذه الخلايا وتغزو الدماغ والحبل الشوكي والأعصاب القحفية والشوكية ، مما يؤدي في النهاية إلى تدهور عصبي سريع والموت في نهاية المطاف17. لفهم الآليات الفيزيولوجية المرضية الأساسية بشكل أفضل وتقييم الاستراتيجيات العلاجية المحتملة ، من الأهمية بمكان تطوير نموذج فعال في الجسم الحي يلخص العملية النقيلية والبيئة المكروية المحيطة بها في ورم خبيث البريمياتي.
أظهر تقرير سابق أنه يمكن تحفيز LM في نماذج الفئران عن طريق حقن الخلايا السرطانية مباشرة في نصف الكرة المخيخيالأيمن 15. ومع ذلك ، غالبا ما يفشل هذا النهج في إحداث ورم خبيث في المنطقة تحت الجبهة أو الحبل الشوكي البعيد في بعض الأشخاص. أظهرت دراسة حديثة أن الأورام المشتقة من خلايا سرطان الرئة ذات الخلايا الصغيرة المتحولة ، عند زرعها تحت الجلد ، قد تنتشر تلقائيا إلى الفضاء السحائي بعد فترة زمن انتقال طويلة14. بعد التوسع المختبري للخلايا السرطانية من LM التلقائي ، نجح المؤلفون في إنشاء خط فرعي للخلية قادر على تطوير LM مع الحد الأدنى من تسلل حمة الدماغ من خلال حقن الشريان السباتي. في حين أن هذا الإجراء يلتقط المسار الطبيعي للانتشار النقيلي في الفضاء السحائي ، إلا أنه غير فعال ويستغرق وقتا طويلا ، حيث تموت معظم الفئران من النقائل في الأعضاء الأخرى قبل أن يتطور LM بشكل كامل. بالإضافة إلى ذلك ، يتطلب هذا النهج إجراء جراحة مجهرية متطورة ، مما يفرض صدمة كبيرة على هذا الموضوع26. بدلا من ذلك ، أدى الحقن المباشر للخلايا السرطانية في الصهريج إلى تورط واسع النطاق في السحائية البريمائية ، والتي تشبه إلى حد كبير الحالة التي لوحظت في مرضى LM15. ومع ذلك ، تتطلب بعض طرق الحقن داخل القص تشريح الجلد والعضلات ، مما يؤدي إلى صدمة كبيرة وزيادة خطر الإصابة بالعدوى داخل الجمجمة ، مما قد يغير السمات الفيزيولوجية المرضية للمحور المحوري.
هنا ، وصفنا طريقة طفيفة التوغل لحقن الخلايا السرطانية في الصهريج الماغنا من خلال طريق البزل عن طريق الجلد. على عكس الأساليب الجراحية الأخرى ، تتجنب الحقن عن طريق الجلد الخطوات الغازية مثل شق الجلد ، وبالتالي تقليل خطر الإصابة بالعدوى. من خلال تحديد المواقع بدقة ، يمكن إكمال الإجراء في بضع دقائق فقط ، مما يقلل بشكل كبير من وقت الرعاية الجراحية وما بعد الجراحة. علاوة على ذلك ، فإن الحقن المباشر للخلايا السرطانية في الصهريج يحسن نقش الخلايا السرطانية داخل الفضاء السحائي مع تقليل حدوث استعمار الأعضاء خارج الجمجمة (الجدول 1).
هناك بعض الاعتبارات الهامة ومعلومات استكشاف الأخطاء وإصلاحها للبروتوكول. على الرغم من أننا نتوقع أن يقلل الإجراء الحالي من الحاجة إلى موظفين ذوي مهارات عالية ويبسط العملية برمتها ، إلا أنه لا يزال من الأهمية بمكان للمشغل تحديد موقع الثقب بدقة. يجب أن يكون المشغلون على دراية بتشريح الفأر ، وخاصة الحفرة القحفية الخلفية ومنطقة عنق الرحم ، لضمان تحديد المواقع بدقة. إذا واجهت الإبرة سطحا عظميا أثناء الإدخال ، فقد يكون موقع البزل مرتفعا جدا ويجب تعديله لأسفل بشكل مناسب. لضمان نجاح الحقن ، نقوم بوضع وتأمينها فوق أنبوب طرد مركزي سعة 15 مل لكشف موقع الحقن بالكامل. وجدنا أيضا أن حقنة الأنسولين 31G ، 8 مم تعمل بشكل أفضل من حقنة هاميلتون التقليدية لثقب الصهريج ماغنا. هذا على الأرجح لأن إبرة حقنة هاميلتون أقل فعالية في اختراق طبقات الأنسجة السميكة وتوفر تحكما أقل أثناء الإدخال. يعد العمق (4 مم) والزاوية (45 درجة -50 درجة) لإدخال الإبرة أمرا بالغ الأهمية. قد يؤدي العمق المفرط إلى نمو الورم في جذع الدماغ، بينما قد يؤدي العمق غير الكافي إلى ظهور أورام تحت الجلد. وبالتالي ، لتقليل مخاطر الوفاة العرضية من الزيادة المفاجئة في الضغط داخل الجمجمة ، يجب إجراء الحقن ببطء قدر الإمكان.
ومع ذلك ، فإن هذا البروتوكول لا يخلو من قيود. على عكس الطرق التقليدية ، يعتمد الإجراء الموصوف على تحديد المواقع الدقيقة للحيوان وردود الفعل المثيرة للمشغل ، والتي تقدم درجة من التباين. من خلال التحكم الدقيق في عمق الحقن والممارسة المتكررة ، يمكن تحقيق معدل نجاح مرتفع. عيب رئيسي آخر للإجراء الحالي هو أنه يتجاوز الخطوات المبكرة للتسلسل النقيلي ، وبالتالي فهو غير قادر على تلخيص المسار الكامل للLM في المرضى. بشكل عام ، فإن الإجراء المقدم مباشر من الناحية الفنية وعالي الكفاءة لإنشاء نماذج LM للفئران ، مما يمثل منصة ما قبل السريرية القيمة للدراسات المتعلقة بالمحور المحوري.
Disclosures
ويعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
يشكر المؤلفون أعضاء مختبر تشانغ على مناقشاتهم القيمة ومساعدتهم طوال هذه الدراسة. WZ مدعومة من قبل صناديق البحوث الأساسية لجامعات مقاطعة تشجيانغ (2023QZJH60) ، وبرنامج صندوق العلوم للباحثين الشباب المتميزين من المؤسسة الوطنية للعلوم الطبيعية في الصين (588020-X42306/041) ، وصندوق بدء التشغيل من معهد علوم الحياة بجامعة تشجيانغ.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5ml Eppendorf tubes | Biosharp | BS-15-M-S | |
| 15ml centrifuge tube | LABSELECT | CT-002-15A | |
| 31G x 8mm insulin syringe(0.3ml) | Promisemed | / | |
| Abrasive drill | GLOBALEBIO | GEGZ-AM1 | |
| Animal heat mat | woggee | / | |
| Cryomold | Supin | SP-AB-7 x 7 x 5 | |
| Depilatory creams | Nair | 1.00023E+11 | |
| D-Luciferin | Gold Biology | LUCK-1G | |
| DMEM | Gibco | C11995500CP | |
| FBS | Gibco | 10270-106 | |
| IVIS Spectrum | Caliper | / | |
| Optimal Cutting Temperature | Sakura | 4583-1 | |
| Paraformaldehyde | SCR | 80096618 | |
| PBS | Servicebio | G4202-500ML | |
| Pen/Strep Amphotericin B | Gibco | 15140122 | |
| Shaver | Hipidog | 2103CGMJ3373-GQ22N526 | |
| Stereo fluorescence microscope | Olympus | / | |
| Straight forceps | Beyotime | FS019 | Need to be autoclaved |
| Surgical scissors | Beyotime | FS001 | Need to be autoclaved |
| Triangular mouse fixation head piece | Transcend vivoscope | TVS-FDM-027 | |
| Tribromoethanol | Macklin | C14432922 | |
| TRITC-dextran, MW 70000 | MedChemExpress | HY-158082C | |
| Trypsin/EDTA solution | Gibco | 25200056 | |
| Two-photon laser scanning microscopy | Olympus | / | |
| Vetbond Tissue Adhesives | 3M | 1469SB |
References
- Wilcox, J. A., et al. Leptomeningeal metastases from solid tumors: A Society for Neuro-Oncology and American Society of Clinical Oncology consensus review on clinical management and future directions. Neuro Oncol. 26 (10), 1781-1804 (2024).
- Wasserstrom, W. R., Glass, J. P., Posner, J. B. Diagnosis and treatment of leptomeningeal metastases from solid tumors: experience with 90 patients. Cancer. 49 (4), 759-772 (1982).
- Remsik, J., Boire, A. The path to leptomeningeal metastasis. Nat Rev Cancer. 24 (7), 448-460 (2024).
- Kokkoris, C. P. Leptomeningeal carcinomatosis. How does cancer reach the pia-arachnoid. Cancer. 51 (1), 154-160 (1983).
- Remsik, J., et al. Leptomeningeal metastatic cells adopt two phenotypic states. Cancer Rep. 5 (4), e1236(2022).
- Chi, Y., et al. Cancer cells deploy lipocalin-2 to collect limiting iron in leptomeningeal metastasis. Science. 369 (6501), 276-282 (2020).
- Yin, K., et al. A molecular graded prognostic assessment (molGPA) model specific for estimating survival in lung cancer patients with leptomeningeal metastases. Lung Cancer. 131, 134-138 (2019).
- Li, Y. S., et al. Leptomeningeal Metastases in Patients with NSCLC with EGFR Mutations. J Thorac Oncol. 11 (11), 1962-1969 (2016).
- Li, Y. S., et al. Unique genetic profiles from cerebrospinal fluid cell-free DNA in leptomeningeal metastases of EGFR-mutant non-small-cell lung cancer: a new medium of liquid biopsy. Ann Oncol. 29 (4), 945-952 (2018).
- Posner, J. B., Chernik, N. L. Intracranial metastases from systemic cancer. Adv Neurol. 19, 579-592 (1978).
- Kuiper, J. L., et al. Treatment and survival of patients with EGFR-mutated non-small cell lung cancer and leptomeningeal metastasis: A retrospective cohort analysis. Lung Cancer. 89 (3), 255-261 (2015).
- Tsukada, Y., Fouad, A., Pickren, J. W., Lane, W. W. Central nervous system metastasis from breast carcinoma. Autopsy study. Cancer. 52 (12), 2349-2354 (1983).
- Singh, M., Bakhshinyan, D., Venugopal, C., Singh, S. K. Preclinical Modeling and Therapeutic Avenues for Cancer Metastasis to the Central Nervous System. Front Oncol. 7, 220(2017).
- Shi, M. X., et al. PROTAC EZH2 degrader-1 overcomes the resistance of podophyllotoxin derivatives in refractory small cell lung cancer with leptomeningeal metastasis. BMC Cancer. 24 (1), 504(2024).
- Choi, S. A., et al. In vivo bioluminescence imaging for leptomeningeal dissemination of medulloblastoma in mouse models. BMC Cancer. 16 (1), 723(2016).
- Zhao, J., et al. Dura immunity configures leptomeningeal metastasis immunosuppression for cerebrospinal fluid barrier invasion. Nat Cancer. 5 (12), 1940-1961 (2024).
- Boire, A., et al. Complement Component 3 Adapts the Cerebrospinal Fluid for Leptomeningeal Metastasis. Cell. 168 (6), 1101-1113.e13 (2017).
- Zhang, W., et al. Metastasis Initiation Is Coupled with Bone Remodeling through Osteogenic Differentiation of NG2+ Cells. Cancer Discov. 13 (2), 474-495 (2023).
- Louis, K. S., Siegel, A. C. Cell viability analysis using trypan blue: manual and automated methods. Methods Mol Biol. 740, 7-12 (2011).
- Green, T. R. F., Ortiz, J. B., Harrison, J. L., Lifshitz, J., Rowe, R. K. Simultaneous Cryosectioning of Multiple Rodent Brains. J Vis Exp. (139), e58513(2018).
- Feldman, A. T., Wolfe, D. Tissue Processing and Hematoxylin and Eosin Staining. Methods Mol Biol. 1180, 31-43 (2014).
- Shih, A. Y., Mateo, C., Drew, P. J., Tsai, P. S., Kleinfeld, D. A polished and reinforced thinned-skull window for long-term imaging of the mouse brain. J Vis Exp. (61), e3742(2012).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. J Cereb Blood Flow Metab. 32 (7), 1277-1309 (2012).
- Drew, P. J., et al. Chronic optical access through a polished and reinforced thinned skull. Nat Methods. 7 (12), 981-984 (2010).
- Wilcox, J. A., Li, M. J., Boire, A. A. Leptomeningeal Metastases: New Opportunities in the Modern Era. Neurotherapeutics. 19 (6), 1782-1798 (2022).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid Cancer Cell Injection to Produce Mouse Models of Brain Metastasis. J Vis Exp. (120), e55085(2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved