Method Article
Поведенческие анализы для оптогенетических манипуляций с нейронными цепями у Drosophila melanogaster
* Эти авторы внесли равный вклад
В этой статье
Резюме
В данной статье представлены методы оптогенетической манипуляции у Drosophila melanogaster с использованием CsChrimson и GtACR2 для активации и подавления определенных нейронов. Описаны четыре эксперимента с использованием оптогенетики для изучения термотаксического и вкусового поведения, что дает представление о лежащих в основе нейронных механизмах, управляющих этими процессами.
Аннотация
Оптогенетика стала фундаментальным методом в нейробиологии, позволяющим точно контролировать активность нейронов с помощью световой стимуляции. В этом исследовании представлены простые в реализации настройки для применения оптогенетических методов у Drosophila melanogaster. Два оптогенетических инструмента, CsChrimson, катионный канал, активируемый красным светом, и GtACR2, анионный канал, активируемый синим светом, были использованы в четырех экспериментальных подходах. Три из этих подходов включают эксперименты с одной мухой: (1) оптогенетический термотаксический анализ позиционных предпочтений синего света, нацеленный на чувствительные к температуре нагревающие клетки, (2) оптогенетический анализ оптогенетических предпочтений в красном свете, активирующий горькие чувствительные нейроны, и (3) анализ реакции на расширение хоботка, активирующий сладкие чувствительные нейроны. Четвертый подход (4) представляет собой установку лабиринта мух для оценки поведения избегания с использованием нескольких мух. Возможность манипулировать нейронной активностью во времени и пространстве дает мощное понимание сенсорной обработки и принятия решений, подчеркивая потенциал оптогенетики для расширения наших знаний о нейронных функциях. Эти методы обеспечивают доступную и надежную основу для будущих исследований в области нейробиологии, чтобы улучшить понимание конкретных нейронных путей и их поведенческих последствий.
Введение
Оптогенетика возникла как мощный метод, объединяющий оптику и генетику в нейробиологии, обеспечивающий точный, неинвазивный контроль над нейронной активностью с помощью световой стимуляции. У Drosophila melanogaster, широко используемого модельного организма, оптогенетические инструменты позволяют активировать и ингибировать определенные нейроны, позволяя исследователям модулировать нейронные цепи. Среди используемых инструментов CsChrimson и GtACR (Guillardia theta anion channel rhodopsins) обеспечивают взаимодополняющие подходы к нейрональному нацеливанию. Каналродопсин CsChrimson, чувствительный к красному свету катионный канал из зеленых водорослей, способствует активации нейронов за счет деполяризации при воздействии красного света, с пиковой активацией примерно на длине волны 590нм2. CsChrimson обеспечивает лучшее проникновение в ткани по сравнению с предыдущими каналродопсинами и уменьшает вызванные светом поведенческие артефакты в исследованиях дрозофил 2. В отличие от него, GtACR, который включает в себя такие варианты, как GtACR2, представляет собой светозависимый хлоридный канал, который заглушает нейроны посредством гиперполяризации 3,4. GtACR2 проводит анионы и активируется синим светом с пиком активации около 470 нм4. CsChrimson и GtACR2 активируются различными длинами волн света, обеспечивая точное и независимое управление нейронной активностью без перекрестнойактивации.
Дрозофила является эффективной моделью для исследований в области нейробиологии благодаря своей экономической эффективности, простоте выращивания и устойчивым поведенческим реакциям на раздражители окружающей среды, включаяпривлекательное поведение и поведение избегания. Его небольшой размер и полупрозрачная кутикула усиливают проникновение света, особенно длинноволнового красного света, что позволяет эффективно проводить оптогенетические манипуляции 7,8. В то время как клетки дрозофилы не могут производить достаточное количество сетчатки, важнейшего кофактора для функционирования каналродопсинов, добавление сетчатки в их рацион компенсирует это ограничение, обеспечивая эффективную активацию оптогенетическихинструментов.
Чтобы изучить эффекты оптогенетических манипуляций у дрозофил, мы описываем четыре эксперимента, нацеленных на различные нейронные цепи и поведение, в каждом из которых используются различные модальности для оценки либо избегания, либо привлекательных реакций, начиная от анализов на одной мухе и заканчивая групповыми оценками. Нагревательные клетки (ГК) у дрозофил представляют собой термосенсорные нейроны, расположенные в аристе, реагирующие на повышение температуры10. Эти нейроны экспрессируют чувствительные к теплу ионные каналы, которые запускают поведение избегания, уводя мух от источников тепла10,11. В подходе 1 мы использовали оптогенетический термотактический анализ предпочтений синей мухи для манипулирования нейронами HC. Экспрессируя GtACR2 в этих нейронах, мы подавляли их активность при воздействии синего света. Мух подвергали воздействию двух температурных режимов: 25 °C и 31 °C. При комнатном освещении мухи избегали стороны 31 °C, демонстрируя типичную термотаксическую реакцию. Тем не менее, активация GtACR2 синим светом заставила замолчать нейроны HC. В результате мухи не показали значительного температурного предпочтения, что свидетельствует об успешном оптогенетическом ингибировании. В дополнение к оценке функции сенсорных нейронов, экспрессия GtACR2 в нижестоящих сенсорных нейронах позволяет проводить подобные оптогенетические манипуляции для изучения нейронных цепей, необходимых для конкретных сенсорныхмодальностей.
Вкусовой рецептор GR66a у дрозофил экспрессируется в губных пальпах на дистальном конце хоботка и в ногах, опосредуя обнаружение горького вкуса 12,13. Эти нейроны запускают поведение избегания в ответ на горькие вещества. В подходе 2 мы использовали оптогенетический анализ оптогенетических предпочтений для манипулирования нейронами, экспрессирующими GR66a. Экспрессируя CsChrimson в этих нейронах, мы активировали их при воздействии красного света. Мухи были размещены на арене, одна половина которой подвергалась воздействию красного света, а другая половина фильтровала красный свет. В отсутствие красного света мухи не проявляли предпочтения. Тем не менее, активация CsChrimson красным светом стимулировала чувствительные нейроны, что привело к значительному избеганию освещенной области, что подтвердило успешную оптогенетическую активацию нейронов GR66a. Аналогичные подходы были использованы для идентификации последующих контуров нагревательных элементов, достаточныхдля поведения избегания.
В подходе 3 мы сосредоточились на оптогенетической активации аппетитного поведения. GR5a-экспрессирующие нейроны, расположенные во вкусовой сенсилле на лабеллуме и ножках, обнаруживают сахара и управляют пищевым поведением. Активация этих нейронов запускает реакцию на расширение хоботка (PER)14. Мы использовали анализ ответа на удлинение оптогенетического хоботка в красном свете для активации нейронов GR5a. Экспрессируя CsChrimson в этих нейронах, мы стимулировали их красным светом. Мухи не вытягивали свой хоботок в условиях комнатного освещения. Тем не менее, активация CsChrimson красным светом привела к расширению хоботка без сладкого стимула, демонстрируя успешную оптогенетическую активацию нейронов GR5a. Этот подход был использован для исследования нейронной цепи, включая вкусовые сенсорные нейроны, нейроны проекции вкуса и мотонейроны хоботка15,16.
В подходе 4 мы исследовали оптогенетическую активацию избегающего поведения в группах мух, используя оптогенетический анализ лабиринта мух с красным светом, нацеленный на нейроны GR66a. Мухи были размещены на пересечении двух трубок: одна освещалась красным светом, а другая затенялась. Экспрессия CsChrimson в нейронах GR66a вызывала избегание. В отсутствие красного света мухи не проявляли никаких предпочтений, но активация красным светом заставляла мух, экспрессирующих GR66a, избегать красного света, что свидетельствует об успешной активации пути. Анализы лабиринта мух широко используются для изучения различных сенсорных модальностей, включая температуру, влажность и обоняние. В сочетании с оптогенетикой этот подход является мощным для исследования как привлекательного, так и избегающего поведения.
Эти методы обеспечивают воспроизводимую основу для изучения оптогенетической активации и ингибирования нейронных цепей дрозофилы . Используя комбинацию различных каналродопсинов и доступных поведенческих анализов, это экспериментальное исследование демонстрирует эффективность оптогенетических манипуляций, предоставляя простые методы манипулирования функциями нейронных цепей с потенциалом более широкого применения в исследованиях в области нейробиологии.
протокол
1. Штаммы, выращивание мух и аспиратор от мух
- Деформации и техническое обслуживание
- В экспериментах использовались следующие штаммы: HC-Gal410, Gr5a-Gal420 (Bloomington Drosophila Stock Center (BDSC): 57592), Gr66a-Gal421 (BDSC: 57670), UAS-GtACR23, UAS-CsChrimson2 (BDSC: 55136). Задняя часть работает при температуре 25 °C на стандартной среде из кукурузной муки при 12-часовом темном цикле свет:12 часов.
ПРИМЕЧАНИЕ: 1 л среды из кукурузной муки содержит 1 л dH2O, 79 г декстрозы, 7,5 г агара, 24 г хлопьевых дрожжей, 57 г кукурузной муки, 2,1 г метил-4-гидроксибензоата (растворенного в 11,1 мл этанола), 6 г тетрагидрата тартрата натрия и 0,9 г хлорида кальция.
- В экспериментах использовались следующие штаммы: HC-Gal410, Gr5a-Gal420 (Bloomington Drosophila Stock Center (BDSC): 57592), Gr66a-Gal421 (BDSC: 57670), UAS-GtACR23, UAS-CsChrimson2 (BDSC: 55136). Задняя часть работает при температуре 25 °C на стандартной среде из кукурузной муки при 12-часовом темном цикле свет:12 часов.
- Выращивание мух и подготовка к опыту
- Сортируйте мух от 0 до 3 дней. К моменту эксперимента возраст мух составит от 3 до 6 дней, что обеспечит возрастную стабильность (рисунок 1A).
- За 3 дня до проведения экспериментов разделите каждый генотип на четыре группы: комнатно-световой ATR -, комнатный ATR +, красный или синий свет ATR + и красный или синий свет ATR +.
- Приготовьте стоковый раствор ATR 80 мМ путем растворения ATR в 100% этаноле. Дополните корм 400 μM ATR к группам ATR+.
- Дополняйте пищу той же концентрацией этанола, но без ATR в группы ATR.
- Задний ход всех групп в темное время суток22.
- Starve Gr5a>CsChrimson летает в течение 16-24 часов во флаконах, содержащих только влажную ткань. Флаконы ATR + содержат 400 мкМ ATR в смеси с водой, в то время как флаконы ATR содержат dH2O, смешанный с той же концентрацией этанола.
- Аспиратор от мух
- Соберите аспиратор от мух (рис. 1B) с помощью пластиковой трубки, сетки от насекомых и двух пипеток объемом 3 мл.
- Обрежьте кончики и колбы переводных пипеток, убедившись, что наконечник для присоски мухи обеспечивает комфортное прохождение мухи. Такая конструкция обеспечивает мягкую аспирацию мух через вдыхание, сводя к минимуму вред и способствуя эффективному сбору и переносу отдельных мух.
- Накиньте сетку от насекомых на пластиковую трубку и закрепите концы пипетки на трубке с помощью парапленки.
2. Оптогенетический термотаксический анализ предпочтений одиночной мухи в синем свете
- Штаммы дрозофил и выращивание мух
- Скрещиваем линию драйвера HC-Gal410 с UAS-GtACR23, в результате чего получаем экспериментальный генотип HC>GtACR2. Мухи HC>GtACR2 экспрессируют GtACR2 в нагревательных элементах.
ПРИМЕЧАНИЕ: Убедитесь, что для каждого состояния используется равное количество самцов и самок мух.
- Скрещиваем линию драйвера HC-Gal410 с UAS-GtACR23, в результате чего получаем экспериментальный генотип HC>GtACR2. Мухи HC>GtACR2 экспрессируют GtACR2 в нагревательных элементах.
- Постановка и проведение экспериментального анализа
- Выровняйте две стальные пластины на отдельных горячих пластинах так, чтобы их края встретились. Сверху поместите протектор из пластикового листа, закрепив его скотчем, чтобы свести к минимуму перемещения. Положите лист белой бумаги на защитную пленку листа, чтобы уменьшить сигналы фонового шума (рисунок 1C).
ПРИМЕЧАНИЕ: Заменяйте белую бумагу в начале каждого эксперимента или когда она загрязнена. - Поместите прозрачную пластиковую обложку (высотой 2 мм × шириной 58 мм × длиной 83 мм) поверх белой бумаги. Этот чехол позволяет мухе свободно ходить, предотвращая ее полет.
- Вырежьте отверстие на дне коробки из пенополистирола (высота 27 см × ширина 22 см × длина 16 см) для приклеивания к камере и синему свету (1000 мА) примерно на 12 см над экспериментальной поверхностью.
- Расположите камеру и синий свет так, чтобы свести к минимуму блики при активации системы.
ПРИМЕЧАНИЕ: Для определения диапазона активации синего света может потребоваться предварительный тест. - Настройте камеру на запись со следующими настройками: таймлапс 1 с, узкое поле, 4000 × 3000 пикселей.
- Отрегулируйте настройки конфорки так, чтобы температура поверхности составляла 25 ± 1 °C и 31 ± 1 °C на соответствующих стальных пластинах.
ПРИМЕЧАНИЕ: Для условий, требующих температуры ниже 25 °C, необходимы альтернативные методы охлаждения, такие как устройства Пельтье или лед. Если температура стальных пластин превышает желаемый уровень, опрыскайте поверхность дистиллированной водой для достижения и поддержания требуемых условий. Затем используйте салфетку, чтобы впитать лишнюю влагу из протектора из пластикового листа. - До и после каждого испытания контролируйте температуру с помощью поверхностного датчика температуры.
ПРИМЕЧАНИЕ: Точный контроль температуры имеет решающее значение, так как колебания могут повлиять на результаты. - Поместите пластиковую крышку со стороны 25 °C. С помощью аспиратора от мух аккуратно выпустите одну муху под крышкой. Расположите коробку над экспериментальной зоной, чтобы создать тусклый свет (<10 люкс) и дайте мухе акклиматизироваться в течение 1 минуты.
- После периода акклиматизации поднимите коробку и быстро отрегулируйте пластиковую крышку, расположив ее так, чтобы центр крышки был выровнен по границе стальной пластины, чтобы обеспечить равномерное покрытие сторон 25 °C и 31 °C.
ПРИМЕЧАНИЕ: Во время этого процесса температура воздуха и температура внутри крышки со стороны 31 °C увеличиваются примерно до 27 °C в течение 5 секунд (дополнительный рисунок 1), что достаточно для активации нагревательных элементов11. - Запустите пробную версию, включив камеру и синий свет (20 кЛюкс).
ПРИМЕЧАНИЕ: Не включайте синий свет в условиях комнатного освещения. Включите камеру и запишите несколько кадров перед включением синего света в случае движения. - По прошествии более 2 минут завершите испытание, выключив камеру и свет. Избавьтесь от мух с помощью аспиратора.
ПРИМЕЧАНИЕ: Запишите несколько дополнительных кадров в случае движения при выключении камеры.
- Выровняйте две стальные пластины на отдельных горячих пластинах так, чтобы их края встретились. Сверху поместите протектор из пластикового листа, закрепив его скотчем, чтобы свести к минимуму перемещения. Положите лист белой бумаги на защитную пленку листа, чтобы уменьшить сигналы фонового шума (рисунок 1C).
- Поведенческий и статистический анализ
- Анализируйте данные только тех мух, температура которых в начале испытания оставалась на стороне 25 °C.
ПРИМЕЧАНИЕ: Отбросьте данные от мух, начинающих испытания со стороны 31 °C, которые часто демонстрируют измененные предпочтения23. Отбросьте мух, которые не приближаются к краю 31 °C, чтобы убедиться, что они сделали выбор между температурами. Отбросьте данные от мух, которые остаются неподвижными более 30 секунд. - Анализируйте полученные результаты с помощью процедур, описанных ранее23. Рассчитайте индекс предпочтения (PI) как отношение разницы во времени, которое муха провела в каждой температурной зоне, к общему времени, как показано в следующей формуле:

ПРИМЕЧАНИЕ: Статистические данные об экспериментах представлены в подписях к рисункам. Анализ данных выполняется с использованием соответствующего программного обеспечения для анализа данных.
- Анализируйте данные только тех мух, температура которых в начале испытания оставалась на стороне 25 °C.
3. Оптогенетический анализ оптогенетических предпочтений одной мухи
- Штаммы дрозофил и выращивание мух
- Скрещиваем линию драйвера Gr66a-Gal421 с UAS-CsChrimson2, в результате чего получаем экспериментальный генотип Gr66a>CsChrimson. Gr66a>CsChrimson мухи экспрессируют CsChrimson в нейронах горького вкуса.
ПРИМЕЧАНИЕ: Убедитесь, что для каждого состояния используется равное количество самцов и самок мух.
- Скрещиваем линию драйвера Gr66a-Gal421 с UAS-CsChrimson2, в результате чего получаем экспериментальный генотип Gr66a>CsChrimson. Gr66a>CsChrimson мухи экспрессируют CsChrimson в нейронах горького вкуса.
- Постановка и проведение экспериментального анализа
- Проведите анализ в темной комнате или затемненной среде, чтобы обеспечить контролируемую активацию CsChrimson (Рисунок 1D).
- Расположите видеокамеру на высоте примерно 45 см над экспериментальной поверхностью.
- Используйте видеокамеру без инфракрасного фильтра. Если видеокамера оснащена внутренним короткочастотным инфракрасным фильтром, блокирующим волны длиной волны более 700 нм, снимите его.
- Наклейте на объектив длинночастотный фильтр с длиной волны 830 нм с помощью суперклея для захвата инфракрасных длин волн. Эта регулировка необходима для регистрации движения мухи в условиях инфракрасного света.
- Расположите источник красного света навысоте 24 см над экспериментальной поверхностью, обеспечив интенсивность света около 2,5 кЛюкс (1000 мА).
ПРИМЕЧАНИЕ: Рекомендуется использовать соответствующую защиту для глаз, которая может отфильтровать красный лазер/свет. Лазерные защитные очки помогают предотвратить потенциальное повреждение глаз при прямом воздействии интенсивного красного света. - Используйте инфракрасный свет для визуализации мух внутри установки. Не снимайте его на протяжении всего эксперимента.
ПРИМЕЧАНИЕ: Избегайте бликов в экспериментальной зоне, вызванных инфракрасным светом; Блики могут усложнить анализ данных. - С помощью клея прикрепите инфракрасный фильтр дальнего пропускания 780 нм к половине пластиковой крышки.
ПРИМЕЧАНИЕ: Используйте любой фильтр длинных частот, который блокирует длины волн ниже 780 нм. Нефильтрованная сторона пропускает красный и инфракрасный свет, в то время как фильтруемая сторона пропускает только инфракрасный свет. - Поместите черный матовый материал под экспериментальную зону, чтобы свести к минимуму фоновый шум.
- Поместите одну муху под прозрачную пластиковую крышку (высота 2 мм × ширина 58 мм × длина 83 мм) с помощью аспиратора и дайте ей акклиматизироваться в течение 1 минуты.
- Подождите, пока муха не станет видна на нефильтрованной стороне. Начните испытание, включив видеокамеру и красный свет.
ПРИМЕЧАНИЕ: Камкордер подвержен движению сразу после запуска. Тщательно закрепите камеру во время записи и включите камеру за несколько секунд до записи, чтобы избежать отклонений от нормы, которые могут затруднить анализ. Не включайте красный свет до начала судебного разбирательства. - Запишите движение мухи в течение 1 минуты.
ПРИМЕЧАНИЕ: Откажитесь от испытаний, в которых муха не приближается к средней линии или не двигается более 15 секунд. - Через 1 минуту завершите испытание, выключив видеокамеру и свет. Избавьтесь от мух с помощью аспиратора.
ПРИМЕЧАНИЕ: Запишите несколько дополнительных кадров, чтобы избежать эффектов движения при выключении камеры.
- Поведенческий и статистический анализ
- Анализируйте полученные результаты с помощью процедур, описанных ранее23. Рассчитайте индекс предпочтения (PI) как отношение разницы между временем, проведенным мухой в зоне без фильтра и в зоне с фильтром, к общему времени, как показано в следующей формуле:

ПРИМЕЧАНИЕ: Статистические данные об экспериментах представлены в подписях к рисункам. Анализ данных выполняется с использованием соответствующего программного обеспечения для анализа данных.
- Анализируйте полученные результаты с помощью процедур, описанных ранее23. Рассчитайте индекс предпочтения (PI) как отношение разницы между временем, проведенным мухой в зоне без фильтра и в зоне с фильтром, к общему времени, как показано в следующей формуле:
4. Реакция на удлинение оптогенетического хоботка на красный свет
- Штаммы дрозофил и выращивание мух
- Пересечь линию драйвера Gr5a-Gal420 с UAS-CsChrimson2, в результате чего получится экспериментальный генотип, обозначенный как Gr5a>CsChrimson. Мухи Gr5a>CsChrimson экспрессируют CsChrimson в нейронах рецепторов сладкого вкуса.
ПРИМЕЧАНИЕ: Убедитесь, что для каждого состояния используется равное количество самцов и самок мух. - Голодает в течение 16-24 часов с ATR (ATR +) или без (ATR -) перед тестированием.
ПРИМЕЧАНИЕ: Для того, чтобы вызвать сильную реакцию, могут потребоваться более длительные периоды голодания.
- Пересечь линию драйвера Gr5a-Gal420 с UAS-CsChrimson2, в результате чего получится экспериментальный генотип, обозначенный как Gr5a>CsChrimson. Мухи Gr5a>CsChrimson экспрессируют CsChrimson в нейронах рецепторов сладкого вкуса.
- Постановка и проведение экспериментального анализа
- Обезболить мух путем охлаждения на льду (рисунок 1Е).
ПРИМЕЧАНИЕ: Избегайте прямого контакта мух со льдом. Ограничьте время охлаждения примерно до 1 минуты; Длительное охлаждение может привести к проблемам с восстановлением и смерти. - С помощью наконечника пипетки объемом 1000 мкл нанесите 7-10 небольших точек клея на предметные стекла.
ПРИМЕЧАНИЕ: Небольшие капли клея на предметном стекле гарантируют, что муха не погрузится в воду, и помогают предотвратить прилипание клея к ее хоботку или ножкам. - Расположите по одной ширинке, брюшной стороной вверх, на каждой клеевой точке. Следите за тем, чтобы грудная клетка и крылья соприкасались с клеем, чтобы свести к минимуму движение. Разверните крылья веером в каждую сторону, чтобы увеличить площадь клейкой поверхности.
ПРИМЕЧАНИЕ: Не размещайте мух слишком близко друг к другу, так как это может непреднамеренно активировать несколько мух во время воздействия света. - Дайте клею высохнуть около 10 минут.
- Перенесите предметные стекла в ящик для влажности (пластиковый ящик с влажными бумажными полотенцами) и дайте мухам восстановиться в течение 2 часов.
- Поместите предметное стекло под микроскоп. Используйте шприц, чтобы накачать каплю воды, чтобы насытить мух, предотвращая вызванное жаждой расширение хоботка.
- Вручную держите красную лазерную указку, чтобы посветить красным светом на хоботок/голову одной мухи (700 люкс), наблюдая за реакцией PER через микроскоп.
ПРИМЕЧАНИЕ: Защита глаз, которая может отфильтровать красный лазер/свет, имеет важное значение при наблюдении за красным светом через микроскоп. - Наблюдайте и регистрируйте расширение хоботка в течение 30 секунд. Оцените каждую муху с помощью следующей системы регистрации: 0 указывает на отсутствие расширения, 0,5 — на 1-2 с, 1 — на 3 с.
- После тестирования светового индуцированного расширения хоботка исследуйте реакцию на 4% сахарозу с помощью шприца. Вытолкните капельку сахарозы на конце иглы и поднесите ее поближе к хоботку мухи.
ПРИМЕЧАНИЕ: Отбросьте данные от мух, которые не реагируют на каплю сахарозы.
- Обезболить мух путем охлаждения на льду (рисунок 1Е).
- Поведенческий и статистический анализ
- Выполняйте статистический анализ с помощью соответствующего программного обеспечения для анализа данных.
ПРИМЕЧАНИЕ: Статистические данные об экспериментах представлены в подписях к рисункам.
- Выполняйте статистический анализ с помощью соответствующего программного обеспечения для анализа данных.
5. Оптогенетический лабиринт мух на красный свет
- Штаммы дрозофил и выращивание мух
- Скрещиваем линию драйвера Gr66a-Gal421 с UAS-CsChrimson2, в результате чего получаем экспериментальный генотип Gr66a>CsChrimson. Gr66a>CsChrimson мухи экспрессируют CsChrimson в нейронах горького вкуса.
ПРИМЕЧАНИЕ: Убедитесь, что в каждой группе одинаковое количество самцов и самок мух.
- Скрещиваем линию драйвера Gr66a-Gal421 с UAS-CsChrimson2, в результате чего получаем экспериментальный генотип Gr66a>CsChrimson. Gr66a>CsChrimson мухи экспрессируют CsChrimson в нейронах горького вкуса.
- Сборка лабиринта из мух
- Создайте лабиринт из мух, как показано на рисунке 1F.
ПРИМЕЧАНИЕ: В качестве альтернативы, можно напечатать на 3D-принтере компоненты лабиринта из мух, собрав их в соответствии с предыдущими описаниями25. - Разрежьте три пластиковые пробирки по 5 мл на нужную длину, чтобы получилась загрузочная пробирка, открытая прозрачная пробирка для тестирования и пробирка, покрытая фольгой. Прикрепите трубки к лабиринту мух, как показано на рисунке 1F.
- В зависимости от материала лабиринта разрежьте пробирки так, чтобы обеспечить равное расстояние для каждого условия испытания. В зависимости от длины камеры выдержки укоротите открытую пробирку в прозрачном лабиринте, в то время как пробирку, покрытую фольгой, укоротите, если лабиринт непрозрачен.
- Создайте лабиринт из мух, как показано на рисунке 1F.
- Постановка и проведение экспериментального анализа
- В темное время суток или при слабом освещении поместите в загрузочную трубу 10 самцов и 10 самок. Подсоедините загрузочную трубку к камере выдержки. Наклоните элеватор и осторожно постучайте по трубке, чтобы переместить мух в камеру хранения.
ПРИМЕЧАНИЕ: Опустите элеватор так, чтобы была открыта только половина камеры выдержки. Эта манипуляция облегчает перенос мух из загрузочной трубы в камеру выдержки. - После того, как мухи будут переведены в камеру выдержки, используйте элеватор, чтобы опустить мух между загрузочной трубой и отверстиями испытательной трубы. Затем снимите загрузочную трубку.
- Расположите лабиринт от мух на расстоянии примерно 13 см от источника красного света (1000 мА), не включая свет.
- Опустите элеватор до тех пор, пока камера выдержки не совпадет с отверстиями пробирки, что позволит мухам свободно перемещаться между обернутыми фольгой и открытыми пробирками. Одновременно включите красный свет, чтобы активировать CsChrimson. Убедитесь, что интенсивность красного света на поверхности открытой пробирки составляет около 40 кЛюкс.
ПРИМЕЧАНИЕ: Не включайте красный свет, пока камера выдержки не будет опущена и не совмещена с отверстиями в пробирке. Рекомендуется использовать соответствующую защиту глаз, которая может отфильтровать красный лазер/свет из-за интенсивной яркости красного света. - Мухи выбирают между трубкой, открытой красным светом, и затененной трубкой в течение одной минуты.
- Через 1 минуту поднимите элеватор между загрузочной трубой и отверстиями в испытательной трубе. Посчитайте мух в каждой трубке.
ПРИМЕЧАНИЕ: Учитываются только активные и неповрежденные мухи. - Очистите лифт и лабиринт полетов с помощью dH2O после каждой пробы.
- В темное время суток или при слабом освещении поместите в загрузочную трубу 10 самцов и 10 самок. Подсоедините загрузочную трубку к камере выдержки. Наклоните элеватор и осторожно постучайте по трубке, чтобы переместить мух в камеру хранения.
- Анализ данных и статистика
- Рассчитайте индекс предпочтения (PI) как отношение разницы в количестве мух между незакрытыми и закрытыми трубками к общему количеству мух, как показано в следующей формуле:

ПРИМЕЧАНИЕ: Статистические данные об экспериментах представлены в подписях к рисункам. Анализ данных выполняется с использованием соответствующего программного обеспечения для анализа данных
- Рассчитайте индекс предпочтения (PI) как отношение разницы в количестве мух между незакрытыми и закрытыми трубками к общему количеству мух, как показано в следующей формуле:
Результаты
Оптогенетический термотаксический анализ предпочтений на одной мухе в синем свете
Были протестированы четыре условия: комнатный свет без добавки ATR (комнатный свет, ATR -), комнатный свет с добавкой ATR (комнатный свет, ATR +), синий свет без добавки ATR (синий, ATR -) и синий свет с добавкой ATR (синий, ATR +). Первые три условия служили контрольными. В контрольных экспериментах мухи избегали стороны 31 °C. В синем свете при приеме добавок ATR мухи не проявляли предпочтения в диапазоне от 25 °C до 31 °C, что указывает на успешное ингибирование нейронов HC активацией GtACR2 (рис. 2A).
Оптогенетический анализ оптогенетических предпочтений на одной мухе
Были протестированы четыре условия: комнатный свет без дополнения ATR (комнатный свет, ATR -), комнатный свет с дополнением ATR (комнатный свет, ATR +), красный свет без дополнения ATR (красный, ATR -) и красный свет с дополнением ATR (красный, ATR +). Первые три условия служили контрольными. Мухи в контрольных условиях не проявляли предпочтений, с одинаковым распределением между обеими сторонами. Активация красного света с добавкой ATR (красный, ATR +) направляет мух в сторону избегания области красного света, предполагая, что нейроны, чувствительные к горькому излучению, активируются CsChrimson, чтобы стимулировать поведение избегания (рис. 2B). Мы наблюдали небольшую, но значимую разницу между самцами и самками (дополнительный рисунок 2), что может быть связано с ролью глоточных GR66a-положительных вкусовых клеток в опосредовании влечения к откладыванию яиц26.
Реакция на расширение оптогенетического хоботка на красный свет
Были протестированы четыре условия: комнатный свет без дополнения ATR (комнатный свет, ATR -), комнатный свет с дополнением ATR (комнатный свет, ATR +), красный свет без дополнения ATR (красный, ATR -) и красный свет с дополнением ATR (красный, ATR +). Первые три условия служили контрольными. Мухи в контрольных условиях показали минимальный ПЭР, что согласуется с отсутствием аппетитного стимула. Тем не менее, значительный PER наблюдался у мух при активации красным светом с добавкой ATR (красный, ATR +), что указывает на активацию сладких нейронов CsChrimson (рис. 2C).
Оптогенетический лабиринт мух на красный свет
Были протестированы четыре условия: комнатный свет без дополнения ATR (комнатный свет, ATR -), комнатный свет с дополнением ATR (комнатный свет, ATR +), красный свет без дополнения ATR (красный, ATR -) и красный свет с дополнением ATR (красный, ATR +). Первые три группы выполняли функции контрольных. В контрольных группах мухи не проявляли предпочтения между трубками, покрытыми фольгой, и незакрытыми. Под красным светом, с добавкой ПВО, мухи Gr66a>CsChrimson избегали открытой трубки, подверженной воздействию красного света, что указывает на активацию нейронов, чувствительных к горькому восприятию, что приводит к избегающему поведению (рис. 2D).
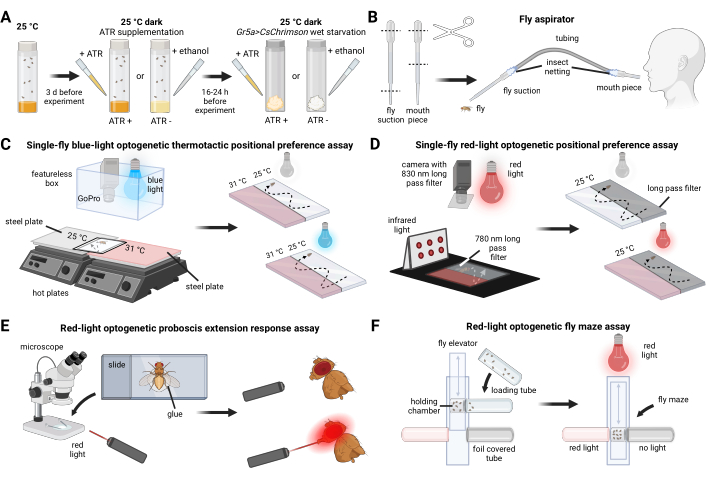
Рисунок 1: Обзор разведения мух, экспериментальных препаратов и поведенческих анализов. (А) Выращивание и подготовка мух. (Б) Конструкция аспиратора от мух. (C) Установка для оптогенетического термотаксического анализа предпочтений одиночной мухи в синем свете. (D) Установка для анализа оптогенетических предпочтений одиночной мухи в красном свете. (E) Установка для анализа ответа на расширение оптогенетического хоботка в красном свете. (F) Установка для оптогенетического анализа лабиринта мух на красный свет. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Результаты оптогенетического эксперимента. (A) Индекс предпочтения (PI) HC>GtACR2 в оптогенетическом термотаксическом анализе предпочтения одиночной мухи в синем свете. n = 26-31, данные представляют среднее значение ± S.E.M.; * p < 0,05, ** p < 0,01, *** p < 0,001, тест Манна-Уитни. (B) PI Gr66a>CsChrimson в анализе оптогенетических предпочтений одиночной мухи в красном свете. n = 20-21, данные представляют среднее значение ± S.E.M.; p < 0,0001, тест Манна-Уитни. (C) PI Gr5a>CsChrimson в ответе на расширение оптогенетического хоботка в красном свете. n = 36-44, данные представляют среднее значение ± S.E.M.; p < 0,0001, тест Манна-Уитни. (D) PI Gr66a>CsChrimson в анализе лабиринта оптогенетических мух на красном свете. n = 10, данные представляют среднее значение ± S.E.M.; * p < 0,05, ** p < 0,01, тест Манна-Уитни. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный рисунок 1. Изменения температуры в оптогенетическом термотаксическом анализе предпочтений одиночной мухи в синем свете. Температура изменяется на стороне 31 °C после позиционирования крышки со стороны 25 °C до тех пор, пока ее центр не совпадет с границей стальной пластины в оптогенетическом термотаксическом анализе предпочтения одиночной мухи в синем свете. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Самцы и самки мух Gr66a>CsChrimson ведут себя по-разному в оптогенетическом анализе оптогенетических предпочтений одной мухи в красном свете. n = 10, данные представляют среднее значение ± S.E.M.; * p < 0,05, тест Манна-Уитни. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Оптогенетические манипуляции преобразовали область нейробиологии, позволив точно управлять нейронными цепями с пространственно-временнойточностью. Нейронная цепь включает в себя популяции нейронов, соединенных между собой синапсами, выполняющих определенные функции при активации. Коннектом всего мозга дрозофилы был завершен, предлагая всестороннее понимание синаптических путей в мозге дрозофилы 28,29. В то время как коннектом может предсказывать потенциальные механизмы цепи, лежащие в основе определенного поведения, необходима дальнейшая экспериментальная проверка. Сочетая генетические инструменты и поведенческие анализы, оптогенетические манипуляции обеспечивают мощный подход к изучению роли нейронных цепей в поведенческих функциях. Например, интеграция транс-танго с оптогенетическими методами позволяет активировать или заглушить нижестоящие нейроны, что позволяет исследователям определить поведенческое значение отдельных постсинаптическихнейронов.
В этом исследовании были установлены простые, доступные и воспроизводимые оптогенетические протоколы для поведенческих анализов у Drosophila melanogaster. Разработав четыре экспериментальных подхода, нацеленных на отдельные нейронные цепи, мы демонстрируем, как можно эффективно достичь как активации, так и ингибирования нейронов. Результаты подтверждают использование CsChrimson и GtACR2 в исследовании различных поведенческих процессов, таких как термотаксис и вкусовые реакции, демонстрируя универсальность оптогенетических методов в исследованиях дрозофил.
Группа ATR продемонстрировала тенденцию, аналогичную группе ATR + в оптогенетическом анализе оптогенетических предпочтений одиночной мухи красного света (рисунок 2B). Эти результаты указывают на то, что эндогенный ATR может быть достаточным для активации низкого уровня белков CsChrimson. Хотя генетический контроль, такой как wildtype, Gal4 и контроль БАС, может помочь смягчить эти проблемы, у него есть свои проблемы. Например, органы управления БАС могут демонстрировать негерметичную экспрессию, а генетический фон может влиять на поведение. Таким образом, включение полного набора средств контроля, включая генетический контроль и контроль ATR, имеет важное значение для получения наиболее надежных и убедительных результатов. Традиционный метод оценки реакции на разгибание хоботка заключается в проталкивании мухи через наконечникпипетки 31. Мы используем клей для обездвиживания мух, что значительно повышает пропускную способность и снижает технические сложности. Помимо поведения избегания, оптогенетический лабиринт мух с красным светом также может быть использован для проверки привлекательного поведения, например, путем активации нейронов, которые управляют аппетитным поведением. Если необходимо выбрать поведение отслеживания мухи между двумя условиями, то пробирку можно закрыть с помощью инфракрасного фильтра длинных частот 780 нм вместо фольги.
Чтобы обеспечить успех оптогенетических манипуляций, выбор подходящего источника света имеет важное значение. При выборе следует учитывать следующие факторы: (1) Различные каналы родопсинов активируются под действием определенных длин волн света. Например, CsChrimson активируется красным светом с пиком на 590 нм, GtACR1 — зеленым светом с пиком на 515 нм, а GtACR2 — синим светом с пиком на 470 нм 2,3,4. Для активации и подавления одних и тех же нейронов CsChrimson и GtACR2 можно использовать в комбинации, чтобы избежать перекрестной активации5, в то время как GtACR1 не идеален для одновременного использования с CsChrimson. (2) Красный свет проникает в ткани мухи более эффективно и оказывает меньшее воздействие на фототаксисмухи 7. По возможности мы рекомендуем использовать каналы с красным смещением, такие как CsChrimson. (3) Интенсивность света имеет решающее значение для успеха. Низкая интенсивность может не активировать нейроны, в то время как чрезмерная интенсивность может изменить фототаксическое поведение или повредить ткани. Мы предлагаем начинать эксперименты с относительно высокой интенсивностью света и подвергать мух воздействию на минимально необходимую продолжительность. После того, как желаемое поведение будет замечено, постепенно уменьшайте интенсивность света - это может быть легко достигнуто путем увеличения расстояния между источником света и мухами - до тех пор, пока не будет определена оптимальная интенсивность.
Важнейшей целью этой работы является разработка протоколов, которые можно было бы легко внедрить в большинстве лабораторий дрозофил. В каждой установке используются общедоступные материалы и оборудование, что делает методы подходящими для лабораторий с ограниченными ресурсами. Описанные анализы являются экономически эффективными и удобными для пользователя, сводя к минимуму технические проблемы и обеспечивая воспроизводимость. Стоимость каждой установки колеблется от менее чем 10 долларов США для анализа ответа на расширение оптогенетического хоботка в красном свете (за исключением препарирующего микроскопа) до примерно 100 долларов США для анализа оптогенетического лабиринта мух в красном свете и анализа оптогенетических позиционных предпочтений для одной мухи в красном свете, до нескольких сотен долларов для оптогенетического термотаксического анализа позиционных предпочтений для одной мухи в синем свете, для которого требуется датчик температуры поверхности. совместимый термометр и две конфорки (записывающее оборудование не включено в эти оценки, так как его стоимость сильно варьируется, и многие лаборатории уже могут им обладать). Эта простота способствует внедрению оптогенетических инструментов в образовательных учреждениях. Несколько отчетов продемонстрировали применение оптогенетики дрозофилы в учебных лабораториях, что позволило студентам бакалавриата изучить принципы оптогенетики и понять, как сенсорные нейроны и их нисходящие нейронные цепи регулируют поведение 25,32,33.
В заключение, мы предоставляем простые в использовании, экономичные оптогенетические протоколы. Сосредоточившись на четких методологиях и воспроизводимых результатах, это исследование продвигает оптогенетику в качестве стандартного инструмента для нейробиологии, улучшая наше понимание нейронных функций с помощью легко реализуемых методов.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов в связи с публикацией данной статьи. Все авторы раскрыли любые потенциальные конфликты и утверждают, что у них нет финансовых или личных отношений, которые могли бы повлиять на работу, представленную в данном исследовании.
Благодарности
Принципиальные схемы для всех рисунков были созданы с Biorender.com. Эта работа была поддержана NIH R01GM140130 (https://www.nigms.nih.gov/) до L.N. Спонсоры не играли никакой роли в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| 1000 mA LED driver | Luxeon Star | 3021-D-E-1000 | |
| 5 mL VWR Culture Tubes, Plastic, with Dual-Position Caps | VWR | 60818-664 | |
| 780 Longpass Filter / IR 780 nm 100 mm x 100 mm | Lee Filters | BH #LE8744 | Cut to approximately 47 x 100 fit the plastic cover |
| Agfabric 6.5 ft. x 15 ft. Insect Bug Netting Garden Net for Protecting Plants Vegetables Flowers Fruits | The Home Depot | EIBNW6515 | |
| All trans retinal | Sigma-Aldrich | 116-31-4 | |
| Aluminum Plate (30.5 cm x 30.5 cm x 0.6 cm) | Amazon | purchased from Amazon | |
| Black Plastic Box | LI-COR | 929-97101 | |
| CALCIUM CHLORIDE ANHYDRO 25GR | Thermo Fisher Scientific | AC297150250 | |
| CX405 Handycam with Exmor R CMOS sensor | SONY | HDR-CX405 | |
| Elmer’s “School Glue” | Elmer | ||
| Ethyl alcohol, Pure (200 Proof) | Sigma-Aldrich | E7023 | |
| Fisherbrand Isotemp Hot Plate Stirrer | Fisher Scientific | SP88850200 | |
| Fly line: Gr5a-Gal4 | Bloomington Drosophila Stock Center | 57592 | |
| Fly line: Gr66a-Gal4 | Bloomington Drosophila Stock Center | 57670 | |
| Fly line: HC-Gal4 (II) | Dr. Marco Gallio Lab | A kind gift | |
| Fly line: UAS-CsChrimson | Bloomington Drosophila Stock Center | 55136 | |
| Fly line: UAS-GtACR2/TM6B | Dr. Quentin Gaudry Lab | A kind gift | |
| Flystuff 62-101 Yellow Cornmeal (11.3 Kg), Yellow, 11.3 Kg/Unit | Genesee Scientific | 62-101 | |
| Flystuff 62-107 Inactive Dry Yeast, 10 Kg, Nutritional Flake, 10 Kg/Unit | Genesee Scientific | 62-107 | |
| Flystuff 66-103 Nutri-Fly Drosophila Agar, Gelidium, 100 Mesh, 5 Kg (11.02 lbs)/Unit | Genesee Scientific | 66-103 | |
| FreeMascot OD 8+ 190 nm–420 nm / 600 nm–1100 nm Wavelength Violet/Red/Infrared Laser Safety Glasses | FreeMascot | B08LGMQ65S | purchased from Amazon |
| GoPro Hero8 Black | GoPro | 6365359 | |
| LEE Filters 100×100 mm Infra Red #87 Infrared Polyester Filter | B&H Photo | LE8744 | |
| Longpass Filter, Colored Glass, 50.8 x 50.8 mm, 830 nm Cut-on, RG830 | Newport | FSQ-RG830 | |
| Methyl 4-hydroxybenzoate, 99%, Thermo Scientific Chemicals | Thermo Fisher Scientific | 126960025 | |
| MicroWell Mini Tray 60 Well, Low Profile NS PS | Thermal Scientific | NUNC 439225 | The lids are used as the "plastic cover" |
| Olympus Plastics 24-160RS, 1000 µL Olympus Ergonomic Pipet Tips Low Binding, Racked, Sterile, 8 Racks of 96 Tips/Unit | Eppendorf | 24-160RS | |
| Parafilm M Sealing Film | Heathrow Scientific | HS234526B | 4 in x 125 feet |
| Potassium chloride, ACS, 99.0-100.5%, | Thermo Fisher Scientific | AA1159530 | |
| Prism | GraphPad | Version 9 | data analysis software |
| Samco Graduated Transfer Pipettes | Thermo Fisher Scientific | 225 | 3 mL |
| Slides | Fisher Scientific | 12-544-2 | 5 mm x 75 mm x 1.0 mm |
| Stereo microscope | OLYMPUS | CZ61 | |
| Styrofoam box (27 cm height × 22 cm width × 16 cm length) | |||
| Sucrose | Fisher Scientific | 225911 | |
| Surface temperature probe | Fluke | 80PK-3A | |
| Syringe | BD Integra | 305270 | |
| Tate & Lyle 457 Dextrose, Tate & Lyle, Pow, Tate & Lyle 457 Dextrose, Tate & Lyle, Powder, 50 lbs/Unit | Genesee Scientific | 62-113 | |
| Traceable Calibrated Big-Digit Thermocouple Thermometer | Traceable by cple-parmer | UX-91210-07 | Fisherbrand Traceable BigDigit Type K Thermometer |
| Triple blue LED starboard | LEDSupply | 07007-PB000-D | 470 nm |
| Triple red LED starboard | LEDSupply | 07007-PD000-F | 627 nm |
| Tygon PVC Clear Tubing 1/4" ID, 3/8" OD, 5 ft. Length | McMaster Carr Supply Company | 6516T21 | |
| Univivi IR Illuminator, 850nm 12 LEDs Wide Angle IR Illuminator for Night Vision | Univivi | 4331910725 | |
| Wakefield Thermal 25.4 mm Round Heatsink Star LED Board - 882-100AB | Wakefield-Vette | 882-100AB | |
| Wireless Presenter | DinoFire Store | B01410YNAM | purchased from Amazon |
Ссылки
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in neural systems. Neuron. 71 (1), 9-34 (2011).
- Klapoetke, N. C., et al. Independent optical excitation of distinct neural populations. Nat Methods. 11 (3), 338-346 (2014).
- Mauss, A. S., Busch, C., Borst, A. Optogenetic neuronal silencing in drosophila during visual processing. Sci Rep. 7 (1), 13823 (2017).
- Govorunova, E. G., Sineshchekov, O. A., Janz, R., Liu, X., Spudich, J. L. Neuroscience. Natural light-gated anion channels: A family of microbial rhodopsins for advanced optogenetics. Science. 349 (6248), 647-650 (2015).
- Castaneda, A. N., et al. Functional labeling of individualized postsynaptic neurons using optogenetics and trans-tango in drosophila (flipsot). PLoS Genet. 20 (3), e1011190 (2024).
- Fischer, F. P., et al. Drosophila melanogaster as a versatile model organism to study genetic epilepsies: An overview. Front Mol Neurosci. 16, 1116000 (2023).
- Aragon, M. J., et al. Multiphoton imaging of neural structure and activity in drosophila through the intact cuticle. Elife. 11, e69094 (2022).
- Zhang, W., Ge, W., Wang, Z. A toolbox for light control of drosophila behaviors through channelrhodopsin 2-mediated photoactivation of targeted neurons. Eur J Neurosci. 26 (9), 2405-2416 (2007).
- Kono, M., Goletz, P. W., Crouch, R. K. 11-cis- and all-trans-retinols can activate rod opsin: Rational design of the visual cycle. Biochemistry. 47 (28), 7567-7571 (2008).
- Gallio, M., Ofstad, T. A., Macpherson, L. J., Wang, J. W., Zuker, C. S. The coding of temperature in the drosophila brain. Cell. 144 (4), 614-624 (2011).
- Ni, L., et al. A gustatory receptor paralogue controls rapid warmth avoidance in drosophila. Nature. 500 (7464), 580-584 (2013).
- Weiss, L. A., Dahanukar, A., Kwon, J. Y., Banerjee, D., Carlson, J. R. The molecular and cellular basis of bitter taste in drosophila. Neuron. 69 (2), 258-272 (2011).
- Ling, F., Dahanukar, A., Weiss, L. A., Kwon, J. Y., Carlson, J. R. The molecular and cellular basis of taste coding in the legs of drosophila. J Neurosci. 34 (21), 7148-7164 (2014).
- Dethier, V. G. . The Hungry Fly: A Physiological Study of the Behavior Associated with Feeding. , (1976).
- Shiu, P. K., Sterne, G. R., Engert, S., Dickson, B. J., Scott, K. Taste quality and hunger interactions in a feeding sensorimotor circuit. Elife. 11, e79887 (2022).
- Kim, H., Kirkhart, C., Scott, K. Long-range projection neurons in the taste circuit of drosophila. Elife. 6, e23386 (2017).
- Sayeed, O., Benzer, S. Behavioral genetics of thermosensation and hygrosensation in drosophila. Proc Natl Acad Sci U S A. 93 (12), 6079-6084 (1996).
- Coya, R., Martin, F., Calvin-Cejudo, L., Gomez-Diaz, C., Alcorta, E. Validation of an optogenetic approach to the study of olfactory behavior in the t-maze of drosophila melanogaster adults. Insects. 13 (8), 662 (2022).
- Chu, L. A., Tai, C. Y., Chiang, A. S. Thirst-driven hygrosensory suppression promotes water seeking in drosophila. Proc Natl Acad Sci U S A. 121 (34), e2404454121 (2024).
- Chyb, S., Dahanukar, A., Wickens, A., Carlson, J. R. Drosophila gr5a encodes a taste receptor tuned to trehalose. Proc Natl Acad Sci U S A. 100 (Suppl 2), 14526-14530 (2003).
- Dunipace, L., Meister, S., Mcnealy, C., Amrein, H. Spatially restricted expression of candidate taste receptors in the drosophila gustatory system. Curr Biol. 11 (11), 822-835 (2001).
- Ratnayake, K., et al. Blue light excited retinal intercepts cellular signaling. Sci Rep. 8 (1), 10207 (2018).
- Huda, A., Omelchenko, A. A., Vaden, T. J., Castaneda, A. N., Ni, L. Responses of different drosophila species to temperature changes. J Exp Biol. 225 (11), jeb243708 (2022).
- Tyrrell, J. J., Wilbourne, J. T., Omelchenko, A. A., Yoon, J., Ni, L. Ionotropic receptor-dependent cool cells control the transition of temperature preference in drosophila larvae. PLoS Genet. 17 (4), e1009499 (2021).
- Fu, Z., Huda, A., Kimbrough, I. F., Ni, L. Using drosophila two-choice assay to study optogenetics in hands-on neurobiology laboratory activities. J Undergrad Neurosci Educ. 22 (1), A45-A50 (2023).
- Joseph, R. M., Heberlein, U. Tissue-specific activation of a single gustatory receptor produces opposing behavioral responses in drosophila. Genetics. 192 (2), 521-532 (2012).
- Riemensperger, T., Kittel, R. J., Fiala, A. Optogenetics in drosophila neuroscience. Methods Mol Biol. 1408, 167-175 (2016).
- Dorkenwald, S., et al. Neuronal wiring diagram of an adult brain. Nature. 634 (8032), 124-138 (2024).
- Schlegel, P., et al. Whole-brain annotation and multi-connectome cell typing of drosophila. Nature. 634 (8032), 139-152 (2024).
- Talay, M., et al. Transsynaptic mapping of second-order taste neurons in flies by trans-tango. Neuron. 96 (4), 783-795.e4 (2017).
- Shiraiwa, T., Carlson, J. R. Proboscis extension response (per) assay in drosophila. J Vis Exp. (3), e193 (2007).
- Pulver, S. R., Hornstein, N. J., Land, B. L., Johnson, B. R. Optogenetics in the teaching laboratory: Using channelrhodopsin-2 to study the neural basis of behavior and synaptic physiology in drosophila. Adv Physiol Educ. 35 (1), 82-91 (2011).
- Titlow, J. S., Johnson, B. R., Pulver, S. R. Light activated escape circuits: A behavior and neurophysiology lab module using drosophila optogenetics. J Undergrad Neurosci Educ. 13 (3), A166-A173 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены