Method Article
Verhaltensassays zur optogenetischen Manipulation neuronaler Schaltkreise in Drosophila melanogaster
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In dieser Arbeit werden Methoden zur optogenetischen Manipulation in Drosophila melanogaster vorgestellt, bei denen CsChrimson und GtACR2 verwendet werden, um spezifische Neuronen zu aktivieren und zum Schweigen zu bringen. Es werden vier Experimente beschrieben, die die Optogenetik nutzen, um thermotaktische und gustatorische Verhaltensweisen zu erforschen und Einblicke in die zugrunde liegenden neuronalen Mechanismen zu geben, die diese Prozesse steuern.
Zusammenfassung
Die Optogenetik hat sich zu einer grundlegenden Technik in den Neurowissenschaften entwickelt, die eine präzise Steuerung der neuronalen Aktivität durch Lichtstimulation ermöglicht. In dieser Studie werden einfach zu implementierende Setups für die Anwendung optogenetischer Methoden bei Drosophila melanogaster vorgestellt. Zwei optogenetische Werkzeuge, CsChrimson, ein durch rotes Licht aktivierter Kationenkanal, und GtACR2, ein durch blaues Licht aktivierter Anionenkanal, wurden in vier experimentellen Ansätzen eingesetzt. Drei dieser Ansätze beinhalten Einzelfliegenexperimente: (1) ein optogenetischer thermotaktischer Blaulicht-Positionspräferenz-Assay, der auf temperaturempfindliche Heizzellen abzielt, (2) ein optogenetischer Rotlicht-Positionspräferenz-Assay, der bitterempfindliche Neuronen aktiviert, und (3) ein Rüssel-Extensions-Response-Assay, der die süßen Neuronen aktiviert. Der vierte Ansatz (4) ist ein Fliegenlabyrinth-Setup, um Vermeidungsverhalten mit mehreren Fliegen zu bewerten. Die Fähigkeit, neuronale Aktivität zeitlich und räumlich zu manipulieren, bietet aussagekräftige Einblicke in die sensorische Verarbeitung und Entscheidungsfindung und unterstreicht das Potenzial der Optogenetik, unser Wissen über neuronale Funktionen zu erweitern. Diese Methoden bieten einen zugänglichen und robusten Rahmen für zukünftige Forschung in den Neurowissenschaften, um das Verständnis spezifischer neuronaler Bahnen und ihrer Verhaltensergebnisse zu verbessern.
Einleitung
Die Optogenetik hat sich in den Neurowissenschaften zu einer leistungsfähigen Technik entwickelt, die Optik und Genetik kombiniert und eine präzise, nicht-invasive Kontrolle der neuronalen Aktivität durch Lichtstimulation ermöglicht1. In Drosophila melanogaster, einem weit verbreiteten Modellorganismus, ermöglichen optogenetische Werkzeuge die Aktivierung und Hemmung bestimmter Neuronen, wodurch Forscher neuronale Schaltkreise modulieren können. Unter den verwendeten Werkzeugen bieten CsChrimson und GtACR (Guillardia Theta Anion Channel Rhodopsine) komplementäre Ansätze für neuronales Targeting. CsChrimson-Kanalrhodopsin, ein rotlichtempfindlicher Kationenkanal aus Grünalgen, erleichtert die neuronale Aktivierung durch Depolarisation, wenn er rotem Licht ausgesetzt wird, mit einer maximalen Aktivierung bei etwa 590 nm2. CsChrimson bietet eine bessere Gewebepenetration als frühere Channelrhodopsine und reduziert lichtinduzierte Verhaltensartefakte in Drosophila-Studien 2. Im Gegensatz dazu ist GtACR, zu dem Varianten wie GtACR2 gehören, ein lichtgesteuerter Chloridkanal, der Neuronen durch Hyperpolarisation zum Schweigen bringt 3,4. GtACR2 leitet Anionen und wird durch blaues Licht aktiviert, wobei die Spitzenaktivierung bei etwa 470 nmliegt 4. CsChrimson und GtACR2 werden durch unterschiedliche Wellenlängen des Lichts aktiviert, was eine präzise und unabhängige Steuerung der neuronalen Aktivität ohne Kreuzaktivierung gewährleistet5.
Drosophila ist aufgrund ihrer Kosteneffizienz, ihrer einfachen Aufzucht und ihrer robusten Verhaltensreaktionen auf Umweltreize, einschließlich Attraktivitäts- und Vermeidungsverhalten, ein effektives Modell für die neurowissenschaftliche Forschung6. Seine geringe Größe und die halbtransparente Kutikula verbessern das Eindringen von Licht, insbesondere von langwelligem rotem Licht, und ermöglichen eine effiziente optogenetische Manipulation 7,8. Während Drosophila-Zellen nicht genügend Retinal produzieren können, ein entscheidender Cofaktor für die Funktionalität von Channelrhodopsinen, gleicht die Zugabe von Retinal zu ihrer Ernährung diese Einschränkung aus und sorgt für eine effektive Aktivierung optogenetischer Werkzeuge9.
Um die Auswirkungen optogenetischer Manipulation bei Drosophila zu untersuchen, beschreiben wir vier Experimente, die auf verschiedene neuronale Schaltkreise und Verhaltensweisen abzielen und jeweils unterschiedliche Modalitäten verwenden, um entweder Vermeidung oder attraktive Reaktionen zu bewerten, die von Single-Fly-Assays bis hin zu gruppenbasierten Bewertungen reichen. Heizzellen (HC) in Drosophila sind thermosensorische Neuronen, die sich in der Arista befinden und auf Temperaturanstiege reagieren10. Diese Neuronen exprimieren wärmeempfindliche Ionenkanäle, die Vermeidungsverhalten auslösen und Fliegen von Wärmequellen wegleiten10,11. In Ansatz 1 verwendeten wir einen optogenetischen thermotaktischen Positionspräferenz-Assay mit einer einzigen Fliege, um HC-Neuronen zu manipulieren. Durch die Expression von GtACR2 in diesen Neuronen hemmten wir deren Aktivität bei Blaulicht-Exposition. Die Fliegen wurden zwei Temperaturoptionen ausgesetzt: 25 °C und 31 °C. Bei Raumlicht mieden die Fliegen die 31 °C heiße Seite und zeigten damit eine typische thermotaktische Reaktion. Die Aktivierung von GtACR2 durch blaues Licht brachte jedoch die HC-Neuronen zum Schweigen. Infolgedessen zeigten die Fliegen keine signifikante Temperaturpräferenz, was auf eine erfolgreiche optogenetische Hemmung hindeutet. Neben der Beurteilung der Funktion sensorischer Neuronen ermöglicht die Expression von GtACR2 in nachgeschalteten sensorischen Neuronen ähnliche optogenetische Manipulationen, um die neuronalen Schaltkreise zu untersuchen, die für bestimmte sensorische Modalitäten notwendig sind5.
Der gustatorische Rezeptor GR66a wird in Drosophila in den labialen Palpen am distalen Ende des Rüssels und in den Beinen exprimiert, was die Detektion von bitterem Geschmack vermittelt12,13. Diese Neuronen lösen als Reaktion auf Bitterstoffe Vermeidungsverhalten aus. In Ansatz 2 verwendeten wir einen optogenetischen Rotlicht-Positionspräferenz-Assay mit einer einzigen Fliege, um GR66a-exprimierende Neuronen zu manipulieren. Durch die Expression von CsChrimson in diesen Neuronen aktivierten wir sie bei Rotlichteinstrahlung. Die Fliegen wurden in einer Arena platziert, wobei die eine Hälfte rotem Licht ausgesetzt war und die andere Hälfte rotes Licht filterte. In Ermangelung von rotem Licht zeigten Fliegen keine Präferenz. Die Aktivierung von CsChrimson durch rotes Licht stimulierte jedoch die bitterempfindlichen Neuronen, was zu einer signifikanten Vermeidung des beleuchteten Bereichs führte, was die erfolgreiche optogenetische Aktivierung der GR66a-Neuronen bestätigt. Ähnliche Ansätze wurden verwendet, um die nachgeschalteten Kreisläufe von Heizzellen zu identifizieren, die für das Vermeidungsverhalten5 ausreichend sind.
In Ansatz 3 konzentrierten wir uns auf die optogenetische Aktivierung des appetitiven Verhaltens. GR5a-exprimierende Neuronen, die sich in den Geschmackssensillen an der Labellum und den Beinen befinden, erkennen Zucker und steuern das Fressverhalten. Die Aktivierung dieser Neuronen löst die Rüsselverlängerungsantwort (PER)14 aus. Wir verwendeten einen optogenetischen Rotlicht-Rüsselverlängerungs-Response-Assay, um GR5a-Neuronen zu aktivieren. Indem wir CsChrimson in diesen Neuronen exprimierten, stimulierten wir sie mit rotem Licht. Fliegen streckten ihren Rüssel unter Raumlichtbedingungen nicht aus. Die Aktivierung von CsChrimson durch rotes Licht führte jedoch zu einer Ausdehnung des Rüssels ohne süßen Stimulus, was eine erfolgreiche optogenetische Aktivierung von GR5a-Neuronen zeigt. Dieser Ansatz wurde verwendet, um den neuronalen Schaltkreis zu untersuchen, einschließlich gustatorischer sensorischer Neuronen, Geschmacksprojektionsneuronen und Rüssel-Motoneuronen15,16.
In Ansatz 4 untersuchten wir die optogenetische Aktivierung von Vermeidungsverhalten in Gruppen von Fliegen, indem wir einen optogenetischen Rotlicht-Fliegenlabyrinth-Assay verwendeten, der auf GR66a-Neuronen abzielte. Die Fliegen wurden an der Kreuzung zweier Röhren platziert: eine mit rotem Licht beleuchtet und die andere mit Schatten. Die CsChrimson-Expression in GR66a-Neuronen löste Vermeidung aus. In Abwesenheit von rotem Licht zeigten die Fliegen keine Präferenz, aber die Aktivierung von Rotlicht führte dazu, dass GR66a-exprimierende Fliegen rotes Licht mieden, was auf eine erfolgreiche Aktivierung des Signalwegs hindeutet. Fliegenlabyrinth-Assays werden häufig verwendet, um verschiedene sensorische Modalitäten zu untersuchen, einschließlich Temperatur, Luftfeuchtigkeit und Geruchssinn. In Kombination mit der Optogenetik ist dieser Ansatz leistungsfähig, um sowohl attraktives als auch Vermeidungsverhalten zu untersuchen 17,18,19.
Diese Methoden bieten einen reproduzierbaren Rahmen für die Untersuchung der optogenetischen Aktivierung und Hemmung neuronaler Schaltkreise von Drosophila . Durch die Verwendung einer Kombination aus verschiedenen Kanalrhodopsinen und zugänglichen Verhaltensassays demonstriert diese Proof-of-Concept-Studie die Wirksamkeit optogenetischer Manipulation und bietet einfache Methoden zur Manipulation neuronaler Schaltkreisfunktionen mit potenziell breiteren Anwendungen in der neurowissenschaftlichen Forschung.
Protokoll
1. Stämme, Fliegenaufzucht und Fliegensauger
- Beanspruchung und Wartung
- Zu den in den Experimenten verwendeten Stämmen gehören HC-Gal410, Gr5a-Gal420 (Bloomington Drosophila Stock Center (BDSC): 57592), Gr66a-Gal421 (BDSC: 57670), UAS-GtACR23, UAS-CsChrimson2 (BDSC: 55136). Das Heck fliegt bei 25 °C auf einem Standard-Maismehlmedium bei einem Dunkelzyklus von 12 h Licht: 12 Stunden.
HINWEIS: 1 l Maismehlmedium enthält 1 l dH2O, 79 g Dextrose, 7,5 g Agar, 24 g Flockenhefe, 57 g Maismehl, 2,1 g Methyl-4-hydroxybenzoat (gelöst in 11,1 ml Ethanol), 6 g Natriumkaliumtartrattetrahydrat und 0,9 g Calciumchlorid.
- Zu den in den Experimenten verwendeten Stämmen gehören HC-Gal410, Gr5a-Gal420 (Bloomington Drosophila Stock Center (BDSC): 57592), Gr66a-Gal421 (BDSC: 57670), UAS-GtACR23, UAS-CsChrimson2 (BDSC: 55136). Das Heck fliegt bei 25 °C auf einem Standard-Maismehlmedium bei einem Dunkelzyklus von 12 h Licht: 12 Stunden.
- Fliegenaufzucht und Versuchsvorbereitung
- Sortieren Sie 0 bis 3 Tage alte Fliegen. Zum Zeitpunkt des Experiments sind die Fliegen 3 bis 6 Tage alt, um eine altersbedingte Konsistenz zu gewährleisten (Abbildung 1A).
- Teilen Sie jeden Genotyp 3 Tage vor der Durchführung der Experimente in vier Gruppen ein: Raumlicht-ATR -, Raumlicht-ATR+, Rot- oder Blaulicht-ATR - und Rot- oder Blaulicht-ATR+.
- Bereiten Sie 80 mM ATR-Stammlösung vor, indem Sie ATR in 100 % Ethanol auflösen. Ergänzen Sie das Futter mit 400 μM ATR zu den ATR+ Gruppen.
- Ergänzen Sie das Futter mit der gleichen Konzentration an Ethanol, jedoch ohne ATR, zu den ATR-Gruppen.
- Heck alle Gruppen im Dunkeln22.
- Starve Gr5a>CsChrimson fliegt 16-24 Stunden lang in Fläschchen, die nur feuchtes Gewebe enthalten. Die ATR+ Fläschchen enthalten 400 μM ATR gemischt mit Wasser, während die ATR+ Fläschchen dH2O gemischt mit der gleichen Konzentration an Ethanol enthalten.
- Fliegen-Aspirator
- Montieren Sie den Fliegensauger (Abbildung 1B) mit Kunststoffschläuchen, Insektennetzen und zwei 3-ml-Transferpipetten.
- Schneiden Sie die Spitzen und Kügelchen der Transferpipetten ab und stellen Sie sicher, dass die Fliegensaugspitze einen bequemen Durchgang einer Fliege ermöglicht. Dieses Design ermöglicht eine sanfte Aspiration der Fliegen durch Inhalation, minimiert den Schaden und erleichtert das effiziente Einfangen und Übertragen einzelner Fliegen.
- Drapieren Sie ein Insektennetz über den Kunststoffschlauch und befestigen Sie die Kolbenenden der Pipette mit Parafilm am Schlauch.
2. Optogenetischer thermotaktischer Positionspräferenz-Assay mit einer einzigen Fliege mit blauem Licht
- Drosophila-Stämme und Fliegenaufzucht
- Kreuzen Sie die HC-Gal410-Treiberlinie mit UAS-GtACR23, was zum experimentellen Genotyp HC>GtACR2 führt. HC>GtACR2-Fliegen exprimieren GtACR2 in Heizzellen.
HINWEIS: Stellen Sie sicher, dass für jede Bedingung die gleiche Anzahl männlicher und weiblicher Fliegen verwendet wird.
- Kreuzen Sie die HC-Gal410-Treiberlinie mit UAS-GtACR23, was zum experimentellen Genotyp HC>GtACR2 führt. HC>GtACR2-Fliegen exprimieren GtACR2 in Heizzellen.
- Experimenteller Aufbau und Durchführung von Assays
- Richten Sie zwei Stahlplatten auf separaten Kochplatten so aus, dass sich ihre Kanten treffen. Legen Sie eine Plastikfolie darauf und sichern Sie sie mit Klebeband, um Bewegungen zu minimieren. Positionieren Sie ein weißes Blatt Papier auf der Schutzfolie, um Hintergrundgeräusche zu reduzieren (Abbildung 1C).
HINWEIS: Ersetzen Sie das weiße Papier zu Beginn jedes Experiments oder bei Verschmutzung. - Legen Sie eine durchsichtige Kunststoffabdeckung (2 mm Höhe × 58 mm Breite × 83 mm Länge) auf das weiße Papier. Diese Abdeckung lässt die Fliege frei laufen und verhindert gleichzeitig, dass sie fliegt.
- Schneiden Sie ein Loch in den Boden einer Styropor-Schaumstoffbox (27 cm Höhe × 22 cm Breite × 16 cm Länge), um die Kamera und das blaue Licht (1.000 mA) ca. 12 cm über der Versuchsfläche zu verkleben.
- Positionieren Sie die Kamera und das blaue Licht, um die Blendung zu minimieren und gleichzeitig die Aktivierung zu ermöglichen.
HINWEIS: Möglicherweise ist ein Vortest erforderlich, um den Aktivierungsbereich des blauen Lichts zu bestimmen. - Stellen Sie die Kamera so ein, dass sie mit den folgenden Einstellungen aufzeichnet: 1 s Zeitraffer, schmales Feld, 4000 × 3000 Pixel.
- Passen Sie die Kochplatteneinstellungen so an, dass auf den jeweiligen Stahlplatten eine Oberflächentemperatur von 25 ± 1 °C und 31 ± 1 °C erreicht wird.
HINWEIS: Für Bedingungen, die Temperaturen unter 25 °C erfordern, sind alternative Kühlmethoden wie Peltier-Geräte oder Eis erforderlich. Wenn die Temperaturen der Stahlplatten die gewünschten Werte überschreiten, besprühen Sie die Oberfläche mit destilliertem Wasser, um die erforderlichen Bedingungen zu erreichen und aufrechtzuerhalten. Verwenden Sie dann eine Serviette, um überschüssige Feuchtigkeit von der Plastikfolie aufzunehmen. - Überwachen Sie vor und nach jedem Versuch die Temperaturen mit einem Oberflächentemperaturfühler.
HINWEIS: Eine präzise Temperaturregelung ist entscheidend, da Schwankungen die Ergebnisse beeinflussen können. - Setzen Sie die Kunststoffabdeckung auf die 25 °C-Seite. Lassen Sie mit einem Fliegensauger vorsichtig eine einzelne Fliege unter der Abdeckung los. Positionieren Sie die Box über dem Versuchsbereich, um schwaches Licht (<10 Lux) zu erzeugen und die Fliege 1 Minute lang akklimatisieren zu lassen.
- Heben Sie nach der Eingewöhnungsphase die Box an und stellen Sie die Kunststoffabdeckung schnell ein, indem Sie sie so positionieren, dass die Mitte der Abdeckung mit der Stahlplattengrenze ausgerichtet ist, um eine gleichmäßige Abdeckung der Seiten von 25 °C und 31 °C zu gewährleisten.
HINWEIS: Während dieses Vorgangs steigen die Lufttemperatur und die Temperatur im Inneren der Abdeckung auf der 31 °C-Seite innerhalb von 5 s auf etwa 27 °C an (Ergänzende Abbildung 1), was ausreicht, um die Heizzellen11 zu aktivieren. - Starten Sie den Test, indem Sie die Kamera und das blaue Licht (20 kLux) einschalten.
HINWEIS: Schalten Sie das blaue Licht nicht bei Raumlicht ein. Schalten Sie die Kamera ein und nehmen Sie einige Bilder auf, bevor Sie das blaue Licht einschalten, falls es zu einer Bewegung kommt. - Beenden Sie den Test nach mehr als 2 Minuten, indem Sie die Kamera und das Licht ausschalten. Entsorgen Sie die Fliegen mit dem Sauger.
HINWEIS: Nehmen Sie einige zusätzliche Bilder auf, falls sich die Kamera ausschaltet.
- Richten Sie zwei Stahlplatten auf separaten Kochplatten so aus, dass sich ihre Kanten treffen. Legen Sie eine Plastikfolie darauf und sichern Sie sie mit Klebeband, um Bewegungen zu minimieren. Positionieren Sie ein weißes Blatt Papier auf der Schutzfolie, um Hintergrundgeräusche zu reduzieren (Abbildung 1C).
- Verhaltens- und statistische Analyse
- Analysieren Sie nur Daten von Fliegen, die sich zu Beginn des Versuchs auf der 25 °C-Seite befinden.
HINWEIS: Daten von Fliegen, die Versuche auf der 31 °C-Seite beginnen, sind zu verwerfen, die oft veränderte Präferenzen aufweisen23. Versuche mit Fliegen, die sich nicht dem Rand der 31 °C-Seite nähern, sind zu verwerfen, um sicherzustellen, dass sie eine Wahl zwischen den Temperaturen getroffen haben. Verwerfen Sie Daten von Fliegen, die länger als 30 s stationär bleiben. - Analysieren Sie die Ergebnisse mit den zuvor beschriebenen Verfahren23. Berechnen Sie den Präferenzindex (PI) als das Verhältnis der Zeitdifferenz, die die Fliege in jeder Temperaturzone verbracht hat, zur Gesamtzeit, wie in der folgenden Formel dargestellt:

HINWEIS: Statistische Details zu den Experimenten finden Sie in den Abbildungslegenden. Die Datenanalyse wird mit einer geeigneten Datenanalysesoftware durchgeführt.
- Analysieren Sie nur Daten von Fliegen, die sich zu Beginn des Versuchs auf der 25 °C-Seite befinden.
3. Optogenetischer Rotlicht-Positionspräferenz-Assay mit einer einzigen Fliege
- Drosophila-Stämme und Fliegenaufzucht
- Überqueren Sie die Gr66a-Gal421-Treiberlinie zu UAS-CsChrimson2, was zum experimentellen Genotyp Gr66a>CsChrimson führt. Gr66a>CsChrimson Fliegen exprimieren CsChrimson in bitteren Geschmacksneuronen.
HINWEIS: Stellen Sie sicher, dass für jede Bedingung die gleiche Anzahl männlicher und weiblicher Fliegen verwendet wird.
- Überqueren Sie die Gr66a-Gal421-Treiberlinie zu UAS-CsChrimson2, was zum experimentellen Genotyp Gr66a>CsChrimson führt. Gr66a>CsChrimson Fliegen exprimieren CsChrimson in bitteren Geschmacksneuronen.
- Experimenteller Aufbau und Durchführung von Assays
- Führen Sie den Assay in einem dunklen Raum oder einer abgedunkelten Umgebung durch, um eine kontrollierte Aktivierung von CsChrimson zu gewährleisten (Abbildung 1D).
- Positionieren Sie einen Camcorder ca. 45 cm über der Versuchsfläche.
- Verwenden Sie einen Camcorder ohne Infrarotfilter. Wenn ein Camcorder über einen internen Kurzpass-Infrarotfilter verfügt, der Wellenlängen von mehr als 700 nm blockiert, entfernen Sie ihn.
- Kleben Sie einen 830-nm-Langpassfilter mit Sekundenkleber über das Objektiv, um die Infrarotwellenlängen einzufangen. Diese Einstellung ist für die Aufzeichnung von Fliegenbewegungen unter Infrarotlichtbedingungen unerlässlich.
- Positionieren Sie eine rote Lichtquelle24 ca. 45 cm über der Versuchsfläche, um eine Lichtintensität von ca. 2,5 kLux (1.000 mA) zu gewährleisten.
HINWEIS: Es wird ein geeigneter Augenschutz empfohlen, der rote Laser/Lichter herausfiltern kann. Eine Laserschutzbrille hilft, mögliche Augenschäden durch direkte Einwirkung von intensivem rotem Licht zu vermeiden. - Verwenden Sie ein Infrarotlicht, um die Fliegen innerhalb des Setups zu visualisieren. Lassen Sie es während des gesamten Experiments eingeschaltet.
HINWEIS: Vermeiden Sie Blendung im Versuchsbereich, die durch das Infrarotlicht verursacht wird. Blendung kann die Datenanalyse erschweren. - Verwenden Sie Kleber, um einen 780-nm-Infrarot-Langpassfilter an der Hälfte der Kunststoffabdeckung zu befestigen.
HINWEIS: Verwenden Sie einen beliebigen Langpassfilter, der Wellenlängen unter 780 nm blockiert. Die ungefilterte Seite lässt rotes Licht und Infrarot durch, während die gefilterte Seite nur Infrarotlicht durchlässt. - Platzieren Sie ein schwarzes, mattes Material unter dem Versuchsbereich, um Hintergrundgeräusche zu minimieren.
- Legen Sie eine einzelne Fliege mit einem Fliegensauger unter eine durchsichtige Kunststoffabdeckung (2 mm Höhe × 58 mm Breite × 83 mm Länge) und lassen Sie sie 1 Minute lang akklimatisieren.
- Warten Sie, bis die Fliege auf der ungefilterten Seite sichtbar ist. Starten Sie die Testversion, indem Sie den Camcorder und das rote Licht einschalten.
HINWEIS: Der Camcorder reagiert sofort nach dem Start auf Bewegungen. Sichern Sie die Kamera während der Aufnahme gründlich und schalten Sie die Kamera einige Sekunden vor der Aufnahme ein, um Fehlbewegungen zu vermeiden, die die Analyse erschweren könnten. Schalten Sie das rote Licht erst zu Beginn der Testversion ein. - Zeichnen Sie die Bewegung der Fliege 1 Minute lang auf.
HINWEIS: Versuche, bei denen sich die Fliege nicht der Mittellinie nähert oder sich nicht länger als 15 s bewegt, sind zu verwerfen. - Beenden Sie die Testversion nach 1 Minute, indem Sie den Camcorder und das Licht ausschalten. Entsorgen Sie die Fliegen mit dem Sauger.
HINWEIS: Nehmen Sie einige zusätzliche Bilder auf, um die Auswirkungen von Bewegungen beim Ausschalten der Kamera zu vermeiden.
- Verhaltens- und statistische Analyse
- Analysieren Sie die Ergebnisse mit den zuvor beschriebenen Verfahren23. Berechnen Sie den Präferenzindex (PI) als Verhältnis der Differenz zwischen der Zeit, die die Fliege in dem Bereich ohne Filter verbracht hat, und dem Bereich mit dem Filter zur Gesamtzeit, wie in der folgenden Formel dargestellt:

HINWEIS: Statistische Details zu den Experimenten finden Sie in den Abbildungslegenden. Die Datenanalyse wird mit einer geeigneten Datenanalysesoftware durchgeführt.
- Analysieren Sie die Ergebnisse mit den zuvor beschriebenen Verfahren23. Berechnen Sie den Präferenzindex (PI) als Verhältnis der Differenz zwischen der Zeit, die die Fliege in dem Bereich ohne Filter verbracht hat, und dem Bereich mit dem Filter zur Gesamtzeit, wie in der folgenden Formel dargestellt:
4. Reaktion der optogenetischen Rüsselverlängerung durch rotes Licht
- Drosophila-Stämme und Fliegenaufzucht
- Überqueren Sie die Gr5a-Gal420-Treiberlinie mit UAS-CsChrimson2, was zu dem experimentellen Genotyp führt, der als Gr5a>CsChrimson bezeichnet wird. Gr5a>CsChrimson-Fliegen exprimieren CsChrimson in Rezeptorneuronen für süße Geschmacksrichtungen.
HINWEIS: Stellen Sie sicher, dass für jede Bedingung die gleiche Anzahl männlicher und weiblicher Fliegen verwendet wird. - Starve fliegt 16-24 h mit ATR (ATR+) oder ohne (ATR -) vor dem Testen.
HINWEIS: Längere Hungerperioden können erforderlich sein, um eine starke Reaktion hervorzurufen.
- Überqueren Sie die Gr5a-Gal420-Treiberlinie mit UAS-CsChrimson2, was zu dem experimentellen Genotyp führt, der als Gr5a>CsChrimson bezeichnet wird. Gr5a>CsChrimson-Fliegen exprimieren CsChrimson in Rezeptorneuronen für süße Geschmacksrichtungen.
- Experimenteller Aufbau und Durchführung von Assays
- Betäuben Sie Fliegen, indem Sie sie auf Eis abkühlen (Abbildung 1E).
HINWEIS: Vermeiden Sie den direkten Kontakt zwischen Fliegen und Eis. Begrenzen Sie die Abkühlzeit auf ca. 1 min; Längeres Abkühlen kann zu Erholungsproblemen und Sterblichkeit führen. - Tragen Sie mit der Spitze einer 1000-μl-Pipettenspitze 7-10 kleine Punkte Kleber auf die Objektträger auf.
HINWEIS: Kleine Leimtropfen auf der Rutsche sorgen dafür, dass der Hosenschlitz nicht untergetaucht wird, und verhindern, dass der Kleber an seinem Rüssel oder seinen Beinen kleben bleibt. - Positionieren Sie eine Fliege mit der Bauchseite nach oben auf jedem Klebepunkt. Stellen Sie sicher, dass der Brustkorb und die Flügel den Kleber berühren, um Bewegungen zu minimieren. Fächern Sie die Flügel zu jeder Seite auf, um die Klebefläche zu vergrößern.
HINWEIS: Vermeiden Sie es, Fliegen zu nah beieinander zu platzieren, da dies bei Lichteinwirkung versehentlich mehrere Fliegen aktivieren kann. - Lass den Kleber ca. 10 min trocknen.
- Übertragen Sie die Objektträger in eine Feuchtigkeitsbox (eine Plastikbox mit nassen Papiertüchern) und lassen Sie die Fliegen 2 Stunden lang ruhen.
- Legen Sie den Objektträger unter das Mikroskop. Verwenden Sie eine Spritze, um einen Tropfen Wasser zu verabreichen, um die Fliegen zu sättigen und durstbedingte Rüsselausdehnungen zu verhindern.
- Halten Sie manuell einen roten Laserpointer, um rotes Licht auf den Rüssel/Kopf einer einzelnen Fliege (700 Lux) zu richten, während Sie die PER-Reaktion durch das Mikroskop beobachten.
HINWEIS: Ein Augenschutz, der rote Laser/Licht herausfiltern kann, ist bei der Beobachtung des roten Lichts durch das Mikroskop unerlässlich. - Beobachten und Aufzeichnen der Rüsselausdehnung innerhalb eines 30-s-Fensters. Bewerten Sie jeden Flug mit dem folgenden Aufzeichnungssystem: 0 bedeutet keine Dehnung, 0,5 bedeutet 1-2 s Dehnung, 1 bedeutet, dass die Dehnung länger als 3 s dauert.
- Nach dem Testen der lichtinduzierten Rüsselverlängerung untersuchen Sie das Ansprechen auf 4% Saccharose mit einer Spritze. Stoße ein Tröpfchen Saccharose am Ende der Nadel aus und bringe es in die Nähe des Fliegenrüssels.
HINWEIS: Verwerfen Sie die Daten von Fliegen, die nicht auf das Saccharose-Tröpfchen reagieren.
- Betäuben Sie Fliegen, indem Sie sie auf Eis abkühlen (Abbildung 1E).
- Verhaltens- und statistische Analyse
- Führen Sie statistische Analysen mit geeigneter Datenanalysesoftware durch.
HINWEIS: Statistische Details zu den Experimenten finden Sie in den Abbildungslegenden.
- Führen Sie statistische Analysen mit geeigneter Datenanalysesoftware durch.
5. Optogenischer Rotlicht-Fliegenlabyrinth-Assay
- Drosophila-Stämme und Fliegenaufzucht
- Überqueren Sie die Gr66a-Gal421-Treiberlinie zu UAS-CsChrimson2, was zum experimentellen Genotyp Gr66a>CsChrimson führt. Gr66a>CsChrimson Fliegen exprimieren CsChrimson in bitteren Geschmacksneuronen.
HINWEIS: Stellen Sie sicher, dass jede Gruppe die gleiche Anzahl männlicher und weiblicher Fliegen enthält.
- Überqueren Sie die Gr66a-Gal421-Treiberlinie zu UAS-CsChrimson2, was zum experimentellen Genotyp Gr66a>CsChrimson führt. Gr66a>CsChrimson Fliegen exprimieren CsChrimson in bitteren Geschmacksneuronen.
- Fliegenlabyrinth-Montage
- Erstellen Sie das Fliegenlabyrinth wie in Abbildung 1F gezeigt.
HINWEIS: Alternativ können Sie die Komponenten des Fliegenlabyrinths in 3D drucken und wie zuvor beschriebenzusammenbauen 25. - Schneiden Sie drei 5-ml-Kulturröhrchen aus Kunststoff auf die richtige Länge, um ein Laderöhrchen, ein unbedecktes klares Reagenzglas und ein mit Folie bedecktes Reagenzglas herzustellen. Befestigen Sie die Rohre am Fliegenlabyrinth, wie in Abbildung 1F gezeigt.
- Schneiden Sie die Reagenzgläser je nach Labyrinthmaterial so ab, dass für jede Prüfbedingung der gleiche Abstand gewährleistet ist. Kürzen Sie basierend auf der Länge der Haltekammer das unbedeckte Reagenzglas in einem klaren Labyrinth, während Sie das mit Folie bedeckte Reagenzglas kürzen, wenn das Labyrinth undurchsichtig ist.
- Erstellen Sie das Fliegenlabyrinth wie in Abbildung 1F gezeigt.
- Experimenteller Aufbau und Durchführung von Assays
- Bei Dunkelheit oder schlechten Lichtverhältnissen 10 Männchen und 10 Hündinnen in das Laderohr setzen. Verbinden Sie das Laderohr mit der Haltekammer. Kippen Sie den Aufzug und klopfen Sie vorsichtig auf das Rohr, um die Fliegen in die Haltekammer zu befördern.
HINWEIS: Senken Sie den Aufzug so ab, dass nur die Hälfte der Warmhaltekammer offen ist. Diese Manipulation erleichtert den Transfer von Fliegen aus dem Laderohr in die Haltekammer. - Nachdem die Fliegen in die Haltekammer transportiert wurden, verwenden Sie den Aufzug, um die Fliegen zwischen dem Laderohr und den Löchern des Testrohrs abzusenken. Entfernen Sie dann das Laderohr.
- Positionieren Sie das Fliegenlabyrinth in einem Abstand von ca. 13 cm zur Rotlichtquelle (1000 mA), ohne das Licht einzuschalten.
- Senken Sie den Elevator ab, bis die Haltekammer mit den Löchern des Reagenzglases ausgerichtet ist, sodass sich die Fliegen frei zwischen den mit Folie umwickelten und den unbedeckten Reagenzgläsern bewegen können. Schalten Sie gleichzeitig das rote Licht ein, um CsChrimson zu aktivieren. Stellen Sie sicher, dass die Rotlichtintensität auf der Oberfläche des unbedeckten Reagenzglases etwa 40 kLux beträgt.
HINWEIS: Schalten Sie das rote Licht erst ein, wenn die Haltekammer abgesenkt und mit den Löchern des Reagenzglases ausgerichtet ist. Aufgrund der intensiven Helligkeit des roten Lichts wird ein geeigneter Augenschutz empfohlen, der rote Laser/Licht herausfiltern kann. - Die Fliegen wählen eine Minute lang zwischen der rotlichtexponierten Röhre und der schattierten Röhre.
- Heben Sie nach 1 Minute den Aufzug zwischen dem Laderohr und den Löchern des Testrohrs an. Zähle die Fliegen in jeder Tube.
HINWEIS: Es werden nur aktive und unverletzte Fliegen gezählt. - Reinigen Sie das Fliegenhöhenruder und das Fliegenlabyrinth nach jedem Versuch mit dH2O.
- Bei Dunkelheit oder schlechten Lichtverhältnissen 10 Männchen und 10 Hündinnen in das Laderohr setzen. Verbinden Sie das Laderohr mit der Haltekammer. Kippen Sie den Aufzug und klopfen Sie vorsichtig auf das Rohr, um die Fliegen in die Haltekammer zu befördern.
- Datenanalyse und Statistik
- Berechnen Sie den Präferenzindex (PI) als das Verhältnis der Differenz in der Fliegenzahl zwischen unbedeckten und abgedeckten Röhren zur Gesamtzahl der Fliegen, wie in der folgenden Formel dargestellt:

HINWEIS: Statistische Details zu den Experimenten finden Sie in den Abbildungslegenden. Die Datenanalyse wird mit einer geeigneten Datenanalysesoftware durchgeführt
- Berechnen Sie den Präferenzindex (PI) als das Verhältnis der Differenz in der Fliegenzahl zwischen unbedeckten und abgedeckten Röhren zur Gesamtzahl der Fliegen, wie in der folgenden Formel dargestellt:
Ergebnisse
Optogenetischer thermotaktischer Positionspräferenz-Assay mit einer einzigen Fliege mit blauem Licht
Es wurden vier Bedingungen getestet: Raumlicht ohne ATR-Supplementierung (Raumlicht, ATR -), Raumlicht mit ATR-Supplementierung (Raumlicht, ATR+), blaues Licht ohne ATR-Supplementierung (blau, ATR -) und blaues Licht mit ATR-Supplementierung (blau, ATR+). Die ersten drei Bedingungen dienten als Kontrollen. In Kontrollexperimenten mieden die Fliegen die 31 °C-Seite. In blauem Licht mit ATR-Supplementierung zeigten die Fliegen keine Präferenz zwischen 25 °C und 31 °C, was auf eine erfolgreiche Hemmung der HC-Neuronen durch GtACR2-Aktivierung hinweist (Abbildung 2A).
Optogenetischer Rotlicht-Positionspräferenz-Assay mit einer Fliege
Getestet wurden vier Bedingungen: Raumlicht ohne ATR-Supplementierung (Raumlicht, ATR -), Raumlicht mit ATR-Supplementierung (Raumlicht, ATR+), rotes Licht ohne ATR-Supplementierung (rot, ATR -) und rotes Licht mit ATR-Supplementierung (rot, ATR+). Die ersten drei Bedingungen dienten als Kontrollen. Fliegen unter Kontrollbedingungen zeigten keine Präferenz, mit ähnlicher Verteilung auf beiden Seiten. Die Aktivierung von Rotlicht mit ATR-Supplementierung (rot, ATR+) führte dazu, dass Fliegen den Rotlichtbereich meideten, was darauf hindeutet, dass bitterempfindliche Neuronen von CsChrimson aktiviert werden, um das Vermeidungsverhalten zu steuern (Abbildung 2B). Wir beobachteten einen geringen, aber signifikanten Unterschied zwischen Männchen und Weibchen (Ergänzende Abbildung 2), der möglicherweise auf die Rolle der pharyngealen GR66a-positiven Geschmackszellen bei der Vermittlung der Eiablageattraktion zurückzuführenist 26.
Optogenetische Reaktion auf die Verlängerung des Rüssels mit rotem Licht
Getestet wurden vier Bedingungen: Raumlicht ohne ATR-Supplementierung (Raumlicht, ATR -), Raumlicht mit ATR-Supplementierung (Raumlicht, ATR+), rotes Licht ohne ATR-Supplementierung (rot, ATR -) und rotes Licht mit ATR-Supplementierung (rot, ATR+). Die ersten drei Bedingungen dienten als Kontrollen. Fliegen zeigten unter kontrollierten Bedingungen ein minimales PER, was mit dem Fehlen eines appetitiven Stimulus übereinstimmt. Bei Fliegen unter Rotlichtaktivierung mit ATR-Supplementierung (rot, ATR+) wurde jedoch eine signifikante PER beobachtet, was auf eine Aktivierung von süß empfindenden Neuronen durch CsChrimson hinweist (Abbildung 2C).
Optogenischer Rotlicht-Fliegenlabyrinth-Assay
Getestet wurden vier Bedingungen: Raumlicht ohne ATR-Supplementierung (Raumlicht, ATR -), Raumlicht mit ATR-Supplementierung (Raumlicht, ATR+), rotes Licht ohne ATR-Supplementierung (rot, ATR -) und rotes Licht mit ATR-Supplementierung (rot, ATR+). Die ersten drei Gruppen dienten als Kontrollen. In den Kontrollgruppen zeigten die Fliegen keine Präferenz zwischen den folienbedeckten und unbedeckten Röhren. Unter rotem Licht und mit ATR-Supplementierung mieden Gr66a>CsChrimson-Fliegen die unbedeckte Röhre, die rotem Licht ausgesetzt war, was darauf hindeutet, dass die Aktivierung von bitter empfindenden Neuronen das Vermeidungsverhalten antreibt (Abbildung 2D).
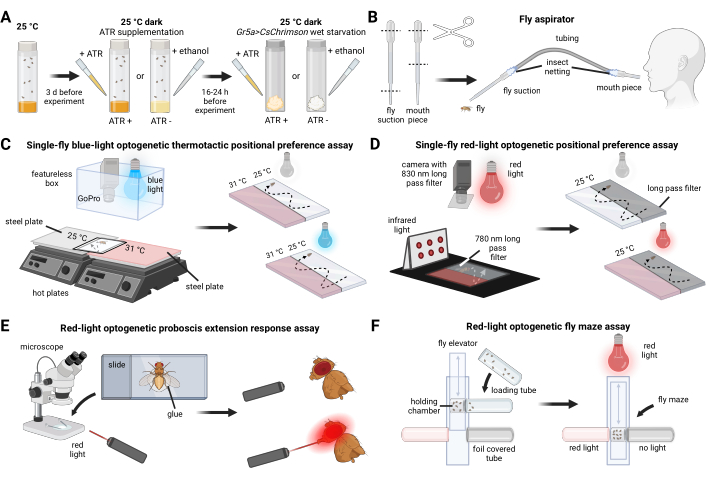
Abbildung 1: Überblick über die Fliegenaufzucht, experimentelle Vorbereitungen und Verhaltensassays. (A) Fliegenaufzucht und -vorbereitung. (B) Konstruktion des Fliegensaugers. (C) Aufbau für den optogenetischen thermotaktischen Positionspräferenz-Assay mit einer einzigen Fliege. (D) Aufbau für den optogenetischen Einzelflug-Rotlicht-Positionspräferenz-Assay. (E) Aufbau für den optogenetischen Rotlicht-Rüsselverlängerungs-Reaktions-Assay. (F) Aufbau für den optogenetischen Rotlicht-Fliegenlabyrinth-Assay. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Ergebnisse des optogenetischen Experiments. (A) Preference Index (PI) von HC>GtACR2 im optogenetischen thermotaktischen Positionspräferenz-Assay mit einer einzigen Fliege mit blauem Licht. n = 26-31, die Daten stellen den Mittelwert ± S.E.M. dar; * p < 0,05, ** p < 0,01, *** p < 0,001, Mann-Whitney-Test. (B) PI von Gr66a>CsChrimson im optogenetischen Positionspräferenz-Assay mit einer einzigen Fliege mit rotem Licht. n = 20-21, die Daten stellen den Mittelwert ± S.E.M. dar; p < 0,0001, Mann-Whitney-Test. (C) PI von Gr5a>CsChrimson in der optogenetischen Rüsselverlängerungsantwort mit rotem Licht. n = 36-44, die Daten stellen den Mittelwert ± S.E.M. dar; p < 0,0001, Mann-Whitney-Test. (D) PI von Gr66a>CsChrimson im optogenetischen Rotlicht-Fliegenlabyrinth-Assay. n = 10, die Daten stellen den Mittelwert ± S.E.M. dar; * p < 0,05, ** p < 0,01, Mann-Whitney-Test. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1. Die Temperaturänderungen im optogenetischen thermotaktischen Positionspräferenz-Assay mit einer einzigen Fliege mit blauem Licht. Die Temperatur ändert sich auf der 31 °C-Seite, nachdem die Abdeckung von der 25 °C-Seite positioniert wurde, bis ihre Mitte mit der Stahlplattengrenze im optogenetischen thermotaktischen Positionspräferenztest mit einer einzigen Fliege übereinstimmt. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Männliche und weibliche Gr66a>CsChrimson-Fliegen verhalten sich im optogenetischen Positionspräferenz-Assay mit einer einzigen Fliege unterschiedlich. n = 10, die Daten stellen den Mittelwert ± S.E.M. dar; * p < 0,05, Mann-Whitney-Test. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Die optogenetische Manipulation hat das Gebiet der Neurowissenschaften verändert, indem sie die präzise Steuerung neuronaler Schaltkreise mit raumzeitlicher Genauigkeit ermöglicht27. Ein neuronaler Schaltkreis umfasst Populationen von Neuronen, die durch Synapsen miteinander verbunden sind und bei der Aktivierung bestimmte Funktionen ausführen. Das Drosophila-Ganzhirnkonnektom wurde fertiggestellt und bietet umfassende Einblicke in die synaptischen Signalwege im Drosophila-Gehirn 28,29. Während das Konnektom potenzielle Schaltungsmechanismen vorhersagen kann, die bestimmten Verhaltensweisen zugrunde liegen, ist eine weitere experimentelle Validierung erforderlich. Durch die Kombination von genetischen Werkzeugen und Verhaltensassays bietet die optogenetische Manipulation einen leistungsstarken Ansatz zur Erforschung der Rolle neuronaler Schaltkreise bei Verhaltensfunktionen. Zum Beispiel ermöglicht die Integration von Trans-Tango mit optogenetischen Techniken die Aktivierung oder Stilllegung nachgeschalteter Neuronen, was es den Forschern ermöglicht, die Verhaltensbedeutung einzelner postsynaptischer Neuronen zu bestimmen 5,30.
Diese Studie etablierte einfache, zugängliche und reproduzierbare optogenetische Protokolle für Verhaltensassays bei Drosophila melanogaster. Durch die Entwicklung von vier experimentellen Ansätzen, die auf unterschiedliche neuronale Schaltkreise abzielen, zeigen wir, wie sowohl die Aktivierung als auch die Hemmung von Neuronen effizient erreicht werden können. Die Ergebnisse bestätigen die Verwendung von CsChrimson und GtACR2 bei der Untersuchung verschiedener Verhaltensweisen wie Thermotaxis und gustatorische Reaktionen und zeigen die Vielseitigkeit optogenetischer Techniken in der Drosophila-Forschung .
Die ATR-Gruppe zeigte einen ähnlichen Trend wie die ATR+-Gruppe im Single-Fly-Rotlicht-Positionspräferenz-Assay (Abbildung 2B). Diese Ergebnisse deuten darauf hin, dass endogene ATR ausreichen könnte, um ein niedriges Gehalt an CsChrimson-Proteinen zu aktivieren. Genetische Kontrollen wie Wildtyp-, Gal4- und UAS-Kontrollen können zwar dazu beitragen, diese Probleme zu mildern, haben aber ihre eigenen Probleme. Zum Beispiel können UAS-Steuerungen eine undichte Expression aufweisen, und der genetische Hintergrund kann das Verhalten beeinflussen. Daher ist die Einbeziehung eines umfassenden Satzes von Kontrollen, einschließlich genetischer und ATR-Kontrollen, unerlässlich, um die robustesten und überzeugendsten Ergebnisse zu gewährleisten. Die traditionelle Methode zur Beurteilung der Reaktion auf die Nasenverlängerung besteht darin, eine Fliege durch eine Pipettenspitze31 zu schieben. Wir verwenden Klebstoff, um Fliegen zu immobilisieren, was den Durchsatz erheblich erhöht und die technischen Herausforderungen verringert. Neben dem Vermeidungsverhalten kann der optogenetische Rotlicht-Fliegenlabyrinth-Assay auch verwendet werden, um attraktive Verhaltensweisen zu testen, z. B. durch die Aktivierung von Neuronen, die appetitives Verhalten steuern.Wenn das Verhalten der Tracking-Fliege zwischen den beiden Bedingungen gewählt werden soll, kann das Reagenzglas mit einem 780-nm-Infrarot-Langpassfilter anstelle von Folie abgedeckt werden.
Um den Erfolg der optogenetischen Manipulation zu gewährleisten, ist die Auswahl einer geeigneten Lichtquelle unerlässlich. Folgende Faktoren sollten bei dieser Wahl berücksichtigt werden: (1) Unterschiedliche Kanalrhodopsine werden durch bestimmte Wellenlängen des Lichts aktiviert. Zum Beispiel wird CsChrimson durch rotes Licht mit einem Peak bei 590 nm aktiviert, GtACR1 wird durch grünes Licht mit einem Peak bei 515 nm aktiviert und GtACR2 wird durch blaues Licht mit einem Peak bei 470 nmaktiviert 2,3,4. Um dieselben Neuronen zu aktivieren und zum Schweigen zu bringen, können CsChrimson und GtACR2 in Kombination verwendet werden, um eine Kreuzaktivierungzu vermeiden 5, während GtACR1 nicht ideal für die gleichzeitige Anwendung mit CsChrimson ist. (2) Rotes Licht dringt effektiver in das Fliegengewebe ein und hat weniger Auswirkungen auf die Fliegenphototaxis7. Wann immer möglich, empfehlen wir die Verwendung von rotverschobenen Channelrhodopsinen, wie z. B. CsChrimson. (3) Die Intensität des Lichts ist entscheidend für den Erfolg. Eine niedrige Intensität kann die Neuronen nicht aktivieren, während eine übermäßige Intensität das phototaktische Verhalten verändern oder das Gewebe schädigen kann. Wir empfehlen, Experimente mit relativ hoher Lichtintensität zu beginnen und Fliegen für die minimal erforderliche Dauer zu belichten. Sobald das gewünschte Verhalten beobachtet wurde, reduzieren Sie die Lichtintensität allmählich - dies kann leicht erreicht werden, indem Sie den Abstand zwischen der Lichtquelle und den Fliegen vergrößern - bis die optimale Intensität identifiziert ist.
Ein wichtiges Ziel dieser Arbeit ist es, Protokolle zu entwickeln, die in den meisten Drosophila-Laboratorien einfach umzusetzen sind. Jedes Setup verwendet allgemein verfügbare Materialien und Geräte, so dass die Methoden für Labore mit begrenzten Ressourcen geeignet sind. Die beschriebenen Assays sind kostengünstig und benutzerfreundlich, minimieren technische Herausforderungen und gewährleisten die Reproduzierbarkeit. Die Kosten für jedes Setup reichen von weniger als 10 US-Dollar für den optogenetischen Rotlicht-Rüsselverlängerungs-Response-Assay (ohne das Präpariermikroskop) über etwa 100 US-Dollar für den optogenetischen Rotlicht-Fliegenlabyrinth-Assay und den optogenetischen Rotlicht-Positionspräferenz-Assay mit einer Fliege bis zu mehreren hundert Dollar für den optogenetischen thermotaktischen Positionspräferenz-Assay mit einer Fliege, der eine Oberflächentemperatursonde erfordert. ein kompatibles Thermometer und zwei Herdplatten (Aufzeichnungsgeräte sind in diesen Schätzungen nicht enthalten, da ihre Kosten stark variieren und viele Labore bereits über sie verfügen). Diese Einfachheit unterstützt die Einführung optogenetischer Werkzeuge in Bildungseinrichtungen. Mehrere Berichte haben die Anwendung der Drosophila-Optogenetik in Lehrlaboratorien gezeigt und es Studenten im Grundstudium ermöglicht, die Prinzipien der Optogenetik zu erforschen und zu verstehen, wie sensorische Neuronen und ihre nachgeschalteten neuronalen Schaltkreise Verhaltensweisen regulieren 25,32,33.
Zusammenfassend bieten wir leicht verständliche, ressourcenschonende optogenetische Protokolle an. Durch die Fokussierung auf klare Methoden und reproduzierbare Ergebnisse fördert diese Studie die Optogenetik als Standardwerkzeug für die Neurowissenschaften und verbessert unser Verständnis der neuronalen Funktion durch leicht implementierbare Techniken.
Offenlegungen
Die Autoren erklären, dass es keine Interessenkonflikte bezüglich der Veröffentlichung dieses Beitrags gibt. Alle Autoren haben mögliche Konflikte offengelegt und versichern, dass sie keine finanziellen oder persönlichen Beziehungen haben, die die in dieser Studie vorgestellte Arbeit beeinflussen könnten.
Danksagungen
Schematische Darstellungen für alle Abbildungen wurden mit Biorender.com erstellt. Diese Arbeit wurde unterstützt von NIH R01GM140130 (https://www.nigms.nih.gov/) to L.N. Die Geldgeber spielten keine Rolle beim Studiendesign, bei der Datenerhebung und -analyse, bei der Veröffentlichungsentscheidung oder bei der Vorbereitung des Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| 1000 mA LED driver | Luxeon Star | 3021-D-E-1000 | |
| 5 mL VWR Culture Tubes, Plastic, with Dual-Position Caps | VWR | 60818-664 | |
| 780 Longpass Filter / IR 780 nm 100 mm x 100 mm | Lee Filters | BH #LE8744 | Cut to approximately 47 x 100 fit the plastic cover |
| Agfabric 6.5 ft. x 15 ft. Insect Bug Netting Garden Net for Protecting Plants Vegetables Flowers Fruits | The Home Depot | EIBNW6515 | |
| All trans retinal | Sigma-Aldrich | 116-31-4 | |
| Aluminum Plate (30.5 cm x 30.5 cm x 0.6 cm) | Amazon | purchased from Amazon | |
| Black Plastic Box | LI-COR | 929-97101 | |
| CALCIUM CHLORIDE ANHYDRO 25GR | Thermo Fisher Scientific | AC297150250 | |
| CX405 Handycam with Exmor R CMOS sensor | SONY | HDR-CX405 | |
| Elmer’s “School Glue” | Elmer | ||
| Ethyl alcohol, Pure (200 Proof) | Sigma-Aldrich | E7023 | |
| Fisherbrand Isotemp Hot Plate Stirrer | Fisher Scientific | SP88850200 | |
| Fly line: Gr5a-Gal4 | Bloomington Drosophila Stock Center | 57592 | |
| Fly line: Gr66a-Gal4 | Bloomington Drosophila Stock Center | 57670 | |
| Fly line: HC-Gal4 (II) | Dr. Marco Gallio Lab | A kind gift | |
| Fly line: UAS-CsChrimson | Bloomington Drosophila Stock Center | 55136 | |
| Fly line: UAS-GtACR2/TM6B | Dr. Quentin Gaudry Lab | A kind gift | |
| Flystuff 62-101 Yellow Cornmeal (11.3 Kg), Yellow, 11.3 Kg/Unit | Genesee Scientific | 62-101 | |
| Flystuff 62-107 Inactive Dry Yeast, 10 Kg, Nutritional Flake, 10 Kg/Unit | Genesee Scientific | 62-107 | |
| Flystuff 66-103 Nutri-Fly Drosophila Agar, Gelidium, 100 Mesh, 5 Kg (11.02 lbs)/Unit | Genesee Scientific | 66-103 | |
| FreeMascot OD 8+ 190 nm–420 nm / 600 nm–1100 nm Wavelength Violet/Red/Infrared Laser Safety Glasses | FreeMascot | B08LGMQ65S | purchased from Amazon |
| GoPro Hero8 Black | GoPro | 6365359 | |
| LEE Filters 100×100 mm Infra Red #87 Infrared Polyester Filter | B&H Photo | LE8744 | |
| Longpass Filter, Colored Glass, 50.8 x 50.8 mm, 830 nm Cut-on, RG830 | Newport | FSQ-RG830 | |
| Methyl 4-hydroxybenzoate, 99%, Thermo Scientific Chemicals | Thermo Fisher Scientific | 126960025 | |
| MicroWell Mini Tray 60 Well, Low Profile NS PS | Thermal Scientific | NUNC 439225 | The lids are used as the "plastic cover" |
| Olympus Plastics 24-160RS, 1000 µL Olympus Ergonomic Pipet Tips Low Binding, Racked, Sterile, 8 Racks of 96 Tips/Unit | Eppendorf | 24-160RS | |
| Parafilm M Sealing Film | Heathrow Scientific | HS234526B | 4 in x 125 feet |
| Potassium chloride, ACS, 99.0-100.5%, | Thermo Fisher Scientific | AA1159530 | |
| Prism | GraphPad | Version 9 | data analysis software |
| Samco Graduated Transfer Pipettes | Thermo Fisher Scientific | 225 | 3 mL |
| Slides | Fisher Scientific | 12-544-2 | 5 mm x 75 mm x 1.0 mm |
| Stereo microscope | OLYMPUS | CZ61 | |
| Styrofoam box (27 cm height × 22 cm width × 16 cm length) | |||
| Sucrose | Fisher Scientific | 225911 | |
| Surface temperature probe | Fluke | 80PK-3A | |
| Syringe | BD Integra | 305270 | |
| Tate & Lyle 457 Dextrose, Tate & Lyle, Pow, Tate & Lyle 457 Dextrose, Tate & Lyle, Powder, 50 lbs/Unit | Genesee Scientific | 62-113 | |
| Traceable Calibrated Big-Digit Thermocouple Thermometer | Traceable by cple-parmer | UX-91210-07 | Fisherbrand Traceable BigDigit Type K Thermometer |
| Triple blue LED starboard | LEDSupply | 07007-PB000-D | 470 nm |
| Triple red LED starboard | LEDSupply | 07007-PD000-F | 627 nm |
| Tygon PVC Clear Tubing 1/4" ID, 3/8" OD, 5 ft. Length | McMaster Carr Supply Company | 6516T21 | |
| Univivi IR Illuminator, 850nm 12 LEDs Wide Angle IR Illuminator for Night Vision | Univivi | 4331910725 | |
| Wakefield Thermal 25.4 mm Round Heatsink Star LED Board - 882-100AB | Wakefield-Vette | 882-100AB | |
| Wireless Presenter | DinoFire Store | B01410YNAM | purchased from Amazon |
Referenzen
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in neural systems. Neuron. 71 (1), 9-34 (2011).
- Klapoetke, N. C., et al. Independent optical excitation of distinct neural populations. Nat Methods. 11 (3), 338-346 (2014).
- Mauss, A. S., Busch, C., Borst, A. Optogenetic neuronal silencing in drosophila during visual processing. Sci Rep. 7 (1), 13823 (2017).
- Govorunova, E. G., Sineshchekov, O. A., Janz, R., Liu, X., Spudich, J. L. Neuroscience. Natural light-gated anion channels: A family of microbial rhodopsins for advanced optogenetics. Science. 349 (6248), 647-650 (2015).
- Castaneda, A. N., et al. Functional labeling of individualized postsynaptic neurons using optogenetics and trans-tango in drosophila (flipsot). PLoS Genet. 20 (3), e1011190 (2024).
- Fischer, F. P., et al. Drosophila melanogaster as a versatile model organism to study genetic epilepsies: An overview. Front Mol Neurosci. 16, 1116000 (2023).
- Aragon, M. J., et al. Multiphoton imaging of neural structure and activity in drosophila through the intact cuticle. Elife. 11, e69094 (2022).
- Zhang, W., Ge, W., Wang, Z. A toolbox for light control of drosophila behaviors through channelrhodopsin 2-mediated photoactivation of targeted neurons. Eur J Neurosci. 26 (9), 2405-2416 (2007).
- Kono, M., Goletz, P. W., Crouch, R. K. 11-cis- and all-trans-retinols can activate rod opsin: Rational design of the visual cycle. Biochemistry. 47 (28), 7567-7571 (2008).
- Gallio, M., Ofstad, T. A., Macpherson, L. J., Wang, J. W., Zuker, C. S. The coding of temperature in the drosophila brain. Cell. 144 (4), 614-624 (2011).
- Ni, L., et al. A gustatory receptor paralogue controls rapid warmth avoidance in drosophila. Nature. 500 (7464), 580-584 (2013).
- Weiss, L. A., Dahanukar, A., Kwon, J. Y., Banerjee, D., Carlson, J. R. The molecular and cellular basis of bitter taste in drosophila. Neuron. 69 (2), 258-272 (2011).
- Ling, F., Dahanukar, A., Weiss, L. A., Kwon, J. Y., Carlson, J. R. The molecular and cellular basis of taste coding in the legs of drosophila. J Neurosci. 34 (21), 7148-7164 (2014).
- Dethier, V. G. . The Hungry Fly: A Physiological Study of the Behavior Associated with Feeding. , (1976).
- Shiu, P. K., Sterne, G. R., Engert, S., Dickson, B. J., Scott, K. Taste quality and hunger interactions in a feeding sensorimotor circuit. Elife. 11, e79887 (2022).
- Kim, H., Kirkhart, C., Scott, K. Long-range projection neurons in the taste circuit of drosophila. Elife. 6, e23386 (2017).
- Sayeed, O., Benzer, S. Behavioral genetics of thermosensation and hygrosensation in drosophila. Proc Natl Acad Sci U S A. 93 (12), 6079-6084 (1996).
- Coya, R., Martin, F., Calvin-Cejudo, L., Gomez-Diaz, C., Alcorta, E. Validation of an optogenetic approach to the study of olfactory behavior in the t-maze of drosophila melanogaster adults. Insects. 13 (8), 662 (2022).
- Chu, L. A., Tai, C. Y., Chiang, A. S. Thirst-driven hygrosensory suppression promotes water seeking in drosophila. Proc Natl Acad Sci U S A. 121 (34), e2404454121 (2024).
- Chyb, S., Dahanukar, A., Wickens, A., Carlson, J. R. Drosophila gr5a encodes a taste receptor tuned to trehalose. Proc Natl Acad Sci U S A. 100 (Suppl 2), 14526-14530 (2003).
- Dunipace, L., Meister, S., Mcnealy, C., Amrein, H. Spatially restricted expression of candidate taste receptors in the drosophila gustatory system. Curr Biol. 11 (11), 822-835 (2001).
- Ratnayake, K., et al. Blue light excited retinal intercepts cellular signaling. Sci Rep. 8 (1), 10207 (2018).
- Huda, A., Omelchenko, A. A., Vaden, T. J., Castaneda, A. N., Ni, L. Responses of different drosophila species to temperature changes. J Exp Biol. 225 (11), jeb243708 (2022).
- Tyrrell, J. J., Wilbourne, J. T., Omelchenko, A. A., Yoon, J., Ni, L. Ionotropic receptor-dependent cool cells control the transition of temperature preference in drosophila larvae. PLoS Genet. 17 (4), e1009499 (2021).
- Fu, Z., Huda, A., Kimbrough, I. F., Ni, L. Using drosophila two-choice assay to study optogenetics in hands-on neurobiology laboratory activities. J Undergrad Neurosci Educ. 22 (1), A45-A50 (2023).
- Joseph, R. M., Heberlein, U. Tissue-specific activation of a single gustatory receptor produces opposing behavioral responses in drosophila. Genetics. 192 (2), 521-532 (2012).
- Riemensperger, T., Kittel, R. J., Fiala, A. Optogenetics in drosophila neuroscience. Methods Mol Biol. 1408, 167-175 (2016).
- Dorkenwald, S., et al. Neuronal wiring diagram of an adult brain. Nature. 634 (8032), 124-138 (2024).
- Schlegel, P., et al. Whole-brain annotation and multi-connectome cell typing of drosophila. Nature. 634 (8032), 139-152 (2024).
- Talay, M., et al. Transsynaptic mapping of second-order taste neurons in flies by trans-tango. Neuron. 96 (4), 783-795.e4 (2017).
- Shiraiwa, T., Carlson, J. R. Proboscis extension response (per) assay in drosophila. J Vis Exp. (3), e193 (2007).
- Pulver, S. R., Hornstein, N. J., Land, B. L., Johnson, B. R. Optogenetics in the teaching laboratory: Using channelrhodopsin-2 to study the neural basis of behavior and synaptic physiology in drosophila. Adv Physiol Educ. 35 (1), 82-91 (2011).
- Titlow, J. S., Johnson, B. R., Pulver, S. R. Light activated escape circuits: A behavior and neurophysiology lab module using drosophila optogenetics. J Undergrad Neurosci Educ. 13 (3), A166-A173 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten