Method Article
Техника хронического краниального окна для повторных записей коры головного мозга во время анестезии у свиней
В этой статье
Резюме
В этом исследовании представлен масштабируемый, надежный и воспроизводимый метод повторных хронических записей коры головного мозга в модели свиньи. Метод находит применение в различных областях нейробиологии, включая исследования боли и диагностику неврологических заболеваний.
Аннотация
Записи коры головного мозга необходимы для извлечения нейронных сигналов для информирования различных приложений, включая интерфейсы мозг-компьютер и диагностику заболеваний. Каждая область применения предъявляет определенные требования к технике записи, и для длительной записи часто выбираются инвазивные решения. Однако инвазивные методы записи осложняются отказом устройства и неблагоприятными реакциями тканей, которые ставят под угрозу качество сигнала в долгосрочной перспективе.
Чтобы повысить надежность и качество хронических записей коры головного мозга при минимизации рисков, связанных с отказом устройства и тканевыми реакциями, мы разработали технику краниального окна. В этом протоколе мы рассказываем о методах имплантации и доступа к краниальному окну у молодых свиней ландрас, что облегчает временное размещение матрицы электрокортикографии (ЭКоГ) на твердой мозговой оболочке. Далее мы опишем, как корковые сигналы могут быть записаны с помощью метода краниального окна. Доступ к краниальному окну можно повторять несколько раз, но рекомендуется минимум 2 недели между операциями по имплантации и доступу, чтобы облегчить восстановление и заживление тканей.
Подход с использованием краниального окна успешно минимизировал распространенные режимы отказа электродов и реакцию тканей, что привело к стабильным и надежным корковым записям с течением времени. В качестве примера мы регистрировали потенциалы, связанные с событиями (ERP) из первичной соматосенсорной коры. Метод обеспечил высоконадежные записи, что также позволило оценить влияние вмешательства (высокочастотной стимуляции) на ERP. Отсутствие значительных отказов устройств и уменьшенное количество используемых электродов (два электрода, 43 сеанса записи, 16 животных) свидетельствуют об улучшении экономики исследований. Несмотря на то, что для установки электродов требуется незначительный хирургический доступ, этот метод дает такие преимущества, как снижение риска инфицирования и улучшение условий содержания животных.
В этом исследовании представлен масштабируемый, надежный и воспроизводимый метод хронических записей коры головного мозга с потенциальными приложениями в различных областях неврологии, включая исследования боли и диагностику неврологических заболеваний. Будущие адаптации могут распространить его использование на другие виды и методы записи, такие как внутрикорковые записи и методы визуализации.
Введение
В целом, цель записей коры головного мозга заключается в извлечении информации из нейронных сигналов в мозге. Эта информация может быть использована различными способами - управление внешним устройством, связь, диагностика заболеваний или реабилитация 1,2,3,4. Каждое приложение предъявляет уникальные требования к требуемому информационному содержанию и пространственному разрешению, а также к степени инвазивности, которая считается приемлемой. Таким образом, с момента открытия электроэнцефалограммы в 1929 году были разработаны записывающие решения с диапазоном инвазивности и пространственногоразрешения5.
В целом, их можно разделить на электроэнцефалографию (ЭЭГ), электрокортикографию (ЭКоГ) и внутрикорковую запись. ЭЭГ — это неинвазивный метод записи, который захватывает нейронные колебания и связанные с событиями потенциалы (ERP) всего мозга. Однако его способность определять источники этой активности ограничена из-за его низкого пространственного разрешения. ЭКоГ является более инвазивным методом, при котором электроды размещаются эпи- или субдурально, обычно охватывая меньшую часть коры головного мозга. Он имеет более высокое пространственное разрешение и может регистрировать ERP и поверхностные локальные полевые потенциалы (LFP). Таким образом, он может более точно локализовать источник мозговой активности, что делает его полезным, например, при выявлении происхождения очаговой эпилепсии. Внутрикортикальная запись является наиболее инвазивным методом записи и может регистрировать спайковую активность от отдельных нейронов, расположенных поверхностно или глубоко внутри мозга, и LFP от объема нейронов вокруг электродов. Эти сигналы имеют очень высокое пространственное разрешение и информативность, но производятся ограниченным подмножеством нейронов (1-10 нейронов на канал)6.
Чтобы извлекать информацию из мозга в течение длительных периодов времени (месяцы-годы), интерфейс должен быть стабильным и надежным, чтобы полученные сигналы продолжали представлять одну и ту же информацию в течение всего периода. Записи ЭЭГ требуют частой замены электродов, в результате чего их надежность варьируется от очень низкой до очень высокой 7,8,9,10. Поэтому для длительной записи часто выбирают ЭКоГ и интракортикальные методы. Тем не менее, оба эти метода требуют, чтобы состояние записывающего электрода, а также ткани, оставалось стабильным с течением времени. В то время как электрод обычно остается на одном и том же месте, граница электрод-ткань может изменяться из-за тканевых реакций или режимов разрушения электродов 11,12,13,14. Тканевые реакции включают гибель нейронов, кровоизлияние, биообрастание, реакцию на инородные тела, глиоз, инкапсуляцию, инфекцию, менингит и экструзию менингеальногослоя 15. Эти реакции ставят под угрозу регистрирующие возможности электродов 12,13. Распространенными видами разрушения электродов являются расслоение или утечка на изолированных деталях, расслоение или растрескивание поверхностного покрытия электрода, повреждение провода и дислокация электродов11,12.
Чтобы преодолеть режимы отказа электродов, мы рассмотрели жизнеспособность решения для временной установки электродов, которое также решает многие проблемы, связанные с тканевыми реакциями, а именно гибель нейронов, реакцию инородного тела, глиоз, инкапсуляцию и экструзию менингеа. Кроме того, последовательное размещение электродов было требованием для получения надежных и воспроизводимых нейронных записей. Поскольку электрод был размещен эпидурально на расстоянии нескольких миллиметров от нервной ткани, перемещение электрода не должно превышать 1 мм. Краниальное окно было спроектировано с размерами, предотвращающими чрезмерное перемещение между электродами. Развивая технику краниального окна, мы стремимся повысить надежность и качество сигнала в долгосрочной перспективе, а также устранить риск выхода из строя электрода.
протокол
Данный протокол утвержден Датским ветеринарным и продовольственным управлением при Министерстве продовольствия, сельского хозяйства и рыболовства Дании (протокол No 2020-15-0201-00514). В общей сложности 16 самок свиней породы ландрас прошли процедуры. По прибытии на объект животные весили около 20 кг, то есть им было около 2 месяцев. Они весили около 30 кг на момент имплантации и 40-60 кг в конце исследования. Процедуры состоят из операции по имплантации, хирургии доступа и терминальной хирургии (Рисунок 1).

Рисунок 1: Хронология экспериментальных процедур. Операция доступа (фаза II) может повторяться несколько раз. Рекомендуется интервал не менее 2 недель между операциями для восстановления и заживления ран между операциями. Аббревиатура: ERP = потенциал, связанный с событием. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
1. Операция по имплантации (Фаза I)
Примечание: Напечатанное на 3D-принтере окно черепа с полимолочной кислотой (PLA) (Рисунок 2) имплантировано для облегчения повторных записей из первичной соматосенсорной коры свиньи. Регистрируются ВП из-за электрической стимуляции локтевого нерва. Хирургическое вмешательство и закрытие раны проводятся таким образом, чтобы можно было получить доступ к краниальному окну и впоследствии его закрыть.

Рисунок 2: Дизайн черепного окна. (А) Вид сбоку на черепное окно с указанием высоты стен и основания, которое крепится к черепу. (B) Вид сверху с указанием диаметра черепной вдовы, отверстий для винтов, пространства для колпачка и окна. Краниальный оконный колпачок представляет собой цилиндр диаметром 22 мм и высотой 1 мм, который точно помещается в пространство колпачка. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Имплантация краниальных окон
- Подготовка к операции
ПРИМЕЧАНИЕ: Процессор данных (RZ2), рабочая станция (WS8) и ПК включаются перед началом операции. Заметки об операции делаются в электронной таблице не реже одного раза в 15 минут нестерильным исследователем, чтобы зафиксировать жизненно важные показатели (частоту сердечных сокращений,spO2,CO2 в конце выдоха, температуру тела), уровни анестезии (скорость инфузии пропофола, скорость инфузии фентанила, процент севофлурана), стадию операции и любые отклонения.- Транквилизацию животного проводят с помощью внутримышечной инъекции 5-7 мл смеси Золетила (в 1 мл содержалось 8,3 мг Тилетамина, 8,3 мг Золазепама, 8,3 мг Ксилацина и 1,7 мг Бутофанола).
Примечание: В этом конкретном исследовании кетамин был исключен из смеси Золетил, чтобы избежать блокирования NMDA-рецепторов. - Транспортировка животного в операционную. Интубируйте животное и подключите его к аппарату искусственной вентиляции легких.
- Установите катетер в ушную вену для введения пропофола, фентанила и физиологического раствора.
- Применение хирургической анестезии: севофлуран 1-2%, пропофол (10 мг/мл при введении при дозе 8 мг∙кг-1∙ч-1), фентанил (50 мкг/мл при введении при дозе 20 мкг∙кг-1∙ч-1).
- Отметьте место разреза стерильным маркером перед стерильным драпированием. Определите точку брегмы, проведя прямые линии между каждым ухом и контралатеральным глазом; точка брегмы находится на пересечении этих линий (рис. 3А). Следите за тем, чтобы разрез был немного латеральнее средней линии на стороне, контралатеральной к стимулируемой передней конечности.
- Поместите металлическую пластину под простыни и убедитесь в правильном размещении и стабильности перед началом операции.
- Транквилизацию животного проводят с помощью внутримышечной инъекции 5-7 мл смеси Золетила (в 1 мл содержалось 8,3 мг Тилетамина, 8,3 мг Золазепама, 8,3 мг Ксилацина и 1,7 мг Бутофанола).
- Доступ к черепу
ПРИМЕЧАНИЕ: В этой и последующих частях протокола все процедуры выполняются стерильным хирургом, если не указано иное.- Сделайте первоначальный разрез в дерме скальпелем немного латеральнее средней линии, как указано в шаге 1.1.1.5. Продолжайте разрез через кожу с помощью прижигания.
ПРИМЕЧАНИЕ: Не расширяйте разрез слишком далеко вперед, чтобы избежать больших лобных пазух свиньи. Если требуется больше места, продлите разрез с задней стороны. - Поместите ретрактор и удерживайте кожу с помощью щипцов и разрежьте аваскулярную соединительную ткань между надкостницей и подкожным участком (рис. 3B), чтобы обеспечить большую гибкость кожи и облегчить наложение швов на шаге 1.4. Отрегулируйте втягивающее устройство в соответствии с достигнутой гибкостью.
- Надрезать надкостницу и отделить ее от черепа с помощью надкостницыного элеватора. Отложите надкостницу в сторону с помощью ретрактора.
- Сделайте первоначальный разрез в дерме скальпелем немного латеральнее средней линии, как указано в шаге 1.1.1.5. Продолжайте разрез через кожу с помощью прижигания.
- Доступ к твердой мозговой оболочке
- Просверлите отверстие диаметром 10 мм спереди к линии сагиттального шва и сбоку от средней линии шва (рис. 3C). Начните с диаметра 15 мм, чтобы получить отверстие диаметром 10 мм на уровне твердой мозговой оболочки, поскольку закругленное сверло приведет к слегка сужающемуся отверстию.
- Установите краниальное окно в отверстие на ранней стадии, чтобы обеспечить хорошее прилегание.
- Переключитесь на сверло меньшего размера, когда твердая мозговая оболочка станет видимой, чтобы добиться максимальной ширины отверстия на уровне твердой мозговой оболочки. Обрежьте края с помощью Rongeurs.
- Имплантация краниальных окон
- Убедитесь, что краниальное окно помещается внутри и до дна отверстия и определите его глубину. Хотя это зависит от животных, убедитесь, что стенки краниального окна достигают твердой мозговой оболочки для хорошего прилегания, но не оказывают давления на мозг в любом месте.
- Отметьте отверстия для винтов с помощью ручной дрели, удерживая черепное окно на месте.
- Снимите черепное окно и просверлите отверстия глубиной не менее 4 мм. Проникните в череп для одного из винтов, чтобы использовать его в качестве заземления/ориентира для корковых записей.
- Поместите черепное окно (рисунок 3) и извлеките иглу из набора для инфузии бабочек. Измерьте глубину отверстий для винтов через краниальное окно с помощью тупой бабочки. Вставьте и закрепите в отверстие винт соответствующей длины.
ПРИМЕЧАНИЕ: Слишком длинный винт не сможет эффективно закрепить колпачок краниального окна. - Поместите U-образный соединитель под один винт, который перфорирует череп и касается твердой мозговой оболочки.
ПРИМЕЧАНИЕ: Важно, чтобы длина этого винта была больше толщины черепа, чтобы отрастающая кость не препятствовала контакту с твердой мозговой оболочкой.
- Подготовка к операции
- Имплантация периферическим проводом
ПРИМЕЧАНИЕ: Эта процедура может быть выполнена одновременно с имплантацией краниального окна. Это стерильная процедура. Чтобы предотвратить загрязнение места операции или области черепа, следует носить стерильную одежду.- Имплантация проводов рядом с локтевым нервом
- Применяйте электростимуляцию на уровне 5 мА к коже, касаясь кожи в задней дистальной части передней конечности двумя иглами (не проникающими) или другим стерильным куском металла, разделенным на 2 см. Ищите четкое сгибание копыта, которое указывает на то, что нерв проходит между этими двумя точками.
ПРИМЕЧАНИЕ: Конечность может потребоваться повернуть назад, чтобы задняя часть была более доступной. - Введите две иглы перпендикулярно ходу нерва на расстоянии примерно 2 см друг от друга. Снова проткните кожу примерно в 3 см от точки введения (рисунок 4A).
- Проверьте местоположение с помощью тестового стимула, приложенного к иглам с температурой 2 мА; Убедитесь, что видно четкое движение копыта.
- Пропустите проволоку Кунера через иглы и удалите иглы, оставив проволоку Кунера частично под кожей. Убедитесь, что неизолированная часть в середине провода находится под кожей для обоих проводов (рисунок 4B).
ПРИМЕЧАНИЕ: Если конечность была повернута назад, осторожно поверните ее вперед. - Прикрепите каждый разъем типа «крокодил» к изолированному концу двух проводов Кунера.
- Применяйте электростимуляцию на уровне 5 мА к коже, касаясь кожи в задней дистальной части передней конечности двумя иглами (не проникающими) или другим стерильным куском металла, разделенным на 2 см. Ищите четкое сгибание копыта, которое указывает на то, что нерв проходит между этими двумя точками.
- Установление порога двигателя
- Найдите порог двигателя методом вверх-вниз16,17; начните с 100 мкА, увеличивая с шагом 50 мкА, наблюдая и ощущая двигательную реакцию в области копыт. Пороговое значение ниже 1 мА обычно является допустимым.
- Запрограммируйте STG на выдачу 100 прямоугольных двухфазных симметричных стимулов с длительностью импульса 200 мкс при 2-кратном моторном пороге, за которым следует 100 стимулов с 10-кратным моторным порогом.
- Имплантация проводов рядом с локтевым нервом
- Запись сигналов коры головного мозга
- Попросите нестерильного исследователя установить предусилитель в нужное положение и подключить его к процессору данных (RZ2) с помощью оптоволоконных кабелей.
- Уменьшите дозу севофлурана до 0,5-1% (половина от его хирургического уровня) и контролируйте частоту сердечных сокращений, выдыхаемыйCO2 и артериальное давление (если доступно) для обеспечения адекватной и стабильной глубины анестезии. Увеличьте дозу пропофола и фентанила по мере необходимости.
- Попросите нестерильного исследователя прикрепить подставку к предусилителю (SI8) и поместить подставку (ZIF-clip) в держатель подставки, который установлен на магнитной подставке для микроманипулятора.
- Поместите стерильную драпировку вокруг микроманипулятора и прикрепите клейкую часть к сцене и держателю для сцены (рисунок 5A).
- Попросите нестерильного исследователя закрепить микроманипулятор с помощью магнитной подставки, окуните электрод μECoG в спирт и поместите его в головной стол (ZIF-clip).
ПРИМЕЧАНИЕ: Дайте электроду высохнуть, прежде чем устанавливать его на твердую мозговую оболочку. Обязательно прикасайтесь только к стерильной драпировке, покрывающей сцену, так как электрод μECoG не является стерильным. - Установите μECoG на место с помощью микроманипулятора и направляйте ватной палочкой. Подсоедините провода заземления μECoG к винту заземления с помощью разъема типа «крокодил».
- Уменьшите дозу севофлурана до 0%, контролируйте частоту сердечных сокращений, уровень CO2 с истекшим срокомгодности и артериальное давление (если доступно) для обеспечения адекватной и стабильной глубины анестезии, увеличивайте дозу пропофола и фентанила по мере необходимости.
- Предварительный просмотр сигналов в синапсе; Типичный диапазон сигнала составляет до ±100 мкВ.
- Если сигнал выглядит как жирная линия (указывающая на шум линии), попросите стерильного человека выполнить следующие действия: исследовать схему заземления и держать винт заземления и соединения сухими и изолированными от близлежащих тканей. Выясните, изолированы ли другие кабели от тела свиньи и хирургических инструментов. Если нет, используйте стерильную марлю, чтобы изолировать кабели от тела или хирургических инструментов.
- Если амплитуда сигнала превышает ±100 мкВ (что указывает на артефакты движения), убедитесь, что электрод подвешен и лежит на мозге, а кабели не перемещаются при движении свиньи из-за вентиляции или электрической стимуляции локтевого нерва.
- Если амплитуда сигнала меньше ± 20 мВ (что свидетельствует о плохом контакте или глубокой анестезии), убедитесь, что μECoG находится на головном мозге, а твердая мозговая оболочка и электрод гидратированы; При необходимости капните на электрод немного физиологического раствора. Убедитесь, что севофлуран был выключен, и уменьшите скорость инфузии пропофола (и, возможно, фентанила). Проведите тестовую стимуляцию и проверьте, видны ли вызванные реакции. Убедитесь, что неизолированная часть периферийного провода полностью находится под кожей.
ПРИМЕЧАНИЕ: Вызванные реакции обычно можно различить в одиночных развертках в режиме онлайн, но их также можно оценить в автономном режиме, используя в среднем 5-10 стимулов. Если пик виден в момент срабатывания, это артефакт стимуляции. Артефакт стимуляции будет мешать анализу данных.
- Положите на электрод стерильную марлю для поддержания хорошего контакта с тканями. Капните на марлю физраствор температуры тела, чтобы предотвратить высыхание тканей.
ПРИМЕЧАНИЕ: Поскольку эти записи являются эпидуральными, точная температура не имеет значения. С субдуральной записью это более критично. - Дайте электроду осесть (30 минут) и задокументируйте размещение электрода и настройку разъема заземления, чтобы обеспечить аналогичные последующие записи (рис. 5B-D). Начните запись и подождите 30 секунд перед началом программы стимуляции каждые 10 минут.
ПРИМЕЧАНИЕ: Регулярно проверяйте между записями, чтобы марля на электроде оставалась увлажненной, и при необходимости капайте физиологический раствор температуры тела. - Проведите вмешательство после трех раундов стимуляции (в качестве исходного уровня перед вмешательством). Повторяйте стимуляцию еще девять раундов.
ПРИМЕЧАНИЕ: Продолжайте регулярно проверять между записями, чтобы марля на электроде оставалась увлажненной, и при необходимости капайте физиологический раствор.
- Закрытие места установки имплантата
- Снимите марлю с электрода и снимите электрод с помощью микроманипулятора, аккуратно направляя его ватной палочкой.
- Попросите нестерильного исследователя извлечь и убрать на хранение микроманипулятор, электрод, головную часть и предусилитель и очистить электрод в соответствии с инструкциями производителя с помощью быстрого промывания деионизированной водой для удаления остатков ткани. Замочите электрод на срок до 4 часов в очистителе для линз, чтобы удалить ткани и белки с поверхности электрода, после чего промывайте его деионизированной водой, чтобы удалить очиститель линз с поверхности электрода. Перед хранением окуните электрод в изопропиловый спирт.
- Установите колпачок краниального окна, чтобы закрыть краниальное окно, убедившись, что он точно входит в краниальное окно. Не требует дополнительного крепления; Давление кожи на имплантат будет удерживать его на месте.
- Поместите мешочек с антибиотиком поверх колпачка краниального окна и закройте кожу подкожно одиночными рассасывающимися швами, используя технику наложения заглубленных вертикальных матрасных швов (рисунок 6A). Накладывайте швы на расстоянии 5-10 мм, что дает пространство для наложения кожных швов. Не завязывайте последние три шва после их наложения. Вместо этого завяжите эти три шва, когда все швы будут наложены.
ПРИМЕЧАНИЕ: Наложение последних трех швов после наложения всех трех гарантирует, что останется достаточно места для наложения последних швов. - Наложите на кожу непрерывные внутрикожные швы. Начните наложение внутрикожного шва на 1-2 см латеральнее места разреза и проложите туннель под кожей к дермальному слою кожи, но ниже его поверхности (рис. 6В), чтобы избежать чрезмерного расчесывания и ослабления швов. Завяжите узел на боковом конце шва.
ПРИМЕЧАНИЕ: Пропофол и фентанил можно отключить во время этой процедуры, так как у них есть несколько минут времени пробуждения. - Наложите непрерывный шов между подкожными швами до тех пор, пока не будет достигнута другая сторона разреза.
ПРИМЕЧАНИЕ: Важно, чтобы шов выходил из дермы, но не прокалывал кожу, чтобы животное меньше могло поцарапать швы. - Проложите шов на 1-2 см латеральнее разреза к месту бокового выхода и завяжите узел (рис. 6B). Нанесите тканевый клей на место разреза.
- Возвращение животного в домашний загон
- Снимите стерильные простыни с животного и отлучите животное от аппарата искусственной вентиляции легких, как только заметите движение.
- Переведите животное в домашний загон и держите его отдельно от соседа по загону в течение одной ночи.
ПРИМЕЧАНИЕ: Свиней разделяют после операции, так как для них нормально яростно пытаться разбудить партнера по загону, что приводит к ранам от укусов. Свиньи должны иметь возможность контактировать с мордой.

Рисунок 3: Имплантация черепного окна. (А) Предполагаемое местоположение точки брегмы определяется и отмечается на свинье до стерильной драпировки, так как впоследствии его может быть трудно различить. (В) После разреза кожи аваскулярный подкожный слой ослабляется с помощью ножниц. (C) В черепе просверливается отверстие диаметром 15 мм, а края удаляются с помощью ронжеров. Линии коронального и сагиттального швов выделены. (D) Черепное окно имплантируется и крепится с помощью винтов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
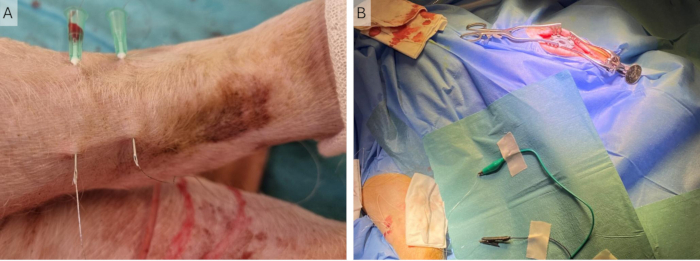
Рисунок 4: Имплантация периферических проводов. (A) Две иглы 23 G помещаются в кожу, и через них вставляются провода Кунера. (В) Иглы удаляются, а провода остаются в коже, подключенной к стимулятору с помощью зажимов типа «крокодил». Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Настройка записи в кору головного мозга. (A) Электродная решетка размещается на твердой мозговой оболочке, а держатель головной сцены и микроманипулятор находятся в стерильной втулке во время операции по имплантации, где разрез длиннее и латеральнее. (B) Крупный план μECoG в записывающей установке во время операции доступа, где разрез более медиальный. (C) Настройка заземления, при которой все заземляющие и опорные провода на ECoG замыкаются и подключаются через U-образный разъем к перикраниальному винту. (D) Крупный план головной сцены и держателя сцены во время операции доступа. μECoG размещается на твердой мозговой оболочке. Сокращения: ЭКоГ = электрокортикография; μECoG = микроECoG. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Техника наложения швов. (А) Схема подкожного заглубленного вертикального матраса. (B) Схема техники наложения непрерывных внутрикожных швов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
2. Доступная хирургия (II фаза)
Примечание: Через 2-4 недели краниальное окно открывается для последующей записи сигналов коры головного мозга от S1. Хирургическое вмешательство и закрытие раны снова выполняются таким образом, чтобы можно было получить доступ к краниальному окну и снова закрыть.
- Подготовка к операции
ПРИМЕЧАНИЕ: Шаги 2.1.1-2.1.6 аналогичны шагам 1.1.1.1-1.1.1.6.- Успокойте животное с помощью смеси золетила (5 мл золетила [тилетамин 25 мг/мл и золазепам 25 мг/мл], 6,25 мл ксилазина (20 мг/мл) и 2,5 мл буторфанола (10 мг/мл)).
Примечание: В этом конкретном исследовании кетамин был исключен из смеси золетила, чтобы избежать блокировки NMDA-рецепторов. - Транспортируйте животное в операционную, интубируйте и проветривайте его.
- Установите катетер в ушную вену. Введите пропофол, фентанил и физиологический раствор через катетер.
- Применение хирургической анестезии: севофлуран 1-2%, пропофол (10 мг/мл при введении при дозе 8 мг∙кг-1∙ч-1), фентанил (50 мкг/мл при введении при дозе 20 мкг∙кг-1∙ч-1).
- При необходимости отметьте место разреза стерильным маркером перед стерильным драпированием. Определите точку брегмы, проведя прямые линии между каждым ухом и контралатеральным глазом; брегма находится на пересечении этих линий (рис. 3А).
ПРИМЕЧАНИЕ: Первоначальный разрез обычно все еще виден. Новый разрез должен быть сделан на расстоянии не менее 30 мм от первоначального разреза, чтобы избежать большей части рубцовой ткани и облегчить закрытие раны. - Поместите металлическую пластину под простыни и убедитесь в правильном размещении и стабильности перед началом операции.
- Успокойте животное с помощью смеси золетила (5 мл золетила [тилетамин 25 мг/мл и золазепам 25 мг/мл], 6,25 мл ксилазина (20 мг/мл) и 2,5 мл буторфанола (10 мг/мл)).
- Доступ к краниальному окну
ПРИМЕЧАНИЕ: Шаги 2.2.1-2.2.3 аналогичны шагам 1.1.2.1-1.1.2.3.- Сделайте первоначальный разрез в дерме скальпелем немного латеральнее средней линии, как отмечено в шаге 2.1.5. Продолжайте разрез через кожу с помощью прижигания.
ПРИМЕЧАНИЕ: В случае терминального эксперимента разрез может быть сделан в том же месте, что и первоначальный разрез. - Поместите ретрактор и удерживайте кожу с помощью щипцов и разрежьте аваскулярную соединительную ткань между надкостницей и подкожным участком (рис. 3B), чтобы обеспечить большую гибкость кожи и облегчить наложение швов на шаге 1.4. Отрегулируйте втягивающее устройство в соответствии с достигнутой гибкостью.
ПРИМЕЧАНИЕ: Если это терминальный эксперимент, этот шаг можно пропустить. - Надрезать надкостницу и отделить ее от черепа с помощью надкостницыного подъемника. Отложите надкостницу в сторону с помощью ретрактора.
- Снимите колпачок краниального окна и удалите все соединительные вещества из отверстия легкими круговыми движениями ватной палочки, пока не будет достигнута твердая мозговая оболочка.
- Сделайте первоначальный разрез в дерме скальпелем немного латеральнее средней линии, как отмечено в шаге 2.1.5. Продолжайте разрез через кожу с помощью прижигания.
- Имплантация периферическим проводом
- Повторите шаг 1.2.
- Запись сигналов коры головного мозга
- Повторите шаг 1.3.
- Закрытие места установки имплантата
- Повторите шаг 1.4.
ПРИМЕЧАНИЕ: Если это терминальный эксперимент, этот шаг можно пропустить.
- Повторите шаг 1.4.
3. Терминальная хирургия (фаза III)
Примечание: Через 2-4 недели краниальное окно открывается для последующей записи сигналов коры головного мозга от S1. Шаги 2.2-2.5 повторяются, как описано выше, за ними следует шаг 3.1.
- Эвтаназия
ПРИМЕЧАНИЕ: Трубку катетера ушной вены необходимо промыть физиологическим раствором, чтобы предотвратить окисление барбитуратов.- Промойте катетер ушной вены физиологическим раствором.
- Прикрепите шприц с передозировкой пентобарбитала (10 мл, 400 мг/мл) и введите пентобарбитал через катетер ушной вены.
Результаты
С помощью техники краниального окна корковые сигналы были зарегистрированы в 43 сеансах у 16 животных. Животные выздоравливали после операции и содержались в парах на протяжении всего исследования и ежедневно контролировались с использованием схемы благополучия, приведенной в Дополнительной таблице S1. Все животные всегда получали оценку 0, что указывает на отличное благополучие. На рисунке 7 показано, что окна действительно были расположены над областью S1 коры головного мозга свиньи. Некоторые рубцы обычно наблюдались на твердой мозговой оболочке in vivo и после смерти (рис. 7A), но посмертное исследование показало, что они никогда не затрагивали нижележащую кортикальную ткань (рис. 7B), которая выглядела здоровой у всех животных и сопоставима с контралатеральной областью S1.

Рисунок 7: Расположение коркового окна по отношению к анатомии мозга. (А) Для изучения здоровья корковой ткани и расположения коркового окна по отношению к S1, черепное окно было удалено в конце исследования. В этом случае были использованы хирургические интервалы в 2 недели, и на твердой мозговой оболочке может наблюдаться некоторая рубцовая ткань. (B) Подлежащая ткань мозга выглядит здоровой и не затронутой имплантатом. (C) Наложение двух фотографий показывает, что имплантат действительно покрывал S1-область коры головного мозга свиньи. Стрелкой обозначена передне-задняя ось. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Вкратце, для анализа сигналов коры головного мозга их необходимо отфильтровать для удаления линейных шумов и других артефактов (см. рисунок 8 и таблицу 1). Режекторный фильтр используется вокруг частоты линейного шума, которая в Европе составляет 50 Гц и ее гармоник. Затем сигналы фильтруются по верхним частотам для удаления артефактов смещения и низкочастотного движения; максимальная частота среза зависит от цели записи, но выше 5 Гц не рекомендуется, так как это ослабит как ERP, так и спонтанные функции ЭЭГ. Кроме того, фильтр нижних частот используется для удаления любых высокочастотных шумов. Поскольку электрод размещается в верхней части твердой мозговой оболочки, высокие частоты немного ослабляются тканью между мозгом и электродом18. Поэтому частота среза может быть ниже, чем когда электрод расположен непосредственно на ткани мозга.

Рисунок 8: Конвейер обработки данных. Необработанные собранные данные (шаг 1) обрабатываются путем фильтрации (шаг 2). Затем они разбиваются на эпохи на основе триггеров стимула (шаг 3), которые усредняются (шаг 4). Для анализа данных используются усредненные ERP-системы (шаг 5). Аббревиатура: ERP = потенциалы, связанные с событиями. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Тип фильтра | Типичная отсечка | Типовой заказ | Используемая отсечка | Использованный заказ |
| Зарубка | 50±3 Гц или 60±3 Гц | Высокий порядок | 50±3 Гц и | 10-й заказ |
| и гармоники | гармоники ±1 Гц | |||
| Высокие пропуска | 0,1-5 Гц | Низкий порядок | 1-5 Гц | 2-й порядок |
| Низкие частоты | 100-1000 Гц | Низкий порядок | 300 Гц | 2-й порядок |
Таблица 1: Типичные свойства фильтра для анализа поверхностных сигналов мозга, записанных с помощью электродов электрокортикографии или электроэнцефалографии.
Отфильтрованные данные разбиты на эпохи 50-100 мс до и 500-1000 мс после стимула. Из данных удаляются зашумленные каналы (рисунок 9A), а также удаляются эпохи, загрязненные артефактами (рисунок 9B). Оставшиеся эпохи без артефактов усредняются для каждого канала. Вызванные реакции часто можно различить в одиночных взмахах. Они становятся более четкими и последовательными при усреднении не менее 10 ответов и не меняются при усреднении более 25. Для получения надежного среднего значения должно быть не менее 20 эпох без артефактов. Это типичный случай, и более чем в половине наборов данных не было необходимости удалять какие-либо эпохи. Чтобы облегчить сравнение между ERP, записанными на разных этапах (имплантация, доступ, операции по эвтаназии), данные обычно нормализуются по z-баллу, чтобы учесть различия в глубине анестезии и фоновой активности.

Рисунок 9: Примеры плохих каналов и эпох. (А) Сигналы от эпидуральной записи на относительно небольшой области мозга имеют схожие характеристики, но разную амплитуду. Неисправные каналы легко отличить по отсутствию формы сигнала ERP. Кроме того, каналы могут иметь артефакты, более шумный внешний вид и большую амплитуду сигнала (каналы 9, 10 и 13). Канал 7 является еще одним примером неисправного канала и не улавливает ни сигнала, ни шума. (B) Ожидаемая амплитуда ERP составляет приблизительно до 100 мкВ. Зашумленные эпохи обычно имеют большую амплитуду, которая может повлиять на среднюю форму сигнала ERP и поэтому должна быть устранена. У них отсутствует типичная форма сигнала ERP, но эта форма волны не всегда различима в отдельные эпохи. Аббревиатура: ERP = потенциал, связанный с событием. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Надежность ERP, зарегистрированных с использованием метода краниального окна, была высокой с точки зрения пиковых амплитуд и задержки19. Не было обнаружено существенных различий по пиковой амплитуде (запись 1: 17,9 ± 7,26 мкВ; запись 2: 17,6 ± 10,1 мкВ; запись 3: 14,0 ± 6,95 мкВ) и дисперсии между каналами (запись 1: 6,47 ± 8,36 мкВ; запись 2: 3,93 ± 6,13 мкВ; запись 3: 3,84 ± 3,71 мкВ) при повторном измеренном дисперсионном анализе (RM-ANOVA). Была обнаружена значительная разница в пиковой задержке между первой и последующей записями. Пик был на 1 мс позже в первой записи по сравнению с последующими записями (запись 1: 25,2 ± 2,0 мс; запись 2: 24,0 ± 2,4 мс; запись 3: 24,1 ± 2,0 мс), что может быть связано с развитием нервной системы20,21, так как в этом исследовании использовались свиньи-подростки ландрас.
Метод краниального окна был дополнительно использован для исследования влияния высокочастотной стимуляции (HFS) на ERP. HFS вызывает долгосрочное потенцирование поверхностных нейронов дорсального рога у грызунов22,23, повышение чувствительности к боли и усиление вызванных реакций мозга у людей24,25. Наблюдалось значительное увеличение амплитуды N1-пика потенциалов, связанных с событиями (259 ± увеличение на 107% по сравнению с исходным уровнем до вмешательства), и можно было различить четкую разницу между HFS и экспериментами, в которых HFS не применялась у одного и того же животного (Рисунок 10)17.
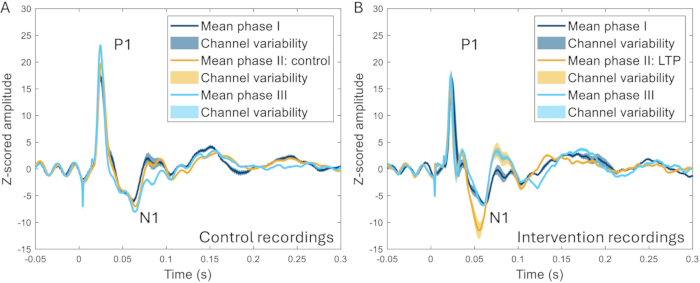
Рисунок 10: Примеры ERP, усредненных по всем каналам, записанных за 2-3 недели до, во время и через 2-3 недели после индукции модели боли. (A) ERP, собранные у одного и того же животного во время трех разных записей с интервалом в 2 недели, показывают очень похожие характеристики. (B) ERP имеют схожие характеристики между записями, но N1 имеет большую амплитуду после индукции долгосрочного потенцирования в фазе II по сравнению с другими фазами, которые имеют место за 3-4 недели до и после фазы II. Затененные области указывают на стандартное отклонение по каналам. Сокращения: ERP = потенциалы, связанные с событиями; LTP = долгосрочное потенцирование. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительная таблица S1: Схема благополучия для оценки одиночного и социального поведения свиней. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Значимость разработки этой методики заключается в устранении режимов отказа электродов, снижении реакций тканей и тем самым повышении надежности инвазивных методов записи коры головного мозга. Во время исследования не было никаких режимов отказа электродов, и в общей сложности на протяжении всего исследования использовались две матрицы ЭКоГ, включая 16 животных и 43 сеанса записи. Это оказывает дополнительное положительное влияние на экономику науки. При использовании традиционных полностью имплантированных методов 12,26,27, по меньшей мере 16 матриц ECoG потребуются при условии отсутствия сбоев устройств. Тем не менее, режимы отказа и реакции тканей продолжают создавать значительные проблемы для широкого внедрения внутричерепной записи в мозг 11,12,13,28,29. Это исследование существенно уменьшило количество электродов, тем самым снизив как стоимость, так и риск исследований хронической неврологии одновременно.
Единственным побочным явлением, которое возникало при имплантации черепно-оконных имплантатов, были случайные инфекции на ранних этапах операций. Эти инфекции всегда были поверхностными (не достигая уровня твердой мозговой оболочки) и разрешались путем имплантации губки с антибиотиком Genta-coll. В связи с эффективностью этого лечения, имплантация губки с антибиотиком была принята как часть имплантации краниального окна в качестве профилактической меры. Несмотря на то, что свиньи являются сильными животными, которые демонстрируют укореняющее поведение, ни один из имплантатов, изготовленных из стандартного PLA, не был сломан.
Все имплантируемые электроды подвержены реакции на инородное тело, а также глиальной или фиброзной инкапсуляции 14,15,28,29,30. Это означает, что граница между электродом и тканью, а также способность электрода к записи изменяются со временем после имплантации 13,18,28. При использовании современного метода реакция тканей не влияет на целостность и точность записи электродов благодаря стратегии временного размещения электродов. Электрод помещался на твердую мозговую оболочку во время каждого сеанса, и, таким образом, граница между электродом и тканью была сопоставима во время каждого сеанса. Единственный фактор, который мог немного отличаться за сеанс, — это положение электродов. Поэтому крайне важно сопоставлять размер окна с размером электрода и фотографировать расположение электродов во время каждой сессии записи. Благодаря этим усилиям были зарегистрированы высоконадежные и воспроизводимые ERP19.
Тканевая реакция на имплантат краниального окна происходила, и у первых пилотов с использованием транскраниального окна наблюдался повторный рост кости без стенок, простирающихся от внешней поверхности черепа до твердой мозговой оболочки. Непрерывный слой мягкой костной ткани был обнаружен через 2 недели после первого сеанса, что указывает на возобновление роста кости. Удалить эту ткань и получить доступ к твердой мозговой оболочке было невозможно; Поэтому к черепному окну были добавлены вертикальные стенки, простирающиеся от поверхности черепа до твердой мозговой оболочки31 . Окна с разной длиной стен были напечатаны в соответствии с толщиной черепа в соответствии с толщиной черепа, чтобы избежать давления на кору головного мозга. Животные были исследованы после эвтаназии, в результате чего у всех животных были выявлены здоровые ткани мозга. Мягкие ткани все еще формируются в области окна; Тем не менее, он не прикрепляется к стене и не является непрерывным с черепом, что позволяет легко удалить его с помощью ватной палочки. Для достоверности записей критически важно, чтобы эта мягкая ткань удалялась из окна, чтобы электрод каждый раз помещался на твердую мозговую оболочку.
Оптимальные результаты достигаются при интервале не менее 3 недель между операциями. Через 2 недели краниальное окно становится доступным, но мягкие ткани в области окна прикрепляются к твердой мозговой оболочке. Кроме того, открытие и закрытие раны осложняется кровотечением и недостаточной гибкостью тканей. Через 3 и 4 недели рана на разрезе достаточно зажила, чтобы нормальные границы тканей (например, надкостница, кожа, твердая мозговая оболочка) были отчетливыми, что позволяет легко удалить мягкие ткани из окна и повторно закрыть кожу над имплантатом. Поскольку с интервалом в 4 недели не наблюдалось костеподобной ткани, может быть целесообразно сделать перерыв между операциями и операциями с множественным доступом более 4 недель. Мы не исследовали, можно ли продлить интервал между операциями до нескольких месяцев.
Для успеха операций по имплантации и доступу первоначальный разрез и закрытие раны имеют решающее значение. Гибкость кожи лба свиньи очень ограничена, именно поэтому необходимо ослабление аваскулярного подкожного слоя кожи. Это обеспечивает дополнительную гибкость для закрытия кожи над имплантатом и снижает нагрузку на швы. Это напряжение еще больше уменьшается за счет использования двух слоев швов и дополнительного клея для кожи. Кожа зашивается с помощью техники непрерывного внутрикожного наложения швов, чтобы избежать расчесывания ран животными и преждевременного снятия швов. Стратегии вскрытия и закрытия раны имеют решающее значение в обоих типах операций по выживанию, будь то имплантат или операция доступа.
Ограничением текущего подхода является то, что доступ к окну требует небольшой операции, что исключает запись у бодрствующих животных. Это означает, что, в зависимости от исследовательского вопроса, он не будет подходящим подходом для каждого исследования. Для использования полностью имплантированных устройств в режиме бодрствования существуют другие методы преодоления биологических изменений на границе раздела32. Поскольку доступ к краниальному окну является небольшой процедурой, можно использовать местный анестетик и седативное средство, а не общую анестезию. Преимущества нахождения черепного окна полностью под кожей заключаются в снижении вероятности заражения и улучшении благополучия животных, поскольку животные могут содержаться в парах или группах. Более того, мы исследовали только достоверность вызванных реакций19. Тем не менее, спонтанная активность мозга была зарегистрирована и в целом более надежна и воспроизводима, чем ERP8, что указывает на то, что метод не ограничивается регистрацией ERP.
Наш метод представляет собой новый, масштабируемый, надежный и воспроизводимый метод хронических записей коры головного мозга. Этот метод очень ценен для научных исследований в области нейробиологии, где надежность и воспроизводимость имеют важное значение для результатов исследований33,34. Мы использовали этот метод для исследования вызванных реакций коры головного мозга от S1 до и после индукции различных моделей боли и контроля, показавнадежные результаты. Как правило, метод может быть легко адаптирован для доступа к другим областям коры головного мозга, например, для исследования движения, слуха или зрения. Также возможно использование метода для диагностики эпилепсии 4,35 или мониторинга лечения и реабилитации после черепно-мозговой травмы36,37.
Метод также может быть масштабирован на другие виды, такие как приматы или другие млекопитающие, кошки, собаки или овцы 35,38,39. Каждая из этих адаптаций потребует корректировки хирургической техники, определения надежных ориентиров для установки черепного окна и корректировки его конструкции. Авторы рекомендуют использовать трупы для оптимизации техники краниального окна, прежде чем приступать к опытно-промышленным испытаниям. Для определенных областей мозга операция может быть более инвазивной, что может привести к другому оптимальному времени восстановления, чем мы рекомендуем. Кроме того, метод может быть адаптирован для обеспечения субдуральной записи ЭКоГ и внутрикорковых записей, тем самым расширяя его применение и увеличивая доступ к различным областям мозга. Из-за толщины черепа свиньи может потребоваться увеличение размера кортикального окна для выполнения дуротомии для субдуральных записей26,27.
Для внутрикортикальной записи электрод можно разместить через канюлю или челнок40, что позволяет еще больше уменьшить размер кортикального окна. Как субдуральные, так и внутричерепные методы увеличивают риск кровотечения, поэтому во время операции необходимо соблюдать осторожность, чтобы избежать попадания кровеносных сосудов. Метод краниального окна также может быть использован для целей, отличных от регистрации электрических сигналов от мозга, например, для визуализации сосудистой сети, что очень актуально в моделях мигрени41 у свиней. Кроме того, метод краниального окна может быть адаптирован для использования в сочетании с новыми методами визуализации31, такими как двухфотонная визуализация, и может быть объединен с заменителем дураля, разработанным Costine-Bartell et al. для улучшения оптического разрешения42.
В заключение следует отметить, что представленный методический подход снижает риски, связанные с постоянным имплантатом12,13, устраняя риск отказа устройства, сводя к минимуму биологические реакции на месте электрода и, таким образом, повышая точность записи и, как следствие, получая высоконадежные кортикальные записи. Методология также имеет большие перспективы для других приложений, поскольку она может быть масштабирована на другие виды и типы записей.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Авторы хотели бы поблагодарить специалистов по уходу за животными и техников в помещении для лабораторных животных в Университетской больнице Ольборга. Центр нейропластичности и боли (CNAP) поддерживается Датским национальным исследовательским фондом (DNRF121). Рисунок 6 и Рисунок 8 были созданы в BioRender.
Материалы
| Name | Company | Catalog Number | Comments |
| Cranial window implantation | |||
| Scalpel | disposable, blade 10 | ||
| Tweezers | |||
| Gauze | |||
| Cauterizer | |||
| Periosteum elevator | flat, 10 mm width | ||
| Weitlaner retractor | 3 x 4 prong, blunt, 16.5 cm | ||
| Midas Rex Legend EHS stylus surgical drill system | Medtronic Powered Surgical Solutions, Fort Worth, USA | ||
| Legend Ball Fine drill bits | Medtronic Powered Surgical Solutions, Fort Worth, USA | 7BA40F-MN and 7BA60F-MN | MedNext type 4 and 6 mm head diameter |
| Sterile cover for the drill | |||
| Syringe | 5 mL | ||
| Saline | |||
| Suction | |||
| Ruler | |||
| Cotton buds | |||
| Rongeur | straight jaw, 15 cm, 3 x 20 mm bit size | ||
| 2.5 mm hand drill and handle | |||
| Butterfly infusion set | |||
| Six M3 screws in 6-14 mm length | |||
| Screwdriver | |||
| Three sizes of 3D-printed cranial window (4-, 5- and 6-mm depth) and cap | |||
| Deisolated U-shaped connector | |||
| Crocodile connector | |||
| Genta-coll resorbable antibiotic sponge | |||
| VYCRIL resorbable suture | Ethicon | 2-0 26 mm round bodied | |
| Monocryl non-resorbable suture | Ethicon | 3-0 24 mm reverse cutting | |
| Needle holder | |||
| Scissors | |||
| Topical adhesive tissue glue | Leukosan | ||
| Peripheral wire implantation | |||
| Two partially uninsulated Cooner wires | |||
| NOTE: 1-2 cm of the wires is uninsulated in the middle and at one of the ends | |||
| Two 23 G needles | |||
| Gauze | |||
| Programmable stimulator controlled by a PC running MC_stimulus | Multichannel Systems, Reutlingen, Germany | STG4008 | |
| Two crocodile connectors | |||
| Cortical recordings | |||
| Metal plate for the magnetic micromanipulator | |||
| Magnetic micromanipulator stand | |||
| Micromanipulator | |||
| Headstage holder | |||
| 32-channel ZIF-clip headstage | TDT, Alachua, FL, USA | ||
| 32-channel micro-electrocorticography (µECoG) array | Neuronexus, Ann Arbor, USA | E32-1000-30-200 | |
| TDT recording equipment including pre-amplifier SI8, data processor RZ2 and workstation WS8 | TDT, Alachua, FL, USA |
Ссылки
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены