Method Article
טכניקת חלון גולגולת כרונית להקלטות חוזרות ונשנות בקליפת המוח במהלך הרדמה בחזירים
In This Article
Summary
מחקר זה מציג שיטה ניתנת להרחבה, אמינה וניתנת לשחזור עבור הקלטות קליפת המוח הכרוניות החוזרות ונשנות במודל חזיר. לשיטה יישומים בתחומים שונים של מדעי המוח, כולל חקר כאב ואבחון מחלות נוירולוגיות.
Abstract
הקלטות קליפת המוח חיוניות לחילוץ אותות עצביים כדי ליידע יישומים שונים, כולל ממשקי מוח-מחשב ואבחון מחלות. כל יישום מציב דרישות ספציפיות לטכניקת ההקלטה, ולעתים קרובות נבחרים פתרונות פולשניים להקלטות ארוכות טווח. עם זאת, שיטות הקלטה פולשניות מאותגרות על ידי כשל במכשיר ותגובות רקמות שליליות, הפוגעות באיכות האות לטווח הארוך.
כדי לשפר את האמינות והאיכות של הקלטות כרוניות בקליפת המוח תוך מזעור סיכונים הקשורים לכשל במכשיר ותגובות רקמות, פיתחנו טכניקת חלון גולגולת. בפרוטוקול זה, אנו מדווחים על שיטות להשתלה וגישה לחלון גולגולת בחזירים צעירים, מה שמקל על מיקום מערך אלקטרוקורטיקוגרפיה זמנית (ECoG) על הדורה מאטר. אנו מתארים עוד כיצד ניתן להקליט אותות קליפת המוח באמצעות טכניקת חלון הגולגולת. ניתן לחזור על גישה לחלון הגולגולת מספר פעמים, אך מומלץ לפחות שבועיים בין ניתוחי השתלה לגישה כדי להקל על ההחלמה וריפוי הרקמות.
גישת חלון הגולגולת הצליחה למזער מצבי כשל אלקטרודות נפוצים ותגובות רקמות, וכתוצאה מכך הקלטות קליפת המוח יציבות ואמינות לאורך זמן. רשמנו פוטנציאלים הקשורים לאירועים (ERP) מקליפת המוח הסומטוסנסורית הראשונית כדוגמה. השיטה סיפקה הקלטות אמינות ביותר, שאפשרו גם להעריך את השפעת ההתערבות (גירוי בתדר גבוה) על ה-ERP. היעדר כשלים משמעותיים במכשירים והמספר המופחת של אלקטרודות בשימוש (שתי אלקטרודות, 43 מפגשי הקלטה, 16 בעלי חיים) מרמזים על כלכלת מחקר משופרת. בעוד שנדרשת גישה כירורגית קלה למיקום אלקטרודות, השיטה מציעה יתרונות כמו סיכון מופחת לזיהום ושיפור רווחת בעלי החיים.
מחקר זה מציג שיטה ניתנת להרחבה, אמינה וניתנת לשחזור עבור הקלטות קליפת המוח הכרוניות, עם יישומים פוטנציאליים בתחומים שונים של מדעי המוח, כולל חקר כאב ואבחון מחלות נוירולוגיות. התאמות עתידיות עשויות להרחיב את השימוש בו למינים אחרים ולשיטות הקלטה, כגון הקלטות תוך-קורטיקליות וטכניקות הדמיה.
Introduction
באופן כללי, מטרת ההקלטות בקליפת המוח היא לחלץ מידע מהאיתות העצבי במוח. ניתן להשתמש במידע זה בדרכים שונות - שליטה במכשיר חיצוני, תקשורת, אבחון מחלות או שיקום 1,2,3,4. כל יישום מציב דרישות ייחודיות לתוכן המידע ולרזולוציה המרחבית הנדרשת ולכמות הפולשניות הנחשבת מקובלת. לכן, פתרונות הקלטה עם מגוון פולשניות ורזולוציה מרחבית פותחו מאז גילוי האלקטרואנצפלוגרמה בשנת 19295.
באופן כללי, ניתן לחלק אותם לאלקטרואנצפלוגרפיה (EEG), אלקטרוקורטיקוגרפיה (ECoG) והקלטות תוך-קורטיקליות. EEG היא שיטת הקלטה לא פולשנית הלוכדת תנודות עצביות ופוטנציאלים הקשורים לאירועים (ERP) מכל המוח. עם זאת, יכולתו להגדיר את מקורות הפעילות מוגבלת בשל הרזולוציה המרחבית הנמוכה שלו. ECoG היא שיטה פולשנית יותר שבה אלקטרודות ממוקמות באופן אפי או תת-דורלי, בדרך כלל מכסות חלק קטן יותר של קליפת המוח. יש לו רזולוציה מרחבית גבוהה יותר והוא יכול להקליט ERP ופוטנציאל שדה מקומי על פני השטח (LFP). לכן, הוא יכול למקם את מקור הפעילות המוחית בצורה מדויקת יותר, מה שהופך אותו למועיל, למשל, בזיהוי מקור האפילפסיה המוקדית. ההקלטה התוך-קורטיקלית היא שיטת ההקלטה הפולשנית ביותר ויכולה לתעד פעילות זינוק מנוירונים בודדים הממוקמים שטחיים או עמוקים בתוך המוח ו-LFP מנפח הנוירונים סביב האלקטרודות. לאותות אלה יש רזולוציה מרחבית גבוהה מאוד ותכולת מידע אך הם מיוצרים על ידי תת-קבוצה מוגבלת של נוירונים (1-10 נוירונים לכל ערוץ)6.
כדי לחלץ מידע מהמוח לתקופות ממושכות (חודשים-שנים), הממשק חייב להיות יציב ואמין כדי שהאותות הנרכשים ימשיכו לייצג את אותו מידע לאורך כל התקופה. הקלטות EEG דורשות החלפות אלקטרודות תכופות, מה שהופך את האמינות שלהן למשתנה מנמוכה מאוד לגבוהה מאוד 7,8,9,10. לכן, שיטות ECoG ושיטות תוך-קליפתיות נבחרות לעתים קרובות להקלטות ממושכות. עם זאת, שתי השיטות הללו דורשות שמצב האלקטרודה ההקלטה, כמו גם הרקמה, חייב להישאר יציב לאורך זמן. בעוד שהאלקטרודה בדרך כלל נשארת באותו מיקום, ממשק האלקטרודה-רקמה עשוי להשתנות עקב תגובות רקמה או מצבי כשל אלקטרודה 11,12,13,14. תגובות רקמות כוללות מוות עצבי, דימום, זיהום ביולוגי, תגובה לגוף זר, גליוזיס, אנקפסולציה, זיהום, דלקת קרום המוח ושחול קרום המוח15. תגובות אלו פוגעות ביכולות ההקלטה של האלקטרודות12,13. מצבי כשל נפוצים באלקטרודות הם דלמינציה או דליפה בחלקים המבודדים, דלמינציה או סדקים של ציפוי משטח האלקטרודה, נזק לחוטים ופריקת אלקטרודה11,12.
כדי להתגבר על מצבי כשל באלקטרודות, שקלנו את הכדאיות של פתרון מיקום אלקטרודות זמני הנותן מענה גם לרבים מהאתגרים הקשורים לתגובות רקמות, כלומר מוות עצבי, תגובה לגוף זר, גליוזיס, אנקפסולציה ושחול קרום המוח. יתר על כן, מיקום עקבי של אלקטרודות היה דרישה להשגת הקלטות עצביות אמינות וניתנות לשחזור. מכיוון שהאלקטרודה הוצבה אפידורלית במרחק של כמה מילימטרים לרקמת העצבים, תנועת האלקטרודה לא תעלה על 1 מ"מ. חלון הגולגולת תוכנן במידות כדי למנוע תנועה מוגזמת בין מיקומי האלקטרודות. עם התפתחות טכניקת חלון הגולגולת, אנו שואפים לשפר את אמינות ואיכות האות לטווח הארוך ולהסיר את הסיכון לכשל באלקטרודה.
Protocol
פרוטוקול זה אושר על ידי מינהל הווטרינריה והמזון הדני תחת משרד המזון, החקלאות והדיג של דנמרק (מספר פרוטוקול 2020-15-0201-00514). בסך הכל עברו 16 חזירות מקומיות את ההליכים. בעלי החיים שקלו כ-20 ק"ג עם הגעתם למתקן, כלומר הם היו בני חודשיים בערך. הם שקלו כ-30 ק"ג בעת ההשתלה ו-40-60 ק"ג בסוף המחקר. ההליכים מורכבים מניתוח השתלה, ניתוח גישה וניתוחים סופניים (איור 1).

איור 1: ציר הזמן של הליכי הניסוי. ניתן לחזור על ניתוח הגישה (שלב II) מספר פעמים. מומלץ לבצע הפרדה של שבועיים לפחות בין ניתוחים להחלמה וריפוי פצעים בין ניתוחים. קיצור: ERP = פוטנציאל הקשור לאירוע. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
1. ניתוח השתלה (שלב I)
הערה: חלון גולגולת של חומצה פולילקטית (PLA) מודפס בתלת מימד (איור 2) מושתל כדי להקל על הקלטות חוזרות ונשנות מקליפת המוח הסומטוסנסורית הראשונית של החזיר. נרשמים ERPs עקב גירוי חשמלי של העצב האולנרי. הניתוח וסגירת הפצע מבוצעים כך שניתן יהיה לגשת לחלון הגולגולת ולסגור אותו לאחר מכן.

איור 2: עיצוב חלון גולגולת. (A) מבט מהצד של חלון הגולגולת המציין את גובה הקירות ואת הבסיס המהודק לגולגולת. (B) מבט למעלה המציין את קוטר האלמנה הגולגולתית, חורי הברגים, חלל המכסה והחלון. מכסה חלון הגולגולת הוא גליל בקוטר 22 מ"מ בגובה 1 מ"מ המתאים במדויק לחלל המכסה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- השתלת חלון גולגולת
- הכנה לניתוח
הערה: מעבד הנתונים (RZ2), תחנת העבודה (WS8) והמחשב מופעלים לפני תחילת הניתוח. הערות ניתוח נלקחות על גיליון אלקטרוני לפחות כל 15 דקות על ידי חוקר לא סטרילי כדי לתעד סימנים חיוניים (דופק, spO2, CO 2 בסוף הגאות, טמפרטורת הליבה), רמות ההרדמה (קצב עירוי פרופופול, קצב עירוי פנטניל, אחוז סבופלורן), שלב הניתוח וכל אי סדרים.- הרגיעו את בעל החיים באמצעות הזרקה תוך שרירית של 5-7 מ"ל תערובת זולטיל (1 מ"ל הכיל 8.3 מ"ג טילטמין, 8.3 מ"ג זולאזפאם, 8.3 מ"ג קסילאצין ו-1.7 מ"ג בוטופנול).
הערה: במחקר הספציפי הזה, קטמין הושמט מתערובת הזולטיל כדי למנוע חסימת קולטני NMDA. - הובלת בעל החיים לחדר הניתוח. החדרו את החיה וחברו אותה למכונת הנשמה מכנית.
- הנח קטטר לוורידי האוזן כדי לתת פרופופול, פנטניל ותמיסת מלח.
- מתן הרדמה כירורגית: סבופלורן 1-2%, פרופופול (10 מ"ג/מ"ל מוזרק ב-8 מ"ג-1∙h-1), פנטניל (50 מיקרוגרם/מ"ל מוזרק ב-20 מיקרוגרם∙ק"ג-1∙h-1).
- סמן את מקום החתך באמצעות טוש סטרילי לפני עטיפה סטרילית. זהה את נקודת הברגמה על ידי ציור קווים ישרים בין כל אוזן לעין הנגדית; נקודת ברגמה נמצאת במפגש של הקווים האלה (איור 3A). ודא שהחתך מעט לרוחב קו האמצע בצד הנגדי לגפה הקדמית המגורה.
- הנח את לוחית המתכת מתחת לווילונות והקפד על מיקום ויציבות נכונים לפני תחילת הניתוח.
- הרגיעו את בעל החיים באמצעות הזרקה תוך שרירית של 5-7 מ"ל תערובת זולטיל (1 מ"ל הכיל 8.3 מ"ג טילטמין, 8.3 מ"ג זולאזפאם, 8.3 מ"ג קסילאצין ו-1.7 מ"ג בוטופנול).
- גישה לגולגולת
הערה: בחלק זה ובחלקים הבאים של הפרוטוקול, כל ההליכים מבוצעים על ידי מנתח סטרילי אלא אם צוין אחרת.- בצע את החתך הראשוני בדרמיס בעזרת אזמל מעט לרוחב קו האמצע, כפי שמסומן בשלב 1.1.1.5. המשך את החתך דרך העור בעזרת צריבה
הערה: אין להאריך את החתך יותר מדי קדימה כדי להימנע מהסינוסים הקדמיים הגדולים של החזיר. אם יש צורך בשטח נוסף, הרחב את החתך בצד האחורי. - הנח את המחזיר והחזק את העור באמצעות מלקחיים וחתוך את רקמת החיבור האווסקולרית בין הפריאוסטאום לתת-העור (איור 3B) כדי לספק גמישות רבה יותר לעור ולהקל על התפירה בשלב 1.4. התאם את המחזיר לגמישות שהושגה.
- חותכים את הפריאוסטאום ומשחררים אותו מהגולגולת באמצעות מעלית פריוסטאום. החזק את הפריאוסטאום בצד באמצעות המפרק.
- בצע את החתך הראשוני בדרמיס בעזרת אזמל מעט לרוחב קו האמצע, כפי שמסומן בשלב 1.1.1.5. המשך את החתך דרך העור בעזרת צריבה
- גישה לדורה
- קדחו חור בקוטר 10 מ"מ קדמי לקו התפר הסגיטלי ולרוחב לתפר קו האמצע (איור 3C). התחל בקוטר של 15 מ"מ כדי להשיג חור בקוטר 10 מ"מ ברמת הדורה מכיוון שהמקדח המעוגל יגרום לחור מחודד מעט.
- התאם את חלון הגולגולת לחור מוקדם כדי להבטיח התאמה טובה.
- עבור למקדחה קטנה יותר כאשר הדורה נראית לעין כדי להשיג את הרוחב המרבי של החור ברמת הדורה. גזור את הקצוות באמצעות Rongeurs.
- השתלת חלון גולגולת
- ודא שחלון הגולגולת נכנס לתחתית החור ועד לתחתית החור והחליט על עומקו. למרות שזה תלוי בבעלי חיים, ודא שדפנות חלון הגולגולת יגיעו לדורה להתאמה טובה אך לא יפעילו לחץ על המוח בשום מקום.
- סמן את חורי הברגים באמצעות המקדחה הידנית תוך החזקת חלון הגולגולת במקומו.
- הסר את חלון הגולגולת וקדח את החורים בעומק של 4 מ"מ לפחות. חודר לגולגולת כדי שאחד הברגים ישתמש בו כקרקע/התייחסות להקלטות קליפת המוח.
- הנח את חלון הגולגולת (איור 3), והסר את המחט מערכת עירוי הפרפר. מדוד את עומק חורי הברגים דרך חלון הגולגולת באמצעות הפרפר הבוטה. הכנס והדק בורג באורך תואם לתוך החור.
הערה: בורג ארוך מדי לא יצליח להדק את מכסה חלון הגולגולת ביעילות. - הנח מחבר U מתחת לבורג אחד שמחורר את הגולגולת ונוגע בדורה.
הערה: חשוב שאורכו של בורג זה יהיה גדול מעובי הגולגולת כדי שעצם שצומחת מחדש לא תמנע מגע עם הדורה.
- הכנה לניתוח
- השתלת חוט היקפי
הערה: הליך זה יכול להיעשות במקביל להשתלת חלון גולגולת. זהו הליך סטרילי. כדי למנוע זיהום של אתר הניתוח או אתר הגולגולת, יש ללבוש לבוש סטרילי.- השתלת חוטים ליד העצב האולנרי
- הפעל גירוי חשמלי ב-5 mA על העור על ידי נגיעה בעור בחלק הדיסטלי האחורי של הגפה הקדמית עם שתי מחטים (לא חודרות) או פיסת מתכת סטרילית אחרת המופרדת ב-2 ס"מ. חפש כיפוף פרסה ברור, המעיד על כך שהעצב עובר בין שתי הנקודות הללו.
הערה: ייתכן שיהיה צורך לסובב את הגפה לאחור כדי שיהיה קל יותר לגשת לחלק האחורי. - הכנס את שתי המחטים בניצב למהלך העצב במרחק של כ -2 ס"מ זה מזה. חודרים שוב את העור כ-3 ס"מ מנקודת ההחדרה (איור 4A).
- אמת את המיקום באמצעות גירוי בדיקה המופעל על המחטים ב-2 mA; ודא שתנועה ברורה של הפרסה נראית לעין.
- העבירו את חוטי הקונר דרך המחטים והוציאו את המחטים, והשאירו את חוטי הקונר חלקית מתחת לעור. ודא שהחלק הלא-מבודד באמצע החוט נמצא מתחת לעור עבור שני החוטים (איור 4B).
הערה: אם הגפה סובבה לאחור, סובב אותה בזהירות קדימה. - חבר כל מחבר תנין לקצה מבודד של שני חוטי הקונר.
- הפעל גירוי חשמלי ב-5 mA על העור על ידי נגיעה בעור בחלק הדיסטלי האחורי של הגפה הקדמית עם שתי מחטים (לא חודרות) או פיסת מתכת סטרילית אחרת המופרדת ב-2 ס"מ. חפש כיפוף פרסה ברור, המעיד על כך שהעצב עובר בין שתי הנקודות הללו.
- קביעת סף מוטורי
- מצא את סף המנוע בשיטת למעלה-למטה16,17; התחל ב-100 μA, גדל בצעדים של 50 μA, תוך התבוננות ותחושה לתגובה מוטורית באזור הפרסה. סף מתחת ל-1 mA הוא בדרך כלל אפשרי.
- תכנת את ה-STG לספק 100 גירויים סימטריים דו-פאזיים מלבניים עם רוחב פולס של 200 מיקרון ב-2x הסף המוטורי ואחריו 100 גירויים ב-10x הסף המוטורי.
- השתלת חוטים ליד העצב האולנרי
- הקלטת אותות קליפת המוח
- בקש מחוקר לא סטרילי להביא את המגבר המקדים למקומו ולחבר אותו למעבד הנתונים (RZ2) באמצעות כבלי סיבים אופטיים.
- הפחת את הסבופלורן ל-0.5-1% (מחצית מרמתו הניתוחית) ועקוב אחר קצב הלב,CO2 שפג תוקפו ולחץ הדם (אם זמין) כדי להבטיח עומק הרדמה הולם ויציב. יש להגדיל את הכמות של פרופופול ופנטניל לפי הצורך.
- בקש מחוקר לא סטרילי לחבר את ה-headstage למגבר המקדים (SI8) ולהניח את headstage (ZIF-clip) במחזיק headstage, המותקן על המיקרומניפולטור של המעמד המגנטי.
- הנח את העטיפה הסטרילית סביב המיקרומניפולטור והצמד את החלק הדביק לראש ה-stage ולמחזיק headstage (איור 5A).
- בקש מחוקר לא סטרילי לאבטח את המיקרומניפולטור באמצעות המעמד המגנטי, לטבול את האלקטרודה μECoG באלכוהול ולהניח אותה בראש הבמה (ZIF-clip).
הערה: הניחו לאלקטרודה להתייבש לפני הנחתה על הדורה. הקפד לגעת רק בווילון הסטרילי המכסה את הבמה הראש, מכיוון שהאלקטרודה μECoG אינה סטרילית. - הבא את ה-μECoG למקומו באמצעות המיקרומניפולטור והדרכה עם צמר גפן. חבר את חוטי ההארקה של ה-μECoG לבורג ההארקה באמצעות מחבר תנין.
- הפחת את הסבופלורן ל-0%, עקוב אחר קצב הלב, CO2 שפג תוקפו ולחץ הדם (אם זמין) כדי להבטיח עומק הרדמה הולם ויציב, הגדל את הפרופופול והפנטניל לפי הצורך.
- תצוגה מקדימה של האותות בסינפסה; תחום האותות הטיפוסי הוא עד ±100 μV.
- אם האות נראה כמו קו מודגש (המעיד על רעש קו), בקש מאדם סטרילי לבצע את הפעולות הבאות: חקור את מעגלי ההארקה ושמור על בורג ההארקה והחיבורים יבשים ומבודדים מרקמות סמוכות. בדוק אם כבלים אחרים מבודדים מגוף החזיר וממכשירי הניתוח. אם לא, השתמש בגזה סטרילית כדי לבודד כבלים מהגוף או ממכשירים כירורגיים.
- אם משרעת האות גדולה מ-±100 μV (מעיד על חפצי תנועה), ודא שהאלקטרודה תלויה ונחה על המוח ושהכבלים אינם זזים כאשר החזיר נע עקב אוורור או גירוי חשמלי של העצב האולנרי.
- אם משרעת האות קטנה מ-±-20 mV (מעיד על מגע לקוי או הרדמה עמוקה), ודא שה-μECoG מונח על המוח והדורה והאלקטרודה לחות; במידת הצורך, טפטפו מעט מי מלח על האלקטרודה. ודא שהסבופלורן כבוי והפחית את קצב העירוי של פרופופול (ואולי פנטניל). בצע גירוי בדיקה ובדוק אם תגובות מעוררות נראות לעין. ודא שהחלק הלא מבודד של החוט ההיקפי נמצא כולו מתחת לעור.
הערה: בדרך כלל ניתן להבחין בתגובות מעוררות בסריקות בודדות באינטרנט, אך ניתן גם להעריך זאת במצב לא מקוון, תוך שימוש בממוצע של 5-10 גירויים. אם שיא נראה בזמן ההדק, זהו חפץ גירוי. חפץ הגירוי יפריע לניתוח הנתונים.
- הניחו גזה סטרילית על האלקטרודה כדי לשמור על מגע טוב עם הרקמות. טפטפו מי מלח בטמפרטורת הגוף על הגזה כדי למנוע ייבוש של הרקמה.
הערה: מכיוון שההקלטות הללו הן אפידורליות, הטמפרטורה המדויקת אינה חיונית. בהקלטות תת-דוראליות, זה קריטי יותר. - אפשר לאלקטרודה להתייצב (30 דקות) ולתעד את מיקום האלקטרודה ואת הגדרת מחבר ההארקה כדי להבטיח הקלטות עוקבות דומות (איור 5B-D). התחל להקליט והמתן 30 שניות לפני שתתחיל את תוכנית הגירוי כל 10 דקות.
הערה: בדוק באופן קבוע בין ההקלטות שהגזה על האלקטרודה נשארת לחות וטפטף מי מלח בטמפרטורת הגוף במידת הצורך. - בצע התערבות לאחר שלושה סבבים של גירוי (כדי לשמש כבסיס לפני ההתערבות). חזור על הגירוי במשך תשעה סיבובים נוספים.
הערה: המשך לבדוק באופן קבוע בין ההקלטות שהגזה על האלקטרודה נשארת לחות ולטפטף מי מלח במידת הצורך.
- סגירת אתר השתל
- הסר את הגזה מהאלקטרודה והסר את האלקטרודה באמצעות המיקרומניפולטור תוך הנחיית אותה בעדינות עם צמר גפן.
- בקש מחוקר לא סטרילי להסיר ולאחסן את המיקרומניפולטור, האלקטרודה, הבמה הראשית והמגבר המקדים ולנקות את האלקטרודה לפי הוראות היצרן באמצעות שטיפה מהירה במים נטולי יונים כדי להסיר שאריות רקמות. השרו את האלקטרודה עד 4 שעות במנקה עדשות כדי להסיר רקמות וחלבונים משטח האלקטרודה, ולאחר מכן שטיפה שנייה במים נטולי יונים כדי להסיר את מנקה העדשות משטח האלקטרודה. לפני אחסונו, טבלו את האלקטרודה באלכוהול איזופרופיל.
- הנח את מכסה חלון הגולגולת כדי לסגור את חלון הגולגולת, וודא שהוא מתאים במדויק לחלון הגולגולת. זה לא דורש הידוק נוסף; לחץ מהעור על השתל ישמור אותו במקומו.
- הניחו את השקית האנטיביוטית על גבי מכסה חלון הגולגולת וסגרו את העור תת-עורי עם תפרים בודדים הניתנים לספיגה באמצעות טכניקת תפר המזרן האנכי הקבור (איור 6A). הניחו תפרים במרחק של 5-10 מ"מ, מה שמאפשר מקום למקם את התפרים העוריים. אין לקשור את שלושת התפרים האחרונים לאחר הנחתם. במקום זאת, קשרו את שלושת התפרים הללו כאשר כל התפרים מונחים.
הערה: קשירת שלושת התפרים האחרונים לאחר הנחת שלושתם מבטיחה שיש מספיק מקום להניח את התפרים האחרונים. - הנח תפרים תוך עוריים רציפים בצורה רציפה בעור. התחל את התפר התוך-עורי 1-2 ס"מ לרוחב לאתר החתך ותעלה מתחת לעור לשכבת העור אך מתחת לפני השטח שלו (איור 6B) כדי למנוע גירוד והתרופפות יתר של התפרים. קושרים קשר בקצה הצדדי של התפר.
הערה: ניתן לכבות פרופופול ופנטניל במהלך הליך זה, מכיוון שיש להם מספר דקות של זמן התעוררות. - הנח את התפר הרציף בין התפרים התת עוריים עד שמגיעים לצד השני של החתך.
הערה: חשוב שהתפר ייצא בדרמיס אך לא ינקב את העור כך שהחיה תהיה פחות מסוגלת לשרוט את התפרים. - מנהרה של התפר 1-2 ס"מ לרוחב החתך לאתר יציאה רוחבי וקשר קשר (איור 6B). מרחו דבק רקמות על מקום החתך.
- החזרת בעלי חיים למכלאה הביתית
- הסר את הווילונות הסטריליים מהחיה, וגמל את החיה ממכונת ההנשמה ברגע שנצפתה תנועה.
- העבירו את החיה לדיר הביתי ושמרו אותה מופרדת מחבר העט למשך לילה אחד.
הערה: חזירים מופרדים לאחר הניתוח, מכיוון שזה נורמלי שהם מנסים באלימות להעיר את חבר העט, וכתוצאה מכך פצעי נשיכה. חזירים צריכים להיות מסוגלים לבוא במגע עם החוטם.

איור 3: השתלת חלון הגולגולת. (A) המיקום הצפוי של נקודת הברגמה מזוהה ומסומן על החזיר לפני העטיפה הסטרילית, מאחר שקשה להבחין בכך לאחר מכן. (B) אחרי חתך העור, תת-העור של כלי הדם משוחרר באמצעות מספריים. (C) נקדח חור בקוטר 15 מ"מ בגולגולת, והקצוות מוסרים באמצעות רונג'ורים. קווי התפרים העטרתיים והסגיטליים מודגשים. (D) חלון הגולגולת מושתל ומהודק באמצעות ברגים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
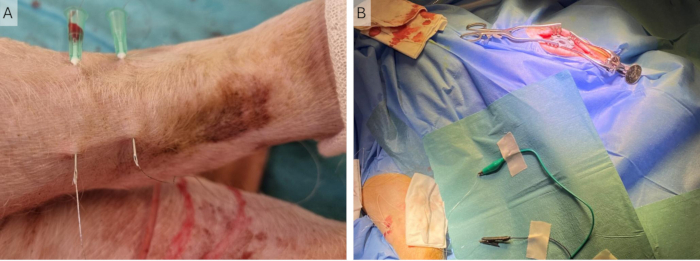
איור 4: השתלת חוטים היקפיים. (A) שתי מחטי 23 G ממוקמות בעור וחוטי הקונר מוחדרים דרכן. (B) המחטים מוסרות, והחוטים נשארים בעור מחוברים לממריץ באמצעות אטבי תנין. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: מערך הקלטה קליפת המוח. (A) מערך האלקטרודות ממוקם על הדורה, ומחזיק הבמה הראשית והמיקרומניפולטור נמצאים בשרוול סטרילי במהלך ניתוח השתלה, שבו החתך ארוך ורוחבי יותר. (B) תקריב של ה-μECoG במערך ההקלטה במהלך ניתוח גישה, שבו החתך הוא מדיאלי יותר. (ג) מערך ההארקה, שבו כל חוטי ההארקה והייחוס ב-ECoG מקוצרים ומחוברים דרך מחבר ה-U לבורג הפרי-גולגולתי. (ד) תקריב של הבמה הראשית ומחזיק הבמה הראשית במהלך ניתוח גישה. ה- μECoG ממוקם על הדורה. קיצורים: ECoG = אלקטרוקורטיקוגרפיה; μECoG = microECoG. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 6: טכניקת תפירה. (A) סכמטי של טכניקת המזרן האנכי הקבור התת עורי. (B) סכמטי של טכניקת התפר התוך-עורי הרציף. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
2. ניתוח גישה (שלב II)
הערה: לאחר 2-4 שבועות, חלון הגולגולת נפתח לביצוע הקלטות מעקב של אותות קליפת המוח מה-S1. הניתוח וסגירת הפצע מבוצעים שוב באופן שניתן לגשת לחלון הגולגולת ולסגור אותו שוב.
- הכנה לניתוח
הערה: שלבים 2.1.1-2.1.6 דומים לשלבים 1.1.1.1-1.1.1.6.- הרגיעו את בעל החיים באמצעות תערובת זולטיל (5 מ"ל זולטיל [טילטמין 25 מ"ג/מ"ל וזולאזפם 25 מ"ג/מ"ל), 6.25 מ"ל קסילזין (20 מ"ג/מ"ל) ו-2.5 מ"ל בוטאורפנול (10 מ"ג/מ"ל)).
הערה: במחקר הספציפי הזה, קטמין הושמט מתערובת הזולטיל כדי למנוע חסימה של קולטני NMDA. - העבר את בעל החיים לחדר הניתוח והחדיר ואוורר אותו.
- הנח קטטר לווריד האוזן. יש לתת פרופופול, פנטניל ותמיסת מלח דרך הצנתר.
- מתן הרדמה כירורגית: סבופלורן 1-2%, פרופופול (10 מ"ג/מ"ל מוזרק ב-8 מ"ג-1∙h-1), פנטניל (50 מיקרוגרם/מ"ל מוזרק ב-20 מיקרוגרם∙ק"ג-1∙h-1).
- במידת הצורך, סמנו את מקום החתך באמצעות טוש סטרילי לפני הכיסוי הסטרילי. זהה את נקודת הברגמה על ידי ציור קווים ישרים בין כל אוזן לעין הנגדית; ברגמה נמצאת בצומת של הקווים האלה (איור 3A).
הערה: החתך הראשוני בדרך כלל עדיין נראה לעין. יש למקם את החתך החדש לפחות 30 מ"מ מהחתך הראשוני כדי למנוע את רוב רקמת הצלקת ולהקל על סגירת הפצע. - הנח את לוחית המתכת מתחת לווילונות והקפד על מיקום ויציבות נכונים לפני תחילת הניתוח.
- הרגיעו את בעל החיים באמצעות תערובת זולטיל (5 מ"ל זולטיל [טילטמין 25 מ"ג/מ"ל וזולאזפם 25 מ"ג/מ"ל), 6.25 מ"ל קסילזין (20 מ"ג/מ"ל) ו-2.5 מ"ל בוטאורפנול (10 מ"ג/מ"ל)).
- גישה לחלון הגולגולת
הערה: שלבים 2.2.1-2.2.3 דומים לשלבים 1.1.2.1-1.1.2.3.- בצע את החתך הראשוני בדרמיס בעזרת אזמל מעט לרוחב קו האמצע כפי שמסומן בשלב 2.1.5. המשך את החתך דרך העור בעזרת צריבה
הערה: במקרה של ניסוי סופי, ניתן לבצע את החתך באותו מיקום כמו החתך המקורי. - הנח את המחזיר והחזק את העור באמצעות מלקחיים וחתוך את רקמת החיבור האווסקולרית בין הפריאוסטאום לתת-העור (איור 3B) כדי לספק גמישות רבה יותר לעור ולהקל על התפירה בשלב 1.4. התאם את המחזיר לגמישות שהושגה.
הערה: אם זהו ניסוי סופי, ניתן להשמיט שלב זה. - חתכו את הפריאוסטאום ושחררו אותו מהגולגולת באמצעות מעלית הפריאוסטאום. החזק את הפריאוסטאום בצד באמצעות המפרק.
- הסר את מכסה חלון הגולגולת והסר כל חיבור מהפתח בתנועות מעגליות עדינות עם צמר גפן עד שמגיעים לדורה.
- בצע את החתך הראשוני בדרמיס בעזרת אזמל מעט לרוחב קו האמצע כפי שמסומן בשלב 2.1.5. המשך את החתך דרך העור בעזרת צריבה
- השתלת חוט היקפי
- חזור על שלב 1.2.
- הקלטת אותות קליפת המוח
- חזור על שלב 1.3.
- סגירת אתר השתל
- חזור על שלב 1.4.
הערה: אם זהו ניסוי סופי, ניתן להשמיט שלב זה.
- חזור על שלב 1.4.
3. ניתוח סופני (שלב III)
הערה: לאחר 2-4 שבועות, חלון הגולגולת נפתח לביצוע הקלטות מעקב של אותות קליפת המוח מה-S1. שלבים 2.2-2.5 חוזרים על עצמם, כמתואר לעיל, ואחריהם שלב 3.1.
- המתת חסד
הערה: יש לשטוף את הצינור של קטטר וריד האוזן במי מלח כדי למנוע חמצון של הברביטוראט.- שטפו את קטטר וריד האוזן במי מלח.
- חבר מזרק עם מנת יתר של פנטוברביטל (10 מ"ל, 400 מ"ג/מ"ל) והזריק את הפנטוברביטל דרך קטטר וריד האוזן.
תוצאות
באמצעות טכניקת חלון הגולגולת, אותות קליפת המוח נרשמו ב-43 מפגשים ב-16 בעלי חיים. בעלי חיים החלימו כראוי לאחר הניתוח ושוכנו בזוגות לאורך כל המחקר והיו במעקב יומיומי באמצעות תוכנית הרווחה בטבלה משלימה S1. כל בעלי החיים קיבלו ציון 0 בכל עת, מה שמעיד על רווחה מצוינת. איור 7 מראה שהחלונות אכן הוצבו מעל אזור S1 של קליפת המוח החזירית. בדרך כלל נצפו צלקות מסוימות על הדורה in vivo ואחרי המוות (איור 7A), אולם בדיקה שלאחר המוות גילתה שהיא מעולם לא השפיעה על רקמת קליפת המוח הבסיסית (איור 7B), שנראתה בריאה בכל החיות ודומה לאזור S1 הנגדי.

איור 7: מיקום החלון בקליפת המוח ביחס לאנטומיה של המוח. (A) כדי לחקור את בריאות הרקמה בקליפת המוח ואת מיקום החלון בקליפת המוח ביחס ל-S1, חלון הגולגולת הוסר בסוף המחקר. במקרה זה נעשה שימוש במרווחי ניתוח של שבועיים, וניתן להבחין ברקמת צלקת מסוימת על הדורה. (B) רקמת המוח הבסיסית נראית בריאה ולא מושפעת מהשתל. (C) שכבת-על של שתי התמונות מראה שהשתל אכן כיסה את אזור S1 בקליפת המוח של החזיר. החץ מציין את הציר הקדמי-אחורי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
בקצרה, כדי לנתח את האותות בקליפת המוח, יש לסנן אותם כדי להסיר רעשי קו וחפצים אחרים (ראה איור 8 וטבלה 1). נעשה שימוש במסנן חריץ סביב תדר רעש הקו, שהוא 50 הרץ באירופה וההרמוניות שלו. לאחר מכן האותות מסוננים במעבר גבוה כדי להסיר חפצי תנועה בהיסט ובתדר נמוך; תדר הניתוק המרבי תלוי במטרת ההקלטות, אך לא מומלץ להגיע ליותר מ-5 הרץ, מכיוון שהדבר יחליש הן את תכונות ה-ERP והן את תכונות ה-EEG הספונטניות. יתר על כן, מסנן מעביר-נמוכים משמש להסרת כל רעש בתדר גבוה. מכיוון שהאלקטרודה ממוקמת על גבי הדורה, תדרים גבוהים מוחלשים מעט על ידי הרקמה שבין המוח לאלקטרודה18. לכן, תדר הניתוק יכול להיות נמוך יותר מאשר כאשר האלקטרודה ממוקמת ישירות על רקמת המוח.

איור 8: צינור עיבוד נתונים. הנתונים הגולמיים שנאספו (שלב 1) מעובדים על ידי סינון (שלב 2). לאחר מכן הם מחולקים לתקופות על סמך טריגרים לגירוי (שלב 3), שהם ממוצעים (שלב 4). ה-ERP הממוצע משמש לניתוח נתונים (שלב 5). קיצור: ERPs = פוטנציאלים הקשורים לאירוע. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| סוג מסנן | חתך אופייני | סדר אופייני | חתך משומש | סדר משומש |
| חריץ | 50±3 הרץ או 60±3 הרץ | סדר גבוה | 50±3 הרץ ו | צו 10 |
| והרמוניות | הרמוניות ±1 הרץ | |||
| מעבר גבוה | 0.1-5 הרץ | הזמנה נמוכה | 1-5 הרץ | סדר 2 |
| מעבר נמוך | 100-1000 הרץ | הזמנה נמוכה | 300 הרץ | סדר 2 |
טבלה 1: מאפייני סינון אופייניים לניתוח אותות מוח על פני השטח שנרשמו באמצעות אלקטרוקורטיקוגרפיה או אלקטרואנצפלוגרפיה.
הנתונים המסוננים מחולקים לתקופות של 50-100 אלפיות השנייה לפני הגירוי ו-500-1,000 אלפיות השנייה אחריו. ערוצים רועשים מוסרים מהנתונים (איור 9A), והתקופות המזוהמות בחפצים מוסרות (איור 9B). התקופות הנותרות נטולות החפצים מחושבות בממוצע עבור כל ערוץ. לעתים קרובות ניתן להבחין בתגובות מעוררות בסריקות בודדות. אלה הופכים ברורים ועקביים יותר כאשר ממוצע של לפחות 10 תגובות ואינם משתנים כאשר ממוצע של יותר מ-25. צריכות להיות לפחות 20 תקופות נטולות חפצים כדי להשיג ממוצע אמין. זה בדרך כלל המקרה, וביותר ממחצית ממערכי הנתונים, לא היה צורך להסיר תקופות כלשהן. כדי להקל על השוואה בין ERPs שתועדו במהלך השלבים השונים (השתלה, גישה, ניתוחי המתת חסד), הנתונים בדרך כלל מנורמלים בציון z כדי להסביר את ההבדלים בעומק ההרדמה ובפעילות הרקע.

איור 9: דוגמאות לערוצים ותקופות גרועות. (A) לאותות מהקלטות אפידורליות על פני אזור קטן יחסית במוח יש מאפיינים דומים, אולם משרעות שונות. ערוצים לא תקינים נבדלים בקלות על ידי היעדר צורת הגל של ERP. בנוסף, ערוצים עשויים להציג חפצים, מראה רועש יותר ומשרעת אות גדולה יותר (ערוצים 9, 10 ו-13). ערוץ 7 הוא דוגמה נוספת לערוץ לא תקין ואינו קולט שום אות או רעש. (B) משרעת ה-ERP הצפויה היא עד כ-100 μV. לתקופות רועשות יש בדרך כלל משרעת גדולה יותר, מה שעשוי להשפיע על צורת הגל הממוצעת של ERP ולכן יש להסירו. צורת הגל הטיפוסית של ERP חסרה מאלה, אך לא תמיד ניתן להבחין בצורת גל זו בתקופות בודדות. קיצור: ERP = פוטנציאל הקשור לאירוע. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
האמינות של ה-ERP שתועדו בטכניקת חלון הגולגולת הייתה גבוהה במונחים של אמפליטודות שיא וחביון19. לא נמצאו הבדלים משמעותיים במשרעת השיא (הקלטה 1: 17.9 ± 7.26 μV; הקלטה 2: 17.6 ± 10.1 μV; הקלטה 3: 14.0 ± 6.95 μV) ושונות בין ערוצים (הקלטה 1: 6.47 ± 8.36 μV; הקלטה 2: 3.93 ± 6.13 μV; הקלטה 3: 3.84 ± 3.71 μV) בניתוח שונות שנמדד שוב ושוב (RM-ANOVA). נמצא הבדל משמעותי בהשהיה השיא בין ההקלטה הראשונה להקלטת המעקב. השיא היה 1 אלפיות השנייה מאוחר יותר בהקלטה הראשונה בהשוואה להקלטות ההמשך (הקלטה 1: 25.2 ± 2.0 אלפיות השנייה; הקלטה 2: 24.0 ± 2.4 אלפיות השנייה; הקלטה 3: 24.1 ± 2.0 אלפיות השנייה), מה שעשוי להיות קשור להתפתחות מערכת העצבים20,21, שכן במחקר זה נעשה שימוש בחזירים מתבגרים.
טכניקת חלון הגולגולת שימשה עוד כדי לחקור את ההשפעה של גירוי בתדר גבוה (HFS) על ERPs. HFS גורם לחיזוק ארוך טווח של נוירונים שטחיים בקרן הגב במכרסמים22,23, רגישות מוגברת לכאב ותגובות מוח מוגברות בבני אדם 24,25. נצפתה עלייה משמעותית במשרעת של שיא ה-N1 של הפוטנציאלים הקשורים לאירוע (עלייה של 259 ±-107% בהשוואה לקו הבסיס לפני ההתערבות), וניתן היה להבחין בהבדל ברור בין HFS לניסויים שבהם לא הופעל HFS באותה חיה (איור 10)17.
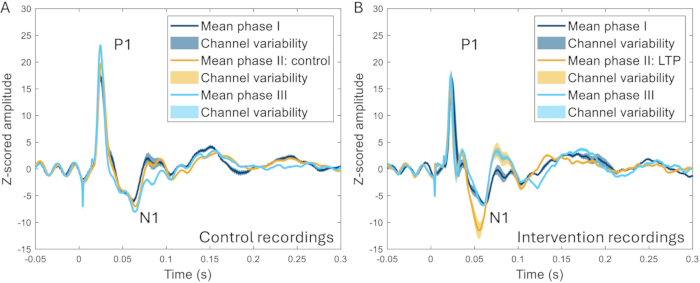
איור 10: דוגמאות של ERP בממוצע בכל הערוצים שתועדו 2-3 שבועות לפני, במהלך ו-2-3 שבועות לאחר השראת מודל כאב. (A) ה-ERP שנאסף מאותה חיה במהלך שלוש הקלטות שונות בהפרש של שבועיים זה מזה מראה מאפיינים דומים מאוד. (B) ל-ERP יש מאפיינים דומים בין ההקלטות, אולם ל-N1 יש משרעת גדולה יותר לאחר השראת העצמה ארוכת טווח בשלב II בהשוואה לשלבים האחרים שהם 3-4 שבועות לפני ואחרי שלב II. אזורים מוצללים מציינים את סטיית התקן בין הערוצים. קיצורים: ERPs = פוטנציאלים הקשורים לאירוע; LTP = חיזוק לטווח ארוך. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
טבלה משלימה S1: תוכנית רווחה לציון ההתנהגות הבודדת והחברתית של החזירים. אנא לחץ כאן להורדת קובץ זה.
Discussion
המשמעות של פיתוח טכניקה זו טמונה בהסרת מצבי כשל באלקטרודות, הפחתת תגובות רקמות ובכך שיפור האמינות של טכניקות הקלטה פולשניות בקליפת המוח. לא התרחשו מצבי כשל באלקטרודות במהלך המחקר, ובסך הכל נעשה שימוש בשני מערכי ECoG במהלך המחקר, כולל 16 בעלי חיים ו-43 מפגשי הקלטה. יש לכך השפעה חיובית נוספת על כלכלת המחקר. באמצעות שיטות מסורתיות מושתלות במלואן 12,26,27, יידרשו לפחות 16 מערכי ECoG בהנחה שלא מתרחשים כשלים במכשיר. עם זאת, מצבי כשל ותגובות רקמות ממשיכים להוות אתגרים משמעותיים ליישום נרחב של רישום מוח תוך גולגולתי 11,12,13,28,29. מחקר זה הפחית באופן משמעותי את מספר האלקטרודות, ובכך הפחית הן את העלות והן את הסיכון של מחקרים כרוניים במדעי המוח בו זמנית.
תופעת הלוואי היחידה שהתרחשה עם שתלי חלון הגולגולת היא זיהומים מזדמנים בניתוחים המוקדמים. זיהומים אלה היו תמיד שטחיים (לא הגיעו לרמת הדורה) ונפתרו על ידי השתלת ספוג אנטיביוטי נספג Genta-coll. בשל יעילותו של טיפול זה, השתלת הספוג האנטיביוטי אומצה כחלק מהשתלת חלון הגולגולת כאמצעי מניעה. למרות שחזירים הם בעלי חיים חזקים שמבצעים התנהגות השתרשות, אף אחד מהשתלים העשויים מ-PLA סטנדרטי לא נשבר.
כל האלקטרודות המושתלות כפופות לתגובת גוף זר, ואנקפסולציה גליאלית או סיבית 14,15,28,29,30. המשמעות היא שממשק האלקטרודה-רקמה, כמו גם יכולת ההקלטה של האלקטרודה, משתנים עם הזמן לאחר ההשתלה 13,18,28. בשיטה הנוכחית, תגובות הרקמות לא השפיעו על שלמות ונאמנות הרישום של האלקטרודות עקב אסטרטגיית מיקום האלקטרודות הזמנית. האלקטרודה הונחה על הדורה במהלך כל מפגש, ולכן ממשק האלקטרודה-רקמה היה דומה במהלך כל מפגש. הגורם היחיד שיכול היה להיות שונה מעט בכל מפגש הוא מיקום האלקטרודה. לכן, חיוני להתאים את גודל החלון לגודל האלקטרודה ולצלם תמונות של מיקום האלקטרודה במהלך כל סשן הקלטה. עם מאמצים אלה, תועדו ERP אמינים וניתנים לשחזור19.
תגובת רקמות לשתל חלון הגולגולת התרחשה, וצמיחה מחודשת של העצם נצפתה בפיילוטים המוקדמים ביותר שהשתמשו בחלון טרנס-גולגולתי ללא קירות המשתרעים מהמשטח החיצוני של הגולגולת לדורה. שכבה רציפה של רקמה גרמית רכה נמצאה שבועיים לאחר הפגישה הראשונה, מה שמעיד על צמיחה מחודשת של העצם. אי אפשר היה להסיר את הרקמה הזו ולגשת לדורה; לכן נוספו לחלון הגולגולת קירות אנכיים המשתרעים מפני השטח של הגולגולת ועד לדורה31 . חלונות באורכי דופן שונים הודפסו כדי להתאים את השתל לעובי הגולגולת כדי למנוע לחץ על קליפת המוח. בעלי חיים נחקרו לאחר המתת חסד, שגילתה רקמת מוח בריאה בכל בעלי החיים. רקמות רכות עדיין נוצרות באזור החלון; עם זאת, הוא אינו מתחבר לקיר ואינו רציף עם הגולגולת, מה שמקל על הסרתו באמצעות צמר גפן. זה קריטי לאמינות ההקלטות שהרקמה הרכה הזו תוסר מהחלון כך שהאלקטרודה תונח על הדורה בכל פעם.
תוצאות אופטימליות מתקבלות בהפרש של 3 שבועות לפחות בין ניתוחים. לאחר שבועיים, חלון הגולגולת נגיש, אך הרקמה הרכה באזור החלון מחוברת לדורה. יתר על כן, הפתיחה והסגירה של הפצע מסובכות בגלל דימום וחוסר גמישות ברקמה. בגיל 3 ו-4 שבועות, פצע החתך נרפא מספיק כך שגבולות הרקמה הרגילים (למשל, periosteum, עור, דורה) ברורים, מה שמקל על הסרת הרקמה הרכה מהחלון וסגירת העור מחדש מעל השתל. מכיוון שלא נצפתה רקמה דמוית עצם במרווחים של 4 שבועות, יותר מ-4 שבועות בין ניתוחים לניתוחים מרובים עשויים להיות אפשריים. לא בדקנו האם ניתן להאריך את התקופה בין הניתוחים למספר חודשים.
להצלחת ניתוחי ההשתלה והגישה, החתך הראשוני וסגירת הפצע הם קריטיים. הגמישות של עור המצח של החזיר מוגבלת מאוד, ולכן חיוני לשחרר את השכבה התת עורית של העור. זה מספק גמישות נוספת לסגירת העור מעל השתל ומפחית את הלחץ על התפרים. מתח זה מופחת עוד יותר על ידי שימוש בשתי שכבות של תפרים ודבק עור נוסף. העור נתפר בטכניקת תפירה תוך עורית רציפה כדי למנוע מבעלי החיים לשרוט את הפצעים ולהסיר את התפרים בטרם עת. אסטרטגיות הפתיחה והסגירה של הפצע הן קריטיות בשני סוגי ניתוחי ההישרדות, בין אם מדובר בשתל או בניתוח גישה.
מגבלה של הגישה הנוכחית היא שהגישה לחלון דורשת ניתוח קל, המונע הקלטות בבעלי חיים ערים. המשמעות היא שבהתאם לשאלת המחקר, זו לא תהיה גישה מתאימה לכל מחקר. כדי להשתמש במכשירים מושתלים במלואם בהקלטות ערות, קיימות שיטות אחרות להתגברות על שינויים ביולוגיים בממשק32. מכיוון שהגישה לחלון הגולגולת היא הליך קטן, ייתכן שניתן יהיה להשתמש בהרדמה מקומית ובחומר הרגעה ולא בהרדמה כללית. היתרונות של חלון הגולגולת שנמצא כולו מתחת לעור הם סיכוי מופחת לזיהום ושיפור רווחת בעלי החיים, מכיוון שבעלי חיים יכולים להיות מאוחסנים בזוגות או בקבוצה. יתר על כן, חקרנו רק את מהימנות התגובות המעוררות19. עם זאת, פעילות מוחית ספונטנית תועדה והיא בדרך כלל אמינה וניתנת לשחזור יותר מ-ERP8, מה שמצביע על כך שהשיטה אינה מוגבלת לרישום ERP.
השיטה שלנו מציגה שיטה חדשנית, ניתנת להרחבה, אמינה וניתנת לשחזור עבור הקלטות כרוניות בקליפת המוח. שיטה זו היא בעלת ערך רב למחקרים במדעי המוח, שבהם אמינות ושחזור חיוניים לתוצאות המחקרים33,34. השתמשנו בשיטה כדי לחקור תגובות מעוררות בקליפת המוח מ-S1 לפני ואחרי השראת מודלים ובקרות שונות של כאב, והראינו תוצאות חזקות17. באופן כללי, ניתן להתאים את השיטה בקלות לגישה לאזורים אחרים בקליפת המוח, למשל, לחקור תנועה, שמיעה או ראייה. ייתכן שניתן יהיה להשתמש בשיטה גם לאבחון אפילפסיה 4,35 או לעקוב אחר טיפול ושיקום לאחר פגיעה מוחית36,37.
השיטה ניתנת להרחבה גם למינים אחרים, כמו פרימטים לא אנושיים או יונקים אחרים, חתולים, כלבים או כבשים 35,38,39. כל אחת מההתאמות הללו תדרוש התאמת הטכניקה הכירורגית, זיהוי ציוני דרך אמינים למיקום חלון הגולגולת והתאמת עיצובו. המחברים ממליצים להשתמש בגופות כדי לייעל את טכניקת חלון הגולגולת לפני שתמשיך לניסוי פיילוט. עבור אזורים מסוימים במוח, הניתוח עשוי להיות פולשני יותר, מה שעשוי לגרום לזמן החלמה אופטימלי שונה ממה שאנו ממליצים. בנוסף, ניתן להתאים את הטכניקה כדי לאפשר הקלטות ECoG תת-דוראליות והקלטות תוך-קורטיקליות, ובכך להרחיב את יישומיה ולהגדיל את הגישה לאזורי מוח שונים. בשל עובי גולגולת החזיר, ייתכן שיהיה צורך להגדיל את גודל החלון בקליפת המוח כדי לבצע את הדורוטומיה עבור הקלטות תת-דוראליות 26,27.
להקלטות תוך-קורטיקליות, ניתן למקם את האלקטרודה באמצעות צינורית או מעבורת40, מה שמאפשר הקטנה נוספת של גודל החלון בקליפת המוח. הן טכניקות תת-דוראליות והן תוך גולגולתיות יגדילו את הסיכון לדימום, ולכן יש לנקוט בזהירות במהלך הניתוח כדי להימנע מכלי דם. טכניקת חלון הגולגולת עשויה לשמש גם למטרות אחרות מלבד הקלטת אותות חשמליים מהמוח, למשל, הדמיה של כלי הדם, שהיא רלוונטית מאוד במודלים חזיריים של מיגרנה41. יתר על כן, ניתן להתאים את שיטת חלון הגולגולת לשימוש בשילוב עם טכניקות הדמיה חדשות31, כמו הדמיה דו-פוטונית, וניתן לשלב אותה עם התחליף הדוראלי שפותח על ידי קוסטין-ברטל ואחרים לשיפור הרזולוציה האופטית42.
לסיכום, הגישה המתודולוגית המוצגת מפחיתה את הסיכונים הקשורים לשתל קבוע12,13 על ידי ביטול הסיכון לכשל במכשיר, מזעור תגובות ביולוגיות באתר האלקטרודה, ובכך הגברת נאמנות ההקלטה וכתוצאה מכך הקלטות קליפת המוח אמינות ביותר. המתודולוגיה טומנת בחובה גם הבטחה גדולה ליישומים אחרים, מכיוון שהיא ניתנת להרחבה למינים אחרים ולסוגי תיעוד.
Disclosures
למחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
המחברים רוצים להודות למטפלים ולטכנאים בחיות המעבדה בבית החולים האוניברסיטאי אלבורג. המרכז לנוירופלסטיות וכאב (CNAP) נתמך על ידי קרן המחקר הלאומית הדנית (DNRF121). איור 6 ואיור 8 נוצרו ב-BioRender.
Materials
| Name | Company | Catalog Number | Comments |
| Cranial window implantation | |||
| Scalpel | disposable, blade 10 | ||
| Tweezers | |||
| Gauze | |||
| Cauterizer | |||
| Periosteum elevator | flat, 10 mm width | ||
| Weitlaner retractor | 3 x 4 prong, blunt, 16.5 cm | ||
| Midas Rex Legend EHS stylus surgical drill system | Medtronic Powered Surgical Solutions, Fort Worth, USA | ||
| Legend Ball Fine drill bits | Medtronic Powered Surgical Solutions, Fort Worth, USA | 7BA40F-MN and 7BA60F-MN | MedNext type 4 and 6 mm head diameter |
| Sterile cover for the drill | |||
| Syringe | 5 mL | ||
| Saline | |||
| Suction | |||
| Ruler | |||
| Cotton buds | |||
| Rongeur | straight jaw, 15 cm, 3 x 20 mm bit size | ||
| 2.5 mm hand drill and handle | |||
| Butterfly infusion set | |||
| Six M3 screws in 6-14 mm length | |||
| Screwdriver | |||
| Three sizes of 3D-printed cranial window (4-, 5- and 6-mm depth) and cap | |||
| Deisolated U-shaped connector | |||
| Crocodile connector | |||
| Genta-coll resorbable antibiotic sponge | |||
| VYCRIL resorbable suture | Ethicon | 2-0 26 mm round bodied | |
| Monocryl non-resorbable suture | Ethicon | 3-0 24 mm reverse cutting | |
| Needle holder | |||
| Scissors | |||
| Topical adhesive tissue glue | Leukosan | ||
| Peripheral wire implantation | |||
| Two partially uninsulated Cooner wires | |||
| NOTE: 1-2 cm of the wires is uninsulated in the middle and at one of the ends | |||
| Two 23 G needles | |||
| Gauze | |||
| Programmable stimulator controlled by a PC running MC_stimulus | Multichannel Systems, Reutlingen, Germany | STG4008 | |
| Two crocodile connectors | |||
| Cortical recordings | |||
| Metal plate for the magnetic micromanipulator | |||
| Magnetic micromanipulator stand | |||
| Micromanipulator | |||
| Headstage holder | |||
| 32-channel ZIF-clip headstage | TDT, Alachua, FL, USA | ||
| 32-channel micro-electrocorticography (µECoG) array | Neuronexus, Ann Arbor, USA | E32-1000-30-200 | |
| TDT recording equipment including pre-amplifier SI8, data processor RZ2 and workstation WS8 | TDT, Alachua, FL, USA |
References
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved