Method Article
Мониторинг прогрессирования легочного узла с помощью микрокомпьютерной томографии и забора крови на мышиной модели
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол описывает эффективный, простой и минимально инвазивный метод исследования легочных узелков. В качестве методов исследования используются забор крови из подчелюстных вен и микрокомпьютерная томография.
Аннотация
Микрокомпьютерная томография (микрокомпьютерная томография) — это интуитивно понятный, чувствительный и минимально инвазивный метод в режиме реального времени для мониторинга изменений от легочных узлов (ПН) до рака легких (ЛК). Интеграция отбора проб крови из подчелюстных вен обеспечивает быстрое, стабильное и простое обнаружение визуализации и ключевых изменений мишени во время прогрессирования ПН в ЛК. В этом исследовании мы вводили дозу 100 мг/кг 4-(метилнитрозамино)-1-(3-пиридил)-1-бутанона мышам типа A/J для разработки модели аденокарциномы легкого. Прогрессирование заболевания у экспериментальных животных затем контролировалось с помощью забора крови из подчелюстных вен и микрокомпьютерной томографии. Результаты эксперимента показали наличие узловых очагов в легких у некоторых животных к10-й неделе, при этом развитие изображений аденокарциномы легкого стало очевидным к21-й неделе. В заключение следует отметить, что микрокомпьютерная томография может эффективно наблюдать за патологическими изменениями в легких мышей и, в сочетании с забором крови из подчелюстных вен, может динамически контролировать изменения крови, белка и мишеней. Этот метод обеспечивает высокоспецифичный, простой и чувствительный подход к скринингу лекарственных средств, фармакокинетическим испытаниям, токсикологическим экспериментам и исследованиям безопасности.
Введение
Рак легких (РЛ) – это тяжелое новообразование, возникающее в слизистой оболочке бронхов или легочных железах. Согласно статистическим данным за 2021 год, LC ежегодно становится причиной около двух миллионов смертельных случаев во всем мире, при этом показатели заболеваемости и смертности растут1. Ранняя диагностика и вмешательство при ЛК способствуют повышению показателей излечения, снижению смертности и снижению затрат на лечение. Легочные узелки (ПН) являются специфическими предшественниками ЛК, характеризуются локализованными, круглыми и более плотными твердыми или субтвердыми тенями ≤30 мм в диаметре при рентгенологических исследованиях, без признаков коллапса легкого, увеличения медиастинальных лимфатических узлов или плеврального выпота2. Национальная комплексная онкологическая сеть (NCCN) в 2022 году классифицировала ПН по количеству, диаметру и плотности, выявив такие комбинации, как изолированный 5 мм узел из матового стекла в правом легком3. Тем не менее, в рекомендациях NCCN указано, что риск малигнизации при ПП увеличивается с диаметром и количеством узелков. Широкое применение низкодозной компьютерной томографии привело к резкому увеличению числа диагнозов ПН,при этом ежегодно выявляются миллионы новых случаев4.
Комбинация мышей типа A/J с 4-(метилнитрозамино)-1-(3-пиридил)-1-бутаноном (NNK) является наиболее часто используемой животной моделью рака легких (LC)5,6. Использование микрокомпьютерной томографии в сочетании с забором крови из подчелюстных вен является эффективным подходом к мониторингу изменений от легочных узлов (ПН) к ЛК в режиме реального времени. Индукция химических канцерогенов, особенно на мышах NNK и A/J, является наиболее распространенным методом моделирования рака легких и доказала свою эффективность при установлении карциномы in situ 7,8. Этот метод моделирования более точно моделирует прогрессирование PN в LC по сравнению с методом подмышечной инокуляции.
Предыдущие исследования были сосредоточены на статистическом анализе морфологии узелков и патологическом окрашивании образцов тканей после эвтаназии. Однако эти методы не позволяют в режиме реального времени отслеживать динамическое развитие от PN к LC10. Микрокомпьютерная томография, как неинвазивный метод визуализации, обеспечивает точные продольные данные с высоким разрешением, быстрой визуализацией, низкой дозой облучения и безопасностью, что делает ее пригодной для обнаружения изображений легких в режиме реального времени11,12. Забор крови из подчелюстных вен является новейшим, самым простым и быстрым методом получения образцов крови у мышей13. Этот неинвазивный метод требует минимального обращения с животными и обеспечивает быстрое выздоровление, в соответствии с принципами 3R, направленными на сокращение количества животных, используемых в исследованиях, минимизацию дискомфорта и продвижение этичного обращения. Объем собранной крови, примерно 0,2-0,5 мл, достаточен для контроля параметров крови при умеренных потребностях14.
Одновременное использование микрокомпьютерной томографии и забора крови из подчелюстных вен позволяет в режиме реального времени наблюдать за прогрессированием PN-to-LC на визуализации и обнаруживать в режиме реального времени ключевые мишенив кровотоке. Кроме того, этот подход позволяет исследовать метаболиты и другие биохимические вещества в режиме реального времени, что в сочетании с такими методами, как высокоэффективная хроматография, расширяет наше понимание LC16,17.
В этом исследовании мыши A/J в сочетании с NNK были использованы для создания мышиной модели рака легких in-situ. Микрокомпьютерная томография проводилась через 4, 10 и 20 недель после индукции модели для получения изображений легких, в то время как кровь собиралась с помощью забора подчелюстных вен на протяжении всего эксперимента. Данное исследование направлено на создание основы для исследований ПН и ЛК путем комбинирования забора крови из подчелюстных вен с микрокомпьютерной томографией.
В онкологии микрокомпьютерная томография является высокоэффективным инструментом для обнаружения опухолевого роста, предлагая технику с высоким разрешением для измерения локальных изменений теневого фокуса в любое время во время таких исследований18,19. Тем не менее, важно признать, что микро-КТ сама по себе не дает информации о характеристиках теневого фокуса, физиологическом статусе животного или уровнях ключевых биологических факторов. Таким образом, в данном исследовании в качестве дополнительного метода был использован забор подчелюстных вен.
протокол
Все эксперименты на животных, описанные в этом исследовании, были одобрены Комитетом по этике благополучия экспериментальных животных Университета традиционной китайской медицины Чэнду и проводились в соответствии с соответствующими законами и этическими стандартами для исследований на животных (номер обзора: 2024035). Самки инбредных мышей A/JGpt (в возрасте 7-8 недель) содержались при температуре 20-24 °C с относительной влажностью 40%-70%. Они получали стандартный корм для животных и очищенную воду в неограниченном количестве в течение 12-часового цикла «свет-темнота». Перед экспериментом каждое животное акклиматизировалось к этой среде в течение 7 дней. Подробная информация об используемых реагентах и оборудовании приведена в Таблице материалов.
1. Реагенты и препараты животного происхождения
- Химикаты и реактивы
- Растворите NNK в физрастворе с образованием мастер-смеси 10 мг/мл20. Однократное внутрибрюшинное введение 0,2 мл с концентрацией 100 мг/кг в группу ННК, при этом в бланковую группу вводится равный объем нормального физиологического раствора.
ПРИМЕЧАНИЕ: Следуйте за Jang et al.21 , чтобы определить время проведения микрокомпьютерной томографии и забора крови.
- Растворите NNK в физрастворе с образованием мастер-смеси 10 мг/мл20. Однократное внутрибрюшинное введение 0,2 мл с концентрацией 100 мг/кг в группу ННК, при этом в бланковую группу вводится равный объем нормального физиологического раствора.
- Забор крови
ПРИМЕЧАНИЕ: Чтобы обеспечить здоровье мышей, ограничьте сбор крови не более чем 0,2 мл за каждый раз и дайте одну неделю на восстановление. Из-за обилия волос в подбородочной области следите за тем, чтобы не допустить загрязнения образца крови волосами во время сбора.- Удалите волосы на морде животного за день до эксперимента с помощью подходящей бритвы.
- Крепко возьмитесь левой рукой за кожу на задней стороне головы мыши, чтобы предотвратить любое движение и удерживать голову мыши в фиксированном положении.
- Быстро введите иглу для сбора крови в подчелюстную артерию из нижней челюсти за косой глазницей. Удерживайте иглу на месте не менее 3 с, чтобы обеспечить оптимальный кровоток. Соберите 50-200 μл крови.
- Соберите кровь в пробирку с ЭДТА. С помощью ватного тампона слегка надавите на кожу, чтобы остановить кровотечение. Как только кровотечение прекратится, отпустите мышь и наблюдайте за ней в течение 30 с.
- Аккуратно взбалтывайте пробирку, чтобы убедиться, что кровь тщательно перемешана с коагулянтом.
- Для рутинного анализа крови поместите собранную кровь в ветеринарный прибор для рутинного анализа крови, нажмите кнопку сбора и дайте инструменту собрать кровь. Запишите отображаемые результаты. Безопасно утилизируйте оставшуюся кровь.
2. Визуализация in vivo с помощью микрокомпьютерной томографии
ПРИМЕЧАНИЕ: Перед использованием микрокомпьютерной томографии всегда удаляйте металлические предметы, такие как ушные бирки, с подопытного животного. Металлические предметы могут привести к серьезным артефактам на изображении. Микро-КТ излучает определенное количество излучения; Убедитесь, что это не повлияет на другие экспериментальные результаты.
- Запустите устройство, запустите программное обеспечение микро-КТ и выполните калибровку и прогрев датчика. Для сканирования используйте платформу для инструментов, предназначенную для мыши.
- Создайте новую базу данных и присвойте ей имя для сканирования или подключите ее к существующей базе данных.
- Измените параметры в окне настройки программного обеспечения. Установите рентгеновский фильтр на Cu0,06 + Al0,5, напряжение 70 кВ, ток 80 мкА, поле зрения 36 мм × 36 мм, вращательное сканирование на 360° и время сканирования 4 мин22.
- Анестезируйте мышей 3% изофлураном перед сканированием23 (в соответствии с утвержденными в учреждении протоколами). Откройте экран просмотра микро-КТ и закрепите мышей на ложе для инструментов с помощью клейкой ленты. Непрерывно поддерживайте анестезию с помощью назогастрального зонда, помещенного в инструмент микрокомпьютерной томографии на ложе для инструментов.
- Осторожно направляйте животное в аппарат и следите за его положением в режиме реального времени. Используйте соответствующие кнопки для регулировки положения мыши, чтобы ее грудь была полностью видна в поле зрения.
- Поверните станину с инструментом на 90°, чтобы расположить мышь. Используйте кнопки для регулировки положения мыши, следя за тем, чтобы область легких располагалась по центру в поле зрения. Затем верните станину для инструмента в исходное положение.
- Чтобы начать сканирование, нажмите кнопку Сканировать . Позвольте системе завершить сканирование без прерывания и не открывайте экран просмотра во время процесса. Наблюдайте за трансаксиальными, корональными и сагиттальными срезами реконструкции с помощью программного обеспечения.
- Оцените качество изображения сразу после сканирования. Если появились артефакты или размытые изображения, повторите процедуру сканирования.
- Извлеките мышей из аппарата и следите за их здоровьем, чтобы убедиться, что они находятся в стабильном состоянии, прежде чем возвращать их в клетки.
- В конце эксперимента снимите клейкую ленту со станины для инструментов, затем очистите станину. Сохраните данные и выключите прибор.
- Осторожно переведите мышей обратно в клетки, чтобы свести к минимуму стресс. Убедитесь, что клетки чистые и имеют соответствующую подстилку.
- Следите за мышами на предмет признаков восстановления после анестезии. Наблюдайте за их поведением, подвижностью и аппетитом. Обеспечьте едой и водой по мере необходимости.
- Поддерживайте теплую среду для мышей, чтобы предотвратить переохлаждение после анестезии. При необходимости используйте грелки или одеяла.
- Проводите ежедневные медицинские осмотры в течение следующей недели. Ищите признаки стресса, необычного поведения или любых травм. Задокументируйте наблюдения для каждой мыши.
- Если у какой-либо мыши проявляются признаки болезни или стресса, проконсультируйтесь с ветеринаром для соответствующего вмешательства и ухода.
- Убедитесь, что мыши возвращаются в свои нормальные жилищные условия после того, как они полностью выздоровеют и будут стабильны.
3. Обработка и анализ данных
- Используйте программное обеспечение для статистики и построения графиков в качестве ценного инструмента для анализа данных и создания таблиц для представления результатов.
- Откройте программу. Выберите графики XY из вновь созданной таблицы данных, введите еженедельные данные для NNK и контрольной групп и создайте диаграмму, отображающую изменения веса мышей.
- Снова откройте программное обеспечение, выберите диаграмму непредвиденных обстоятельств из вновь созданной таблицы данных, введите рутинные данные крови для группы NNK и контрольной группы и сгенерируйте значок.
- Выберите параметры анализа в программном обеспечении. Проанализируйте общие данные с помощью одностороннего анализа ANOVA с последующей проверкой данных с помощью внедрения t-критерия. Отметьте существенные отличия.
- Сохраните данные микрокомпьютерной томографии в формате SimpleViewer или DICOM. Откройте программное обеспечение SimpleViewer и наблюдайте за данными визуализации под руководством профессионального врача. Пометьте узелки и количественно оцените объем теней с помощью предоставленных измерительных инструментов.
Результаты
Это исследование продемонстрировало построение стабильной модели рака легких с использованием NNK в сочетании с мышами A/J. План эксперимента проиллюстрирован на рисунке 1. Цель исследования состояла в том, чтобы наблюдать в реальном времени за процессом перехода от легочных узелков (ПН) к раку легкого (ЛЛ) в легких мышей с помощью микрокомпьютерной томографии и забора крови из подчелюстных вен. Соответственно, микрокомпьютерная томография и забор крови из легких мышей проводились на четвертой, десятой и двадцатой неделях.
Экспериментальные результаты показали, что подход к моделированию NNK в сочетании с мышами A/J эффективно имитирует патологический процесс от PN к LC. Во-первых, можно констатировать, что анализ, использованный в данном исследовании, не оказал существенного влияния на благополучие подопытных животных. Как показано на рисунке 2, масса тела экспериментальных животных в течение 20-недельного периода кормления не показала заметных различий по сравнению с контрольной группой. Во-вторых, результаты рутинных анализов крови на образцах, взятых у подопытных животных, выявили значительное увеличение количества лейкоцитов и тромбоцитов в модельной группе, в то время как количество эритроцитов и гемоглобина осталось неизменным (рис. 3). Это свидетельствует о том, что процесс трансформации из ПН в ЛК также связан с постепенным нарастанием хронического воспаления. Важно отметить, что как микрокомпьютерная томография, так и забор крови из подчелюстных вен не нарушили кроветворную функцию экспериментальных животных, что согласуется с результатами многочисленных предыдущих исследований. Кроме того, тщательное наблюдение за поведением, состоянием шерсти, дыханием, диетой и потреблением воды подопытными животными на протяжении всего исследования не выявило никаких отклонений.
После первоначального введения ННК экспериментальным животным мы провели микрокомпьютерную томографию легких в первый день четвертой, десятой и двадцатой недель24. Результаты показали, что по сравнению с контрольной группой, текстура легких модельной группы демонстрировала постепенное утолщение. К10-й неделе наблюдалось образование мельчайших узелковых очагов, а к20-й неделе узелки превратились в различимые теневые очаги. В свете этих результатов можно предположить, что образование теневых очагов в легких связано с хроническим воспалением, индуцированным NNK25. Однако, поскольку данное исследование было разработано для наблюдения за безопасным, эффективным и безвредным развитием ПН в ЛК без проведения патологических исследований на животных, последующие исследования должны проводиться в соответствии со специальными экспериментальными протоколами26. На рисунке 4 показаны изменения в визуализации легких, наблюдаемые у экспериментальных животных на 4, 10 и 20 неделях.

Рисунок 1: Экспериментальный дизайн лечения NNK у мышей A/J. Пяти самкам мышей A/J вводили соединение NNK в один момент времени, в то время как еще пяти вводили физиологический раствор в качестве контроля. Образцы крови собирали на 4, 10 и 20 неделях с помощью микрокомпьютерной томографии легких мышей и забора крови из подчелюстных вен. Полученные данные были подвергнуты перекрестной валидации для оценки прогрессирования заболевания у мышей. (А) Обзор плана эксперимента. (Б) Диаграмма забора крови из подчелюстной артерии. (C) Схематическое изображение микрокомпьютерной томографии, показывающее мышь, расположенную на кровати животного (синяя), и желтую рамку в качестве видоискателя, которая должна полностью покрывать легочную ткань мыши. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
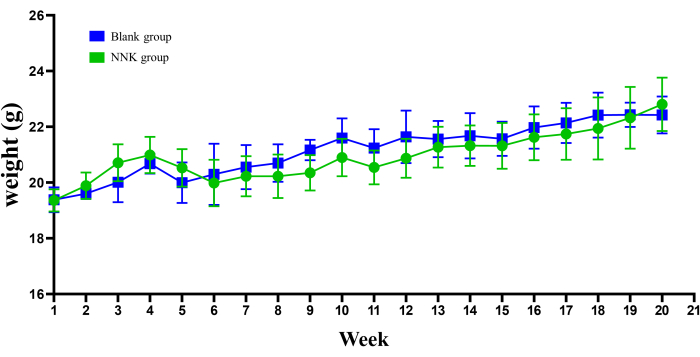
Рисунок 2: Изменения веса у мышей в течение 20 недель. Тенденции веса показали, что лечение NNK у мышей с A/J не привело к значительному снижению массы тела. Микрокомпьютерная томография и экстракция крови из подчелюстных вен могут вызвать некоторый стресс у мышей; Однако они быстро восстановились. Данные выражаются в виде среднего ± SEM, (n = 5). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Количество клеток крови с течением времени. Содержание лейкоцитов, тромбоцитов, эритроцитов и гемоглобина измеряли у мышей на 4, 10 и 20 неделях. По сравнению с контрольной группой, в группе ННК наблюдалась тенденция к увеличению количества лейкоцитов и тромбоцитов, в то время как уровни гемоглобина и эритроцитов существенно не изменялись. Эти данные свидетельствуют о том, что процесс трансформации PN-LC связан с усилением воспаления и что метод забора крови из подчелюстной вены, выполняемый с интервалом более 4 недель, не вызывает инфекции или нарушения кроветворной функции у мышей. (А) Лейкоциты. (б) Тромбоциты. (В) Эритроциты. (Г) Гемоглобин. Данные выражаются в виде среднего ± SEM, (n = 5). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
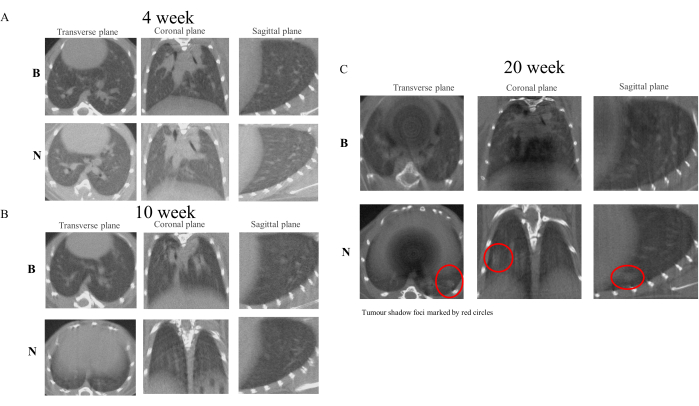
Рисунок 4: Микрокомпьютерная томография мышей на 4, 10 и 20 неделях. Результаты микрокомпьютерной томографии показывают, что лечение NNK у мышей с A/J эффективно моделирует процесс трансформации PN-LC. По сравнению с контрольной группой, группа ННК начала проявлять признаки утолщения и изменения текстуры на изображениях легких к 10-й неделе. На 20-й неделе в легочной ткани были различимы устойчивые теневые очаги. (A) Изображения с недели 4. (B) Изображения с недели 10. (C) Изображения с недели 20. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Важно повторить несколько ключевых моментов из этого исследования. Во-первых, хотя забор крови из подчелюстных вен является относительно малотравматичной процедурой, он все же может привести к некоторой степени вреда для животных. Поэтому необходимо провести несколько процедур, чтобы снизить нагрузку на мышей и своевременно завершить процесс27. Во-вторых, удаление волос перед забором крови обеспечивает чистоту образца. В-третьих, обязательно нужно использовать соответствующие сосуды для сбора крови. В настоящем исследовании сосуды для забора крови, содержащие ЭДТА, использовались для рутинных анализов крови. Если бы использовалась сыворотка, то потребовались бы сосуды, специально предназначенные для сбора чистой крови. В-четвертых, все анестетики имеют определенный уровень летальности; Таким образом, сведение к минимуму времени анестезии и визуализации может эффективно защитить здоровье мышей. В-пятых, поскольку микро-КТ может наблюдать за различными тканями и органами, конкретные настройки параметров в программном обеспечении микро-КТ, используемом во время визуализации ПН, могут быть использованы в данном исследовании, но могут быть неприменимы к другим тканям.
Предыдущие исследования были более склонны к усыплению животных в фиксированные моменты времени и изучению процесса трансформации легочных узелков посредствомпатологического окрашивания. Такой подход приводил к значительному количеству смертей среди подопытных животных и затруднял отслеживание изменений в легких в режиме реального времени. По сравнению с традиционными методами, забор подчелюстной крови и микрокомпьютерная томография имеют ряд преимуществ, включая минимальное повреждение, мониторинг в режиме реального времени, интуитивно понятное управление и универсальность. В данном исследовании сбор подчелюстной крови был выбран в качестве предпочтительного метода получения образцов крови для рутинных анализов32. Кроме того, кровь может быть использована для протеомического, сывороточного фармакологического и биохимического анализов крови.
Аналогичным образом, микро-КТ была использована в этом исследовании для наблюдения за динамическим ростом ПН у экспериментальных мышей без необходимости их эвтаназии. Такой подход способствует более интуитивной и точной оценке ингибиторного действия препарата на ПН при значительном сокращении количества животных, необходимых для эксперимента, тем самым повышая точность результатов эксперимента. Примечательно, что сочетание этих двух технологий позволяет всесторонне отслеживать процессы образования, развития и канцерогенеза клубеньков у экспериментальных животных, а также локализовать изменения в ключевых мишенях (таких как TNF-α)33. Это представляет собой уникальную концепцию для исследования ПН и даже рака легких.
Тем не менее, ряд вопросов требует дальнейшего рассмотрения для повышения качества будущих исследований. Учитывая длительный экспериментальный период, необходимый для животной модели NNK в сочетании с мышами A/J, крайне важно, чтобы ранние инъекции лекарств проводились смаксимальной точностью. Во-вторых, стандартный метод получения аденокарциномы легкого у мышей включает NNK в координации с самками мышей A/J, при этом основной механизм связан с эстрадиолом. Поэтому важно рассмотреть конкретные механизмы действия задействованных терапевтических препаратов35. Кроме того, микрокомпьютерная томография не использовалась для определения природы теневых очагов, что обусловливает необходимость использования окрашивания гематоксилином и флуоресцентного окрашивания, которые до сих пор требуют усыпления мышей для получения образцов легочной ткани. Наконец, несмотря на то, что микрокомпьютерная томография имеет преимущество в виде низкой лучевой нагрузки, она все же может нанести определенный вред человеческому организму, что обуславливает необходимость избегания близости к постороннемуперсоналу. Для решения этих проблем дифференцировка и маркировка различных тканей, дыхательных путей и кровеносных сосудов могут быть эффективно достигнуты с помощью инъекции контрастного вещества в хвостовую вену. Кроме того, микрокомпьютерная томография в сочетании с лекарствами из новых материалов (например, наночастицами) может быть использована для более точного лечения. Наконец, технология микрокомпьютерной томографии постепенно интегрируется с патологией, такой как пространственная и визуальная гистология, для более динамичного отслеживания изменений в легочных узлах36,37.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим профессора Цун Хуана из Школы фундаментальных медицинских наук и профессора Янь Хуана из Школы фармацевтики Университета традиционной китайской медицины в Чэнду за их поддержку. Мы также хотели бы поблагодарить доктора Бинцзе Сюя и доктора Пэнмэй Го. (Инновационный институт китайской медицины и фармации, Чэнду
Университет традиционной китайской медицины) за предоставление инструментов и техническую поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| A/J mice | GemPharmatech LLC. | N000018 | |
| 0.5 mL EDTA tubes | Labshark | 130201070 | |
| 1-Butanone,4-(methylnitrosoamino)-1-(3-pyridinyl) | Gu Shi Gong Yuan Medical Equipment Co. | N589770 | |
| 75% ethanol | ChengDu Chron Chemicals Co,.Ltd | 2023052901 | |
| Animal shaver | Codos | BM010220 | |
| Isoflurane | Shenzhen Reward Life Technology Co. | R510-22-16 | |
| medical tricorder | MedChemexpress | 69652 | |
| Quantum GX2 microCT imaging system | PerkinElme | 2020166501 | |
| Saline (medicine) | Beijing Biolabs Technology Co. | GL1736 |
Ссылки
- Sung, H., et al. Global cancer statistics 2020: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 71 (3), 209-249 (2021).
- Baum, P., et al. Incidental pulmonary nodules: Differential diagnosis and clinical management. Dtsch Arztebl Int. , (2024).
- Ajani, J. A., et al. Gastric cancer, version 2.2022, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 20 (2), 167-192 (2022).
- Kondo, K. K., et al. Lung cancer diagnosis and mortality beyond 15 years since quit in individuals with a 20+ pack-year history: A systematic review. CA Cancer J Clin. 74 (1), 84-114 (2024).
- Ray, E., et al. Inhalable chitosan-coated nano-assemblies potentiate niclosamide for targeted abrogation of non-small-cell lung cancer through dual modulation of autophagy and apoptosis. Int J Biol Macromol. 279 (Pt 4), 135411 (2024).
- Ali, N. A., et al. Chia seed (Salvia hispanica) attenuates chemically induced lung carcinomas in rats through suppression of proliferation and angiogenesis. Pharmaceuticals (Basel). 17 (9), 1129 (2024).
- Kiran, A., Kumari, G. K., Krishnamurthy, P. T. Preliminary evaluation of anticancer efficacy of pioglitazone combined with celecoxib for the treatment of non-small cell lung cancer. Invest New Drugs. 40 (1), 1-9 (2022).
- Marshall, K., Twum, Y., Gao, W. Proteome derangement in malignant epithelial cells and its stroma following exposure to 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone. Arch Toxicol. 97 (3), 711-720 (2023).
- Li, B., et al. LNCRNA XIST modulates miR-328-3p ectopic expression in lung injury induced by tobacco-specific lung carcinogen NNK both in vitro and in vivo. Br J Pharmacol. 181 (15), 2509-2527 (2024).
- Liang, F., et al. Tobacco carcinogen induces tryptophan metabolism and immune suppression via induction of indoleamine 2,3-dioxygenase 1. Signal Transduct Target Ther. 7 (1), 311 (2022).
- Ding, R., et al. The effect of immunotherapy PD-1 blockade on acute bone cancer pain: Insights from transcriptomic and microbiomic profiling. Int Immunopharmacol. 142 (Pt A), 113100 (2024).
- Kayı Cangır, A., et al. Microcomputed tomography as a diagnostic tool for detection of lymph node metastasis in non-small cell lung cancer: A decision-support approach for pathological examination "a pilot study for method validation"). J Pathol Inform. 15, 100373 (2024).
- Packialakshmi, B., et al. A clinically-relevant mouse model that displays hemorrhage exacerbates tourniquet-induced acute kidney injury. Front Physiol. 14, 1240352 (2023).
- Sørensen, D. B., et al. Time-dependent pathologic and inflammatory consequences of various blood sampling techniques in mice. J Am Assoc Lab Anim Sci. 58 (3), 362-372 (2019).
- Wu, G. L., Li, T. Y., Pu, X. H., Yu, G. Y. Effect of prescriptions replenishing vital essence, tonifying qi and activating blood on TNF-alpha, IL-1beta expressions in serum and submaxillary gland of nod mice with Sjogren's syndrome. Zhongguo Zhong Yao Za Zhi. 38 (3), 413-416 (2013).
- Schroeder, J. A., et al. Thromboelastometry assessment of hemostatic properties in various murine models with coagulopathy and the effect of factor VIII therapeutics. J Thromb Haemost. 19 (10), 2417-2427 (2021).
- Guo, K., et al. Integration of microbiomics, metabolomics, and transcriptomics reveals the therapeutic mechanism underlying Fuzheng-Qushi decoction for the treatment of lipopolysaccharide-induced lung injury in mice. J Ethnopharmacol. 334, 118584 (2024).
- Luo, T., Zhang, S., Li, X., Huang, M. Challenges in the differential diagnosis of pulmonary tuberculosis vs. lung cancer: A case report. Oncol Lett. 28 (4), 494 (2024).
- Mascalchi, M., et al. Large cell carcinoma of the lung: LDCT features and survival in screen-detected cases. Eur J Radiol. 179, 111679 (2024).
- Peng, M., et al. P27 specifically decreases in squamous carcinoma and mediates NNK-induced transformation of human bronchial epithelial cells. J Cell Mol Med. 28 (15), e18577 (2024).
- Jang, H. J., et al. Tobacco-induced hyperglycemia promotes lung cancer progression via cancer cell-macrophage interaction through paracrine IGF2/IR/NPM1-driven PD-L1 expression. Nat Commun. 15 (1), 4909 (2024).
- Zhang, Y., et al. Curcumin analogue EF24 prevents alveolar epithelial cell senescence to ameliorate idiopathic pulmonary fibrosis via activation of PTEN. Phytomedicine. 133, 155882 (2024).
- Li, M., et al. Isoflurane anesthesia decreases excitability of inhibitory neurons in the basolateral amygdala leading to anxiety-like behavior in aged mice. Exp Ther Med. 28 (4), 399 (2024).
- Xiong, R., et al. Hypermethylation of the ADIRF promoter regulates its expression level and is involved in NNK-induced malignant transformation of lung bronchial epithelial cells. Arch Toxicol. 97 (12), 3243-3258 (2023).
- Shaikh, Z. M., et al. Thearubigins/polymeric black tea polyphenols (PBPs) do not prevent benzo[a]pyrene (B[a]P) induced lung tumors in A/J mice. Am J Transl Res. 15 (9), 5826-5834 (2023).
- Li, M. Y., et al. Targeting CD36 determines nicotine derivative NNK-induced lung adenocarcinoma carcinogenesis. iScience. 26 (8), 107477 (2023).
- Arlt, E., et al. A flow cytometry-based examination of the mouse white blood cell differential in the context of age and sex. Cells. 13 (18), 1583 (2024).
- Su, Z., et al. Feasibility of using serum, plasma, and platelet 5-hydroxytryptamine as peripheral biomarker for the depression diagnosis and response evaluation to antidepressants: Animal experimental study. Clin Psychopharmacol Neurosci. 22 (4), 594-609 (2024).
- Zhou, X., et al. Mechanosensitive lncRNA H19 promotes chondrocyte autophagy, but not pyroptosis, by targeting miR-148a in post-traumatic osteoarthritis. Noncoding RNA Res. 10, 163-176 (2025).
- Chen, C., et al. Cardamonin attenuates iron overload-induced osteoblast oxidative stress through the HIF-1α/ROS pathway. Int Immunopharmacol. 142 (Pt A), 112893 (2024).
- Yan, F., et al. Hypoxia promotes non-small cell lung cancer cell stemness, migration, and invasion via promoting glycolysis by lactylation of SOX9. Cancer Biol Ther. 25 (1), 2304161 (2024).
- Inoue, S., et al. Utility of ultrasound imaging in monitoring fracture healing in rat femur: Comparison with other imaging modalities. Bone Rep. 23, 101807 (2024).
- An, Y., et al. Quercetin through miR-147-5p/CLIP3 axis reducing Th17 cell differentiation to alleviate periodontitis. Regen Ther. 27, 496-505 (2024).
- Tian, J., et al. Diallyl disulfide blocks cigarette carcinogen 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone-induced lung tumorigenesis via activation of the Nrf2 antioxidant system and suppression of NF-κB inflammatory response. J Agric Food Chem. 71 (46), 17763-17774 (2023).
- Han, L., et al. Wutou decoction alleviates arthritis inflammation in CIA mice by regulating Treg cell stability and Treg/Th17 balance via the JAK2/STAT3 pathway. J Ethnopharmacol. 334, 118463 (2024).
- Napieczyńska, H., et al. µCT imaging of a multi-organ vascular fingerprint in rats. PLoS One. 19 (10), e0308601 (2024).
- Liu, H., et al. Using broadly targeted plant metabolomics technology combined with network pharmacology to explore the mechanism of action of the Yishen Gushu formula in the treatment of postmenopausal osteoporosis in vivo. J Ethnopharmacol. 333, 118469 (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены