Method Article
Подготовка отмытых тромбоцитов человека для количественных исследований метаболического потока
В этой статье
Резюме
Метаболизм тромбоцитов представляет интерес, особенно в связи с ролью гипер- и гипоактивности тромбоцитов в кровотечениях и тромботических расстройствах. Выделение тромбоцитов из плазмы необходимо для некоторых метаболических анализов; Представлен метод выделения внутриклеточных метаболитов из отмытых тромбоцитов.
Аннотация
Тромбоциты — это клетки крови, которые играют неотъемлемую роль в гемостазе и врожденном иммунном ответе. Гипер- и гипоактивность тромбоцитов связана с метаболическими нарушениями, увеличивая риск тромбоза и кровотечения. Активация тромбоцитов и метаболизм тесно связаны, при этом существует множество методов измерения первых, но относительно мало для последних. Чтобы изучить метаболизм тромбоцитов без вмешательства других клеток крови и компонентов плазмы, тромбоциты должны быть изолированы, что является нетривиальным процессом из-за чувствительности тромбоцитов к сдвигу и способности к необратимой активации. Здесь представлен протокол выделения тромбоцитов (промывания), в результате которого образуются пассивные тромбоциты, чувствительные к стимуляции агонистами тромбоцитов. Последовательные этапы центрифугирования используются с добавлением ингибиторов тромбоцитов для выделения тромбоцитов из цельной крови и их ресуспендирования в контролируемом изосмотическом буфере. Этот метод воспроизводимо обеспечивает 30–40% восстановление тромбоцитов из цельной крови с низкой активацией, измеряемой маркерами секреции гранул и активности интегринов. Количество тромбоцитов и концентрация топлива могут точно контролироваться, что позволяет пользователю исследовать различные метаболические ситуации.
Введение
Тромбоциты – это небольшие (2–4 мкм в диаметре), нуклеарные клетки, которые играют важную роль в гемостазе, жестко регулируемом процессе образования тромбов1. Хотя тромбоциты жизненно важны для целостности сосудов, они также участвуют в неблагоприятных событиях для здоровья. Тромбоциты участвуют в тромбозе глубоких вен (ТГВ) и артериальном тромбозе (АТ), которые представляют собой сгустки, которые закупоривают кровеносные сосуды, приводя к локальному снижению кровоснабжения, или, если кусочки тромба отламываются (эмболизируются), они могут блокировать кровоснабжение легких, сердца или мозга 2,3,4,5,6,7 . Гиперреактивность тромбоцитов является коморбидностью гипертензии, сахарного диабета и рака, приводящей к увеличению заболеваемости ТГВ и АТ 8,9,10. Активация тромбоцитов и метаболизм тесно связаны11,12, что приводит к повышенному интересу к нацеливанию на метаболизм тромбоцитов в качестве терапевтической стратегии13,14. Ведутся споры о точной метаболической перестройке, которая происходит при активации, и это активнаяобласть исследований. Этот повышенный интерес к дисфункции тромбоцитов при заболевании и ее связи с метаболизмом подчеркивает необходимость повторяемого метода выделения тромбоцитов и изучения их метаболизма.
Человеческие тромбоциты обычно получают путем венепункции, а затем выделяют из цельной крови. Промытые тромбоциты отделяют от цельной крови с помощью последовательных этапов промывания и центрифугирования16. Первоначально это было сделано группой17 Мастарда и немного изменено группой18 Казенава. Другой альтернативой являются фильтрованные в геле тромбоциты, которые могут быть получены из обогащенной тромбоцитами плазмы (PRP) методом эксклюзионной хроматографии с использованием упакованной колонки агарозных гелевых шариков19. Существует множество протоколов промывки как для крови человека, так и для крови грызунов, и они оптимизированы для различных анализов 20,21,22,23, но не для измерения метаболизма тромбоцитов.
Методы изучения метаболизма тромбоцитов включают биоэнергетические измерения с помощью анализатора Seahorse XF 11,24,25,26,27, измерения внеклеточного потока 11,13,24, метаболомики 14,28 и анализ метаболического потока изотопов (13C-MFA)29. В метаболомных исследованиях целью обычно является определение измененных путей между двумя различными состояниями (например, состояние покоя и активированные тромбоциты14). Метаболомные исследования предполагают использование жидкостной хромато-масс-спектрометрии (ЖХ-МС). Эти исследования могут быть проведены для внутри- или внеклеточных метаболитов и часто сочетаются с анализом путей или анализом главных компонент (PCA)14,28. Анализ метаболического потока изотопов (13C-MFA) включает в себя кормление клеток меченым субстратом, известным как индикатор, и измерение того, как этот индикатор распространяется через реакционную сеть с LC-MS. Этот метод позволяет рассчитать потоки по метаболическим путям с разрешением уровня реакции 29,30. В цельной крови и обогащенной тромбоцитами плазме (PRP) концентрация топлива (глюкозы, глутамина, ацетата и т.д.) зависит от вариабельности от донора к донору, а альбумин и глобулин, связывающий половые гормоны, присутствующие в плазме, могут изменять активную концентрацию гормонов, лекарств и других биологическизначимых молекул. Промытые тромбоциты предлагают метод суспендирования тромбоцитов в заданной пользователем среде, включая известные концентрации топлива, которая совместима с 13C-MFA32.
Здесь описан метод промывки тромбоцитов с целью получения тромбоцитов, которые могут быть использованы в метаболических анализах. Протокол производит неподвижные тромбоциты с низким уровнем загрязнения эритроцитов и лейкоцитов. Статус активации тромбоцитов контролировали с помощью проточной цитометрии маркеров активации тромбоцитов. Этот протокол воспроизводимо обеспечивает восстановление тромбоцитов не менее чем на 30–40% по сравнению с количеством тромбоцитов в цельной крови. Отмытые тромбоциты, полученные с помощью этого метода, подходят для методов метаболического анализа, а метод экстракции внутриклеточных метаболитов может быть адаптирован к анализу по выбору пользователя (ЖХ-МС, ГХ-МС, фотометрический анализ и т. д.).
протокол
Исследование получило одобрение Институционального наблюдательного совета от Медицинского кампуса Аншутц Университета Колорадо. Письменное согласие было получено от всех участников исследования. Участники сообщили, что они не употребляли алкоголь в течение предыдущих 48 часов или нестероидные противовоспалительные препараты (НПВП) в течение предыдущих десяти дней. Этот проект поддерживается Национальным институтом сердца, легких и крови Национальных институтов здравоохранения под номером R61HL141794.
1. Забор крови
- Настроен на забор крови. Рекомендуется забор крови у обученного флеботомиста.
- Выполните венепункцию внутренней части руки с помощью иглы 19 G.
- Соберите первые ~2 мл в вакуумер без добавок и утилизируйте. Это делается для удаления химических сигнальных молекул из поврежденных эндотелиальных клеток, которые могут активировать тромбоциты. После того, как первоначальные 2 мл будут собраны, снимите жгут, чтобы уменьшить напряжение сдвига на тромбоцитах.
- Соберите оставшуюся кровь в антиокоагулянт цитрат декстрозу (АХД-А) вакутайнеры в соотношении 14:3 (кровь: АКД-А). Аккуратно переверните каждый вакутайнер после сбора крови, чтобы смешать кровь и антикоагулянт.
2. Промывка тромбоцитов

Рисунок 1: Последовательные этапы центрифугирования и ресуспендирования при промывании тромбоцитов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
ПРИМЕЧАНИЕ: Избегайте образования пузырьков воздуха. Используйте трансферные пипетки для удаления пузырьков при их образовании, особенно перед центрифугированием. Каждый раз, когда пробирки с кровью/тромбоцитами открываются/закрываются, рекомендуется дышать в пробирку перед закрытием колпачка, чтобы повысить уровеньCO2 .
- Предварительно нагрейте центрифугу до 37 °C для снижения температурных эффектов. Между каждым этапом центрифугирования в протоколе поддерживайте температуру центрифуги при температуре 37 °C.
- Разогрейте водяную баню до 37 °C. Поместите модифицированный буфер Тиродеса с глюкозой на водяную баню.
ПРИМЕЧАНИЕ: модифицированный рецепт буфера Tyrode можно найти в дополнительном файле 1. - Собранную цельную кровь из всех вакутайнеров соедините в полипропиленовые конические пробирки объемом 50 мл. С помощью кончика пипетки со скосом, срезанного под углом 45°, возьмите соответствующий объем образца для подсчета клеток (см. раздел Подсчет клеток).
- Удалите все пузырьки, образовавшиеся путем тщательной аспирации с помощью узкопроходной пипетки.
- Дайте крови отдохнуть на водяной бане в течение 25 минут при температуре 37 °C Это позволяет тромбоцитам в обратимо активированном состоянии (после удаления из организма, переноса из пробирки в пробирку и т.д.) вернуться в состояние покоя.
- Чтобы предотвратить активацию во время центрифугирования, добавьте 500 нМ простагландина I2 (PGI2) и 0,02 Ед/мл апиразы в цельную кровь и аккуратно перемешайте, перевернув один раз. Удалите образовавшиеся пузырьки с помощью узкой переводной пипетки.
ПРИМЕЧАНИЕ: Инструкции по правильному рецепту PGI2 и апиразы можно найти в Дополнительном файле 1. - Центрифугируйте цельную кровь для получения обогащенной тромбоцитами плазмы (PRP) (15 минут при 250 x g для 42 мл цельной крови) без тормоза (37 °C).
- Аккуратно соберите PRP (верхний желтый слой над охристой шерстью и красным кровяным слоем) в новую коническую пробирку объемом 50 мл с помощью пипетки для переноса с широким отверстием.
- При переносе наклоните чистую коническую трубку и осторожно пропустите PRP вниз по боковой стороне трубки. Избегайте образования пузырьков воздуха.
- Оставьте около 3 мм PRP, чтобы не нарушить охристую шерсть (слой белых кровяных телец между PRP и красной кровью). Если его потревожить, это будет выглядеть как внезапный белый завихрение в переводной пипетке.
- Подсчитайте количество клеток (см. раздел «Подсчет тромбоцитов»), чтобы определить объем ресуспензии для следующего этапа мытья.
- Дайте отдохнуть 10 минут при температуре 37 °C.
- С помощью наконечника пипетки со скошенной кромкой возьмите образец для проточной цитометрии (см. раздел Проточная цитометрия).
- Добавьте 500 нМ PGI2 и 0,02 Ед/мл апиразы в PRP и перемешайте, слегка перевернув один раз.
- Центрифугируйте в течение 10 минут при 1000 x g при 37 °C (ускорение: 0, тормоз: 0). Не используйте тормоз. Дробина не компактна, и резкое торможение может стать причиной перемешивания.
- Во время центрифугирования определите объем ресуспензии. Предположим, что восстановление составляет 75%. Сделайте плотность ячеек примерно 3х105 клеток/мкл.
- Надосадочная жидкость с использованием пластиковой пипетки с широким отверстием для переноса для объемного объема и пипетки объемом 1 мл (неразрезанный наконечник) для оставшейся жидкости рядом с гранулой. Не прикасайтесь к гранулам на дне пробирки.
- Добавьте 500 нМ PGI2 и 0,02 Ед/мл апиразы в модифицированный буфер Тирода. Медленно добавьте рассчитанное количество буфера из шага 16, просачиваясь вниз по боковой стороне конической трубки.
- С помощью наконечника со скошенным срезом и наконечника для пипетки объемом 1 мл аккуратно ресуспендируйте гранулу, осторожно пипетируя вверх и вниз несколько раз.
- Установите объем на 300 μл, нажмите на поршень до упора, находясь над линией жидкости, затем поместите пипетку ниже жидкости и поднимитесь до первой остановки. Это позволит ученому повторно суспендировать гранулу, не создавая случайно пузырьков воздуха, которые могут активировать тромбоциты.
- Иногда в нижней части гранулы появляется кольцо из видимых эритроцитов. Избегайте повторной приостановки.
- После того, как гранула будет повторно суспендирована, используйте пипетку с широким отверстием, чтобы перенести ресуспендированную гранулу в новую коническую трубку, оставив все эритроциты или заметно слипшиеся клетки.
- Повторите шаги 11-20. Убедитесь, что вы добавили 500 нМ PGI2 и 0,02 Ед/мл из свежей аликвоты в модифицированный буфер Tyrode (не используйте повторно модифицированный буфер Tyrode из шага 18, PGI2 слишком нестабилен).
- Возьмите образец для подсчета клеток. При необходимости отрегулируйте концентрацию тромбоцитов с помощью модифицированного буфера Tyrode.
- Используйте наконечник пипетки со скошенным вырезом для взятия образца для проточной цитометрии.
- Дайте тромбоцитам отдохнуть в течение 1 ч при 37 °C, чтобы дать время для испарения ингибиторов и позволить обратимо активированным тромбоцитам вернуться в состояние покоя.
- Аккуратно перемешайте с помощью пипетки с широким отверстием. Берут образцы для проточной цитометрии.
- Промытые, находящиеся в состоянии покоя тромбоциты теперь готовы к использованию для метаболического анализа.
3. Подсчет тромбоцитов
- Подсчет тромбоцитов может проводиться с помощью либо автоматического счетчика клеток крови (следуйте инструкциям производителя), либо гемоцитометра33.
4. Проточная цитометрия
- Подготовка
- Подробные протоколы и обзоры передовых методов создания смесей антител и подготовки проточного цитометра к измерению активации тромбоцитов можно найти в других разделах 34,35.
- Выборка
- При взятии образца для проточной цитометрии соберите тромбоцитарную суспензию с помощью кончика пипетки, срезанного скосом. Медленно добавьте это в микроцентрифужную пробирку с антителами, затем осторожно перемешайте. Дайте поинкубироваться в течение 30 с.
- Используя кончик пипетки со скосом, перенесите смесь тромбоцитарной суспензии/антител в соответствующую лунку на 96-луночный планшет.
- Сразу же добавьте фиксант в лунку для фиксации ячеек.
- Провести на проточном цитометре в течение 8 ч после фиксации.
- Тесты на чувствительность агонистов
- После промывания отложите в сторону 2 конические пробирки объемом 15 мл, одну для контроля покоя и одну для контроля активируемого тромбином.
- Аккуратно нанесите 100 μл тромбоцитарной суспензии в каждую коническую пробирку с помощью наконечника пипетки со скошенной кромкой. Дайте отдохнуть при температуре 37 °C в течение 1 часа.
- После часового отдыха добавьте 0,1 Ед/мл тромбина в одну трубку (инструкции по приготовлению тромбина можно найти в Дополнительном файле 1), а носитель – в другую. Выдерживать при температуре 37 °C в течение 15 минут.
- Возьмите образец проточной цитометрии из каждой пробирки, чтобы определить чувствительность тромбоцитов к агонисту.
5. Отбор проб для количественного анализа метаболического потока
- Тушение
ПРИМЕЧАНИЕ: Гашение метаболизма является необходимым этапом для точного измерения метаболических потоков. Быстрое охлаждение клеток и поддержание их температуры на уровне или ниже 4 °C замедляет метаболизм настолько, что можно предположить, что он существенно остановлен, так что отобранные клетки точно отражают метаболизм клеток из основной массы. Существует множество методов, которые можно использовать, но чтобы сбалансировать потребность в быстром охлаждении и минимизацию утечек, используйте холодный (-4 °C) обычный физиологический раствор36. Если соль будет мешать последующему анализу, можно использовать другую жидкость (метанол/воду, этанол и т.д.)37.- Приготовьте и заморозьте аликвоты обычного физиологического раствора. Сделайте каждую солевую аликвоту в 6 раз больше объема желаемого образца.
ПРИМЕЧАНИЕ: рецепт обычного солевого раствора можно найти в Дополнительном файле 1. - Предварительно охладите микроцентрифугу до 0 °C.
- Соберите суспензию тромбоцитов в частично замороженном нормальном физиологическом растворе (< -4 °C) в соотношении 1:6 (например, соберите 150 мкл суспензии тромбоцитов в 750 мкл физиологического раствора в микроцентрифужных пробирках).
ПРИМЕЧАНИЕ: Не оставляйте тромбоцитарный/солевой раствор на льду более чем на 15 минут. - Центрифуга при 16 000 x g, 0 °C в течение 10 мин.
- Сохраните надосадочную жидкость для анализа внешних метаболитов, а гранулу для внутриклеточной экстракции и измерения метаболитов. Храните оба при температуре -20 °C до тех пор, пока они не будут готовы к анализу.
- Повторите этот процесс в нужном временном интервале и количестве точек выборки.
- Приготовьте и заморозьте аликвоты обычного физиологического раствора. Сделайте каждую солевую аликвоту в 6 раз больше объема желаемого образца.
- Внутриклеточная экстракция метаболитов
- Добавьте в закаленную гранулу 0,5 мл предварительно охлажденной метанол-воды 7:3 при температуре -20 °C. Энергично вихрь в течение 1 мин.
- Заморозьте в жидком азоте, разморозьте при 0 °C, затем повторите еще 2 цикла.
- Центрифугируйте суспензии при 16 000 x g в течение 10 минут при -4 °C.
- Соберите надосадочную жидкость в новую микроцентрифужную пробирку.
- Используйте гранулы из шага 3 и повторите протокол экстракции (шаги 1-3) с соотношением метанол:вода 50:50. Второй собранный экстракт добавить к первому. Сушите на ночь.
- Суспендируйте высушенный экстракт в 150 μл воды класса LC-MS (или другого растворителя, подходящего для предполагаемого анализа). Перемешивайте в течение 15 минут при 4 °C. Кратковременно сделать вихрь и перенести в микроцентрифужные пробирки 0,22 мкм для удаления клеточного мусора. Центрифугируйте в течение 5 минут при 16 000 x g и 4 °C.
- Снимите с центрифуги, налейте пипеткой еще 50 μл оптимальной воды на фильтр и снова центрифугируйте (5 минут, 16 000 x g и 4 °C) для промывки фильтра. Сбор для анализа.
Результаты
Репрезентативные результаты на рисунке 2 представляют 6 различных доноров крови, включая 3 мужчин и 3 женщин. Выход тромбоцитов по отношению к цельной крови показан на рисунке 2А. Окончательное восстановление тромбоцитов составило в среднем 52% ± 3% (стандартное отклонение, n=6). Итоговое количество тромбоцитов по сравнению с контаминацией лейкоцитов измеряли с помощью автоматизированного гематологического анализатора. Количество лейкоцитов составило менее 0,1% от общего количества клеток (рисунок 2B). В процессе мытья и часового отдыха тромбоциты сохраняли низкую экспозицию P-селектина, но сильно реагировали на лечение тромбином (рис. 2C). Связанный фибриноген резко возрастает после первого спина 1000 x g, но возвращается ниже 5% после второго спина 1000 x g. Как и воздействие Р-селектина, связанный фибриноген резко увеличивается после лечения тромбином после часового отдыха (Рисунок 2D). Репрезентативное стробирование по размеру, синглетам и положительному результату CD42a показано на рисунке 3A-C. События, которые проходят через эти последовательные ворота, используются для поиска воздействия P-селектина и связанного фибриногена. Репрезентативное гейтирование для P-селектин-положительных и фибриноген-положительных тромбоцитов показано на рисунке 3D-E. На рисунке 3D показан образец тромбоцитов, обработанный с помощью контроля транспортного средства, а на рисунке 3E показан образец тромбоцита через 15 минут после добавления 0,1 ЕД/мл тромбина.
Отмытые тромбоциты были использованы для проведения количественного эксперимента по поглощению и выведению, показанного на рисунке 4. Тромбоциты промывали, и в окончательные промытые суспензии добавляли 5 ммоль/л глюкозы и 20 ммоль/л ацетата. 0,1 ЕД/мл тромбина или транспортного средства добавляли в промытые тромбоцитарные суспензии после часового отдыха. Образцы собирали и гасили каждые 15 минут после добавления тромбина в течение 30 минут. Надосадочные жидкости использовали для измерения изменений концентрации внеклеточного лактата, глюкозы и ацетата с помощью автоматизированных фотометрических анализов. Поток был рассчитан с учетом регрессионного наклона концентрации метаболита во времени. На рисунке 4 показаны рассчитанные потоки метаболитов для трех репрезентативных доноров. Потоки лактата у всех доноров были положительными, что указывало на выработку лактата, а потоки глюкозы и ацетата были отрицательными, что указывало на их употребление. Несмотря на различия в изменении складки, лечение тромбином приводило к увеличению величины флюсов по сравнению с состоянием покоя для каждого донора.

Рисунок 2: (A) Процент восстановленных тромбоцитов по отношению к цельной крови на каждом этапе процесса промывки. n=6, погрешности представляют собой стандартное отклонение. (B) Количество тромбоцитарных и лейкоцитарных клеток в конце процесса промывки. (C) Процент тромбоцитов, положительных на экспрессию P-селектина, измеренный с помощью проточной цитометрии. n=6, погрешности представляют собой стандартное отклонение. (D) Процент тромбоцитов, положительных на фибриноген, измеренный с помощью проточной цитометрии. n=6, погрешности представляют собой стандартное отклонение. . Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Репрезентативное стробирование для проточной цитометрии тромбоцитов. Тромбоциты (A) стробируются по размеру с прямым рассеянием (FSC) и боковым рассеянием (SSC), (B) затем стробируются для одиночных клеток с FSC-шириной и FSC-высотой, и (C) стробируются для CD42a-положительного результата. События, которые проходят через эти последовательные вентили, используются для поиска маркеров активации. (D) Экспрессия P-селектина и фибриногена для контрольного образца тромбоцитов в состоянии покоя. Здесь измеряются маркеры активации P-Selectin PECy5 и FITC-Fibrinogen. (E) Экспрессия P-селектина и фибриногена для образца тромбоцитов, обработанного тромбином с концентрацией 0,1 ЕД/мл. Здесь измеряются маркеры активации P-Selectin PECy5 и FITC-Fibrinogen. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
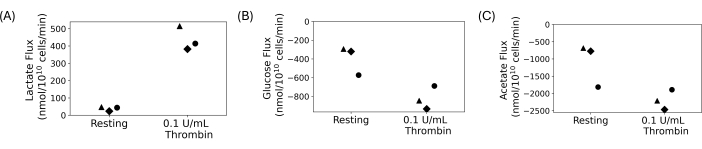
Рисунок 4: (А) Скорость экскреции лактата у трех разных доноров в состоянии покоя и при активации тромбина. (B) Скорость поглощения глюкозы тремя различными донорами в состоянии покоя и при активации тромбина. (C) Коэффициенты поглощения ацетата для трех различных доноров в состоянии покоя и при активации тромбина. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный файл 1: Рецепты и инструкции по приготовлению буферов и реагентов. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Тромбоциты очень чувствительны к окружающей среде, в том числе к напряжению сдвига и присутствию агонистов38,39. Это затрудняет работу с тромбоцитами и их изоляцию, чтоделает использование ингибиторов и широкопроходных пипеток критически важным. Правильное хранение и подготовка PGI2 имеет жизненно важное значение, так как отсутствие подготовки PGI2 в основных PBS приведет к быстрой деградации PGI241. Чтобы свести к минимуму риск активации, вызванной сдвигом, используйте пипетки с широким отверстием, наконечники пипеток со скошенным вырезом и иглу для флеботомии 19-го калибра.
Неизбежно часть тромбоцитов будет теряться на каждом этапе процесса промывки (Рисунок 2A). Не все тромбоциты попадают в слой плазмы, и скопление плазмы слишком близко к охристому слою оболочки может привести к заражению лейкоцитов. Кроме того, популяция тромбоцитов слипается и опускается на дно при ресуспензии, что подчеркивает важность переноса ресуспендированной гранулы в чистую пробирку после каждой ресуспензии. Обратите внимание, что на рисунке 2D наблюдается увеличение связывания фибриногена после первого спина 1000 x g, которое затем снижается после второго спина 1000 x g. Образцы для проточной цитометрии отбирали после 10-минутного периода отдыха в каждом случае. Возможно, что часть этой популяции восстанавливает свою природу покоя, но поскольку эта популяция присутствует после первого 10-минутного отдыха, часть этой активированной популяции может слипаться и упасть на дно трубки при повторном взвесе.
Несмотря на то, что использование проточной цитометрии не является строго необходимым, полезно следить за тем, находятся ли тромбоциты в состоянии покоя и способны ли они реагировать на агонисты в конце процесса промывки. Кроме того, особенно если большая часть тромбоцитов выглядит визуально комковатой во время промывки, выполнение проточной цитометрии на каждом этапе может помочь определить, где возникает проблема. Хотя это случается редко, примерно 1 из 20 донорских экспериментов должен быть исключен из-за спонтанной активации тромбоцитов в период покоя. Анализ маркеров активации тромбоцитов с помощью проточной цитометрии является ценным инструментом для подтверждения покоя и чувствительности к агонисту перед экспериментами с тромбоцитами.
Для измерения реакции тромбоцитов на агонист с помощью проточной цитометрии некоторые исследования позволяют тромбоцитам инкубироваться в агонисте и коктейле антител в течение 10-30 минут при комнатной температуре, прежде чем зафиксировать 42,43,44. После часового отдыха 20-минутная инкубация при комнатной температуре перед фиксацией контрольных тромбоцитов в состоянии покоя приводит к завышенной оценке активации. Эта активация не происходит, когда тромбоциты инкубируются в течение 20 минут при 37 °C, что позволяет предположить, что эта кажущаяся активация происходит из-за того, что ингибиторы исчезли, и резкое изменение температуры активирует тромбоциты. Ожидание 20 минут для фиксации в процессе стирки также не вызывает этой искусственной активации, которая может быть связана с ослаблением действия ингибиторов во время часового отдыха. Чтобы зафиксировать истинное состояние активации тромбоцитов, рекомендуется проводить инкубацию при 37 °C или фиксировать их после короткой (30 секунд) инкубации с антителами.
Промытые тромбоциты позволяют изучать тромбоциты без вмешательства других клеток крови и компонентов плазмы. Они идеально подходят для исследований, в которых необходимо манипулировать внеклеточной средой, в том числе для метаболических исследований. Плотность конечной суспензии тромбоцитов можно регулировать и контролировать, чтобы свести к минимуму вариабельность количества тромбоцитов у разных людей. Для метаболических исследований можно контролировать пользовательские концентрации углеродных субстратов тромбоцитов. Репрезентативные результаты, показанные на рисунке 4, получены в ходе эксперимента по поглощению и выведению, в котором глюкоза и ацетат были добавлены в качестве углеродных субстратов, и был получен лактат. Несмотря на то, что на рисунке 4 существует биологическая вариабельность между донорами, продукция лактата увеличивается при лечении тромбином, в то время как потребление глюкозы и ацетата увеличивается. Это согласуется с литературой; Известно, что тромбоциты увеличивают скорость аэробного гликолиза и окислительного фосфорилирования при активации 13,14,15,45. Этот метод может быть применен для исследования тромбоцитов в различных питательных условиях или с различными ионами в конечной суспензии тромбоцитов.
Несмотря на то, что исследования промытых тромбоцитов полезны, важно помнить, что искусственная среда не повторяет среду in vivo. Поэтому промытые тромбоциты следует использовать только в тех ситуациях, когда исследователя интересует только функция тромбоцитов. Как и во всех исследованиях in vitro , результаты следует интерпретировать с осторожностью. Рекомендуется ресуспендировать тромбоциты в модифицированном буфере Тироде с концентрацией кальция 2 мМ после окончательной промывки. Экспрессия связывания P-селектина и фибриногена была измерена только в течение 1,5 часов после процесса промывания (2,5 часа, включая час отдыха), поэтому ученому рекомендуется использовать промытую суспензию тромбоцитов в течение этого временного окна или иным образом подтвердить верность тромбоцитов. В этом исследовании не измерялись другие классические метрики функциональности тромбоцитов, такие как агрегация.
Промытые тромбоциты, приготовленные по нашему протоколу, находятся в состоянии покоя, что подтверждается проточным цитометрическим измерением P-селектина и фибриногена. Метаболические субстраты, гормоны и агонисты тромбоцитов во внеклеточной среде могут быть точно контролируемы, что позволяет ученому изучать метаболизм тромбоцитов в системе по их выбору.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы сообщить.
Благодарности
Авторы выражают признательность доктору Эмили Янус-Белл и Клариссе Мурьо из лаборатории доктора Пьера Манжена и Катрине Барк из лаборатории доктора Хорхе ДиПаолы за их руководство и советы.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 µM filter Spin-X tubes | Millapore-Sigma | CLS8160 | Reagent prep |
| 19 G x 3/4" needle | McKesson Corporation | 448406 | Phlebotomy |
| 21 G 1.5 inch needle with luer lock | Amazon | B0C39PJD23 | Reagent prep |
| 96 well plate, half area | Greiner Bio-One | 675101 | Flow cytometry |
| ACD-A vaccutainers | Fisher Scientific | 364606 | Phlebotomy |
| Adapter | McKesson Corporation | 609 | Phlebotomy |
| Alcohol swab | VWR | 15648-916 | Phlebotomy |
| Apyrase from potatoes | Sigma | A6410-100UN | Reagent prep |
| CD42a Monoclonal Antibody | Thermo Fisher Scientific | 48-0428-42 | Flow cytometry |
| Chilled microcentrifuge | ThermoFisher Scientific | 75002441 | Quenching |
| D-Glucose | Sigma | G7021 | Reagent prep |
| FITC Anti-Fibrinogen antibody | Abcam | 4217 | Flow cytometry |
| Flow cytometer | Beckman Coulter | 82922828 | Flow cytometry |
| Gauze | VWR | 76049-110 | Phlebotomy |
| Glycerol | Sigma Aldrich | G5516 | Reagent prep |
| HEPES | Sigma Aldrich | H4034 | Reagent prep |
| Human alpha-thrombin | Prolytix | HCT-0020 | Flow cytometry |
| KCl | Sigma Aldrich | P9333 | Reagent prep |
| KH2PO4 | Sigma Aldrich | P5655 | Reagent prep |
| MgCl2 | Sigma | M8266 | Reagent prep |
| Microcentrifuge tubes | VWR | 87003-292 | General |
| Na2HPO4 | Sigma | S3264 | Reagent prep |
| NaCl | Sigma Aldrich | S7653 | Reagent prep |
| NaHCO3 | Sigma Aldrich | S5761 | Reagent prep |
| Narrow bore transfer pipette | VWR | 16001-176 | Platelet washing |
| Paraformaldehyde solution, 4% in PBS | Santa Cruz Biotechnology | sc-281692 | Flow cytometry |
| PECy5 Mouse Anti-Human CD62P | BD Pharmingen | 551142 | Flow cytometry |
| Plate cover | Thermo Fisher Scientific | AB0626 | Flow cytometry |
| Polypropylene 15 mL conical tubes | VWR | 89039-658 | Reagent prep |
| Polypropylene 50 mL conical tubes | VWR | 352070 | Platelet washing |
| Prostaglandin I2 (sodium salt) | Cayman Chemical | 18220 | Reagent prep |
| SKC Inc. C-Chip Disposable Hemocytometers | Fisher Scientific | 22-600-100 | Cell counting |
| Syringe | BD Pharmingen | 14-823-41 | Reagent prep |
| Tourniquet | VWR | 76235-371 | Phlebotomy |
| Vacutainer needle holder | BD | 364815 | Phlebotomy |
| Vortexer | VWR | 102091-234 | Reagent prep |
| Water bath | Thermo Fisher Scientific | TSGP02 | Platelet washing |
| Wide bore transfer pipette | VWR | 76285-362 | Platelet washing |
Ссылки
- Versteeg, H. H., Heemskerk, J. W., Levi, M., Reitsma, P. H. New fundamentals in hemostasis. Physiol Rev. 93 (1), 327-358 (2013).
- Webera, M., et al. Enhanced platelet aggregation with trap-6 and collagen in platelet aggregometry in patients with venous thromboembolism. Thromb Res. 107, 325-328 (2002).
- Herbert, J. M., Bernat, A., Maffrand, J. P. Importance of platelets in experimental venous thrombosis in the rat. Blood. 80 (9), 2281-2286 (1992).
- Puurunen, M. K., Hwang, S. J., O'donnell, C. J., Tofler, G., Johnson, A. D. Platelet function as a risk factor for venous thromboembolism in the framingham heart study. Thromb Res. 151, 57-62 (2017).
- Montoro-Garcia, S., Schindewolf, M., Stanford, S., Larsen, O. H., Thiele, T. The role of platelets in venous thromboembolism. Semin Thromb Hemost. 42 (3), 242-251 (2016).
- Koupenova, M., Kehrel, B. E., Corkrey, H. A., Freedman, J. E. Thrombosis and platelets: An update. Eur Heart J. 38 (11), 785-791 (2017).
- Yeung, J., Li, W., Holinstat, M. Platelet signaling and disease: Targeted therapy for thrombosis and other related diseases. Pharmacol Rev. 70 (3), 526-548 (2018).
- Ferreiro, J. L., Gomez-Hospital, J. A., Angiolillo, D. J. Platelet abnormalities in diabetes mellitus. Diab Vasc Dis Res. 7 (4), 251-259 (2010).
- Buergy, D., Wenz, F., Groden, C., Brockmann, M. A. Tumor-platelet interaction in solid tumors. Int J Cancer. 130 (12), 2747-2760 (2012).
- Gkaliagkousi, E., Passacquale, G., Douma, S., Zamboulis, C., Ferro, A. Platelet activation in essential hypertension: Implications for antiplatelet treatment. Am J Hypertens. 23 (3), 229-236 (2010).
- Fidler, T. P., et al. Deletion of GLUT1 and GLUT3 reveals multiple roles for glucose metabolism in platelet and megakaryocyte function. Cell Rep. 20 (4), 881-894 (2017).
- Fidler, T. P., et al. Glucose metabolism is required for platelet hyperactivation in a murine model of type 1 diabetes. Diabetes. 68 (5), 932-938 (2019).
- Kulkarni, P. P., et al. Aerobic glycolysis fuels platelet activation: Small-molecule modulators of platelet metabolism as anti-thrombotic agents. Haematologica. 104 (4), 806-818 (2019).
- Ghatge, M., Flora, G. D., Nayak, M. K., Chauhan, A. K. Platelet metabolic profiling reveals glycolytic and 1-carbon metabolites are essential for gp vi-stimulated human platelets-brief report. Arterioscler Thromb Vasc Biol. 44 (2), 409-416 (2024).
- Ravera, S., Signorello, M. G., Panfoli, I. Platelet metabolic flexibility: A matter of substrate and location. Cells. 12 (13), (2023).
- Hechler, B., Dupuis, A., Mangin, P. H., Gachet, C. Platelet preparation for function testing in the laboratory and clinic: Historical and practical aspects. Res Pract Thromb Haemost. 3 (4), 615-625 (2019).
- Mustard, J. F., Perry, D. W., Ardille, N. G., Packham, M. A. Preparation of suspensions of washed platelets from humans. British Journal of Haematology. 22, 193-204 (1972).
- Cazenave, J. P., et al. Preparation of washed platelet suspensions from human and rodent blood. Methods Mol Biol. 272, 13-28 (2004).
- Fine, K., Ashbrook, P., Brigden, L., Maldonado, J., Didishelm, P. Gel-filtered human platelets. Ultrastructure, function, and role of proteins in inhibition of aggregation by aspirin. Am J Pathol. 84 (1), (1976).
- Weiss, L., et al. An optimized protocol to isolate quiescent washed platelets from human whole blood and generate platelet releasate under clinical conditions. STAR Protoc. 4 (2), 102150 (2023).
- Burzynski, L. C., Pugh, N., Clarke, M. C. H. Platelet isolation and activation assays. Bio Protoc. 9 (20), e3405 (2019).
- Aurbach, K., Spindler, M., Haining, E. J., Bender, M., Pleines, I. Blood collection, platelet isolation and measurement of platelet count and size in mice-a practical guide. Platelets. 30 (6), 698-707 (2018).
- Narciso, M. G., Nasimuzzaman, M. Purification of platelets from mouse blood. J Vis Exp. (147), (2019).
- Aibibula, M., Naseem, K. M., Sturmey, R. G. Glucose metabolism and metabolic flexibility in blood platelets. J Thromb Haemost. 16 (11), 2300-2314 (2018).
- Ravi, S., et al. Metabolic plasticity in resting and thrombin-activated platelets. PLoS One. 10 (4), e0123597 (2015).
- Nayak, M. K., et al. an inhibitor of pyruvate dehydrogenase kinases, inhibits platelet aggregation and arterial thrombosis. Blood Advances. 2, (2018).
- Hadley, J. B., et al. Hormones, age, and sex affect platelet responsiveness in vitro. Transfusion. 62 (9), 1882-1893 (2022).
- Paglia, G., et al. Comprehensive metabolomic study of platelets reveals the expression of discrete metabolic phenotypes during storage. Transfusion. 54 (11), 2911-2923 (2014).
- Sake, C. L., et al. Isotopically nonstationary (13)c metabolic flux analysis in resting and activated human platelets. Metab Eng. 69, 313-322 (2022).
- Antoniewicz, M. R. A guide to metabolic flux analysis in metabolic engineering: Methods, tools and applications. Metab Eng. 63, 2-12 (2021).
- Larsen, M. T., Kuhlmann, M., Hvam, M. L., Howard, K. A. Albumin-based drug delivery: Harnessing nature to cure disease. Mol Cell Ther. 4 (3), (2016).
- Balduini, C. L., Noris, P. P. latelet count and aging. Haematologica. 9 (6), 953-955 (2014).
- JoVE Science Education Database. Basic methods in cellular and molecular biology. Using a hemacytometer to count cells. , (2023).
- Spurgeon, B. E. J., Naseem, K. M. Platelet flow cytometry: Instrument setup, controls, and panel performance. Cytometry B Clin Cytom. 98 (1), 19-27 (2020).
- Van Velzen, J. F., Laros-Van Gorkom, B. A., Pop, G. A., Van Heerde, W. L. Multicolor flow cytometry for evaluation of platelet surface antigens and activation markers. Thromb Res. 130 (1), 92-98 (2012).
- Sake, C. L., Newman, D. M., Boyle, N. R. Evaluation of quenching methods for metabolite recovery in photoautotrophic synechococcus sp. Pcc 7002. Biotechnol Prog. 36 (5), e3015 (2020).
- Sapcariu, S. C., et al. Simultaneous extraction of proteins and metabolites from cells in culture. MethodsX. 1, 74-80 (2014).
- Rana, A., Westein, E., Niego, B., Hagemeyer, C. E. Shear-dependent platelet aggregation: Mechanisms and therapeutic opportunities. Front Cardiovasc Med. 6, 141 (2019).
- Ding, J., et al. Quantification of shear-induced platelet activation: High shear stresses for short exposure time. Artif Organs. 39 (7), 576-583 (2015).
- Ardlie, N., Perry, D., Packham, M., Mustard, J. Influence of apyrase on stability of suspensions of washed rabbit platelets. Proc Soc Exp Biol Med. 136 (4), (1971).
- Rao, G. H. R., Reddy, K. R., Hagert, K., White, J. G. Influence of ph on the prostacyclin (pg12) mediated inhibition of platelet function. Prostaglandins Medicine. 4, 263-273 (1980).
- Navred, K., et al. A simplified flow cytometric method for detection of inherited platelet disorders-a comparison to the gold standard light transmission aggregometry. PLoS One. 14 (1), e0211130 (2019).
- Aldrighi, J. M., et al. Platelet activation status decreases after menopause. Gynecol Endocrinol. 20 (5), 249-257 (2005).
- Bausset, O., et al. Formulation and storage of platelet-rich plasma homemade product. Biores Open Access. 1 (3), 115-123 (2012).
- Nayak, M. K., et al. The metabolic enzyme pyruvate kinase m2 regulates platelet function and arterial thrombosis. Blood. 137 (12), 1658-1668 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены