Method Article
정량적 대사 플럭스 연구를 위한 세척된 인간 혈소판의 준비
요약
혈소판 대사는 특히 출혈 및 혈전성 질환에서 혈소판 과잉 및 저활동의 역할과 관련이 있기 때문에 관심이 있습니다. 혈장에서 혈소판을 분리하는 것은 일부 대사 분석에 필요합니다. 여기에 제시된 것은 세척된 혈소판에서 세포 내 대사 산물을 분리하는 방법입니다.
초록
혈소판은 지혈과 선천성 면역 반응에 필수적인 역할을 하는 혈액 세포입니다. 혈소판 과잉 및 저활동은 대사 장애와 관련이 있으며, 혈전증과 출혈의 위험을 증가시킵니다. 혈소판 활성화와 신진대사는 밀접하게 연결되어 있으며, 전자를 측정하는 방법은 많지만 후자의 경우 상대적으로 적습니다. 다른 혈액 세포와 혈장 성분의 간섭 없이 혈소판 대사를 연구하려면 혈소판을 분리해야 하는데, 이는 혈소판 전단 민감도와 비가역적으로 활성화되는 능력으로 인해 사소한 과정이 아닙니다. 여기에 제시된 것은 혈소판 작용제에 의한 자극에 민감한 정지 혈소판을 생성하는 혈소판 분리(세척)를 위한 프로토콜입니다. 혈소판 억제제를 추가하여 연속적인 원심분리 단계를 사용하여 전혈에서 혈소판을 분리하고 제어된 이질체 완충액에 재현탁합니다. 이 방법은 과립 분비 및 인테그린 활성의 마커로 측정된 낮은 활성화로 전혈에서 혈소판의 30%-40% 회수를 재현 가능하게 생성합니다. 혈소판 수와 연료 농도를 정밀하게 제어하여 사용자가 다양한 대사 상황을 조사할 수 있습니다.
서문
혈소판은 작고(직경 2-4μm) 무핵 세포로, 혈전 형성의 엄격하게 조절되는 과정인 지혈에 중요한 역할을 합니다1. 혈소판은 혈관 무결성에 필수적이지만 건강에 해로운 사건과도 관련이 있습니다. 혈소판은 혈관을 막는 혈전인 심부정맥혈전증(DVT)과 동맥혈전증(AT)에 관여하며, 이는 국소적인 혈액 공급을 감소시키거나, 혈전 조각이 끊어지면(색전화) 폐, 심장 또는 뇌로의 혈액 공급을 차단할 수 있습니다 2,3,4,5,6,7. 혈소판 과민반응은 고혈압, 당뇨병 및 암의 동반 질환으로 DVT 및 AT 8,9,10의 발병률을 증가시킵니다. 혈소판 활성화와 신진대사는 밀접하게 연관되어 있으며, 11,12 이로 인해 치료 전략으로 혈소판 대사를 표적으로 삼는 것에 대한 관심이 높아지고 있습니다 13,14. 활성화 시 발생하는 정확한 대사 재배전에 대한 논쟁이 있으며, 이는 활발한 연구 분야이다15. 질병의 혈소판 기능 장애 및 신진대사와의 관계에 대한 관심이 높아짐에 따라 혈소판을 분리하고 신진대사를 연구하기 위한 반복 가능한 방법의 필요성이 강조됩니다.
인간의 혈소판은 일반적으로 정맥 천자로 얻은 다음 전혈에서 분리합니다. 세척된 혈소판은 연속적인 세척 및 원심분리 단계를 통해 전혈에서 분리됩니다16. 이것은 원래 Mustard의 그룹17에 의해 수행되었으며 Cazenave의 그룹18에 의해 약간 수정되었습니다. 또 다른 대안은 겔 여과된 혈소판으로, 아가로스 겔 비드의 패킹된 컬럼을 사용하여 크기 배제 크로마토그래피를 통해 혈소판 풍부 혈장(PRP)에서 얻을 수 있습니다19. 인간과 설치류의 혈액 모두에 대해 많은 세척 프로토콜이 존재하며, 다양한 분석20,21,22,23에 최적화되어 있지만, 혈소판 대사를 측정하기 위해서는 최적화되지 않았다.
혈소판 대사를 연구하는 기술에는 Seahorse XF 분석기 11,24,25,26,27을 통한 생체 에너지 측정, 세포 외 플럭스 측정 11,13,24, 대사체학 14,28 및 동위원소 보조 대사 플럭스 분석(13C-MFA)29 등이 있습니다. 대사체학 연구에서 목표는 일반적으로 두 가지 다른 상태(예: 휴지 혈소판 대 활성화된 혈소판14) 사이의 변경된 경로를 결정하는 것입니다. 대사체학 연구에는 액체 크로마토그래피-질량 분석법(LC-MS)의 사용이 포함됩니다. 이러한 연구는 세포 내 또는 세포 외 대사 산물에 대해 수행할 수 있으며 경로 분석 또는 주성분 분석(PCA)과 자주 결합됩니다14,28. 동위원소 보조 대사 플럭스 분석(13C-MFA)은 추적자로 알려진 표지된 기질을 세포에 공급하고 이 추적자가 LC-MS와의 반응 네트워크를 통해 어떻게 전파되는지 측정하는 것을 포함합니다. 이 기술은 반응 수준 분해능29,30을 가진 대사 경로를 통한 플럭스를 계산할 수 있습니다. 전혈 및 혈소판 풍부 혈장(PRP)에서 연료 농도(포도당, 글루타민, 아세테이트 등)는 기증자-기증자 간 변동에 따라 달라질 수 있으며, 혈장에 존재하는 알부민 및 성 호르몬 결합 글로불린은 호르몬, 약물 및 기타 생물학적으로 관련된 분자의 활성 농도를 변화시킬 수 있습니다31. 세척된 혈소판은 13C-MFA32와 호환되는 알려진 연료 농도를 포함한 사용자 정의 배지에서 혈소판을 현탁하는 방법을 제공합니다.
여기에는 대사 분석에 사용할 수 있는 혈소판을 생성하기 위한 혈소판 세척 방법이 설명되어 있습니다. 이 프로토콜은 적혈구 및 백혈구 오염이 낮은 정지 혈소판을 생성합니다. 혈소판 활성화 상태는 혈소판 활성화 마커의 유세포 분석을 통해 모니터링되었습니다. 이 프로토콜은 전혈의 혈소판 수에 비해 최소 30%–40%의 혈소판 회수율을 재현 가능하게 달성합니다. 이 기술로 얻은 세척된 혈소판은 대사 분석 기술에 적합하며, 세포 내 대사 산물 추출 방법은 사용자가 선택한 분석(LC-MS, GC-MS, 측광 분석 등)에 맞게 조정할 수 있습니다.
프로토콜
이 연구는 콜로라도 대학교 앤슈츠 메디컬 캠퍼스(University of Colorado Anschutz Medical Campus)로부터 기관 검토 위원회(Institutional Review Board)의 승인을 받았습니다. 모든 연구 참가자로부터 서면 동의를 얻었다. 참가자들은 이전 48시간 동안 알코올을 섭취하지 않았거나 이전 10일 동안 비스테로이드성 항염증제(NSAID)를 섭취하지 않았다고 보고했습니다. 이 프로젝트는 미국 국립보건원(National Institutes of Health)의 국립 심장, 폐 및 혈액 연구소(National Heart, Lung, and Blood Institute)의 지원을 받습니다(수상 번호 R61HL141794).
1. 채혈
- 채혈을 위한 설정. 혈액 채취는 숙련된 정맥 전문의가 수행하는 것이 좋습니다.
- 19G 바늘을 사용하여 팔 안쪽에 정맥 천자를 수행합니다.
- 처음 ~2mL를 무첨가 액포에 모아 폐기합니다. 이는 손상된 내피 세포에서 혈소판을 활성화할 수 있는 화학적 신호 분자를 제거하기 위한 것입니다. 초기 2mL를 채취한 후 혈소판의 전단 응력을 줄이기 위해 지혈대를 제거합니다.
- 나머지 혈액을 항응고제 시트레이트 포도당(ACD-A) 액포자에 14:3(혈액:ACD-A)의 비율로 수집합니다. 채혈 후 각 액포를 부드럽게 뒤집어 혈액과 항응고제를 혼합합니다.
2. 혈소판 세척

그림 1: 혈소판 세척과 관련된 연속적인 원심분리 및 재현탁 단계.이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
알림: 기포 생성을 피하십시오. 전사 피펫을 사용하여 기포가 형성될 때, 특히 원심분리 전에 기포를 제거하십시오. 혈액/혈소판 튜브가 열리거나 닫힐 때마다 CO2 수준을 높이기 위해 캡을 닫기 전에 튜브에 숨을 들이쉬는 것이 좋습니다.
- 온도 영향을 줄이기 위해 원심분리기를 37°C로 예열합니다. 프로토콜의 각 원심분리 단계 사이에 원심분리기를 37°C로 유지합니다.
- 수조를 37 °C로 예열합니다. 포도당이 든 변형된 Tyrode의 완충액을 수조에 넣습니다.
참고: 수정된 Tyrode의 버퍼 레시피는 보충 파일 1에서 찾을 수 있습니다. - 모든 진공에서 수집한 전혈을 50mL 폴리프로필렌 원뿔형 튜브에 결합합니다. 45° 각도로 절단된 베벨 절단 피펫 팁을 사용하여 적절한 시료량을 채취하여 세포 계수를 수행합니다( 세포 계수 참조).
- 좁은 보어 이송 피펫으로 조심스럽게 흡인하여 생성된 기포를 제거합니다.
- 37°C에서 25분 동안 수조에 혈액을 담그십시오.이렇게 하면 가역적으로 활성화된 상태(신체에서 제거되거나, 튜브에서 튜브로 이동되는 등)의 혈소판이 휴식 상태로 돌아갈 수 있습니다.
- 원심분리 중 활성화를 방지하기 위해 500nM 프로스타글란딘 I2 (PGI2)와 0.02U/mL의 아피라아제를 전혈에 첨가하고 한 번 뒤집어서 부드럽게 혼합합니다. 좁은 보어 전사 피펫을 사용하여 생성된 기포를 제거합니다.
참고: 적절한 PGI2 및 아피라제 레시피에 대한 지침은 보충 파일 1에서 찾을 수 있습니다. - 브레이크 없이(37°C) 없이 혈소판 풍부 혈장(PRP)(250 x g 에서 15분, 전혈 42mL)을 얻기 위한 전혈을 원심분리합니다.
- 광경 전사 피펫을 사용하여 PRP(담황색 털과 붉은 혈액층 위의 상단 노란색 층)를 새 50mL 원뿔형 튜브에 부드럽게 수집합니다.
- 전사할 때 깨끗한 원뿔형 튜브를 기울이고 PRP를 튜브 측면 아래로 부드럽게 실행합니다. 기포를 피하십시오.
- 담황색 코트(PRP와 적혈구 사이의 백혈구층)를 방해하지 않도록 약 3mm의 PRP를 남겨 두십시오. 방해를 받으면 이송 피펫에서 갑자기 흰색 소용돌이처럼 보입니다.
- 세포 수( 혈소판 계수 참조)를 취하여 다음 세척 단계를 위한 재현탁량을 결정합니다.
- 37 °C에서 10분 동안 그대로 두십시오.
- 베벨 컷 피펫 팁을 사용하여 유세포 분석을 위한 샘플을 채취합니다( 유세포 분석 참조).
- PRP에 500nM PGI2 및 0.02 U/mL 아피라아제를 첨가하고 한 번 부드럽게 뒤집어 혼합합니다.
- 37°C에서 1000 x g 에서 10분간 원심분리기(가속:0 브레이크:0).브레이크를 사용하지 마십시오. 펠릿이 조밀하지 않으며 급브레이크로 인해 재혼합이 발생할 수 있습니다.
- 원심분리하는 동안 재현탁액을 측정합니다. 75%의 회복률을 가정합니다. 세포 밀도를 약 3x105 cells/μL로 만듭니다.
- 벌크 부피는 플라스틱 광경 전사 피펫을 사용하고 펠릿 근처의 나머지 액체는 1mL 피펫(절단되지 않은 팁)을 사용하여 상층액을 흡입합니다. 튜브 바닥에 있는 펠릿을 만지지 마십시오.
- 500 nM PGI2 및 0.02 U/mL의 아피라아제를 변형된 Tyrode의 완충액에 첨가합니다. 원뿔형 튜브의 측면을 따라 흘러 내려가 16단계에서 계산된 양의 버퍼를 천천히 추가합니다.
- 베벨 절단 팁과 1mL 피펫 팁을 사용하여 위아래로 여러 번 부드럽게 피펫팅하여 펠릿을 부드럽게 재현탁합니다.
- 부피를 300μL로 설정하고 액체 라인 위에서 플런저를 끝까지 누른 다음 피펫을 액체 아래에 놓고 첫 번째 정지까지 올라옵니다. 이를 통해 과학자는 혈소판을 활성화할 수 있는 기포를 실수로 생성하지 않고 펠릿을 다시 현탁시킬 수 있습니다.
- 때때로, 펠릿 바닥에 눈에 보이는 적혈구 고리가 있습니다. 이를 다시 중단하지 마십시오.
- 펠릿이 재현탁되면 광경 전사 피펫을 사용하여 재현탁액 펠릿을 새로운 원추형 튜브로 이송하여 적혈구 또는 눈에 띄게 응집된 세포를 남겨둡니다.
- 11-20단계를 반복합니다. 새로운 부분 표본에서 500 nM PGI2 및 0.02 U/mL를 수정된 Tyrode의 버퍼에 추가해야 합니다(18단계에서 수정된 Tyrode의 버퍼를 재사용하지 마십시오. PGI2 는 너무 불안정함).
- 세포 수를 위해 샘플을 채취합니다. 변형된 Tyrode's buffer로 필요에 따라 혈소판 농도를 조정합니다.
- 베벨 컷 피펫 팁을 사용하여 유세포 분석을 위한 샘플을 채취합니다.
- 37°C에서 1시간 동안 혈소판을 휴지시켜 억제제가 소멸되고 가역적으로 활성화된 혈소판이 휴지 상태로 돌아갈 수 있도록 합니다.
- 넓은 구멍의 피펫으로 부드럽게 섞습니다. 유세포 분석을 위해 샘플을 채취합니다.
- 세척된 휴지 혈소판은 이제 대사 분석에 사용할 준비가 되었습니다.
3. 혈소판 계수
- 혈소판은 자동 혈구 계수기(제조업체의 지침에 따름) 또는 혈구계(hemocyometer)를 사용하여 계수할 수 있다33.
4. 유세포 분석
- 준비
- 항체 혼합물을 설정하고 혈소판 활성화를 측정하기 위해 유세포 분석기를 준비하기 위한 모범 사례에 대한 자세한 프로토콜과 검토는 다른 곳에서 찾을 수 있습니다34,35.
- 견본 추출
- 유세포 분석을 위해 검체를 채취할 때 베벨 컷 피펫 팁을 사용하여 혈소판 현탁액을 수집합니다. 이것을 항체가 있는 마이크로 원심분리기 튜브에 천천히 첨가한 다음 부드럽게 튕겨 섞습니다. 30초 동안 배양합니다.
- 베벨 컷 피펫 팁을 사용하여 혈소판 현탁액/항체 혼합물을 96웰 플레이트에 적절한 웰로 전달합니다.
- 즉시 세포를 고정하기 위해 잘 정착물을 첨가하십시오.
- 고정 후 8시간 이내에 유세포분석기에서 실행합니다.
- 작용제 민감도 검사
- 세척 후 2개의 15mL 원뿔형 튜브를 따로 보관하며, 하나는 휴지 제어용이고 다른 하나는 트롬빈 활성화 제어용입니다.
- 베벨 컷 피펫 팁을 사용하여 각 원뿔형 튜브에 100μL의 혈소판 현탁액을 부드럽게 피펫팅합니다. 37°C에서 1시간 동안 그대로 두십시오.
- 한 시간 휴식 후, 한 튜브에 0.1 U/mL의 트롬빈을 넣고(트롬빈 조제에 대한 지침은 보충 파일 1에서 찾을 수 있음) 다른 튜브에 비히클을 추가합니다. 37°C에서 15분 동안 배양합니다.
- agonist에 대한 혈소판 민감도를 확인하기 위해 각 튜브의 유세포 분석 샘플을 채취합니다.
5. 정량적 대사 플럭스 분석을 위한 샘플링
- 냉각
참고: 담금질 대사는 정확한 대사 플럭스를 측정하는 데 필요한 단계입니다. 세포를 빠르게 냉각시키고 체온을 4°C 이하로 유지하면 신진대사가 충분히 느려져 샘플링된 세포가 벌크에서 세포의 신진대사를 정확하게 반영하도록 본질적으로 중단된 것으로 간주할 수 있습니다. 사용할 수 있는 방법은 다양하지만 급속 냉각의 필요성과 누출 최소화의 균형을 맞추기 위해 저온(-4°C) 일반 식염수36을 사용합니다. 염이 후속 분석을 방해하는 경우 다른 유체(메탄올/물, 에탄올 등)를 사용할 수 있습니다.37.- 생리식염수의 분취액을 준비하고 동결합니다. 각 식염수 부분 표본을 원하는 샘플 부피의 6배로 만듭니다.
참고: 일반 식염수 레시피는 보충 파일 1에서 찾을 수 있습니다. - 마이크로 원심분리기를 0°C로 사전 냉각합니다.
- 부분적으로 동결된 생리식염수(< -4 °C)에서 1:6 비율로 혈소판 현탁액을 수집합니다(예: 마이크로 원심분리 튜브에서 750μL의 식염수로 150μL의 혈소판 현탁액을 수집).
참고: 혈소판/식염수를 얼음 위에 15분 이상 두지 마십시오. - 16,000 x g, 0°C에서 10분 동안 원심분리기
- 상등액은 외부 대사산물 분석을 위해 보관하고, 펠릿은 세포 내 대사산물 추출 및 측정을 위해 보관합니다. 분석 준비가 될 때까지 둘 다 -20°C에서 보관하십시오.
- 원하는 시간 간격과 샘플 시간 점 수에 대해 이 과정을 반복합니다.
- 생리식염수의 분취액을 준비하고 동결합니다. 각 식염수 부분 표본을 원하는 샘플 부피의 6배로 만듭니다.
- 세포 내 대사 산물 추출
- 담금질 된 펠릿에 -20 ° C에서 0.5 mL의 사전 냉각 된 7 : 3 메탄올 물을 첨가한다. 1분 동안 격렬하게 소용돌이칩니다.
- 액체 질소에서 동결하고 0 °C에서 해동한 다음 2 사이클 더 반복합니다.
- 현탁액을 16,000 x g 에서 -4°C에서 10분 동안 원심분리합니다.
- 새 마이크로 원심분리기 튜브에 상층액을 수집합니다.
- 3단계의 펠릿을 사용하고 50:50 메탄올:물로 추출 프로토콜(1-3단계)을 반복합니다. 수집된 두 번째 추출물을 첫 번째 추출물에 추가합니다. 밤새 말리십시오.
- 건조된 추출물을 150μL의 LC-MS 등급의 물(또는 의도한 분석에 적합한 기타 용매)에 재현탁합니다. 4 °C에서 15 분 동안 혼합합니다. 잠시 와류를 일으킨 후 0.22μm 마이크로 원심분리기 튜브로 옮겨 세포 파편을 제거합니다. 16,000 x g 및 4 °C에서 5분 동안 원심분리기.
- 원심분리기에서 분리하여 필터에 50μL의 옵티마 물을 추가로 피펫으로 주입한 다음 다시 원심분리(5분, 16,000xg 및 4°C)하여 필터를 헹굽니다. 분석을 위해 수집합니다.
결과
그림 2의 대표적인 결과는 남성 3명과 여성 3명을 포함한 6명의 헌혈자를 나타냅니다. 전혈에 대한 상대적인 혈소판 수율은 그림 2A에 나와 있습니다. 최종 혈소판 회수율은 평균 52% ± 3%(표준 편차, n=6)였다. 백혈구 오염과 비교한 최종 혈소판 수는 자동 혈액학 분석기를 사용하여 측정되었습니다. 백혈구 수는 전체 세포의 0.1% 미만이었습니다(그림 2B). 세척 과정과 시간 휴식을 통해 혈소판은 낮은 P-selectin 노출을 유지했지만 트롬빈 처리에는 강력하게 반응했습니다(그림 2C). 결합된 피브리노겐은 첫 번째 1000 x g 스핀 후에 급증하지만 두 번째 1000 x g 스핀 후에는 5% 미만으로 돌아갑니다. P-셀렉틴(P-selectin) 노출과 마찬가지로, 결합 피브리노겐(bound fibrinogen)은 시간 휴식 후 트롬빈(thrombin) 처리 후 급격히 증가한다(그림 2D). 크기, 싱글렛 및 CD42a 양성에 대한 대표적인 게이팅은 그림 3A-C에 나와 있습니다. 이러한 연속적인 게이트를 통과하는 이벤트는 P-셀렉틴 노출 및 결합 섬유유래물질을 찾는 데 사용됩니다. P-selectin 양성 및 피브리노겐 양성 혈소판에 대한 대표적인 게이팅은 그림 3D-E에 나와 있습니다. 그림 3D는 차량 제어로 처리된 혈소판 샘플을 보여주고, 그림 3E는 0.1 U/mL의 트롬빈을 첨가한 후 15분 후의 혈소판 샘플을 보여줍니다.
세척된 혈소판은 그림 4와 같이 정량적 흡수 및 배설 실험을 수행하는 데 사용되었습니다. 혈소판을 세척하고, 5mmol/L의 포도당 및 20mmol/L의 아세테이트를 최종 세척된 현탁액에 첨가했습니다. 0.1 U/mL의 트롬빈 또는 차량을 한 시간 휴식 후 세척된 혈소판 현탁액에 첨가했습니다. 샘플을 채취하여 30분 동안 트롬빈 첨가 후 15분마다 담금질했습니다. 상등액은 자동화된 측광 분석을 사용하여 세포외 젖산염, 포도당 및 아세테이트의 농도 변화를 측정하는 데 사용되었습니다. 플럭스는 시간 경과에 따른 대사 산물 농도의 회귀 기울기를 취하여 계산되었습니다. 그림 4 는 3개의 대표적인 공여체에 대해 계산된 대사산물 플럭스를 보여줍니다. 모든 기증자에 대한 젖산 플럭스는 양성으로 젖산이 생성되고 있음을 나타내고, 포도당 및 아세테이트 플럭스는 음성으로 섭취되고 있음을 나타냅니다. 주름 변화에는 차이가 있지만, 트롬빈 치료는 각 기증자에 대해 휴식을 취하는 것에 비해 플럭스의 크기를 증가시켰습니다.

그림 2: (A) 세척 과정의 각 단계에서 전혈 대비 회복된 혈소판의 비율. n=6, 오차 막대는 표준 편차를 나타냅니다. (B) 세척 과정이 끝날 때의 혈소판 및 백혈구 세포 수. (C) 유세포 분석으로 측정된 P-Selectin 발현에 양성인 혈소판의 비율. n=6, 오차 막대는 표준 편차를 나타냅니다. (D) 유세포 분석으로 측정한 피브리노겐에 대해 양성인 혈소판의 비율. n=6, 오차 막대는 표준 편차를 나타냅니다. . 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 혈소판 유세포 분석을 위한 대표적인 게이팅. 혈소판은 (A) 전방 산란(FSC) 및 측면 산란(SSC)이 있는 크기에 대해 게이트, (B) FSC 너비 및 FSC 높이가 있는 단일 세포에 대해 게이트, (C) CD42a 양성에 대해 게이트됩니다. 이러한 연속 게이트를 통과하는 이벤트는 활성화 마커를 찾는 데 사용됩니다. (D) 휴지 대조 혈소판 샘플에 대한 P-selectin 및 피브리노겐 발현. 여기에서 측정된 활성화 마커는 P-Selectin PECy5 및 FITC-Fibrinogen입니다. (E) 0.1 U/mL 트롬빈 처리된 혈소판 샘플에 대한 P-셀렉틴 및 피브리노겐 발현. 여기에서 측정된 활성화 마커는 P-Selectin PECy5 및 FITC-Fibrinogen입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
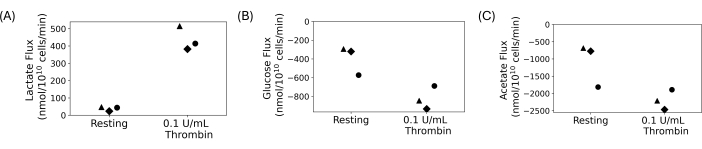
그림 4: (A) 휴지 및 트롬빈 활성화 상태에 대한 3개의 서로 다른 기증자에 대한 젖산 배설률. (B) 휴지 및 트롬빈 활성화 상태에 대한 3명의 다른 기증자에 대한 포도당 흡수율. (C) 휴지 및 트롬빈 활성화 상태에 대한 3명의 다른 기증자에 대한 아세테이트 흡수율. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 1: 완충액 및 시약 준비 레시피 및 지침. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
혈소판은 전단 응력 및 작용제의 존재를 포함한 환경에 매우 민감하다38,39. 이로 인해 혈소판을 처리하고 분리하는 것이 어려워지므로 억제제와 광구경 피펫을 사용하는 것이 중요합니다40. 기본 PBS에서 PGI2를 준비하지 못하면 PGI2가 급격히 저하될 수 있으므로 PGI2의 적절한 보관 및 준비는 매우 중요합니다 41. 전단 유도 활성화의 위험을 최소화하려면 광경 피펫, 베벨 컷 피펫 팁 및 19게이지 정맥 절개술 바늘을 사용하십시오.
불가피하게 세척 과정의 각 단계에서 혈소판의 일부가 손실됩니다(그림 2A). 모든 혈소판이 혈장층으로 들어가는 것은 아니며, 혈장을 담황색 코팅층에 너무 가깝게 수집하면 백혈구가 오염될 위험이 있습니다. 또한, 혈소판 집단은 재부유 시 뭉쳐져 바닥으로 가라앉기 때문에 각 재부유 후 재부유 펠릿을 깨끗한 튜브로 옮기는 것이 중요하다는 점을 강조합니다. 그림 2D에서 첫 번째 1000 x g 스핀 후에 피브리노겐 결합이 증가하고 두 번째 1000 x g 스핀 후에 감소하는 것을 볼 수 있습니다. 유세포 분석을 위한 샘플은 각 사례에서 10분의 휴식 시간 후에 수집되었습니다. 이 개체군의 일부가 정지 상태를 회복할 수 있지만, 이 개체군은 처음 10분 휴식 후에 존재하기 때문에 이 활성화된 개체군의 일부는 다시 부유할 때 덩어리가 되어 튜브 바닥으로 떨어질 수 있습니다.
유세포 분석의 사용이 반드시 필요한 것은 아니지만, 혈소판이 정지 상태이고 세척 과정이 끝날 때 작용제에 반응할 수 있는지 모니터링하는 것이 좋습니다. 또한, 특히 세척 중에 혈소판의 많은 부분이 시각적으로 뭉쳐 보이는 경우 각 단계에서 유세포 분석을 수행하면 문제가 발생하는 위치를 식별하는 데 도움이 될 수 있습니다. 흔하지는 않지만, 20건의 공여자 실험 중 약 1건은 휴지 기간 동안의 자발적인 혈소판 활성화로 인해 제외되어야 합니다. 혈소판 활성화 마커의 유세포 분석 분석은 혈소판과 관련된 실험에 앞서 작용제에 대한 정지 및 민감도를 검증하는 데 유용한 도구입니다.
유세포 분석을 사용하여 작용제에 대한 혈소판 반응을 측정하기 위해 일부 연구에서는 혈소판이 작용제와 항체 칵테일에서 10-30분 동안 배양한 후 고정할 수 있습니다 42,43,44. 한 시간 휴식 후, 휴식 조절 혈소판을 고정하기 전에 실온에서 20분 동안 배양하면 활성화가 과대 평가됩니다. 혈소판을 37°C에서 20분 동안 배양할 때는 이러한 활성화가 발생하지 않으며, 이는 억제제가 마모되고 급격한 온도 변화로 인해 혈소판이 활성화되기 때문에 이러한 명백한 활성화가 발생함을 시사합니다. 세척 과정에서 20 분을 기다렸다가 수정하면 이러한 인위적 활성화가 유도되지 않으며, 이는 시간 휴식 중 억제제의 작용이 감쇠되기 때문일 수 있습니다. 혈소판의 실제 활성화 상태를 포착하려면 37°C에서 배양을 수행하거나 항체로 짧은(30초) 배양 후 수정하는 것이 좋습니다.
세척된 혈소판은 다른 혈액 세포와 혈장 구성 요소의 간섭 없이 혈소판을 연구할 수 있는 방법을 제공합니다. 그들은 대사 연구를 포함하여 세포 외 환경을 조작해야 하는 연구에 이상적입니다. 최종 혈소판 현탁액의 밀도는 조정 가능하며 사람들 간의 혈소판 수 변동성을 최소화하도록 제어할 수 있습니다. 대사 연구를 위해 혈소판 탄소 기질의 맞춤형 농도를 제어할 수 있습니다. 그림 4에 나타난 대표적인 결과는 포도당과 아세테이트를 탄소 기질로 첨가하고 젖산을 생산하는 흡수 및 배설 실험에서 얻은 것입니다. 그림 4에서는 공여자들 간에 생물학적 차이가 있지만, 트롬빈 처리 시 젖산 생산이 증가하는 반면, 포도당과 아세테이트 소비는 증가합니다. 이것은 문학과 일치한다. 혈소판은 활성화 시 호기성 해당작용 및 산화적 인산화 속도를 증가시키는 것으로 알려져 있습니다 13,14,15,45. 이 기술은 다양한 영양 조건 또는 최종 혈소판 현탁액에서 다른 이온을 가진 혈소판을 연구하는 데 적용할 수 있습니다.
세척된 혈소판 연구는 가치가 있지만, 인공 환경이 생체 내 환경을 재현하지 않는다는 점을 명심하는 것이 중요합니다. 따라서 세척된 혈소판은 연구자가 혈소판 기능에만 관심이 있는 상황에서만 사용해야 합니다. 모든 시험관 내 연구와 마찬가지로 결과는 신중하게 해석해야 합니다. 최종 세척 후 칼슘 농도가 2mM인 변형된 Tyrode의 완충액에 혈소판을 재현탁하는 것이 좋습니다. P-selectin과 피브리노겐 결합 발현은 세척 공정 후 최대 1.5시간까지만 측정되었기 때문에(1시간 휴식 포함 2.5시간), 과학자는 해당 시간 내에 세척된 혈소판 현탁액을 사용하거나 혈소판의 충실도를 검증하는 것이 좋습니다. 이 연구는 응집체와 같은 혈소판 기능의 다른 고전적인 지표를 측정하지 않았습니다.
당사의 프로토콜로 준비된 세척된 혈소판은 정지되어 있으며, P-selectin 및 fibrinogen의 유세포 측정으로 검증됩니다. 세포 외 환경의 대사 기질, 호르몬 및 혈소판 작용제는 정밀하게 제어할 수 있으므로 과학자는 자신이 선택한 시스템에서 혈소판 대사를 연구할 수 있습니다.
공개
저자는 보고할 이해 상충이 없습니다.
감사의 말
저자는 Pierre Mangin 박사의 연구실의 Emily Janus-Bell 박사와 Clarisse Mouriaux 박사, Jorge DiPaola 박사 연구실의 Katrina Bark에게 지도와 조언을 아끼지 않은 것에 감사를 표합니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.22 µM filter Spin-X tubes | Millapore-Sigma | CLS8160 | Reagent prep |
| 19 G x 3/4" needle | McKesson Corporation | 448406 | Phlebotomy |
| 21 G 1.5 inch needle with luer lock | Amazon | B0C39PJD23 | Reagent prep |
| 96 well plate, half area | Greiner Bio-One | 675101 | Flow cytometry |
| ACD-A vaccutainers | Fisher Scientific | 364606 | Phlebotomy |
| Adapter | McKesson Corporation | 609 | Phlebotomy |
| Alcohol swab | VWR | 15648-916 | Phlebotomy |
| Apyrase from potatoes | Sigma | A6410-100UN | Reagent prep |
| CD42a Monoclonal Antibody | Thermo Fisher Scientific | 48-0428-42 | Flow cytometry |
| Chilled microcentrifuge | ThermoFisher Scientific | 75002441 | Quenching |
| D-Glucose | Sigma | G7021 | Reagent prep |
| FITC Anti-Fibrinogen antibody | Abcam | 4217 | Flow cytometry |
| Flow cytometer | Beckman Coulter | 82922828 | Flow cytometry |
| Gauze | VWR | 76049-110 | Phlebotomy |
| Glycerol | Sigma Aldrich | G5516 | Reagent prep |
| HEPES | Sigma Aldrich | H4034 | Reagent prep |
| Human alpha-thrombin | Prolytix | HCT-0020 | Flow cytometry |
| KCl | Sigma Aldrich | P9333 | Reagent prep |
| KH2PO4 | Sigma Aldrich | P5655 | Reagent prep |
| MgCl2 | Sigma | M8266 | Reagent prep |
| Microcentrifuge tubes | VWR | 87003-292 | General |
| Na2HPO4 | Sigma | S3264 | Reagent prep |
| NaCl | Sigma Aldrich | S7653 | Reagent prep |
| NaHCO3 | Sigma Aldrich | S5761 | Reagent prep |
| Narrow bore transfer pipette | VWR | 16001-176 | Platelet washing |
| Paraformaldehyde solution, 4% in PBS | Santa Cruz Biotechnology | sc-281692 | Flow cytometry |
| PECy5 Mouse Anti-Human CD62P | BD Pharmingen | 551142 | Flow cytometry |
| Plate cover | Thermo Fisher Scientific | AB0626 | Flow cytometry |
| Polypropylene 15 mL conical tubes | VWR | 89039-658 | Reagent prep |
| Polypropylene 50 mL conical tubes | VWR | 352070 | Platelet washing |
| Prostaglandin I2 (sodium salt) | Cayman Chemical | 18220 | Reagent prep |
| SKC Inc. C-Chip Disposable Hemocytometers | Fisher Scientific | 22-600-100 | Cell counting |
| Syringe | BD Pharmingen | 14-823-41 | Reagent prep |
| Tourniquet | VWR | 76235-371 | Phlebotomy |
| Vacutainer needle holder | BD | 364815 | Phlebotomy |
| Vortexer | VWR | 102091-234 | Reagent prep |
| Water bath | Thermo Fisher Scientific | TSGP02 | Platelet washing |
| Wide bore transfer pipette | VWR | 76285-362 | Platelet washing |
참고문헌
- Versteeg, H. H., Heemskerk, J. W., Levi, M., Reitsma, P. H. New fundamentals in hemostasis. Physiol Rev. 93 (1), 327-358 (2013).
- Webera, M., et al. Enhanced platelet aggregation with trap-6 and collagen in platelet aggregometry in patients with venous thromboembolism. Thromb Res. 107, 325-328 (2002).
- Herbert, J. M., Bernat, A., Maffrand, J. P. Importance of platelets in experimental venous thrombosis in the rat. Blood. 80 (9), 2281-2286 (1992).
- Puurunen, M. K., Hwang, S. J., O'donnell, C. J., Tofler, G., Johnson, A. D. Platelet function as a risk factor for venous thromboembolism in the framingham heart study. Thromb Res. 151, 57-62 (2017).
- Montoro-Garcia, S., Schindewolf, M., Stanford, S., Larsen, O. H., Thiele, T. The role of platelets in venous thromboembolism. Semin Thromb Hemost. 42 (3), 242-251 (2016).
- Koupenova, M., Kehrel, B. E., Corkrey, H. A., Freedman, J. E. Thrombosis and platelets: An update. Eur Heart J. 38 (11), 785-791 (2017).
- Yeung, J., Li, W., Holinstat, M. Platelet signaling and disease: Targeted therapy for thrombosis and other related diseases. Pharmacol Rev. 70 (3), 526-548 (2018).
- Ferreiro, J. L., Gomez-Hospital, J. A., Angiolillo, D. J. Platelet abnormalities in diabetes mellitus. Diab Vasc Dis Res. 7 (4), 251-259 (2010).
- Buergy, D., Wenz, F., Groden, C., Brockmann, M. A. Tumor-platelet interaction in solid tumors. Int J Cancer. 130 (12), 2747-2760 (2012).
- Gkaliagkousi, E., Passacquale, G., Douma, S., Zamboulis, C., Ferro, A. Platelet activation in essential hypertension: Implications for antiplatelet treatment. Am J Hypertens. 23 (3), 229-236 (2010).
- Fidler, T. P., et al. Deletion of GLUT1 and GLUT3 reveals multiple roles for glucose metabolism in platelet and megakaryocyte function. Cell Rep. 20 (4), 881-894 (2017).
- Fidler, T. P., et al. Glucose metabolism is required for platelet hyperactivation in a murine model of type 1 diabetes. Diabetes. 68 (5), 932-938 (2019).
- Kulkarni, P. P., et al. Aerobic glycolysis fuels platelet activation: Small-molecule modulators of platelet metabolism as anti-thrombotic agents. Haematologica. 104 (4), 806-818 (2019).
- Ghatge, M., Flora, G. D., Nayak, M. K., Chauhan, A. K. Platelet metabolic profiling reveals glycolytic and 1-carbon metabolites are essential for gp vi-stimulated human platelets-brief report. Arterioscler Thromb Vasc Biol. 44 (2), 409-416 (2024).
- Ravera, S., Signorello, M. G., Panfoli, I. Platelet metabolic flexibility: A matter of substrate and location. Cells. 12 (13), (2023).
- Hechler, B., Dupuis, A., Mangin, P. H., Gachet, C. Platelet preparation for function testing in the laboratory and clinic: Historical and practical aspects. Res Pract Thromb Haemost. 3 (4), 615-625 (2019).
- Mustard, J. F., Perry, D. W., Ardille, N. G., Packham, M. A. Preparation of suspensions of washed platelets from humans. British Journal of Haematology. 22, 193-204 (1972).
- Cazenave, J. P., et al. Preparation of washed platelet suspensions from human and rodent blood. Methods Mol Biol. 272, 13-28 (2004).
- Fine, K., Ashbrook, P., Brigden, L., Maldonado, J., Didishelm, P. Gel-filtered human platelets. Ultrastructure, function, and role of proteins in inhibition of aggregation by aspirin. Am J Pathol. 84 (1), (1976).
- Weiss, L., et al. An optimized protocol to isolate quiescent washed platelets from human whole blood and generate platelet releasate under clinical conditions. STAR Protoc. 4 (2), 102150 (2023).
- Burzynski, L. C., Pugh, N., Clarke, M. C. H. Platelet isolation and activation assays. Bio Protoc. 9 (20), e3405 (2019).
- Aurbach, K., Spindler, M., Haining, E. J., Bender, M., Pleines, I. Blood collection, platelet isolation and measurement of platelet count and size in mice-a practical guide. Platelets. 30 (6), 698-707 (2018).
- Narciso, M. G., Nasimuzzaman, M. Purification of platelets from mouse blood. J Vis Exp. (147), (2019).
- Aibibula, M., Naseem, K. M., Sturmey, R. G. Glucose metabolism and metabolic flexibility in blood platelets. J Thromb Haemost. 16 (11), 2300-2314 (2018).
- Ravi, S., et al. Metabolic plasticity in resting and thrombin-activated platelets. PLoS One. 10 (4), e0123597 (2015).
- Nayak, M. K., et al. an inhibitor of pyruvate dehydrogenase kinases, inhibits platelet aggregation and arterial thrombosis. Blood Advances. 2, (2018).
- Hadley, J. B., et al. Hormones, age, and sex affect platelet responsiveness in vitro. Transfusion. 62 (9), 1882-1893 (2022).
- Paglia, G., et al. Comprehensive metabolomic study of platelets reveals the expression of discrete metabolic phenotypes during storage. Transfusion. 54 (11), 2911-2923 (2014).
- Sake, C. L., et al. Isotopically nonstationary (13)c metabolic flux analysis in resting and activated human platelets. Metab Eng. 69, 313-322 (2022).
- Antoniewicz, M. R. A guide to metabolic flux analysis in metabolic engineering: Methods, tools and applications. Metab Eng. 63, 2-12 (2021).
- Larsen, M. T., Kuhlmann, M., Hvam, M. L., Howard, K. A. Albumin-based drug delivery: Harnessing nature to cure disease. Mol Cell Ther. 4 (3), (2016).
- Balduini, C. L., Noris, P. P. latelet count and aging. Haematologica. 9 (6), 953-955 (2014).
- JoVE Science Education Database. Basic methods in cellular and molecular biology. Using a hemacytometer to count cells. , (2023).
- Spurgeon, B. E. J., Naseem, K. M. Platelet flow cytometry: Instrument setup, controls, and panel performance. Cytometry B Clin Cytom. 98 (1), 19-27 (2020).
- Van Velzen, J. F., Laros-Van Gorkom, B. A., Pop, G. A., Van Heerde, W. L. Multicolor flow cytometry for evaluation of platelet surface antigens and activation markers. Thromb Res. 130 (1), 92-98 (2012).
- Sake, C. L., Newman, D. M., Boyle, N. R. Evaluation of quenching methods for metabolite recovery in photoautotrophic synechococcus sp. Pcc 7002. Biotechnol Prog. 36 (5), e3015 (2020).
- Sapcariu, S. C., et al. Simultaneous extraction of proteins and metabolites from cells in culture. MethodsX. 1, 74-80 (2014).
- Rana, A., Westein, E., Niego, B., Hagemeyer, C. E. Shear-dependent platelet aggregation: Mechanisms and therapeutic opportunities. Front Cardiovasc Med. 6, 141 (2019).
- Ding, J., et al. Quantification of shear-induced platelet activation: High shear stresses for short exposure time. Artif Organs. 39 (7), 576-583 (2015).
- Ardlie, N., Perry, D., Packham, M., Mustard, J. Influence of apyrase on stability of suspensions of washed rabbit platelets. Proc Soc Exp Biol Med. 136 (4), (1971).
- Rao, G. H. R., Reddy, K. R., Hagert, K., White, J. G. Influence of ph on the prostacyclin (pg12) mediated inhibition of platelet function. Prostaglandins Medicine. 4, 263-273 (1980).
- Navred, K., et al. A simplified flow cytometric method for detection of inherited platelet disorders-a comparison to the gold standard light transmission aggregometry. PLoS One. 14 (1), e0211130 (2019).
- Aldrighi, J. M., et al. Platelet activation status decreases after menopause. Gynecol Endocrinol. 20 (5), 249-257 (2005).
- Bausset, O., et al. Formulation and storage of platelet-rich plasma homemade product. Biores Open Access. 1 (3), 115-123 (2012).
- Nayak, M. K., et al. The metabolic enzyme pyruvate kinase m2 regulates platelet function and arterial thrombosis. Blood. 137 (12), 1658-1668 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유