Method Article
Выделение и культивирование мезенхимальных стволовых клеток костного мозга из нижней челюсти человека
* Эти авторы внесли равный вклад
В этой статье
Резюме
В настоящем протоколе описана эффективная методика выделения и культивирования мезенхимальных стволовых клеток костного мозга нижней челюсти человека с использованием метода адгезии всего костного мозга. Культивируемые клетки были идентифицированы с помощью анализа пролиферации клеток, проточной цитометрии и индукции многолинейной дифференцировки.
Аннотация
Мезенхимальные стволовые клетки человека (МСК) показали большой потенциал в регенерации костей, иммуномодуляции и лечении рефрактерных хронических заболеваний. В последнее время были обнаружены различные источники получения hMSCs, в то время как костный мозг по-прежнему считался основным источником. МСК, полученные из костного мозга (BMSC) из различных участков донорской кости, имеют различные характеристики, обусловленные факторами микросреды. Исследования показали, что BMSC из челюстно-лицевой кости могут обладать большей пролиферативной и остеогенной способностью, чем BMSC из длинных костей или подвздошного гребня. А челюстно-лицевые BMSC были признаны более подходящими для терапии стволовыми клетками в челюстно-лицевых тканях. Нижняя челюсть, особенно восходящая область ветвей с достаточным количеством костного мозга, была подходящим донорским участком для сбора БМСК. В этом исследовании описан протокол сбора, выделения и культивирования МСК, полученных из костного мозга нижней челюсти человека (hmBMSCs). Кроме того, для идентификации культивируемых клеток проводили иммунофенотипирование hmBMSC, анализы пролиферации и индукцию in vitro остеогенной, адипогенной и хондрогенной дифференцировки. Применение этого протокола может помочь исследователям успешно получить достаточное количество высококачественных hmBMSC, что необходимо для дальнейших исследований биологической функции, эффектов микросреды и клинического применения.
Введение
Мезенхимальные стволовые клетки человека (МСК) представляют собой мультипотентные клетки, которые могут быть дифференцированы в различные типы клеток, такие как остеоциты, адипоциты и хондроциты мезодермальной линии, гепатоциты и панкреоциты энтодермальной линии, а также нейроциты эктодермальной линии1. Таким образом, гмск показали большой потенциал в регенерации тканей. Кроме того, МСК являются мощными иммуномодуляторами, которые могут регулировать микроокружение в тканях хозяина и эффективно лечить хронические рефрактерные заболевания2. Поэтому гмск широко используются в клеточной терапии клинических исследований. Следовательно, важно успешно получить достаточное количество hMSC с высоким качеством и удобным способом.
С тех пор, как о МСК впервые сообщили в костном мозге, было обнаружено множество альтернативных источников МСК, таких как жировая ткань, синовиальная жидкость, скелетные мышцы, амниотическая жидкость, эндометрий, зубные ткани и пуповина 1,3. Тем не менее, костный мозг остается основным источником МСК для большинства доклинических и клинических исследований, а МСК, полученные из костного мозга (МСК), принимаются в качестве стандарта для сравнения МСК из других источников4. В течение многих лет гребень подвздошной кости или длинные кости (большеберцовая и бедренная кости) были наиболее популярными анатомическими местами для получения костного мозга 1,5. Тем не менее, гребень подвздошной кости или длинные кости имеют другое эмбриональное происхождение и модели развития по сравнению с челюстно-лицевыми костями 5,6. Многие клинические, лабораторные исследования и исследования в области разработки доказали, что БМСК разного происхождения проявляют сайт-специфичные свойства, а привитые БМСК сохраняют свойства донорского участка после имплантации на реципиентном участке 5,6,7,8,9. С точки зрения развития, челюстно-лицевые ткани, такие как верхняя челюсть, нижняя челюсть, дентин, альвеолярная кость, пульпа и периодонтальная связка, возникают исключительно из клеток нервного гребня. Напротив, подвздошный гребень и длинные кости образованы мезодермой. Кроме того, нижние челюсти создаются путем внутримембранного окостенения, в то время как осевой и аппендикулярный скелеты подвергаются эндохондральному окостенению. Более того, по сравнению с гребнем подвздошной кости и длинными костями, некоторые клинические исследования показали, что hMSCs, полученные из челюстно-лицевого костного мозга, обладают лучшей клеточной пролиферативной активностью и дифференцировочной способностью 6,8. Таким образом, ожидается, что BMSC из челюстно-лицевой области будут лучшим выбором для регенерации челюстно-лицевой ткани и терапии хронических рефрактерных заболеваний челюстно-лицевой области.
Нижняя челюсть состоит из двухслойных толстых кортикальных костей с губчатым костным мозгом между ними, чтобы она могла нагружать себя жевательной способностью. Таким образом, нижняя челюсть, особенно восходящая область ветвей, обычно используется в качестве донорского участка для получения аутологичных костных трансплантатов при черепно-челюстно-лицевых операциях10. А при таких операциях, как остеотомия сагиттального раскола ветви нижней челюсти и пластика уменьшения угла нижней челюсти, необходимо удалить части кортикальной и губчатой кости нижней челюсти для достижения приятного контура лица. Эти выброшенные губчатые кости могут быть потенциальным ресурсом для ГМСК. Тем не менее, в нескольких опубликованных исследованиях описан протокол быстрой изоляции и культивирования высококачественных МСК, полученных из костного мозга нижней челюсти человека (hmBMSCs).
В настоящем исследовании используется модифицированный метод адгезии цельного костного мозга для введения надежного и воспроизводимого протокола выделения и культивирования hmBMSC. Стволовые клетки были идентифицированы с помощью проточного цитометрического иммунофенотипирования МСК, анализов пролиферации и индукции многолинейной дифференцировки. Применение этой стандартной процедуры может помочь исследователям получить высококачественные МСК, полученные из костного мозга нижней челюсти человека, что важно для дальнейших исследований биологической функции, эффектов микроокружения и клинического применения.
протокол
Порядок забора образцов костей нижней челюсти человека был одобрен Этическим комитетом Школы стоматологии Четвертого военно-медицинского университета. Исследование проводилось в соответствии с этическими принципами Хельсинкской декларации 1975 года. Все доноры для настоящего исследования были проинформированы о возможных рисках и целях исследования. Возраст доноров варьировался от 18 до 40 лет, и не было никаких гендерных предрассудков. Письменное согласие было получено от всех участников.
1. Подготовка к операции
- Выберите подходящего донора.
- Выберите в качестве доноров пациентов, которые планируют провести такие операции, как откат нижней челюсти после остеотомии сагиттального расщепления ветви и пластика уменьшения угла нижней челюсти.
- Приготовьте раствор для консервации.
- Добавьте 30 мл фосфатного буферного раствора (1x PBS) с 1% пенициллином и стрептомицином в стерильной и не содержащей ферментов центрифужной пробирке объемом 50 мл за день до операции. Храните в холодильнике при температуре 4 °C.
- В день операции поместите центрифужную пробирку с консервирующим раствором в холодильник и храните ее в операционной за 1 час до операции.
- Стерилизуйте инструменты для изоляции костного мозга за день до операции, включая ножницы, пинцет и ножи, при температуре 120 °C и давлении 0,27 МПа в течение 20 минут.
- Приготовьте питательную среду α-MEM путем смешивания минимально незаменимой среды альфа (α-MEM) с 10% фетальной бычьей сывороткой (FBS) и 1% пенициллином и стрептомицином.
- Готовят остеогенную среду для дифференцировки, смешивая питательную среду α-MEM с 50 мМ аскорбиновой кислотой, 10 мМ β-глицеринфосфата и 0,1 мМ дексаметазона (см. Таблицу материалов).
- Готовят адипогенную среду для дифференцировки А, смешивая питательную среду α-MEM с 1 мМ дексаметазоном, 0,2 мМ индометацином, 10 мкг/мл инсулина и 0,5 мМ 3-изобутил-1-метилксантина (IBMX) (см. Таблицу материалов).
- Готовят среду для адипогенной дифференцировки В, смешивая питательную среду α-MEM с 10 мкг/мл инсулина.
- Приготовьте хондрогенную среду для дифференцировки, смешав модифицированную среду Дульбекко с высоким содержанием глюкозы (HG-DMEM) и 100 нМ дексаметазона, 100 г/мл пирувата натрия, 25 мг/мл витамина С, 40 мг/мл пролина, 10 нг/мл TGF-β3 и 1% ITS (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Остеогенная, адипогенная и хондрогенная среда для дифференцировки может быть приготовлена на месте, как упоминалось выше. Тем не менее, в настоящем исследовании были использованы коммерчески доступные наборы для того же самого (см. Таблицу материалов).
2. Забор образца кости нижней челюсти человека
- Перед операцией внимательно изучите трехмерные компьютерные томографические изображения и планирование хирургического моделирования доноров (Рисунок 1).
- Выберите участок нижней челюсти, который донор планирует удалить во время операции и который богат губчатой костью с костным мозгом в качестве донорского участка.
- Перед операцией продезинфицируйте и накидывайте пациента.
- Резекцию выбранного донорского участка нижней челюсти с помощью ультразвукового остеотомного лезвия (см. Таблицу материалов), избегая повреждения нижнего альвеолярного нерва и повреждения донорской кости.
- Как можно скорее поместите образцы костей нижней челюсти в раствор для консервации (шаг 1.2).
- Поместите консервационный раствор с образцами костей в холодильник до тех пор, пока в лаборатории не начнется выделение МСК.
ПРИМЕЧАНИЕ: Выделение МСК необходимо начинать как можно скорее после забора, чтобы сохранить жизнеспособность клеток. Если выделение МСК не может быть проведено немедленно, раствор для консервации с образцами костей можно хранить в холодильнике или охлаждать при температуре 4 °C не более 2 часов.
3. Выделение и культивирование человеческих мБМСК
- Достаньте образцы костей из консервационного раствора и опустите их в 1x PBS с 1% пенициллином и стрептомицином на 5 минут на чистую скамейку ламинарного шкафа.
ПРИМЕЧАНИЕ: Этот шаг направлен на вымывание тромба и остатков ротовой жидкости и дальнейшее уничтожение микроорганизмов, поскольку ротовая полость не является полностью стерильной средой. Перед изоляцией и культивированием клеток вымойте и продезинфицируйте руки спиртом, а также наденьте одноразовые стерильные перчатки и маски. - Очистите сросшиеся мягкие ткани и кровяное пятно на поверхности кости с помощью стерильной влажной марли.
- Заполните стерильную питательную чашку диаметром 6 см 5 мл питательной среды α-MEM.
- Положите косточку в стерильную посуду для культуры и нарежьте ее небольшими кусочками (почти 2-3 мм3 объема) стерилизованным ножом или ножницами.
ПРИМЕЧАНИЕ: Держите образцы костей пинцетом, чтобы избежать пореза пальца. - Аспирация питательной среды α-MEM в чашке для культивирования с помощью одноразового стерильного шприца объемом 1 мл.
- Ввести иглу шприца с питательной средой α-MEM глубоко в полость костного мозга губчатых фрагментов костной ткани.
- Промывайте костный мозг в чашку для культуры с помощью шприца со всех сторон кусочков образца кости, не менее 5-10 раз с каждой стороны.
- Повторяйте шаги 3.5-3.7 до тех пор, пока все образцы костей не станут чисто белыми, чтобы обеспечить попадание как можно большего количества костного мозга в питательную среду.
ПРИМЕЧАНИЕ: Общее время работы вышеуказанных ступеней от 3.1 до 3.8 необходимо контролировать в течение 30 минут на льду. - Удалите и выбросьте все кусочки костных образцов пинцетом. Удалите другие мелкие фрагменты с помощью клеточного фильтра с размером пор 70 мкм.
- Слегка встряхните чашку для культивирования, чтобы промытые клетки распределились равномерно.
- Поместите чашку для культивирования в клеточный инкубатор и культивируйте клетки при температуре 37 °C во влажной атмосфере с содержаниемCO2 5%.
- На третий день культивирования проверьте морфологию клеток и состояние роста под световым микроскопом. Удалить половину питательной среды, в которой отсутствуют адгезивные клетки и фрагменты ткани; добавить 3 мл свежей питательной среды α-MEM.
- На 7-й день культуры удалите всю питательную среду и добавьте 5 мл свежей питательной среды α-MEM.
- Затем обновляйте питательную среду α-MEM каждые 3 дня.
- Проверяйте морфологию и рост клеток каждый день.
ПРИМЕЧАНИЕ: Когда первичные клеточные культуры (P0) достигнут 70%-80% конфлюенции через 7-10 дней культивирования, проведите пассаж клеток.
4. Клеточный проход
- При 70%-80% конфлюенции удалите всю культуральную среду из клеток P0. Осторожно вымойте чашку для культивирования 1x PBS дважды, чтобы очистить остаточную питательную среду.
- Добавьте 1 мл 0,25% трипсина с 0,02% ЭДТА в чашку для культур для переваривания клеток. Осторожно встряхните чашку для посева, чтобы трипсин равномерно распределился. Поставьте чашку для культуры при температуре 37 °C на 3 минуты.
- Проверьте клетки под микроскопом. Когда 70-80% клеток сократятся и округлятся, добавьте 2 мл питательной среды α-MEM, чтобы остановить пищеварительную реакцию.
- Аккуратно продуйте поверхность чашки несколько раз пипеткой, чтобы продуть клетки.
- Переложите клеточную суспензию в центрифужную пробирку объемом 15 мл. Центрифугируйте клеточную суспензию при 200 х г в течение 5 мин при комнатной температуре.
- Выбросьте надосадочную жидкость и повторно суспендируйте клетки питательной средой α-MEM. Засеять P0 клеток в культуральных колбах (25 см) для расширения с соотношением деления 1:2. Первые проходные клетки назывались клетками Р1.
- Когда клетки Р1 достигнут 70%-80% слияния, повторите прохождение клетки, следуя шагам, начиная с 4.1-4.6. Элементы второго поколения были названы Р2-клетками.
- Измените коэффициент расщепления расширения на 1:3 после прохождения ячейки третьего поколения.
- Используйте клетки от P3 до P5 для проведения экспериментов по идентификации.
5. Проточный цитометрический анализ
- Расщепляйте МСК от P3 до P5, используя 0,25% трипсина с 0,02% ЭДТА, следуя шагам 4.1-4.5.
- Выбросьте надосадочную жидкость и повторно суспендируйте клетки в 1x PBS при концентрации 1 x 106 клеток/мл.
- Перенесите клетки в микроцентрифужные пробирки со 100 мкл клеточной суспензии на пробирку.
- Добавьте в микроцентрифужные пробирки иммуномеченные мышиные моноклональные антитела против человека.
Примечание: Для настоящего исследования использовали конъюгированное антитело фикоэритрин (ПЭ) против CD45, флуоресцеин-изотиоцианат (FITC)-конъюгированное антитело против CD90, CD34 и CD44 в соотношении 4,11 (см. Таблицу материалов), а все разведения антител составляли 1:100. При разведении антител нужно следовать инструкциям производителя. В качестве контроля будет использоваться PBS. - Инкубируйте антитела и контроль PBS при комнатной температуре в темноте в течение 30 минут.
- Центрифугируйте пробирки при давлении 800 х г в течение 5 минут при комнатной температуре. Выбросьте суспензию и снова суспендируйте клетки в 0,5 мл 1x PBS. Повторите этот шаг дважды.
- Загрузите пробирки в проточный цитометр (см. Таблицу материалов). Подсчитайте количество помеченных флуоресценцией клеток с помощью проточного цитометра, содержащего минимум 10 000 событий.
ПРИМЕЧАНИЕ: Процесс подсчета клеток проточным цитометром лучше начинать сразу после процедуры иммунофлуоресцентного мечения. Если нет, клетки необходимо зафиксировать в 1% параформальдегиде, хранить при температуре 4 °C в темноте и завершить процесс в течение 24 часов.
6. Анализ пролиферации клеток
- Используйте Р3-клетки для проведения анализа пролиферации клеток. Расщепляйте МСК Р3 с 0,25% трипсина, следуя шагам 4.1-4.5.
- Выбросьте надосадочную жидкость и повторно суспендируйте клетки питательной средой α-MEM.
- Подсчитайте количество клеток с помощью гемоцитометра, и засейте клетки на 96-луночные культуральные планшеты с плотностью 3 х 10по 3 клетки на лунку, всего 35 лунок, по 5 лунок на каждый подсчет суток (в день 1, 2, 3, 4, 5, 6, 7). Обновляйте питательную среду клеток каждые 3 дня.
- В каждый день подсчета отбраковывайте питательную среду α-MEM из определенных пяти лунок на определенный день учета, а затем добавляйте 100 μл питательной среды и 10 μл раствора CCK-8 (см. Таблицу материалов). Выдерживать при 37 °C в течение 1 ч.
- Поместите культуральные планшеты в микропланшетный спектрофотометр (см. Таблицу материалов) и измерьте значение оптической плотности пяти лунок для каждого учетного дня (всего 7 счетных дней) на длине волны 450 нм. В качестве заготовок используйте пять лунок питательной среды без клеток.
- Запишите значение оптической плотности каждой лунки, рассчитайте среднее значение и стандартное отклонение пяти скважин для каждого дня учета и постройте кривую роста ячеек 5,12.
7. Многолинейная дифференциация
- Выполните индукцию остеогенной дифференцировки, выполнив следующие действия.
- Расщепляют Р3-клетки с помощью трипсина, следуя шагам 4.1-4.5. Засейте клетки в соотношении 2 х 10по 5 клеток/см2 в 6-луночный планшет. Добавьте 2,5 мл питательной среды α-MEM на лунку.
- Когда клетки достигнут 60%-70% конфлюенции, смените питательную среду на остеогенную индукционную среду (шаг 1.5). Затем меняйте индукционную среду каждые 3 дня.
- Проверяйте клетки под микроскопом каждые 3 дня после индукции. Наблюдайте за морфологией клеток и ищите очевидные узлы минерализации.
- Через 7 дней после индукции проведите окрашивание щелочной фосфатазой (ЩФ) для оценки кальцификации клеток.
- Используйте 1x PBS, чтобы дважды аккуратно промыть клетки. Добавьте 4% параформальдегид для фиксации клеток при комнатной температуре на 30 минут. Затем используйте 1x PBS для промывки клеток дважды.
- Добавьте раствор для окрашивания ALP (см. Таблицу материалов) и выдерживайте при комнатной температуре в течение 10 минут.
ПРИМЕЧАНИЕ: Различные виды раствора для окрашивания ЩФ могут окрашивать клетки в разные цвета, такие как темно-серый, красный и синий. В этом протоколе клетки окрашивались в синий цвет. Время инкубации может быть увеличено, если окрашивающий цвет не очевиден. Некоторые наборы для окрашивания раствором ALP могут быть ядовитыми; Внимательно прочитайте инструкцию перед использованием, наденьте перчатки и маску во время эксперимента, а после использования тщательно вымойте руки. - Промойте клетки водой, чтобы остановить реакцию окрашивания ЩФ. Понаблюдайте за синими пигментированными гранулами в клетках под световым микроскопом и сделайте фотографии. Используйте программное обеспечение Image J для количественного анализа степени окрашивания.
- Проведите окрашивание ализарином в красный цвет (см. Таблицу материалов) для оценки минерализационной способности клеток.
Примечание: Очевидное образование минерализационных узлов дифференцированных клеток обычно можно увидеть через 21 день после индукции. - Используйте 1x PBS, чтобы дважды аккуратно промыть клетки. Затем добавьте 4% параформальдегид, чтобы зафиксировать клетки при комнатной температуре на 30 минут.
- Промойте клетки 1x PBS дважды, добавьте 0,1% раствор ализарина для красного окрашивания (см. Таблицу материалов) и выдержите 20 минут. Снова промойте клетки 1x PBS дважды.
- Наблюдайте за красными узелками среди неподвижных клеток под световым микроскопом, указывающими на отложения кальция остеогенной дифференцировки культивируемых клеток, и делайте фотографии.
- Чтобы количественно определить количество ализарина красного, добавьте 10% цетилпиридиния хлорида (CPC, см. Таблицу материалов) в клетки, окрашенные ализарином красным цветом, и инкубируйте при комнатной температуре в течение 30 минут.
- Отсадите 50 мкл раствора CPC и измерьте оптическую плотность (OD) на длине волны 540 нм с помощью микропланшетного спектрофотометра.
- Проводят индукцию адипогенной дифференцировки.
- Засейте клетки Р3 в 6-луночный планшет, используя описанную выше процедуру (шаг 7.1).
- Когда слияние клеток составляет 80%-90%, измените питательную среду на среду для адипогенной дифференцировки А (шаг 1.6).
- Инкубировать клетки со средой для адипогенной дифференцировки А при 37 °С во влажной атмосфере с содержанием 5%СО2 в течение 3 дней.
- Замените индукционную среду на среду для адипогенной дифференцировки В (шаг 1.7) и инкубируйте в течение 1 суток.
- Замените среду обратно на среду для адипогенной дифференцировки А и инкубируйте в течение 3 дней. Затем замените на среду В на 1 день. Повторите этот цикл 3-5 раз, пока под микроскопом не будут видны липидные капли.
ПРИМЕЧАНИЕ: Липидные капли можно увидеть примерно через 21 день после индукции. - Используйте среду для адипогенной дифференцировки В для культивирования клеток в течение дополнительных 7 дней; Затем под микроскопом можно увидеть крупные и круглые липидные капли. Обновляйте среду B каждые 3 дня.
- Удалите индукционную среду и используйте 1x PBS для аккуратной промывки ячеек. Затем добавьте 4% параформальдегида, чтобы зафиксировать клетки при комнатной температуре на 10 минут.
- Промойте клетки 1x PBS дважды; затем инкубируйте клетки с масляным красным раствором для окрашивания O (1 мл на лунку, см. Таблицу материалов) в течение 15 минут. Снова промойте клетки 1x PBS дважды.
- Поместите клетки под микроскоп и понаблюдайте за красными липидными каплями, чтобы оценить адипогенез дифференцированных клеток.
- Провести индукцию хондрогенной дифференцировки.
- Переварите и перенесите клетки P3 в центрифужную пробирку объемом 15 мл с номерами ячеек 5 x 105.
- Центрифугируйте пробирку при давлении 250 х г в течение 4 минут при комнатной температуре. Выбросьте надосадочную жидкость, осторожно сцедив верхний раствор.
- Добавьте 0,5 мл хондрогенной дифференцировочной среды (шаг 1,8) в пробирку для ресуспендирования клеток и снова центрифугируйте пробирку при 150 x g в течение 5 минут при комнатной температуре. Повторите этот шаг дважды.
- Ослабьте крышку центрифужной трубки для облегчения воздухообмена. Поместите пробирку в инкубатор и индуцируйте клетки 0,5 мл хондрогенной дифференцировочной среды при 37 °C во влажной атмосфере с содержанием 5%CO2.
- Держите центрифужную трубку в стабильном положении, не снимая и не встряхивая ее, в течение 24 или 48 часов, пока ячейки не начнут гранулировать. Сдвиньте дно центрифужной трубки, чтобы суспензировать клеточную гранулу в среде для дифференцировки (шаг 1.5).
- Обновляйте среду хондрогенной дифференцировки пипеткой каждые 3 дня. Избегайте отсасывания клеточной гранулы.
- Индуцируйте клетки не менее чем в течение 21 дня, пока гранула не достигнет диаметра 2 мм.
- Промойте гранулу 1x PBS и зафиксируйте 4% параформальдегидом на 30 минут. После обезвоживания и заделки парафина13 разрежьте гранулу толщиной 3 мкм с помощью микротома (см. Таблицу материалов).
- Выложите срезы на стеклянные горки. Закрасьте предметные стекла раствором алкийского синего (см. Таблицу материалов) в течение 1 часа при температуре 37 °C. Испачканные горки промойте водой. Поместите предметные стекла под световой микроскоп и сделайте фотографии окрашенного в синий цвет кислотного мукополисахарида с указанием хрящевых тканей.
Результаты
У пациента был успешно взят образец кости нижней челюсти. А время от разрезания ультразвуковым остеотомным лезвием до помещения костного фрагмента в центрифужную пробирку составляет около 5 минут. Во время и после процедуры резекции не произошло ни одного из возможных осложнений, включая повреждение нижнего альвеолярного нерва или корня зуба, инфекцию, разрыв и кровотечение из сосуда, травму слизистой оболочки, случайный перелом кости и т. д. ГмБМСК были успешно культивированы, пропущены и дифференцированы без контаминации.
В настоящем исследовании многие адгезивные клетки были видны под микроскопом на третий день после первоначального культивирования. На седьмой день большая часть адгезивных клеток уже была прикреплена к чашке для культивирования. В норме культивируемые клетки достигали 70%-80% слияния через 7-9 дней после первоначального культивирования. После пассажа клетки Р3 обычно считались очищенными МСК, которые демонстрировали веретенообразную, пластичную и фибробластоподобную морфологию (рис. 2). Эксперименты по идентификации проводились в клетках от Р3 до Р5. Анализ пролиферации клеток показал, что скорость роста клеток быстро увеличивалась с третьего дня культивирования, а повышенная скорость замедлялась на 6-й день (рис. 2).
Согласно определению, данному Международным обществом клеточной терапии, МСК имеют положительную и отрицательную экспрессию определенных поверхностных молекул. В данном исследовании проточный цитометрический анализ культуральных клеток показал положительную экспрессию CD44, CD90 и отрицательную экспрессию CD45, CD34, что согласуется с определением 4,11 (рис. 3). В экспериментах Multilineage по дифференцировке культивируемые клетки продемонстрировали сильную остеогенную, адипогенную и хондрогенную способность к дифференцировке. Через 7 дней остеогенной индукции отложение кальция во внеклеточном матриксе появлялось под микроскопом. После 21 дня остеогенной индукции в культивируемых клетках наблюдались явные узлы минерализации, и узлы были окрашены в красный цвет с окрашиванием в красный цвет ализарином (рис. 4). При адипогенезе после 21 дня адипогенной индукции в цитоплазме наблюдалось большое количество накопленных круглых липидных капель, окрашенных в красный цвет в результате окрашивания Oil-red-O. После 21 дня индукции хондрогенной дифференцировки слайды клеточных гранул, показывающие хрящевидную ткань с хрящевой лакуной, могут быть окрашены в синий цвет (рис. 4).

Рисунок 1: Выбор донорского участка на 3D КТ-изображении. (A) 3D КТ-изображение донорской нижней челюсти 21-летней пациентки. (B) Хирургическое моделирование двусторонней сагиттальной остеотомии ветви нижней челюсти. (C) Хирургическое планирование показывает отступление расколотой нижней челюсти. (D) 3D-КТ-изображение, показывающее кортикальную кость (полупрозрачную часть), губчатую кость, богатую костным мозгом, и нижний альвеолярный нерв (красный) на основе различных значений КТ, что может помочь хирургам выбрать донорский участок и избежать повреждения нерва. В этом регионе черным прямоугольником были собраны канцелярские костяные щепы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
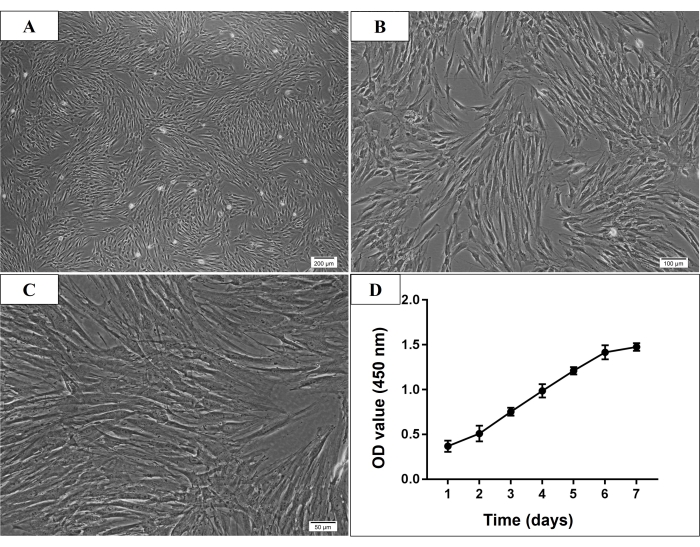
Рисунок 2: Микроскопическая морфология и кривая роста стволовых клеток костного мозга человека, полученных из P3 нижней челюсти человека (hmBMSCs). (A-C) Веретенообразная, пластичная и фибробластоподобная морфология P3 hmBMSC (масштабная линейка = 200 мкм, 100 мкм, 50 мкм для A, B, C соответственно). (D) Кривая роста клеток показала, что скорость роста hmBMSC быстро увеличивалась с третьего дня культивирования, а скорость увеличения замедлялась на шестой день культивирования. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Экспрессия антигена клеточной поверхности на hmBMSC была обнаружена с помощью проточной цитометрии. Анализ проточной цитометрии показал, что hmBMSC были отрицательными на CD45 (A) и CD44 (C), положительными на CD44 (B) и CD90 (D). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
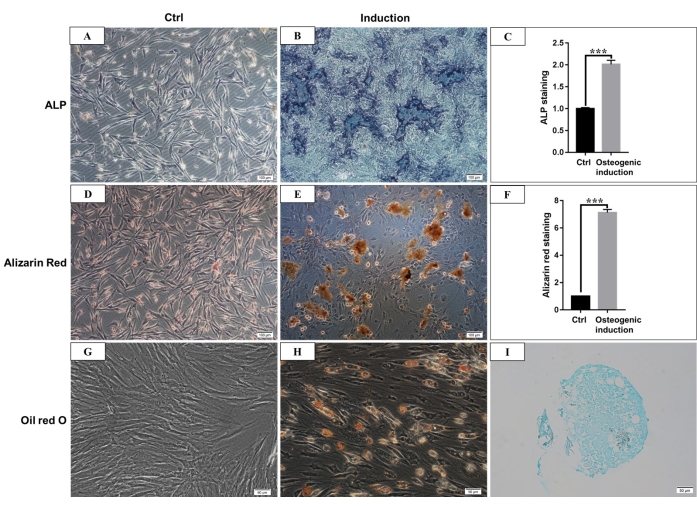
Рисунок 4: Остеогенная, адипогенная и хондрогенная дифференцировка hmBMSCs. (A) Окрашивание ЩФ hmBMSC после 7 дней культивирования без индукции остеогенной дифференцировки (масштабная линейка = 100 мкм). (В) Окрашивание ЩФ hmBMSC после 7 дней индукции остеогенной дифференцировки (масштабная линейка = 100 мкм). (C) Количественные результаты окрашивания ЩФ в положительную область (***P < 0,001). (D) Ализариновое окрашивание hmBMSC в красный цвет без остеогенной дифференцировки (масштабная линейка = 100 мкм). (E) Образование явных узлов минерализации можно увидеть через 21 день остеогенной дифференциации hmBMSC, и они могут быть окрашены в красный цвет с окрашиванием в красный цвет ализарином (масштабная линейка = 100 мкм). (F) Количественные результаты окрашивания ализарином в красный цвет (***P < 0,001). (G) Масляное красное О-окрашивание hmBMSC без адипогенной дифференциации (масштабная линейка = 50 мкм); (H) Круглые липидные капли были видны после 21 дня адипогенной дифференцировки hmBMSC, и липидные капли были окрашены в красный цвет с масляно-красным окрашиванием O (масштабная линейка = 50 мкм). (I) Окрашивание альцианским синим было положительным после 21 дня индукции хондрогенной дифференцировки (масштабная линейка = 50 мкм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
В последнее время терапия hMSCs показала большие перспективы в регенерации тканей и лечении многих рефрактерных заболеваний, таких как заболевания иммунной дисфункции, системные гематологические заболевания, рак или травмы, в многочисленных клинических испытаниях 1,14,15,16,17. Среди различных источников МСК костный мозг остается наиболее широко используемым и легкодоступным источником. Мы использовали чипы губчатой кости человека для успешного культивирования BMSC с использованием метода адгезии всего костного мозга, описанного в настоящем протоколе. На сегодняшний день существует четыре основных подхода к выделению стволовых клеток из костного мозга, включая метод адгезии всего костного мозга, метод центрифугирования с градиентом плотности, метод сортировки флуоресцентных клеток и метод сортировки магнитных клеток10. Метод склеивания всего костного мозга прост, удобен в эксплуатации, дешев и позволяет получить большое количество адгезивных клеток. Однако ограничением этого метода была низкая чистота первичных культивируемых БМСК, которые смешивались с гемопоэтическими клетками и фибробластами. После регулярного обновления питательной среды первичных клеток неадгезивные клетки отбраковывали вместе с отбракованной средой. Кроме того, фибробласты могут очищаться через клеточный проход, а клетки Р3 являются высокоочищенными BMSC. Таким образом, клетки от P0 до P2 не могут быть использованы для клеточной терапии, а это означает, что для очистки стволовых клеток потребовалось дополнительное время. Используя флуоресцентную сортировку клеток и магнитно-активируемую сортировку клеток, можно получить более очищенные BMSC, в то время как эти два метода дороги, а длительное время отбора может ухудшитьжизнеспособность клеток. Чтобы доказать, что культивируемые клетки являются МСК, мы обратились к определению человеческих МСК, предложенному Комитетом по мезенхимальным и тканевым стволовым клеткам Международного общества клеточной терапии, которое включало пластический адгезивный характер, положительную и отрицательную экспрессию определенных фенотипов, таких как CD45, CD90 и т.д., а также способность к многолинейной дифференцировке18.
В большинстве исследований бедренные кости и подвздошный гребень были основными источниками BMSC, по сравнению с челюстно-лицевыми костями, такими как нижняя челюсть и верхняя челюсть 9,16. Тем не менее, сайт-специфичная характеристическая теория hBMSC в недавних исследованиях показала, что hBMSC из разных костей имеют разные признаки в способности к дифференцировке, пролиферативной активности, остеогенезе и иммунитете 6,8. Сайт-специфичные различия могут быть связаны с различным эмбриологическим происхождением, адаптацией к функциональным потребностям на каждом участке скелета, микроокружением, местным кровоснабжением, гормональными эффектами и т. д. Кроме того, исследования показали, что пересаженная подвздошная кость демонстрировала более быструю вертикальную потерю, чем челюстная кость, в течение 6 месяцев после костного трансплантата8. В остальном исследования показали, что пролиферативная активность МСК из нижнечелюстного мозга была выше, чем из подвздошного мозга 5,8,19,20. И эта разница в пролиферативной активности была связана с тем, что нижняя челюсть имела большее кровоснабжение и более быструю скорость обновления костной ткани, чем подвздошная кость 5,6,8. Исследования также показали, что BMSC из нижней челюсти экспрессировали более высокий уровень Runx-2 и OCN, чем из бедренных костей, а остеогенная способность BMSC из нижней челюсти была равной или выше, чем у бедренных костей и подвздошной кости 5,19,21. Приверженность титановых способностей hmBMSC также была обнаружена сильнее, чем у BMSC из бедренных костей, что позволяет предположить, что hmBMSC более подходят для использования в оральнойимплантологии. Кроме того, 3-летнее клиническое исследование по реконструкции альвеолярного дефекта показало, что регенерированная кость МСК из пульпы зуба состояла из полностью компактной кости с более высокой плотностью матрицы, в то время как МСК регенерировали губчатую кость, аналогичную нормальной структуре альвеолярной костичеловека 22. В заключение можно сказать, что hmBMSC являются идеальными терапевтическими стволовыми клетками для регенерации челюстно-лицевой области и других заболеваний благодаря тому же эмбриологическому происхождению и их превосходным характеристикам.
Тем не менее, нижняя челюсть имеет меньше костного мозга, чем бедренная и подвздошная кости, поэтому важно получить достаточное количество костного мозга и BMSC из нижней челюсти для клинического использования. Подвздошные аспираты человека могут получать большое количество костного мозга для выделения МСК. Исследователи также использовали аспираты нижней челюсти для получения МСК, в то время как первоначальный выход МСК из аспиратов нижней челюсти был в три раза ниже, чем у подвздошных аспиратов21. Потребовались дополнительные разрезы, чтобы собрать достаточное количество аспиратов нижнечелюстного мозга, что добавило дополнительную хирургическую травму. Кроме того, исследования показали, что пролиферативный потенциал МСК из чипов костей нижней челюсти может быть выше, чем из аспиратов нижнечелюстного мозга 8,21. Поэтому в данном исследовании для выделения МСК были использованы отброшенные стружки губчатой кости нижней челюсти. Поскольку обе стороны нижней челюсти были включены в сагиттальную остеотомию расщепленной ветви или пластику по уменьшению угла нижней челюсти, мы можем получить достаточное количество нижнечелюстного мозга от пациентов без какого-либо дополнительного вреда. В последнее время компьютерные технологии широко используются в челюстно-лицевой хирургии для улучшения хирургического эффекта и снижения хирургических осложнений23. Чтобы избежать травмирования нижней челюсти и нерва во время забора костного мозга нижней челюсти, было получено 3D-компьютерное изображение нижней челюсти донора, а также проанализировано хирургическое планирование доноров для определения донорских участков и реализации хирургического моделирования в исследовании; Таким образом, ни одно из хирургических осложнений не произошло. Ультразвуковое остеотомное лезвие, тканеспецифическое устройство, позволяющее хирургам проводить точную остеотомию, защищая прилегающие мягкие ткани24, также использовалось для предотвращения травмирования мягких тканей и сохранения полученной активности костного мозга.
Таким образом, в этом исследовании описан надежный, простой, безопасный и дешевый протокол выделения и культивирования адекватных МСК нижней челюсти человека, которые могут быть использованы в клеточной терапии тканей зубов и челюстно-лицевой области.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Исследование выполнено при поддержке Национального фонда естественных наук Китая (No.81903249) и Программы фундаментальных исследований естественных наук провинции Шэньси (No.2019JQ-701, No.2022JZ-50).
Материалы
| Name | Company | Catalog Number | Comments |
| 4% Paraformaldehyde | PlantChemMed | PC-00005 | |
| Adipogenic differentiation medium | OriCell, Cyagen Biosciences | HUXMX-90031 | |
| Alcian blue solution | OriCell, Cyagen Biosciences | ALCB-10001 | |
| Alcohol | Macklin | e809056 | |
| Alizarin red staining solution | Solarbio | G1452 | |
| ALP staining solution | Beijing ComWin Biotech Co.,Ltd. | CW0051S | |
| Autoclave | ALP Co., Ltd., Japan | CL-40L | |
| CCK-8 solution | Yeasen Biotech Co., Ltd. | 40203ES80 | |
| Cell filter (70 μm pore size) | BD Biosciences | 352350 | |
| Cell incubator | Thermo Fisher Scientific | 41334177 | |
| Centrifuge | Eppendorf | 5805ZP761456 | |
| Centrifuge tube (50 mL, 15 mL) | Sangon Biotech | F600888-9001 | |
| Cetylpyridinium chloride | Aladdin | H108696 | |
| Chondrogenesis differentiation medium | OriCell, Cyagen Biosciences | HUXMX-90041 | |
| Clean bench/Laminar flow cabinet | BIOBASE | BBS-DDS00030 | |
| Culture dish (6 cm) | Thermo | 150462 | |
| Culture flasks (25 cm) | Thermo | 156367 | |
| Culture plates (96-well, 6-well) | Corning-Costar | 352350 | |
| Disposable sterile gloves and masks | Sangon Biotech | F516018-9001;F516038-9001 | |
| Disposable sterile syringe (1 mL) | Shaanxi longkangxin Medical Instrument Co., Ltd | 1.00009E+11 | |
| Dulbecco's modified Eagle's medium with high glucose (HG-DMEM) | Hyclone | SH30022.01B | |
| EDTA | Solarbio | E8040-500g | |
| Fetal bovine serum (FBS) | PlantChemMed | PC-00001 | |
| Flow cytometer | Beckman Coulter | EPICS XL | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD34 | Biolegend | 343503 | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD44 | Biolegend | 338804 | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD90 | Biolegend | 328108 | |
| Hemocytometer | Koraba | 30119480698 | |
| Icebox | Sangon Biotech | F615002-0001 | |
| Image J software | National Institute of Mental Health | ||
| Light microscope | OLYMPUS | IX71-2L20944 | |
| Microcentrifuge tubes | Sangon Biotech | F601620-0010 | |
| Microplate spectrophotometer | BioTek-EPOCH | 259091 | |
| Microtome | Feica | 1003001 | |
| Mimics software | Materialise | ||
| Minimum essential medium alpha (α-MEM) | Hyclone | SH30265.01 | |
| Oil red O staining solution | Solarbio | G1261 | |
| Osteogenic differentiation medium | OriCell, Cyagen Biosciences | HUXMA-90021 | |
| Penicillin and streptomycin | PlantChemMed | PC-86115 | |
| Phosphate buffer saline (PBS) | PlantChemMed | PC-00003 | |
| Phycoerythrin (PE)-conjugated mouse monoclonal anti-human antibody against CD45 | Biolegend | 304008 | |
| Pipette | SORFA | 320511 | |
| ProPlan CMF 3.0 | Materialise | ||
| Scissors, tweezers and knives | Shanghai Jinzhong Surgical instrument Co., Ltd | ZJA030,YAA110,J11010 | |
| Sterile wet gauze | HENAN PIAOAN GROUP Co., Ltd | ||
| Trypsin | Gibco | 17075029 | |
| Ultrasonic osteotome blade | Stryker Instruments | 5450-815-107 |
Ссылки
- Ullah, I., Subbarao, R. B., Rho, G. J. Human mesenchymal stem cells - current trends and future prospective. Bioscience Reports. 35 (2), 1-8 (2015).
- Brown, C., et al. Mesenchymal stem cells: Cell therapy and regeneration potential. Journal of Tissue Engineering and Regenerative Medicine. 13 (9), 1738-1755 (2019).
- Trohatou, O., Maria, G. R. Mesenchymal stem/stromal cells in regenerative medicine: Past, present, and future. Cellular Reprogramming. 19 (4), 217-224 (2017).
- Heo, J. S., Choi, Y., Kim, H. S., Kim, H. O. Comparison of molecular profiles of human mesenchymal stem cells derived from bone marrow, umbilical cord blood, placenta and adipose tissue. International Journal of Molecular Medicine. 37 (1), 115-125 (2016).
- Li, C. J., Wang, F. F., Zhang, R., Qiao, P. Y., Liu, H. C. Comparison of proliferation and osteogenic differentiation potential of rat mandibular and femoral bone marrow mesenchymal stem cells in vitro. Stem Cells and Development. 29 (11), 728-736 (2020).
- Lloyd, B., et al. Similarities and differences between porcine mandibular and limb bone marrow mesenchymal stem cells. Archives of Oral Biology. 77 (5), 1-11 (2017).
- Yamaza, T., et al. Mouse mandible contains distinctive mesenchymal stem cells. Journal of Dental Research. 90 (3), 317-324 (2011).
- Akintoye, S. O., et al. Skeletal site-specific characterization of orofacial and iliac crest human bone marrow stromal cells in same individuals. Bone. 38 (6), 758-768 (2006).
- Mendi, A., Ulutürk, H., Ataç, M. S., Stem Yılmaz, D. cells for the oromaxillofacial area: Could they be a promising source for regeneration in dentistry. Advances in Experimental Medicine and Biology. 11 (44), 101-121 (2019).
- Hong, Y. Y., et al. Isolation and cultivation of mandibular bone marrow mesenchymal stem cells in rats. Journal of Visualized Experiments. (162), e61532 (2020).
- Chu, D. T., et al. An update on the progress of isolation, culture, storage, and clinical application of human bone marrow mesenchymal stem/stromal cells. International Journal of Molecular Sciences. 21 (3), 708 (2020).
- Yu, Y. J., et al. Activation of mesenchymal stem cells promotes new bone formation within dentigerous cyst. Stem Cell Research & Therapy. 11 (1), 476 (2020).
- Sadeghipour, A., Babaheidarian, P. Making formalin-fixed, paraffin embedded blocks. Methods in Molecular Biology. 1897, 253-268 (2019).
- Mathiasen, A. B., et al. marrow-derived mesenchymal stromal cell treatment in patients with ischaemic heart failure: final 4-year follow-up of the MSC-HF trial. European Journal of Heart Failure. 22 (5), 884-892 (2020).
- Maqsood, M., et al. Adult mesenchymal stem cells and their exosomes: Sources, characteristics, and application in regenerative medicine. Life Sciences. 01 (256), 118002 (2020).
- Reinders, M. J., et al. Autologous bone marrow-derived mesenchymal stromal cell therapy with early tacrolimus withdrawal: The randomized prospective, single-center, open-label TRITON study. American Journal of Transplantation: Official Journal of the American Society of Transplantation and the American Society of Transplant Surgeons. 21 (9), 3055-3065 (2021).
- Shi, H. Y., et al. marrow-derived mesenchymal stem cells promote Helicobacter pylori-associated gastric cancer progression by secreting thrombospondin-2. Cell Proliferation. 54 (10), 13114 (2021).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
- Aghaloo, T. L., et al. Osteogenic potential of mandibular vs. long-bone marrow stromal cells. Journal of Dental Research. 89 (11), 1293-1298 (2010).
- Dong, W. J., et al. Phenotypic characterization of craniofacial bone marrow stromal cells: unique properties of enhanced osteogenesis, cell recruitment, autophagy, and apoptosis resistance. Cell and Tissue Research. 358 (1), 165-175 (2014).
- Lee, B. K., Choi, S. J., Mack, D., Oh, S. H. Isolation of mesenchymal stem cells from the mandibular marrow aspirates. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontics. 112 (6), 86-93 (2011).
- Giuliani, A., et al. Three years after transplants in human mandibles, histological and in-line holotomography revealed that stem cells regenerated a compact rather than a spongy bone: biological and clinical implications. Stem Cells Translational Medicine. 2 (4), 316-324 (2013).
- Chen, Y. W., et al. Computer-assisted surgery in medical and dental applications. Expert Review of Medical Devices. 18 (7), 669-696 (2021).
- Gilles, R., Couvreur, T., Dammous, S. Ultrasonic orthognathic surgery: enhancements to established osteotomies. International Journal of Oral and Maxillofacial Surgery. 42 (8), 981-987 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены