Method Article
Isolamento e Cultura de Células-Tronco Mesenquimais da Medula Óssea da Mandíbula Humana
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O presente protocolo descreve um procedimento eficiente para isolar e cultivar células-tronco mesenquimais derivadas da medula óssea mandibular humana usando o método de adesão da medula óssea total. As células cultivadas foram identificadas por ensaios de proliferação celular, citometria de fluxo e indução de diferenciação de múltiplas linhagens.
Resumo
As células-tronco mesenquimais humanas (hMSCs) têm mostrado grande potencial na regeneração óssea, modulação imunológica e tratamento de doenças crônicas refratárias. Várias origens foram encontradas para obter hMSCs recentemente, enquanto a medula óssea ainda era considerada a principal fonte. As CTMs derivadas da medula óssea (BMSCs) de diferentes locais ósseos de doadores têm características distintas devido a fatores microambientais. Estudos têm demonstrado que as BMSCs do osso maxilofacial podem ter maiores capacidades proliferativas e osteogênicas do que as BMSCs de ossos longos ou da crista ilíaca. E as BMSCs maxilofaciais foram consideradas mais adequadas para terapia com células-tronco nos tecidos maxilofaciais. A mandíbula, especialmente a área ramal ascendente com medula suficiente, foi um local doador viável para a colheita de BMSCs. Este estudo descreveu um protocolo para coleta, isolamento e cultura de MSCs derivadas da medula óssea mandibular humana (hmBMSCs). Além disso, imunofenotipagem de hmBMSCs, ensaios de proliferação e indução in vitro de diferenciação osteogênica, adipogênica e condrogênica foram realizados para identificar as células cultivadas. A aplicação deste protocolo pode ajudar os pesquisadores a obter com sucesso hmBMSCs de alta qualidade suficientes, o que é necessário para estudos adicionais da função biológica, efeitos microambientais e aplicações clínicas.
Introdução
As células-tronco mesenquimais humanas (hMSCs) são células multipotentes que podem ser diferenciadas em vários tipos celulares, como osteócitos, adipócitos e condrócitos da linhagem mesodérmica, hepatócitos e pancreócitos da linhagem endodérmica e neurócitos da linhagem ectodérmica1. Assim, as hMSCs têm mostrado grande potencial na regeneração tecidual. Além disso, as hMSCs são imunomoduladores poderosos que podem regular o microambiente nos tecidos do hospedeiro e tratar efetivamente doenças refratárias crônicas2. Portanto, as hMSCs têm sido amplamente utilizadas na terapia celular de estudos clínicos. Consequentemente, é importante obter hMSCs suficientes com alta qualidade de maneira conveniente com sucesso.
Desde que as hMSCs foram relatadas pela primeira vez na medula óssea, muitas fontes alternativas de MSCs foram encontradas, como tecido adiposo, líquido sinóvio, músculo esquelético, líquido amniótico, endométrio, tecidos dentários e cordão umbilical 1,3. No entanto, a medula óssea continua sendo a principal fonte de hMSCs para a maioria dos estudos pré-clínicos e clínicos, e as MSCs derivadas da medula óssea (BMSCs) são tomadas como padrão para comparar MSCs de outras fontes4. Durante anos, a crista ilíaca ou ossos longos (tíbia e fêmur) foram os locais anatômicos mais populares para a obtenção da medula óssea 1,5. No entanto, a crista ilíaca ou ossos longos têm origens embrionárias e padrões de desenvolvimento diferentes em comparação com os ossos maxilofaciais 5,6. Muitos estudos clínicos, laboratoriais e de desenvolvimento provaram que as BMSCs de diferentes origens apresentaram propriedades específicas do local, e as BMSCs enxertadas retêm as propriedades da área doadora após a implantação no local receptor 5,6,7,8,9. Do ponto de vista da origem do desenvolvimento, os tecidos maxilofaciais, como maxila, mandíbula, dentina, osso alveolar, polpa e ligamento periodontal, surgem exclusivamente das células da crista neural. Em contraste, a crista ilíaca e os ossos longos são formados pelo mesoderma. Além disso, as mandíbulas são criadas por ossificação intramembranosa, enquanto os esqueletos axiais e apendiculares sofrem ossificação endocondral. Além disso, em comparação com a crista ilíaca e ossos longos, alguns estudos clínicos mostraram que as hMSCs derivadas da medula óssea maxilofacial apresentaram melhor atividade proliferativa celular e capacidade de diferenciação 6,8. Portanto, espera-se que as BMSCs das áreas maxilofaciais sejam a melhor escolha para a regeneração do tecido maxilofacial e terapia de doenças refratárias crônicas maxilofaciais.
A mandíbula é composta de ossos corticais de duas camadas de espessura com medula óssea esponjosa entre eles, para que possa carregar o poder da mastigação. Portanto, a mandíbula, especialmente a área ramal ascendente, é geralmente utilizada como área doadora para obtenção de enxertos ósseos autólogos em cirurgias craniomaxilofaciais10. E em cirurgias como osteotomia do ramo sagital mandibular e plastia de redução do ângulo mandibular, partes da cortical mandibular e do osso esponjoso devem ser removidas para obter um contorno facial agradável. Esses ossos esponjosos descartados podem ser um recurso potencial para hMSCs. No entanto, poucos estudos publicados descreveram o protocolo para isolar rapidamente e cultivar MSCs derivadas da medula óssea mandibular humana de alta qualidade (hmBMSCs).
O presente estudo utiliza um método modificado de adesão da medula óssea total para introduzir um protocolo confiável e reprodutível para o isolamento e cultura de hmBMSCs. E as células-tronco foram identificadas por imunofenotipagem por citometria de fluxo de MSCs, ensaios de proliferação e indução de diferenciação de múltiplas linhagens. A aplicação deste procedimento padrão pode ajudar os pesquisadores a obter MSCs derivadas da medula óssea mandibular humana de alta qualidade, o que é importante em estudos futuros da função biológica, efeitos microambientais e aplicações clínicas.
Protocolo
O procedimento para a coleta de espécimes ósseos mandibulares humanos foi aprovado pelo Comitê de Ética da Escola de Estomatologia da Quarta Universidade Médica Militar. O estudo seguiu as diretrizes éticas da Declaração de Helsinque de 1975. Todos os doadores do presente estudo foram informados sobre os possíveis riscos e os objetivos do estudo. A idade dos doadores variou entre 18 e 40 anos, e não houve preconceito de gênero. O consentimento por escrito foi obtido de todos os participantes humanos.
1. Preparação da cirurgia
- Selecione o doador apropriado.
- Selecione os pacientes como doadores que planejam se submeter a cirurgias como recuo mandibular após osteotomia de ramo sagital e plastia redutora do ângulo mandibular.
- Prepare a solução de preservação.
- Suplementar 30 mL de solução salina tampão fosfato (1x PBS) com penicilina e estreptomicina a 1% em um tubo de centrífuga estéril e sem enzimas de 50 mL no dia anterior à cirurgia. Guarde-o no frigorífico a 4 °C.
- No dia da cirurgia, coloque o tubo centrífugo com solução de preservação em uma geladeira e mantenha-o na sala de cirurgia 1 h antes da cirurgia.
- Esterilize os instrumentos para isolar a medula óssea no dia anterior à cirurgia, incluindo tesouras, pinças e facas a 120 °C e pressão de 0,27 MPa por 20 min.
- Prepare o meio de cultura α-MEM misturando o meio essencial mínimo alfa (α-MEM) com 10% de soro fetal bovino (FBS) e 1% de penicilina e estreptomicina.
- Prepare um meio de diferenciação osteogênica misturando meio de cultura α-MEM com ácido ascórbico 50 mM, fosfato de β-glicerol 10 mM e dexametasona 0,1 mM (ver Tabela de Materiais).
- Prepare o meio de diferenciação adipogênica A misturando meio de cultura α-MEM com 1 mM de dexametasona, 0,2 mM de indometacina, 10 μg/mL de insulina e 0,5 mM de 3-isobutil-1-metilxantina (IBMX) (ver Tabela de Materiais).
- Prepare o meio de diferenciação adipogénica B misturando α-MEM com 10 μg/ml de insulina.
- Prepare o meio de diferenciação condrogênica misturando o meio de Eagle modificado de Dulbecco com glicose alta (HG-DMEM) e 100 nM de dexametasona, 100 g / mL de piruvato de sódio, 25 mg / mL de vitamina C, 40 mg / mL de prolina, 10 ng / mL de TGF-β3 e 1% de ITS (ver Tabela de Materiais).
NOTA: O meio de diferenciação osteogênico, adipogênico e condrogênico pode ser preparado internamente, conforme mencionado acima. No entanto, kits disponíveis comercialmente para o mesmo foram usados (ver Tabela de Materiais) no presente estudo.
2. Colheita de espécime de osso mandibular humano
- Antes da cirurgia, estudar cuidadosamente as imagens tridimensionais da tomografia computadorizada e o planejamento da simulação cirúrgica dos doadores (Figura 1).
- Selecione o local mandibular que o doador planeja remover na cirurgia e é rico em osso esponjoso com medula óssea como local doador.
- Desinfete e cubra o paciente antes de operar.
- Ressece a área doadora selecionada da mandíbula usando a lâmina do osteótomo ultrassônico (ver Tabela de Materiais), evitando lesão do nervo alveolar inferior e comprometimento do osso doador.
- Coloque as amostras de osso mandibular na solução de preservação (etapa 1.2) o mais rápido possível.
- Colocar a solução de conservação com amostras de osso numa caixa frigorífica até que se inicie o isolamento das MSC no laboratório.
NOTA: O isolamento das MSCs precisa ser iniciado o mais rápido possível após a colheita para preservar a viabilidade das células. Se o isolamento das MSC não puder ser efectuado imediatamente, a solução de conservação com amostras ósseas pode ser armazenada numa caixa frigorífica ou refrigerada a 4 °C durante um máximo de 2 h.
3. Isolamento e cultivo de mBMSCs humanas
- Retire as amostras de osso da solução de preservação e mergulhe-as em 1x PBS com penicilina a 1% e estreptomicina por 5 min em uma bancada limpa do gabinete de fluxo laminar.
NOTA: Esta etapa visa lavar o coágulo sanguíneo e os fluidos orais residuais e eliminar ainda mais o microrganismo, pois a boca não é um ambiente completamente estéril. Antes do isolamento e cultivo celular, lave e desinfete as mãos com álcool e use luvas e máscaras estéreis descartáveis. - Limpe o tecido mole aderente e a mancha de sangue na superfície óssea usando gaze úmida estéril.
- Encha uma placa de cultura estéril de 6 cm com 5 ml de meio de cultura α-MEM.
- Coloque o osso na placa de cultura estéril e corte-o em pedaços pequenos (quase 2-3 mm3 volumes) com uma faca ou tesoura esterilizada.
NOTA: Segure as amostras de osso com uma pinça para evitar um corte no dedo. - Aspire o meio de cultura α-MEM na placa de cultura com uma seringa estéril descartável de 1 mL.
- Insira a agulha da seringa com meio de cultura α-MEM profundamente na cavidade da medula óssea dos pedaços de amostra de osso esponjoso.
- Lave a medula óssea na placa de cultura com a seringa de todos os lados dos pedaços da amostra óssea, pelo menos 5-10 vezes de cada lado.
- Repita as etapas 3.5-3.7 até que todos os pedaços de amostra óssea fiquem brancos puros para garantir que o máximo de medula óssea seja liberado no meio de cultura.
NOTA: O tempo total de operação das etapas acima de 3.1-3.8 precisa ser controlado dentro de 30 minutos no gelo. - Remova e descarte todos os pedaços de amostra de osso com uma pinça. Remover outros pequenos fragmentos utilizando um filtro de células com poros de 70 μm.
- Agite suavemente a placa de cultura para que as células lavadas sejam distribuídas uniformemente.
- Coloque a placa de cultura em uma incubadora de células e cultive as células a 37 ° C em uma atmosfera umidificada de 5% de CO2.
- No terceiro dia de cultura, verificar a morfologia celular e o estado de crescimento ao microscópio óptico. Remover metade do meio de cultura sem células aderentes e fragmento de tecido; adicione 3 ml de meio de cultura α-MEM fresco.
- No dia 7 da cultura, remova todo o meio de cultura e adicione 5 ml de meio de cultura α-MEM fresco.
- Em seguida, atualize o meio de cultura α-MEM a cada 3 dias.
- Verifique a morfologia e o crescimento celular todos os dias.
NOTA: Quando as culturas de células primárias (P0) atingirem 70%-80% de confluência após 7-10 dias de cultura, realizar a passagem celular.
4. Passagem de células
- Na confluência de 70% a 80%, remova todo o meio de cultura das células P0. Lave a placa de cultura suavemente com 1x PBS duas vezes para limpar o meio de cultura residual.
- Adicione 1 mL de tripsina a 0,25% com EDTA a 0,02% à placa de cultura para digerir as células. Agite suavemente a placa de cultura para garantir que a tripsina seja distribuída uniformemente. Colocar a placa de cultura a 37 °C durante 3 min.
- Verifique as células ao microscópio. Quando 70% -80% das células se contraírem e arredondarem, adicione 2 mL de meio de cultura α-MEM para interromper a reação digestiva.
- Sopre suavemente a superfície do prato várias vezes com uma pipeta para soprar as células.
- Transfira a suspensão celular para um tubo de centrífuga de 15 mL. Centrifugue a suspensão da célula a 200 x g por 5 min em temperatura ambiente.
- Rejeitar o sobrenadante e ressuspender as células com meio de cultura α-MEM. Semear células P0 em frascos de cultura (25 cm) para expansão com uma proporção de divisão de 1:2. As primeiras células de passagem foram chamadas de células P1.
- Quando as células P1 atingirem 70% -80% de confluência, repita a passagem celular seguindo as etapas de 4,1 a 4,6. As células de segunda geração foram chamadas de células P2.
- Altere a taxa de divisão de expansão para 1:3 após a passagem da célula de terceira geração.
- Use células P3 a P5 para realizar experimentos de identificação.
5. Análise por citometria de fluxo
- Digerir as MSCs P3 a P5 usando 0,25% de tripsina com 0,02% de EDTA, seguindo as etapas 4.1-4.5.
- Descarte o sobrenadante e ressuspenda as células em 1x PBS a uma concentração de 1 x 106 células/mL.
- Transfira as células para tubos de microcentrífuga com 100 μL da suspensão celular por tubo.
- Adicione anticorpos anti-humanos monoclonais de camundongo imunomarcados nos tubos de microcentrífuga.
NOTA: Para o presente estudo, foram utilizados anticorpos conjugados com ficoeritrina (PE) contra CD45, anticorpos conjugados com fluoresceína-isotiocianato (FITC) contra CD90, CD34 e CD44 4,11 (ver Tabela de Materiais), e as diluições dos anticorpos foram todas de 1:100. As diluições de anticorpos precisam seguir as instruções do fabricante. O PBS será servido como controle. - Incube os anticorpos e o controle de PBS em temperatura ambiente no escuro por 30 min.
- Centrifugue os tubos a 800 x g por 5 min em temperatura ambiente. Descarte a suspensão e ressuspenda as células em 0,5 mL de 1x PBS. Repita esta etapa duas vezes.
- Carregue os tubos no citômetro de fluxo (consulte a Tabela de Materiais). Conte o número de células marcadas com fluorescência usando um citômetro de fluxo com um mínimo de 10.000 eventos.
NOTA: É melhor iniciar o processo de contagem de células do citômetro de fluxo imediatamente após o procedimento de marcação por imunofluorescência. Caso contrário, as células precisam ser fixadas em paraformaldeído a 1%, armazenadas a 4 ° C no escuro e terminar o processo em 24 horas.
6. Ensaio de proliferação celular
- Use células P3 para realizar o ensaio de proliferação celular. Digerir as MSCs P3 com tripsina a 0,25%, seguindo as etapas 4.1-4.5.
- Rejeitar o sobrenadante e ressuspender as células com meio de cultura α-MEM.
- Conte o número de células com um hemocitômetro e semeie as células em placas de cultura de 96 poços a uma densidade de 3 x 103 células por poço, um total de 35 poços, 5 poços para cada dia de contagem (no dia 1, 2, 3, 4, 5, 6, 7). Atualize o meio de cultura das células a cada 3 dias.
- Em cada dia de contagem, descarte o meio de cultura α-MEM de certos cinco poços para o dia de contagem determinado e, em seguida, adicione 100 μL de meio de cultura e 10 μL de solução CCK-8 (consulte a Tabela de Materiais). Incubar a 37 °C durante 1 h.
- Colocar as placas de cultura num espectrofotómetro de microplacas (ver Tabela de Materiais) e medir o valor da densidade óptica de cinco alvéolos por cada dia de contagem (um total de 7 dias de contagem) a um comprimento de onda de 450 nm. Use cinco poços do meio de cultura sem células como brancos.
- Registre o valor da densidade óptica de cada poço, calcule o valor médio e o desvio padrão de cinco poços para cada dia de contagem e trace a curva de crescimento celular 5,12.
7. Diferenciação de multilinhagem
- Realize a indução da diferenciação osteogênica seguindo as etapas abaixo.
- Digerir as células P3 com tripsina seguindo os passos 4.1-4.5. Semeie as células a 2 x 105 células/cm2 em uma placa de 6 poços. Adicione 2,5 mL de meio de cultura α-MEM por alvéolo.
- Quando as células atingirem 60%-70% de confluência, troque o meio de cultura pelo meio de indução osteogênica (etapa 1.5). Em seguida, troque o meio de indução a cada 3 dias.
- Verifique as células ao microscópio a cada 3 dias após a indução. Observe a morfologia celular e procure nós de mineralização óbvios.
- Após 7 dias da indução, realizar a coloração com fosfatase alcalina (ALP) para avaliar a calcificação das células.
- Use 1x PBS para lavar as células duas vezes suavemente. Adicione 4% de paraformaldeído para fixar as células à temperatura ambiente por 30 min. Em seguida, use 1x PBS para lavar as células duas vezes.
- Adicione a solução de coloração ALP (consulte a Tabela de Materiais) e incube em temperatura ambiente por 10 min.
NOTA: Diferentes tipos de solução de coloração ALP podem corar as células com cores diferentes, como cinza escuro, vermelho e azul. Nesse protocolo, as células foram coradas de azul. O tempo de incubação pode ser prolongado se a cor da coloração não for óbvia. Alguns kits de coloração de solução ALP podem ser venenosos; Leia atentamente as instruções antes de usar, use luvas e máscara durante o experimento e lave as mãos cuidadosamente após o uso. - Lave as células com água para interromper a reação de coloração ALP. Observe grânulos pigmentados azuis nas células sob um microscópio de luz e capture as fotos. Use o software Image J para analisar quantitativamente o grau de coloração.
- Realize a coloração com vermelho de alizarina (consulte a Tabela de Materiais) para avaliar a capacidade de mineralização das células.
NOTA: A formação óbvia de nódulos de mineralização das células diferenciadas geralmente pode ser observada após 21 dias de indução. - Use 1x PBS para lavar as células duas vezes suavemente. Em seguida, adicione 4% de paraformaldeído para fixar as células em temperatura ambiente por 30 min.
- Lave as células com 1x PBS duas vezes, adicione a solução de coloração vermelho de alizarina a 0,1% (ver Tabela de Materiais) e incube por 20 min. Novamente, lave as células com 1x PBS duas vezes.
- Observe os nódulos vermelhos entre as células fixas ao microscópio óptico, indicando depósitos de cálcio de diferenciação osteogênica das células cultivadas, e capture as fotos.
- Para quantificar a quantidade de vermelho de alizarina, adicione cloreto de cetilpiridínio a 10% (CPC, consulte a Tabela de Materiais) às células coradas com vermelho de alizarina e incube em temperatura ambiente por 30 min.
- Aspirar 50 μl da solução de CPC e medir a densidade óptica (DO) a um comprimento de onda de 540 nm usando um espectrofotômetro de microplacas.
- Realize a indução da diferenciação adipogênica.
- Semeie as células P3 em uma placa de 6 poços usando o procedimento descrito acima (etapa 7.1).
- Quando as células obtiverem 80% -90% de confluência, troque o meio de cultura por meio de diferenciação adipogênica A (etapa 1.6).
- Incubar as células com meio de diferenciação adipogénica A a 37 °C numa atmosfera humidificada de 5% de CO2 durante 3 dias.
- Mude o meio de indução para o meio de diferenciação adipogênica B (etapa 1.7) e incube por 1 dia.
- Mude o meio de volta para o meio de diferenciação adipogênica A e incube por 3 dias. Em seguida, substitua por meio B por 1 dia. Repita este ciclo 3-5 vezes até que as gotículas lipídicas possam ser vistas ao microscópio.
NOTA: As gotículas lipídicas podem ser vistas aproximadamente 21 dias após a indução. - Use o meio de diferenciação adipogênica B para cultivar as células por mais 7 dias; Em seguida, gotículas lipídicas grandes e redondas podem ser vistas ao microscópio. Atualize o meio B a cada 3 dias.
- Remova o meio de indução e use 1x PBS para lavar as células suavemente. Em seguida, adicione 4% de paraformaldeído para fixar as células em temperatura ambiente por 10 min.
- Lave as células com 1x PBS duas vezes; em seguida, incube as células com solução de coloração O vermelha de óleo (1 mL por poço, consulte a Tabela de Materiais) por 15 min. Novamente, lave as células com 1x PBS duas vezes.
- Coloque as células sob um microscópio e observe as gotículas lipídicas vermelhas para avaliar a adipogênese de células diferenciadas.
- Realize a indução de diferenciação condrogênica.
- Digerir e transferir as células P3 para um tubo de centrifugação de 15 ml com um número de células de 5 x 105.
- Centrifugue o tubo a 250 x g por 4 min em temperatura ambiente. Rejeitar o sobrenadante decantando cuidadosamente a solução de topo.
- Adicione 0,5 mL de meio de diferenciação condrogênica (etapa 1.8) no tubo para ressuspender as células e centrifugue o tubo novamente a 150 x g por 5 min à temperatura ambiente. Repita esta etapa duas vezes.
- Afrouxe a tampa do tubo da centrífuga para facilitar a troca de ar. Coloque o tubo na incubadora e induza as células com 0,5 mL de meio de diferenciação condrogênica a 37 ° C em uma atmosfera umidificada de 5% de CO2.
- Mantenha o tubo de centrífuga estável sem removê-lo ou agitá-lo dentro de 24 ou 48 h, até que as células comecem a peletizar. Agite o fundo do tubo da centrífuga para suspender o pellet de célula no meio de diferenciação (etapa 1.5).
- Renove o meio de diferenciação condrogénica com uma pipeta de 3 em 3 dias. Evite aspirar o pellet celular.
- Induzir as células pelo menos durante 21 dias até que o sedimento atinja um diâmetro de 2 mm.
- Lave o pellet com 1x PBS e fixe-o com paraformaldeído a 4% por 30 min. Após a desidratação e inclusão de parafina13, corte o pellet com uma espessura de 3 μm usando um micrótomo (ver Tabela de Materiais).
- Coloque as seções em lâminas de vidro. Manjar as lâminas com solução de azul de Alcian (ver Tabela de Materiais) durante 1 h a 37 °C. Lave as lâminas manchadas com água. Coloque as lâminas sob um microscópio de luz e capture fotos do mucopolissacarídeo ácido corado de azul, indicando tecidos cartilaginosos.
Resultados
Um espécime de osso mandibular foi coletado com sucesso do paciente. E o tempo desde o corte com a lâmina do osteótomo ultrassônico até a colocação do fragmento ósseo no tubo da centrífuga é de cerca de 5 min. Nenhuma das complicações potenciais ocorreu durante e após o procedimento de ressecção, incluindo danos ao nervo alveolar inferior ou raiz dentária, infecção, ruptura vascular e sangramento, lesão da mucosa, fratura óssea acidental, etc. As hmBMSCs foram cultivadas, passadas e diferenciadas com sucesso sem contaminação.
No presente estudo, muitas células aderidas foram vistas ao microscópio no terceiro dia após a cultura inicial. No sétimo dia, a maioria das células aderentes já estava presa à placa de cultura. Normalmente, as células cultivadas atingiram 70%-80% de confluência após 7-9 dias de cultivo inicial. Após a passagem, as células P3 eram geralmente consideradas MSCs purificadas, que apresentavam morfologia fusiforme, aderente ao plástico e semelhante a fibroblastos (Figura 2). E os experimentos de identificação foram conduzidos em células P3 a P5. Ensaio de proliferação celular, a taxa de crescimento celular aumentou rapidamente a partir do terceiro dia de cultura e a taxa aumentada diminuiu no dia 6 (Figura 2).
De acordo com a definição dada pela Sociedade Internacional de Terapia Celular, as MSCs têm uma expressão positiva e negativa de moléculas de superfície específicas. Neste estudo, a análise por citometria de fluxo de células de cultura mostrou expressão positiva de CD44, CD90 e expressão negativa de CD45, CD34, o que está de acordo com a definição 4,11 (Figura 3). Nos experimentos de capacidade de diferenciação multilinhagem, as células cultivadas mostraram forte capacidade de diferenciação osteogênica, adipogênica e condrogênica. Após 7 dias de indução osteogênica, a deposição de cálcio da matriz extracelular emergiu ao microscópio. Após 21 dias de indução osteogênica, as células cultivadas mostraram nódulos de mineralização óbvios, e os nódulos foram corados de vermelho com coloração de vermelho de alizarina (Figura 4). Para adipogênese, muitas gotículas lipídicas redondas acumuladas coradas de vermelho pela coloração Oil-red-O foram vistas no citoplasma após 21 dias de indução adipogênica (Figura 4). Após 21 dias de indução da diferenciação condrogênica, as lâminas de pellets celulares mostrando tecido semelhante a cartilagem com lacuna de cartilagem podem ser coradas de azul (Figura 4).

Figura 1: Seleção do local doador na imagem de TC 3D. (A) Imagem de TC 3D da mandíbula doadora de uma paciente de 21 anos. (B) Simulação cirúrgica da osteotomia bilateral do ramo sagital dividido da mandíbula. (C) O planejamento cirúrgico mostra o revés de uma mandíbula dividida. (D) Imagem de TC 3D mostrando o osso cortical (a parte translúcida), o osso esponjoso rico em medula óssea e o nervo alveolar inferior (vermelho) com base em diferentes valores de TC, o que pode orientar os cirurgiões a selecionar o local doador e evitar lesão nervosa. Lascas de osso esponjoso foram colhidas da região no retângulo preto. Clique aqui para ver uma versão maior desta figura.
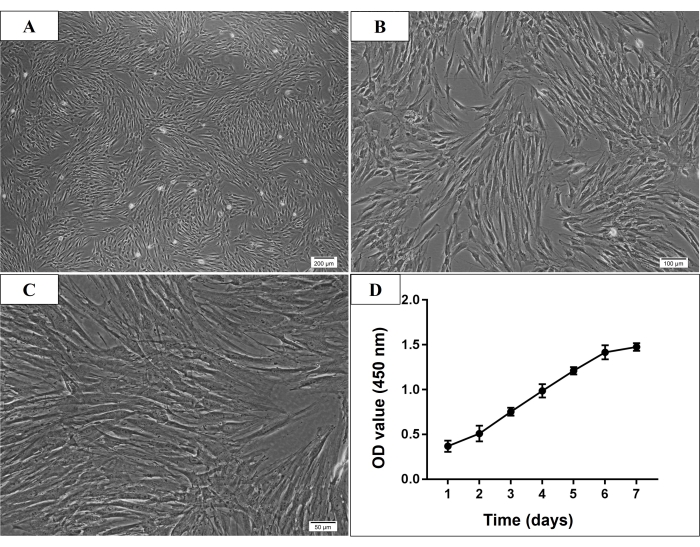
Figura 2: Morfologia microscópica e curva de crescimento de células-tronco da medula óssea derivadas da mandíbula humana P3 (hmBMSCs). (AC) Morfologia fusiforme, aderente ao plástico e semelhante a fibroblastos de hmBMSCs P3 (barra de escala = 200 μm, 100 μm, 50 μm para A, B, C, respectivamente). (D) A curva de crescimento celular mostrou que a taxa de crescimento das hmBMSCs aumentou rapidamente a partir do terceiro dia de cultivo e a taxa de aumento diminuiu no sexto dia de cultivo. Clique aqui para ver uma versão maior desta figura.

Figura 3: A expressão do antígeno da superfície celular em hmBMSCs foi detectada por citometria de fluxo. A análise por citometria de fluxo mostrou que as hmBMSCs foram negativas para CD45 (A) e CD44 (C), positivas para CD44 (B) e CD90 (D). Clique aqui para ver uma versão maior desta figura.
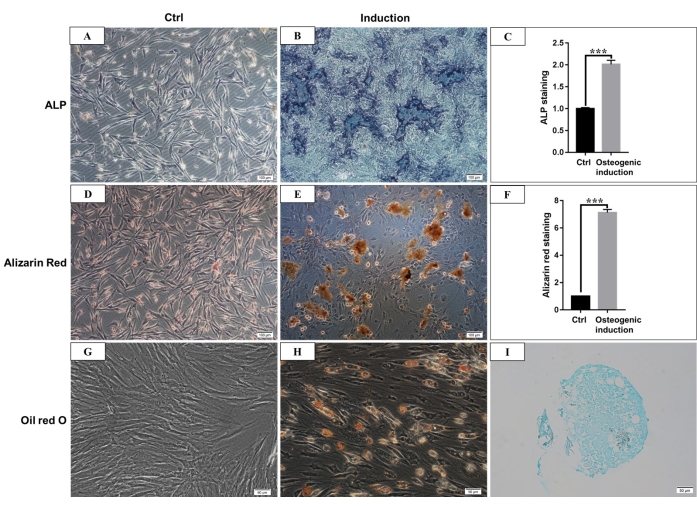
Figura 4: Diferenciação osteogênica, adipogênica e condrogênica de hmBMSCs. (A) Coloração ALP de hmBMSCs após 7 dias de cultura sem indução de diferenciação osteogênica (barra de escala = 100 μm). (B) Coloração ALP de hmBMSCs após 7 dias de indução de diferenciação osteogênica (barra de escala = 100 μm). (C) Resultados quantitativos da área positiva para coloração ALP (***P < 0,001). (D) Coloração com vermelho de alizarina de hmBMSCs sem diferenciação osteogênica (barra de escala = 100 μm). (E) A formação de nódulos de mineralização óbvios pode ser observada após 21 dias de diferenciação osteogênica de hmBMSCs, e pode ser corada de vermelho com coloração de vermelho de alizarina (barra de escala = 100 μm). (F) Resultados quantitativos da coloração com vermelho de alizarina (***P < 0,001). (G) Coloração com vermelho de óleo O de hmBMSCs sem diferenciação adipogênica (barra de escala = 50 μm); (H) Gotículas lipídicas redondas foram observadas após 21 dias de diferenciação adipogênica de hmBMSCs, e as gotículas lipídicas foram coradas de vermelho com coloração O vermelho óleo (barra de escala = 50 μm). (I) A coloração com azul de Alcian foi positiva após 21 dias de indução de diferenciação condrogênica (barra de escala = 50 μm). Clique aqui para ver uma versão maior desta figura.
Discussão
Recentemente, a terapia com hMSCs tem se mostrado muito promissora na regeneração tecidual e no tratamento de muitas doenças refratárias, como doenças de disfunção imunológica, doenças hematológicas sistêmicas, cânceres ou traumas, em vários ensaios clínicos 1,14,15,16,17. Dentre as várias fontes de MSCs, a medula óssea continua sendo a fonte mais utilizada e de fácil acesso. Usamos chips de osso esponjoso mandibular humano para cultivar com sucesso BMSCs usando o método de adesão de medula óssea total descrito no presente protocolo. Até o momento, existem quatro abordagens principais para isolar células-tronco da medula óssea, incluindo o método de adesão de toda a medula óssea, método de centrifugação por gradiente de densidade, método de classificação de células fluorescentes e método de classificação de células ativadas por magnetismo10. Todo o método de adesão da medula óssea é simples, fácil de operar, barato e pode obter grandes quantidades de células aderentes. No entanto, a limitação desse método foi a baixa pureza das BMSCs cultivadas primáriamente, que foram misturadas com células hematopoiéticas e fibroblastos. Após a atualização regular do meio de cultura das células primárias, as células hematopoiéticas não aderentes foram descartadas junto com o meio descartado. Além disso, os fibroblastos podem ser eliminados através da passagem celular, e as células P3 eram BMSCs altamente purificadas. Portanto, as células P0 a P2 não podem ser usadas para terapia celular, o que significa que foi necessário mais tempo para purificar as células-tronco. Usando métodos de classificação de células fluorescentes e classificação de células ativadas por magnetismo, pode-se obter BMSCs mais purificados, enquanto os dois métodos são caros e um longo tempo de seleção pode prejudicar a viabilidade celular11. Para provar que as células cultivadas eram CTMs, recorremos à definição de CTMs humanas proposta pelo Comitê de Células-Tronco Mesenquimais e Tecidutais da Sociedade Internacional de Terapia Celular, que incluía caráter aderente plástico, expressão positiva e negativa de certos fenótipos, como CD45, CD90 e assim por diante, e capacidade de diferenciação de múltiplas linhagens18.
Na maioria dos estudos, os fêmures e a crista ilíaca foram as principais fontes de BMSCs, em comparação com os ossos maxilofaciais, como mandíbula e maxila 9,16. No entanto, a teoria característica site-specific das hBMSCs em estudos recentes mostrou que as hBMSCs de diferentes ossos tinham diferentes caracteres na capacidade de diferenciação, atividade proliferativa, osteogênese e imunidade 6,8. A diferença sítio-específica pode estar relacionada a diferentes origens embriológicas, adaptação às demandas funcionais em cada sítio esquelético, microambiente, suprimento vascular local, efeitos hormonais, etc. Além disso, estudos mostraram que o osso ilíaco enxertado exibiu perda vertical mais rápida do que o maxilar dentro de 6 meses após o enxerto ósseo8. Por outro lado, estudos descobriram que a atividade proliferativa das CTMs da medula mandibular foi superior à da medula ilíaca5,8,19,20. E essa diferença de atividade proliferativa foi atribuída aos caracteres de que a mandíbula tinha mais suprimento sanguíneo e uma taxa de renovação óssea mais rápida do que o ílio 5,6,8. Estudos também revelaram que as BMSCs da mandíbula expressaram um nível mais alto de Runx-2 e OCN do que as dos fêmures, e a capacidade osteogênica das BMSCs da mandíbula foi igual ou superior às dos fêmures e ílio 5,19,21. A aderência à capacidade de titânio das hmBMSCs também foi mais forte do que as BMSCs dos fêmures, o que sugeriu que as hmBMSCs eram mais apropriadas para serem usadas em implantodontia oral5. Além disso, um estudo clínico de 3 anos para reconstruir o defeito alveolar constatou que o osso regenerado das CTMs da polpa dentária era composto por um osso totalmente compacto com maior densidade de matriz, enquanto as BMSCs hm regeneraram osso esponjoso semelhante à estrutura óssea alveolar humana normal22. Em conclusão, as hmBMSCs foram células-tronco terapêuticas ideais para regeneração maxilofacial e outras doenças devido à mesma origem embriológica e suas características superiores.
No entanto, a mandíbula tem menos medula óssea do que os fêmures e o ílio, por isso é importante obter medula óssea e BMSCs suficientes da mandíbula para uso clínico. Os aspirados ilíacos humanos podem obter grandes quantidades de medula óssea para isolar as CTMs. Os pesquisadores também usaram os aspirados mandibulares para obter CTMs, enquanto o rendimento inicial das CTMs dos aspirados mandibulares foi três vezes menor do que o dos aspirados ilíacos21. Incisões adicionais foram necessárias para coletar aspirados de medula mandibular suficientes, adicionando trauma cirúrgico adicional. Além disso, estudos têm demonstrado que o potencial proliferativo das CTMs das lascas ósseas da mandíbula pode ser superior ao dos aspirados de medula da mandíbula8,21. Portanto, neste estudo, os chips de osso esponjoso da mandíbula descartados foram usados para isolar as CTMs. Como ambos os lados da mandíbula foram incluídos na osteotomia sagital do ramo dividido ou na plastia de redução do ângulo mandibular, podemos obter medula da mandíbula suficiente dos pacientes sem nenhum dano extra. Recentemente, a tecnologia assistida por computador tem sido amplamente utilizada em cirurgia oral e maxilofacial para melhorar o efeito cirúrgico e reduzir as complicações cirúrgicas23. Para evitar lesões da mandíbula e do nervo durante a coleta da medula óssea da mandíbula, foi obtida a imagem 3D da tomografia computadorizada 3D da mandíbula dos doadores e o planejamento cirúrgico dos doadores foi analisado para decidir os locais doadores e implementar a simulação cirúrgica no estudo; portanto, nenhuma das complicações cirúrgicas ocorreu. A lâmina do osteótomo ultrassônico, um dispositivo específico do tecido que permite aos cirurgiões fazer osteotomias precisas enquanto protegem os tecidos moles adjacentes24, também foi usada para evitar lesões nos tecidos moles e preservar a atividade da medula óssea obtida.
Em resumo, este estudo descreveu um protocolo confiável, simples, seguro e barato para isolar e cultivar CTMs mandibulares humanas adequadas, que podem ser usadas em terapias celulares de tecidos dentários e maxilofaciais.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
O estudo foi apoiado pela Fundação Nacional de Ciências Naturais da China (No.81903249) e pelo Programa de Pesquisa Básica em Ciências Naturais da província de Shaanxi (No.2019JQ-701, No.2022JZ-50).
Materiais
| Name | Company | Catalog Number | Comments |
| 4% Paraformaldehyde | PlantChemMed | PC-00005 | |
| Adipogenic differentiation medium | OriCell, Cyagen Biosciences | HUXMX-90031 | |
| Alcian blue solution | OriCell, Cyagen Biosciences | ALCB-10001 | |
| Alcohol | Macklin | e809056 | |
| Alizarin red staining solution | Solarbio | G1452 | |
| ALP staining solution | Beijing ComWin Biotech Co.,Ltd. | CW0051S | |
| Autoclave | ALP Co., Ltd., Japan | CL-40L | |
| CCK-8 solution | Yeasen Biotech Co., Ltd. | 40203ES80 | |
| Cell filter (70 μm pore size) | BD Biosciences | 352350 | |
| Cell incubator | Thermo Fisher Scientific | 41334177 | |
| Centrifuge | Eppendorf | 5805ZP761456 | |
| Centrifuge tube (50 mL, 15 mL) | Sangon Biotech | F600888-9001 | |
| Cetylpyridinium chloride | Aladdin | H108696 | |
| Chondrogenesis differentiation medium | OriCell, Cyagen Biosciences | HUXMX-90041 | |
| Clean bench/Laminar flow cabinet | BIOBASE | BBS-DDS00030 | |
| Culture dish (6 cm) | Thermo | 150462 | |
| Culture flasks (25 cm) | Thermo | 156367 | |
| Culture plates (96-well, 6-well) | Corning-Costar | 352350 | |
| Disposable sterile gloves and masks | Sangon Biotech | F516018-9001;F516038-9001 | |
| Disposable sterile syringe (1 mL) | Shaanxi longkangxin Medical Instrument Co., Ltd | 1.00009E+11 | |
| Dulbecco's modified Eagle's medium with high glucose (HG-DMEM) | Hyclone | SH30022.01B | |
| EDTA | Solarbio | E8040-500g | |
| Fetal bovine serum (FBS) | PlantChemMed | PC-00001 | |
| Flow cytometer | Beckman Coulter | EPICS XL | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD34 | Biolegend | 343503 | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD44 | Biolegend | 338804 | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD90 | Biolegend | 328108 | |
| Hemocytometer | Koraba | 30119480698 | |
| Icebox | Sangon Biotech | F615002-0001 | |
| Image J software | National Institute of Mental Health | ||
| Light microscope | OLYMPUS | IX71-2L20944 | |
| Microcentrifuge tubes | Sangon Biotech | F601620-0010 | |
| Microplate spectrophotometer | BioTek-EPOCH | 259091 | |
| Microtome | Feica | 1003001 | |
| Mimics software | Materialise | ||
| Minimum essential medium alpha (α-MEM) | Hyclone | SH30265.01 | |
| Oil red O staining solution | Solarbio | G1261 | |
| Osteogenic differentiation medium | OriCell, Cyagen Biosciences | HUXMA-90021 | |
| Penicillin and streptomycin | PlantChemMed | PC-86115 | |
| Phosphate buffer saline (PBS) | PlantChemMed | PC-00003 | |
| Phycoerythrin (PE)-conjugated mouse monoclonal anti-human antibody against CD45 | Biolegend | 304008 | |
| Pipette | SORFA | 320511 | |
| ProPlan CMF 3.0 | Materialise | ||
| Scissors, tweezers and knives | Shanghai Jinzhong Surgical instrument Co., Ltd | ZJA030,YAA110,J11010 | |
| Sterile wet gauze | HENAN PIAOAN GROUP Co., Ltd | ||
| Trypsin | Gibco | 17075029 | |
| Ultrasonic osteotome blade | Stryker Instruments | 5450-815-107 |
Referências
- Ullah, I., Subbarao, R. B., Rho, G. J. Human mesenchymal stem cells - current trends and future prospective. Bioscience Reports. 35 (2), 1-8 (2015).
- Brown, C., et al. Mesenchymal stem cells: Cell therapy and regeneration potential. Journal of Tissue Engineering and Regenerative Medicine. 13 (9), 1738-1755 (2019).
- Trohatou, O., Maria, G. R. Mesenchymal stem/stromal cells in regenerative medicine: Past, present, and future. Cellular Reprogramming. 19 (4), 217-224 (2017).
- Heo, J. S., Choi, Y., Kim, H. S., Kim, H. O. Comparison of molecular profiles of human mesenchymal stem cells derived from bone marrow, umbilical cord blood, placenta and adipose tissue. International Journal of Molecular Medicine. 37 (1), 115-125 (2016).
- Li, C. J., Wang, F. F., Zhang, R., Qiao, P. Y., Liu, H. C. Comparison of proliferation and osteogenic differentiation potential of rat mandibular and femoral bone marrow mesenchymal stem cells in vitro. Stem Cells and Development. 29 (11), 728-736 (2020).
- Lloyd, B., et al. Similarities and differences between porcine mandibular and limb bone marrow mesenchymal stem cells. Archives of Oral Biology. 77 (5), 1-11 (2017).
- Yamaza, T., et al. Mouse mandible contains distinctive mesenchymal stem cells. Journal of Dental Research. 90 (3), 317-324 (2011).
- Akintoye, S. O., et al. Skeletal site-specific characterization of orofacial and iliac crest human bone marrow stromal cells in same individuals. Bone. 38 (6), 758-768 (2006).
- Mendi, A., Ulutürk, H., Ataç, M. S., Stem Yılmaz, D. cells for the oromaxillofacial area: Could they be a promising source for regeneration in dentistry. Advances in Experimental Medicine and Biology. 11 (44), 101-121 (2019).
- Hong, Y. Y., et al. Isolation and cultivation of mandibular bone marrow mesenchymal stem cells in rats. Journal of Visualized Experiments. (162), e61532 (2020).
- Chu, D. T., et al. An update on the progress of isolation, culture, storage, and clinical application of human bone marrow mesenchymal stem/stromal cells. International Journal of Molecular Sciences. 21 (3), 708 (2020).
- Yu, Y. J., et al. Activation of mesenchymal stem cells promotes new bone formation within dentigerous cyst. Stem Cell Research & Therapy. 11 (1), 476 (2020).
- Sadeghipour, A., Babaheidarian, P. Making formalin-fixed, paraffin embedded blocks. Methods in Molecular Biology. 1897, 253-268 (2019).
- Mathiasen, A. B., et al. marrow-derived mesenchymal stromal cell treatment in patients with ischaemic heart failure: final 4-year follow-up of the MSC-HF trial. European Journal of Heart Failure. 22 (5), 884-892 (2020).
- Maqsood, M., et al. Adult mesenchymal stem cells and their exosomes: Sources, characteristics, and application in regenerative medicine. Life Sciences. 01 (256), 118002 (2020).
- Reinders, M. J., et al. Autologous bone marrow-derived mesenchymal stromal cell therapy with early tacrolimus withdrawal: The randomized prospective, single-center, open-label TRITON study. American Journal of Transplantation: Official Journal of the American Society of Transplantation and the American Society of Transplant Surgeons. 21 (9), 3055-3065 (2021).
- Shi, H. Y., et al. marrow-derived mesenchymal stem cells promote Helicobacter pylori-associated gastric cancer progression by secreting thrombospondin-2. Cell Proliferation. 54 (10), 13114 (2021).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
- Aghaloo, T. L., et al. Osteogenic potential of mandibular vs. long-bone marrow stromal cells. Journal of Dental Research. 89 (11), 1293-1298 (2010).
- Dong, W. J., et al. Phenotypic characterization of craniofacial bone marrow stromal cells: unique properties of enhanced osteogenesis, cell recruitment, autophagy, and apoptosis resistance. Cell and Tissue Research. 358 (1), 165-175 (2014).
- Lee, B. K., Choi, S. J., Mack, D., Oh, S. H. Isolation of mesenchymal stem cells from the mandibular marrow aspirates. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontics. 112 (6), 86-93 (2011).
- Giuliani, A., et al. Three years after transplants in human mandibles, histological and in-line holotomography revealed that stem cells regenerated a compact rather than a spongy bone: biological and clinical implications. Stem Cells Translational Medicine. 2 (4), 316-324 (2013).
- Chen, Y. W., et al. Computer-assisted surgery in medical and dental applications. Expert Review of Medical Devices. 18 (7), 669-696 (2021).
- Gilles, R., Couvreur, T., Dammous, S. Ultrasonic orthognathic surgery: enhancements to established osteotomies. International Journal of Oral and Maxillofacial Surgery. 42 (8), 981-987 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados