Method Article
Флуоресцентный анализ для оценки проницаемости сердечного микрососудистого эндотелиального барьера в модели ишемии/реперфузии у крыс
* Эти авторы внесли равный вклад
В этой статье
Резюме
В данной работе мы описываем метод функциональной оценки эндотелиального барьера микрососудов сердца после ишемического/реперфузионного повреждения путем измерения средней интенсивности флуоресценции экстравазированного 70 000 Да ФИТК-декстрана по сравнению с Эвансом Блю.
Аннотация
Реваскуляризационная терапия виновных артерий, независимо от чрескожного коронарного вмешательства и аортокоронарного шунтирования, считается лучшей стратегией для улучшения клинического прогноза пациентов с острым коронарным синдромом (ОКС). Тем не менее, реперфузия миокарда после эффективной реваскуляризации может вызвать значительную гибель кардиомиоцитов и коллапс эндотелия коронарных артерий, известный как ишемия/реперфузионное повреждение миокарда (MIRI). Как правило, эндотелиальные клетки и их межклеточные плотные соединения совместно поддерживают микрососудистый эндотелиальный барьер и его относительно низкую проницаемость, но не справляются в зонах реперфузии.
Гиперпроницаемость микрососудистого эндотелия, индуцированная ишемией/реперфузией (ИР), способствует отеку миокарда, усилению инфильтрации провоспалительных клеток и усугублению интрамиокардиального кровоизлияния, что может ухудшить прогноз ОКС. Индикатор, использованный в этом исследовании — 70 000 Да ФИТК-декстран, разветвленная молекула глюкозы, меченная флуоресцеином изотиоцианатом (ФИТК) — кажется слишком большим, чтобы проникнуть в сердечный микрососудистый эндотелий в нормальных условиях. Тем не менее, он способен проникнуть через сломанный барьер после MIRI. Таким образом, чем выше проницаемость эндотелия, тем больше ФИТК-декстрана накапливается во внесосудистом межклеточном пространстве. Таким образом, интенсивность флуоресценции от FITC может указывать на проницаемость микрососудистого эндотелиального барьера. Этот протокол использует преимущества FITC-декстрана для функциональной оценки сердечного микрососудистого эндотелиального барьера, который обнаруживается автоматизированной системой количественной визуализации патологии.
Введение
Тот факт, что все большее число пациентов с ишемической болезнью сердца получают пользу от реваскуляризационной терапии в течение десятилетий, не отменяет фатальных последствий MIRI. Как описывают Йеллон и Хаузенлой, примерно 30% от конечного размера инфаркта можно отнести к MIRI1. Дисфункция сердечного микрососудистого эндотелия является основным механизмом, лежащим в основе MIRI и феномена «отсутствия возврата», и является мишенью многих кардиопротекторных агентов и классических кардиопротекторных путей2. Кроме того, эндотелиальная гиперпроницаемость микрососудов может вызывать отек миокарда3и чрезмерную инфильтрацию провоспалительных клеток, включая нейтрофилы4, макрофаги и эртроциты5.
Индуцированный MIRI окислительный стресс и сверхэкспрессия провоспалительных цитокинов, таких как члены семейства факторов некроза опухоли6 и семейства интерлейкинов7, активируют сигнальные пути клеточного апоптоза, ускоряя гибель ишемизированного миокарда. Эритроциты проникают через уязвимый эндотелиальный барьер и накапливаются во внеклеточном матриксе (ВКМ), образуя интрамиокардиальную гематому8. Матриксные металлопротеиназы, полученные из макрофагов и нейтрофилов, разрушают коллаген в ВКМ, что увеличивает риск механического осложнения и постинфарктной аневризмы желудочков9. Таким образом, проницаемость эндотелиального барьера является решающим признаком для прогностической оценки острого инфаркта миокарда и в той или иной степени указывает на тяжесть МИРИ.
FITC-декстран представляет собой массив полисахаридов, состоящий из разветвленных молекул глюкозы различной длины с молекулярной массой от 4000 Да до 70000 Да. Он широко используется в качестве стандартного индикатора для демонстрации проницаемости клеточных мембран, функциональных физиологических барьеров, таких как гематоэнцефалический барьер10 и слизистые оболочки11 при специфических методах лечения и патологических состояниях. Проницаемость одной конкретной мембраны варьируется для разных веществ в зависимости от их молекулярной массы. Обычно альбумин ограничен сердечными микрососудами; однако он может проникать в эндотелий на ранней стадии ИР, вызывая отек миокарда. Поскольку молекулярная масса альбумина составляет приблизительно 68 000 Да, 70 000 Да ФИТК-декстран было бы подходящим агентом для демонстрации гиперпроницаемости эндотелия после ИР. Кроме того, декстран широко применяется для поддержания объема крови и коллоидосмотического давления у шоковых пациентов, а меченые FITC индикаторы используются в многочисленных исследованиях in vivo или in vitro с небольшими побочными эффектами.
В дополнение к FITC-декстрану, проницаемость эндотелия была измерена с помощью окрашивания Evans Blue (EB). После введения в кровоток БЭ прочно связывается с сывороточным альбумином и образует комплекс12. Таким образом, этот комплекс БЭ-альбумина, а не только БЭБ, может быть использован для измерения проницаемости, а это означает, что на точность такого метода, основанного на БЭБ, могут влиять различные концентрации сывороточного альбумина у подопытных. Кроме того, сообщалось, что БЭ отравляет органы экспериментальных животных, особенно сердце, печень и легкие, в результате клеточной дегенерации и повышения проницаемости сосудов13. Эндотелий, подвергающийся ишемии/реперфузии, будет более чувствителен к таким вредным воздействиям, чем нормальный эндотелий, что может исказить значимость экспериментальных результатов.
По сравнению с EB-красителем, FITC-декстран является экзогенным, а сродство связывания с альбумином незначительно. Следовательно, ФИТК-декстран остается в свободном состоянии и не связан макромолекулами, такими как альбумин и тканевые белки. Таким образом, при введении в соответствии с массой тела, ФИТК-декстран может работать при одинаковой концентрации в крови и не подвержен влиянию индивидуальных различий в концентрации сывороточного альбумина и объеме крови. Тунсиньлуо (TXL), традиционная китайская медицина, была использована для проверки диагностической чувствительности этого метода. TXL снижает MIRI, поддерживая ультраструктуру эндотелиальных клеток и целостность эндотелиального барьера14. TXL также используется для лечения стенокардии и улучшения безрецидивного потока миокарда после инфаркта клинически15. Он содержит Radix ginseng, Buthus martensi, Hirudo, Eupolyphaga seu steleophaga, Scolopendra subspinipes, Periostracum cicadae, Radix paeoniae rubra, Semen ziziphi spinosae, Lignum dalbergiae odoriferae, Lignum santali albi и Borneolum syntheticum. Было показано, что TXL защищает микрососудистый эндотелий через путь MEK/ERK16 и эндотелиальныемеханизмы 5,17, опосредованные синтазой оксида азота, и облегчает ишемию/реперфузионное повреждение (IRI) органов18, особенно сердца, дозозависимым образом. Здесь крыс кормили 0,5 г/кг порошка TXL (доза, эквивалентная той, которая использовалась клинически у людей), как описано19. В данной работе представлен метод функциональной оценки эндотелиального барьера сердечных микрососудов после ИР путем измерения общей интенсивности флуоресценции экстравазированного 70 000 Да ФИТК-декстрана по сравнению с БЭ.
протокол
Эксперименты на животных проводились в соответствии с «Руководством по уходу за лабораторными животными и их использованию», выпущенным Национальными институтами здравоохранения США (Bethesda, MD, США, публикация NIH No 85-23, пересмотренная в 1996 году) и «Регламентом по уходу и использованию экспериментальных животных» Пекинского совета по уходу за животными (1996). Протокол исследования был одобрен Комитетом по уходу за экспериментальными животными больницы Фувай. В данном исследовании использовались самцы крыс SPF-класса Sprague-Dawley (крысы SD) массой 150-180 г.
1. Подготовка реактивов, материалов и оборудования
- Приготовьте реагенты и растворы, включающие 70% этанол, ФИТК-декстран (70 000 Да, растворенных в ледяном физрастворе с получением 10% весового раствора для использования), крем для удаления волос, монтажную среду с 4',6-диамидино-2-фенилиндолом (DAPI, 0,5-10 мкг/мл), 1% w/v раствор EB/физиологического раствора и 5% w/v раствор пентобарбитала натрия/физиологического раствора (хранить при температуре 4 °C в темноте).
- Заранее простерилизовать все хирургические инструменты и материалы, в том числе хирургическую ленту; марлевые салфетки; хирургические перчатки; Эндотрахеальная трубка 16 G; инсулиновый шприц; операционные ножницы; большие, изогнутые рассекающие щипцы; прямые рассекающие щипцы; прямые щипцы от комаров; изогнутые щипцы от комаров; втягивающие устройства (разброс 30 мм); держатели микроигл 5 см; 3-0 полипропиленовый шов (коническая игла); и полипропиленовый шов 6-0 (круглая игла).
- Проверьте и убедитесь, что все оборудование, включая систему нагрева при постоянной температуре, систему освещения, аппарат искусственной вентиляции легких, автоматизированную систему количественной визуализации патологии и ультрафиолетовый замораживающий слайсер, находится в хорошем состоянии.
2. Подготовка крыс к хирургическим процедурам
- Случайным образом разделите всех крыс SD на фиктивную группу, группу IR и группу TXL (группа IR+TXL).
Примечание: В этом протоколе шесть крыс были случайным образом распределены в каждую группу, n=6. - Взвесьте каждую крысу SD, запишите вес и рассчитайте дозу TXL, которую следует ввести каждой крысе.
- Вводите ибупрофен в дозе 30 мг/кг через зонд каждой крысе не менее чем за 12 ч до торакотомии для облегчения предоперационной боли и дистресса.
- Вводят сверхдисперсный порошок TXL в дозе 0,5 г/кг через 12 ч и 1 ч каждой крысе SD в группе IR+TXL перед анестезией, как описано19.
- Продезинфицируйте операционный стол 70% этанолом и поместите стерилизованные хирургические инструменты и материалы на продезинфицированную поверхность.
- Отрегулируйте температуру системы нагрева постоянной температуры, чтобы поддерживать температуру тела крыс на уровне 37 ± 1 °C.
3. Создание модели ишемии/реперфузии сердца на крысах
- Введите 5% пентобарбитала натрия/фосфатно-солевого буферного раствора (PBS) в дозе 50 мг/кг (0,1 мл/100 г массы тела) в брюшную полость для обезболивания крысы. Подготовьте место операции, аккуратно удалив шерсть от шеи до груди, побрив или используя крем для депиляции.
- Аккуратно отрегулируйте положение языка по мере необходимости с помощью стерилизованного пинцета и протрите дыхательный секрет стерилизованными ватными шариками. Держите голосовую щель в поле зрения и аккуратно введите эндотрахеальную трубку в трахею.
- Подключите эндотрахеальную трубку к аппарату искусственной вентиляции легких, вращающемуся со скоростью 65-80 вдохов в минуту, и отрегулируйте дыхательный объем на 4-5 мл путем фиксации головы и конечностей крысы.
- Наденьте на крысу стерильную простыню, продезинфицируйте операционную зону настойкой йода с последующим добавлением 70% этанола и повторите эту процедуру три раза.
- Сделайте левый парастернальный разрез на уровне четвертого межреберья, чтобы обнажить левую большую и малую грудную мышцы.
- Рассеките фасцию между большой и малой мышцами, используя технику тупого рассечения, чтобы обнажить левое четвертое межреберье.
ПРИМЕЧАНИЕ: Избегайте чрезмерного повреждения тканей и сосудистых повреждений, которые могут вызвать сильное кровотечение и послеоперационную смерть. - Рассеките межреберные мышцы, расположите грудной ретрактор в четвертом межреберье, а затем раздвиньте ребра.
- Разорвите перикард и удалите прикрепленную жировую ткань.
ПРИМЕЧАНИЕ: Избегайте повреждения других органов острыми хирургическими инструментами, особенно легких. Повреждение легких может привести к развитию пневмоторакса и гемопневмоторакса во время операции, вызывая какоэтические последствия, начиная от гемодинамических нарушений и заканчивая снижением выживаемости животных. - Манипулируйте положением тимуса и мягко обнажите восходящую аорту и левое предсердие. Определите и переложите проксимальную левую переднюю нисходящую артерию (ПМЖ) транзиторно в течение 45 мин с помощью полипропиленового шва 6-0 (см. Рисунок 1 A-D).
ПРИМЕЧАНИЕ: Эта процедура идентична для фиктивных контрольных крыс, за исключением того, что ПМЖ не перевязывается. - Снимите ретрактор грудной клетки и сведите ребра вместе в прерывистый шов полипропиленовым швом 3-0.
- Восстановите отрицательное внутригрудное давление для обеспечения эффективного дыхания.
ПРИМЕЧАНИЕ: Для восстановления отрицательного внутригрудного давления можно использовать два метода: i) перед закрытием грудной полости исследователи могут закупорить выходное отверстие аппарата искусственной вентиляции легких на 2 цикла, чтобы надуть легкие. ii) Воздух, оставшийся в грудной полости, может быть выведен с помощью шприца после того, как межреберье будет закрыто. - После удаления волос и дезинфекции сделайте разрез в правой нижней конечности и рассеките поверхностную фасцию от правой бедренной вены.
- Ослабьте лигирование и проверьте состояние дыхания и кровообращения после индуцирования ишемии миокарда в течение 45 минут.
- Введите 10% (по мас./об.) раствор FITC-декстрана/физиологического раствора в бедренную вену в дозе 0,15 мл/100 г массы тела и надавите на бедренную вену в течение 1 минуты стерильными ватными тампонами, чтобы остановить кровотечение (рис. 2A, B).
ПРИМЕЧАНИЕ: В качестве альтернативы можно ввести 1% w/v раствор EB/физиологического раствора в бедренную вену в дозе 0,5 мл/100 г массы тела. - Зашить разрезы полипропиленовым швом 3-0 и продезинфицировать разрезы с последующей послеоперационной анальгезией ибупрофеном, как описано выше.
4. Подготовка срезов замороженной ткани к измерению флуоресценции
- Вводите 5% в/в раствор пентобарбитала натрия/PBS в дозе 150 мг/кг (0,3 мл/100 г массы тела) внутрибрюшинно для глубокой анестезии крыс после 3 ч реперфузии миокарда.
- Разрежьте брюшную полость и обнажите брюшную аорту и полую вену (см. рисунок 3А).
- Постепенно вводите 50 мл ледяного PBS в полую вену, разрежьте брюшную аорту, чтобы вымыть кровь из миокарда, и изберите сердце.
ПРИМЕЧАНИЕ: Наблюдайте за изменениями в легких и печени. Потливость печени указывает на то, что физиологический раствор точно вводится в полую вену (см. рисунок 3C), а бледное легкое считается признаком хорошо перфузированного миокарда (см. рисунок 3B). - В темной комнате осторожно промойте сердце ледяным физиологическим раствором или PBS, чтобы удалить остатки крови и ФИТК-декстрана (или БЭ) из камер сердца.
- Отрежьте сердце от перевязки и отбросьте миокард над перевязкой.
- Сердце погрузить в формы с закладочным составом с последующим хранением при -80 °C.
- Выгрузите замороженные ткани из закладных форм и загрузите их на держатели образцов в предварительно охлажденную камеру с температурой -20 °C замораживающего слайсера.
- Отрегулируйте толщину одного среза до 5-8 мкм и сделайте срез ткани примерно в середине оси основание-вершина (например, в середине ишемии).
- Загрузите срез ткани на адгезивные предметные стекла микроскопа и запечатайте каждый срез одной каплей (примерно 40 мкл) флуоресцентной монтажной среды, содержащей DAPI.
- Храните слайды в сухой и темной коробке.
ПРИМЕЧАНИЕ: Если слайды не могут быть отсканированы сразу, храните их в сухом, прохладном и темном месте, чтобы предотвратить образование конденсата в воде и гашение флуоресценции.
5. Измерение флуоресценции и анализ данных
- Настройте систему обработки изображений и проверьте программное обеспечение, подключенное к сканеру.
- Загрузите слайды в полки для слайдов и вставьте их в сканер.
- Откройте программное обеспечение для сканирования предметных стекол (см. Таблицу материалов) и настройте новый протокол воздействия, нажав на кнопку «Редактировать протокол» | Новые функции....
ПРИМЕЧАНИЕ: Если сканер или связанное с ним программное обеспечение недоступно, альтернативой автоматизированному количественному флуоресцентному сканеру может стать лазерный конфокальный микроскоп (см. Таблицу материалов) или другие обычные слайдовые сканеры с режимом флуоресценции (см. Таблицу материалов). - Переименуйте протокол и исследование, а затем выберите режим флуоресценции .
- Определение сканирования всего предметного стекла | Разрешение пикселей и мультиспектральные области | Разрешение в пикселях 0,25 мкм (40x) соответственно.
- Нажмите « Редактировать фильтры и каналы...», чтобы выбрать столбцы «Фильтры сканирования всего слайда » и « Каналы мультиспектральной области ».
ПРИМЕЧАНИЕ: Если используется EB, выберите «Фильтры сканирования всего предметного стекла» | DAPI и Texas Red или AF495. Если используется FITC-декстран, выберите Multispectral Region Bands | DAPI и FITC или AF488. - Нажмите « Редактировать экспозиции...» и загрузите носитель.
- Выберите целевой слот и нажмите « Сделать обзор».
ПРИМЕЧАНИЕ: Для этого требуется яркопольное сканирование каждого участка сердца. Выберите миокард для фокусировки или выберите область вслепую. - Выберите целевой слайд, отрегулируйте Высоту сцены примерно до -50 μм и нажмите на Автофокус.
- Нажмите на Экспозиция всего сканирования (мс)-DAPI | Автоэкспонирование.
Примечание: Время экспозиции DAPI для каждого слайда не обязательно должно быть одинаковым, потому что изображения с DAPI используются для иллюстрации поперечных сечений сердца, которые удобны для очерчивания области миокарда, но не для расчета плотности флуоресценции. - Нажмите на Экспозиция всего сканирования (мс)-FITC | Автоэкспонирование.
ПРИМЕЧАНИЕ: Нажмите на Полное сканирование Экспозиция (мс) - Техасский красный | Автоэкспонирование при использовании EB. Важно помнить и следить за тем, чтобы время воздействия FITC или Texas Red было одинаковым на всех слайдовых сканированиях. - Нажмите « Автофокус» еще раз и убедитесь, что слайд находится в фокусе.
- Нажмите на кнопку «Назад » и сохраните протокол.
- Повторите шаги 5.7-5.14 для каждого слайда.
- Вернитесь на главную страницу и нажмите « Сканировать слайды».
- Выберите слот, переименуйте все слайды и выберите соответствующий протокол экспозиции для каждого слайда.
- Отсканируйте слайды и сделайте снимки.
- Откройте изображения с помощью программы для просмотра слайдов для сканирования (см. Таблицу материалов).
- Увеличьте все изображения в относительно равной степени.
- Делайте снимки и сохраняйте изображения как .tiff.
ПРИМЕЧАНИЕ: Лучше сохранять изображения с масштабными линейками и без них одновременно. Изображения с масштабными линейками могут быть использованы для публикации, а изображения без масштабных линеек — для статистического анализа. - Откройте программу ImageJ, нажмите « Анализ» и выберите «Установить измерение».
- Выбрать область | Интегрированная плотность.
- Откройте изображение в канале FITC с помощью Image J.
- Нажмите « Анализ» еще раз и запишите появившееся числовое значение интегрированной плотности (IntDen).
ПРИМЕЧАНИЕ: Поскольку масштабные линейки на изображениях могут быть ошибочно приняты компьютерами за оттенки серого флуоресценции, используйте изображения без масштабных линеек для измерения IntDen. - Закройте образ FITC и откройте образ в канале DAPI.
- Наметьте контур поперечного сечения миокарда.
- Нажмите « Анализировать и собирать данные по площади ».
- Рассчитайте отношения IntDen/Area (среднее значение флуоресценции) для каждого сердца.
- Вводите все коэффициенты в программное обеспечение для статистического анализа.
Результаты
Перед проведением анализа FITC-декстрана для оценки изменений проницаемости эндотелия сердца после ИР мы настоятельно рекомендуем провести эксперименты тем же исследователем, специализирующимся на создании модели ИР миокарда у крыс, чтобы подтвердить, что коронарные артерии успешно окклюзируются в одном и том же положении, а соотношение площади ишемии/общей площади является постоянным у всех крыс. Как показано на рисунках 1А,В, сердце (обозначено желтой стрелкой) было обнажено, а в миокарде, расположенном в передней стенке левого желудочка, примерно в 2 мм под краем придатка левого предсердия, образовалась петля (обозначена зеленой стрелкой) с капиллярной силиконовой трубкой 0,5 мм (внутренний диаметр) и швом 6-0. Как видно на рисунке 1В, когда петля была закреплена, ишемизированный миокард сразу же превратился из розового в серовато-розовый (обозначен белой стрелкой).
Более того, миокард реперфузировал и восстановил свой розовый цвет сразу после того, как петля была ослаблена, как показано на рисунке 1D. После ослабления петли был сделан разрез, параллельный длинной оси бедренной кости во внутренней части бедра. Бедренная вена была обнажена и проколота инсулиновым шприцем, как показано на рисунках 2A, B. После 3-часовой реперфузии был сделан V-образный разрез в нижней части брюшной полости, а аорта брюшной полости и полая вена были рассечены из брюшины (Рисунок 3A). Холодный физиологический раствор был аккуратно введен в полую вену, а брюшная аорта была разрезана, чтобы предотвратить чрезмерное растяжение стенки желудочка из-за внутрижелудочкового давления, которое могло бы повлиять на ее гистопатологическую структуру. Обесцвеченные легкие (красная стрелка на рисунке 3B) и печень на рисунке 3C указывают на то, что ткань была хорошо реперфузирована физиологическим раствором.
Следовательно, не было существенной разницы в площади поперечного сечения между тремя группами: 1,00 ± 0,08 в группе Шам против 0,97 ± 0,08 в группе IR против 1,02 ± 0,04 в группе IR+TXL (рис. 4A, n = 6 в каждой группе, p > 0,05 между любыми двумя группами). Как показано на рисунке 4B, C, средняя интенсивность зеленой флуоресценции во всех срезах у фиктивных крыс была чрезвычайно низкой. Напротив, флуоресценция, испускаемая экстравазированным FITC-декстраном, заметно увеличилась в группе ИК, нормализованной к группе Шама (5,52 ± 0,85 в группе ИК против 1,00 ± 0,19 в группе Шама, n = 6, p < 0,05). Кроме того, сверхдисперсный порошок TXL, который, как известно, защищает сердечный микрососудистый эндотелий14,16, заметно обратил вспять более высокую интенсивность флуоресценции, индуцированную IR (2,87 ± 0,52 в группе IR+TXL против 5,52 ± 0,85 в группе IR, n = 6, p < 0,05). Изображения регионарного миокарда показали, что FITC-декстран в подавляющем большинстве накапливается во внеклеточном матриксе, но не в микрососудах, и что TXL улучшает функцию эндотелиального барьера (рис. 5).
По сравнению с FITC-декстраном, EB может быть неоптимальной альтернативой, поскольку EB уступает 70 000 Да FITC-декстрана как по качеству изображения, так и по чувствительности. Аналогичным образом, не было существенной разницы в площади поперечного сечения между тремя группами: 1,00 ± 0,08 в группе Шама против 0,97 ± 0,08 в группе IR против 0,98 ± 0,05 в группе IR+TXL (дополнительный рисунок S1A, n = 6 в каждой группе, p > 0,05 между любыми двумя группами). Как показано на дополнительном рисунке S1B,C, средняя интенсивность красной флуоресценции в целых срезах у крыс Сима была относительно выше, особенно в эндокарде и эпикарде. Несмотря на то, что красная флуоресценция, испускаемая ЭБ, резко возросла в группе ИК (4,41 ± 0,66 в группе ИК против 1,00 ± 0,22 в группе Шам, n = 6, p < 0,05), разница между группами ИК+TXL и ИР не была значимой (3,73 ± 0,47 в группе ИК+TXL против 4,41 ± 0,66 в группе ИК, n = 6, p = 0,0956).
Кроме того, этот метод был протестирован на модели инфаркта миокарда (ИМ) (дополнительный рисунок S2). В группе Iинфаркции I инъекции Iинъекции Мйокарда (MII) раствор ФИТК-декстрана (в той же концентрации, о которой говорилось ранее) вводили в кровоток за 5 мин до лигирования ПМЖ. Это отличалось от раствора FITC-декстрана, вводимого сразу после лигирования крысам MIL (сначала Myocardial nfarction Ligation), описанному ранее в этом протоколе. Интересно, что только низкие количества FITC-декстрана экстравазировались в ВКМ поврежденного миокарда у крыс с ИМ обеих групп, о чем свидетельствует слабая интенсивность зеленой флуоресценции на дополнительном рисунке S2.
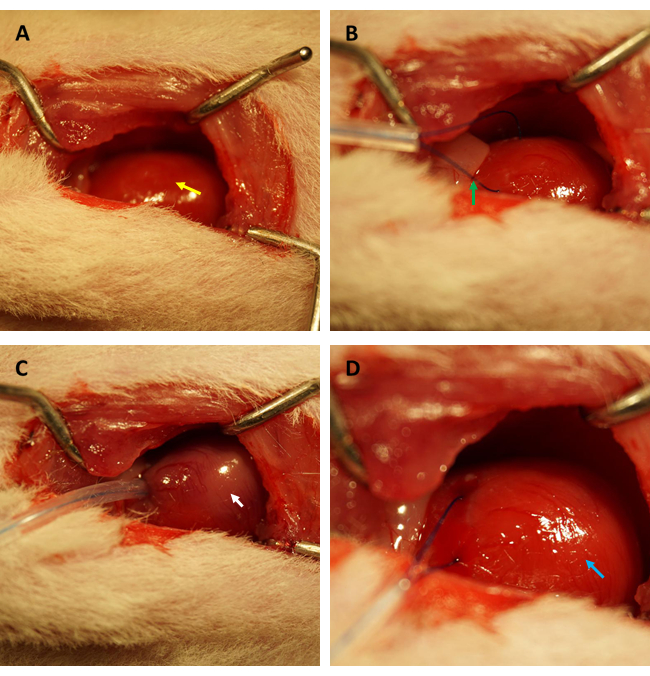
Рисунок 1: Визуальное поле торакотомии и установление ишемии/реперфузии на модели крысы. (А) Обнажение сердца крысы (обозначено желтой стрелкой); (В) образуя петлю для огибания коронарной артерии (обозначена зеленой стрелкой); (В) закрепление петли и индуцирование ишемии миокарда в течение 45 мин (обозначено белой стрелкой); (D) ослабление петли и разрешение на реперфузию миокарда в течение 3 ч (обозначено синей стрелкой). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
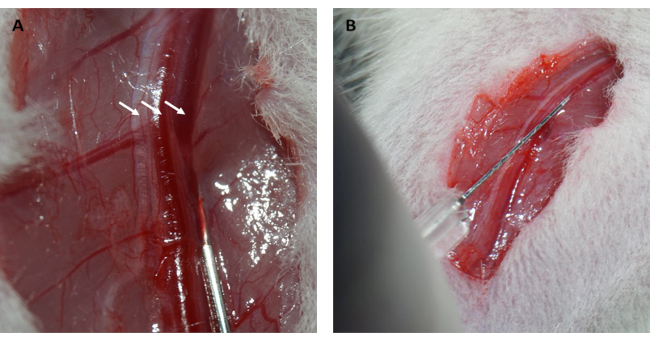
Рисунок 2: Рассечение бедренной вены и внутривенное введение. (А) Обнажение бедренной вены (бедренный нерв обозначен стрелкой слева; бедренная артерия обозначена стрелкой посередине; бедренная вена обозначена стрелкой справа). (В) Введение раствора ФИТК-декстрана в бедренную вену с помощью инсулинового шприца. Сокращение: FITC = флуоресцеин изотиоцианат. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Перфузия тканей и симптомы эффективной перфузии. (А) Рассечение брюшной аорты и полой вены (брюшная аорта обозначена белой стрелкой; полая вена обозначена черной стрелкой). (B) Обесцвеченные легкие являются симптомом адекватной перфузии; (В) обесцвеченная слизистая оболочка, обесцвеченная почка и потливость печени – все это симптомы адекватной перфузии (красная стрелка: слизистая; белая стрелка: печень; черная стрелка: почка). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
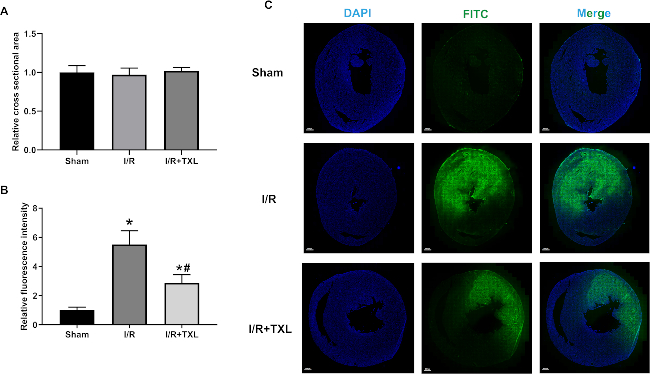
Рисунок 4: Репрезентативные изображения и анализ средней интенсивности флуоресценции с помощью окрашивания FITC-декстраном. (A) Относительная площадь поперечного сечения каждой группы нормализована по отношению к площади группы Шама (p > 0,05); (B) относительная интенсивность флуоресценции в канале FITC каждой группы, нормированная по отношению к интенсивности фиктивной группы; (C) репрезентативные изображения с 9,5-кратным увеличением в каждой группе. Масштабные линейки = 800 μм. Односторонняя ANOVA с постфактум множественными сравнениями Тьюки. * против группы «Шам», p < 0,05; # против IR-группы, p < 0,05. Гистограммы показывают среднее значение группы ± SD. Сокращения: IR = ишемия/реперфузия; TXL = Tongxinluo; FITC = флуоресцеин изотиоцианат; DAPI = 4',6-диамидино-2-фенилиндол; ANOVA = дисперсионный анализ; SD = стандартное отклонение. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
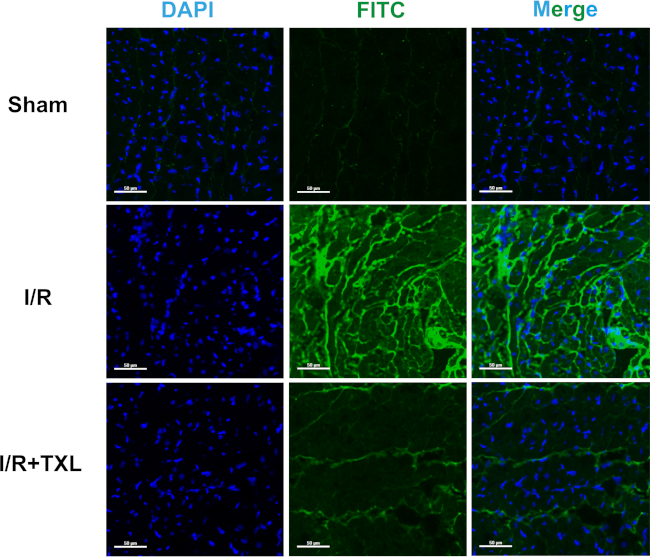
Рисунок 5: Репрезентативные изображения областей интереса при 200-кратном увеличении каждой группы после окрашивания FITC-декстраном. Масштабные линейки = 50 μм. Сокращения: FITC = флуоресцеин изотиоцианат; DAPI = 4',6-диамидино-2-фенилиндол. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный рисунок S1: Репрезентативные изображения и анализ средней интенсивности флуоресценции с помощью окрашивания синим цветом Эванса. (A) Относительная площадь поперечного сечения каждой группы, нормированная по площади группы Шама (p > 0,05); (В) относительная интенсивность флуоресценции в красном канале Техаса каждой группы, нормализованная к интенсивности Фальшивой группы; (В) репрезентативные изображения в каждой группе. Односторонняя ANOVA с постфактум множественными сравнениями Тьюки. Масштабные линейки = 800 мкм. * по сравнению с группой Шама, p < 0,05. Гистограммы показывают среднее значение группы ± SD. Сокращения: IR = ишемия/реперфузия; TXL = Tongxinluo; DAPI = 4',6-диамидино-2-фенилиндол; ANOVA = дисперсионный анализ; SD = стандартное отклонение. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S2: Репрезентативные изображения при 9,5-кратном увеличении окрашивания FITC-декстрана в модели инфаркта миокарда. Масштабные линейки = 800 μм. Сокращения: MII = инфаркт миокарда сначала (ввести ФИТК-декстран перед инфарктом миокарда); MIL = сначала лигирование инфаркта миокарда (введение FITC-декстрана сразу после инфаркта миокарда); FITC = флуоресцеин изотиоцианат; DAPI = 4',6-диамидино-2-фенилиндол. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
В данной работе представлен протокол оценки дисфункции эндотелиального барьера сердца после воздействия MIRI. Следует отметить, что в этом протоколе есть несколько важнейших этапов, которые определяют надежность и точность результатов. Все действия, связанные с FITC-декстраном, должны выполняться в темной комнате. Растворы ФИТК-декстрана/физиологического раствора должны храниться при температуре 4 °C и упаковываться в оловянную фольгу. Кроме того, коронарные артерии должны быть перевязаны, как показано на рисунке 1, чтобы миокард мог быть реперфузирован сразу после ослабления петли. Исследователи могут выбрать полиэтиленовые шовные нити 5-0 или 6-0, потому что более тонкие нити ниже 7-0 с большей вероятностью перережут волокна миокарда и сосуды. Важно, чтобы раствор индикатора вводился в бедренные вены, а не в хвостовые вены. Каждое сердце должно быть хорошо пропитано и хорошо промыто ледяным физиологическим раствором до и после жертвоприношения соответственно.
Многие исследователи, специализирующиеся на МИРИ, склонны изучать нарушенную субклеточную структуру эндотелия на ранней стадии реперфузии миокарда — образование апоптотических тел, набухание митохондрий и аномальных межклеточных соединений — чтобы доказать гиперпроницаемость эндотелия с помощью электронно-микроскопического исследования. Иммуноблоттинг также используется для измерения проницаемости микрососудов, поскольку снижение уровня плотных соединительных белков рассматривается как основной механизм повреждения эндотелия и нарушения эндотелиального барьера с течением времени. Например, VE-кадгерин20 и β-катенин21 являются ключевыми элементами эндотелиальных межклеточных адгезионных соединений, и эти соединения способствуют поддержанию целостности сосудов22. Плотные соединения, такие как JAM-A23,24 и окклюдин25, также совместно участвуют в построении эндотелиального барьера в системе кровообращения.
В настоящее время все большее число исследований показывают, что митохондриальная функция и митохондриальный гомеостаз могут быть ключевыми мишенями защитных путей против реперфузионного повреждения. Как сообщается в патофизиологических и фармакологических исследованиях, митофагия может играть важную роль в клеточной гибели эндотелия и миокарда, вызванной IR26. Кроме того, деление митохондрий, митохондриальный протеостаз и контроль качества митохондрий могут защитить миокард высокого риска в реперфузных областях 27,28. Вышеуказанные методы в большей степени сосредоточены на демонстрации различных механизмов или причин гиперпроницаемости, чем на непосредственном и визуальном отображении эндотелиальной проницаемости. Кроме того, подготовка образцов для электронно-микроскопического исследования сложна и опасна. Растворы глутаральдегида, ацетона и осмиевой кислоты, используемые в электронной микроскопии, вероятно, улетучиваются и разрушают слизистую оболочку, конъюнктиву и кожу, даже угрожая жизни при использовании в неконтролируемых условиях.
По сравнению с этими косвенными и опасными для жизни методами, этот метод, который измеряет интенсивность флуоресценции, испускаемой экстравазацией FITC-декстрана, идеально подходит для оценки проницаемости сердечных микрососудов. Во-первых, 70 000 Da FITC-декстран не могут проникнуть через эндотелий при нормальных физиологических условиях, но могут проникать в интерстициальное пространство миокарда под воздействием ИК, что позволяет провести четкую дифференциацию между крысами при различном лечении. Кроме того, раствор ФИТК-декстрана вводится в кровь через бедренные вены, что гарантирует, что вся жидкость будет введена в кровоток крысы. Напротив, инъекция хвостовой вены у крыс более сложна, потому что хвостовая вена нечеткая и покрыта толстым слоем. Кроме того, в отличие от регулярной фиксации параформальдегида и закладки парафина, лечение тканей миокарда упрощается и оптимизируется с использованием техники патологического среза быстрой заморозки, используемой в данном исследовании. Короткое время хранения, светонепроницаемая среда и криоконсервация могут в совокупности облегчить гашение флуоресценции FITC.
Что еще более важно, этот метод может свести к минимуму систематическую ошибку отбора во время статистического анализа. Мы проводим перфузию сердца физиологическим раствором, чтобы гарантировать, что почти вся кровь, смешанная с FITC-декстраном, спринцевается из миокарда и камер сердца, что может устранить флуоресценцию, излучаемую любым FITC, оставшимся в сосудах. Если это не так, флуоресценцию, сросшуюся с капиллярами, следует исключить и обрезать искусственно. При сборе ткани из областей интереса не наблюдалось визуальной границы между ишемизированным миокардом и отдаленным миокардом, особенно после окрашивания красителем EB. Это затруднило сбор проб из этих репрезентативных районов. Используя описанный здесь метод, исследователи могут получать изображения целых срезов и анализировать интенсивность флуоресценции с помощью количественного слайдерного сканера.
Интересно, что EB-краситель может быть альтернативой, хотя и неоптимальной, FITC-декстрану. По сравнению с относительно жесткими условиями хранения ФИТК-декстрана, порошок БЭ или его раствор может оставаться стабильным при комнатной температуре в течение длительного времени. Кроме того, EB относительно недорог для большинства учреждений. Тем не менее, определенные недостатки могут ограничить его применение. Во-первых, окрашивание EB показывает меньшую чувствительность, чем FITC-декстран, что может недооценивать различия между группами и увеличивать размер выборки каждой группы. Кроме того, БЭ демонстрирует более сильную адгезию к белкам. Эндокард и эпикард легче окрашиваются БЭ, что может влиять на результаты плотности флуоресценции. Кроме того, явные дефекты заполнения в области реперфузии заметно снижают качество изображения, что может ограничить использование БЭ.
Чтобы расширить возможности применения этого метода в модели ИМ, метод был протестирован на модели ИМ. Сначала ФИТК-декстран вводили в кровеносные сосуды после лигирования ПМЖ. Как и ожидалось, из среза был выделен низкий уровень флуоресценции, поскольку ФИТК-декстран в кровотоке не может пройти через лигированный участок, и ни один ФИТК-декстран не проник в ишемическую зону. ФИТК-декстран также применяли за 5 минут до лигирования, чтобы обеспечить прохождение ФИТК-декстрана во все органы. Следовательно, ФИТК-декстран не смог проникнуть в микрососудистый эндотелий, вероятно, потому, что никакое перфузионное давление в перевязанных кровеносных сосудах не может провести ФИТК-декстран через эндотелий. В целом, этот метод, вероятно, требует значительно большей модификации для удовлетворения его применения в модели MI.
Несмотря на вышеперечисленные преимущества, у этого метода есть и ограничения. Во-первых, этот протокол не был протестирован на IR-моделях других животных, что может ограничить его применение в доклинических и клинических исследованиях. Во-вторых, красители, меченные FITC, дороже, чем другие распространенные красители, такие как EB. Однако, в отличие от БЭ, поскольку 10% w/v раствор ФИТК-декстрана, разведенный сывороткой, редко изменяет цвет миокарда, окрашивание ФИТК-декстрана и двойное окрашивание EB/2,3,5-трифенилтетразола хлорида (ТТС) могут проводиться в одном и том же сердце, что может сократить бюджет в отношении количества животных и используемых красителей. Наконец, сканер предметных стекол, используемый в этом исследовании - количественный сканер предметных стекол и аналогичные инструменты - может быть недоступен в некоторых лабораториях. Таким образом, данный протокол представляет собой упрощенный, надежный и визуальный метод определения проницаемости эндотелия сердечного микрососуда в ИК-модели у крыс с использованием флуоресцентного анализа, основанного на автоматизированной системе количественной визуализации патологии. Этот протокол демонстрирует, что 70 000 Да ФИТК-декстран работает лучше, чем БЭ, при функциональной оценке эндотелиального барьера сердечных микрососудов после ИР-повреждения.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Данное исследование было поддержано грантами Национальной программы ключевых исследований и разработок Китая (No 2017YFC1700503) и Национального фонда естественных наук Китая (No 81874461 и No 81774292).
Материалы
| Name | Company | Catalog Number | Comments |
| 16 G Angiocather | Becton Dickinson, USA | 2089312 | |
| 3-0 polypropylene suture, taper needle | Ethicon, USA | KGP693 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Invitrogen, USA | D3571 | Alternative to Mounting medium with DAPI |
| 6-0 polypropylene suture, round needle | Ethicon, USA | KGJ656 | |
| Adhesive Microscope Slides | CITOTEST, China | 188105 | |
| ALC-V8S Ventilator | Shanghai Alcott Biotech, China | ALC-V8S | |
| Constant Temperature Warming System | Shanghai Alcott Biotech, China | ALC-HTP203 | |
| Dissecting Forceps-Large Cvd | RWD life Science, China | F12007-10 | |
| Dissecting Forceps-Str | RWD life Science, China | F12005-10 | |
| FITC-dextran, 70,000Da | Sigma-Aldrich, USA | 53471 | |
| Hair Removal Cream | Nair, USA | N/A | |
| Insulin Syringe,1ml | Becton Dickinson, USA | 8155672 | |
| Microneedle holders | RWD life Science, China | F31047-12 | |
| Mosquito Forceps-Cvd | RWD life Science, China | F22007-12 | |
| Mounting medium with DAPI | ZSGB-BIO, China | ZLI-9557 | |
| Multi-position Fiber Optic Illuminator System | RWD life Science, China | 76301 | |
| Operating Scissors | RWD life Science, China | S14014-12 | |
| Pannoramic SCAN | 3DHISTECH, Budapest, Hungary | SC150-211305 | Alternative slide scan to Vectra Polaris |
| Phenochart 1.0.8 | PerkinElmer, USA | N/A | Slide viewer software |
| Phosphate buffered saline | HyClone,USA | SH30256.01 | |
| Retractors,30mm Spread,5cm | RWD life Science, China | F22005-45 | |
| SP8 Confocal microscope | Leica, German | TCS-SP8 SR | Alternative to Vectra Polaris |
| Surgical tape | 3M, USA | 1527C-0 | |
| Tissue-Tek O.C.T. Compound | SAKURA,Japan | 0822-00 | |
| Tongxinluo superfine powder | Yiling, China | Z19980015 | |
| Ultraviolet Freezing Slicer | Leica, German | CM1950 | |
| Vectra Polaris 1.0.7 software | PerkinElmer, USA | N/A | Slide scan software |
| Vectra Polaris Quantitative Slide Scanner | PerkinElmer, USA | VP1814N1068 |
Ссылки
- Yellon, D. M., Hausenloy, D. J. Myocardial reperfusion injury. New England Journal of Medicine. 357 (11), 1121-1135 (2007).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: a target for cardioprotection. Cardiovascular Research. 115 (7), 1143-1155 (2019).
- Tada, Y., Yang, P. C. Myocardial edema on T2-weighted MRI: new marker of ischemia reperfusion injury and adverse myocardial remodeling. Circulation Research. 121 (4), 326-328 (2017).
- Chandrasekar, B., Smith, J. B., Freeman, G. L. Ischemia-reperfusion of rat myocardium activates nuclear factor-KappaB and induces neutrophil infiltration via lipopolysaccharide-induced CXC chemokine. Circulation. 103 (18), 2296-2302 (2001).
- Li, X. -D., et al. Tongxinluo reduces myocardial no-reflow and ischemia-reperfusion injury by stimulating the phosphorylation of eNOS via the PKA pathway. American Journal of Physiology. Heart and Circulatory Physiology. 299 (4), 1255-1261 (2010).
- Pei, H., et al. TNF-α inhibitor protects against myocardial ischemia/reperfusion injury via Notch1-mediated suppression of oxidative/nitrative stress. Free Radical Biology & Medicine. 82, 114-121 (2015).
- Liao, Y. -H., et al. Interleukin-17A contributes to myocardial ischemia/reperfusion injury by regulating cardiomyocyte apoptosis and neutrophil infiltration. Journal of the American College of Cardiology. 59 (4), 420-429 (2012).
- Pedersen, S. F., et al. Assessment of intramyocardial hemorrhage by T1-weighted cardiovascular magnetic resonance in reperfused acute myocardial infarction. Journal of Cardiovascular Magnetic Resonance. 14 (1), 59(2012).
- Fang, L., et al. Differences in inflammation, MMP activation and collagen damage account for gender difference in murine cardiac rupture following myocardial infarction. Journal of Molecular and Cellular Cardiology. 43 (5), 535-544 (2007).
- Xu, Y., et al. Quantifying blood-brain-barrier leakage using a combination of evans blue and high molecular weight FITC-Dextran. Journal of Neuroscience Methods. 325, 108349(2019).
- Li, B. -R., et al. In vitro and in vivo approaches to determine intestinal epithelial cell permeability. Journal of Visualized Experiments. (140), e57032(2018).
- Yao, L., Xue, X., Yu, P., Ni, Y., Chen, F. Evans Blue dye: a revisit of its applications in biomedicine. Contrast Media & Molecular Imaging. 2018, 7628037(2018).
- Roberts, L. N. Evans blue toxicity. Canadian Medical Association Journal. 71 (5), 489-491 (1954).
- Qi, K., et al. Tongxinluo attenuates reperfusion injury in diabetic hearts by angiopoietin-like 4-mediated protection of endothelial barrier integrity via PPAR-α pathway. PLoS One. 13 (6), 0198403(2018).
- Zhang, H. -T., et al. No-reflow protection and long-term efficacy for acute myocardial infarction with Tongxinluo: a randomized double-blind placebo-controlled multicenter clinical trial (ENLEAT Trial). Chinese Medical Journal (English). 123 (20), 2858-2864 (2010).
- Cui, H., et al. Induction of autophagy by Tongxinluo through the MEK/ERK pathway protects human cardiac microvascular endothelial cells from hypoxia/reoxygenation injury. Journal of Cardiovascular Pharmacology. 64 (2), 180-190 (2014).
- Chen, G. -H., et al. Inhibition of miR-128-3p by Tongxinluo protects human cardiomyocytes from ischemia/reperfusion injury via upregulation of p70s6k1/p-p70s6k1. Frontiers in Pharmacology. 8, 775(2017).
- Yu, Z. -H., et al. PI3K/Akt pathway contributes to neuroprotective effect of Tongxinluo against focal cerebral ischemia and reperfusion injury in rats. Journal of Ethnopharmacology. 181, 8-19 (2016).
- Yang, H. -X., Wang, P., Wang, N. -N., Li, S. -D., Yang, M. -H. Tongxinluo ameliorates myocardial ischemia-reperfusion injury mainly via activating Parkin-mediated mitophagy and downregulating ubiquitin-proteasome system. Chinese Journal of Integrative Medicine. , (2019).
- Pulous, F. E., Grimsley-Myers, C. M., Kansal, S., Kowalczyk, A. P., Petrich, B. G. Talin-dependent integrin activation regulates VE-cadherin localization and endothelial cell barrier function. Circulation Research. 124 (6), 891-903 (2019).
- Cong, X., Kong, W. Endothelial tight junctions and their regulatory signaling pathways in vascular homeostasis and disease. Cellular Signaling. 66, 109485(2020).
- Giannotta, M., Trani, M., Dejana, E. VE-cadherin and endothelial adherens junctions: active guardians of vascular integrity. Developmental Cell. 26 (5), 441-454 (2013).
- Monteiro, A. C., Parkos, C. A. Intracellular mediators of JAM-A-dependent epithelial barrier function. Annals of the New York Academy of Sciences. 1257, 115-124 (2012).
- Kakogiannos, N., et al. JAM-A acts via C/EBP-α to promote Claudin-5 expression and enhance endothelial barrier function. Circulation Research. 127 (8), 1056-1073 (2020).
- Feldman, G. J., Mullin, J. M., Ryan, M. P. Occludin: structure, function and regulation. Advanced Drug Delivery Reviews. 57 (6), 883-917 (2005).
- Zhou, H., et al. NR4A1 aggravates the cardiac microvascular ischemia reperfusion injury through suppressing FUNDC1-mediated mitophagy and promoting Mff-required mitochondrial fission by CK2α. Basic Research in Cardiology. 113 (4), 23(2018).
- Wang, J., Toan, S., Zhou, H. Mitochondrial quality control in cardiac microvascular ischemia-reperfusion injury: New insights into the mechanisms and therapeutic potentials. Pharmacological Research. , 156(2020).
- Zhu, H., et al. Phosphoglycerate mutase 5 exacerbates cardiac ischemia-reperfusion injury through disrupting mitochondrial quality control. Redox Biology. 38, 101777(2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены