Method Article
Dosage de fluorescence pour l’évaluation de la perméabilité d’une barrière endothéliale microvasculaire cardiaque dans un modèle d’ischémie/reperfusion chez le rat
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici, nous décrivons une méthode pour évaluer fonctionnellement la barrière endothéliale des microvaisseaux cardiaques après une lésion d’ischémie/reperfusion via la mesure de l’intensité moyenne de fluorescence de 70 000 Da FITC-dextran extravasé par rapport au bleu d’Evans.
Résumé
Les thérapies de revascularisation des artères coupables, indépendamment de l’intervention coronarienne percutanée et du pontage aorto-coronarien, sont considérées comme la meilleure stratégie pour améliorer le pronostic clinique des patients atteints de syndrome coronarien aigu (SCA). Néanmoins, la reperfusion myocardique après une revascularisation efficace peut déclencher une mort importante des cardiomyocytes et un collapsus endothélial coronarien, connu sous le nom de lésion d’ischémie/reperfusion myocardique (MIRI). Habituellement, les cellules endothéliales et leurs jonctions intercellulaires serrées maintiennent en coopération la barrière endothéliale microvasculaire et sa perméabilité relativement faible, mais échouent dans les zones de reperfusion.
L’hyperperméabilité endothéliale microvasculaire induite par l’ischémie/reperfusion (IR) contribue à l’œdème myocardique, à l’augmentation de l’infiltration des cellules pro-inflammatoires et à l’aggravation de l’hémorragie intramyocardique, ce qui peut aggraver le pronostic du SCA. Le traceur utilisé dans cette étude – 70 000 Da FITC-dextran, une molécule de glucose ramifiée marquée par l’isothiocyanate de fluorescéine (FITC) – semble trop grand pour s’infiltrer dans l’endothélium microvasculaire cardiaque dans des conditions normales. Cependant, il est capable de s’infiltrer dans une barrière brisée après MIRI. Ainsi, plus la perméabilité endothéliale est élevée, plus le FITC-dextran s’accumule dans l’espace intercellulaire extravasculaire. Ainsi, l’intensité de la fluorescence de la FITC peut indiquer la perméabilité de la barrière endothéliale microvasculaire. Ce protocole tire parti de FITC-dextran pour évaluer fonctionnellement la barrière endothéliale microvasculaire cardiaque, qui est détectée par un système automatisé d’imagerie quantitative de pathologie.
Introduction
Le fait qu’un nombre croissant de patients atteints de maladies coronariennes bénéficient de thérapies de revascularisation depuis des décennies n’annule pas les conséquences fatales de l’IRMI. Comme décrit par Yellon et Hausenloy, environ 30 % de la taille finale de l’infarctus peut être attribuée à MIRI1. La dysfonction endothéliale microvasculaire cardiaque est le mécanisme central sous-jacent à l’IRIM et au phénomène de « non-refusion » et est la cible de nombreux agents cardioprotecteurs et des voies cardioprotectrices classiques2. De plus, l’hyperperméabilité endothéliale des microvaisseaux peut déclencher un œdème myocardique3 et la sur-infiltration de cellules pro-inflammatoires, notamment les neutrophiles4, les macrophages et les erthrocytes5.
Le stress oxydatif induit par MIRI et les cytokines pro-inflammatoires surexprimées, telles que les membres dela famille 6 du facteur de nécrose tumorale et dela famille 7 de l’interleukine, activent les voies de signalisation de l’apoptose cellulaire pour accélérer la mort du myocarde ischémique. Les érythrocytes pénètrent la barrière endothéliale vulnérable et s’accumulent dans la matrice extracellulaire (MEC) pour former un hématome intramyocardique8. Les métalloprotéinases matricielles dérivées de macrophages et de neutrophiles désassemblent le collagène dans l’ECM, ce qui augmente le risque de complication mécanique et d’anévrisme ventriculaire post-infarctus9. Ainsi, la perméabilité de la barrière endothéliale est un signe crucial pour l’évaluation pronostique de l’infarctus aigu du myocarde et marque la gravité de l’IRM dans une certaine mesure.
Le FITC-dextran est un ensemble de polysaccharides composé de différentes longueurs de molécules de glucose ramifiées de poids moléculaire allant de 4 000 Da à 70 000 Da. Il est largement utilisé comme traceur standard pour démontrer la perméabilité des membranes cellulaires, des barrières physiologiques fonctionnelles telles que la barrière hémato-encéphalique10 et des muqueuses11 dans des traitements spécifiques et des conditions pathologiques. La perméabilité d’une membrane spécifique varie pour différentes substances en fonction de leur poids moléculaire. Habituellement, l’albumine est limitée aux microvaisseaux cardiaques ; cependant, il peut pénétrer dans l’endothélium au stade précoce de l’IR, provoquant un œdème myocardique. Comme le poids moléculaire de l’albumine est d’environ 68 000 Da, 70 000 Da FITC-dextran serait un agent approprié pour démontrer l’hyperperméabilité endothéliale après IR. De plus, le dextran a été largement adopté pour maintenir le volume sanguin et la pression osmotique colloïdale des patients en choc, et les traceurs marqués par FITC sont utilisés dans de nombreuses études in vivo ou in vitro avec peu d’effets indésirables.
En plus du FITC-dextran, la perméabilité endothéliale a été mesurée par coloration au bleu d’Evans (EB). Après injection dans la circulation sanguine, l’EB se lie étroitement à l’albumine sérique et forme un complexe12. Ainsi, ce complexe EB-albumine, et non l’EB seul, peut être utilisé pour la mesure de la perméabilité, ce qui signifie que la précision d’une telle méthode basée sur l’EB peut être influencée par différentes concentrations d’albumine sérique chez les sujets expérimentaux. De plus, il a été signalé que l’EB empoisonne les organes d’animaux de laboratoire, en particulier le cœur, le foie et les poumons, via la dégénérescence cellulaire et l’augmentation de la perméabilité vasculaire13. L’endothélium subissant une ischémie/reperfusion serait plus sensible à de tels effets néfastes que l’endothélium normal, ce qui peut fausser la signification des résultats expérimentaux.
Par rapport au colorant EB, le FITC-dextran est exogène et l’affinité de liaison avec l’albumine est négligeable. Par conséquent, le FITC-dextran reste à l’état libre et n’est pas lié aux macromolécules, telles que l’albumine et les protéines tissulaires. Ainsi, s’il est administré en fonction du poids corporel, le FITC-dextran peut fonctionner à une concentration sanguine égale et n’est pas affecté par les différences individuelles de concentration d’albumine sérique et de volume sanguin. Tongxinluo (TXL), une médecine traditionnelle chinoise, a été utilisé pour tester la sensibilité diagnostique de cette méthode. TXL réduit l’IRM en maintenant l’ultrastructure cellulaire endothéliale et l’intégrité de la barrière endothéliale14. TXL est également utilisé pour soigner l’angine de poitrine et améliorer cliniquement la non-refusion myocardique après un infarctus15. Il contient du Radix ginseng, Buthus martensi, Hirudo, Eupolyphaga seu steleophaga, Scolopendra subspinipes, Periostracum cicadae, Radix paeoniae rubra, Semen ziziphi spinosae, Lignum dalbergiae odoriferae, Lignum santali albi et Borneolum syntheticum. Il a été démontré que TXL protège l’endothélium microvasculaire via la voie MEK/ERK16 et les mécanismes endothéliales médiés par l’oxyde nitrique synthase 5,17 et atténue les lésions d’ischémie/reperfusion (IRI) des organes18, en particulier le cœur, de manière dose-dépendante. Ici, des rats ont été nourris avec 0,5 g/kg de poudre TXL (une dose équivalente à celle utilisée cliniquement chez l’homme) comme décrit19. Cet article propose une méthode pour évaluer fonctionnellement la barrière endothéliale des microvaisseaux cardiaques après IR via la mesure de l’intensité de fluorescence totale du FITC-dextran extravasé de 70 000 Da par rapport à l’EB.
Protocole
Les expériences sur les animaux ont été effectuées conformément au « Guide for the Care and Use of Laboratory Animals » publié par les National Institutes of Health des États-Unis (Bethesda, MD, USA, NIH Publication No. 85-23, révisée en 1996) et au « Regulation to the Care and Use of Experimental Animals » du Beijing Council on Animal Care (1996). Le protocole de l’étude a été approuvé par le Comité de soins aux animaux d’expérimentation de l’hôpital de Fuwai. Des rats Sprague-Dawley mâles de classe SPF (rats SD) pesant de 150 à 180 g ont été utilisés dans cette étude.
1. Préparation des réactifs, des matériaux et des équipements
- Préparez des réactifs et des solutions comprenant de l’éthanol à 70 %, du FITC-dextran (70 000 Da, dissous dans une solution saline glacée pour obtenir une solution à 10 % p/v à utiliser), une crème dépilatoire, un milieu de montage avec du 4',6-diamidino-2-phénylindole (DAPI, 0,5-10 μg/mL), une solution EB/saline à 1 % p/v et une solution saline de pentobarbital sodique/saline à 5 % p/v (stockée à 4 °C dans l’obscurité).
- Stérilisez tous les outils et matériaux chirurgicaux à l’avance, y compris le ruban chirurgical ; tampons de gaze ; gants chirurgicaux ; Sonde endotrachéale de 16 G ; seringue à insuline ; faire fonctionner des ciseaux ; grande pince de dissection incurvée ; pince à dissection droite ; pince à moustiques droite ; pince à moustiques incurvée ; écarteurs (30 mm d’écartement) ; Porte-micro-aiguilles de 5 cm ; Suture en polypropylène 3-0 (aiguille conique) ; et suture en polypropylène 6-0 (aiguille ronde).
- Vérifiez et assurez-vous que tout l’équipement, y compris le système de réchauffement à température constante, le système d’éclairage, le ventilateur, le système automatisé d’imagerie quantitative de pathologie et la trancheuse de congélation par ultraviolets, est en bon état.
2. Préparation des rats aux interventions chirurgicales
- Divisez tous les rats SD en groupe Sham, groupe IR et groupe TXL (groupe IR+TXL) au hasard.
REMARQUE : Dans ce protocole, six rats ont été répartis au hasard dans chaque groupe, n = 6. - Pesez chaque rat SD, notez le poids et calculez la dose de TXL à administrer pour chaque rat.
- Administrer de l’ibuprofène à une dose de 30 mg/kg par gavage à chaque rat au moins 12 heures avant la thoracotomie pour soulager la douleur et la détresse préopératoires.
- Administrer une poudre ultrafine de TXL à une dose de 0,5 g/kg par gavage 12 h et 1 h à chaque rat SD du groupe IR+TXL avant l’anesthésie, comme décrit19.
- Désinfectez la table d’opération avec de l’éthanol à 70 % et placez les outils et matériaux chirurgicaux stérilisés sur la surface désinfectée.
- Ajustez la température du système de réchauffement à température constante pour maintenir la température corporelle des rats à 37 ± 1 °C.
3. Établir un modèle d’ischémie/reperfusion cardiaque chez le rat
- Injecter une solution saline tamponnée au sodium et au phosphate (PBS) à 50 mg/kg (0,1 ml/100 g de poids corporel) dans la cavité abdominale pour anesthésier le rat. Préparez le site chirurgical en retirant soigneusement la fourrure du cou vers la poitrine en vous rasant ou en utilisant une crème dépilatoire.
- Ajustez doucement la position de la langue au besoin à l’aide d’une pince à épiler stérilisée et essuyez les sécrétions respiratoires avec des boules de coton stérilisées. Gardez la glotte bien en vue et insérez doucement une sonde endotrachéale dans la trachée.
- Connectez le tube endotrachéal à un ventilateur tournant à 65-80 respirations par minute et ajustez le volume courant à 4-5 ml en fixant la tête et les membres du rat.
- Placez un champ stérile sur le rat, désinfectez la zone opératoire avec de la teinture d’iode suivie de 70 % d’éthanol, et répétez cette procédure trois fois.
- Faites une incision parasternale gauche au niveau du quatrième espace intercostal pour exposer le muscle gauche : le grand pectoral et le petit pectoral.
- Disséquez le fascia entre le muscle pectoral majeur et le petit pectoral à l’aide d’une technique de dissection émoussée pour exposer le quatrième espace intercostal gauche.
REMARQUE : Évitez les lésions tissulaires excessives et les lésions vasculaires qui entraîneront des saignements graves et la mort postopératoire. - Disséquez les muscles intercostaux, positionnez un écarteur de poitrine dans le quatrième espace intercostal, puis écartez les côtes.
- Déchirez le péricarde et retirez le tissu adipeux attaché.
REMARQUE : Évitez d’endommager d’autres organes avec des instruments chirurgicaux tranchants, en particulier les poumons. Les lésions pulmonaires peuvent entraîner le développement d’un pneumothorax et d’un hémopneumothorax pendant l’opération, entraînant des conséquences cacoéthiques allant de troubles hémodynamiques à une réduction de la survie animale. - Manipulez la position du thymus et exposez doucement l’aorte ascendante et les oreillettes gauches. Identifiez et ligaturez l’artère descendante antérieure gauche proximale (DAL) de manière transitoire pendant 45 minutes à l’aide d’une suture en polypropylène 6-0 (voir Figure 1 A-D).
REMARQUE : Cette procédure est identique pour les rats témoins fictifs, sauf que le DAL n’est pas ligaturé. - Retirez l’écarteur de poitrine et rapprochez les côtes en un motif de suture interrompu avec une suture en polypropylène 3-0.
- Rétablir la pression intrathoracique négative pour assurer une respiration efficace.
REMARQUE : Deux méthodes peuvent être utilisées pour restaurer une pression intrathoracique négative : i) avant de fermer la cavité thoracique, les chercheurs peuvent boucher la sortie d’air du ventilateur pendant 2 cycles pour gonfler les poumons. ii) L’air restant dans la cavité thoracique peut être aspiré à l’aide d’une seringue après la fermeture de l’espace intercostal. - Après l’épilation et la désinfection, faites une incision dans le membre inférieur droit et disséquez le fascia superficiel de la veine fémorale droite.
- Desserrez la ligature et vérifiez les conditions de respiration et de circulation après avoir induit une ischémie myocardique pendant 45 min.
- Injecter une solution saline à 10 % (p/v) de FITC-dextran/saline dans la veine fémorale à raison de 0,15 mL/100 g de poids corporel, et appuyer sur la veine fémorale pendant 1 min avec des boules de coton stériles pour arrêter le saignement (figures 2A, B).
REMARQUE : Alternativement, injecter une solution saline EB/1 % p/v dans la veine fémorale à une dose de 0,5 mL/100 g de poids corporel. - Cousez les incisions avec une suture en polypropylène 3-0 et désinfectez les incisions, suivies d’une analgésie postopératoire à l’ibuprofène, comme décrit ci-dessus.
4. Préparation de tranches de tissus congelés pour la mesure de fluorescence
- Injecter une solution de pentobarbital sodique/PBS à 5 % p/v à une dose de 150 mg/kg (0,3 mL/100 g de poids corporel) par voie intrapéritonéale pour anesthésier profondément les rats après 3 h de reperfusion myocardique.
- Fendre la cavité abdominale et exposer l’aorte abdominale et la veine cave (voir figure 3A).
- Injectez régulièrement 50 ml de PBS glacé dans la veine cave, coupez l’aorte abdominale pour évacuer le sang du myocarde et prélevez le cœur.
REMARQUE : Observez les changements dans les poumons et le foie. Une transpiration du foie suggère qu’une solution saline est injectée avec précision dans la veine cave (voir la figure 3C), et un poumon pâle est considéré comme le signe d’un myocarde bien irrigué (voir la figure 3B). - Dans une pièce sombre, rincez doucement le cœur dans une solution saline glacée ou PBS pour éliminer tout sang restant et le FITC-dextran (ou EB) des cavités cardiaques.
- Coupez le cœur de la ligature et jetez le myocarde au-dessus de la ligature.
- Encastrer le cœur dans des moules avec un composé d’enrobage suivi d’un stockage à -80 °C.
- Déchargez les tissus congelés des moules d’enrobage et chargez-les sur des porte-échantillons dans une chambre pré-réfrigérée à -20 °C d’une trancheuse de congélation.
- Ajustez l’épaisseur d’une seule tranche à 5-8 μm et coupez le tissu à peu près au milieu de l’axe base-apex (par exemple, le milieu de l’ischémie).
- Chargez le tissu tranché sur des lames de microscope adhésives et scellez chaque tranche avec une goutte (environ 40 μL) de support de montage fluorescent contenant du DAPI.
- Conservez les diapositives dans une boîte sèche et sombre.
REMARQUE : Si les lames ne peuvent pas être numérisées immédiatement, stockez-les dans un endroit sec, frais et sombre pour éviter la formation d’eau de condensation et l’extinction de la fluorescence.
5. Mesure de fluorescence et analyse des données
- Configurez le système d’imagerie et vérifiez le logiciel connecté au scanner.
- Chargez les diapositives dans les étagères de diapositives et insérez-les dans le scanner.
- Ouvrez le logiciel du scanner de diapositives (voir la Table des matières) et configurez un nouveau protocole d’exposition en cliquant sur Modifier le protocole | Nouveau....
REMARQUE : Si le scanner ou son logiciel associé n’est pas disponible, un microscope confocal laser (voir le tableau des matériaux) ou d’autres scanners de lames ordinaires avec le mode fluorescence (voir le tableau des matériaux) peuvent être une alternative au scanner de fluorescence quantitative automatisé. - Renommez le protocole et l’étude, puis sélectionnez le mode de fluorescence .
- Définition de la numérisation de l’ensemble de la diapositive | Résolution de pixels et régions multispectrales | Résolution des pixels de 0,25 μm (40x) respectivement.
- Cliquez sur Modifier les filtres et les bandes... pour sélectionner la colonne Filtres de balayage de diapositives entières et la colonne Bandes de régions multispectrales .
REMARQUE : Si EB est utilisé, sélectionnez Filtres de numérisation de diapositives entières | DAPI et Texas Red ou AF495. Si FITC-dextran est utilisé, sélectionnez Bandes de régions multispectrales | DAPI et FITC ou AF488. - Cliquez sur Modifier les expositions... et chargez le support.
- Sélectionnez le créneau cible et cliquez sur Vue d’ensemble.
REMARQUE : Cela prend un balayage en fond clair de chaque section cardiaque. Sélectionnez le myocarde pour la mise au point ou sélectionnez la zone à l’aveuglette. - Sélectionnez la diapositive cible, ajustez la hauteur de la scène à environ -50 μm et cliquez sur Mise au point automatique.
- Cliquez sur Exposition de l’ensemble du balayage (ms)-DAPI | Autoexpose.
REMARQUE : Le temps d’exposition du DAPI pour chaque lame n’a pas besoin d’être le même car les images avec le DAPI sont utilisées pour illustrer les coupes transversales du cœur, ce qui est pratique pour délimiter la zone du myocarde, mais pas pour calculer la densité de fluorescence. - Cliquez sur Exposition de l’ensemble du balayage (ms)-FITC | Autoexpose.
REMARQUE : Cliquez sur Exposition de l’ensemble du balayage (ms)-Texas Red | Autoexpose si vous utilisez EB. Il est important de se rappeler et de s’assurer que le temps d’exposition de FITC ou Texas Red est le même dans tous les scans de diapositives. - Cliquez à nouveau sur Mise au point automatique et assurez-vous que la diapositive est nette.
- Cliquez sur Retour et enregistrez le protocole.
- Répétez les étapes 5.7 à 5.14 pour chaque diapositive.
- Revenez à la page d’accueil et cliquez sur Scanner les diapositives.
- Sélectionnez un emplacement, renommez toutes les diapositives et sélectionnez le protocole d’exposition correspondant pour chaque diapositive.
- Numérisez les diapositives et capturez les images.
- Ouvrez les images avec le logiciel de visualisation de diapositives pour les numérisations (voir la table des matériaux).
- Agrandissez toutes les images dans une mesure relativement égale.
- Capturez et enregistrez des images au .tiff.
REMARQUE : Il est préférable d’enregistrer les images avec et sans barres d’échelle en même temps. Les images avec des barres d’échelle peuvent être utilisées pour la publication, tandis que celles sans barres d’échelle peuvent être utilisées pour l’analyse statistique. - Ouvrez le logiciel ImageJ, cliquez sur Analyser et sélectionnez Définir la mesure.
- Sélectionner une zone | Densité intégrée.
- Ouvrez l’image dans le canal FITC avec l’image J.
- Cliquez à nouveau sur Analyser et enregistrez la valeur numérique de la densité intégrée (IntDen) qui apparaît.
REMARQUE : Comme les barres d’échelle dans les images peuvent être confondues avec l’échelle de gris de la fluorescence par les ordinateurs, utilisez des images sans barres d’échelle pour mesurer IntDen. - Fermez l’image FITC et ouvrez l’image dans le canal DAPI.
- Décrivez une coupe transversale du myocarde.
- Cliquez sur Analyser et collecter les données de surface .
- Calculez les rapports IntDen/Surface (moyenne de fluorescence) pour chaque cœur.
- Entrez tous les ratios dans un logiciel d’analyse statistique.
Résultats
Avant d’effectuer le test FITC-dextran pour évaluer les changements dans la perméabilité endothéliale cardiaque après IR, nous recommandons fortement que les expériences soient menées par le même chercheur spécialisé dans l’établissement d’un modèle IR myocardique chez le rat pour confirmer que les artères coronaires sont occluses dans la même position avec succès, et que les rapports aire ischémique/surface totale sont constants chez tous les rats. Comme le montre la figure 1A, B, le cœur (indiqué par une flèche jaune) a été exposé et une boucle (indiquée par une flèche verte) s’est formée dans le myocarde situé dans la paroi antérieure du ventricule gauche, à environ 2 mm sous le bord de l’appendice auriculaire gauche avec un tube capillaire en silicone de 0,5 mm (diamètre intérieur) et une suture 6-0. Comme le montre la figure 1C, lorsque l’anse a été fixée, le myocarde ischémique est passé du rose au rose grisâtre (indiqué par la flèche blanche) immédiatement.
De plus, le myocarde s’est reperforé et a retrouvé sa couleur rose immédiatement après le relâchement de la boucle, comme illustré sur la figure 1D. Après avoir desserré l’anse, une incision a été pratiquée parallèlement à l’axe long du fémur à l’intérieur de la cuisse. La veine fémorale a été exposée et perforée à l’aide d’une seringue à insuline, comme le montrent les figures 2A et B. À la suite d’une reperfusion de 3 h, une incision en « V » a été pratiquée dans le bas-ventre, et l’aorte abdominale et la veine cave ont été disséquées à partir du péritoine (figure 3A). Une solution saline froide a été injectée doucement dans la veine cave, et l’aorte abdominale a été coupée pour éviter que la paroi ventriculaire ne soit excessivement étirée en raison de la pression intraventriculaire qui affecterait sa structure histopathologique. Les poumons blanchis (flèche rouge sur la figure 3B) et le foie sur la figure 3C indiquent que le tissu était bien reperfusé avec du sérum physiologique.
Par conséquent, il n’y avait pas de différence significative dans l’aire transversale entre les trois groupes : 1,00 ± 0,08 dans le groupe Sham vs 0,97 ± 0,08 dans le groupe IR vs 1,02 ± 0,04 dans le groupe IR+TXL (Figure 4A, n = 6 dans chaque groupe, p > 0,05 entre deux groupes). Comme le montrent les figures 4B et C, l’intensité moyenne de la fluorescence verte dans l’ensemble des sections de rats Sham était extrêmement faible. En revanche, la fluorescence émise par le FITC-dextran extravasé a augmenté de façon marquée dans le groupe IR, normalisé au groupe Sham (5,52 ± 0,85 dans le groupe IR contre 1,00 ± 0,19 dans le groupe Sham, n = 6, p < 0,05). De plus, la poudre superfine TXL, connue pour protéger l’endothélium microvasculaire cardiaque14,16, a remarquablement inversé l’intensité de fluorescence plus élevée induite par l’IR (2,87 ± 0,52 dans le groupe IR+TXL contre 5,52 ± 0,85 dans le groupe IR, n = 6, p < 0,05). Les images du myocarde régional ont indiqué que le FITC-dextran s’accumulait massivement dans la matrice extracellulaire mais pas dans les microvaisseaux, et que le TXL améliorait la fonction de la barrière endothéliale (Figure 5).
Par rapport au FITC-dextran, l’EB peut être une alternative sous-optimale car l’EB est inférieur au FITC-dextran de 70 000 Da en termes de qualité d’image et de sensibilité. De même, il n’y avait pas de différence significative dans l’aire transversale entre les trois groupes : 1,00 ± 0,08 dans le groupe Sham vs 0,97 ± 0,08 dans le groupe IR vs 0,98 ± 0,05 dans le groupe IR+TXL (figure supplémentaire S1A, n = 6 dans chaque groupe, p > 0,05 entre deux groupes). Comme le montre la figure supplémentaire S1B,C, l’intensité moyenne de la fluorescence rouge dans des sections efficaces entières de rats Sham était relativement plus élevée, en particulier dans l’endocarde et l’épicarde. Bien que la fluorescence rouge émise par l’EB ait fortement augmenté dans le groupe IR (4,41 ± 0,66 dans le groupe IR vs 1,00 ± 0,22 dans le groupe Sham, n = 6, p < 0,05), la différence entre les groupes IR+TXL et IR n’était pas significative (3,73 ± 0,47 dans le groupe IR+TXL vs 4,41 ± 0,66 dans le groupe IR, n = 6, p = 0,0956).
De plus, cette méthode a été testée dans un modèle d’infarctus du myocarde (IM) (figure supplémentaire S2). Dans le groupe Myocardie I-njection première(MII), une solution FITC-dextran (à la même concentration mentionnée précédemment) a été injectée dans la circulation 5 minutes avant la ligature LAD. Cela contrastait avec la solution FITC-dextran injectée immédiatement après la ligature chez les rats MIL (Mynarcial Infarction Ligation en premier) décrite plus haut dans ce protocole. Il est intéressant de noter que seules de faibles quantités de FITC-dextran ont été extravasées dans l’ECM du myocarde lésé chez les rats IM des deux groupes, ce qui est indiqué par une faible intensité de fluorescence verte dans la figure supplémentaire S2.
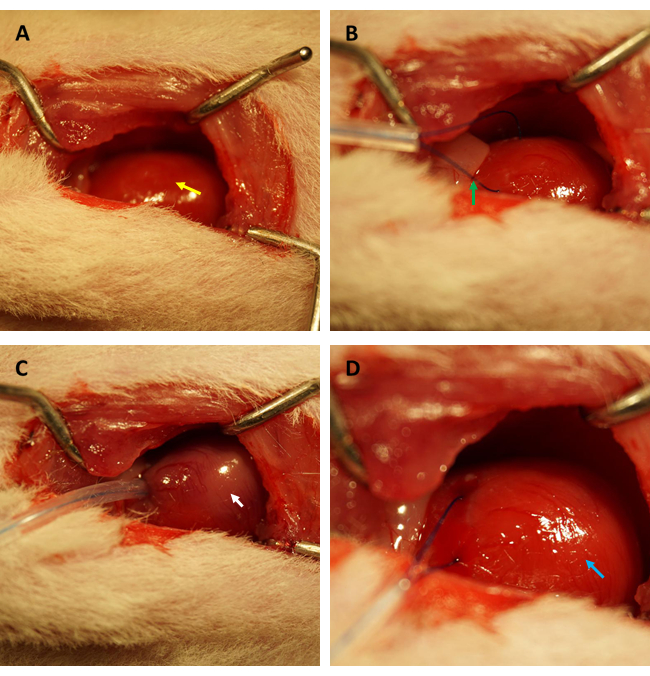
Figure 1 : Champ visuel de la thoracotomie et établissement de l’ischémie/reperfusion dans un modèle de rat. (A) Exposer le cœur du rat (indiqué par une flèche jaune) ; (B) formant une boucle pour encercler l’artère coronaire (indiquée par une flèche verte) ; (C) fixation de l’anse et induction d’une ischémie myocardique pendant 45 min (indiquée par une flèche blanche) ; (D) desserrer l’anse et permettre la reperfusion myocardique pendant 3 h (indiquée par la flèche bleue). Veuillez cliquer ici pour voir une version agrandie de cette figure.
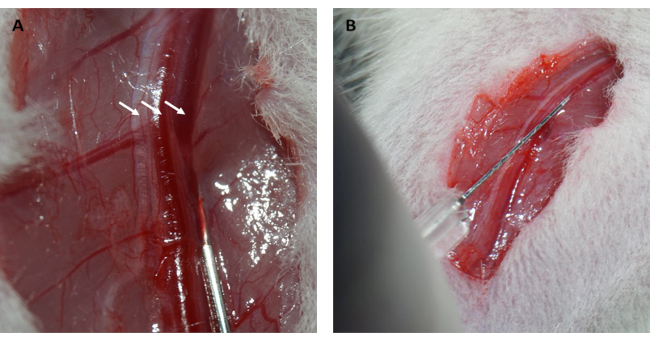
Figure 2 : Dissection de la veine fémorale et injection intraveineuse. (A) Exposer la veine fémorale (le nerf fémoral est indiqué par la flèche à gauche ; l’artère fémorale est indiquée par la flèche au milieu ; la veine fémorale est indiquée par la flèche à droite). (B) Injection d’une solution de FITC-dextran dans la veine fémorale à l’aide d’une seringue à insuline. Abréviation : FITC = isothiocyanate de fluorescéine. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Perfusion tissulaire et symptômes d’une perfusion efficace. (A) Dissection de l’aorte abdominale et de la veine cave (l’aorte abdominale est indiquée par la flèche blanche ; la veine cave est indiquée par la flèche noire). (B) Les poumons blanchis sont un symptôme d’une perfusion adéquate ; (C) la muqueuse blanchie, les reins blanchis et la transpiration du foie sont tous des symptômes d’une perfusion adéquate (flèche rouge : muqueuse ; flèche blanche : foie ; flèche noire : rein). Veuillez cliquer ici pour voir une version agrandie de cette figure.
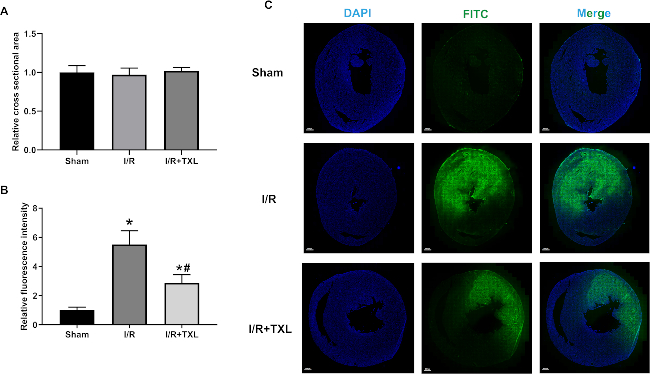
Figure 4 : Images représentatives et analyse de l’intensité moyenne de fluorescence par coloration FITC-dextran. (A) Section transversale relative de chaque groupe normalisée à celle du groupe Sham (p > 0,05) ; (B) l’intensité relative de la fluorescence dans le canal FITC de chaque groupe normalisée à celle du groupe Sham ; (C) des images représentatives à un grossissement de 9,5x dans chaque groupe. Barres d’échelle = 800 μm. ANOVA à un facteur avec les comparaisons multigroupes post-hoc de Tukey. * par rapport au groupe Smock, p < 0,05 ; # par rapport au groupe IR, p < 0,05. Les graphiques à barres montrent la moyenne du groupe ± ET. Abréviations : IR = ischémie/reperfusion ; TXL = Tongxinluo ; FITC = isothiocyanate de fluorescéine ; DAPI = 4',6-diamidino-2-phénylindole ; ANOVA = analyse de la variance ; SD = écart-type. Veuillez cliquer ici pour voir une version agrandie de cette figure.
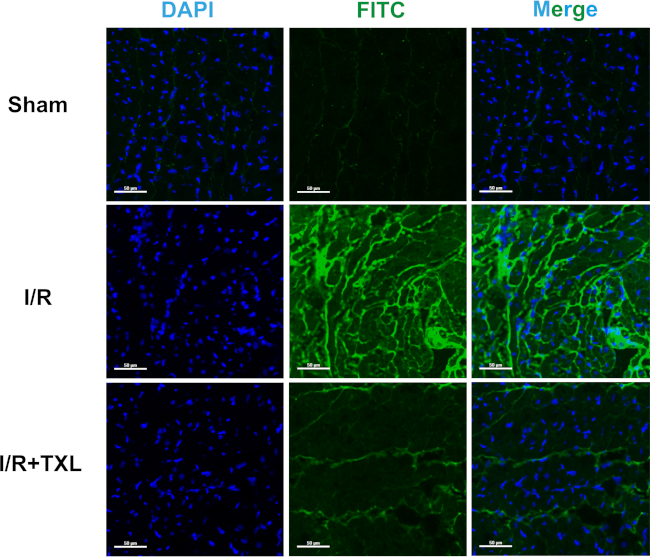
Figure 5 : Images représentatives des zones d’intérêt à un grossissement de 200x de chaque groupe après coloration FITC-dextran. Barres d’échelle = 50 μm. Abréviations : FITC = isothiocyanate de fluorescéine ; DAPI = 4',6-diamidino-2-phénylindole. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire S1 : Images représentatives et analyse de l’intensité moyenne de fluorescence par coloration au bleu d’Evans. (A) Aire transversale relative de chaque groupe normalisée à celle du groupe Sham (p > 0,05) ; (B) l’intensité relative de la fluorescence dans le canal rouge du Texas de chaque groupe normalisée à celle du groupe Sham ; (C) des images représentatives dans chaque groupe. ANOVA à un facteur avec les comparaisons multigroupes post-hoc de Tukey. Barres d’échelle = 800 μm. * par rapport au groupe Sham, p < 0,05. Les graphiques à barres montrent la moyenne du groupe ± ET. Abréviations : IR = ischémie/reperfusion ; TXL = Tongxinluo ; DAPI = 4',6-diamidino-2-phénylindole ; ANOVA = analyse de la variance ; SD = écart-type. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire S2 : Images représentatives à un grossissement de 9,5x de la coloration FITC-dextran dans un modèle d’infarctus du myocarde. Barres d’échelle = 800 μm. Abréviations : MII = injection d’abord dans l’infarctus du myocarde (injecter du FITC-dextran avant l’infarctus du myocarde) ; MIL = ligature de l’infarctus du myocarde en premier (injecter du FITC-dextran immédiatement après l’infarctus du myocarde) ; FITC = isothiocyanate de fluorescéine ; DAPI = 4',6-diamidino-2-phénylindole. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Cet article présente un protocole permettant d’évaluer le dysfonctionnement de la barrière endothéliale cardiaque après une exposition à l’IRMI. Il est à noter qu’il y a plusieurs étapes cruciales dans ce protocole qui déterminent la fiabilité et l’exactitude des résultats. Toutes les étapes impliquant FITC-dextran doivent être effectuées dans une pièce sombre. Les solutions FITC-dextran/saline doivent être conservées à 4 °C et enveloppées dans du papier d’aluminium. De plus, les artères coronaires doivent être ligaturées, comme illustré à la figure 1, afin que le myocarde puisse être reperfusé immédiatement après le relâchement de l’anse. Les chercheurs peuvent choisir des sutures en polyéthylène 5-0 ou 6-0, car les cordes plus fines inférieures à 7-0 sont plus susceptibles de couper les fibres et les vaisseaux myocardiques. Il est important de noter que la solution tracante doit être injectée dans les veines fémorales et non dans les veines de la queue. Chaque cœur doit être bien perfusé et bien rincé avec une solution saline glacée avant et après avoir été sacrifié, respectivement.
De nombreux chercheurs spécialisés dans l’IRIM sont enclins à étudier la structure subcellulaire perturbée de l’endothélium au stade précoce de la reperfusion myocardique - la formation de corps apoptotiques, le gonflement des mitochondries et les jonctions intercellulaires anormales - pour prouver l’hyperperméabilité de l’endothélium par un examen au microscope électronique. L’immunotransfert a également été utilisé pour mesurer la perméabilité microvasculaire, car la diminution des niveaux de protéines de conjonction serrée est considérée comme le mécanisme central des lésions endothéliales et du dysfonctionnement de la barrière endothéliale au fil du temps. Par exemple, la VE-cadhérine20 et la β-caténine21 sont des éléments clés des jonctions d’adhésion endothéliales de cellule à cellule, et ces connexions contribuent au maintien de l’intégrité vasculaire22. Les jonctions serrées, telles que JAM-A23,24 et occludine25, participent également de manière coopérative à la construction de la barrière endothéliale dans le système circulatoire.
À l’heure actuelle, un nombre croissant d’études suggèrent que la fonction mitochondriale et l’homéostasie mitochondriale pourraient être des cibles clés des voies protectrices contre les lésions de reperfusion. Comme indiqué dans des études physiopathologiques et pharmacologiques, la mitophagie peut jouer un rôle important dans la mort cellulaire de l’endothélium et du myocarde induite par l’IR26. De plus, la fission mitochondriale, la protéostasie mitochondriale et le contrôle de la qualité mitochondriale peuvent protéger le myocarde à haut risque dans les zones reperfusées27,28. Les méthodes ci-dessus se concentrent davantage sur la mise en évidence de différents mécanismes ou causes d’hyperperméabilité que sur l’affichage direct et visuel de la perméabilité endothéliale. De plus, la préparation des échantillons pour l’examen au microscope électronique est compliquée et dangereuse. Les solutions de glutaraldéhyde, d’acétone et d’acide osmique utilisées en microscopie électronique volatilisent et érodent probablement la muqueuse, la conjonctive et la peau, menaçant même des vies si elles sont utilisées dans des environnements non contrôlés.
Par rapport à ces méthodes indirectes et potentiellement mortelles, cette méthode, qui mesure l’intensité de fluorescence émise par l’extravasation FITC-dextran, est idéale pour évaluer la perméabilité microvasculaire cardiaque. Tout d’abord, le dextran FITC 70 000 Da ne peut pas pénétrer à travers l’endothélium dans des conditions physiologiques normales, mais peut pénétrer dans l’espace interstitiel myocardique sous IR, ce qui permet une différenciation claire entre les rats sous différents traitements. De plus, la solution FITC-dextran est injectée dans le sang via les veines fémorales, ce qui garantit que tout le liquide est injecté dans la circulation du rat. En revanche, l’injection dans la veine de la queue est plus difficile chez le rat car la veine de la queue est indistincte et recouverte d’une couche épaisse. De plus, contrairement à la fixation régulière du paraformaldéhyde et à l’intégration de paraffine, le traitement des tissus myocardiques est simplifié et optimisé à l’aide de la technique de section pathologique à congélation rapide utilisée dans cette étude. Un temps de stockage court, un environnement étanche à la lumière et la cryoconservation peuvent ensemble atténuer l’extinction de la fluorescence du FITC.
Plus important encore, cette méthode peut minimiser le biais de sélection lors de l’analyse statistique. Nous effectuons une perfusion cardiaque suffisante avec une solution saline pour nous assurer que presque tout le sang mélangé au FITC-dextran est évacué du myocarde et des cavités cardiaques, ce qui peut éliminer la fluorescence émise par tout FITC restant dans les vaisseaux. Si ce n’est pas le cas, la fluorescence fusionnée avec les capillaires doit être exclue et taillée artificiellement. Lors de la collecte de tissu dans les zones d’intérêt, aucune limite visuelle n’a été observée entre le myocarde ischémique et le myocarde distant, en particulier après coloration au colorant EB. Cela a entravé la collecte d’échantillons dans ces zones représentatives. En utilisant la méthode décrite ici, les chercheurs peuvent obtenir des images de sections entières et analyser l’intensité de la fluorescence à l’aide d’un scanner à curseur quantitatif.
Il est intéressant de noter que le colorant EB peut être une alternative, bien que sous-optimale, au FITC-dextran. Par rapport aux conditions de stockage relativement difficiles du FITC-dextran, la poudre d’EB ou sa solution peut rester stable à température ambiante pendant une longue période. De plus, l’EB est relativement peu coûteux pour la plupart des institutions. Néanmoins, certains inconvénients pourraient limiter son application. Tout d’abord, la coloration EB présente une sensibilité plus faible que le FITC-dextran, ce qui peut sous-estimer les différences entre les groupes et augmenter la taille de l’échantillon de chaque groupe. De plus, l’EB montre une plus forte adhérence aux protéines. L’endocarde et l’épicarde sont plus facilement colorés par l’EB, ce qui peut influencer les résultats de la densité de fluorescence. De plus, des défauts de remplissage évidents dans la zone de reperfusion réduisent considérablement la qualité de l’image, ce qui peut limiter l’utilisation de l’EB.
Afin d’étendre l’application de cette méthode dans un modèle d’IM, la méthode a été testée dans un modèle d’IM. Tout d’abord, le FITC-dextran a été injecté dans les vaisseaux sanguins après la ligature LAD. Comme prévu, un faible niveau de fluorescence a été émis par la tranche parce que le FITC-dextran dans le flux sanguin ne peut pas passer à travers le site ligaturé, et aucun FITC-dextran n’a pénétré dans la zone ischémique. Le FITC-dextran a également été appliqué 5 minutes avant la ligature pour assurer le passage du FITC-dextran dans tous les organes. Par conséquent, le FITC-dextran n’a pas réussi à pénétrer dans l’endothélium microvasculaire, probablement parce qu’aucune pression de perfusion dans les vaisseaux sanguins ligaturés ne peut entraîner le FITC-dextran à travers l’endothélium. En général, cette méthode nécessite probablement beaucoup plus de modifications pour satisfaire son application dans le modèle MI.
Malgré les avantages ci-dessus, cette méthode présente des limites. Tout d’abord, ce protocole n’a pas été testé dans des modèles IR d’autres animaux, ce qui peut limiter son application dans les études précliniques et cliniques. Deuxièmement, les colorants étiquetés FITC sont plus chers que d’autres colorants courants tels que l’EB. Cependant, contrairement à l’EB, comme une solution de FITC-dextran à 10 % p/v, diluée avec du sérum, change rarement la couleur du myocarde, la coloration FITC-dextran et la double coloration EB/2,3,5-triphényltétrazole (TTC) peuvent être effectuées dans le même cœur, ce qui peut réduire le budget en ce qui concerne le nombre d’animaux et les colorants utilisés. Enfin, le scanner de lames utilisé dans cette étude - le scanner de lames quantitatif et des instruments similaires - peut ne pas être disponible dans certains laboratoires. En résumé, ce protocole présente une méthode simplifiée, fiable et visuelle pour la détection de la perméabilité endothéliale microvasculaire cardiaque dans un modèle IR chez le rat à l’aide d’un test de fluorescence basé sur un système automatisé d’imagerie pathologique quantitative. Ce protocole démontre que le FITC-dextran 70 000 Da est plus performant que l’EB dans l’évaluation fonctionnelle de la barrière endothéliale des microvaisseaux cardiaques après une lésion IR.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Cette étude a été financée par des subventions du Programme national de recherche et de développement clés de la Chine (n° 2017YFC1700503) et de la Fondation nationale des sciences naturelles de Chine (n° 81874461 et n° 81774292).
matériels
| Name | Company | Catalog Number | Comments |
| 16 G Angiocather | Becton Dickinson, USA | 2089312 | |
| 3-0 polypropylene suture, taper needle | Ethicon, USA | KGP693 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Invitrogen, USA | D3571 | Alternative to Mounting medium with DAPI |
| 6-0 polypropylene suture, round needle | Ethicon, USA | KGJ656 | |
| Adhesive Microscope Slides | CITOTEST, China | 188105 | |
| ALC-V8S Ventilator | Shanghai Alcott Biotech, China | ALC-V8S | |
| Constant Temperature Warming System | Shanghai Alcott Biotech, China | ALC-HTP203 | |
| Dissecting Forceps-Large Cvd | RWD life Science, China | F12007-10 | |
| Dissecting Forceps-Str | RWD life Science, China | F12005-10 | |
| FITC-dextran, 70,000Da | Sigma-Aldrich, USA | 53471 | |
| Hair Removal Cream | Nair, USA | N/A | |
| Insulin Syringe,1ml | Becton Dickinson, USA | 8155672 | |
| Microneedle holders | RWD life Science, China | F31047-12 | |
| Mosquito Forceps-Cvd | RWD life Science, China | F22007-12 | |
| Mounting medium with DAPI | ZSGB-BIO, China | ZLI-9557 | |
| Multi-position Fiber Optic Illuminator System | RWD life Science, China | 76301 | |
| Operating Scissors | RWD life Science, China | S14014-12 | |
| Pannoramic SCAN | 3DHISTECH, Budapest, Hungary | SC150-211305 | Alternative slide scan to Vectra Polaris |
| Phenochart 1.0.8 | PerkinElmer, USA | N/A | Slide viewer software |
| Phosphate buffered saline | HyClone,USA | SH30256.01 | |
| Retractors,30mm Spread,5cm | RWD life Science, China | F22005-45 | |
| SP8 Confocal microscope | Leica, German | TCS-SP8 SR | Alternative to Vectra Polaris |
| Surgical tape | 3M, USA | 1527C-0 | |
| Tissue-Tek O.C.T. Compound | SAKURA,Japan | 0822-00 | |
| Tongxinluo superfine powder | Yiling, China | Z19980015 | |
| Ultraviolet Freezing Slicer | Leica, German | CM1950 | |
| Vectra Polaris 1.0.7 software | PerkinElmer, USA | N/A | Slide scan software |
| Vectra Polaris Quantitative Slide Scanner | PerkinElmer, USA | VP1814N1068 |
Références
- Yellon, D. M., Hausenloy, D. J. Myocardial reperfusion injury. New England Journal of Medicine. 357 (11), 1121-1135 (2007).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: a target for cardioprotection. Cardiovascular Research. 115 (7), 1143-1155 (2019).
- Tada, Y., Yang, P. C. Myocardial edema on T2-weighted MRI: new marker of ischemia reperfusion injury and adverse myocardial remodeling. Circulation Research. 121 (4), 326-328 (2017).
- Chandrasekar, B., Smith, J. B., Freeman, G. L. Ischemia-reperfusion of rat myocardium activates nuclear factor-KappaB and induces neutrophil infiltration via lipopolysaccharide-induced CXC chemokine. Circulation. 103 (18), 2296-2302 (2001).
- Li, X. -. D., et al. Tongxinluo reduces myocardial no-reflow and ischemia-reperfusion injury by stimulating the phosphorylation of eNOS via the PKA pathway. American Journal of Physiology. Heart and Circulatory Physiology. 299 (4), 1255-1261 (2010).
- Pei, H., et al. TNF-α inhibitor protects against myocardial ischemia/reperfusion injury via Notch1-mediated suppression of oxidative/nitrative stress. Free Radical Biology & Medicine. 82, 114-121 (2015).
- Liao, Y. -. H., et al. Interleukin-17A contributes to myocardial ischemia/reperfusion injury by regulating cardiomyocyte apoptosis and neutrophil infiltration. Journal of the American College of Cardiology. 59 (4), 420-429 (2012).
- Pedersen, S. F., et al. Assessment of intramyocardial hemorrhage by T1-weighted cardiovascular magnetic resonance in reperfused acute myocardial infarction. Journal of Cardiovascular Magnetic Resonance. 14 (1), 59 (2012).
- Fang, L., et al. Differences in inflammation, MMP activation and collagen damage account for gender difference in murine cardiac rupture following myocardial infarction. Journal of Molecular and Cellular Cardiology. 43 (5), 535-544 (2007).
- Xu, Y., et al. Quantifying blood-brain-barrier leakage using a combination of evans blue and high molecular weight FITC-Dextran. Journal of Neuroscience Methods. 325, 108349 (2019).
- Li, B. -. R., et al. In vitro and in vivo approaches to determine intestinal epithelial cell permeability. Journal of Visualized Experiments. (140), e57032 (2018).
- Yao, L., Xue, X., Yu, P., Ni, Y., Chen, F. Evans Blue dye: a revisit of its applications in biomedicine. Contrast Media & Molecular Imaging. 2018, 7628037 (2018).
- Roberts, L. N. Evans blue toxicity. Canadian Medical Association Journal. 71 (5), 489-491 (1954).
- Qi, K., et al. Tongxinluo attenuates reperfusion injury in diabetic hearts by angiopoietin-like 4-mediated protection of endothelial barrier integrity via PPAR-α pathway. PLoS One. 13 (6), 0198403 (2018).
- Zhang, H. -. T., et al. No-reflow protection and long-term efficacy for acute myocardial infarction with Tongxinluo: a randomized double-blind placebo-controlled multicenter clinical trial (ENLEAT Trial). Chinese Medical Journal (English). 123 (20), 2858-2864 (2010).
- Cui, H., et al. Induction of autophagy by Tongxinluo through the MEK/ERK pathway protects human cardiac microvascular endothelial cells from hypoxia/reoxygenation injury. Journal of Cardiovascular Pharmacology. 64 (2), 180-190 (2014).
- Chen, G. -. H., et al. Inhibition of miR-128-3p by Tongxinluo protects human cardiomyocytes from ischemia/reperfusion injury via upregulation of p70s6k1/p-p70s6k1. Frontiers in Pharmacology. 8, 775 (2017).
- Yu, Z. -. H., et al. PI3K/Akt pathway contributes to neuroprotective effect of Tongxinluo against focal cerebral ischemia and reperfusion injury in rats. Journal of Ethnopharmacology. 181, 8-19 (2016).
- Yang, H. -. X., Wang, P., Wang, N. -. N., Li, S. -. D., Yang, M. -. H. Tongxinluo ameliorates myocardial ischemia-reperfusion injury mainly via activating Parkin-mediated mitophagy and downregulating ubiquitin-proteasome system. Chinese Journal of Integrative Medicine. , (2019).
- Pulous, F. E., Grimsley-Myers, C. M., Kansal, S., Kowalczyk, A. P., Petrich, B. G. Talin-dependent integrin activation regulates VE-cadherin localization and endothelial cell barrier function. Circulation Research. 124 (6), 891-903 (2019).
- Cong, X., Kong, W. Endothelial tight junctions and their regulatory signaling pathways in vascular homeostasis and disease. Cellular Signaling. 66, 109485 (2020).
- Giannotta, M., Trani, M., Dejana, E. VE-cadherin and endothelial adherens junctions: active guardians of vascular integrity. Developmental Cell. 26 (5), 441-454 (2013).
- Monteiro, A. C., Parkos, C. A. Intracellular mediators of JAM-A-dependent epithelial barrier function. Annals of the New York Academy of Sciences. 1257, 115-124 (2012).
- Kakogiannos, N., et al. JAM-A acts via C/EBP-α to promote Claudin-5 expression and enhance endothelial barrier function. Circulation Research. 127 (8), 1056-1073 (2020).
- Feldman, G. J., Mullin, J. M., Ryan, M. P. Occludin: structure, function and regulation. Advanced Drug Delivery Reviews. 57 (6), 883-917 (2005).
- Zhou, H., et al. NR4A1 aggravates the cardiac microvascular ischemia reperfusion injury through suppressing FUNDC1-mediated mitophagy and promoting Mff-required mitochondrial fission by CK2α. Basic Research in Cardiology. 113 (4), 23 (2018).
- Wang, J., Toan, S., Zhou, H. Mitochondrial quality control in cardiac microvascular ischemia-reperfusion injury: New insights into the mechanisms and therapeutic potentials. Pharmacological Research. , 156 (2020).
- Zhu, H., et al. Phosphoglycerate mutase 5 exacerbates cardiac ischemia-reperfusion injury through disrupting mitochondrial quality control. Redox Biology. 38, 101777 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon