Method Article
Определение профиля транскрипции псориазиформной кожи in vitro с использованием клеток HaCaT, стимулированных комбинацией цитокинов
* Эти авторы внесли равный вклад
В этой статье
Резюме
В данной работе представлен метод создания in vitro псориазийной модели кожного воспаления на уровне транскрипции с использованием комбинации пяти цитокинов (IL-17A, IL-22, IL-1α, TNF-α, OSM) на клеточной линии HaCaT.
Аннотация
Псориаз – распространенное хроническое воспалительное заболевание кожи, опосредованное врожденной и адаптивной иммунной системами, характеризующееся аномальной пролиферацией и дифференцировкой эпидермальных кератиноцитов и инфильтрацией воспалительных клеток. Кожно-специфические кератиноциты являются ключевыми участниками врожденного иммунитета, реагируя на иммунные клетки и стимуляцию окружающей среды, тем самым играя важную роль в иммунопатогенезе псориаза. В данной работе мы представляем метод индуцирования воспаления псориазиформных кератиноцитов на уровне транскрипции с помощью клеточной линии HaCaT с использованием комбинации пяти провоспалительных цитокинов (комбинация M5), включая IL-17A, IL-22, IL-1α, TNF-α и онкостатин M. Результаты показывают, что индуцированные комбинацией M5 клетки HaCaT показали повышенные уровни антимикробных пептидов (BD2, S100A7, S100A8 и S100A9), хемокинов и цитокинов (CXCL1, CXCL2, CXCL8, CCL20, IL-1β, IL-6 и IL-18). Уровни мРНК маркеров дифференцировки кератиноцитов (Кератин1, Кератин10, Филаггрин и Лорикрин) были снижены, что согласуется с данными транскриптома, полученными из псориазоподобных кератиноцитов. Таким образом, описанный здесь метод устанавливает in vitro псориазиформное воспаление кожи на уровне транскрипции и вносит вклад в исследование молекулярного патогенеза псориаза.
Введение
Псориаз является распространенным незаразным хроническим воспалительным заболеванием кожи, вызванным нерегулируемым иммунным ответом, поражающим кератиноциты, которые преимущественно образуют эпидермис1, характеризующимся аномально быстрым размножением кератиноцитов с гиперкератозом и паракератозом. Псориазом страдает около 3% мировой дикой популяции2. Бремя болезней еще больше увеличивается из-за ряда сопутствующих заболеваний, включая сердечно-сосудистые заболевания и метаболический синдром, вызванный синдромом3.
Эпидермис состоит из пяти слоев кератиноцитов и претерпевает морфологические изменения в процессе дифференцировки: базальный слой, слой колючий, слой гранулозный, слой люцидума (обнаруженный на ладонях и подошвах) и роговой слой, описанный здесь от внутренней к внешней поверхности4. Изменение дифференцировки эпидермиса приводит к нарушению кожного барьера, что важно для патогенеза воспалительных заболеваний кожи 5,6,7,8. Кератиноциты играют жизненно важную роль в поддержании неповрежденного эпидермального барьера для предотвращения потери воды и защиты от триггеров окружающей среды, таких как воздействие UVB, аллергены и патогенные микроорганизмы9. У здоровых людей наблюдается баланс между пролиферацией базальных клеток и шелушением рогового слоя, в то время как множественные кожные заболевания, включая псориаз, характеризуются дисбалансом этогосложного механизма.
Помимо формирования барьерной функции, кератиноциты также являются важным компонентом иммунной системы кожи. При иммунопатогенезе псориаза активация кожно-резидентных хелперных Т-клеток 1-го типа (Th1) и хелперных Т-клеток 17-го типа (Th17) приводит к увеличению продукции ИФН-γ и IL-17A соответственно. Эти цитокины индуцируют повышенный синтез хемокинов (CCL20, CXCL1/2/8/9/10/11), антимикробных пептидов (BD2, LL37, S100A7/8/9/12) и других воспалительных факторов (TNF-α, IL-6, IFN-β) в кератиноцитах, что приводит к привлечению большего количества Th1, Th17 и нейтрофилов в кожу, что еще больше усиливает ось IL-17/IL2311. Перекрестные помехи между кератиноцитами и иммунными клетками отвечают за индукцию и поддержание псориаза11.
Сложные цитокиновые сети были описаны при псориазе, и была подчеркнута центральная роль провоспалительных цитокинов (таких как IL-23, IL-22, IL-17, IL-1α, онкостатин M(OSM) и TNF-α), продуцируемых инфильтрацией иммунных клеток. Действительно, предыдущие исследования показали, что повышенные уровни IL-17A, IL-22, IL-1α, TNF-α и OSM индуцировали профиль псориазиформа на нормальных эпидермальных кератиноцитах человека in vitro14.
Бессмертные клеточные линии кератиноцитов (HaCaT), которые легче получить и культивировать, чем первичные кератиноциты с лучшей воспроизводимостью, широко используются для изучения псориаза 15,16,17,18,19,20. В отличие от трансформированных клеток HEK001 и KerTr вируса папилломы человека16 E6/E7, клеточная линия HaCaT способна экспрессировать продукты дифференцировки генов, включая кератин1 (KRT1), кератин10 (KRT10), лорикрин и филаггрин 20,21,22, тем самым обеспечивая многообещающий инструмент, аналогичный первичным кератиноцитам, для изучения регуляции кератинизации и провоспалительных процессов.
KRT5/14 является основной парой кератинов I типа II, экспрессируемой в пролиферативных базальных кератиноцитах, в то время как дифференцированные кератиноциты в надбазальных слоях подавляют KRT5/14 и экспрессируют KRT1/10 в качестве основной кератиновой пары23. При сравнении поражения псориазом со здоровой кожей изменения экспрессии кератина включали снижение KRT1/1024,25 и увеличение KRT5/14 в псориатическом эпидермисе26, характеризующемся гиперпролиферацией и паракератозом27. Лорикрин является терминально дифференцированным структурным белком, составляющим более 70% ороговевшей оболочки, способствует защитной барьерной функции рогового слоя28, регулируемого в коже пациентов с псориазом29. Филаггрин экспрессируется на заключительных стадиях дифференцировки кератиноцитов и участвует в агрегации скаффолдообразной ороговевшей оболочки30, сниженной экспрессии при псориазном поражении кожи29.
В целом, наша цель состояла в том, чтобы создать модель воспалительных кератиноцитов в клетках HaCaT с использованием комбинации цитокинов, которая сможет синергетически повторять некоторые характеристики поражений кожи при псориазе, включая инициирование иммунного ответа, пролиферацию и дифференцировку кератиноцитов.
протокол
Выполните шаги с 1 по 3 в стерильных условиях. Вся питательная среда содержала 0,1 мг/мл пенициллина и стрептомицина.
1. Подготовка клеток
- Посадите 1 x 106 клеток HaCaT в 10 мл модифицированной орлиной среды Dulbecco (DMEM) с добавлением 10% эмбриональной бычьей сыворотки (FBS) в 100 мм чашке для клеточной культуры. Инкубировать питательную чашку при 37 °C в увлажненном инкубаторе с 5% содержаниемCO2 в течение 2 дней.
- Когда конфлюенция культуры достигнет примерно 80%, осторожно извлеките среду из чашки для культивирования и промойте клетки 5 мл 1x фосфатно-солевого буфера (PBS). Аккуратно покачивайте форму для культуры вручную.
- Удалите PBS и добавьте в клетки 2 мл 0,25% раствора трипсина-ЭДТА. Осторожно встряхните чашку для культивирования, чтобы раствор полностью покрыл монослой клеток.
- Инкубируйте клетки при 37 °C в увлажненном инкубаторе с 5% содержаниемCO2 в течение 5 мин до тех пор, пока клетки не станут заметно отделены от поверхности чашки для культивирования с помощью фазово-контрастной микроскопии.
ПРИМЕЧАНИЕ: Морфология клеток должна казаться круглой. Если клетки плохо отделились, инкубируйте в течение дополнительного периода 5 минут вместе с ручным перемешиванием. - После того, как клетки будут отделены, добавьте 5 мл DMEM плюс 10% FBS для инактивации трипсина и соберите клеточную суспензию в центрифужную пробирку объемом 50 мл с помощью пипетки.
- Центрифугируйте пробирку, содержащую клеточную суспензию, при плотности 180 x g в течение 5 минут. Сцедите надосадочную жидкость.
- Добавьте 10 мл DMEM плюс 10% FBS среды в гранулу и аккуратно пипетируйте среду вверх и вниз, чтобы привести клетки в состояние суспензии.
2. Затравка клеток в 6-луночный планшет
- Засейте клетки с плотностью 2,0 х 105 клеток/лунку в 6-луночный культуральный планшет.
- Инкубируйте 6-луночный культуральный планшет при 37 °C в увлажненном инкубаторе с 5% содержаниемCO2 в течение ночи перед комбинированной стимуляцией M5, чтобы клетки прилипли к планшету.
3. М5-стимуляция клеток HaCaT
- Смесь цитокинов М5, содержащая 10 нг/мл рекомбинантного IL-17A, IL-22, IL-1α, TNF-α, и белок онкостатина М в DMEM, содержащем 2% FBS.
Комбинация М5 состояла из рекомбинации IL-17A, IL-22, IL-1α, TNF-α и онкостатина M. Синергическое действие комбинации M5 повторяет некоторые особенности псориаза, такие как повышение регуляции хемокинов и продукции антимикробных пептидов31. - После ночного культивирования клеток удалите надосадочную жидкость и пипеткой 2 мл комбинированной среды М5 в каждую лунку.
- Продолжайте культивирование клеток; клеточные лизаты собирали через 24 ч для количественного определения мРНК (этап 4) или супернатанты культур собирали через 48-72 ч для определения уровней цитокинов методом иммуноферментного анализа 32,33,34,35,36,37 (этап 6).
4. Сбор мРНК стимулированных M5 клеток HaCaT
- Отсадите смесь M5 и промойте один раз 1-2 мл холодной PBS.
- Аспиратуйте PBS и добавьте 1 мл коммерчески доступного раствора изотиоцианата гуанидии непосредственно в чашку для культивирования для лизирования клеток.
- Несколько раз пипеткой вверх и вниз для гомогенизации и переноса лизата клеток в микроцентрифужную пробирку объемом 1,5 мл. Оставить при комнатной температуре на 5 минут.
- Добавьте 200 μл хлороформа, энергично встряхните пробирку в течение примерно 20 с и инкубируйте образец в течение 5 минут при комнатной температуре.
- Центрифуга при 12 000 x g в течение 10 минут при 4 °C.
- Перенесите водную фазу в свежую микроцентрифужную пробирку объемом 1,5 мл.
- Добавьте 500 мкл изопропанола в водную фазу и аккуратно перемешайте. Оставить при комнатной температуре на 5 минут.
- Центрифуга при 10 000 x g в течение 15 мин при 4 °C.
- Аспиратуйте изопропанол и добавьте 1 мл 75% этанола. Промойте гранулу один раз.
- Центрифуга при 7 500 x g в течение 5 мин при 4 °C. Слейте этанол и дайте гранулам высохнуть на воздухе.
- Добавьте 30 μл воды, обработанной DEPC, в гранулу РНК. Подготовьтесь к обнаружению методом ОТ-ПЦР.
5. Анализ экспрессии мРНК методом ПЦР в реальном времени
- Выполните синтез кДНК с 1 мкг общей РНК с использованием коммерчески доступного набора, следуя инструкциям производителя.
ПРИМЕЧАНИЕ: 1 г общей РНК для анализа SYBR Green RT-PCR. - Приготовьте реакционную смесь для ПЦР. 12,5 мкл премикса SYBR EX Taq II, 1 мкл прямого праймера для ПЦР (10 мкМ), 1 мкл обратного праймера для ПЦР (10 мкМ), 2 г кДНК и 8,5 мкл dH2O. Конечный объем составляет 25 мкл на одну реакцию.
Примечание: Список последовательностей праймеров генов, использованных для анализа методом ОТ-ПЦР в данном исследовании, приведен в таблице 1. - Инкубировать в термоамплификаторе. Условия циклирования включали стадию денатурации при 95 °C в течение 30 с, 40 циклов при 95 °C в течение 5 с, 60 °C в течение 30 с, 72°C в течение 20 с и анализ кривой плавления.
- Анализируйте данные эксперимента ОТ-ПЦР путем вычисления относительных различий в экспрессии генов от значений Ct (порогового цикла) с использованием уравнений 2-ΔΔCT. Используйте β-актин в качестве внутреннего контроля для стандартизации относительной количественной экспрессии генов ОТ-ПЦР.
6. Забор супернатанта клеточных культур для ИФА
- Пипетируйте каждую среду для культивирования клеток в микроцентрифужную пробирку объемом 1,5 мл.
- Центрифуга при 1500 x g в течение 10 мин при 4 °C.
- Добавьте надосадочную жидкость и немедленно храните при температуре -80 °C.
7. Анализ экспрессии цитокинов методом ИФА
- Следуйте инструкциям производителя, чтобы подготовить все реактивы, рабочий стандарт и образцы. Трехкратное серийное разведение стандартного с разбавителем образца в диапазоне от 2 000 до 2,74 пг/мл. Разбавьте образцы 1:2 разбавителем для пробы.
- Добавьте 100 мкл стандарта и образца в лунку. Накройте лунки крышкой и заклейте пластину парафиновой пленкой. Выдерживать в течение 2,5 ч при комнатной температуре.
- Через 2,5 ч раствор выбросить. Добавьте по 300 мкл промывочного буфера в каждую лунку планшета на 3 минуты и аспирируйте. Повторите процесс еще четыре раза. После последней стирки переверните пластину и постучите по впитывающей бумаге, чтобы удалить остатки жидкости.
- Добавьте по 100 мкл раствора антитела для обнаружения в каждую лунку. Выдержите тарелку в шейкере в течение 2 ч при температуре 37 °C.
ПРИМЕЧАНИЕ: Раствор биотинилированных антител для обнаружения готовится в каждом наборе для ИФА. - Отсадите и промойте каждую лунку планшета пять раз, используя 300 μл буфера для промывки. После последней стирки переверните пластину и постучите по впитывающей бумаге, чтобы удалить остатки жидкости.
- Добавьте в каждую лунку по 100 мкл конъюгата HRP-стрептавидина. Выдерживать в течение 45 минут при комнатной температуре с легким встряхиванием.
- Выбросьте раствор путем аспирации с помощью пипетки после инкубации. Промойте каждую лунку пластины пять раз, используя 300 μл буфера для промывки. После последней стирки переверните пластину и постучите по впитывающей бумаге, чтобы удалить остатки жидкости.
- Выполните обнаружение, добавив 100 мкл субстрата TMB в каждую лунку. Выдерживать в течение 30 минут при температуре 37 °C в темноте.
- Добавьте в каждую лунку по 50 мкл стоп-раствора, когда цвет проявится. Аккуратно постучите по тарелке, чтобы обеспечить тщательное перемешивание. Считывание при 450 нм сразу.
Результаты
Комбинированная стимуляция M5 индуцировала воспалительную реакцию клеток HaCaT.
Клетки HaCaT стимулировали комбинацией цитокинов M5 или без нее в течение 24 ч. Оценивали экспрессию мРНК генов, связанных с псориазом, которые участвуют в регуляции иммунных и воспалительных хемокинов и антимикробных пептидов. Нейтрофильные хемокины CXCL138, CXCL239, CXCL840 и Т-клеточные хемокины CCL2041,42 были значительно увеличены в комбинированных М5 клетках HaCaT по сравнению с необработанными клетками HaCaT в зависимости от времени (рис. 1A). Экспрессия BD243, S100A744,45, S100A846, S100A946 и S100A1247,48 в виде антимикробных пептидов была едва обнаружена в нестимулированных клетках HaCaT и сильно экспрессировалась после комбинированной стимуляции M5 с независящим от времени паттерном экспрессии (рис. 2A). Кроме того, микроматричную экспрессию псориазиформного кожного воспаления при HaCaT также проводили с использованием Human Expr 12x135K ArrDel 49. Было обнаружено, что цитокины, хемокины (рисунок 1B) и антимикробные пептиды (рисунок 2B) активируются в комбинированном сочетании M5 HaCaT. Уровни белков IL-6, IL-1β, IL-18 и CXCL8 20,50,51,52,53,54 были изучены с помощью ИФА в качестве подтверждения. Более высокие уровни белка наблюдались в супернатанте комбинационных клеток HaCaT, стимулированных комбинацией M5, по сравнению с контрольными клетками (рис. 1C). Между тем, для оценки патофизиологической корреляции индуцированного комбинацией M5 псориазиформного кожного воспаления на клетках HaCaT, набор данных микрочипов (GDS4602)55 из образца биопсии пораженной кожи нормальных пациентов и пациентов с псориазом был загружен из омнибуса экспрессии генов (GEO). Мы исследовали уровни экспрессии нескольких провоспалительных хемокинов, цитокинов и антимикробных пептидов. Результаты показали, что провоспалительные хемокины CXCL1, CXCL2, CXCL8 и CCL20 и антимикробные пептиды BD2, S100A7, S100A8, S100A9 и S100A12 чрезмерно экспрессируются в псориатической коже по сравнению с нормальной кожей (Дополнительная таблица 1). В совокупности эти результаты указывают на то, что комбинированная стимуляция M5 в клетках HaCaT способствовала возникновению псориазиформного воспаления in vitro, с увеличением провоспалительных хемокинов и продукции антимикробных пептидов на уровне транскрипции. Тем не менее, необходимы дальнейшие исследования, чтобы установить это в качестве модели для модели псориазиформного воспаления.
Комбинированная стимуляция M5 снижает уровень дифференцировки кератиноцитов в клетках HaCaT
HaCaT как бессмертная клеточная линия кератиноцитов, сохранил свойства функциональной дифференцировки нормальных кератиноцитов, показал нормальную кератинизацию и стратификацию, выращенные в органотипических культурах56,57, и нормальную трансформацию морфогенеза до особенностей дифференцировки в культуральной среде с высокой концентрацией кальция 57,58,59. Уровни мРНК KRT5 и KRT14 в качестве цитокератина, связанного с пролиферирующими кератиноцитами, были повышены при стимулированном М5 HaCaT (рис. 3A). Для дальнейшего изучения влияния комбинированной стимуляции М5 на уровень дифференцировки кератиноцитов была проведена оценка экспрессии мРНК маркеров дифференцировки кератиноцитов. KRT1 и KRT10, которые одними из первых экспрессировались во время ороговения в качестве ранних создателей дифференцировки, были значительно подавлены (рис. 3A). Между тем, уровни мРНК лорикрина и филаггрина в качестве маркеров поздней дифференцировки, которые являются основными компонентами эпидермальной ороговевшей оболочки, были значительно снижены (рис. 3A). Профилирование экспрессии микрочипов также повышает регуляцию маркеров пролиферации кератиноцитов KRT5 и KRT6, в то время как маркеры дифференцировки KRT1, KRT10, лорикрин и филаггрин подавляются (рис. 3B). Это похоже на исследования, проведенные в биопсии человека, где по сравнению с нормальной кожей, профиль GEO пациентов с псориатическим поражением кожи (GDS4602)60 показал снижение экспрессии KRT10, филаггрина и лорикрина (дополнительная таблица 1). Таким образом, комбинация M5 снижает экспрессию маркера дифференцировки кератиноцитов в клеточной линии HaCaT.
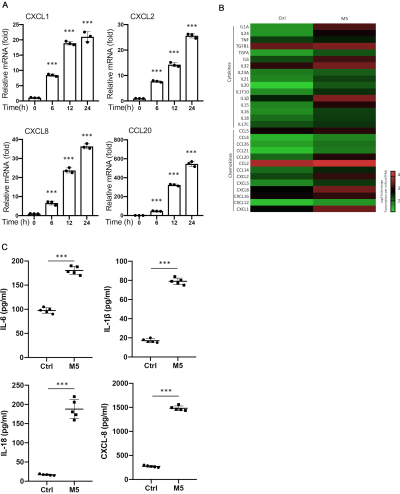
Рисунок 1: Гены хемокинов устойчиво увеличиваются в клетках HaCaT, культивируемых комбинацией IL-17A, IL-22, IL-1α, TNF-α и OSM (комбинация M5). Клетки HaCaT культивировали в комбинации M5 в течение 6, 12 и 24 часов. Проводили анализ QRT-ПЦР и нормализовали уровни экспрессии мРНК для CXCL1, CXCL2, CXCL8 и CCL20 с помощью гена β-актинового домовладения и экспрессировали по мере увеличения кратности по сравнению с нестимулированным контролем (A), Анализ тепловой карты профилей экспрессии цитокинов и хемокинов между контролем и M5-стимулированным HaCaT (B). Уровни IL-6, IL-1β, IL-18 и CXCL8 в супернатанте культур клеток HaCaT, стимулированных M5 в течение 96 ч, определяли методом иммуноферментного анализа (C). Среднее значение ± SD. *P < 0,05; **P < 0,01; Р < 0,001. Двуххвостый t-критерий Стьюдента. Данные представляют собой три независимых эксперимента. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Устойчивое увеличение генов антимикробного пептида в клетках HaCaT, культивируемых комбинацией M5. Клетки HaCaT культивировали в комбинации M5 в течение 6, 12 и 24 часов. Проводили анализ QRT-ПЦР и нормализовали уровни экспрессии мРНК для BD2, S100A7, S100A8, S100A9 и S100A12 с использованием гена β-актинового домохозяйки и экспрессировали по мере увеличения кратности по сравнению с нестимулированным контролем (А), Анализ тепловой карты профилей экспрессии антимикробных пептидов между контролем и М5-стимулированным HaCaT (B). Среднее значение ± SD. *P < 0,05; **P < 0,01; Р < 0,001. Двуххвостый t-критерий Стьюдента. Данные представляют собой три независимых эксперимента. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Поддерживаемое снижение генов дифференцировки кератиноцитов в клетках HaCaT, культивируемых комбинацией M5. Клетки HaCaT культивировали в комбинации M5 в течение 6, 12 и 24 часов. Проводили анализ QRT-ПЦР и нормализовали уровни экспрессии мРНК для KRT1, KRT10, филаггрина и лорикрина с помощью гена β-актинового домовладения и экспрессировали по мере увеличения кратности по сравнению с нестимулированным контролем (А), анализ тепловой карты профилей пролиферации и дифференцировки маркеров кератиноцитов между контролем и М5-стимулированным HaCaT (В). Среднее значение ± SD. *P < 0,05; **P < 0,01; Р < 0,001. Двуххвостый t-критерий Стьюдента. Данные представляют собой три независимых эксперимента. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Последовательность праймеров | ||
| Ген | Вперед (от 5' до 3') | Задний ход (от 5' до 3') |
| β-актин | CCACGAAACTACCTTCAACTCC | GTGATCTCCTTCTGCATCCTGT |
| С100А7 | CCTTAGTGCCTGTGACAA | CTGCTTGTGGTAGTCT |
| С100А8 | AGTGTCCTCAGTATATCA | CATCTTTATCACCAGAATG |
| С100А9 | CAACACCTTCCACCAATAC | TCATTCTTATTCTCCTTCTTGAG |
| S100A12 | CAATACTCAGTTCGGAAGG | CTTTGATATTCTTGATGGTGTTT |
| КХКЛ8 | GTCCTTGTTCCACTGTGCCT | GCTTCCACATGTCCTCACAA |
| ССЛ20 | TGACTGCTGTCTTGGATACACAGA | TGATAGCATTGATGTCACAGCCT |
| КХКЛ1 | GCCAGTGCTTGCAGACCCT | GGCTATGACTTCGGTTTGGG |
| КХКЛ2 | CAAACCGAAGTCATAGCCAC | TCTGGTCAGTTGGATTTGCC |
| БД2 | TTCTCGTTCCTCTTCATA | ATATGGCTCCACTCTTAA |
| Филаггрин | ТГАГГГКАКТАКТГАААГГКАААА | TGGCCACATAAACCTGGGTC |
| Лорикрин | GGGCACCGATGGGCTTAG | GGTAGGTTAAGACATGAAGGATTTGC |
| КРТ14 | CCAGTTCTCCTCTGGATCGC | TCCAGTGGGATCTGTGTCCA |
| КРТ10 | CCTGCTTCAGATCGACAATGCC | ATCTCCAGGTCAGCCTTGGTCA |
| Крт5 | TGTCAAGAAACAGTGCGCCA | GCTGCTGGAGTAGTAGCTTCC |
| КРТ1 | CCCTCCTGGTGGCATACAAG | GTTGGTCCACTCTCCTTCGG |
Таблица 1: Список последовательностей праймеров генов, используемых для анализа ОТ-ПЦР
| Ген | Пропорция Псориаз/контроль | p Значение |
| Хемокин | ||
| КХКЛ1 | 5.34 | <0,001 |
| КХКЛ2 | 10.14 | <0,001 |
| КХКЛ8 | 18.59 | <0,001 |
| ССЛ20 | 7.07 | <0,001 |
| Антимикробный пептид | ||
| БД2 | 193.55 | <0,001 |
| С100А7 | 15.31 | <0,001 |
| С100А8 | 10.14 | <0,001 |
| С100А9 | 52.46 | <0,001 |
| S100A12 | 52.48 | <0,001 |
| Дифференцировка кератиноцитов | ||
| Филаггрин | 0.58 | <0,001 |
| Лорикрин | 0.47 | <0,001 |
| КРТ10 | 0.92 | <0,001 |
Дополнительная таблица 1: GEO-профиль кожи при псориатических поражениях по сравнению с нормальной кожей. Данные профиля GEO (GSD4602) были получены из биопсии кожи 58 здоровых и 64 с псориазными поражениями. Соотношение между кожей при псориазном поражении и нормальной кожей было рассчитано с помощью программного обеспечения Prism 8. Значения p были проанализированы с помощью U-критерия Манна-Уитни.
Обсуждение
В данной работе описан способ с использованием комбинации пяти цитокинов (IL-17A, IL-22, IL-1α, TNF-α, OSM) в клеточную линию HaCaT для установления in vitro псориазиформного кожного воспалительного профиля на уровне транскрипции. Данный протокол может быть адаптирован для изучения механизма действия генов в патогенезе псориаза, а также для скрининга терапевтических препаратов для лечения псориаза. Недавние исследования показали, что гиперэкспрессия CD8 Т-клеток IL-17A и IL22, продуцирующих CD8 в пораженной коже, предполагает их участие в патогенезе псориаза61. IL-1α, IL-22 и IL-17A могут вызывать воспаление кожи у животных моделей 62,63,64,65. Цитокины, способные индуцировать специфические паттерны экспрессии, связанные с продуцируемыми антимикробными пептидами, такими как IL-17 и IL-2266 или врожденным иммунным ответом, таким как IL-17, IL-1α и TNF-α 11,62,67, или программы дифференцировки кератиноцитов, такие как IL-22 или OSM68,69. Наши результаты подтвердили, что IL-17A, IL-22, IL-1α, TNF-α и OSM являются основными индукторами воспаления кожи и продемонстрировали мощный синергизм в экспрессии хемокинов, цитокинов и антимикробных пептидов в клеточной линии HaCaT.
Примечательно, что комбинация M5 индуцировала экспрессию нейтрофилов клеток HaCaT, привлекающих хемокины CXCL1, CXCL2, CXCL8, и рекрутирование клеток CCR6+ Th17 хемокинов CCL20, которые играют решающую роль в инициации и поддержании псориаза 70,71,72. Предполагается, что антимикробные пептиды модифицируют воспалительные реакции хозяина с помощью различных механизмов, включая действие ангиогенных факторов, хемотаксических агентов и регуляторов пролиферации клеток, которые были вовлечены в развитие псориаза в последние годы73. S100A8 и S100A9 также участвуют в вербовке воспалительных инфильтратов74,75. S100A8 и S100A9 увеличивают продукцию CXCL1, CXCL2, CXCL8 и CCL20 в кератиноцитах76. BD2 обладает хемокиновой активностью и может привлекать Т-клетки памяти и незрелые дендритные клетки к месту микробной инвазии посредством взаимодействия с CCR677. S100A12 имеет хемотаксис на тучных клетках и моноцитах78. Антимикробные пептиды, экспрессируемые в модели M5 стимулированного HaCaT псориазиформа in vitro, необходимы для естественной защиты кожи, а также способствуют инфильтрации воспалительных клеток.
Наши данные показали достоверное снижение экспрессии генов ранней (KRT1 и KRT10) и поздней (филаггрин и лорикрин) дифференцировки после комбинированной стимуляции M5 в клетках HaCaT (рис. 2). Псориаз характеризуется неконтролируемым повышением скорости пролиферации и плохой дифференцировкой79. GWAS выявил многочисленные генетические вариации, связанные с псориазом, включающие многие гены, имеющие решающее значение для дифференцировки кератиноцитов. Кератиноциты псориаза, идентифицированные РНК-секвенированием, снижены, дифференциально экспрессируются гены, обогащенные генами, ассоциированными с эпидермальной дифференцировкой81. Кератиноциты псориаза показали снижение экспрессии генов ранней (KRT1, KRT10, DSC1) и поздней (LOR, FLG, IVL) дифференцировки81. KRT1 и KRT10 принимают непосредственное участие в контроле клеточного цикла, который запускает дифференцировку кератиноцитов82. Мутация KRT1/10 или отсутствие KRT10 показали большую эпидермальную пролиферацию в базальном слое83,84. Мутация потери функции (p.K4022X) в гене филаггрина связана с псориазом85. Мутация лорикрина, как кандидата в локус PSORS4, нарушает дифференцировку кератиноцитов и замедляет процесс гибели клеток86. Наблюдалось снижение экспрессии филаггрина и лорикрина кератиноцитами в коже поражения псориазом87. Кроме того, S100A8/A9 стимулирует пролиферацию кератиноцитов за счет индуцированного фосфорилирования p38 и SAPK/JNK с последующей активацией ERK1/288. В целом, паттерн экспрессии мРНК процесса дифференцировки кератиноцитов, стимулируемого комбинацией M5 на клетках HaCaT, согласуется с паттерном экспрессии псориатических поражений кожи.
В этом протоколе клеточная линия HaCaT была использована для создания псориазиформных моделей кожного воспаления in vitro, поскольку их легко получить и они культивируются с хорошей стабильностью и воспроизводимостью. Несмотря на то, что клетки HaCaT широко использовались в исследованиях псориаза 15,16,17,18,19, сообщалось, что профиль транскрипции генов белков, ассоциированных с ороговевшей оболочкой, в клетках HaCaT в целом отличался от такового в первичных кератиноцитах, что позволяет предположить, что клетки HaCaT имеют ограничение в качестве модели для изучения развития нормального кожного барьера 89,90. Между тем, кератиновый профиль, экспрессируемый HaCaT, намного шире, чем обычно наблюдается в первичных кератиноцитарных культурах, включая кератины, связанные с простым эпителием19. В нашем предыдущем исследовании анализ обогащения генонтологии (GO) клетками HaCaT, стимулированными M5, показал аналогичное обогащение генов в данных транскриптома с пораженной кожей и эпидермисом пациентов с псориазом. Мы обнаружили, что в дифференциально экспрессируемых генах (DEGs) псориазоподобных клеток HaCaT паттерн DEGs в клетках HaCaT, стимулированных M5, коррелирует с патогенетическими особенностями псориаза (GSE54456, GSE26866)91. Между тем, иммуногистохимические паттерны хемокинов 40,92,93, антимикробных пептидов 46,94,95,96,97 и маркеров дифференцировки кератиноцитов 97,98,99,100 у пациентов с псориазом соответствовали базе данных GEO. Таким образом, клетки HaCaT, стимулированные М5 в качестве модели кожного воспаления in vitro псориазиформы, были сходны с первичными кератиноцитами.
Примечательно, что активность рекомбинантных цитокинов имеет решающее значение для успеха эксперимента. Всегда делайте рабочие аликвоты растворенных рекомбинантных цитокинов и избегайте циклов замораживания/размораживания. Между тем, мы обнаружили более сильный псориазиформный кожный воспалительный процесс при М5, стимулированном HaCaT культуральной средой плюс 2% FBS по сравнению с 10% FBS. Кроме того, идентификация экспрессии провоспалительных хемокинов необходима для определения того, является ли модель псориазиформа, индуцированной M5, успешной, прежде чем проводить скрининг потенциальных лекарств или исследования механизма псориаза.
Здесь мы установили комбинацию M5, которая стимулирует клетки HaCaT псориазиформную кожную воспалительную модель, демонстрируя последовательную экспрессию медиаторов воспаления и снижение уровня дифференцировки кератиноцитов у пациентов с псориазом, демонстрируя преимущества изучения синергетического влияния цитокинов на патофизиологическое состояние in vitro. Синергетическая стимуляция IL-17A, IL22, IL-1α, TNF-α и OSM может стать новой ценной стратегией для идентификации ключевых патогенных тканеспецифичных молекул заболевания и представлять собой потенциальный биомаркер или лекарственную мишень для разработки будущих методов лечения псориаза.
Раскрытие информации
Авторы не сообщали о потенциальном конфликте интересов.
Благодарности
Работа выполнена при поддержке Национального фонда естественных наук Китая [81703132, 31271483, 81472650, 81673061, 81573050, 31872739 и 81601462]
Материалы
| Name | Company | Catalog Number | Comments |
| DMEM—Dulbecco's Modified Eagle Medium | Gibco | 11965092 | |
| Fetal Bovine Serum | Gibco | 10100139C | |
| HaCaT cells | China Center for Type CultureCollection | GDC0106 | Less than 15 generations |
| Human IL-1β ELISA Kit | Beyotime | PI305 | |
| Human IL-6 ELISA Kit | Beyotime | PI330 | |
| Human IL-8 ELISA Kit | Beyotime | PI640 | |
| IL-1 alpha Human | Prospec | CYT-253 | Recombinant protein |
| IL-17 Human | Prospec | CYT-250 | Recombinant protein |
| IL-22 Human | Prospec | CYT-328 | Recombinant protein |
| OSM Human | Prospec | CYT-231 | Recombinant protein |
| PBS | Gibco | 10010049 | pH 7.4 |
| Penicillin-Streptomycin | Gibco | 15140163 | |
| PrimeScrip RT reagent Kit | TAKARA | RR047A | |
| TB Green Premix Ex Taq | TAKARA | RR420A | |
| TNF alpha Human | Prospec | CYT-223 | Recombinant protein |
| TRIzo Reagent | Invitrogen | 15596018 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | 25200072 |
Ссылки
- Lowes, M. A., Bowcock, A. M., Krueger, J. G. Pathogenesis and therapy of psoriasis. Nature. 445 (7130), 866-873 (2007).
- Gupta, R., Debbaneh, M. G., Liao, W. Genetic epidemiology of psoriasis. Current dermatology reports. 3 (1), 61-78 (2014).
- Boehncke, W. -. H., Schön, M. P. Psoriasis. Lancet. 386 (9997), 983-994 (2015).
- Zaidi, Z., Lanigan, S. W., Lanigan, W. S., Zaidi, Z. . Dermatology in Clinical Practice. , 1-15 (2010).
- Proksch, E., Brandner, J. M., Jensen, J. M. The skin: An indispensable barrier. Experimental Dermatology. 17 (12), 1063-1072 (2008).
- Van Smeden, J., Janssens, M., Gooris, G., Bouwstra, J. The important role of stratum corneum lipids for the cutaneous barrier function. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1841 (3), 295-313 (2014).
- Wolf, R., Orion, E., Ruocco, E., Ruocco, V. Abnormal epidermal barrier in the pathogenesis of psoriasis. Clinics in Dermatology. 30 (3), 323-328 (2012).
- Proksch, E., Brasch, J. Abnormal epidermal barrier in the pathogenesis of contact dermatitis. Clinics in Dermatology. 30 (3), 335-344 (2012).
- Bäsler, K., Brandner, J. M. Tight junctions in skin inflammation. Pflügers Archiv-European Journal of Physiology. 469 (1), 3-14 (2017).
- Hoffjan, S., Stemmler, S. On the role of the epidermal differentiation complex in ichthyosis vulgaris, atopic dermatitis and psoriasis. British Journal of Dermatology. 157 (3), 441-449 (2007).
- Lowes, M. A., Russell, C. B., Martin, D. A., Towne, J. E., Krueger, J. G. The IL-23/T17 pathogenic axis in psoriasis is amplified by keratinocyte responses. Trends in Immunology. 34 (4), 174-181 (2013).
- Saxena, A., Raychaudhuri, S. K., Raychaudhuri, S. P. . Psoriatic Arthritis and Psoriasis. , 73-82 (2016).
- Lowes, M. A., Suárez-Fariñas, M., Krueger, J. G. Immunology of psoriasis. Annual Review of Immunology. 32, 227-255 (2014).
- Guilloteau, K., et al. Skin inflammation induced by the synergistic action of IL-17A, IL-22, oncostatin M, IL-1α, and TNF-α recapitulates some features of psoriasis. The Journal of Immunology. 184 (9), 5263-5270 (2010).
- Wang, Z., et al. Autophagy-based unconventional secretion of HMGB1 by keratinocytes plays a pivotal role in psoriatic skin inflammation. Autophagy. , 1-24 (2020).
- Choi, D. H., Hwang, H. S. Anti-inflammation activity of brazilin in TNF-α induced human psoriasis dermatitis skin model. Applied Biological Chemistry. 62 (1), 46 (2019).
- Teng, X., et al. IL-37 ameliorates the inflammatory process in psoriasis by suppressing proinflammatory cytokine production. Journal of Immunology. 192 (4), 1815-1823 (2014).
- Wu, S., et al. The potential of Diosgenin in treating psoriasis: Studies from HaCaT keratinocytes and imiquimod-induced murine model. Life Sciences. 241, 117115 (2020).
- Katarzyna, B., Elwira, S., Marta, M., Joanna, J. -. B., Magdalena, G. -. C. Models in the Research Process of Psoriasis. International Journal of Molecular Ences. 18 (12), 2514 (2017).
- Auewarakul, P., Gissmann, L., Cid-Arregui, A. Targeted expression of the E6 and E7 oncogenes of human papillomavirus type 16 in the epidermis of transgenic mice elicits generalized epidermal hyperplasia involving autocrine factors. Molecular and Cellular Biology. 14 (12), 8250-8258 (1994).
- Boukamp, P., et al. Normal keratinization in a spontaneously immortalized aneuploid human keratinocyte cell line. Journal of Cell Biology. 106 (3), 761-771 (1988).
- Irma, C., et al. HaCaT cells as a reliable in vitro differentiation model to dissect the inflammatory/repair response of human keratinocytes. Mediators of Inflammation. 2017, 7435621 (2017).
- Melino, G., et al. The cornified envelope: a model of cell death in the skin. Results & Problems in Cell Differentiation. 24 (4), 175 (1998).
- Thewes, M., Stadler, R., Mischke, B. K. Normal psoriatic epidermis expression of hyperproliferation-associated keratins. Archives of Dermatological Research. , (1991).
- Ishida-Yamamoto, A., Senshu, T., Takahashi, H., Akiyama, K., Iizuka, H. Decreased deiminated keratin K1 in psoriatic hyperproliferative epidermis. Journal of investigative Dermatology. 114 (4), 701-705 (2000).
- Elango, T., et al. Methotrexate normalized keratinocyte activation cycle by overturning abnormal keratins as well as deregulated inflammatory mediators in psoriatic patients. Clinica Chimica Acta. , 329-337 (2015).
- Ghadially, R., Reed, J. T., Elias, P. M. Stratum corneum structure and function correlates with phenotype in psoriasis. Journal of investigative dermatology. 107 (4), 558-564 (1996).
- Nithya, S., Radhika, T., Jeddy, N. Loricrin - An overview. Journal of Oral and Maxillofacial Pathology. 19 (1), (2015).
- Kim, B. E., et al. TNF-α downregulates filaggrin and loricrin through c-Jun N-terminal Kinase: Role for TNF-α antagonists to improve skin barrier. Journal of Allergy & Clinical Immunology. 127 (2), (2011).
- Gutowska-Owsiak, D., et al. IL-17 downregulates filaggrin and affects keratinocyte expression of genes associated with cellular adhesion. Experimental dermatology. 21 (2), 104-110 (2012).
- Guilloteau, K., et al. Skin inflammation induced by the synergistic action of IL-17A, IL-22, oncostatin M, IL-1α, and TNF-α recapitulates some features of psoriasis. Journal of Immunology. 184 (9), 5263-5270 (2010).
- Jeon, B., et al. Optimization and validation of a method to identify skin sensitization hazards using IL-1 α and IL-6 secretion from HaCaT. Toxicology In Vitro : An International Journal Published in Association with BIBRA. 61, 104589 (2019).
- Lee, K. -. M., Kang, J. H., Yun, M., Lee, S. -. B. Quercetin inhibits the poly(dA:dT)-induced secretion of IL-18 via down-regulation of the expressions of AIM2 and pro-caspase-1 by inhibiting the JAK2/STAT1 pathway in IFN-γ-primed human keratinocytes. Biochemical and Biophysical Research Communications. 503 (1), 116-122 (2018).
- Lee, N., Chung, Y. C., Kang, C. I., Park, S. -. M., Hyun, C. -. G. 7,8-dimethoxycoumarin attenuates the expression of IL-6, IL-8, and CCL2/MCP-1 in TNF-α-treated HaCaT cells by potentially targeting the NF-κB and MAPK pathways. Cosmetics. 6 (3), (2019).
- Smolińska, E., Moskot, M., Jakóbkiewicz-Banecka, J., Wgrzyn, G., Gabig-Cimińska, M. Molecular action of isoflavone genistein in the human epithelial cell line HaCaT. PLoS One. 13 (2), 0192297 (2018).
- Ying, X., Yan, Y., Li, Y. Tripterine alleviates LPS-induced inflammatory injury by up-regulation of miR-146a in HaCaT cells. Biomedicine & Pharmacotherapy. 105, 798 (2018).
- Zhang, M., et al. AIM2 inflammasome mediates Arsenic-induced secretion of IL-1 β and IL-18. Oncoimmunology. 5 (6), 1160182 (2016).
- Lowes, M. A., et al. Immunology of Psoriasis. Annual Review of Immunology. 32, 227-255 (2014).
- Nedoszytko, B., Wojdyło, M. S., Dziurdzińska, K. -. S., Roszkiewicz, J., Nowicki, R. J. Chemokines and cytokines network in the pathogenesis of the inflammatory skin diseases: atopic dermatitis, psoriasis and skin mastocytosis. Postepy Dermatologii i Alergologii. 31, 84-91 (2014).
- Glowacka, E., Lewkowicz, P., Rotsztejn, H., Zalewska, A. IL-8, IL-12 and IL-10 cytokines generation by neutrophils, fibroblasts and neutrophils- fibroblasts interaction in psoriasis. Advances in Medical Sciences. 55 (2), 254-260 (2010).
- Li, H., et al. Cyr61/CCN1 induces CCL20 production by keratinocyte via activating p38 and JNK/AP-1 pathway in psoriasis. Journal of Dermatological Science. 88 (1), 46-56 (2017).
- Kim, T. G., et al. Dermal clusters of mature dendritic cells and T cells are associated with the CCL20/CCR6 chemokine system in chronic psoriasis. Journal of Investigative Dermatology. 134 (5), 1462-1465 (2014).
- Kolbinger, F., et al. β-Defensin 2 is a responsive biomarker of IL-17A-driven skin pathology in patients with psoriasis. The Journal of Allergy and Clinical Immunology. 139 (3), (2017).
- Ekman, A., Vegfors, J., Eding, C., Enerbäck, C. Overexpression of psoriasin (S100A7) contributes to dysregulated differentiation in psoriasis. Acta Dermato-Venereologica. 97 (4), 441-448 (2016).
- Peric, M., et al. Vitamin D analog calcipotriol suppresses the Th17 cytokine-induced proinflammatory S100 "Alarmins" psoriasin (S100A7) and Koebnerisin (S100A15) in psoriasis. Journal of Investigative Dermatology. 132 (5), 1416-1424 (2012).
- Aochi, S., et al. Markedly elevated serum levels of calcium-binding S100A8/A9 proteins in psoriatic arthritis are due to activated monocytes/macrophages. Journal of the American Academy of Dermatology. 64 (5), 879-887 (2011).
- Krueger, J. G., et al. IL-17A is essential for cell activation and inflammatory gene circuits in subjects with psoriasis. Journal of Allergy Clinical Immunology. 130 (1), 145-154 (2012).
- Wilsmann-Theis, D., et al. Among the S100 proteins, S100A12 is the most significant marker for psoriasis disease activity. Journal of the European Academy of Dermatology & Venereology. 30 (7), 1165-1170 (2016).
- Wang, Z., et al. Systematic screening and identification of novel psoriasis-specific genes from the transcriptome of psoriasis-like keratinocytes. Molecular Medicine Reports. 19 (3), 1529-1542 (2018).
- Mizutani, H., Ohmoto, Y., Mizutani, T., Murata, M., Shimizu, M. Role of increased production of monocytes TNF-alpha, IL-1beta and IL-6 in psoriasis: relation to focal infection, disease activity and responses to treatments. Journal of dermatological science. 14 (2), 145-153 (1997).
- Pietrzak, A., Lecewicz-Torun, B., Chodorowska, G., Rolinski, J. Interleukin-18 levels in the plasma of psoriatic patients correlate with the extent of skin lesions and the PASI score. Acta Dermato-Venereologica. 83 (4), 262-265 (2003).
- Cai, Y., et al. A critical role of the IL-1β-IL-1R signaling pathway in skin inflammation and psoriasis pathogenesis. Journal of investigative Dermatology. 139 (1), 146-156 (2018).
- Arican, O., Aral, M., Sasmaz, S., Ciragil, P. Serum levels of TNF-α, IFN-γ IL-6, IL-8,IL-12, IL-17, and IL-18 in patients with active psoriasis and correlation with disease severity. Mediators of Inflammation. 2005 (5), 273-279 (2005).
- Grossman, R. M., et al. Interleukin 6 is expressed in high levels in psoriatic skin and stimulates proliferation of cultured human keratinocytes. Proceedings of the National Academy of Sciences of the United States of America. 86 (16), 6367-6371 (1989).
- Nair, R. P., et al. Genome-wide scan reveals association of psoriasis with IL-23 and NF-kappaB pathways. Nature Genetics. 41 (2), 199-204 (2009).
- Boukamp, P., et al. Normal keratinization in a spontaneously immortalized aneuploid human keratinocyte cell line. The Journal of Cell Biology. 106 (3), 761-771 (1988).
- Deyrieux, A. F., Wilson, V. G. In vitro culture conditions to study keratinocyte differentiation using the HaCaT cell line. Cytotechnology. 54 (2), 77-83 (2007).
- Micallef, L., et al. Effects of extracellular calcium on the growth-differentiation switch in immortalized keratinocyte HaCaT cells compared with normal human keratinocytes. Experimental Dermatology. 18 (2), 143-151 (2009).
- Wilson, V. G. . Epidermal Cells. , 33-41 (2013).
- Ding, J., et al. Gene expression in skin and lymphoblastoid cells: Refined statistical method reveals extensive overlap in cis-eQTL signals. American Journal of Human Genetics. 87 (6), 779-789 (2010).
- Res, P. C., et al. Overrepresentation of IL-17A and IL-22 producing CD8 T cells in lesional skin suggests their involvement in the pathogenesis of psoriasis. PLoS One. 5 (11), (2010).
- Groves, R. W., Mizutani, H., Kieffer, J. D., Kupper, T. S. Inflammatory skin disease in transgenic mice that express high levels of interleukin 1 alpha in basal epidermis. Proceedings of the National Academy of Sciences. 92 (25), 11874-11878 (1995).
- Chan, J. R., et al. IL-23 stimulates epidermal hyperplasia via TNF and IL-20R2-dependent mechanisms with implications for psoriasis pathogenesis. The Journal of Experimental Medicine. 203 (12), 2577-2587 (2006).
- Zheng, Y., et al. Interleukin-22, a TH 17 cytokine, mediates IL-23-induced dermal inflammation and acanthosis. Nature. 445 (7128), 648-651 (2007).
- Ma, H. -. L., et al. IL-22 is required for Th17 cell-mediated pathology in a mouse model of psoriasis-like skin inflammation. The Journal of Clinical Investigation. 118 (2), 597-607 (2008).
- Lowes, M. A., Russell, C. B., Martin, D. A., Towne, J. E., Krueger, J. G. The IL-23/T17 pathogenic axis in psoriasis is amplified by keratinocyte responses. Trends Immunol. 34 (4), 174-181 (2013).
- Banno, T., Gazel, A., Blumenberg, M. Effects of tumor necrosis factor-α (TNFα) in epidermal keratinocytes revealed using global transcriptional profiling. Journal of Biological Chemistry. 279 (31), 32633-32642 (2004).
- Boniface, K., et al. IL-22 inhibits epidermal differentiation and induces proinflammatory gene expression and migration of human keratinocytes. The Journal of Immunology. 174 (6), 3695-3702 (2005).
- Boniface, K., et al. Oncostatin M secreted by skin infiltrating T lymphocytes is a potent keratinocyte activator involved in skin inflammation. The Journal of Immunology. 178 (7), 4615-4622 (2007).
- Terui, T. Role of neutrophils in induction of acute inflammation in T-cell-mediated immune dermatosis, psoriasis: A neutrophil-associated inflammation-boosting loop. Experimental Dermatology. 9, (2000).
- Chiang, C. -. C., Cheng, W. -. J., Korinek, M., Lin, C. -. Y., Hwang, T. -. L. Neutrophils in psoriasis. Frontiers in Immunology. 10, 2376 (2019).
- Kennedy-Crispin, M., et al. Human keratinocytes' response to injury upregulates CCL20 and other genes linking innate and adaptive immunity. The Journal of Investigative Dermatology. 132 (1), 105-113 (2012).
- Morizane, S., Gallo, R. L. Antimicrobial peptides in the pathogenesis of psoriasis. The Journal of Dermatology. 39 (3), 225-230 (2012).
- Vandal, K., et al. Blockade of S100A8 and S100A9 suppresses neutrophil migration in response to lipopolysaccharide. The Journal of Immunology. 171 (5), 2602-2609 (2003).
- Ryckman, C., Vandal, K., Rouleau, P., Talbot, M., Tessier, P. A. Proinflammatory activities of S100: proteins S100A8, S100A9, and S100A8/A9 induce neutrophil chemotaxis and adhesion. The Journal of Immunology. 170 (6), 3233-3242 (2003).
- Nukui, T., et al. S100A8/A9, a key mediator for positive feedback growth stimulation of normal human keratinocytes. Journal of Cellular Biochemistry. 104 (2), 453-464 (2008).
- Yang, D., et al. β-defensins: linking innate and adaptive immunity through dendritic and T cell CCR6. Science. 286 (5439), 525-528 (1999).
- Hsu, K., et al. Anti-infective protective properties of S100 calgranulins. Anti-Inflammatory & Anti-Allergy Agents in Medicinal Chemistry (Formerly Current Medicinal Chemistry-Anti-Inflammatory and Anti-Allergy Agents). 8 (4), 290-305 (2009).
- Nestle, F. O., Kaplan, D. H., Barker, J. Psoriasis. The New England journal of medicine. 361 (5), 496-509 (2009).
- Tsoi, L. C., et al. Identification of 15 new psoriasis susceptibility loci highlights the role of innate immunity. Nature Genetics. 44 (12), 1341 (2012).
- Swindell, W. R., et al. RNA-seq identifies a diminished differentiation gene signature in primary monolayer keratinocytes grown from lesional and uninvolved psoriatic skin. Scientific Reports. 7 (1), 1-13 (2017).
- Candi, E., Schmidt, R., Melino, G. The cornified envelope: a model of cell death in the skin. Nat Rev Mol Cell Biol. 10 (4), 328-340 (2005).
- Frost, P., Weinstein, G. D., Van Scott, E. J. The ichthyosiform dermatoses II. Journal of Investigative Dermatology. 47, 561-567 (1966).
- Reichelt, J., Furstenberger, G., Magin, T. M. Loss of keratin 10 leads to mitogen-activated protein kinase (MAPK) activation, increased keratinocyte turnover, and decreased tumor formation in mice. Journal of Investigative Dermatology. 123 (5), 973-981 (2004).
- Hu, Z., et al. Loss-of-function mutations in filaggrin gene associate with psoriasis vulgaris in Chinese population. Human Genetics. 131 (7), 1269-1274 (2012).
- Giardina, E., et al. Characterization of the loricrin (LOR) gene as a positional candidate for the PSORS4 psoriasis susceptibility locus. Annals of Human Genetics. 68 (6), 639-645 (2004).
- Suga, H., et al. Skin barrier dysfunction and low antimicrobial peptide expression in cutaneous T-cell lymphoma. Clinical Cancer Research. 20 (16), 4339-4348 (2014).
- Iotzova-Weiss, G., et al. S100A8/A9 stimulates keratinocyte proliferation in the development of squamous cell carcinoma of the skin via the receptor for advanced glycation-end products. PLoS One. 10 (3), (2015).
- Seo, M. -. D., Kang, T. J., Lee, C. H., Lee, A. -. Y., Noh, M. HaCaT keratinocytes and primary epidermal keratinocytes have different transcriptional profiles of cornified envelope-associated genes to T helper cell cytokines. Biomolecules & Therapeutics. 20 (2), 171-176 (2012).
- Soboleva, A. G., et al. Genetically predetermined limitation in the use of HaCaT cells that affects their ability to serve as an experimental model of psoriasis. Genetika. 50 (10), 1222-1231 (2014).
- Wang, Z., et al. Systematic screening and identification of novel psoriasis-specific genes from the transcriptome of psoriasis-like keratinocytes. Molecular Medicine Reports. 19 (3), 1529-1542 (2019).
- Inoue, K., et al. Mechanism underlying ATP release in human epidermal keratinocytes. The Journal of Investigative Dermatology. 134 (5), 1465-1468 (2014).
- Harden, J. L., et al. CARD14 expression in dermal endothelial cells in psoriasis. PLoS One. 9 (11), 111255 (2014).
- Krueger, J. G., et al. IL-17A is essential for cell activation and inflammatory gene circuits in subjects with psoriasis. The Journal of Allergy and Clinical Immunology. 130 (1), (2012).
- Hegyi, Z., et al. Vitamin D analog calcipotriol suppresses the Th17 cytokine-induced proinflammatory S100 "alarmins" psoriasin (S100A7) and koebnerisin (S100A15) in psoriasis. The Journal of Investigative Dermatology. 132 (5), 1416-1424 (2012).
- Schonthaler, H. B., et al. S100A8-S100A9 protein complex mediates psoriasis by regulating the expression of complement factor C3. Immunity. 39 (6), 1171-1181 (2013).
- Wilsmann-Theis, D., et al. Among the S100 proteins, S100A12 is the most significant marker for psoriasis disease activity. Journal of the European Academy of Dermatology and Venereology : JEADV. 30 (7), 1165-1170 (2016).
- Leuner, K., et al. Reduced TRPC channel expression in psoriatic keratinocytes is associated with impaired differentiation and enhanced proliferation. PLoS One. 6 (2), 14716 (2011).
- Gao, L., et al. Ozone therapy promotes the differentiation of basal keratinocytes via increasing Tp63-mediated transcription of KRT10 to improve psoriasis. Journal of Cellular and Molecular Medicine. 24 (8), 4819-4829 (2020).
- Kim, B. E., et al. TNF-α downregulates filaggrin and loricrin through c-Jun N-terminal kinase: role for TNF-α antagonists to improve skin barrier. The Journal of Investigative Dermatology. 131 (6), 1272-1279 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены