Method Article
使用细胞因子组合刺激的 HaCaT 细胞在体外建立银屑病样皮肤的转录谱
* 这些作者具有相同的贡献
摘要
本文提出了一种在 HaCaT 细胞系上使用 5 种细胞因子 (IL-17A、IL-22、IL-1α、TNF-α、OSM) 的组合在转录水平建立体外银屑病样皮肤炎症模型的方法。
摘要
银屑病是一种由先天性和适应性免疫系统介导的常见慢性炎症性皮肤病,其特征是表皮角质形成细胞异常增殖和分化以及炎症细胞浸润。皮肤特异性角质形成细胞是先天免疫的关键参与者,对免疫细胞和环境刺激做出反应,从而在银屑病的免疫发病机制中发挥重要作用。在这里,我们提出了一种使用五种促炎细胞因子组合(M5 组合)在转录水平上诱导 HaCaT 细胞系银屑病样角质形成细胞炎症的方法,包括 IL-17A、IL-22、IL-1α、TNF-α 和抑瘤素 M。结果表明,M5 组合诱导的 HaCaT 细胞显示抗菌肽(BD2、 S100A7、 S100A8 和 S100A9)、趋化因子和细胞因子(CXCL1、 CXCL2、 CXCL8、 CCL20、IL-1β、IL-6 和 IL-18)。角质形成细胞分化标志物 (Keratin1 、 Keratin10 、 Filaggrin 和 Loricrin) 的 mRNA 水平下调,这与银屑病样角质形成细胞的转录组数据一致。因此,此处描述的方法在转录水平建立了体外银屑病样皮肤炎症,并有助于银屑病分子发病机制的研究。
引言
银屑病是一种常见的非传染性慢性炎症性皮肤病,由免疫反应失调引发,影响主要形成表皮1 的角质形成细胞,其特征是角质形成细胞异常快速增殖,伴有角化过度和角化不全。银屑病影响了世界上约 3% 的野生种群2。几种合并症进一步增加了疾病负担,包括心血管疾病和综合征引起的代谢综合征3。
表皮由五层角质形成细胞组成,并随着分化过程发生形态变化:基底层、棘层、颗粒层、透明层(存在于手掌和脚底)和角质层,此处描述的从内表面到外表面4。表皮分化的变化导致皮肤屏障紊乱,这对皮肤炎症性疾病的发病机制很重要 5,6,7,8。角质形成细胞在维持完整的表皮屏障以防止水分流失和对抗环境触发因素(如 UVB 暴露、过敏原和病原体)方面起着至关重要的作用9。健康个体在基底细胞增殖和角质层脱屑之间表现出平衡,而包括牛皮癣在内的多种皮肤病的特征是这种复杂机制的不平衡10。
除了形成屏障功能外,角质形成细胞还是皮肤免疫系统的关键组成部分。在银屑病的免疫病原体中,皮肤驻留的 1 型辅助性 T 细胞 (Th1) 和 17 型辅助性 T 细胞 (Th17) 的激活分别导致 IFN-γ 和 IL-17A 的产生增加。这些细胞因子诱导角质形成细胞中趋化因子(CCL20、CXCL1/2/8/9/10/11)、抗菌肽(BD2、LL37、S100A7/8/9/12)和其他炎症因子(TNF-α、IL-6、IFN-β)的合成增加,导致更多的 Th1、Th17 和中性粒细胞募集到皮肤中,进一步放大 IL-17/IL23 轴11。角质形成细胞和免疫细胞之间的串扰负责银屑病11 的诱导和维持。
银屑病中已经描述了复杂的细胞因子网络,并且强调了免疫细胞浸润产生的促炎细胞因子(如 IL-23、IL-22、IL-17、IL-1α、抑瘤素 M (OSM) 和 TNF-α)的核心作用12,13。事实上,以前的研究表明,IL-17A、IL-22、IL-1α、TNF-α 和 OSM 水平升高在体外诱导正常人表皮角质形成细胞出现银屑病样14。
永生角质形成细胞系 (HaCaT) 比原代角质形成细胞更容易获得和培养,具有更好的可重复性,已广泛用于银屑病的研究 15,16,17,18,19,20。与人瘤病毒 16 E6/E7 转化的 HEK001 和 KerTr 细胞不同,HaCaT 细胞系能够表达分化基因产物,包括角蛋白 1 (KRT1)、角蛋白 10 (KRT10)、洛里克蛋白和丝聚蛋白 20,21,22,从而提供了一种类似于原代角质形成细胞的有前途的工具,用于研究角蛋白化和促炎的调节。
KRT5/14 是在增殖性基底角质形成细胞中表达的主要 I 型 II 型角蛋白对,而基底层上层的分化角质形成细胞下调 KRT5/14 并表达 KRT1/10 作为主要角蛋白对23。将银屑病病变与健康皮肤进行比较,角蛋白表达的变化包括银屑病表皮 KRT1/10降低 24,25 和 KRT5/14 增加26,其特征是过度增殖和角化不全27。Loricrin 是一种终末分化结构蛋白,占角质化包膜的 70% 以上,有助于角质层的保护屏障功能28,在银屑病患者的皮肤中下调29。Filaggrin 在角质形成细胞分化的最后阶段表达,并参与支架状角质化包膜30 的聚集,在银屑病病变皮肤中的表达降低29。
总体而言,我们的目标是使用细胞因子组合在 HaCaT 细胞中生成炎性角质形成细胞模型,该模型将能够协同概括银屑病皮肤病变的一些特征,包括启动免疫反应、角质形成细胞增殖和分化。
研究方案
在无菌条件下执行步骤 1 至 3。所有培养基均含有 0.1 mg/mL 青霉素和链霉素。
1. 细胞制备
- 在 100 mm 细胞培养皿中接种 1 x 10个 6 个 HaCaT 细胞,溶于 10 mL 补充有 10% 胎牛血清 (FBS) 的 Dulbecco 改良 Eagle 培养基 (DMEM) 中。将培养皿在 37 °C 下在加湿的 5% CO2 培养箱中孵育 2 天。
- 当培养物达到约 80% 汇合时,小心地从培养皿中取出培养基,并用 5 mL 1x 磷酸盐缓冲盐水 (PBS) 洗涤细胞。手动轻轻摇动培养皿。
- 去除 PBS 并向细胞中加入 2 mL 0.25% 胰蛋白酶-EDTA 溶液。轻轻摇动培养皿,让溶液完全包被单层细胞。
- 将细胞在 37 °C 下在加湿的 5% CO2 培养箱中孵育 5 分钟,直到细胞在相差显微镜下明显从培养皿表面分离。
注意:细胞的形态应呈圆形。如果细胞没有很好地分离,请在手动搅拌的同时再孵育 5 分钟。 - 细胞分离后,加入 5 mL DMEM 加 10% FBS 以灭活胰蛋白酶,并使用移液管将细胞悬液收集在 50 mL 离心管中。
- 将含有细胞悬液的试管以 180 x g 离心 5 分钟。倒出上清液。
- 向沉淀中加入 10 mL DMEM 加 10% FBS 培养基,然后轻轻上下移液以使细胞悬浮。
2. 在 6 孔板中接种细胞
- 将细胞以 2.0 x 105 个细胞/孔的密度接种在 6 孔培养板中。
- 在 M5 组合刺激之前,将 6 孔培养板在 37 °C 下在加湿的 5% CO2 培养箱中孵育过夜,以使细胞粘附在板上。
3. M5 刺激 HaCaT 细胞
- 在含有 2% FBS 的 DMEM 中制备含有 10 ng/mL 重组 IL-17A、IL-22、IL-1α、TNF-α 和抑瘤素 M 蛋白的 M5 细胞因子组合混合物。
注:M5 组合由 IL-17A、IL-22、IL-1α、TNF-α 和抑瘤素 M 的重组组成。M5 组合的协同作用概括了银屑病的一些特征,如趋化因子的上调和抗菌肽的产生31。 - 细胞培养过夜后,去除上清液,将 2 mL M5 混合培养基移液到每个孔中。
- 继续培养细胞;在 24 小时收集细胞裂解物用于 mRNA 定量(步骤 4),或在 48-72 小时收集培养物上清液,通过 ELISA 测定法32、33、34、35、36、37 (步骤 6)测定细胞因子水平。
4. 收获 M5 刺激的 HaCaT 细胞的 mRNA
- 吸出 M5 组合混合培养基,并用 1-2 mL 冷 PBS 洗涤一次。
- 吸出 PBS,并将 1 mL 市售异硫氰酸胍溶液直接加入培养皿中以裂解细胞。
- 上下移液数次以匀浆,并将细胞裂解物转移到 1.5 mL 微量离心管中。在室温下放置 5 分钟。
- 加入 200 μL 氯仿,剧烈摇动试管约 20 秒,并在室温下孵育样品 5 分钟。
- 在 4 °C 下以 12,000 x g 离心 10 分钟。
- 将水相转移至新的 1.5 mL 微量离心管中。
- 向水相中加入 500 μL 异丙醇并轻轻混合。在室温下放置 5 分钟。
- 在 4 °C 下以 10,000 x g 离心 15 分钟。
- 吸出异丙醇并加入 1 mL 75% 乙醇。洗涤沉淀一次。
- 在 4 °C 下以 7,500 x g 离心 5 分钟。 倒出乙醇,让颗粒风干。
- 向 RNA 沉淀中加入 30 μL DEPC 处理过的水。准备进行 RT-PCR 检测。
5. 通过实时 PCR 分析 mRNA 表达
- 按照制造商的说明,使用市售试剂盒用 1 μg 总 RNA 进行 cDNA 合成。
注:1 μg 总 RNA 用于 SYBR Green RT-PCR 测定。 - 制备 PCR 反应混合物。12.5 μL SYBR 预混物 EX Taq II、1 μL PCR 正向引物 (10 μM)、1 μL PCR 反向引物 (10 μM)、2 μg cDNA 和 8.5 μL dH2O。每个反应的最终体积为 25 μL。
注:本研究中用于 RT-PCR 分析的基因引物序列列表如 表 1 所示。 - 在热循环仪中孵育。循环条件包括 95 °C 变性步骤 30 s、95 °C 40 次循环 5 s、60 °C 30 s、72°C 20 s和熔解曲线分析。
- 通过使用 2-ΔΔCT方程计算 Ct (阈值循环) 值的基因表达相对差异来分析 RT-PCR 实验数据。使用 β-肌动蛋白作为 RT-PCR 相对定量基因表达标准化的内部对照。
6. 收集细胞培养上清液进行 ELISA
- 将每种细胞培养基移液到 1.5 mL 微量离心管中。
- 在 4 °C 下以 1500 x g 离心 10 分钟。
- 分装上清液并立即储存在 -80 °C。
7. ELISA 分析细胞因子表达
- 按照制造商的说明准备所有试剂、工作标准品和样品。标准品的 3 倍连续稀释,样品稀释剂的浓度范围为 2,000 至 2.74 pg/mL。用样品稀释剂以 1:2 的比例稀释样品。
- 每孔添加 100 μL 标准品和样品。用盖子盖住孔,并用石蜡膜密封板。在室温下孵育 2.5 小时。
- 2.5 小时后,丢弃溶液。向板的每个孔中加入 300 μL 洗涤缓冲液 3 分钟并吸出。再重复此过程四次。最后一次洗涤后,倒置板并轻拍吸水纸以去除剩余的液体。
- 向每个孔中加入 100 μL 检测抗体溶液。将板在摇床上于 37 °C 孵育 2 小时。
注:在每个 ELISA 试剂盒中制备生物素化检测抗体溶液。 - 使用 300 μL 洗涤缓冲液吸出并洗涤板的每个孔 5 次。最后一次洗涤后,倒置板并轻敲吸水纸以去除剩余的液体。
- 向每个孔中加入 100 μL HRP-链霉亲和素偶联物。在室温下轻轻摇动孵育 45 分钟。
- 孵育后用移液管吸出丢弃溶液。使用 300 μL 洗涤缓冲液洗涤板的每个孔 5 次。最后一次洗涤后,倒置板并轻敲吸水纸以去除剩余的液体。
- 通过向每个孔中加入 100 μL TMB 底物进行检测。在 37 °C 下避光孵育 30 分钟。
- 当颜色显现时,向每个孔中加入 50 μL 终止液。轻轻敲击板以确保充分混合。立即在 450 nm 处读取。
结果
M5 联合刺激诱导 HaCaT 细胞的炎症反应。
用或不用 M5 细胞因子组合刺激 HaCaT 细胞 24 小时。评估银屑病相关基因的 mRNA 表达,这些基因参与免疫和炎症趋化因子和抗菌肽的调节。与未处理的 HaCaT 细胞相比,中性粒细胞趋化因子 CXCL138、CXCL239、CXCL840 和 T 细胞趋化因子 CCL2041,42 在 M5 组合刺激的 HaCaT 细胞中以时间依赖性方式显着增加(图 1A)。BD243、S100A744,45、S100A846、S100A946 和 S100A1247,48 的表达,因为在未刺激的 HaCaT 细胞中几乎未检测到抗菌肽,并且在 M5 组合刺激后强烈表达,具有时间依赖性表达模式(图 2A).此外,还使用 Human Expr 12x135K Arr Del49 进行了 HaCaT 中银屑病样皮肤炎症的微阵列表达。发现细胞因子、趋化因子(图 1B)和抗菌肽(图 2B)在 M5 组合刺激的 HaCaT 中上调。通过 ELISA 研究 IL-6 、 IL-1β 、 IL-18 和 CXCL820、50、51、52、53、54 的蛋白水平作为确认。与对照细胞相比,在 M5 组合刺激的 HaCaT 细胞的上清液中观察到更高的蛋白质水平(图 1C)。同时,为评价 M5 联合诱导银屑病样皮肤炎症对 HaCaT 细胞的病理生理相关性,从基因表达综合 (GEO) 下载正常和银屑病患者病灶皮肤活检样本的微阵列数据集 (GDS4602)55。我们探索了几种促炎趋化因子、细胞因子和抗菌肽的表达水平。结果表明,与正常皮肤相比,促炎趋化因子 CXCL1、CXCL2、CXCL8 和 CCL20 以及抗菌肽 BD2、S100A7、S100A8、S100A9 和 S100A12 在银屑病皮肤中过表达(补充表 1).综上所述,这些结果表明 HaCaT 细胞中的 M5 组合刺激有助于在体外建立银屑病样炎症,促炎趋化因子增加,并在转录水平产生抗菌肽。然而,需要进一步的研究将其确立为银屑病样炎症模型的模型。
M5 联合刺激降低 HaCaT 细胞角质形成细胞分化水平
HaCaT 作为一种永生的角质形成细胞系,保留了正常角质形成细胞的功能分化特性,在器官型培养物中显示出正常的角化和分层56,57 和在高钙浓度培养基中向分化特征的正常形态发生转化 57,58,59。 KRT5 和 KRT14 的 mRNA 水平作为与增殖角质形成细胞相关的细胞角蛋白,在 M5 刺激的 HaCaT 中增加(图 3A)。为进一步探讨 M5 联合刺激对角质形成细胞分化水平的影响,评估了角质形成细胞分化标志物的 mRNA 表达。KRT1 和 KRT10 是角化过程中作为早期分化因素最早表达的,它们显着下调(图 3A)。同时,作为表皮角质化包膜主要成分的晚期分化标志物 Loricrin 和 Filaggrin 的 mRNA 水平显着下调(图 3A)。微阵列表达谱也上调角质形成细胞增殖标志物 KRT5 和 KRT6,而分化标志物 KRT1 、 KRT10 、 Loricrin 和 Filaggrin 下调 (图 3B)。这类似于在人体活检中进行的研究,与正常皮肤相比,银屑病皮肤病变 (GDS4602)60 患者的 GEO 特征显示 KRT10、丝聚蛋白和 Loricrin 表达降低(补充表 1)。总之,M5 组合降低了 HaCaT 细胞系中角质形成细胞分化标志物的表达。
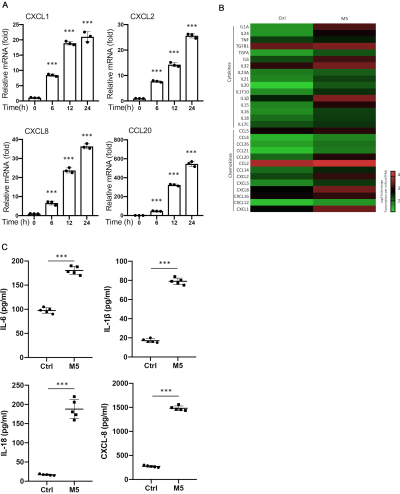
图 1:在 IL-17A、IL-22、IL-1α、TNF-α 和 OSM 组合(M5 组合)培养的 HaCaT 细胞中,趋化因子基因持续增加。 HaCaT 细胞以 M5 组合培养 6 、 12 和 24 小时。进行 QRT-PCR 分析,使用 β-肌动蛋白管家基因对 CXCL1 、 CXCL2 、 CXCL8 和 CCL20 的 mRNA 表达水平进行归一化,并在未刺激对照以上倍数增加时表达 (A),对照和 M5 刺激的 HaCaT 之间细胞因子和趋化因子表达谱的热图 (B).ELISA 检测 M5 刺激 96 h 的 HaCaT 细胞培养上清液中 IL-6 、 IL-1β 、 IL-18 和 CXCL8 水平 (C)。均值± SD *P < 0.05;**P < 0.01;P < 0.001。双尾学生 t 检验。数据表示三个独立的实验。 请单击此处查看此图的较大版本。

图 2:用 M5 组合培养的 HaCaT 细胞中的抗菌肽基因持续增加。 HaCaT 细胞以 M5 组合培养 6 、 12 和 24 小时。进行 QRT-PCR 分析,使用 β-肌动蛋白管家基因对 BD2 、 S100A7 、 S100A8 、 S100A9 和 S100A12 的 mRNA 表达水平进行归一化,并随着倍数的增加而表达 高于未刺激的对照 (A),对照和 M5 刺激的 HaCaT 之间抗菌肽表达谱的热图 分析 (B)。均值± SD *P < 0.05;**P < 0.01;P < 0.001。双尾学生 t 检验。数据表示三个独立的实验。 请单击此处查看此图的较大版本。

图 3:在 M5 组合培养的 HaCaT 细胞中,角质形成细胞分化基因持续降低。 HaCaT 细胞以 M5 组合培养 6 、 12 和 24 小时。进行 QRT-PCR 分析,使用 β-肌动蛋白管家基因对 KRT1 、 KRT10 、 Filaggrin 和 Loricrin 的 mRNA 表达水平进行标准化,并表达为倍数高于未刺激的对照 (A),对照和 M5 刺激的 HaCaT 之间角质形成细胞增殖和分化标志物表达谱的热图分析 (B)。均值± SD *P < 0.05;**P < 0.01;P < 0.001。双尾学生 t 检验。数据表示三个独立的实验。 请单击此处查看此图的较大版本。
| 引物序列 | ||
| 基因 | 向前 (5' 到 3') | 反向(5' 到 3') |
| β-肌动蛋白 | CCACGAAACTACCTTCAACTCC | GTGATCTCCTTCTGCATCCTGT |
| S100A7系列 | CCTTAGTGCCTGTGACAA | CTGCTTGTGGTAGTCTGT |
| S100A8系列 | AGTGTCCTCAGTATATCA | CATCTTTATCACCAGAATG |
| S100A9系列 | CAACACCTTCCACCAATAC | TCATTCTTATTCTCCTTCTTGAG |
| S100A12 | CAATACTCAGTTCGGAAGG | CTTTGATATTCTTGATGGTGTGTTT |
| CXCL8 | GTCCTTGTTCCACTGTGCCT | GCTTCCACATGTCCTCACAA |
| CCL20 系列 | TGACTGCTGTCTTGGATACACAGA | TGATAGCATTGATGTCACAGCCT |
| CXCL1 | GCCAGTGCTTGCAGACCCT | GGCTATGACTTCGGTTTGGG |
| CXCL2 | CAAACCGAAGTCATAGCCAC | TCTGGTCAGTTGGATTTGCC |
| BD2 | TTCTCGTTCCTCTTCATA | ATATGGCTCCACTCTTAA |
| 丝拉格林 | TGAGGGCACTGAAAGGCAAA | TGGCCACATAAACCTGGGTC |
| 洛里克林 | GGGCACCGATGGGCTTAG | GGTAGGTTAAGACATGAAGGATTTGC |
| 克尔特14 | CCAGTTCTCCTCTGGATCGC | TCCAGTGGGATCTGTGTCCA |
| 克尔特10 | CCTGCTTCAGATCGACAATGCC | ATCTCCAGGTCAGCCTTGGTCA |
| KRT5 | TGTCAAGAAACAGTGCGCCA | GCTGCTGGAGTAGTAGCTTCC |
| 克尔特1 | CCCTCCTGGTGGCATACAAG | GTTGGTCCACTCTCCTTCGG |
表 1:用于 RT-PCR 分析的基因引物序列列表
| 基因 | 率 银屑病/控制 | p 值 |
| 趋化因子 | ||
| CXCL1 | 5.34 | <0.001 |
| CXCL2 | 10.14 | <0.001 |
| CXCL8 | 18.59 | <0.001 |
| CCL20 系列 | 7.07 | <0.001 |
| 抗菌肽 | ||
| BD2 | 193.55 | <0.001 |
| S100A7系列 | 15.31 | <0.001 |
| S100A8系列 | 10.14 | <0.001 |
| S100A9系列 | 52.46 | <0.001 |
| S100A12 | 52.48 | <0.001 |
| 角质形成细胞分化 | ||
| 丝拉格林 | 0.58 | <0.001 |
| 洛里克林 | 0.47 | <0.001 |
| KRT10 系列 | 0.92 | <0.001 |
补充表 1:银屑病病变皮肤与正常皮肤的 GEO 概况。GEO 剖面 (GSD4602) 数据来自 58 例正常皮肤和 64 例银屑病病变皮肤的皮肤穿刺活检。使用 Prism 8 软件计算银屑病病变皮肤与正常皮肤之间的比率。使用 Mann-Whitney U 检验分析 p 值。
讨论
本文描述的是一种使用五种细胞因子组合(IL-17A、IL-22、IL-1α、TNF-α、OSM)进入 HaCaT 细胞系以在转录水平建立体外银屑病样皮肤炎症谱的方法。该方案可适用于基因在银屑病发病机制中的机制研究以及银屑病治疗药物的筛选。最近的报道表明,在病变皮肤中过表达产生 CD8 T 细胞的 IL-17A 和 IL22 表明它们参与银屑病的发病机制61。IL-1α、IL-22 和 IL-17A 可在动物模型中诱导皮肤炎症62、63、64、65。能够诱导与产生的抗菌肽相关的特异性表达模式的细胞因子,例如 IL-17 和 IL-2266 或先天免疫反应,例如 IL-17、IL-1α 和 TNF-α 11,62,67 或角质形成细胞分化程序,例如 IL-22 或 OSM68,69.我们的结果证实 IL-17A 、 IL-22 、 IL-1α 、 TNF-α 和 OSM 是主要的皮肤炎症诱导剂,并证明了对 HaCaT 细胞系中趋化因子、细胞因子和抗菌肽表达的强大协同作用。
值得注意的是,M5 组合诱导吸引趋化因子 CXCL1、CXCL2、CXCL8 的中性粒细胞的 HaCaT 细胞表达,以及 CCR6+ Th17 细胞趋化因子 CCL20 的募集,这在银屑病的发生和维持中起决定性作用 70,71,72。抗菌肽被怀疑通过多种机制改变宿主炎症反应,包括作为血管生成因子、趋化剂和细胞增殖调节剂的作用,近年来与银屑病的发展有关73。S100A8 和 S100A9 也参与炎症浸润的募集74,75。S100A8 和 S100A9 可增强角质形成细胞中 CXCL1、CXCL2、CXCL8 和 CCL20 的产生76。BD2 具有趋化因子活性,可通过与 CCR677 相互作用将记忆 T 细胞和未成熟的树突状细胞募集到微生物侵袭部位。S100A12 对肥大细胞和单核细胞具有趋化性78。在 M5 刺激的 HaCaT 银屑病样体外模型中表达的抗菌肽对皮肤的自然防御至关重要,也有利于促进炎症细胞的浸润。
我们的数据显示,在 HaCaT 细胞中 M5 联合刺激后,早期 (KRT1 和 KRT10) 和晚期 (Filaggrin 和 Loricrin) 分化基因的表达显著降低(图 2)。银屑病的特征是增殖率不受控制地增加和分化不良79。GWAS 已经鉴定出许多与银屑病相关的遗传变异,包括许多对角质形成细胞分化至关重要的基因80。银屑病角质形成细胞 RNA-seq 鉴定的差异表达降低的基因富集了与表皮分化相关的基因81。银屑病角质形成细胞显示早期 (KRT1 、 KRT10 、 DSC1 )和晚期 (LOR 、 FLG 、 IVL) 分化基因的表达降低81。KRT1 和 KRT10 直接参与细胞周期控制,从而启动角质形成细胞分化82。KRT1/10 突变或 KRT10 缺失显示基底层表皮增生更大83,84。丝聚蛋白基因的功能丧失突变 (p.K4022X) 与银屑病85 有关。Loricrin 作为 PSORS4 基因座的候选者,突变会扰乱角质形成细胞分化并延迟细胞死亡过程86。观察到银屑病病变皮肤中角质形成细胞的丝聚蛋白和 loricrin 表达降低87。此外,S100A8/A9 通过诱导 p38 和 SAPK/JNK 磷酸化,然后激活 ERK1/2 来刺激角质形成细胞增殖88。总之,M5 组合刺激 HaCaT 细胞的角质形成细胞分化过程的 mRNA 表达模式与银屑病皮肤病变的表达模式一致。
在该方案中,HaCaT 细胞系用于在体外建立银屑病样皮肤炎症模型,因为它们易于获得和培养,具有良好的稳定性和可重复性。尽管 HaCaT 细胞已广泛用于银屑病研究 15,16,17,18,19,但据报道,HaCaT 细胞中角质化包膜相关蛋白的基因转录谱通常与原代角质形成细胞不同,这表明 HaCaT 细胞作为模型研究正常皮肤屏障发育存在局限性89,90.同时,HaCaT 表达的角蛋白谱比原代角质形成细胞培养物中通常看到的角蛋白谱要广泛得多,包括与简单上皮19 相关的角蛋白。在我们之前的研究中,用 M5 刺激的基因本体论 (GO) 富集分析 HaCaT 细胞在银屑病患者病变皮肤和表皮的转录组数据中显示出类似的基因富集。在银屑病样 HaCaT 细胞的差异表达基因 (DEG) 中,我们发现 M5 刺激的 HaCaT 细胞中的 DEGs 模式与银屑病的致病性相关 (GSE54456, GSE26866)91。同时,趋化因子 40,92,93,抗菌肽 46,94,95,96,97 和角质形成细胞分化标志物 97,98,99,100 的免疫组化模式在银屑病患者中与 GEO 数据库一致。因此,用 M5 刺激的 HaCaT 细胞作为体外银屑病样皮肤炎症模型与原代角质形成细胞相似。
值得注意的是,重组细胞因子的活性对实验的成功至关重要。必须始终将溶解的重组细胞因子进行工作等分试样,并避免冻融循环。同时,我们发现与 10% FBS 相比,培养基加 2% FBS 刺激的 M5 刺激的银屑病样皮肤炎症更强。此外,在筛选潜在药物或研究银屑病机制之前,识别促炎趋化因子的表达对于检测 M5 诱导的银屑病样模型是否成功是必要的。
在这里,我们建立了一种刺激 HaCaT 细胞银屑病样皮肤炎症模型的 M5 组合,显示银屑病患者炎症介质的一致表达和角质形成细胞分化水平降低,证明了研究细胞因子对体外病理生理状况的协同作用的优势。IL-17A、IL22、IL-1α、TNF-α 和 OSM 协同刺激可能是一种新颖的有价值的策略,可以识别疾病的关键致病组织特异性分子,并代表未来银屑病治疗开发的潜在生物标志物或药物靶点。
披露声明
作者未报告潜在的利益冲突。
致谢
这项工作得到了中国国家自然科学基金的支持 [81703132, 31271483, 81472650, 81673061, 81573050, 31872739, and 81601462]
材料
| Name | Company | Catalog Number | Comments |
| DMEM—Dulbecco's Modified Eagle Medium | Gibco | 11965092 | |
| Fetal Bovine Serum | Gibco | 10100139C | |
| HaCaT cells | China Center for Type CultureCollection | GDC0106 | Less than 15 generations |
| Human IL-1β ELISA Kit | Beyotime | PI305 | |
| Human IL-6 ELISA Kit | Beyotime | PI330 | |
| Human IL-8 ELISA Kit | Beyotime | PI640 | |
| IL-1 alpha Human | Prospec | CYT-253 | Recombinant protein |
| IL-17 Human | Prospec | CYT-250 | Recombinant protein |
| IL-22 Human | Prospec | CYT-328 | Recombinant protein |
| OSM Human | Prospec | CYT-231 | Recombinant protein |
| PBS | Gibco | 10010049 | pH 7.4 |
| Penicillin-Streptomycin | Gibco | 15140163 | |
| PrimeScrip RT reagent Kit | TAKARA | RR047A | |
| TB Green Premix Ex Taq | TAKARA | RR420A | |
| TNF alpha Human | Prospec | CYT-223 | Recombinant protein |
| TRIzo Reagent | Invitrogen | 15596018 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | 25200072 |
参考文献
- Lowes, M. A., Bowcock, A. M., Krueger, J. G. Pathogenesis and therapy of psoriasis. Nature. 445 (7130), 866-873 (2007).
- Gupta, R., Debbaneh, M. G., Liao, W. Genetic epidemiology of psoriasis. Current dermatology reports. 3 (1), 61-78 (2014).
- Boehncke, W. -. H., Schön, M. P. Psoriasis. Lancet. 386 (9997), 983-994 (2015).
- Zaidi, Z., Lanigan, S. W., Lanigan, W. S., Zaidi, Z. . Dermatology in Clinical Practice. , 1-15 (2010).
- Proksch, E., Brandner, J. M., Jensen, J. M. The skin: An indispensable barrier. Experimental Dermatology. 17 (12), 1063-1072 (2008).
- Van Smeden, J., Janssens, M., Gooris, G., Bouwstra, J. The important role of stratum corneum lipids for the cutaneous barrier function. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1841 (3), 295-313 (2014).
- Wolf, R., Orion, E., Ruocco, E., Ruocco, V. Abnormal epidermal barrier in the pathogenesis of psoriasis. Clinics in Dermatology. 30 (3), 323-328 (2012).
- Proksch, E., Brasch, J. Abnormal epidermal barrier in the pathogenesis of contact dermatitis. Clinics in Dermatology. 30 (3), 335-344 (2012).
- Bäsler, K., Brandner, J. M. Tight junctions in skin inflammation. Pflügers Archiv-European Journal of Physiology. 469 (1), 3-14 (2017).
- Hoffjan, S., Stemmler, S. On the role of the epidermal differentiation complex in ichthyosis vulgaris, atopic dermatitis and psoriasis. British Journal of Dermatology. 157 (3), 441-449 (2007).
- Lowes, M. A., Russell, C. B., Martin, D. A., Towne, J. E., Krueger, J. G. The IL-23/T17 pathogenic axis in psoriasis is amplified by keratinocyte responses. Trends in Immunology. 34 (4), 174-181 (2013).
- Saxena, A., Raychaudhuri, S. K., Raychaudhuri, S. P. . Psoriatic Arthritis and Psoriasis. , 73-82 (2016).
- Lowes, M. A., Suárez-Fariñas, M., Krueger, J. G. Immunology of psoriasis. Annual Review of Immunology. 32, 227-255 (2014).
- Guilloteau, K., et al. Skin inflammation induced by the synergistic action of IL-17A, IL-22, oncostatin M, IL-1α, and TNF-α recapitulates some features of psoriasis. The Journal of Immunology. 184 (9), 5263-5270 (2010).
- Wang, Z., et al. Autophagy-based unconventional secretion of HMGB1 by keratinocytes plays a pivotal role in psoriatic skin inflammation. Autophagy. , 1-24 (2020).
- Choi, D. H., Hwang, H. S. Anti-inflammation activity of brazilin in TNF-α induced human psoriasis dermatitis skin model. Applied Biological Chemistry. 62 (1), 46 (2019).
- Teng, X., et al. IL-37 ameliorates the inflammatory process in psoriasis by suppressing proinflammatory cytokine production. Journal of Immunology. 192 (4), 1815-1823 (2014).
- Wu, S., et al. The potential of Diosgenin in treating psoriasis: Studies from HaCaT keratinocytes and imiquimod-induced murine model. Life Sciences. 241, 117115 (2020).
- Katarzyna, B., Elwira, S., Marta, M., Joanna, J. -. B., Magdalena, G. -. C. Models in the Research Process of Psoriasis. International Journal of Molecular Ences. 18 (12), 2514 (2017).
- Auewarakul, P., Gissmann, L., Cid-Arregui, A. Targeted expression of the E6 and E7 oncogenes of human papillomavirus type 16 in the epidermis of transgenic mice elicits generalized epidermal hyperplasia involving autocrine factors. Molecular and Cellular Biology. 14 (12), 8250-8258 (1994).
- Boukamp, P., et al. Normal keratinization in a spontaneously immortalized aneuploid human keratinocyte cell line. Journal of Cell Biology. 106 (3), 761-771 (1988).
- Irma, C., et al. HaCaT cells as a reliable in vitro differentiation model to dissect the inflammatory/repair response of human keratinocytes. Mediators of Inflammation. 2017, 7435621 (2017).
- Melino, G., et al. The cornified envelope: a model of cell death in the skin. Results & Problems in Cell Differentiation. 24 (4), 175 (1998).
- Thewes, M., Stadler, R., Mischke, B. K. Normal psoriatic epidermis expression of hyperproliferation-associated keratins. Archives of Dermatological Research. , (1991).
- Ishida-Yamamoto, A., Senshu, T., Takahashi, H., Akiyama, K., Iizuka, H. Decreased deiminated keratin K1 in psoriatic hyperproliferative epidermis. Journal of investigative Dermatology. 114 (4), 701-705 (2000).
- Elango, T., et al. Methotrexate normalized keratinocyte activation cycle by overturning abnormal keratins as well as deregulated inflammatory mediators in psoriatic patients. Clinica Chimica Acta. , 329-337 (2015).
- Ghadially, R., Reed, J. T., Elias, P. M. Stratum corneum structure and function correlates with phenotype in psoriasis. Journal of investigative dermatology. 107 (4), 558-564 (1996).
- Nithya, S., Radhika, T., Jeddy, N. Loricrin - An overview. Journal of Oral and Maxillofacial Pathology. 19 (1), (2015).
- Kim, B. E., et al. TNF-α downregulates filaggrin and loricrin through c-Jun N-terminal Kinase: Role for TNF-α antagonists to improve skin barrier. Journal of Allergy & Clinical Immunology. 127 (2), (2011).
- Gutowska-Owsiak, D., et al. IL-17 downregulates filaggrin and affects keratinocyte expression of genes associated with cellular adhesion. Experimental dermatology. 21 (2), 104-110 (2012).
- Guilloteau, K., et al. Skin inflammation induced by the synergistic action of IL-17A, IL-22, oncostatin M, IL-1α, and TNF-α recapitulates some features of psoriasis. Journal of Immunology. 184 (9), 5263-5270 (2010).
- Jeon, B., et al. Optimization and validation of a method to identify skin sensitization hazards using IL-1 α and IL-6 secretion from HaCaT. Toxicology In Vitro : An International Journal Published in Association with BIBRA. 61, 104589 (2019).
- Lee, K. -. M., Kang, J. H., Yun, M., Lee, S. -. B. Quercetin inhibits the poly(dA:dT)-induced secretion of IL-18 via down-regulation of the expressions of AIM2 and pro-caspase-1 by inhibiting the JAK2/STAT1 pathway in IFN-γ-primed human keratinocytes. Biochemical and Biophysical Research Communications. 503 (1), 116-122 (2018).
- Lee, N., Chung, Y. C., Kang, C. I., Park, S. -. M., Hyun, C. -. G. 7,8-dimethoxycoumarin attenuates the expression of IL-6, IL-8, and CCL2/MCP-1 in TNF-α-treated HaCaT cells by potentially targeting the NF-κB and MAPK pathways. Cosmetics. 6 (3), (2019).
- Smolińska, E., Moskot, M., Jakóbkiewicz-Banecka, J., Wgrzyn, G., Gabig-Cimińska, M. Molecular action of isoflavone genistein in the human epithelial cell line HaCaT. PLoS One. 13 (2), 0192297 (2018).
- Ying, X., Yan, Y., Li, Y. Tripterine alleviates LPS-induced inflammatory injury by up-regulation of miR-146a in HaCaT cells. Biomedicine & Pharmacotherapy. 105, 798 (2018).
- Zhang, M., et al. AIM2 inflammasome mediates Arsenic-induced secretion of IL-1 β and IL-18. Oncoimmunology. 5 (6), 1160182 (2016).
- Lowes, M. A., et al. Immunology of Psoriasis. Annual Review of Immunology. 32, 227-255 (2014).
- Nedoszytko, B., Wojdyło, M. S., Dziurdzińska, K. -. S., Roszkiewicz, J., Nowicki, R. J. Chemokines and cytokines network in the pathogenesis of the inflammatory skin diseases: atopic dermatitis, psoriasis and skin mastocytosis. Postepy Dermatologii i Alergologii. 31, 84-91 (2014).
- Glowacka, E., Lewkowicz, P., Rotsztejn, H., Zalewska, A. IL-8, IL-12 and IL-10 cytokines generation by neutrophils, fibroblasts and neutrophils- fibroblasts interaction in psoriasis. Advances in Medical Sciences. 55 (2), 254-260 (2010).
- Li, H., et al. Cyr61/CCN1 induces CCL20 production by keratinocyte via activating p38 and JNK/AP-1 pathway in psoriasis. Journal of Dermatological Science. 88 (1), 46-56 (2017).
- Kim, T. G., et al. Dermal clusters of mature dendritic cells and T cells are associated with the CCL20/CCR6 chemokine system in chronic psoriasis. Journal of Investigative Dermatology. 134 (5), 1462-1465 (2014).
- Kolbinger, F., et al. β-Defensin 2 is a responsive biomarker of IL-17A-driven skin pathology in patients with psoriasis. The Journal of Allergy and Clinical Immunology. 139 (3), (2017).
- Ekman, A., Vegfors, J., Eding, C., Enerbäck, C. Overexpression of psoriasin (S100A7) contributes to dysregulated differentiation in psoriasis. Acta Dermato-Venereologica. 97 (4), 441-448 (2016).
- Peric, M., et al. Vitamin D analog calcipotriol suppresses the Th17 cytokine-induced proinflammatory S100 "Alarmins" psoriasin (S100A7) and Koebnerisin (S100A15) in psoriasis. Journal of Investigative Dermatology. 132 (5), 1416-1424 (2012).
- Aochi, S., et al. Markedly elevated serum levels of calcium-binding S100A8/A9 proteins in psoriatic arthritis are due to activated monocytes/macrophages. Journal of the American Academy of Dermatology. 64 (5), 879-887 (2011).
- Krueger, J. G., et al. IL-17A is essential for cell activation and inflammatory gene circuits in subjects with psoriasis. Journal of Allergy Clinical Immunology. 130 (1), 145-154 (2012).
- Wilsmann-Theis, D., et al. Among the S100 proteins, S100A12 is the most significant marker for psoriasis disease activity. Journal of the European Academy of Dermatology & Venereology. 30 (7), 1165-1170 (2016).
- Wang, Z., et al. Systematic screening and identification of novel psoriasis-specific genes from the transcriptome of psoriasis-like keratinocytes. Molecular Medicine Reports. 19 (3), 1529-1542 (2018).
- Mizutani, H., Ohmoto, Y., Mizutani, T., Murata, M., Shimizu, M. Role of increased production of monocytes TNF-alpha, IL-1beta and IL-6 in psoriasis: relation to focal infection, disease activity and responses to treatments. Journal of dermatological science. 14 (2), 145-153 (1997).
- Pietrzak, A., Lecewicz-Torun, B., Chodorowska, G., Rolinski, J. Interleukin-18 levels in the plasma of psoriatic patients correlate with the extent of skin lesions and the PASI score. Acta Dermato-Venereologica. 83 (4), 262-265 (2003).
- Cai, Y., et al. A critical role of the IL-1β-IL-1R signaling pathway in skin inflammation and psoriasis pathogenesis. Journal of investigative Dermatology. 139 (1), 146-156 (2018).
- Arican, O., Aral, M., Sasmaz, S., Ciragil, P. Serum levels of TNF-α, IFN-γ IL-6, IL-8,IL-12, IL-17, and IL-18 in patients with active psoriasis and correlation with disease severity. Mediators of Inflammation. 2005 (5), 273-279 (2005).
- Grossman, R. M., et al. Interleukin 6 is expressed in high levels in psoriatic skin and stimulates proliferation of cultured human keratinocytes. Proceedings of the National Academy of Sciences of the United States of America. 86 (16), 6367-6371 (1989).
- Nair, R. P., et al. Genome-wide scan reveals association of psoriasis with IL-23 and NF-kappaB pathways. Nature Genetics. 41 (2), 199-204 (2009).
- Boukamp, P., et al. Normal keratinization in a spontaneously immortalized aneuploid human keratinocyte cell line. The Journal of Cell Biology. 106 (3), 761-771 (1988).
- Deyrieux, A. F., Wilson, V. G. In vitro culture conditions to study keratinocyte differentiation using the HaCaT cell line. Cytotechnology. 54 (2), 77-83 (2007).
- Micallef, L., et al. Effects of extracellular calcium on the growth-differentiation switch in immortalized keratinocyte HaCaT cells compared with normal human keratinocytes. Experimental Dermatology. 18 (2), 143-151 (2009).
- Wilson, V. G. . Epidermal Cells. , 33-41 (2013).
- Ding, J., et al. Gene expression in skin and lymphoblastoid cells: Refined statistical method reveals extensive overlap in cis-eQTL signals. American Journal of Human Genetics. 87 (6), 779-789 (2010).
- Res, P. C., et al. Overrepresentation of IL-17A and IL-22 producing CD8 T cells in lesional skin suggests their involvement in the pathogenesis of psoriasis. PLoS One. 5 (11), (2010).
- Groves, R. W., Mizutani, H., Kieffer, J. D., Kupper, T. S. Inflammatory skin disease in transgenic mice that express high levels of interleukin 1 alpha in basal epidermis. Proceedings of the National Academy of Sciences. 92 (25), 11874-11878 (1995).
- Chan, J. R., et al. IL-23 stimulates epidermal hyperplasia via TNF and IL-20R2-dependent mechanisms with implications for psoriasis pathogenesis. The Journal of Experimental Medicine. 203 (12), 2577-2587 (2006).
- Zheng, Y., et al. Interleukin-22, a TH 17 cytokine, mediates IL-23-induced dermal inflammation and acanthosis. Nature. 445 (7128), 648-651 (2007).
- Ma, H. -. L., et al. IL-22 is required for Th17 cell-mediated pathology in a mouse model of psoriasis-like skin inflammation. The Journal of Clinical Investigation. 118 (2), 597-607 (2008).
- Lowes, M. A., Russell, C. B., Martin, D. A., Towne, J. E., Krueger, J. G. The IL-23/T17 pathogenic axis in psoriasis is amplified by keratinocyte responses. Trends Immunol. 34 (4), 174-181 (2013).
- Banno, T., Gazel, A., Blumenberg, M. Effects of tumor necrosis factor-α (TNFα) in epidermal keratinocytes revealed using global transcriptional profiling. Journal of Biological Chemistry. 279 (31), 32633-32642 (2004).
- Boniface, K., et al. IL-22 inhibits epidermal differentiation and induces proinflammatory gene expression and migration of human keratinocytes. The Journal of Immunology. 174 (6), 3695-3702 (2005).
- Boniface, K., et al. Oncostatin M secreted by skin infiltrating T lymphocytes is a potent keratinocyte activator involved in skin inflammation. The Journal of Immunology. 178 (7), 4615-4622 (2007).
- Terui, T. Role of neutrophils in induction of acute inflammation in T-cell-mediated immune dermatosis, psoriasis: A neutrophil-associated inflammation-boosting loop. Experimental Dermatology. 9, (2000).
- Chiang, C. -. C., Cheng, W. -. J., Korinek, M., Lin, C. -. Y., Hwang, T. -. L. Neutrophils in psoriasis. Frontiers in Immunology. 10, 2376 (2019).
- Kennedy-Crispin, M., et al. Human keratinocytes' response to injury upregulates CCL20 and other genes linking innate and adaptive immunity. The Journal of Investigative Dermatology. 132 (1), 105-113 (2012).
- Morizane, S., Gallo, R. L. Antimicrobial peptides in the pathogenesis of psoriasis. The Journal of Dermatology. 39 (3), 225-230 (2012).
- Vandal, K., et al. Blockade of S100A8 and S100A9 suppresses neutrophil migration in response to lipopolysaccharide. The Journal of Immunology. 171 (5), 2602-2609 (2003).
- Ryckman, C., Vandal, K., Rouleau, P., Talbot, M., Tessier, P. A. Proinflammatory activities of S100: proteins S100A8, S100A9, and S100A8/A9 induce neutrophil chemotaxis and adhesion. The Journal of Immunology. 170 (6), 3233-3242 (2003).
- Nukui, T., et al. S100A8/A9, a key mediator for positive feedback growth stimulation of normal human keratinocytes. Journal of Cellular Biochemistry. 104 (2), 453-464 (2008).
- Yang, D., et al. β-defensins: linking innate and adaptive immunity through dendritic and T cell CCR6. Science. 286 (5439), 525-528 (1999).
- Hsu, K., et al. Anti-infective protective properties of S100 calgranulins. Anti-Inflammatory & Anti-Allergy Agents in Medicinal Chemistry (Formerly Current Medicinal Chemistry-Anti-Inflammatory and Anti-Allergy Agents). 8 (4), 290-305 (2009).
- Nestle, F. O., Kaplan, D. H., Barker, J. Psoriasis. The New England journal of medicine. 361 (5), 496-509 (2009).
- Tsoi, L. C., et al. Identification of 15 new psoriasis susceptibility loci highlights the role of innate immunity. Nature Genetics. 44 (12), 1341 (2012).
- Swindell, W. R., et al. RNA-seq identifies a diminished differentiation gene signature in primary monolayer keratinocytes grown from lesional and uninvolved psoriatic skin. Scientific Reports. 7 (1), 1-13 (2017).
- Candi, E., Schmidt, R., Melino, G. The cornified envelope: a model of cell death in the skin. Nat Rev Mol Cell Biol. 10 (4), 328-340 (2005).
- Frost, P., Weinstein, G. D., Van Scott, E. J. The ichthyosiform dermatoses II. Journal of Investigative Dermatology. 47, 561-567 (1966).
- Reichelt, J., Furstenberger, G., Magin, T. M. Loss of keratin 10 leads to mitogen-activated protein kinase (MAPK) activation, increased keratinocyte turnover, and decreased tumor formation in mice. Journal of Investigative Dermatology. 123 (5), 973-981 (2004).
- Hu, Z., et al. Loss-of-function mutations in filaggrin gene associate with psoriasis vulgaris in Chinese population. Human Genetics. 131 (7), 1269-1274 (2012).
- Giardina, E., et al. Characterization of the loricrin (LOR) gene as a positional candidate for the PSORS4 psoriasis susceptibility locus. Annals of Human Genetics. 68 (6), 639-645 (2004).
- Suga, H., et al. Skin barrier dysfunction and low antimicrobial peptide expression in cutaneous T-cell lymphoma. Clinical Cancer Research. 20 (16), 4339-4348 (2014).
- Iotzova-Weiss, G., et al. S100A8/A9 stimulates keratinocyte proliferation in the development of squamous cell carcinoma of the skin via the receptor for advanced glycation-end products. PLoS One. 10 (3), (2015).
- Seo, M. -. D., Kang, T. J., Lee, C. H., Lee, A. -. Y., Noh, M. HaCaT keratinocytes and primary epidermal keratinocytes have different transcriptional profiles of cornified envelope-associated genes to T helper cell cytokines. Biomolecules & Therapeutics. 20 (2), 171-176 (2012).
- Soboleva, A. G., et al. Genetically predetermined limitation in the use of HaCaT cells that affects their ability to serve as an experimental model of psoriasis. Genetika. 50 (10), 1222-1231 (2014).
- Wang, Z., et al. Systematic screening and identification of novel psoriasis-specific genes from the transcriptome of psoriasis-like keratinocytes. Molecular Medicine Reports. 19 (3), 1529-1542 (2019).
- Inoue, K., et al. Mechanism underlying ATP release in human epidermal keratinocytes. The Journal of Investigative Dermatology. 134 (5), 1465-1468 (2014).
- Harden, J. L., et al. CARD14 expression in dermal endothelial cells in psoriasis. PLoS One. 9 (11), 111255 (2014).
- Krueger, J. G., et al. IL-17A is essential for cell activation and inflammatory gene circuits in subjects with psoriasis. The Journal of Allergy and Clinical Immunology. 130 (1), (2012).
- Hegyi, Z., et al. Vitamin D analog calcipotriol suppresses the Th17 cytokine-induced proinflammatory S100 "alarmins" psoriasin (S100A7) and koebnerisin (S100A15) in psoriasis. The Journal of Investigative Dermatology. 132 (5), 1416-1424 (2012).
- Schonthaler, H. B., et al. S100A8-S100A9 protein complex mediates psoriasis by regulating the expression of complement factor C3. Immunity. 39 (6), 1171-1181 (2013).
- Wilsmann-Theis, D., et al. Among the S100 proteins, S100A12 is the most significant marker for psoriasis disease activity. Journal of the European Academy of Dermatology and Venereology : JEADV. 30 (7), 1165-1170 (2016).
- Leuner, K., et al. Reduced TRPC channel expression in psoriatic keratinocytes is associated with impaired differentiation and enhanced proliferation. PLoS One. 6 (2), 14716 (2011).
- Gao, L., et al. Ozone therapy promotes the differentiation of basal keratinocytes via increasing Tp63-mediated transcription of KRT10 to improve psoriasis. Journal of Cellular and Molecular Medicine. 24 (8), 4819-4829 (2020).
- Kim, B. E., et al. TNF-α downregulates filaggrin and loricrin through c-Jun N-terminal kinase: role for TNF-α antagonists to improve skin barrier. The Journal of Investigative Dermatology. 131 (6), 1272-1279 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。