Method Article
Infecção in vivo e in vitro de raízes de batata com nematóides parasitas de plantas para avaliação de alterações estruturais induzidas
Neste Artigo
Resumo
O protocolo descreve a infecção de raízes de Solanum tuberosum com nematóides parasitas de plantas em condições de casa de vegetação in vivo e raízes transgênicas in vitro de batata para análise histoquímica da estrutura radicular por meio de microscopia óptica.
Resumo
Os nematóides parasitas de plantas (PPNs) que vivem no solo são importantes pragas da batata que causam lesões e/ou alteram a estrutura das raízes das plantas, levando à redução da aptidão e produtividade das culturas. Pesquisas sobre os mecanismos celulares e subcelulares de infecção e desenvolvimento de PPNs podem recorrer a plantas de campo ou mudas em condições de casa de vegetação. Os estudos de campo são mais representativos dos ambientes naturais, mas estão sujeitos à imprevisibilidade das condições ambientais que podem influenciar fortemente os resultados da pesquisa. Os estudos em casa de vegetação permitem maior controle sobre as variáveis ambientais e maior segurança contra contaminantes ou patógenos. No entanto, em alguns hospedeiros, a diversidade genética torna-se um importante fator de variabilidade e influencia a resposta do complexo parasito-hospedeiro. Desenvolvemos co-culturas in vitro de raízes transgênicas com PPNs como uma alternativa confiável que ocupa menos espaço, requer menos tempo para obter e é livre de contaminação ou de variabilidade genética do hospedeiro. As co-culturas são obtidas pela introdução de PPNs assépticos para hospedar raízes transgênicas in vitro . Eles podem ser mantidos indefinidamente, o que os torna um excelente suporte para manter coleções de PPNs de referência. No presente trabalho, é detalhado um protocolo para a infecção controlada de raízes de batata in vivo com o nematóide da lesão radicular e para o estabelecimento in vitro de co-culturas de raízes transgênicas de batata com o nematoide das galhas. As co-culturas in vitro forneceram um proxy laboratorial para a condição natural de infecção da batata e produziram estágios de vida do nematóide, independentemente da estação ou das condições climáticas. Além disso, a metodologia utilizada para análise estrutural é detalhada usando histoquímica e microscopia óptica. O corante ácido fucsina é usado para seguir os locais de ataque de nematóides nas raízes, enquanto a coloração diferencial com ácido periódico-Schiff (PAS) e azul de toluidina O destaca as estruturas dos nematóides no tecido radicular interno da batata.
Introdução
As culturas de raízes e tubérculos ocupam o4º lugar entre os alimentos básicos mais importantes do mundo. A batata (Solanum tuberosum L.) é um dos tubérculos cultivados mais importantes. Teve sua origem na Cordilheira dos Andes, na América do Sul, mas depois de ser introduzida na Europa noséculo 16, rapidamente se tornou a fonte de alimento mais comum para a população de baixa renda. Hoje, as batatas representam 1,7% da ingestão calórica mundial1. A produção agrícola é fortemente afetada por pragas e patógenos de plantas, dos quais os nematóides parasitas de plantas (PPNs) podem causar perdas médias de rendimento que chegam a 12%2. Os nematóides parasitas de plantas são responsáveis por algumas das doenças mais prejudiciais às culturas na agricultura moderna. Os NPPs que habitam o solo impõem grandes perdas aos agricultores porque afetam as raízes das plantas e interferem na produtividade das culturas, reduzindo a produção e/ou prejudicando os produtos, tornando-os não comercializáveis3. Esses fitoparasitas perigosos usam seu estilete (um aparelho bucal em forma de agulha) para perfurar as células da raiz e se alimentar do conteúdo celular. Alguns PPNs se alimentam de fora das raízes, outros entram na raiz e causam danos aos tecidos (migratórios), enquanto outros entram nas raízes e se tornam sedentários, mudando fortemente a estrutura radicular para facilitar a alimentação4. Os principais NPPs que afetam a batata são os nematóides de cisto da batata, Globodera spp., nematóides das galhas (RKN), Meloidogyne spp., nematóides das lesões radiculares, Pratylenchus spp., o falso nematóide das galhas Nacobbus aberrans e o nematóide da podridão da batata Ditylenchus destructor. Para esses NPPs, diferentes hábitos alimentares induzem diferentes mudanças estruturais nos tecidos radiculares do hospedeiro 5,6. A pesquisa sobre os mecanismos de infecção por NPP e a resposta do hospedeiro é frequentemente realizada por meio de ensaios de campo ou em estufa para manter coleções de culturas de NPP de referência ou para realizar experimentos em larga escala 7,8. Os ensaios em condições naturais são fortemente influenciados pela variação ambiental e pelos fatores de stress bióticos ou abióticos. Os bioensaios em estufa são uma alternativa mais próxima de uma condição natural, permitindo um controle relativo da variação ambiental e limitando a influência do estresse abiótico e biótico. No entanto, a diversidade genética do hospedeiro ainda pode ser um desafio para ensaios que requerem um controle mais preciso da variabilidade biológica. Essas limitações podem ser superadas recorrendo a culturas de tecidos vegetais in vitro. Estes são sistemas laboratoriais versáteis com muitas vantagens para a pesquisa de doenças PPNs. Para PPNs que habitam o solo, culturas in vitro de raízes transgênicas são uma ferramenta útil para pesquisas em condições de laboratório 9,10.
Raízes transgênicas, ou raízes peludas (HR), são obtidas após infecção de material vegetal com Rhizobium rhizogenes (Riker et al. 1930) Young et al. 200111. Essa bactéria gram-negativa induz a transfecção de seu plasmídeo Ri para o genoma do hospedeiro e altera a regulação da biossíntese de hormônios vegetais, promovendo a formação de tecido radicular12. As raízes transgênicas podem ser mantidas indefinidamente sob assepsia em um meio de cultura. As vantagens do uso do HR para o estudo de NPPs são uma alta taxa de crescimento na ausência de reguladores de crescimento de plantas que influenciam a infecção e o desenvolvimento de nematoides, uma alta proporção de produção de biomassa por unidade de tempo e integridade e longevidade celular, que determinam uma maior estabilidade genética e bioquímica6. Recorrendo a raízes transgênicas in vitro, os genótipos de PPNs podem ser mantidos indefinidamente em condições de laboratório, a infecção e o desenvolvimento de PPNs podem ser facilmente acompanhados, a variabilidade genética do hospedeiro pode ser reduzida, a manipulação da composição molecular do hospedeiro pode estar diretamente ligada à resposta do nematóide e as mudanças estruturais do hospedeiro e do parasita podem ser seguidas com mais precisão 6,13. Para estudos sobre doenças PPN da batata, as co-culturas de raízes transgênicas in vitro permitem a realização de experimentos independentemente da estação do ano ou da dormência do tubérculo da batata.
Neste protocolo, é detalhada a metodologia tradicional de manutenção de NPPs e infecção in vivo de plantas de batata. Para a análise estrutural de raízes infectadas, também é detalhada uma metodologia aprimorada baseada no estabelecimento de co-culturas in vitro de raízes transgênicas de batata com PPNs como uma alternativa que permite um maior controle da variabilidade genética ambiental e do hospedeiro. Para acompanhar a infecção e o desenvolvimento de PPNs no tecido radicular, a histoquímica é empregada para auxiliar na observação de PPNs sob microscopia óptica. O objetivo geral deste protocolo é otimizar o estudo das interações PPN-hospedeiro, garantindo condições mais controladas e reprodutíveis para experimentação, ao mesmo tempo em que facilita análises estruturais e de desenvolvimento detalhadas de nematóides no tecido radicular.
Protocolo
1. Infecção de plantas de batata cultivadas em estufa
NOTA: Os testes em estufa são realizados com suspensões de PPNs em estágios de vida mistos ou juvenis de segundo estágio (J2), dependendo do ciclo de vida específico da praga PPN. Para este protocolo, foram utilizadas suspensões de estágios de vida mistos do nematóide da lesão radicular (NLR) Pratylenchus penetrans . Os PPNs podem ser criados em laboratório ou solicitados a laboratórios de referência certificados.
- Multiplicação e manutenção de nematóides de lesões radiculares
NOTA: Discos de cenoura esterilizados são usados para a multiplicação e manutenção de RLNs14. Use cenouras adquiridas comercialmente (var. Nice) sem danos visíveis para reduzir a contaminação microbiana. De preferência, eles devem estar livres de pesticidas para evitar prejudicar o desenvolvimento do RLN.- Lave a cenoura em água corrente da torneira para remover detritos maiores e, em seguida, com uma solução detergente comum (1 gota por 40 mL de água) para remover os detritos mais finos. Seque com papel toalha de laboratório.
- Sob assepsia, em uma coifa de fluxo vertical, insira um espeto de metal esterilizado no topo da cenoura (1 a 2 cm para dentro) para que possa ser segurado com mais facilidade.
- Com a ajuda de um frasco de lavagem com bico, molhe a cenoura com etanol a 96% (v/v). Seque a ponta inferior da cenoura em um papel de filtro esterilizado e leve-a cuidadosamente ao fogo.
CUIDADO: Esteja ciente de que o etanol inflama fortemente, portanto, fique à distância. - Descasque a cenoura de cima para baixo usando um descascador estéril e repita a etapa anterior. Descarte as seções superior e inferior (2 cm para dentro) e coloque a seção intermediária da cenoura em uma placa de Petri estéril (150 mm de diâmetro). Usando uma lâmina estéril e uma pinça, corte cuidadosamente seções de 1 cm de espessura da porção de aproximadamente 2 cm de diâmetro da cenoura (Figura 1).
- Transfira as seções para placas de Petri estéreis (60 mm de diâmetro) e sele a borda com filme transparente. Usando uma luz ultravioleta, esterilize a superfície dos discos de cenoura por 60 min de cada lado.
- Mantenha a 25 ° C por 1-2 semanas na escuridão e descarte quaisquer discos de cenoura que comecem a mostrar sinais de contaminação microbiana15.
NOTA: Os sinais visíveis de contaminação são escurecimento excessivo (apodrecimento), acúmulo de líquido na borda inferior do disco da cenoura ou crescimento de micélio fúngico na superfície. - Os discos de cenoura restantes estão prontos para serem infectados com suspensões RLN. Comece fazendo uma incisão em forma de X no centro do disco de cenoura usando uma lâmina estéril. Certifique-se de cortar apenas até a metade.
- Inocule o RLN pipetando 50 μL de uma suspensão contendo pelo menos 50 estágios de vida mistos no centro da ferida em forma de X. Feche a placa de Petri e sele a borda com filme transparente para evitar a dessecação.
- Determinar o número médio de nemátodos na suspensão contando cinco alíquotas de 50 μl num estereomicroscópio binocular (40x) à temperatura ambiente numa lâmina côncava. Defina a suspensão de RLNs mistos em estágio de vida para 1000 por mL adicionando água à suspensão ou esperando que os nematóides se assentem (aproximadamente 60 min) e diminuindo o volume decantando a água superficial.
- Manter os discos de cenoura a 25 °C, no escuro, até 3 meses e acompanhar semanalmente em estereomicroscópio binocular para detecção de sinais de lesões necróticas, resultantes do crescimento populacional do NLR.
NOTA: Os discos de cenoura parasitados com sucesso podem ser armazenados a 11 ° C para uso posterior por até 2 meses, mas verifique regularmente se há contaminação microbiana. Os discos de cenoura parasitados que apresentam sinais de infecção microbiana devem ser descontaminados em autoclavagem antes de serem descartados. - Sob a capela de fluxo, extrair os NLR transferindo discos de cenoura com necrose tecidual visível no local da inoculação (figura 1) para uma peneira de malha de 8 cm de diâmetro e 75 μm colocada numa taça de vidro estéril. Deixe um pequeno espaço de 1 cm entre o fundo da peneira e a concavidade da tigela para coletar os RLNs.
NOTA: Na falta de uma peneira adquirida comercialmente, pode-se fazer um tubo de plástico de 8 cm de diâmetro / um copo de plástico resistente e uma gaze de malha apertada. Use elásticos para prender a gaze ao tubo ou copo de plástico. - Despeje uma solução antibiótica na peneira até que os discos de cenoura estejam cobertos e mantenha por 12 h (durante a noite) no escuro. Os RLNs saem dos discos de cenoura e se depositam no fundo da tigela. A solução antibiótica deve ser preparada extemporaneamente com a extração, adicionando-se 50 μg/mL de canamicina e carbenicilina em água destilada esterilizada16.
NOTA: As soluções de estoque de antibióticos são preparadas a 50 mg / mL dissolvendo 0,5 g de monossulfato de canamicina ou 0,5 g de carbenicilina dissódica cada em 10 mL de água destilada esterilizada. As soluções de estoque são filtradas (malha de 0,22 μm) na capela de fluxo e podem ser mantidas a -20 °C por até 1 ano. - Remova a peneira, use uma pipeta de vidro esterilizado para puxar os RLNs do fundo da tigela para um bloco de coloração de vidro esterilizado (4 cm x 4 cm x 1 cm) e lave pipetando 1 mL de solução antibiótica. Aguarde de 30 a 40 minutos para que os nematóides assentem antes de coletar a solução antibiótica usada. Repita esta lavagem 4x-5x.
- Utilizar imediatamente a suspensão aquosa com os RLN ou mantê-la a 11 °C durante um período de conservação mais longo (até 2 meses).
- Infecção in vivo de plantas de batata com PPNs
NOTA: Para cultivar plantas de batata suscetíveis (S. tuberosum var. Désirée), as batatas-semente certificadas devem ser adquiridas de agro-comerciantes entre janeiro e março. Escolha batatas-semente certificadas porque são vendidas com passaporte fitossanitário, garantindo que não estejam contaminadas com fitoparasitas de quarentena. Como precaução, uma etapa inicial de desinfecção com uma solução de alvejante a 10% seguida de lavagem em água corrente da torneira pode ser realizada para garantir a desinfecção da superfície do tubérculo de batata. Batatas comercializadas comuns não são recomendadas, pois os tratamentos impostos para reduzir a brotação e o vigor podem interferir no crescimento da batata e na resposta à infecção.- Selecione tubérculos de batata do mesmo tamanho e descarte aqueles com buracos, hematomas ou seções mais macias. Remova suavemente todos os brotos crescidos (1 mm) antes de semear para sincronizar a germinação.
NOTA: Se necessário, guarde as batatas-semente em local bem ventilado, seco e escuro antes de semear. - Encha vasos de 5 L (22 cm x 18 cm) com uma mistura 1:1 de solo autoclavado e areia fina grossa misturada com 22,5 g de fertilizante NPK de liberação lenta (12-12-12) e semeie as batatas a 9 cm abaixo da superfície do solo.
NOTA: O solo e a areia devem ser peneirados para remover detritos maiores que 2 mm, autoclavados 2x a 121 °C por 15 min e secos a 100 °C por 1 a 2 dias, com mistura frequente. Areje os próximos 7 a 10 dias misturando com frequência, antes de usar. - Mantenha os vasos em uma estufa em condições úmidas (50% -70% de umidade) e regue com frequência (mantenha o solo com 70% da capacidade máxima de retenção de água), evitando temperaturas extremas, até que os brotos da planta de batata comecem a emergir na superfície do solo.
- Após a emergência da planta, use suspensões de RLN recém-extraídas para infectar as raízes da batata. Comece criando 4 a 6 buracos (1 cm de largura) uniformemente distribuídos ao redor da planta até a profundidade da semeadura.
- Pipete uniformemente uma suspensão de 8 mL de 30.000 RLNs vivos em estágio de vida misto nos orifícios, de modo que o inóculo fique na proporção de 4 RLNs vivos por g de mistura de solo e cubra com a mistura de solo. Para os vasos com RLNs, reter a rega no dia da inoculação.
NOTA: Os RLNs são contados em um estereomicroscópio (40x). Os nematóides mortos são imóveis e têm uma forma estendida, enquanto os nematóides vivos geralmente se movem (forma não estendida). O estímulo físico é usado para determinar a mortalidade. - Mantenha os vasos por 2 meses nas condições descritas acima (Figura 2). Depois, arranque as plantas de batata e pese os brotos e raízes separadamente.
- Lave cuidadosamente o sistema radicular antes de verificar a localização dos locais de ataque do RLN por meio de técnicas de coloração5.
- Selecione tubérculos de batata do mesmo tamanho e descarte aqueles com buracos, hematomas ou seções mais macias. Remova suavemente todos os brotos crescidos (1 mm) antes de semear para sincronizar a germinação.
2. Estabelecimento de co-culturas in vitro de raízes transgênicas de batata com PPNs
- Estabelecer in vitro raízes transgênicas de batata
NOTA: Para este protocolo, usamos Rhizobium rhizogenes carregando o gus gene repórter co-integrado no plasmídeo Ri e acionado por um promotor duplo 35S (A4pRiA4::70GUS)17. As bactérias podem ser adquiridas de fontes comerciais ou solicitadas a laboratórios de referência certificados.- Para obter bactérias na fase de crescimento exponencial, espalhe a placa R. rhizogenes em uma placa média sólida Luria-Bertani (LB)18 e mantenha durante a noite a 26 °C.
NOTA: O meio LB pode ser adquirido comercialmente ou preparado em laboratório adicionando 10 g / L de peptona, 5 g / L de extrato de levedura, 10 g / L de NaCl e 15 g / L de ágar e, em seguida, esterilizando a vapor por 15 min a 121 ° C. - Com uma alça de inoculação, pegue uma colônia e inocule 10 mL de caldo LB líquido (meio LB sem ágar) em um frasco estéril de 50 mL. Manter durante a noite no escuro a 26 °C sob agitação (180 rpm).
- Medir a absorvância da cultura líquida até que A600 atinja 0,6. Nesta fase, as bactérias estão na fase de crescimento exponencial e são usadas para inocular o material vegetal.
- A inoculação é realizada em tubérculos assépticos de batata fresca. Para esterilizar a superfície dos tubérculos de batata, comece por lavar em água corrente da torneira para remover os detritos maiores, e depois com uma solução detergente comum (1 gota por 40 mL de água), com agitação vigorosa, para remover os detritos mais finos.
NOTA: Selecione uma variedade de batata com suscetibilidade conhecida aos PPNs em uso. Para este protocolo, utilizou-se S. tuberosum var. - Coloque os tubérculos em um recipiente, cubra com uma solução de alvejante comercial (1:4, alvejante comercial em água da torneira) e feche. Misture por 15 min, descarte a solução de alvejante e enxágue 3x com água da torneira esterilizada.
- Em uma capela de fluxo, mergulhe os tubérculos em uma solução de etanol (80%, v/v) por 15 min com agitação vigorosa, descarte o etanol e enxágue 3x com água da torneira esterilizada.
- Com bisturi estéril, remover as porções periféricas dos tubérculos (aproximadamente 50% do tubérculo da superfície para dentro) e seccionar a peça central interna em segmentos de 0,5 cm de espessura19. Inocular imediatamente com a suspensão bacteriana preparada no passo 2.1.3.
- Para a inoculação, diluir a suspensão bacteriana adicionando 1 mL de suspensão bacteriana a 9 mL de meio Schenk e Hildebrandt20 (SH) suplementado com 30 g/L de sacarose a pH = 5,6. Mergulhe a ponta de um bisturi estéril na suspensão diluída e enrole a superfície do goma de batata. Repita esta etapa 5x para cada segmento de batata.
- Secar os segmentos de excesso de humidade em papel de filtro estéril durante 1 min, colocá-los em meio SH semi-sólido (meio SH com 30 g/L de sacarose, 8 g/L de ágar, pH = 5,6) e manter na escuridão a 25 °C para que ocorra a transfecção do plasmídeo.
- Após 3 dias, transfira os segmentos infectados para placas de meio SH semi-sólido suplementado com 150 μg / mL de cada uma das cefotaximas e carbenicilina do antibiótico. Conservar por mais de 3 meses com renovação semanal do meio para garantir a eliminação das bactérias.
NOTA: A solução estoque de cefotaxima pode ser preparada a 100 mg / mL dissolvendo 1 g de cefotaxima sódica em 10 mL de água desmineralizada estéril e filtrando (malha de 0,22 μm) sob a capela de fluxo. Os antibióticos podem ser mantidos a -20 °C por até 1 ano. - Após 3 meses, o crescimento da raiz transgênica é extenso. Transfira as raízes para um meio SH fresco e semi-sólido sem antibióticos, reunindo uma touceira de raiz de 1 g com as pontas de uma pinça estéril e colocando-a no centro do meio de cultura em uma nova placa (Figura 3).
NOTA: Aproximadamente 1 mês após a infecção, pequenas massas de crescimento celular aparecem na superfície do segmento da batata, de onde as raízes transgênicas começam a se desenvolver6. Certifique-se de mantê-los em contato com o meio de cultura, caso contrário, eles podem secar. - Para garantir a estabilidade genética e metabólica, mantenha as raízes transgênicas sob uma rotina mensal de subcultura (conforme descrito na etapa 2.1.11.) a 25 ° C no escuro por mais de 1 ano antes de infectar com PPNs.
NOTA: Certifique-se de que pelo menos seis réplicas sejam mantidas em cada etapa do protocolo, pois geralmente ocorre contaminação microbiana indesejada. Uma vez estabelecida, uma única placa de co-cultura pode ser usada como inóculo para várias novas co-culturas; no entanto, certifique-se de manter pelo menos seis placas replicadas.
- Para obter bactérias na fase de crescimento exponencial, espalhe a placa R. rhizogenes em uma placa média sólida Luria-Bertani (LB)18 e mantenha durante a noite a 26 °C.
- Estabelecimento de co-culturas in vitro de raízes de batata transgênica com PPNs
NOTA: Para obter coculturas de raízes transgênicas com PPNs, o processo de esterilização de nematóides é crítico. Para o presente protocolo, foram utilizados juvenis de segundo estágio do nematoide das galhas Meloidogyne chitwoodi. O inóculo do nematóide pode ser obtido em laboratórios de referência certificados na forma de galhas radiculares.- Sob um estereomicroscópio binocular (20x), isole as massas de ovos de nematóides das galhas das raízes com uma pinça de ponta ultrafina estéril. Coloque as massas de ovos em uma placa de Petri coberta com 5 mL de água da torneira estéril e deixe os ovos eclodirem por 48 h. Defina a suspensão J2 para 100 nematóides por mL.
- Numa capela de fluxo, pipetar 5 ml de uma suspensão contendo 500 J2 para um crivo estéril de malha de 20 μm e lavar com água da torneira estéril.
- Mergulhar a metade inferior da peneira que contém os J2s numa solução de peróxido de hidrogénio (H2O2) a 20 % e misturar manualmente em movimentos circulares durante 15 min.
- Lave os J2s estéreis distribuindo água da torneira estéril pela peneira. Repita esta etapa 3x. Na lavagem final, incline a peneira para que os nematóides se acumulem na borda da peneira. Recuperar a suspensão estéril de nemátodes pipetando 1 ml de água ultrapura estéril na borda do crivo e conservar a 11 °C ou utilizar imediatamente.
NOTA: O sucesso da esterilização pode ser avaliado plaqueando uma alíquota de 100 μL da suspensão do nematóide em meio SH e monitorando regularmente, por 1 semana, a contaminação - Na capela de fluxo, subcultive um aglomerado de 1 g de raízes transgênicas de batata (conforme descrito na etapa 2.1.11.) em placas SH com 100 nematóides estéreis (100 μL de uma suspensão com 1000 J2s por mL). Após 2 a 3 semanas, pequenas galhas começam a aparecer nas novas raízes.
- Siga a co-cultura regularmente sob um microscópio invertido (100x) e, quando as massas de ovos começarem a ser perceptíveis, subcultive para uma nova placa média SH semi-sólida, certificando-se de que as galhas sejam colhidas com a touceira da raiz (Figura 4). Mantenha as co-culturas sob uma rotina mensal de subculturas a 25 ° C na escuridão.
3. Análise estrutural da infecção por NPPs
NOTA: Para acompanhar as mudanças induzidas por PPNs na estrutura do tecido radicular, técnicas de coloração histoquímica são usadas para contrastar tecidos com diferentes composições químicas. A coloração diferencial é realizada em massas radiculares ou em seções finas de material radicular fixo, onde corantes específicos reagem com o tecido alvo de acordo com sua afinidade química21. Para o presente protocolo, usamos fucsina ácida, ou reagente ácido periódico de Schiff (PAS) combinado com corantes de azul de toluidina O para coloração diferencial.
- Distribuição de nematoides parasitas em raízes coradas com fucsina ácida
NOTA: Para acompanhar a distribuição de PPNs em todo o sistema radicular, a fucsina ácida é usada para corar o tecido muscular do nematóide em uma tonalidade vermelha5.- Comece lavando o sistema radicular em água corrente da torneira por 5 min para remover quaisquer detritos do solo (raízes de plantas in vivo ) ou resíduos do meio de cultura (raízes transgênicas in vitro ). Use os dedos em movimentos circulares para ajudar a separar o solo do sistema radicular.
- Corte o sistema radicular em seções de 1 a 2 cm de comprimento e coloque-o dentro de um béquer de 150 mL. Dispense 70 mL de uma solução de hipoclorito de sódio (NaOCl) a 1,5% e misture vigorosamente por 4 min para limpar os tecidos radiculares. Em seguida, descarte a solução de NaOCl, enxágue as raízes em água corrente da torneira e deixe de molho por 15 min em água desmineralizada para remover o NaOCl22 residual.
NOTA: O alvejante contém um mínimo de 5,25% de NaOCl, portanto, adicione 20 mL de alvejante a 50 mL de água para obter uma solução de NaOCl a 1,5%. Para materiais mais macios (por exemplo, tecidos mais moles de raízes jovens ou de raízes transgênicas cultivadas in vitro ), use uma solução de NaOCl a 0,9%, enquanto para materiais mais duros (raízes lignificadas mais antigas) é usada uma solução de NaOCl a 2,0%. - Escorra as raízes limpas e coloque-as em um copo de vidro borossilicato com 30 mL de água desmineralizada. Pipetar 1 ml de solução ácida de fucsina corante, misturar manualmente e ferver durante 30 segundos numa placa quente. Deixe o copo de vidro esfriar, escorra a solução e lave as raízes manchadas em água corrente da torneira.
NOTA: A solução de coloração de fucsina ácida é feita dissolvendo 3,5 g de pó de corante de fucsina ácida em 250 mL de ácido acético e adicionando 750 mL de água desmineralizada. A coloração é sempre seguida por uma etapa de descoloração para remover o excesso de manchas não utilizadas e aumentar o contraste da amostra. - Destain adicionando 10-30 mL de glicerina acidificada com algumas gotas de HCl (5N)13.
- Observe sob o microscópio estereoscópico ou microscópio invertido para avaliar aproximadamente onde na estrutura radicular os PPNs estão atacando preferencialmente (Figura 5 e Figura 6).
- Avaliação da morfologia das células radiculares com ácido periódico-Schiff (PAS)/azul de toluidina O
NOTA: A influência da infecção por PPNs ou danos à morfologia das células radiculares pode ser avaliada ao microscópio primeiro fixando, seccionando e colorindo diferencialmente as raízes de batata infectadas.- Em um frasco de amostra fechado, fixe o material radicular fresco com glutaraldeído a 2,5%, preparado em tampão fosfato de sódio 0,1 M, a pH 7,2, por 24-48 h, à temperatura ambiente6.
CUIDADO: O glutaraldeído é tóxico. Evite a inalação e o contato. Use jaleco e luvas de proteção e trabalhe em uma capela de exaustão. Os frascos para injetáveis de amostra devem ser fechados, a menos que em procedimentos de enxágue ou vácuo. Descarte o glutaraldeído seguindo as regras dos Procedimentos de Resíduos Perigosos. As etapas 3.2.1 a 3.2.5 são executadas em uma capela para evitar a inalação de reagentes.
NOTA: Para preparar 1 L de tampão fosfato de sódio, pH 7,2, adicione 68,4 mL de 1M Na2HPO4 (141,96 g em solução de 1 L) a 31,6 mL de 1M NaH2PO4 (119,98 g em solução de 1 L) e encha até 1 L adicionando 900 mL de água desmineralizada. Para ajudar na infiltração do fixador, coloque os frascos de amostra sem tampa com material radicular sob baixo vácuo (26 mm Hg) por 2 min em um dessecador conectado a uma bomba de vácuo. - Com uma pipeta de vidro Pasteur, descarte a solução fixadora e lave as raízes fixadas com tampão fosfato de sódio (3x).
- Começar a desidratar gradualmente o tecido radicular fixado, substituindo o tampão por uma solução de etanol a 10 % (v/v) durante 15 min. Em seguida, troque por uma solução de etanol a 20% usando uma pipeta de vidro e mantenha as raízes embutidas por 15 min. Continue com a sucessão gradual de concentrações crescentes de etanol (30%, 40%, 50%, 60%, 70%, 80% e 90% por 15 min cada) até a etapa de etanol puro, onde as raízes devem ser mantidas por 1 h.
- Incorporar as raízes desidratadas gradualmente em resina (2-hidroxietil metacrilato). Com uma pipeta de vidro, substituir o etanol puro por uma solução de etanol/resina 3:1 (v/v) e conservar durante 24 h a 4 °C. Seguir com soluções de etanol/resina 1:1 e 1:3 (v/v), cada uma com um período de incubação de 24 horas a 4 °C. Em seguida, substitua a solução 1:3 (v/v) por resina pura suplementada com peróxido de dibenzoíla (1%) como iniciador de polimerização.
- Coloque as amostras em uma bandeja de moldes de resina, adicione uma mistura de resina: dimetilsulfóxido 15:1 (v/v) e mantenha a 60 ° C sobre uma placa quente por 48 h para que a resina endureça.
- Coloque as amostras impregnadas em um micrótomo rotativo equipado com uma faca de tungstênio e corte seções de 2-5 μm em lâminas de vidro, de acordo com as instruções do fabricante.
- Comece a coloração diferencial imergindo as lâminas por 10 min em um frasco de coloração de vidro com uma solução de 2,4-dinitrofenilhidrazina a 15% em ácido acético, à temperatura ambiente. Em seguida, lave cuidadosamente em água corrente da torneira por 15 min e seque em forno a 60 °C (15 min).
- Em seguida, mergulhe as lâminas em ácido periódico (1%) por 10 min e, em seguida, lave em água corrente da torneira por 5 min e deixe secar em estufa a 60 ° C (15 min).
- Mergulhe as lâminas em Reagente de Schiff (composto por 1% de pararosanilina e 4% de metabissulfito de sódio, em ácido clorídrico 0,25 M), por 30 min. Em seguida, lave com uma solução de metabissulfito de sódio (0,5%) em ácido clorídrico (0,05 M), por 2 min. Repita 3x. Por fim, lave em água corrente da torneira por 5 min e seque em temperatura ambiente.
- Por outro lado, manche imergindo as lâminas em azul de toluidina O a 0,05% por 15 min, lavando em água corrente da torneira por 15 min e secando em estufa a 60 °C (15 min).
- Observe sob um microscópio (100x) equipado com hardware de captura de imagem (Figura 7).
- Em um frasco de amostra fechado, fixe o material radicular fresco com glutaraldeído a 2,5%, preparado em tampão fosfato de sódio 0,1 M, a pH 7,2, por 24-48 h, à temperatura ambiente6.
Resultados
Os discos de cenoura podem ser usados para multiplicar e manter vários tipos de NPPs migratórios23. Para o RLN, essa técnica é geralmente usada para manter coleções de referência de espécies ou isolados de nematóides. Usando discos de cenoura, um aumento médio de 100x nas populações de nematóides pode ser obtido em um período de 3 meses (Figura 1). No entanto, o número de nematóides varia amplamente (entre 30x e 200x), principalmente devido à diversidade genética do nematoide e/ou variação no conteúdo nutricional das cenouras. Além disso, apesar de várias medidas de prevenção usadas para reduzir a contaminação microbiana, 20% a 30% dos discos de cenoura podem contaminar, portanto, certifique-se de preparar mais placas do que o necessário.
Nas plantas de batata, a presença de RLNs nem sempre induz sintomas visíveis, uma vez que dependem muito do número da população de parasitas que atacam o sistema radicular (Figura 2). Para P. penetrans, um inóculo inicial de 4 RLNs/g de solo pode acumular até 2000 RLNs/g de raiz e 750 ovos/g de raiz após 2 meses, induzindo uma diminuição de quase 30% no peso da raiz5.
As culturas de raízes pilosas da batata são um sistema de alto rendimento para estudar doenças relacionadas à raiz em um contexto de laboratório. As raízes transgênicas de batata estabelecidas têm uma taxa de crescimento específica de 300 mg de peso fresco da raiz por L de meio SH por dia e um tempo de duplicação de 2,6 dias6 (Figura 3). Quando co-cultivados com M. chitwoodi, esses parâmetros são ligeiramente afetados, uma vez que os nematóides se alimentam do tecido radicular e causam um sumidouro de energia. Para as co-culturas, pode-se atingir uma taxa de crescimento específico de 200 mg de massa fresca da raiz por L de meio SH por dia e um tempo de duplicação de 3 dias6. O número de nematóides desenvolvidos pode chegar a 1200 J2s por g de peso fresco da raiz transgênica da batata, e a quantidade de ovos pode ser 4x maior 6,13 (Figura 4). Quando comparado aos testes em solo de tomateiros infectados com RKN cultivados em estufa, o maior rendimento para as populações de nematóides foi apenas metade do das raízes transgênicas por g de material radicular (dados não publicados). No entanto, sabe-se que o crescimento populacional da RKN depende fortemente das espécies de plantas hospedeiras e até mesmo da variedade. No entanto, morfologicamente, os nematóides criados em raízes transgênicas não apresentam diferença substancial daqueles recuperados de infecções de campo ou de casa de vegetação 6,13.
O uso de fucsina ácida é útil no rastreamento de ataques de nematóides no tecido radicular. Sabe-se que os estágios móveis do NLR são encontrados dentro das raízes assim que 1 dia após a inoculação5. Acredita-se que esse estágio inicial não dependa da suscetibilidade do hospedeiro. No entanto, após a penetração, os RLNs permanecem se alimentando das células epidérmicas e do córtex da raiz, reproduzem-se e induzem a formação de necrose em plantas suscetíveis ou saem das raízes de volta ao solo5. Esses mecanismos são facilmente seguidos pela coloração com fucsina ácida (Figura 5). Os co-cultivos de raízes pilosas de batata com RKNs fornecem uma poderosa ferramenta laboratorial para analisar os mecanismos de penetração de J2 e a tomada de decisão no estabelecimento do sítio de alimentação para a fêmea adulta sedentária. Todas as etapas após a infecção podem ser acompanhadas, incluindo a formação da matriz gelatinosa e a liberação do ovo (Figura 6).
A estrutura do tecido pode ser detalhada usando histoquímica e microscopia óptica. Usando técnicas de coloração diferencial, os estágios do ciclo de vida do fitoparasita podem ser acompanhados juntamente com as alterações induzidas no tecido radicular circundante. Meloidogyne chitwoodi, assim como outros nematóides das galhas, promovem a formação de um local de alimentação composto por um tipo específico de célula chamada células gigantes. Essas células multinucleadas são induzidas por secreções do nematóide J2s e tornam-se metabolicamente hiperativas, produzindo alimento para a fêmea adulta estacionária (Figura 7). Seguir a formação dessa estrutura especializada fornece informações importantes sobre os mecanismos de alimentação de nematóides e permite a identificação de etapas específicas que podem ser direcionadas para a interrupção de seu ciclo de vida. Além disso, a estrutura do local de alimentação pode ser específica para as espécies RKN, contribuindo para sua identificação.

Figura 1: Manutenção do nematóide da lesão radicular em discos de cenoura. (A) Discos de raízes de cenoura são esterilizados e infectados com Pratylenchus penetrans causando (B) lesões necróticas características (seções escuras) devido ao crescimento populacional (C). Bar=1 cm (A e B), 100 μm (C). Clique aqui para ver uma versão maior desta figura.

Figura 2: Infecção de raízes de Solanum tuberosum cultivadas em casa de vegetação. Plantas de batata controle (vasos na parte de trás) e plantas infectadas com o nematóide da lesão radicular (vasos na frente) não apresentam sintomas visíveis de infecção na parte aérea após 30 dias de infecção. Barra = 10 cm. Clique aqui para ver uma versão maior desta figura.

Figura 3: Desenvolvimento de raízes transgênicas de Solanum tuberosum . (A) Pequenas massas de crescimento de células começam a aparecer ao longo da área de ferimento do bisturi na seção do tubérculo da batata (seta), (B) seguidas pelo surgimento das primeiras raízes transgênicas (inserção do lado direito), (C) que crescem e se sustentam rapidamente no meio de cultura. (D) Um aglomerado de raízes pode ser transferido para uma placa de meio de cultura fresco para crescimento contínuo. Barra = 1 cm. Clique aqui para ver uma versão maior desta figura.

Figura 4: Co-culturas de Solanum tuberosum com o nematóide parasita de plantas Meloidogyne chitwoodi. (A) In vitro, as culturas de raízes transgênicas de batata podem ser infectadas com (B) juvenis assépticos de segundo estágio do nematóide das galhas Columbia (J2) para estabelecer uma co-cultura planta/nematóide. (C) Galhas radiculares podem ser obtidas com fêmeas adultas com massas de ovos. Bar = 1 cm (A, B) e 200 μm (C). Clique aqui para ver uma versão maior desta figura.
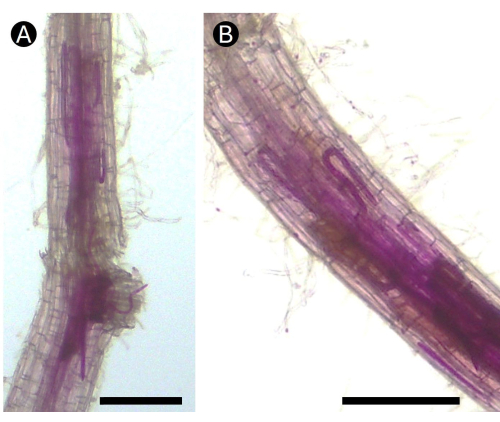
Figura 5: Raízes coradas com fucsina ácida de batatas infectadas pelo nematóide da lesão radicular Pratylenchus penetrans em condições de casa de vegetação. (A) Vários estágios de vida do nematóide podem ser vistos na área do córtex de (B) a raiz causando lesões necróticas. Bar = 100 μm. Clique aqui para ver uma versão maior desta figura.

Figura 6: Galhas de raízes coradas com fucsina ácida de raízes transgênicas infectadas com Meloidogyne chitwoodi. (A) O tecido da vesícula pode ser visto (B) envolvendo parte da fêmea adulta M. chitwoodi (C) que já produziu a massa de ovos (D) com os ovos. Bar = 500 μm (A), 100 μm (B, C) e 20 μm (D). Clique aqui para ver uma versão maior desta figura.

Figura 7: Estrutura celular de uma galha radicular transgênica formada por Meloidogyne chitwoodi. (A) Cortes ultrafinos de uma galha radicular transgênica corada com ácido periódico-Schiff (PAS) e azul de toluidina O, mostrando o local de alimentação da fêmea adulta e (B) as células gigantes induzidas pelo nematóide envolto pelo tecido da galha radicular. Bar = 100 μm. Clique aqui para ver uma versão maior desta figura.
Discussão
O estudo dos mecanismos de infecção e desenvolvimento de doenças em plantas atacadas por PPNs que habitam o solo é difícil porque esses fitoparasitas geralmente infectam os tecidos internos do sistema radicular e induzem sintomas inespecíficos nos brotos. Apesar das condições ambientais controladas da casa de vegetação, a brotação dos tubérculos de batata e o crescimento das plantas de batata ainda são favorecidos nos meses de primavera e verão, reduzindo o período experimental disponível para uma estação por ano. Além disso, um número substancial de vasos não tem surgimento de plantas de batata. O ciclo de vida do NLR é relativamente longo e são necessários cerca de 2 a 3 meses para atingir picos populacionais capazes de induzir sintomatologia da doença. As principais deficiências de recorrer a bioensaios em estufa para pesquisa de PPNs são que a) os testes de maconha geralmente apresentam uma alta variabilidade quando se trata de suscetibilidade a doenças de PPNs; b) embora as infecções sejam realizadas com populações puras de NPPs, existe o risco de estabelecimento malsucedido de NPPs e/ou contaminação cruzada com diferentes espécies de NPPs; c) mesmo que medidas preventivas sejam aplicadas, há sempre o risco de contaminação por patógenos microbianos; e d) dependendo dos fundos disponíveis e do tamanho da estufa, o número de réplicas é muitas vezes muito reduzido para um esquema de amostragem adequado, para validade estatística.
As raízes transgênicas da batata são uma ferramenta de laboratório versátil que não requer grandes espaços para manutenção; pode ser obtido em menos tempo; Estejam isentos de contaminação ou de variabilidade genética do hospedeiro; e, mais importante, permitem controlar variáveis ambientais ou nutricionais isoladas, o que garante que a resposta radicular seja diretamente resultante do tratamento imposto12. Para estudos sobre infecção e desenvolvimento de PPNs, o uso de HRs é uma melhoria quando comparado aos bioensaios em casa de vegetação. Em primeiro lugar, a necessidade de cultivar previamente grandes quantidades de PPNs antes de cada experimento é desnecessária, uma vez que as coculturas de batata HR / PPNs são um sistema contínuo que fornece todos os estágios de desenvolvimento do nematóide, independentemente da estação ou das condições climáticas. Além disso, a variabilidade genética é muito limitada porque os HRs são tecidos somáticos clonais, portanto, as mudanças na resposta dos PPNs dependem diretamente das condições impostas. As coculturas de batata HR/PPNs ocupam um espaço pequeno; uma câmara de crescimento com temperatura controlada pode abrigar muitas placas de Petri, de modo que a experimentação raramente é limitada pelo número de réplicas. Por fim, a técnica é expansível para outros PPNs de batata, por exemplo, Globodera spp., sendo limitada principalmente pela etapa de esterilização do nematoide, que pode se tornar desafiadora dependendo da espécie de PPNs e do estágio de vida selecionado para descontaminação19,24. Apesar de suas muitas vantagens, a pesquisa usando co-culturas é limitada a estudos sobre o nível tecidual, por exemplo, morfologia ultraestrutural ou sobre mecanismos de regulação bioquímica, sob estresse biótico ou abiótico 6,25, e é inadequada para estudos que exigem, por exemplo, determinar o rendimento do tubérculo ou o fenótipo de dano. Além disso, as interações planta-nematóide em condições naturais são influenciadas por muitas variáveis, portanto, recomenda-se cautela para comparações diretas com resultados obtidos em estudos com co-culturas.
A histoquímica combina histologia com aspectos químicos, permitindo determinar a natureza das substâncias presentes nos tecidos e sua localização21. As técnicas de coloração diferencial são amplamente utilizadas para a distinção de alterações químicas e morfológicas específicas. O corante ácido fucsina cora os tecidos do nematóide penetrando na cutícula impermeável durante a etapa de ebulição. Posteriormente, a descoloração do sistema radicular com glicerina acidificada permite identificar os locais onde os nematóides estão atacando, pois contrastam com o tecido radicular. No entanto, se mantido em glicerol acidificado por mais de 1 a 2 meses, a mancha diminuirá de intensidade e o contraste entre os nematóides e as raízes das plantas diminuirá.
O ácido periódico de Schiff (PAS) e o azul de toluidina O são empregados para uma técnica de coloração dupla comumente usada para corar tecidos frescos ou embebidos em resina. Esta é uma técnica de fácil aplicação, mas com baixa especificidade e sensibilidade. A aplicação sequencial de dois corantes permite a coloração simultânea de vários alvos celulares com diferentes propriedades químicas. O ácido periódico com reagente de Schiff corará os polissacarídeos com uma tonalidade rosa, principalmente amido, polissacarídeos da parede celular e alguns fenóis, mas não celulose ou calose. O corante azul de toluidina O destaca a coloração PAS e cora as paredes celulares do xilema e do esclerênquima de verde ou azul-esverdeado, as paredes celulares do colênquima e do parênquima em vermelho-púrpura e as paredes do floema e a lamela média das paredes celulares em vermelho. A calose e o amido não ficam manchados21.
O protocolo descrito oferece várias aplicações futuras promissoras em ciência de plantas, agricultura e biotecnologia. Ele permite estudos detalhados sobre os mecanismos moleculares e celulares do parasitismo, fornecendo informações sobre como os PPNs infectam e manipulam os hospedeiros. Ele apóia o melhoramento de culturas resistentes, auxiliando na triagem de cultivares de batata ou linhagens transgênicas para resistência a PPNs, bem como na identificação de genes-chave envolvidos na resistência ou suscetibilidade. Além disso, as coculturas in vitro podem servir como uma ferramenta poderosa para a triagem de alto rendimento de nematicidas ou agentes de controle biológico (por exemplo, micróbios ou produtos naturais), permitindo que os pesquisadores avaliem sua eficácia no controle de doenças PPN.
Divulgações
Não temos nada a divulgar.
Agradecimentos
Esta investigação foi parcialmente financiada pela Fundação para a Ciência e a Tecnologia (FCT), através das bolsas NemACT, DOI: 10.54499/2022.00359.CEECIND/CP1737/CT0002 (JMSF), CEECIND/00040/2018, DOI: 10.54499/CEECIND/00040/2018/CP1560/CT0001 (CSLV) e SFRH/BD/134201/2017 (PB); projeto PratyOmics, DOI: 10.54499/PTDC/ASP-PLA/0197/2020; e dos fundos estruturais UIDB/00329/2020 | cE3c (DOI: 10.54499/UIDB/00329/2020) + LA/P/0121/2020 |CHANGE (DOI: 10.54499/LA/P/0121/2020) e GreenIT (DOI: 10.54499/UIDB/04551/2020 e DOI: 10.54499/UIDP/04551/2020)..
Materiais
| Name | Company | Catalog Number | Comments |
| 2,4-Dinitrophenylhydrazine | Sigma-Aldrich | D199303 | |
| 2-Hydroxyethyl methacrylate | Sigma-Aldrich | 17348 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Acid Fuchsin | Sigma-Aldrich | F8129 | |
| Benzoyl peroxide | Sigma-Aldrich | B5907 | |
| borosilicate glass beaker | Sigma-Aldrich | Z231827 | |
| Carbenicillin disodium salt | Sigma-Aldrich | C3416 | |
| Cefotaxime sodium salt | Sigma-Aldrich | C7039 | |
| Dimethyl sulfoxide | Sigma-Aldrich | 472301 | |
| Ethanol | Supelco | 1.00983 | |
| Fertilizer | Compo Expert | ||
| Flower pot 5 L | VWR | 470049-676 | |
| Glutaraldehyde | Sigma-Aldrich | 354400 | |
| Glycerol | Sigma-Aldrich | G7893 | |
| Hydrochloric acid | Sigma-Aldrich | 258148 | |
| Kanamycin monosulfate | Sigma-Aldrich | BP861 | |
| LB Broth with agar | Sigma-Aldrich | L3147 | |
| MCE syringe filter | Millipore | SLGSR33SS | |
| PARAFILM M sealing film | BRAND | HS234526B-1EA | |
| Pararosaniline hydrochloride | Sigma-Aldrich | P3750 | |
| Periodic acid | Sigma-Aldrich | P0430 | |
| Phyto agar | Duchefa Biochemie | P1003 | |
| Scalpel blade no. 24 | Romed Holland | BLADE24 | |
| Schenk & Hildebrandt Basal salt medium | Duchefa Biochemie | S0225 | |
| Schenk & Hildebrandt vitamin mixture | Duchefa Biochemie | S0411 | |
| Schiff′s reagent | Sigma-Aldrich | 1.09033 | |
| Sodium metabisulfite | Sigma-Aldrich | 161519 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | Sigma-Aldrich | S5011 | |
| Soil / Substrate | Compo Sana | ||
| Stainless Steel Tweezers | Sigma-Aldrich | 22435-U | |
| Sucrose | Duchefa Biochemie | S0809 | |
| Toluidine Blue O | Sigma-Aldrich | 198161 |
Referências
- Çalışkan, M. E., Yousaf, M. F., Yavuz, C., Zia, M. A. B., Çalışkan, S. History, production, current trends, and future prospects. Potato Production Worldwide. , 1-18 (2022).
- Barker, K. R., Koenning, S. R. Developing sustainable systems for nematode management. Ann Rev Phytopathol. 36 (1), 165-205 (1998).
- Jones, J. T., et al. Top 10 plant-parasitic nematodes in molecular plant pathology. Mol Plant Pathol. 14 (9), 946-961 (2013).
- Davis, E. L., Hussey, R. S., Baum, T. J. Getting to the roots of parasitism by nematodes. Trend Parasitol. 20 (3), 134-141 (2004).
- Figueiredo, J., Vieira, P., Abrantes, I., Esteves, I. Commercial potato cultivars exhibit distinct susceptibility to the root lesion nematode Pratylenchus penetrans. Horticulturae. 8 (3), 244 (2022).
- Faria, J. M. S., et al. In vitro co-culture of Solanum tuberosum hairy roots with Meloidogyne chitwoodi: Structure, growth and production of volatiles. Plant Cell Tissue Organ Culture. 118 (3), 519-530 (2014).
- Wesemael, W. M. L., Moens, M., Viaene, N., Taning, L. M. Life cycle and damage of the root-knot nematode Meloidogyne minor on potato, Solanum tuberosum. Nematology. 16 (2), 185-192 (2014).
- Subramanian, P., et al. Differential metabolic profiles during the developmental stages of plant-parasitic nematode Meloidogyne incognita. Int J Mol Sci. 18 (7), 1351 (2017).
- Gutierrez-Valdes, N., et al. Hairy root cultures-A versatile tool with multiple applications. Front Plant Sci. 11, 33 (2020).
- Cho, H. J., Farrand, S. K., Noel, G. R., Widholm, J. M. High-efficiency induction of soybean hairy roots and propagation of the soybean cyst nematode. Planta. 210 (2), 195-204 (2000).
- Young, J. M., Kuykendall, L. D., Martínez-Romero, E., Kerr, A., Sawada, H., et al. A revision of Rhizobium Frank 1889, with an emended description of the genus, and the inclusion of all species of Agrobacterium Conn 1942 and Allorhizobium undicola de Lajudie et al. 1998 as new combinations: Rhizobium radiobacter, R. rhizogenes, R. rubi, R. undicola and R. vitis. Int J Syst Evol Microbiol. 51 (1), 89-103 (2001).
- Giri, A., Narasu, M. L. Transgenic hairy roots. Biotechnol Adv. 18 (1), 1-22 (2000).
- Faria, J. M. S., Rusinque, L., Cavaco, T., Nunes, J. C., Inácio, M. L. Essential oil volatiles as sustainable antagonists for the root-knot nematode Meloidogyne ethiopica. Sustainability. 15 (14), 11421 (2023).
- European Mediterranean Plant Protection Organization (EPPO). PM 7/148 (1) Guidelines for the management of nematode collections used for the production and maintenance of reference material. EPPO Bulletin. 51 (3), 507-548 (2021).
- Boisseau, M., Sarah, J. L. In vitro rearing of Pratylenchidae nematodes on carrot discs. Fruits. 63 (5), 307-310 (2008).
- Barbosa, P., et al. Nematicidal activity of phytochemicals against the root-lesion nematode Pratylenchus penetrans. Plants. 13 (5), 726 (2024).
- Santos, P. M., et al. Essential oils from hairy root cultures and from fruits and roots of Pimpinella anisum. Phytochemistry. 48 (3), 455-460 (1998).
- Bertani, G. Studies on lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli. J Bacteriol. 62 (3), 293-300 (1951).
- Kumar, A., Forrest, J. M. Reproduction of Globodera rostochiensis on transformed roots of Solanum tuberosum cv. Desiree. J Nematol. 22 (3), 395-398 (1990).
- Schenk, R. U., Hildebrandt, A. C. Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures. Canadian J Botany. 50 (1), 199-204 (1972).
- Figueiredo, A. C. S., Barroso, J. M. G., Pedro, L. M. G., Ascensão, L. . Histoquímica e citoquímica em plantas: princípios e protocolos. Universidade de Lisboa. , (2007).
- Bybd, D. W., Kirkpatrick, T., Barker, K. R. An improved technique for clearing and staining plant tissues for detection of nematodes. J Nematol. 15 (1), 142-143 (1983).
- Coyne, D., Adewuyi, O., Mbiru, E. . Protocol for in vitro culturing of lesion nematodes: Radopholus similis and Pratylenchus spp. on carrot disc. , (2014).
- Faria, J. M. S., Vicente, C. S. L., Rusinque, L., Camacho, M. J., Inácio, M. L. Plant-Nematode co-cultures in the screening of sustainable nematicides against soil-dweling parasitic nematodes of plants. Revista de Ciências Agrárias. 45 (4), 436-439 (2022).
- Faria, J. M. S., et al. In vitro co-cultures of Pinus pinaster with Bursaphelenchus xylophilus: a biotechnological approach to study pine wilt disease. Planta. 241 (6), 1325-1336 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados