Method Article
유도된 구조적 변화의 평가를 위한 식물 기생 선충을 사용한 감자 뿌리의 생체 내 및 체외 감염
요약
이 프로토콜은 생체 내 온실 조건에서 Solanum tuberosum 뿌리를 식물 기생 선충과 감염시키고 광학 현미경을 통한 뿌리 구조의 조직화학적 분석을 위해 감자 체외 형질전환 뿌리를 감염시키는 것을 설명합니다.
초록
토양에 서식하는 식물 기생 선충(PPN)은 병변을 일으키거나 식물 뿌리 구조를 변화시켜 작물의 적합성과 생산성을 감소시키는 중요한 감자 해충입니다. PPN 감염 및 발병의 세포 및 세포 내 메커니즘에 대한 연구는 온실 조건에서 들판 식물이나 묘목에 의존 할 수 있습니다. 현장 연구는 자연 환경을 더 잘 대표하지만 연구 결과에 큰 영향을 미칠 수 있는 환경 조건의 예측 불가능성에 노출됩니다. 온실 연구를 통해 환경 변수를 보다 잘 통제하고 오염 물질 또는 병원체에 대한 안전성을 높일 수 있습니다. 그러나 일부 숙주에서는 유전적 다양성이 가변성의 중요한 요소가 되어 숙주-기생충 복합체 반응에 영향을 미칩니다. 당사는 PPN을 이용한 형질전환 뿌리의 체외 공동 배양을 공간을 덜 차지하고, 획득하는 데 시간이 덜 필요하며, 오염 또는 숙주 유전적 다양성이 없는 신뢰할 수 있는 대안으로 개발했습니다. 공동 배양은 무균 PPN을 도입하여 in vitro 형질전환 뿌리를 숙주함으로써 얻어집니다. 무기한 유지 관리할 수 있으므로 참조 PPN 컬렉션을 유지하는 데 탁월한 지원을 제공합니다. 본 연구에서는 뿌리 병변 선충에 의한 생체 내 감자 뿌리의 통제된 감염 및 뿌리혹 선충과 감자 형질전환 뿌리의 체외 공동 배양을 확립하기 위한 프로토콜이 자세히 설명되어 있습니다. 시험관 공동 배양은 자연 감자 감염 상태에 대한 실험실 대리물을 제공하고 계절이나 기후 조건에 관계없이 선충의 생활 단계를 생성했습니다. 또한 구조 분석에 사용되는 방법론은 조직화학과 광학 현미경을 사용하여 자세히 설명되어 있습니다. acid fuchsin dye는 뿌리의 선충 공격 부위를 추적하는 데 사용되며, PAS(Periodic acid-Schiff) 및 toluidine blue O를 사용한 감별 염색은 감자 내부 뿌리 조직의 선충 구조를 강조합니다.
서문
뿌리와 괴경 작물은 세계에서 가장 중요한 주식 식품 중 4위를 차지합니다. 감자(Solanum tuberosum L.)는 가장 중요한 재배 괴경 중 하나입니다. 남아메리카의 안데스 산맥에서 시작되었지만 16세기에 유럽에 소개된 후 저소득층에게 가장 흔한 식량 공급원이 되었습니다. 오늘날 감자는 전 세계 칼로리 섭취량의 1.7%를 차지합니다1. 작물 생산은 식물 해충 및 병원체의 영향을 크게 받으며, 그 중 식물 기생 선충(PPN)은 평균 수확량 손실이 최대 12%2까지 증가할 수 있습니다. 식물 기생 선충은 현대 농업에서 작물에 가장 큰 피해를 주는 질병의 원인입니다. 토양에 거주하는 PPN은 식물 뿌리에 영향을 미치고 생산량을 감소시키거나 제품을 손상시켜 시장성을 잃게 만들어 작물 생산성을 방해하기 때문에 농부들에게 큰 손실을 입힙니다3. 이 위험한 식물 기생충은 탐침(바늘 모양의 입 부분)을 사용하여 뿌리 세포에 구멍을 뚫고 세포 내용물을 먹습니다. 일부 PPN은 뿌리 밖에서 먹이를 먹고, 다른 PPN은 뿌리로 들어가 조직 손상(철새)을 일으키고, 다른 PPN은 뿌리로 들어가 앉아서 먹이를 쉽게 먹기 위해 뿌리 구조를 크게 변화시킵니다4. 감자에 영향을 미치는 주요 PPN은 감자 낭종 선충, Globodera spp., 뿌리혹 선충(RKN), Meloidogyne spp., 뿌리 병변 선충, Pratylenchus spp., 거짓뿌리혹 선충 Nacobbus aberrans, 감자 썩음병 선충 Ditylenchus destructor입니다. 이러한 PPN의 경우, 다른 섭식 습관은 숙주 뿌리 조직에서 다른 구조적 변화를 유발합니다 5,6. PPN 감염 및 숙주 반응의 메커니즘에 대한 연구는 종종 참조 PPN 배양 수집을 유지하거나 대규모 실험을 수행하기 위해 현장 또는 온실 시험을 통해 수행됩니다 7,8. 자연 조건에서의 테스트는 환경 변화와 생물 또는 비생물적 스트레스 요인의 영향을 크게 받습니다. 온실 생물 검정은 환경 변화를 상대적으로 제어하고 비생물 및 생물 스트레스의 영향을 제한하는 동시에 자연 상태에 더 가까운 대안입니다. 그러나 숙주의 유전적 다양성은 생물학적 다양성을 보다 세밀하게 제어해야 하는 임상시험에서 여전히 문제가 될 수 있습니다. 이러한 한계는 체외 식물 조직 배양에 의존하여 극복할 수 있습니다. 이들은 PPN 질병 연구에 많은 이점을 가진 다목적 실험실 시스템입니다. 토양에 거주하는 PPN의 경우, 형질전환 뿌리의 시험관 내 배양은 실험실 조건에서 연구에 유용한 도구입니다 9,10.
식물 재료에 Rhizobium rhizogenes를 감염시킨 후 형질전환 뿌리 또는 털이 많은 뿌리(HR)를 얻는다(Riker et al. 1930), Young et al. 2001,11. 이 그람 음성 박테리아는 Ri 플라스미드가 숙주 게놈으로 형질주입되도록 유도하고 식물 호르몬 생합성의 조절을 변화시켜 뿌리 조직의 형성을 촉진합니다12. 형질전환 뿌리는 배양 배지에서 무균 상태에서 무기한 유지될 수 있습니다. PPN 연구를 위해 HR을 사용하는 이점은 선충 감염 및 발달에 영향을 미치는 식물 성장 조절제가 없는 경우 높은 성장률, 단위 시간당 바이오매스 생산 비율이 높다는 점, 더 높은 유전적 및 생화학적 안정성을 결정하는 세포 무결성 및 수명입니다6. 시험관 내 형질전환 뿌리에 의존함으로써, PPN 유전자형은 실험실 조건에서 무기한 유지될 수 있고, 감염 및 PPN 발달을 쉽게 추적할 수 있으며, 숙주 유전적 다양성을 줄일 수 있고, 숙주 분자 구성의 조작은 선충 반응과 직접 연결될 수 있으며, 숙주 및 기생충 구조 변화를 보다 정확하게 따를 수 있습니다 6,13. 감자의 PPN 질병에 대한 연구의 경우, 체외 형질전환 뿌리 공동 배양을 통해 계절 또는 감자 괴경 휴면과 독립적으로 실험을 수행할 수 있습니다.
이 프로토콜에서는 PPN 유지 관리 및 감자 식물의 생체 내 감염에 대한 전통적인 방법론이 자세히 설명되어 있습니다. 감염된 뿌리의 구조 분석을 위해 PPN을 사용한 형질전환 감자 뿌리의 체외 공동 배양 확립을 기반으로 하는 개선된 방법론도 환경 및 숙주 유전적 다양성을 보다 잘 제어할 수 있는 대안으로 자세히 설명되어 있습니다. 뿌리 조직에서의 PPN 감염 및 발달을 추적하기 위해 조직화학(histochemistry)을 사용하여 광학 현미경 검사에서 PPN 관찰을 돕습니다. 이 프로토콜의 전반적인 목표는 PPN-숙주 상호 작용에 대한 연구를 최적화하여 실험을 위한 보다 통제되고 재현 가능한 조건을 보장하는 동시에 뿌리 조직의 선충에 대한 상세한 구조 및 발달 분석을 촉진하는 것입니다.
프로토콜
1. 온실에서 자란 감자 식물의 감염
참고: 온실 시험은 PPN 해충의 특정 수명 주기에 따라 혼합 수명 단계 또는 2단계 청소년(J2)의 PPN을 현탁액으로 수행합니다. 이 프로토콜의 경우, 뿌리 병변 선충(RLN) Pratylenchus penetrans 의 혼합 생활 단계의 현탁액이 사용되었습니다. PPN은 실험실에서 사육하거나 인증된 참조 실험실에서 요청할 수 있습니다.
- 뿌리 병변 선충의 증식 및 유지
참고: 멸균된 당근 디스크는 RLN의 곱셈 및 유지에 사용됩니다.14. 미생물 오염을 줄이기 위해 눈에 띄는 손상이 없는 상업적으로 구입한 당근(var. Nice)을 사용하십시오. 가급적이면 RLN 발달을 방해하지 않도록 살충제가 없어야 합니다.- 당근을 흐르는 수돗물에 씻어 더 큰 부스러기를 제거한 다음 일반 세제 용액(물 40mL당 1방울)으로 더 미세한 부스러기를 제거합니다. 실험실용 종이 타월로 말리십시오.
- 무균 상태에서 수직 흐름 후드에 멸균 된 금속 꼬챙이를 당근 위에 삽입 (안쪽으로 1-2cm)하여 더 쉽게 잡을 수 있습니다.
- 노즐이 달린 세척 병을 사용하여 당근을 96%(v/v) 에탄올로 적십니다. 당근의 아래쪽 끝을 살균 여과지에 묻혀 조심스럽게 불에 태운다.
주의: 에탄올은 강하게 발화하므로 거리를 두고 서 있습니다. - 멸균 필러를 사용하여 당근을 위에서 아래로 껍질을 벗긴 다음 이전 단계를 반복합니다. 위쪽과 아래쪽 부분(안쪽으로 2cm)을 버리고 당근의 중간 부분을 멸균 페트리 접시(직경 150mm)에 넣습니다. 멸균 칼날과 핀셋을 사용하여 당근의 직경 약 2cm 부분에서 1cm 두께의 부분을 조심스럽게 자릅니다(그림 1).
- 섹션을 멸균 페트리 접시(직경 60mm)로 옮기고 투명 필름으로 테두리를 밀봉합니다. 자외선을 사용하여 당근 디스크 표면을 양쪽에서 60분 동안 살균합니다.
- 어둠 속에서 1-2주 동안 25°C로 유지하고 미생물 오염의 징후를 보이기 시작하는 당근 디스크는 모두 버립니다15.
알림: 눈에 보이는 오염 징후는 과도한 갈변(썩음), 당근 디스크의 아래쪽 경계에 액체 축적 또는 표면의 곰팡이 균사체 성장입니다. - 나머지 당근 디스크는 RLN 현탁액에 감염될 준비가 되었습니다. 멸균 칼날을 사용하여 당근 디스크 중앙을 X자 모양으로 절개하는 것으로 시작합니다. 절반 깊이만 잘라야 합니다.
- X자형 상처 중앙에 최소 50개의 혼합 수명 단계를 포함하는 현탁액 50μL를 피펫팅하여 RLN을 접종합니다. 페트리 접시를 닫고 건조를 방지하기 위해 투명 필름으로 테두리를 밀봉하십시오.
- 오목한 슬라이드에서 실온에서 양안 실체 현미경(40x)으로 5개의 50μL 분취량을 계수하여 현탁액의 평균 선충 수를 측정합니다. 현탁액에 물을 추가하거나 선충이 가라앉을 때까지 기다린 후(약 60분) 지표수를 디캔팅하여 부피를 낮추어 혼합된 수명 단계 RLN의 현탁액을 mL당 1000으로 설정합니다.
- 당근 디스크를 25 °C의 어둠 속에서 최대 3개월 동안 유지하고 RLN 개체군 증가로 인한 괴사성 병변의 징후를 양안 실체 현미경으로 매주 따릅니다.
참고: 성공적으로 기생된 당근 디스크는 나중에 최대 2개월 동안 사용할 수 있도록 11°C에서 보관할 수 있지만 정기적으로 미생물 오염을 확인합니다. 미생물 감염의 징후를 보이는 기생충 당근 디스크는 폐기하기 전에 오토클레이빙으로 오염을 제거해야 합니다. - 유동 후드 아래에서 접종 부위(그림 1)에서 조직 괴사가 보이는 당근 디스크를 멸균 유리 그릇에 설정된 직경 8cm, 75μm 메쉬 체로 옮겨 RLN을 추출합니다. RLN을 수집하기 위해 체 바닥과 그릇 오목한 부분 사이에 1cm의 작은 간격을 두십시오.
참고 : 상업적으로 구입 한 체가 없으면 8cm 직경의 플라스틱 튜브 / 견고한 플라스틱 컵 및 단단한 메쉬 거즈로 만들 수 있습니다. 고무 밴드를 사용하여 거즈를 플라스틱 튜브나 컵에 고정합니다. - 당근 디스크가 덮일 때까지 항생제 용액을 체에 붓고 어둠 속에서 12시간(밤새) 보관합니다. RLN은 당근 디스크에서 빠져나와 그릇 바닥에 정착합니다. 항생제 용액은 멸균된 증류수에 카나마이신과 카르베니실린을 각각 50μg/mL씩 첨가하여 추출과 함께 즉석에서 준비해야 합니다16.
참고: 항생제 원액은 멸균된 증류수 10mL에 각각 0.5g의 카나마이신 모노설페이트 또는 0.5g의 카르베니실린 디소듐을 용해하여 50mg/mL로 준비됩니다. 원액은 플로우 후드에서 여과(0.22μm 메쉬)되며 최대 1년 동안 -20°C에서 유지할 수 있습니다. - 체를 제거하고 멸균된 유리 피펫을 사용하여 용기 바닥의 RLN을 멸균된 유리 염색 블록(4cm x 4cm x 1cm)으로 추출한 다음 1mL의 항생제 용액을 피펫팅하여 세척합니다. 사용한 항생제 용액을 채취하기 전에 선충이 가라앉을 때까지 30-40분 정도 기다립니다. 이 세척을 4x-5x 반복합니다.
- RLN과 함께 수성 현탁액을 즉시 사용하거나 더 긴 보관 기간(최대 2개월)을 위해 11°C로 유지하십시오.
- PPN에 의한 감자 식물의 생체 내 감염
참고: 감염되기 쉬운 감자 식물(S. tuberosum var. Désirée)을 재배하려면 1월에서 3월 사이에 농산물 딜러로부터 인증된 씨감자를 구입해야 합니다. 인증된 씨감자는 식물 위생 여권과 함께 판매되어 검역 식물 기생충에 오염되지 않았는지 확인하기 때문에 인증된 씨감자를 선택하십시오. 예방 조치로, 10% 표백제 용액으로 소독하는 초기 단계를 수행한 다음 흐르는 수돗물로 세척하여 감자 괴경 표면을 소독할 수 있습니다. 싹이 트고 활력을 줄이기 위해 부과되는 치료법은 감자 성장과 감염에 대한 반응을 방해할 수 있으므로 일반적으로 상업화된 감자는 권장되지 않습니다.- 같은 크기의 감자 괴경을 선택하고 구멍, 타박상 또는 부드러운 부분이 있는 것은 버리십시오. 파종하기 전에 자란 모든 콩나물(1mm)을 부드럽게 제거하여 싹을 동기화합니다.
알림: 필요한 경우 파종하기 전에 씨감자를 통풍이 잘되고 건조하며 어두운 곳에 보관하십시오. - 5L 화분(22cm x 18cm)에 고압멸균 토양과 미세한 굵은 모래를 22.5g의 천천히 방출되는 NPK 비료(12-12-12)와 혼합한 1:1 혼합물로 채우고 토양 표면 아래 9cm에 감자를 파종합니다.
참고: 토양과 모래는 2mm보다 큰 파편을 제거하기 위해 체질하고, 121°C에서 15분 동안 2회 고압멸균하고, 100°C에서 1-2일 동안 건조해야 하며 자주 혼합해야 합니다. 다음 7 – 10일 동안 사용하기 전에 자주 혼합하여 공기에 쐬십시오. - 감자 식물 싹이 토양 표면에서 나오기 시작할 때까지 습한 조건(습도 50%-70%)과 물을 자주 주고(토양을 최대 수분 보유 용량의 70%로 유지) 온실에 보관하십시오.
- 식물 출현 후에, 감자 뿌리를 감염시키기 위하여 갓 추출한 RLN 현탁액을 이용하십시오. 씨앗 깊이를 위해 식물 주위에 4-6 개의 구멍 (1cm 너비)을 고르게 분포 시키는 것으로 시작하십시오.
- 30,000개의 살아있는 혼합 수명 단계 RLN의 8mL 현탁액을 구멍에 고르게 피펫으로 넣어 접종물이 토양 혼합물 g당 4개의 살아있는 RLN의 비율이 되도록 하고 토양 혼합물로 덮습니다. RLN이 있는 화분의 경우 접종 당일에 물을 주지 마십시오.
참고: RLN은 실체현미경(40x)으로 계산됩니다. 죽은 선충은 운동성이 없고 확장된 모양을 가지고 있는 반면, 살아있는 선충은 일반적으로 움직입니다(확장되지 않은 모양). 물리적 찌르기는 사망률을 확인하는 데 사용됩니다. - 위에서 설명한 조건에서 냄비를 2개월 동안 보관하십시오(그림 2). 그 후, 감자 식물을 뿌리째 뽑고 새싹과 뿌리의 무게를 따로 잰다.
- 염색 기술을 통해 RLN 공격 부위의 위치를 확인하기 전에 뿌리 시스템을 조심스럽게 세척하십시오5.
- 같은 크기의 감자 괴경을 선택하고 구멍, 타박상 또는 부드러운 부분이 있는 것은 버리십시오. 파종하기 전에 자란 모든 콩나물(1mm)을 부드럽게 제거하여 싹을 동기화합니다.
2. PPN을 가진 감자 형질전환 뿌리의 시험관 내 공동 배양 확립
- 설정 in vitro 감자 형질전환 뿌리
참고: 이 프로토콜의 경우 다음을 사용했습니다. Rhizobium rhizogenes 운반 gus 리포터 유전자는 Ri 플라스미드에 공존하고 이중 35S 프로모터(A4pRiA4::70GUS)에 의해 구동됩니다.17. 박테리아는 상업적 출처에서 얻거나 인증된 참조 실험실에서 요청할 수 있습니다.- 기하급수적 성장 단계에서 박테리아를 얻으려면 R. rhizogenes 플레이트를 Luria-Bertani(LB)18 고체 중간 플레이트에 펴고 26°C에서 하룻밤 동안 유지합니다.
참고: LB 배지는 10g/L 펩톤, 5g/L 효모 추출물, 10g/L NaCl 및 15g/L 한천을 첨가한 다음 121°C에서 15분 동안 증기 멸균하여 상업적으로 구입하거나 실험실에서 준비할 수 있습니다. - 접종 루프를 사용하여 집락을 선택하고 멸균 50mL 플라스크에 10mL의 액체 LB 육수(한천이 없는 LB 배지)를 접종합니다. 26°C의 어두운 곳에서 밤새 교반(180rpm)하여 보관하십시오.
- A600 이 0.6에 도달할 때까지 액체 배양의 흡광도를 측정합니다. 이 단계에서 박테리아는 기하급수적 성장 단계에 있으며 식물 물질에 접종하는 데 사용됩니다.
- 접종은 무균 신선한 감자 괴경에서 수행됩니다. 감자 괴경의 표면을 살균하려면 먼저 흐르는 수돗물로 씻어 더 큰 파편을 제거한 다음 일반 세제 용액(물 1mL당 40방울)으로 세게 교반하여 더 미세한 파편을 제거합니다.
참고: 사용 중인 PPN에 대한 감수성이 알려진 감자 품종을 선택하십시오. 이 프로토콜의 경우 S. tuberosum var. Désirée를 사용했습니다. - 괴경을 용기에 넣고 상업용 표백제 용액(1:4, 수돗물에 상업용 표백제)으로 덮고 닫습니다. 15분 동안 혼합하고 표백제 용액을 버리고 멸균된 수돗물로 3번 헹굽니다.
- 플로우 후드에서 괴경을 에탄올 용액(80%, v/v)에 격렬하게 저어 15분 동안 담그고 에탄올을 폐기하고 멸균된 수돗물로 3번 헹굽니다.
- 멸균 메스를 사용하여 괴경의 주변 부분(괴경의 약 50%가 표면에서 안쪽으로)을 제거하고 내부 중앙 조각을 0.5cm 두께의 세그먼트로 절단합니다19. 2.1.3단계에서 준비한 박테리아 현탁액으로 즉시 접종합니다.
- 접종을 위해 pH = 5.6에서 30g/L 자당이 보충된 9mL의 Schenk 및 Hildebrandt20 (SH) 배지에 1mL의 박테리아 현탁액을 첨가하여 박테리아 현탁액을 희석합니다. 멸균 메스의 끝을 희석된 현탁액에 담그고 감자 세그먼트의 표면을 감습니다. 각 감자 세그먼트에 대해 이 단계를 5회 반복합니다.
- 과도한 습도의 세그먼트를 멸균 여과지에서 1분 동안 건조시키고 반고체 SH 매체(30g/L 자당, 8g/L 한천, pH = 5.6의 SH 매체)에 놓고 플라스미드 형질주입이 일어나도록 25°C의 어둠 속에 보관합니다.
- 3일 후, 감염된 분절을 항생제의 세포탁심(cefotaxime)과 카르베니실린(carbenicillin) 각각 150μg/mL가 보충된 반고체 SH 배지 플레이트로 옮깁니다. 박테리아를 확실히 제거하기 위해 매주 중간 재생으로 3개월 이상 보관하십시오.
참고: Cefotaxime 원액은 100mL의 멸균 탈염수에 1g의 cefotaxime 나트륨을 용해하고 플로우 후드 아래에서 여과(0.22μm 메쉬)하여 준비할 수 있습니다. 항생제는 최대 1년 동안 -20°C에서 보관할 수 있습니다. - 3개월 후, 유전자 변형 뿌리 성장이 광범위하게 이루어집니다. 멸균 핀셋의 끝으로 1g의 뿌리 덩어리를 모아 새 플레이트의 배양 배지 중앙에 놓아 뿌리를 항생제가 없는 새로운 반고체 SH 배지로 옮깁니다(그림 3).
참고: 감염 후 약 1개월이 지나면 감자 분절 표면에 작은 세포 덩어리가 자라나며, 이때부터 형질전환 뿌리가 발달하기 시작합니다6. 배양 배지와 계속 접촉하도록 하십시오. 그렇지 않으면 건조될 수 있습니다. - 유전적 및 대사적 안정성을 보장하기 위해, 형질전환 뿌리를 PPN에 감염되기 전에 1년 이상 어둠 속에서 25°C에서 1년 이상 월별 하위 배양 루틴(단계 2.1.11 참조)에 따라 유지하십시오.
참고: 원치 않는 미생물 오염이 자주 발생하므로 프로토콜의 모든 단계에서 최소 6번의 복제가 유지되도록 합니다. 일단 확립되면 단일 공동 배양 플레이트를 여러 새로운 공동 배양에 대한 접종물로 사용할 수 있습니다. 그러나 최소 6개의 복제 플레이트를 보관해야 합니다.
- 기하급수적 성장 단계에서 박테리아를 얻으려면 R. rhizogenes 플레이트를 Luria-Bertani(LB)18 고체 중간 플레이트에 펴고 26°C에서 하룻밤 동안 유지합니다.
- PPN을 사용한 형질전환 감자 뿌리의 체외 공동 배양 확립
참고: PPN과 형질전환 뿌리의 공동 배양을 얻으려면 선충 살균 과정이 중요합니다. 본 프로토콜에서는 검역 뿌리혹 선충 Meloidogyne chitwoodi의 2단계 청소년을 사용했습니다. 선충 접종물은 뿌리 담즙 형태로 인증된 참조 실험실에서 얻을 수 있습니다.- 양안 실체 현미경(20x)으로 멸균 초미세 포인트 핀셋으로 뿌리 담즙에서 선충 알 덩어리를 분리합니다. 멸균 수돗물 5mL와 함께 덮개를 씌운 페트리 접시에 달걀 덩어리를 넣고 48시간 동안 부화시킵니다. J2 현탁액을 mL당 100 선충으로 설정합니다.
- 플로우 후드에서 500 J2가 포함된 현탁액 5mL를 멸균 20μm 메쉬 멸균 체에 피펫팅하고 멸균 수돗물로 세척합니다.
- J2s를 함유 한 체의 아래쪽 절반을 20 % 과산화수소 (H2O2) 용액에 담그고 15 분 동안 원을 그리며 수동으로 혼합합니다.
- 체를 통해 멸균 수돗물을 분사하여 멸균 J2를 세척합니다. 이 단계를 3회 반복합니다. 최종 세척에서 선충이 체 경계에 모이도록 체를 기울입니다. 체 경계에 1mL의 멸균 초순수를 피펫팅하여 멸균 선충 현탁액을 회수하고 11°C에서 보관하거나 즉시 사용합니다.
참고: 멸균의 성공 여부는 SH 배지에서 선충 현탁액의 100μL 부분 표본을 도금하고 1주일 동안 정기적으로 오염을 모니터링하여 평가할 수 있습니다. - 플로우 후드에서 100개의 멸균 선충(mL당 1000J2s의 현탁액 100μL)이 있는 SH 플레이트에 1g의 감자 형질전환 뿌리 덩어리(2.1.11단계 설명 참조)를 계대배양합니다. 2-3주가 지나면 새로운 뿌리에 작은 담즙이 나타나기 시작합니다.
- 도립 현미경(100x)으로 정기적으로 공동 배양을 따르고, 알 덩어리가 눈에 띄기 시작하면 새로운 반고체 SH 중간 플레이트로 하소배양하여 뿌리 덩어리와 함께 담즙을 채취하는지 확인합니다(그림 4). 어둠 속에서 25 °C에서 매월 하위 배양 루틴으로 공동 배양을 유지하십시오.
3. PPN 감염의 구조 분석
참고: PPN에 의해 유도된 뿌리 조직 구조의 변화를 따르기 위해 조직화학적 염색 기술을 사용하여 조직을 다른 화학 조성으로 대조합니다. 차등 염색은 뿌리 덩어리 또는 고정된 뿌리 물질의 얇은 부분에서 수행되며, 여기서 특정 염료는 화학적 친화력에 따라 표적 조직과 반응합니다21. 본 프로토콜에서는 차등 염색을 위해 톨루이딘 블루 O 염료와 결합된 산성 푸시프 시약(PAS)을 사용했습니다.
- 산성 푹신으로 염색된 뿌리에 있는 식물 기생 선충 분포
참고: 뿌리 시스템 전체에 걸쳐 PPN의 분포를 따르기 위해 산 푹신을 사용하여 선충 근육 조직을 붉은 색조로 염색합니다5.- 먼저 흐르는 수돗물에 뿌리 시스템을 5분 동안 세척하여 토양 파편(생체 내 식물 뿌리) 또는 배양 배지(체외 형질전환 뿌리)의 잔류물을 제거합니다. 손가락을 원을 그리며 사용하여 뿌리 시스템에서 토양을 분리하는 데 도움을 줍니다.
- 뿌리 시스템을 1-2cm 길이로 자르고 150mL 비커에 넣습니다. 1.5% 차아염소산나트륨(NaOCl) 용액 70mL를 분주하고 4분 동안 세게 혼합하여 뿌리 조직을 제거합니다. 그 후, NaOCl 용액을 버리고 흐르는 수돗물에 뿌리를 헹구고 탈염수에 15 분 동안 담가 잔류 NaOCl22를 제거합니다.
참고: 염소 표백제에는 최소 5.25%의 NaOCl이 포함되어 있으므로 물 50mL에 염소 표백제 20mL를 첨가하면 1.5% NaOCl 용액을 얻을 수 있습니다. 더 부드러운 재료(예: 어린 뿌리 또는 시험관 내에서 성장한 형질전환 뿌리의 더 부드러운 조직)의 경우 0.9% NaOCl 용액을 사용하고 더 단단한 재료(오래된 리그화 뿌리)의 경우 2.0% NaOCl 용액을 사용합니다. - 깨끗이 씻은 뿌리를 배수하고 탈염수 30mL가 담긴 붕규산 유리 비커에 놓습니다. 산성 푹신 염색 용액 1mL를 피펫으로 만들고 수동으로 혼합하고 핫 플레이트에서 30초 동안 끓입니다. 유리 비커를 식히고 용액을 배수하고 얼룩진 뿌리를 흐르는 수돗물로 씻으십시오.
참고: 산성 푹신 염색 용액은 3.5g의 산성 푹신 염료 분말을 250mL의 아세트산에 용해시키고 750mL의 탈염수를 첨가하여 만듭니다. 염색 후에는 항상 염색 단계가 이어지며 사용하지 않은 과도한 얼룩을 제거하고 표본 대비를 향상시킵니다. - 산성화된 글리세린 10-30mL와 HCl(5N)13 몇 방울을 첨가하여 탈취합니다.
- 실체 현미경 또는 도립 현미경 아래에서 관찰하여 뿌리 구조에서 PPN이 우선적으로 공격하는 위치를 대략적으로 평가합니다(그림 5 및 그림 6).
- 주기적 산-쉬프(PAS)/톨루이딘 블루 O를 사용한 뿌리 세포 형태 평가
참고: PPN 감염 또는 뿌리 세포 형태에 대한 손상의 영향은 먼저 감염된 감자 뿌리를 고정, 절단 및 차등 염색하여 현미경으로 평가할 수 있습니다.- 밀폐된 샘플 바이알에 2.5% 글루타르알데히드로 새 뿌리 물질을 고정하고 0.1M 인산나트륨 완충액에서 pH 7.2,실온 24-48시간 동안 6.
주의 : 글루타르알데히드는 독성이 있습니다. 흡입 및 접촉을 피하십시오. 보호용 실험복과 장갑을 사용하고 흄 후드에서 작업하십시오. 샘플 바이알은 헹굼 또는 진공 절차가 아닌 한 닫아야 합니다. 글루타르알데히드는 유해 폐기물 절차 규칙에 따라 폐기하십시오. 3.2.1단계부터 3.2.5단계까지는 시약 흡입을 방지하기 위해 흄 후드에서 수행됩니다.
참고 : pH 7.2의 인산나트륨 완충액 1L를 준비하려면 1M NaH2PO4 31.6 mL (1 L 용액에서 119.98 g)에 1M NaH2HPO4 (1L 용액에서 141.96 g) 68.4 mL를 추가하고 900 mL의 탈염수를 첨가하여 최대 1 L를 채 웁니다. 정착제의 침투를 돕기 위해 진공 펌프에 연결된 데시케이터에서 2분 동안 저진공(26mm Hg) 상태에서 뿌리 물질이 있는 뚜껑이 없는 샘플 바이알을 놓습니다. - 유리 파스퇴르 피펫으로 고착 용액을 버리고 고정 된 뿌리를 인산나트륨 완충액 (3x)으로 씻습니다.
- 15분 동안 완충액을 10% 에탄올 용액(v/v)으로 교체하여 고정된 뿌리 조직을 점진적으로 탈수하기 시작합니다. 그 후, 유리 피펫을 사용하여 20 % 에탄올 용액으로 교환하고 15 분 동안 뿌리를 고정시킵니다. 뿌리를 1시간 동안 유지해야 하는 순수 에탄올 단계까지 에탄올 농도(30%, 40%, 50%, 60%, 70%, 80%, 90% 각각 15분 동안)를 증가시키는 단계적 연속을 계속합니다.
- 탈수된 뿌리를 수지(2-하이드록시에틸 메타크릴레이트)에 서서히 삽입하십시오. 유리 피펫을 사용하여 순수 에탄올을 3:1(v/v) 에탄올/수지 용액으로 교체하고 4°C에서 24시간 동안 유지합니다. 1:1 및 1:3(v/v) 에탄올/수지 용액을 각각 4°C에서 24시간의 배양 기간을 갖습니다. 그 후 1:3(v/v) 용액을 중합 개시제로서 과산화디벤조일(1%)이 보충된 순수 수지로 교체합니다.
- 샘플을 수지 몰드 트레이에 넣고 수지 : 디메틸 설폭 시드 15 : 1 (v / v) 혼합물을 넣고 수지가 굳을 때까지 48 시간 동안 핫 플레이트에서 60 ° C로 유지합니다.
- 함침된 샘플을 텅스텐 나이프가 장착된 회전식 마이크로톰에 넣고 제조업체의 지침에 따라 2-5μm 절편을 유리 슬라이드로 자릅니다.
- 실온에서 아세트산에 15% 2,4-디니트로페닐히드라진 용액을 넣은 유리 염색 용기에 슬라이드를 10분 동안 담가 차등 염색을 시작합니다. 그 후 흐르는 수돗물에 15분 동안 조심스럽게 씻고 60°C(15분)의 오븐에서 건조합니다.
- 그런 다음 슬라이드를 주기적인 산(1%)에 10분 동안 담근 다음 흐르는 수돗물에 5분 동안 세척하고 60°C(15분)의 오븐에서 건조시킵니다.
- 슬라이드를 Schiff의 시약(0.25M 염산에서 1% 파라로사닐린과 4% 메타중아황산나트륨으로 구성)에 30분 동안 담그십시오. 그 후, 염산(0.05M)에 메타중아황산나트륨 용액(0.5%)으로 2분 동안 세척합니다. 3회 반복합니다. 마지막으로 흐르는 수돗물에 5분 동안 씻고 실온에서 건조시킵니다.
- 대조를 위해 슬라이드를 0.05% 톨루이딘 블루 O에 15분 동안 담그고 흐르는 수돗물로 15분 동안 세척한 다음 60°C(15분)의 오븐에서 건조시켜 염색합니다.
- 이미지 캡처 하드웨어가 장착된 현미경(100x)으로 관찰합니다(그림 7).
- 밀폐된 샘플 바이알에 2.5% 글루타르알데히드로 새 뿌리 물질을 고정하고 0.1M 인산나트륨 완충액에서 pH 7.2,실온 24-48시간 동안 6.
결과
당근 디스크는 여러 유형의 이동 PPN을 증식시키고 유지하는 데 사용할 수 있습니다23. RLN의 경우 이 기술은 일반적으로 선충 종 또는 분리물의 참조 컬렉션을 유지하는 데 사용됩니다. 당근 디스크를 사용하면 3개월 동안 선충 개체군이 평균 100배 증가할 수 있습니다(그림 1). 그러나 선충의 수는 30배에서 200배 사이로 크게 다양하며, 이는 주로 선충의 유전적 다양성 및/또는 당근의 영양 함량의 차이로 인해 발생합니다. 또한 미생물 오염을 줄이기 위해 여러 가지 예방 조치를 취했음에도 불구하고 당근 디스크의 20%에서 30%가 오염될 수 있으므로 필요한 것보다 많은 접시를 준비해야 합니다.
감자 식물에서 RLN의 존재가 뿌리 시스템을 공격하는 기생충 개체군 수에 크게 의존하기 때문에 항상 눈에 띄는 증상을 유발하는 것은 아닙니다(그림 2). P. penetrans의 경우, 초기 접종 4 RLNs/g의 토양은 2개월 후에 최대 2000 RLNs/g의 뿌리와 750 알/g의 뿌리를 형성할 수 있으며, 이는 뿌리 무게를 거의 30% 감소시킵니다5.
감자 털이 많은 뿌리 배양은 실험실 맥락에서 뿌리 관련 질병을 연구하기 위한 고처리량 시스템입니다. 확립된 감자 형질전환 뿌리는 하루에 SH 배지 L 당 300mg 뿌리 신선 중량의 특정 성장률과 2.6일의 배가 시간을 가집니다6(그림 3). M. chitwoodi와 공동 배양할 때 선충이 뿌리 조직을 먹고 에너지를 흡수하기 때문에 이러한 매개변수는 약간 영향을 받습니다. 공동 배양의 경우, 하루 SH 배지 L 당 200mg 뿌리 신선 중량의 특정 성장률과 3 일의 배가 시간을 달성 할 수 있습니다6. 개발된 선충의 수는 감자 형질전환 뿌리 신선 중량 g당 최대 1200J2s까지 증가할 수 있으며 난자의 양은 4배 더 많을 수 있습니다 6,13(그림 4). 온실에서 자란 RKN에 감염된 토마토 식물의 토양에서 테스트한 것과 비교했을 때, 선충 개체군의 최고 수확량은 뿌리 물질 g당 형질전환 뿌리의 절반에 불과했습니다(미발표 데이터). 그러나 RKN 개체군 성장은 숙주 식물 종과 다양성에 크게 의존하는 것으로 알려져 있습니다. 그럼에도 불구하고, 형태학적으로, 형질전환 뿌리에서 자란 선충은 들판이나 온실 감염에서 채취한 선충과 실질적인 차이를 보이지 않는다 6,13.
산성 푸시신을 사용하면 뿌리 조직에 대한 선충 공격을 추적하는 데 도움이 됩니다. RLN의 운동성 단계는 접종 후 1일 이내에 뿌리 내부에서 발견되는 것으로 알려져 있습니다5. 이 초기 단계는 숙주 감수성에 의존하지 않는 것으로 여겨집니다. 그러나 침투 후 RLN은 뿌리의 표피 및 피질 세포를 계속 먹거나, 취약한 식물에서 번식 및 괴사 형성을 유도하거나, 뿌리에서 토양으로 다시 빠져나갑니다5. 이러한 메커니즘은 산성 푹신(acid fuchsin)으로 염색하는 것으로 쉽게 이어질 수 있습니다(그림 5). RKN과 감자 털이 많은 뿌리의 공동 배양은 좌식 성인 여성을 위한 먹이 장소 설립에서 J2 침투 및 의사 결정의 메커니즘을 분석하기 위한 강력한 실험실 도구를 제공합니다. 젤라틴 기질의 형성 및 난자 방출을 포함하여 감염 후의 모든 단계를 추적할 수 있습니다(그림 6).
조직 구조는 조직화학(histochemistry)과 광학 현미경(optical microscopy)을 사용하여 자세히 설명할 수 있습니다. 차등 염색 기술을 사용하여 식물 기생충의 수명 주기 단계를 주변 뿌리 조직에서 유도된 변화와 함께 추적할 수 있습니다. Meloidogyne chitwoodi와 다른 뿌리혹 선충은 거대 세포라고 하는 특정 세포 유형으로 구성된 먹이 부위의 형성을 촉진합니다. 이 다핵 세포는 선충 J2의 분비물에 의해 유도되고 대사가 과도하게 활성화되어 정지된 성인 암컷을 위한 먹이를 생산합니다(그림 7). 이 특수 구조의 형성에 따라 선충 섭식 메커니즘에 대한 중요한 정보를 제공하고 수명 주기의 중단을 목표로 할 수 있는 특정 단계를 식별할 수 있습니다. 또한 먹이 부위 구조는 RKN 종에 특이적일 수 있어 식별에 기여할 수 있습니다.

그림 1: 당근 디스크의 뿌리 병변 선충 유지. (A) 당근 뿌리 디스크는 살균되고 Pratylenchus penetrans 에 감염되어 (B) (C) 개체군 성장으로 인한 특징적인 괴사 병변(어두운 부분)을 유발합니다. 막대 = 1cm (A 및 B), 100μm (C). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 온실 조건에서 자란 Solanum tuberosum 의 뿌리 감염. 방제 감자 식물(뒤쪽에 있는 화분)과 뿌리 병변 선충(앞쪽에 있는 화분)에 감염된 식물은 감염 30일이 지나면 싹에서 눈에 띄는 감염 증상을 보이지 않습니다. 막대 = 10cm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: Solanum tuberosum 형질전환 뿌리의 발달. (A) 감자 괴경 부분(화살표)의 메스 상처 부위를 따라 소세포 성장 덩어리가 나타나기 시작하고, (B) 첫 번째 형질전환 뿌리(오른쪽 삽입물)가 출현하고, (C) 배양 배지에서 빠르게 성장하고 유지됩니다. (D) 뿌리 덩어리는 지속적인 성장을 위해 신선한 배양 배지 플레이트로 옮길 수 있습니다. 막대 = 1cm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: Solanum tuberosum 과 식물 기생 선충 Meloidogyne chitwoodi의 공동 배양. (A) 시험관 내에서, 감자 형질전환 뿌리 배양은 (B) Columbia 뿌리혹 선충 무균 2단계 청소년(J2)에 감염되어 식물/선충 공동 배양을 확립할 수 있습니다. (C) 뿌리 담즙은 알 덩어리를 가진 성인 암컷에서 얻을 수 있습니다. 막대 = 1cm(A, B) 및 200μm(C). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
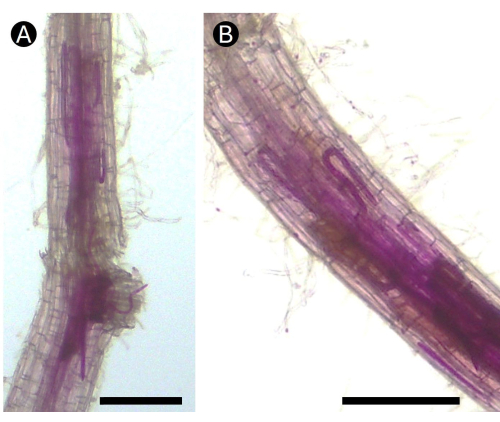
그림 5: 온실 조건에서 침투하는 뿌리 병변 선충 Pratylenchus 에 감염된 감자의 산성 푹신으로 얼룩진 뿌리. (A) 괴사 병변을 일으키는 뿌리 (B)의 피질 영역에서 선충의 여러 생활 단계를 볼 수 있습니다. 막대 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: Meloidogyne chitwoodi에 감염된 형질전환 뿌리의 산성 푹신 염색 뿌리 담즙. (A) 담즙 조직은 (B) 이미 난자 덩어리(D)를 알과 함께 생산한 성인 암컷 M. chitwoodi(C)의 일부를 감싸고 있는 것을 볼 수 있습니다. 막대 = 500μm(A), 100μm(B, C) 및 20μm(D). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: Meloidogyne chitwoodi에 의해 형성된 형질전환 뿌리담즙의 세포 구조. (A) 주기적인 산-Schiff(PAS)와 톨루이딘 블루 O로 염색된 형질전환 뿌리담즙의 초박형 절편으로, 성인 암컷의 섭식 부위와 (B) 뿌리담즙 조직으로 둘러싸인 선충에 의해 유도된 거대 세포를 보여줍니다. 막대 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
토양에 서식하는 PPN의 공격을 받은 식물의 감염 및 질병 발병 메커니즘에 대한 연구는 이러한 식물 기생충이 일반적으로 뿌리 시스템의 내부 조직을 감염시키고 새싹에 불특이한 증상을 유발하기 때문에 어렵습니다. 온실의 통제 된 환경 조건에도 불구하고 싹이 트는 감자 괴경과 감자 식물의 성장은 여전히 봄과 여름에 선호되어 실험 기간을 1 년에 한 계절로 단축합니다. 또한 상당수의 화분에는 감자 식물이 출현하지 않습니다. RLN의 수명 주기는 비교적 길며 질병 증상을 유발할 수 있는 인구 정점에 도달하려면 약 2-3개월이 필요합니다. PPN 연구를 위해 온실 생물 검정에 의존하는 주요 단점은 a) 냄비 테스트는 종종 PPN 질병에 대한 감수성과 관련하여 높은 변동성을 나타냅니다. b) 감염이 PPN의 순수한 집단으로 수행되더라도 PPN 확립 실패 및/또는 다른 PPN 종과의 교차 오염의 위험이 있습니다. c) 예방 조치가 시행되더라도 미생물 병원체에 의한 오염의 위험은 항상 존재합니다. d) 가용 자금과 온실의 크기에 따라 반복 횟수가 너무 적어 통계적 타당성을 확보하지 못할 수도 있습니다.
감자 형질전환 뿌리는 유지 관리를 위해 넓은 공간이 필요하지 않은 다목적 실험실 도구입니다. 더 적은 시간에 얻을 수 있습니다. 오염 또는 숙주 유전적 다양성이 없습니다. 그리고 더 중요한 것은 단일 환경 또는 영양 변수를 제어할 수 있도록 하여 뿌리 반응이 부과된 처리의 직접적인 결과임을 보장합니다12. PPN 감염 및 발병에 대한 연구의 경우, HR을 사용하는 것이 온실 생물 검정과 비교할 때 개선됩니다. 첫째, 감자 HR/PPN 공동 배양은 계절이나 기후 조건에 관계없이 선충 발달의 모든 단계를 제공하는 지속적인 시스템이기 때문에 각 실험 전에 이전에 많은 양의 PPN을 배양할 필요가 없습니다. 또한 HR은 클론 체조직이기 때문에 유전적 다양성이 매우 제한되어 있으므로 PPN 반응의 변화는 부과된 조건에 직접적으로 의존합니다. 감자 HR/PPN 공동 배양은 작은 공간을 차지합니다. 온도가 조절되는 성장 챔버에는 많은 페트리 접시가 있을 수 있으므로 실험은 반복 횟수에 의해 제한되는 경우가 거의 없습니다. 마지막으로, 이 기술은 다른 감자 PPN, 예를 들어 Globodera spp.로 확장할 수 있으며, 주로 선충 살균 단계에 의해 제한되며, 이는 오염 제거를 위해 선택한 PPN 종 및 수명 단계에 따라 까다로워질 수 있습니다19,24. 많은 장점에도 불구하고, 공동 배양을 사용한 연구는 생물적 또는 비생물적 스트레스 하에서 조직 수준, 예를 들어 초구조적 형태학 또는 생화학적 조절 메커니즘에 대한 연구로 제한되며, 6,25 예를 들어 괴경 수율 또는 손상 표현형을 결정해야 하는 연구에는 적합하지 않습니다. 또한 자연 조건에서 식물과 선충의 상호 작용은 많은 변수의 영향을 받기 때문에 공동 배양 연구에서 얻은 결과와 직접 비교하는 데 주의하는 것이 좋습니다.
조직화학은 조직학과 화학적 측면을 결합하여 조직에 존재하는 물질의 성질과 그 위치를 결정할 수 있게 한다21. 차등 염색 기법은 특정 화학적 및 형태학적 변화를 구별하는 데 널리 사용됩니다. 산성 푹신 염료는 끓는 단계에서 불투과성 큐티클을 관통하여 선충 조직을 염색합니다. 나중에 산성화된 글리세린으로 뿌리 시스템을 염색하면 선충이 뿌리 조직과 대조를 이루기 때문에 선충이 공격하는 위치를 식별할 수 있습니다. 그러나 산성화된 글리세롤에 1-2개월 이상 보관하면 염색의 강도가 줄어들고 선충과 식물 뿌리의 대비가 줄어듭니다.
PAS(Periodic acid-Schiff) 및 톨루이딘 블루 O는 신선 조직 또는 수지 포매 조직을 염색하는 데 일반적으로 사용되는 이중 염색 기술에 사용됩니다. 이것은 적용하기 쉬운 기술이지만 특이성과 민감도가 낮습니다. 두 가지 염료를 순차적으로 적용하면 화학적 특성이 다른 여러 세포 표적을 동시에 염색할 수 있습니다. Schiff 시약을 사용한 주기적인 산은 다당류를 분홍색, 주로 전분, 세포벽 다당류 및 일부 페놀이 염색하지만 셀룰로오스 또는 캘로오스는 염색하지 않습니다. Toluidine blue O 염료는 PAS 염색을 강조하며 물관부 및 공막 세포벽을 녹색 또는 청록색으로, collenchyma 및 실질 세포벽을 자주색-적색으로, 체관부 벽과 세포벽의 중간 층을 빨간색으로 염색합니다. 칼로스와 전분은 얼룩이 지지 않습니다21.
설명된 프로토콜은 식물 과학, 농업 및 생명 공학 분야에서 몇 가지 유망한 미래 응용 분야를 제공합니다. 이를 통해 기생충의 분자 및 세포 메커니즘에 대한 자세한 연구를 수행할 수 있으며, PPN이 숙주를 감염시키고 조작하는 방법에 대한 통찰력을 얻을 수 있습니다. PPN에 대한 내성에 대한 감자 품종 또는 형질전환 계통의 스크리닝을 돕고 저항성 또는 감수성에 관여하는 주요 유전자의 식별을 지원함으로써 저항성 작물의 육종을 지원합니다. 또한, 체외 공동 배양은 선충제 또는 생물학적 방제제(예: 미생물 또는 천연 제품)의 고처리량 스크리닝을 위한 강력한 도구 역할을 할 수 있으며, 이를 통해 연구자들은 PPN 질병 통제에 대한 효능을 평가할 수 있습니다.
공개
우리는 공개 할 것이 없습니다.
감사의 말
이 연구는 Fundação para a Ciência e a Tecnologia(FCT)의 일부 자금 지원을 받았으며, NemACT, DOI: 10.54499/2022.00359.CEECIND/CP1737/CT0002 (JMSF), CEECIND/00040/2018, DOI: 10.54499/CEECIND/00040/2018/CP1560/CT0001 (CSLV) 및 SFRH/BD/134201/2017 (PB) 보조금을 통해 지원되었습니다. 프로젝트 PratyOmics, DOI: 10.54499/PTDC/ASP-PLA/0197/2020; 및 구조적 자금 UIDB/00329/2020 | cE3c(DOI: 10.54499/UIDB/00329/2020) + LA/P/0121/2020 |CHANGE (DOI: 10.54499/LA/P/0121/2020) 및 GreenIT (DOI: 10.54499/UIDB/04551/2020 및 DOI: 10.54499/UIDP/04551/2020)..
자료
| Name | Company | Catalog Number | Comments |
| 2,4-Dinitrophenylhydrazine | Sigma-Aldrich | D199303 | |
| 2-Hydroxyethyl methacrylate | Sigma-Aldrich | 17348 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Acid Fuchsin | Sigma-Aldrich | F8129 | |
| Benzoyl peroxide | Sigma-Aldrich | B5907 | |
| borosilicate glass beaker | Sigma-Aldrich | Z231827 | |
| Carbenicillin disodium salt | Sigma-Aldrich | C3416 | |
| Cefotaxime sodium salt | Sigma-Aldrich | C7039 | |
| Dimethyl sulfoxide | Sigma-Aldrich | 472301 | |
| Ethanol | Supelco | 1.00983 | |
| Fertilizer | Compo Expert | ||
| Flower pot 5 L | VWR | 470049-676 | |
| Glutaraldehyde | Sigma-Aldrich | 354400 | |
| Glycerol | Sigma-Aldrich | G7893 | |
| Hydrochloric acid | Sigma-Aldrich | 258148 | |
| Kanamycin monosulfate | Sigma-Aldrich | BP861 | |
| LB Broth with agar | Sigma-Aldrich | L3147 | |
| MCE syringe filter | Millipore | SLGSR33SS | |
| PARAFILM M sealing film | BRAND | HS234526B-1EA | |
| Pararosaniline hydrochloride | Sigma-Aldrich | P3750 | |
| Periodic acid | Sigma-Aldrich | P0430 | |
| Phyto agar | Duchefa Biochemie | P1003 | |
| Scalpel blade no. 24 | Romed Holland | BLADE24 | |
| Schenk & Hildebrandt Basal salt medium | Duchefa Biochemie | S0225 | |
| Schenk & Hildebrandt vitamin mixture | Duchefa Biochemie | S0411 | |
| Schiff′s reagent | Sigma-Aldrich | 1.09033 | |
| Sodium metabisulfite | Sigma-Aldrich | 161519 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | Sigma-Aldrich | S5011 | |
| Soil / Substrate | Compo Sana | ||
| Stainless Steel Tweezers | Sigma-Aldrich | 22435-U | |
| Sucrose | Duchefa Biochemie | S0809 | |
| Toluidine Blue O | Sigma-Aldrich | 198161 |
참고문헌
- Çalışkan, M. E., Yousaf, M. F., Yavuz, C., Zia, M. A. B., Çalışkan, S. History, production, current trends, and future prospects. Potato Production Worldwide. , 1-18 (2022).
- Barker, K. R., Koenning, S. R. Developing sustainable systems for nematode management. Ann Rev Phytopathol. 36 (1), 165-205 (1998).
- Jones, J. T., et al. Top 10 plant-parasitic nematodes in molecular plant pathology. Mol Plant Pathol. 14 (9), 946-961 (2013).
- Davis, E. L., Hussey, R. S., Baum, T. J. Getting to the roots of parasitism by nematodes. Trend Parasitol. 20 (3), 134-141 (2004).
- Figueiredo, J., Vieira, P., Abrantes, I., Esteves, I. Commercial potato cultivars exhibit distinct susceptibility to the root lesion nematode Pratylenchus penetrans. Horticulturae. 8 (3), 244 (2022).
- Faria, J. M. S., et al. In vitro co-culture of Solanum tuberosum hairy roots with Meloidogyne chitwoodi: Structure, growth and production of volatiles. Plant Cell Tissue Organ Culture. 118 (3), 519-530 (2014).
- Wesemael, W. M. L., Moens, M., Viaene, N., Taning, L. M. Life cycle and damage of the root-knot nematode Meloidogyne minor on potato, Solanum tuberosum. Nematology. 16 (2), 185-192 (2014).
- Subramanian, P., et al. Differential metabolic profiles during the developmental stages of plant-parasitic nematode Meloidogyne incognita. Int J Mol Sci. 18 (7), 1351 (2017).
- Gutierrez-Valdes, N., et al. Hairy root cultures-A versatile tool with multiple applications. Front Plant Sci. 11, 33 (2020).
- Cho, H. J., Farrand, S. K., Noel, G. R., Widholm, J. M. High-efficiency induction of soybean hairy roots and propagation of the soybean cyst nematode. Planta. 210 (2), 195-204 (2000).
- Young, J. M., Kuykendall, L. D., Martínez-Romero, E., Kerr, A., Sawada, H., et al. A revision of Rhizobium Frank 1889, with an emended description of the genus, and the inclusion of all species of Agrobacterium Conn 1942 and Allorhizobium undicola de Lajudie et al. 1998 as new combinations: Rhizobium radiobacter, R. rhizogenes, R. rubi, R. undicola and R. vitis. Int J Syst Evol Microbiol. 51 (1), 89-103 (2001).
- Giri, A., Narasu, M. L. Transgenic hairy roots. Biotechnol Adv. 18 (1), 1-22 (2000).
- Faria, J. M. S., Rusinque, L., Cavaco, T., Nunes, J. C., Inácio, M. L. Essential oil volatiles as sustainable antagonists for the root-knot nematode Meloidogyne ethiopica. Sustainability. 15 (14), 11421 (2023).
- European Mediterranean Plant Protection Organization (EPPO). PM 7/148 (1) Guidelines for the management of nematode collections used for the production and maintenance of reference material. EPPO Bulletin. 51 (3), 507-548 (2021).
- Boisseau, M., Sarah, J. L. In vitro rearing of Pratylenchidae nematodes on carrot discs. Fruits. 63 (5), 307-310 (2008).
- Barbosa, P., et al. Nematicidal activity of phytochemicals against the root-lesion nematode Pratylenchus penetrans. Plants. 13 (5), 726 (2024).
- Santos, P. M., et al. Essential oils from hairy root cultures and from fruits and roots of Pimpinella anisum. Phytochemistry. 48 (3), 455-460 (1998).
- Bertani, G. Studies on lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli. J Bacteriol. 62 (3), 293-300 (1951).
- Kumar, A., Forrest, J. M. Reproduction of Globodera rostochiensis on transformed roots of Solanum tuberosum cv. Desiree. J Nematol. 22 (3), 395-398 (1990).
- Schenk, R. U., Hildebrandt, A. C. Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures. Canadian J Botany. 50 (1), 199-204 (1972).
- Figueiredo, A. C. S., Barroso, J. M. G., Pedro, L. M. G., Ascensão, L. . Histoquímica e citoquímica em plantas: princípios e protocolos. Universidade de Lisboa. , (2007).
- Bybd, D. W., Kirkpatrick, T., Barker, K. R. An improved technique for clearing and staining plant tissues for detection of nematodes. J Nematol. 15 (1), 142-143 (1983).
- Coyne, D., Adewuyi, O., Mbiru, E. . Protocol for in vitro culturing of lesion nematodes: Radopholus similis and Pratylenchus spp. on carrot disc. , (2014).
- Faria, J. M. S., Vicente, C. S. L., Rusinque, L., Camacho, M. J., Inácio, M. L. Plant-Nematode co-cultures in the screening of sustainable nematicides against soil-dweling parasitic nematodes of plants. Revista de Ciências Agrárias. 45 (4), 436-439 (2022).
- Faria, J. M. S., et al. In vitro co-cultures of Pinus pinaster with Bursaphelenchus xylophilus: a biotechnological approach to study pine wilt disease. Planta. 241 (6), 1325-1336 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유