Method Article
Investigando o potencial anti-obesidade de sementes de Papaver somniferum em modelo de rato obeso
Neste Artigo
Resumo
O estudo investiga a eficácia anti-obesidade das sementes de Papaver somniferum em ratos albinos induzidos pela obesidade. As sementes de papoula lavadas reduziram efetivamente o peso, diminuíram os níveis de glicose e melhoraram os perfis lipídicos sem toxicidade. Em contraste, as sementes não lavadas alteraram os parâmetros sanguíneos, sugerindo toxicidade potencial e a necessidade de mais pesquisas.
Resumo
A obesidade é um grande problema de saúde global, afetando quase 30% da população mundial. Apesar da prevalência da obesidade, atualmente não há dados disponíveis sobre os efeitos anti-obesidade e metabólicos do Papaver somniferum. O objetivo do estudo foi confirmar os efeitos anti-obesidade e metabólicos das sementes de Papaver somniferum (papoula) em ratos obesos induzidos por dieta hiperlipídica (HFD), avaliando seu impacto na redução de peso, perfil lipídico e toxicidade de órgãos. O experimento foi conduzido em duas fases: uma intervenção de semente de papoula de 4 semanas e um estudo de indução de obesidade de 6 semanas. Os ratos foram separados em grupos e receberam sementes de papoula lavadas ou não, HFD e um medicamento prescrito para perda de peso. Os resultados demonstraram que a lavagem das sementes de papoula diminuiu significativamente o ganho de peso e melhorou os perfis lipídicos, particularmente reduzindo os triglicerídeos, a lipoproteína de baixa densidade (LDL) e a lipoproteína de densidade muito baixa (VLDL). Além disso, os grupos tratados apresentaram uma diminuição nos níveis de glicose. No entanto, doses mais altas de sementes de papoula não lavadas causaram estresse hepático modesto, indicado por níveis elevados de alanina aminotransferase (ALT) e aspartato aminotransferase (AST) e a histopatologia renal mostrou inflamação leve, mas os parâmetros hematológicos foram constantes. Esses resultados sugerem que as sementes de papoula lavadas podem ter o potencial de reduzir a obesidade e melhorar a saúde metabólica sem danos adversos, indicando a necessidade de mais pesquisas para explorar seu potencial terapêutico.
Introdução
A obesidade é uma condição médica caracterizada por um percentual de gordura corporal excessivamente alto, apesar de um índice de massa corporal (IMC) inferior a 20 1,2. Quando o sistema controlado do corpo não consegue manter o equilíbrio adequado entre nutrientes e energia no sistema regulador do corpo, isso resulta no acúmulo de excesso de gordura corporal depositada no corpo3. O IMC é a principal ferramenta diagnóstica usada para determinar o peso normal, sobrepeso e obesidade. É comumente usado em pesquisas clínicas para identificar indivíduos com excesso de peso ou obesidade. Pesquisas indicam que a obesidade é uma doença em si, e não uma das principais causas de qualquer doença crônica4. É causada principalmente pelo consumo excessivo de alimentos calóricos e pelo sedentarismo5. Mecanismos genéticos de ganho de peso e exposição prolongada e excessiva a alimentos ricos em energia também podem contribuir para a obesidade. A prevalência global da obesidade aumentou rapidamente nos últimos anos, com cerca de 2,1 bilhões de pessoas em todo o mundo, ou 30% da população mundial, sofrendo de obesidade e excesso de peso. Prevê-se que esse índice atinja 40% até 2030 se as tendências atuais continuarem aumentando. Fatores ambientais como questões ecossistêmicas e sociais também influenciam o desenvolvimento da obesidade 6,7. A obesidade tem sido associada a várias formas de câncer, incluindo câncer uterino, de mama e de cólon, bem como comorbidades como dislipidemia, diabetes e distúrbios musculoesqueléticos (especialmente osteoartrite). Além disso, a obesidade também está associada a fatores de risco cardíaco, incluindo hiperglicemia e alto índice de massa corporal. Os fatores mais conhecidos que contribuem para a obesidade incluem problemas hormonais e alimentação compulsiva8. Embora os tratamentos tradicionais para a obesidade não tenham sido extensivamente estudados, eles geralmente apresentam riscos mínimos. Por outro lado, os medicamentos ocidentais geralmente vêm com efeitos colaterais caros que podem representar riscos significativos à saúde. Portanto, uma abordagem alternativa para criar medicamentos anti-obesidade seguros e eficientes pode ser investigar produtos naturais contra a obesidade. O avanço dos estudos fitoquímicos reforça o uso tradicional de ervas terapêuticas9, que podem ser utilizadas como terapia alternativa para a obesidade. Várias investigações científicas mostraram a eficácia dos medicamentos fitoterápicos no tratamento da obesidade durante séculos. Estudos anteriores demonstraram que as ervas medicinais, que contêm uma variedade de componentes farmacológicos, são consumidas como alimento10. Tem havido discussão sobre o interesse em empregar ervas naturais como medicamentos. O uso dessas ervas tem sido associado a muito poucas consequências negativas11; Essas plantas podem melhorar a digestão e acelerar a redução de peso12. As plantas medicinais empregam uma abordagem multifacetada para lidar com a obesidade, abrangendo cinco mecanismos primários: supressão do apetite, estimulação da termogênese e metabolismo lipídico, inibição da atividade da lipase pancreática, prevenção da patogênese e promoção da lipólise13. Além disso, as ervas naturais geralmente contêm compostos bioativos que atuam como inibidores das enzimas digestivas, dificultando assim a hidrólise e a absorção de carboidratos e gorduras dietéticas14.
Papaver somniferum, comumente conhecida como papoula do ópio ou Khashkhash no subcontinente, é uma planta tradicional mundialmente reconhecida com uma rica história de uso. Vários fitoquímicos, incluindo alcalóides como morfina, codeína, noscapina, papaverina e tebaína, foram isolados do ópio15. Embora a planta da papoula esteja associada principalmente às suas propriedades psicoativas e analgésicas, suas sementes são cada vez mais reconhecidas por seus potenciais benefícios à saúde. As sementes de papoula são uma fonte rica em ácidos graxos poliinsaturados, particularmente os ácidos graxos ômega-3, que têm sido associados ao controle de peso16. Notavelmente, as sementes de papoula contêm ácido α-linolênico, um ácido graxo ômega-3 cujo potencial anti-obesidade atraiu atenção considerável. Os isômeros 10 e 12 do ácido α-linolênico foram especificamente implicados na perda de peso. Numerosos estudos em humanos demonstraram que a suplementação com uma combinação desses isômeros pode diminuir o percentual de gordura corporal17. O objetivo primário desta investigação foi avaliar os efeitos de P. somniferum na redução de peso em um modelo animal. Além disso, o estudo teve como objetivo avaliar seu impacto no perfil lipídico, parâmetros hematológicos, função renal e hepática e histologia do tecido adiposo.
Protocolo
Todos os procedimentos foram conduzidos após a aprovação do comitê de ética da Universidade de Lahore, Paquistão, na reunião realizada em 21-04-2021 com o nº de registro: REG. # EPZOOL02193026
1. Alojamento dos animais
- Abrigar 35 ratos albinos Wistar machos (3 semanas de idade) individualmente em gaiolas de laboratório padrão. Forneça acesso ad libitum à ração e água para roedores durante todo o experimento.
- Manter o ambiente do biotério a uma temperatura constante de 22 ± 1 °C e uma humidade relativa de 50% ± 10%. Implemente um ciclo claro-escuro de 12 h:12 h usando iluminação artificial.
2. Agrupamento de animais
- No início do experimento, divida os animais em 2 grupos: obesos e não obesos. Forneça ao grupo obeso uma dieta rica em gordura, além da dieta normal. Alimente o grupo não obeso com uma dieta normal e use-a como grupo controle (controle negativo) no experimento.
3. Preparação de dieta rica em gordura (HFD)
- Formular uma dieta rica em gordura (HFD) aumentando a proporção de gorduras derivadas de fontes vegetais e animais. Combine o HFD com a ração padrão para preparar pellets.
- Defina o teor de gordura no HFD em 4 g por 30 g de ração. Coloque os pellets nas gaiolas dos animais por 24 h. Pese e registre qualquer pellet restante após 24 h e remova-o. Forneça pellets novos todos os dias. Mantenha este regime de alimentação HFD por 6 semanas para induzir a obesidade.
- Monitore o peso corporal dos animais e registre todas as semanas para verificar se está aumentando ou não. Para medir o peso corporal, coloque o frasco na máquina de musculação e cubra-o. Adicione o rato dentro do frasco para verificar o peso.
- Complemente os mesmos pellets com sementes de papoula pelas 4 semanas restantes para investigar seus potenciais efeitos de perda de peso.
4. Agrupamento de animais obesos
- Após 6 semanas, divida ainda mais os animais obesos em quatro grupos: O Grupo 1 é o controle obeso (controle positivo), que continuou se alimentando de HFD, mas não recebeu nenhum tratamento. O Grupo 2 (Padrão) é tratado com medicamentos disponíveis comercialmente (ver Tabela de Materiais) para controle da obesidade. O Grupo 3 (não lavado) e o Grupo 4 (lavado) são alimentados com sementes de papoula lavadas e não lavadas, respectivamente.
5. Preparação de sementes de papoula
- Obtenha sementes de papoula (P. somniferum) de um fornecedor comercial local, pois está facilmente disponível nas lojas. Seque as sementes ao sol por algumas horas. Divida as sementes em dois grupos: não lavadas e lavadas.
- Lave as sementes de papoula do grupo lavadas 7x com água destilada, seguida de secagem ao sol. Adicione 500 g de semente de papoula a um copo de 1 L, adicione água e misture com as mãos. Em seguida, descarte a água e repita o procedimento 7x para remover todas as impurezas, poeira e outras partículas das sementes. Após a lavagem, coloque as sementes ao sol para secar.
6. Cálculo da dosagem e preparação da ração
- Determine a dosagem com base na ingestão de ração do animal, padronizada em 30 g por indivíduo. Administrar sementes de papoila a uma concentração de 0,5 g por 30 g de ração.
- Incorpore as sementes de papoula na ração, misturando-as com água destilada para formar um pellet. Prepare os pellets frescos diariamente durante o período experimental de 4 semanas.
7. Dissecção de ratos e coleta de sangue
- Jejue os ratos por 24 horas. Sacrifique o animal usando clorofórmio e colete amostras de sangue e órgãos para outros procedimentos, conforme descrito abaixo.
- Anestesiar os ratos com clorofórmio. Administre clorofórmio por um técnico de laboratório treinado na taxa de clorofórmio inalado a 1% (0,05 mL / L) e certifique-se de que o rato esteja devidamente anestesiado, beliscando o pé do rato.
- Realize a dissecção usando instrumentos de caixa de dissecação padrão. Desinfete uma faca afiada, tesoura e fórceps antes de iniciar a dissecação. Durante a dissecção, remova amostras de rim, fígado e tecido adiposo. Conservar as amostras excisadas em tubos de centrifugação cheios de formalina.
- Colete amostras de sangue em frascos revestidos com EDTA. Extraia 12 mL de sangue de cada animal e, em seguida, divida 3 mL cada para testar a função renal, o teste de funcionamento do fígado e o perfil lipídico.
- Centrifugue as amostras de sangue coletadas a 1.957 x g por 5 min. Separe o soro sanguíneo do resto como um líquido claro ou amarelado. Separe o soro e aliquote-o em tubos de microcentrífuga para análises bioquímicas adicionais.
8. Análise da amostra
- Determinar o perfil lipídico total, incluindo colesterol total, HDL-colesterol, LDL-colesterol, triglicerídeos e VLDL, usando métodos enzimáticos colorimétricos padrão18. Basear a determinação do colesterol HDL em um procedimento de precipitação demorado18.
- Monitore os níveis de glicose em ratos regularmente durante todo o experimento usando um monitor de glicose no sangue GL-11019.
9. Avaliação da toxicidade
- Avaliar o impacto toxicológico do Papaver somniferum sobre os parâmetros ALT, AST, ALP, TP e bilirrubina por meio de testes de função hepática20. Medir os níveis de creatinina sérica seguindo a metodologia descrita em 21.
- Determine os parâmetros hematológicos, incluindo a contagem de glóbulos vermelhos (RBC) e glóbulos brancos (WBC), usando um hemocitômetro Neubauer. Avalie a concentração de hemoglobina usando o método da ciano-hemoglobina.
- Realize um exame histopatológico das amostras de tecido coletadas. Cortes de coloração com hematoxilina e eosina (H&E) para avaliação microscópica.
10. Análise estatística
- Use o software SPSS versão 16 para análise estatística. Aplique um teste t independente aos dados do primeiro mês para o estudo de indução da obesidade.
- Utilize ANOVA de medidas repetidas com teste post-hoc de LSD para a segunda fase. Empregar ANOVA unidirecional com LSD para analisar parâmetros sanguíneos para avaliação de toxicidade
- Defina significância estatística como p ≤ 0,05, com p ≤ 0,001 considerado altamente significativo.
Resultados
Ratos com peso corporal inicial de 40-45 g (estágio de desmame) foram selecionados para o experimento de 70 dias, que foi dividido em duas fases. A primeira fase, com duração de 6 semanas, envolveu a indução da obesidade no grupo experimental, suplementando sua ração padrão com uma dieta rica em gordura (HFD; Figura 1). Na fase subsequente de 4 semanas, os ratos obesos receberam Papaver somniferum. O peso corporal foi medido no início e no final do experimento. A ANOVA de medidas repetidas revelou uma diferença significativa no peso corporal entre os grupos controle e experimental (p < 0,001), bem como um efeito significativo do tempo (semanas) no peso corporal (p < 0,001). Conforme ilustrado na Figura 2, o peso corporal final dos ratos obesos foi significativamente maior (p < 0,001) em comparação com o peso corporal inicial do grupo controle.
O teste de sementes de papoula durou 4 semanas (28 dias) e envolveu a divisão dos ratos obesos em quatro grupos experimentais: Controle Positivo (somente HFD), Controle Negativo (apenas ração padrão), Grupo Padrão (HFD + medicamento comercial para perda de peso (ver Tabela de Materiais)), Grupo Lavado (HFD + sementes de papoula lavadas), Grupo Não Lavado (HFD + sementes de papoula não lavadas).
O grupo controle positivo recebeu apenas a dieta rica em gordura (HFD) com sua ração, enquanto o grupo controle negativo recebeu ração padrão. Os animais padrão do grupo foram tratados com um medicamento para perda de peso disponível comercialmente (0,5 g). Nos grupos lavados e não lavados, sementes de papoula (0,5 g) foram incorporadas à ração HFD.
Durante a semana 1, um aumento significativo de peso foi observado nos grupos lavado e não lavado. Em contraste, o padrão do grupo não apresentou alteração significativa de peso em comparação com o grupo controle positivo (p < 0,01). A semana 2 viu um aumento de peso no grupo não lavado em comparação com os outros (p < 0,01). Essa tendência continuou na semana 3, com o grupo não lavado exibindo um ganho de peso significativo. Na semana 4, tanto o grupo não lavado quanto o padrão demonstraram um aumento significativo de peso em comparação com os outros grupos (p < 0,05). Esses resultados são representados visualmente na Figura 3. A ANOVA de medidas repetidas confirmou um efeito altamente significativo do tempo (semanas) e do grupo sobre o peso corporal (p < 0,001 para ambos).
A Figura 3 mostra os níveis de glicose em diferentes grupos experimentais. A representa o valor mais alto, enquanto D é o valor mais baixo. Gráfico mostrando resultados altamente significativos com valor de p (p < 0,001) indica a inibição da alfa-amilase pelas sementes de papoula. A Figura 4A mostra a densidade da lipoproteína durante o experimento, que está diminuindo nos grupos experimentais em comparação com o controle; estatisticamente, a diferença não é significativa. As sementes de papoula ajudam a reduzir as lipoproteínas de baixa e muito baixa densidade (LDL e VLDL) no sangue, conforme mostrado na Figura 4B, C. Estatisticamente, a diferença é altamente significativa. Não há efeito significativo sobre os triglicerídeos mostrados na Figura 4D.
A contagem de glóbulos vermelhos, contagem de glóbulos brancos, linfócitos, VHS, eosinófilos, contagem de plaquetas e hemoglobina corpuscular média foram estudadas em estudos de hemograma. Não há efeito estatisticamente significativo das sementes de papoula no hemograma completo e hematologia, o que indica que as sementes de papoula não têm efeitos colaterais nos parâmetros sanguíneos. Alanina Transaminase (ALT), Aspartato Aminotransaminase (AST), bilirrubina e fosfato alcalino foram estudados no teste de funcionamento do fígado para verificar se havia qualquer efeito negativo no fígado por sementes de papoula. Não há efeito significativo observado na bilirrubina e fosfatos alcalinos. Um aumento significativo na ALT (p < 0,01) e AST (p < 0,01) foi observado nos grupos padrão e não lavado, conforme mostrado na Figura 5. Isso exibe o efeito não tóxico da semente de papoula, pois não aumenta no grupo lavado. A creatinina sérica é estudada para a função renal e não houve efeito significativo sobre a função renal (Figura 6). A análise histopatológica revelou uma arquitetura hepática normal no grupo controle negativo. Em contraste, todos os grupos tratados exibiram vários graus de inflamação hepática, variando de leve a moderada. Os hepatócitos apresentaram evidências de esteatose microvesicular e macrovesicular, predominantemente localizada ao redor dos tratos portais e veias centrais. (Figura 7). Exame histopatológico do tecido renal dos respectivos grupos (Figura 8). O exame histopatológico do tecido adiposo dos vários grupos demonstrou arquitetura normal do tecido adiposo no grupo controle. Em contraste, os grupos alimentados com HFD exibiram evidências de vazamento vascular e inflamação leve no tecido adiposo (Figura 9).

Figura 1: Ganho de peso. O gráfico mostra um aumento significativo no peso dos ratos em comparação com a primeira semana. A comparação foi realizada por meio da aplicação de um teste t independente. Os dados apresentados em termos de Média ± EP, Para o valor de p * mostram os resultados menos significativos; ** mostram resultados significativos e *** mostra resultados altamente significativos. Clique aqui para ver uma versão maior desta figura.

Figura 2: Diferença no ganho de peso. O gráfico representa comparações múltiplas de um experimento de 4 semanas aplicando ANOVA de Medidas Repetidas mostrando diferenças no ganho de peso em grupos experimentais, enquanto não há efeito de drogas trazidas comercialmente e sementes de Papaver somniferum (lavadas e não lavadas) para tornar os animais magros. Os dados apresentados em termos de (Média ± SE), Para o valor de P uma estrela (*) mostram os resultados menos significativos. Duas estrelas (**) mostram resultados significativos. Três estrelas (***) mostram resultados altamente significativos. Clique aqui para ver uma versão maior desta figura.

Figura 3: Níveis de glicose. O gráfico mostra os níveis de glicose em diferentes grupos experimentais. O valor de p é expresso em ANOVA de uma via e ANOVA comparativa mostrada por LSD. Os dados apresentados em termos de (Média ± SE), Para o valor de P uma estrela (*) mostram os resultados menos significativos. Duas estrelas (**) mostram resultados significativos. Três estrelas (***) mostram resultados altamente significativos. Clique aqui para ver uma versão maior desta figura.

Figura 4: Perfil lipídico. (A) O gráfico mostra um aumento na lipoproteína de alta densidade nos grupos experimentais. O valor de p é expresso em ONE WAY ANOVA e a comparação de pares é mostrada por LSD. Dados apresentados em termos de (Média ± EP). p=0,06. (B) O gráfico representa o nível de lipoproteína de baixa densidade nos grupos experimentais. O valor de p expresso em ONE WAY ANOVA e comparação de pares é mostrado por LSD. Dados apresentados em termos de (Média ± EP), p=0,05*. (C) O gráfico representa a elevação do nível de VLDL nos grupos experimentais. O valor de p expresso em ONE WAY ANOVA e comparação de pares é mostrado por LSD. Dados apresentados em termos de (Média ± EP), p=0,000***. (D) Gráfico representando o nível de triglicerídeos nos grupos experimentais. O valor de p expresso em ONE WAY ANOVA e comparação de pares é mostrado por LSD. Dados apresentados em termos de (Média ± EP), p= 0,22. Clique aqui para ver uma versão maior desta figura.

Figura 5: Teste de função hepática. (A) O gráfico representa a ALT em diferentes grupos experimentais. O valor de P é expresso em ANOVA unidirecional e a comparação em pares é mostrada pelo LSD. Dados apresentados em termos de (Média ± EP). (B) O gráfico mostra a AST em diferentes grupos experimentais. O valor de P é expresso em ANOVA unidirecional e a comparação em pares é mostrada pelo LSD. Dados apresentados em termos de (Média ± EP). (C) O gráfico mostra o nível de bilirrubina em diferentes grupos experimentais. O valor de P é expresso em ANOVA unidirecional e comparação de pares mostrada pelo LSD. Dados apresentados em termos de (Média ± EP). (D) O gráfico mostra o nível de fosfatase alcalina em diferentes grupos experimentais. Clique aqui para ver uma versão maior desta figura.
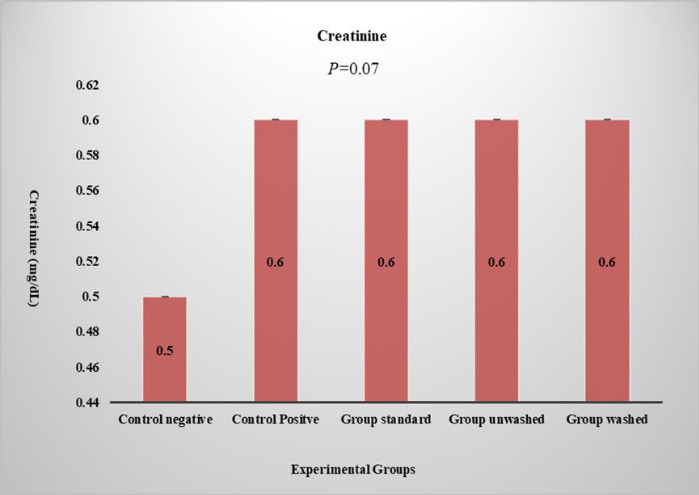
Figura 6: Nível de creatinina sérica. O gráfico mostra os níveis de creatinina em diferentes grupos experimentais. O valor de p é expresso em ANOVA de uma via e ANOVA comparativa mostrada por LSD. Dados apresentados em termos de (Média ± EP). Clique aqui para ver uma versão maior desta figura.

Figura 7: Exame histopatológico do tecido hepático. O exame histopatológico mostra fígado de aparência normal no controle negativo, mas todos os outros grupos tratados apresentam inflamação leve a moderada. Os hepatócitos apresentam micro e macro esteatose ao redor dos espaços portais e áreas perivenulares. Resolução de 40X de (A) Controle de grupo negativo (B) Controle de grupo positivo (C) Padrão de grupo (D) Grupo não lavado (E) Grupo lavado revela fígado negativo de controle de aparência normal enquanto gorduroso e danificado em outros grupos. Clique aqui para ver uma versão maior desta figura.

Figura 8: Exame histopatológico do tecido renal. Resolução de 40X de (A) Controle de grupo negativo (B) Controle de grupo positivo (C) Padrão de grupo (D) Grupo não lavado (E) Grupo lavado revela tecidos adiposos normais. Clique aqui para ver uma versão maior desta figura.

Figura 9: Exame histopatológico do tecido adiposo. O exame histopatológico do tecido adiposo dos respectivos grupos revela tecidos adiposos normais com vasos sanguíneos permeáveis e leve inflamação devido ao HFD. Resolução de 40X de (A) Controle de grupo negativo (B) Controle de grupo positivo (C) Padrão de grupo (D) Grupo não lavado (E) Grupo lavado revela tecidos adiposos normais. Clique aqui para ver uma versão maior desta figura.
Discussão
O protocolo tem as seguintes etapas críticas a serem atendidas. O primeiro passo crítico foi induzir a obesidade nos animais usando dieta rica em gordura. O segundo passo foi monitorar os animais que estão em dieta rica em gordura para que não desenvolvam diabetes ou qualquer outra doença devido ao HFD.
O protocolo também tem as seguintes limitações. Devido a restrições acadêmicas, o tempo experimental para estudar o efeito exato das sementes de papoula foi de apenas 10 semanas. Um estudo mais detalhado de sementes de papoula com diferentes dosagens deve ser estudado. Devido à indisponibilidade de equipamentos avançados, recursos e financiamento, só conseguimos realizar testes básicos, e essa é a maior limitação.
Os resultados deste estudo revelam que não há efeito global ou perda de peso devido a essas sementes. De alguma forma, as sementes de Papaver somniferum ajudam a reduzir os lipídios usando sementes de papoula lavadas, o que apóia a afirmação de que, com mais precisão de dose e duração para a condução do experimento, o peso pode ser reduzido usando sementes de papoula lavadas. As sementes de papoula não lavadas têm efeitos adversos no perfil lipídico e na hematologia devido à morfina e aos sedativos presentes nelas em grandes quantidades. Como nenhuma pesquisa foi feita sobre essas sementes em relação à perda de peso, sugere-se a realização de mais trabalhos experimentais para verificar seus efeitos no controle do controle de peso por meio do controle de lipídios. Um perfil de dislipidemia, caracterizado por colesterol total sérico elevado, colesterol de lipoproteína de baixa densidade (LDL-C) e triglicerídeos, juntamente com níveis reduzidos de colesterol de lipoproteína de alta densidade (HDL-C), é um fator de risco bem estabelecido para doença cardiovascular. Vale ressaltar que, mesmo na presença de níveis normais de LDL-C e triglicerídeos, o HDL-C baixo pode representar um risco significativo para a saúde coronariana, comparável ao LDL-C elevado. O HDL-C desempenha um papel crucial no transporte reverso do colesterol, mitigando assim a carga aterosclerótica. Além disso, o HDL-C apresenta propriedades anti-inflamatórias, antioxidantes, antitrombóticas, antiapoptóticas e vasodilatadoras22.
No presente estudo, a administração de sementes de Papaver somniferum na dosagem selecionada não provocou alterações significativas nos parâmetros do perfil lipídico, exceto triglicerídeos. Notavelmente, o grupo não lavado exibiu os níveis mais baixos de triglicerídeos em comparação com os outros grupos.
O uso de sementes de papoula lavadas e não lavadas pelo estudo revela que o método de preparação afeta significativamente os resultados. As sementes não lavadas, embora apresentem alguns efeitos positivos nos níveis de triglicerídeos, também levaram a efeitos adversos, principalmente nos parâmetros sanguíneos e no estresse hepático potencial. O processo de lavagem provavelmente remove ou reduz a concentração de certos compostos presentes nas sementes, o que poderia explicar a diferença nos resultados. O estresse hepático potencial indicado por níveis elevados de ALT e AST nos grupos que receberam sementes de papoula não lavadas é uma preocupação crítica. O processo de lavagem pode remover ou diluir essas substâncias tóxicas, pois o grupo que recebeu as sementes lavadas não apresentou o mesmo nível de elevação das enzimas hepáticas23. O estudo menciona que o ópio, que é derivado da planta da papoula, contém vários alcalóides, incluindo morfina, codeína e tebaína. Esses alcalóides são conhecidos por terem potenciais efeitos hepatotóxicos, especialmente quando consumidos em doses mais altas ou por períodos prolongados. Quantidades residuais desses alcalóides ou outros compostos tóxicos podem permanecer nas sementes não lavadas, contribuindo para o estresse hepático observado. As descobertas do estudo destacam a importância da preparação e processamento adequados de produtos naturais, mesmo aqueles tradicionalmente considerados seguros. A presença de compostos potencialmente tóxicos em sementes de papoula não lavadas ressalta a necessidade de mais pesquisas para identificar e caracterizar essas substâncias e estabelecer diretrizes de consumo seguro. O processo de lavagem parece ser um método eficaz para reduzir a toxicidade potencial das sementes de papoula, mas mais pesquisas são necessárias para determinar os procedimentos de lavagem ideais e avaliar a segurança a longo prazo do consumo de sementes de papoula lavadas.
As descobertas do estudo destacam uma clara distinção entre os efeitos das sementes de papoula lavadas e não lavadas. As sementes lavadas parecem oferecer benefícios potenciais no controle da obesidade e na melhoria da saúde metabólica sem causar efeitos adversos significativos24. Em contraste, as sementes não lavadas, embora apresentem alguns impactos positivos nos níveis de triglicerídeos, também apresentam toxicidade potencial, principalmente no que diz respeito à saúde do fígado. A inflamação hepática observada, mesmo que leve a moderada a curto prazo, levanta preocupações sobre as implicações a longo prazo do consumo de sementes de papoula não lavadas. A inflamação crônica pode levar a danos hepáticos progressivos, resultando potencialmente em fibrose, cirrose ou até insuficiência hepática25. Portanto, é crucial ter cautela ao consumir sementes de papoula não lavadas e priorizar o uso de sementes lavadas, que parecem ter um perfil mais seguro. Os resultados do estudo ressaltam a necessidade de mais pesquisas para elucidar completamente o perfil de segurança de P. somniferum, particularmente em relação aos efeitos a longo prazo de seu consumo em várias formas e dosagens.
O aumento observado no peso corporal no grupo de sementes não lavadas, juntamente com a potencial toxicidade hepática, sugere que o tratamento pode ter efeitos não intencionais e potencialmente prejudiciais. É essencial a realização de estudos mais rigorosos e de longo prazo para avaliar de forma abrangente a segurança e eficácia de P. somniferum como agente antiobesidade. Esses estudos devem investigar vários métodos de preparação, dosagens e durações de tratamento para estabelecer diretrizes de consumo seguras e eficazes. Além disso, mais pesquisas são necessárias para identificar e caracterizar os compostos específicos responsáveis pelos efeitos observados, tanto benéficos quanto adversos, para desenvolver preparações padronizadas e seguras de P. somniferum para potencial uso terapêutico.
Postula-se que uma redução na atividade da amilase pancreática pode levar à diminuição da absorção de glicose, impedindo a digestão, consequentemente resultando em uma menor ingestão calórica26. Várias investigações científicas têm demonstrado o potencial dos inibidores da α-amilase derivados de plantas para atenuar a hiperglicemia pós-prandial, contribuindo assim para o manejo do metabolismo aberrante da glicose e a prevenção de distúrbios metabólicos. Por exemplo, a suplementação oral com extrato de Bauhinia purpurea demonstrou diminuir as atividades da lipase pancreática e da amilase em ratos alimentados com dieta para hipercolesterolemia19. A amilase e a lipase, enzimas-chave envolvidas no metabolismo de carboidratos e lipídios, estão sendo cada vez mais exploradas como alvos terapêuticos para o tratamento de várias doenças metabólicas, incluindo a obesidade. Intervenções dietéticas e produtos naturais que atuam como inibidores da amilase e da lipase pancreática estão ganhando força como estratégias potenciais para impedir a absorção intestinal de gordura, o que pode facilitar o controle de peso27.
No presente estudo, foi observada uma diminuição nos níveis de glicose nos grupos tratados em comparação com os grupos controle. Além disso, os níveis de triglicerídeos foram reduzidos no grupo não lavado. Investigações adicionais empregando dosagens e concentrações variadas de Papaver somniferum podem lançar luz sobre seu papel potencial na modulação do metabolismo lipídico, particularmente no que diz respeito à inibição da lipase.
Os grupos tratados também exibiram níveis elevados de HDL em comparação com os grupos controle, potencialmente atribuíveis à diferenciação da dose. Da mesma forma, os níveis de LDL foram maiores nos grupos tratados em comparação com o grupo de controle negativo, com o grupo de controle positivo demonstrando os maiores valores de LDL. Por outro lado, os níveis de VLDL e triglicerídeos foram menores nos grupos tratados em comparação com o grupo controle. Essa variabilidade nos resultados pode ser influenciada pelo regime de dieta rica em gordura.
Vasos sanguíneos com vazamento e inflamação nos grupos tratados, grupos positivos padrão e controle são mostrados devido ao acúmulo de HFD. De acordo com um estudo, o extrato de noz-moscada diminui o número de adipócitos28. Um estudo utilizou Tamarindus indica L. reduzir o peso corporal total, reduzindo o número de adipócitos29. Nosso resultado revela que o grupo não tratado apresenta epidídimo significativamente maior em relação ao grupo tratado, o que mostra um tamanho reduzido dos adipócitos (p = 0,05; Figura 8). Os resultados desta pesquisa mostraram que as sementes de Papaver somniferum (lavadas) ajudam a reduzir os níveis de lipídios no corpo, enquanto as sementes de Papaver somniferum não lavadas reduzem os triglicerídeos. Ao mesmo tempo, as sementes de Papaver somniferum não afetam adversamente a histopatologia dos tecidos adiposos. As sementes não lavadas afetam negativamente os parâmetros sanguíneos, aumentando seus níveis no sangue. Portanto, o uso de sementes lavadas de Papaver somniferum pode controlar a obesidade, talvez com um aumento no tempo de duração para a condução do experimento e o cálculo da dose. Mais estudos devem ser realizados com o aumento da dose e da duração do tempo para diferentes resultados.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Os autores gostariam de estender seu sincero agradecimento ao Researchers Supporting Project Number (RSPD2025R986), King Saud University, Riyadh, Arábia Saudita.
Materiais
| Name | Company | Catalog Number | Comments |
| Blood glucose monitor GL-110 | Certeza | GL-110 | A portable device used to measure blood glucose levels. |
| Centrifuge | Eppendorf | 22620005 | A laboratory equipment that spins samples at high speeds to separate components based on density. |
| EDTA-coated vials | BD Vacutainer | 367861 | Tubes used for collecting blood samples, preventing clotting by binding calcium ions. |
| Eppendorf tubes | Eppendorf | 0030 120.094 | Small plastic tubes used for storing and handling small volumes of liquid. |
| Falcon tubes | Corning | 352059 | Conical tubes used for centrifugation and various laboratory applications. |
| Microscope | Olympus | CX23RF100 | An optical instrument used for viewing small objects, typically magnified through lenses. |
| Neubauer hemocytometer | Hawksley | H.H1 | A specialized slide used for counting cells under a microscope. |
| Orlistat120 mg | Windlas Biotech Ltd | ||
| Pipette tips | Eppendorf | 0030 073.435 | Disposable tips used with pipettes for transferring liquids accurately. |
| Serological pipettes | Falcon | 357551 | Graduated pipettes used for transferring liquids in larger volumes. |
| SPSS software version 16 | IBM | N/A (software, not a physical product) | A statistical software package used for data analysis. |
| Standard laboratory cage (Super Mouse 750) | Lab Products, Inc. | 10021 | A cage designed to house laboratory mice, providing a controlled environment. |
Referências
- Da Costa, G. F., et al. The beneficial effect of anthocyanidin-rich Vitis vinifera l. Grape skin extract on metabolic changes induced by a high-fat diet in mice involves anti-inflammatory and antioxidant actions. Phytother Res. 31 (10), 1621-1632 (2017).
- Andersen, M. M., Varga, S., Folker, A. P. On the definition of stigma. J Evaluat Clin Pract. 28 (5), 847-853 (2022).
- Archer, E., Hill, J. O. Body, and fat mass are not regulated, controlled, or defended: An introduction to the invisible hand and 'competition ' models of metabolism. Progr Cardiovasc Dis. 79, 56-64 (2023).
- Imhagen, A., Karlsson, J., Jansson, S., Anderzén-Carlsson, A. A lifelong struggle for a lighter tomorrow: A qualitative study on experiences of obesity in primary healthcare patients. J Clin Nurs. 32 (5-6), 834-846 (2023).
- Alonso-Castro, A. J., et al. Self-treatment with herbal products for weight loss among overweight and obese subjects from central Mexico. J Ethnopharmacol. 234, 21-26 (2019).
- Alsareii, S. A., et al. Iot framework for a decision-making system of obesity and overweight extrapolation among children, youths, and adults. Life. 12 (9), 1414(2022).
- Bautista, R. J. H., Mahmoud, A. M., Königsberg, M., Guerrero, N. E. L. D. Obesity: Pathophysiology, monosodium glutamate-induced model and anti-obesity medicinal plants. Biomed Pharmacother. 111, 503-516 (2019).
- Radin, R. M., et al. Do stress eating or compulsive eating influence metabolic health in a mindfulness-based weight loss intervention. Health Psychol. 39 (2), 147(2020).
- De Freitas Junior, L. M., De Almeida Jr, E. B. Medicinal plants for the treatment of obesity: Ethnopharmacological approach and chemical and biological studies. Am J Transl Res. 9 (5), 2050(2017).
- Awuchi, C. G. Medicinal plants: The medical, food, and nutritional biochemistry and uses. Int J Adv Acad Res. 5 (11), 220-241 (2019).
- Ozioma, E. O. J., Chinwe, O. aN. Herbal medicines in african traditional medicine. Herbal Med. 10, 191-214 (2019).
- Al-Snafi, A. E., Singh, S., Bhatt, P., Kumar, V. A review on prescription and non-prescription appetite suppressants and evidence-based method to treat overweight and obesity. GSC Biol Pharmaceut Sci. 19 (3), 148-155 (2022).
- Saad, B., Zaid, H., Shanak, S., Kadan, S. Anti-diabetes and Anti-obesity Medicinal Plants and Phytochemicals: Safety, Efficacy, and Action Mechanisms. , Springer. Cham. (2017).
- Ardeshirlarijani, E., et al. Potential anti-obesity effects of some medicinal herbs: In vitro α-amylase, α-glucosidase, and lipase inhibitory activity. Int Biol Biomed J. 5 (2), 1-8 (2019).
- Haber, I., Pergolizzi, J., Lequang, J. A. Poppy seed tea: A short review and case study. Pain Ther. 8, 151-155 (2019).
- Liu, R., et al. Omega-3 polyunsaturated fatty acids prevent obesity by improving tricarboxylic acid cycle homeostasis. J Nutri Biochem. 88, 108503(2021).
- Basak, S., Duttaroy, A. K. Conjugated linoleic acid and its beneficial effects in obesity, cardiovascular disease, and cancer. Nutrients. 12 (7), 1913(2020).
- Mcclatchey, K. Clinical laboratory medicine. , Lippincott Williams & Wilkins. Philadelphia, USA. (2002).
- Padmaja, T. K., Naidu, P. B., Kumar, G. E. N. H., Ganapathy, S., Balaji, M. Antiobesity activity of bauhinia purpurea extract: Effect on hormones and lipid profile in high-calorie diet-induced obese rats. Adv Biosci Biotechnol. 5 (11), 861(2014).
- Bülbül, T., Gür, E., Bozkurt, F., Eryavuz, A., Bülbül, A. Biochemical, hematological and histopathological evaluation of the food-safety of the leaf extract of Papaver somniferum in rats. J Trad Compl Med. 10 (6), 544-554 (2021).
- Precious, I. O., Ayoka, T. O., Nnadi, C. O. In-vivo sub-chronic toxicological evaluation of extract of vernonia glaberrima leaves in experimental rats. Notulae Sci Biol. 14 (2), 11181-11181 (2022).
- Bonizzi, A., Piuri, G., Corsi, F., Cazzola, R., Mazzucchelli, S. Hdl dysfunctionality: Clinical relevance of quality rather than quantity. Biomedicines. 9 (7), 729(2021).
- Cabot, S. Hepatitis and aids: A plan to recover with complementary and modern treatments. SCB International. , (2015).
- Mohamed, S. S., Fayed, A. H. M. Anti-obesity synergistic effect of pomegranate seed oil (pso) and arabic gum (ag) in albino rats. Int J Vet Sci. 9 (1), 84-89 (2020).
- Czaja, A. J. Hepatic inflammation and progressive liver fibrosis in chronic liver disease. World J Gastroenterol. 20 (10), 2515(2014).
- Barrett, A. H., Farhadi, N. F., Smith, T. J. Slowing starch digestion and inhibiting digestive enzyme activity using plant flavanols/tannins-a review of efficacy and mechanisms. Lwt. 87, 394-399 (2018).
- Nakajima, K., Muneyuki, T., Munakata, H., Kakei, M. Revisiting the cardiometabolic relevance of serum amylase. BMC Res Notes. 4, 1-5 (2011).
- Lesmana, R., et al. Nutmeg extract potentially alters the characteristics of white adipose tissue in rats. Vet Med Sci. 7 (2), 512-520 (2021).
- Azman, K. F., et al. Antiobesity effect of tamarindus indica l. Pulp aqueous extract in high-fat diet-induced obese rats. J Natural Med. 66, 333-342 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados