Method Article
研究 罂粟 种子在肥胖大鼠模型中的抗肥胖潜力
摘要
该研究调查了 罂粟种子在肥胖诱导的白化大鼠中的抗肥胖功效。洗涤后的罂粟种子可有效减轻重量、降低葡萄糖水平并改善血脂状况,而无毒性。相比之下,未清洗的种子改变了血液参数,表明存在潜在毒性,需要进一步研究。
摘要
肥胖是一个主要的全球健康问题,影响着全球近 30% 的人口。尽管肥胖症普遍存在,但目前没有关于罂粟抗肥胖和代谢作用的数据 。 该研究的目的是确认 罂 粟 (罂粟) 种子在高脂饮食 (HFD) 诱导的肥胖大鼠中的抗肥胖和代谢作用,评估它们对减肥、血脂谱和器官毒性的影响。该实验分两个阶段进行:为期 4 周的罂粟籽干预和 6 周的肥胖诱导试验。将大鼠分成几组,并给予洗过或未洗过的罂粟籽、HFD 和减肥处方药。研究结果表明,清洗罂粟种子可显著降低体重增加并增强血脂水平,特别是降低甘油三酯、低密度脂蛋白 (LDL) 和极低密度脂蛋白 (VLDL)。此外,治疗组显示葡萄糖水平降低。然而,较高剂量的未清洗的罂粟籽会导致适度的肝脏应激,表现为丙氨酸氨基转移酶 (ALT) 和天冬氨酸氨基转移酶 (AST) 水平升高,肾脏组织病理学显示轻度炎症,但血液学参数保持不变。这些结果表明,洗净的罂粟种子可能具有减少肥胖和增强代谢健康而不会造成不良危害的潜力,这表明需要进一步研究以探索其治疗潜力。
引言
肥胖是一种以体重指数 (BMI) 低于 20 1,2 但体脂百分比过高为特征的疾病。当身体的受控系统未能在身体的调节系统中维持营养和能量之间的适当平衡时,会导致体内多余的脂肪堆积3。BMI 是用于确定正常体重、超重和肥胖状态的主要诊断工具。它通常用于临床研究,以识别超重或肥胖的个体。研究表明,肥胖本身就是一种疾病,而不是任何慢性病的主要原因4。它主要是由于食用过量含卡路里的食物和久坐不动的生活方式引起的5。遗传性体重增加机制和长期和过度暴露于高能量食物也可能导致肥胖。近年来,全球肥胖患病率迅速增加,估计全球有 21 亿人(占世界人口的 30%)患有肥胖和超重。如果目前的趋势继续上升,预计到 2030 年,这一比例将达到 40%。生态系统和社会问题等环境因素也会影响肥胖的发展 6,7。肥胖与多种形式的癌症有关,包括子宫癌、乳腺癌和结肠癌,以及血脂异常、糖尿病和肌肉骨骼疾病(尤其是骨关节炎)等合并症。此外,肥胖还与心脏危险因素有关,包括高血糖和高体重指数。导致肥胖的最知名因素包括荷尔蒙问题和强迫性饮食8。虽然肥胖症的传统治疗方法尚未得到广泛研究,但它们通常带来的风险很小。另一方面,西药通常带有昂贵的副作用,可能会带来重大的健康风险。因此,创造安全、有效的抗肥胖药物的另一种方法是研究抗肥胖的天然产品。植物化学研究的进步支持了治疗草药9 的传统使用,它可以用作肥胖的替代疗法。几个世纪以来,几项科学调查表明草药在治疗肥胖症方面的有效性。早期的研究表明,含有多种药理成分的草药作为食物食用10。关于使用天然草药作为药物的兴趣,已经进行了讨论。使用这些草药几乎没有负面后果11;这些植物可以改善消化并加速减肥12。药用植物采用多方面的方法来解决肥胖问题,包括五个主要机制:抑制食欲、刺激产热和脂质代谢、抑制胰脂肪酶活性、预防发病机制和促进脂肪分解13。此外,天然草药通常含有生物活性化合物,这些化合物充当消化酶抑制剂,从而阻碍膳食碳水化合物和脂肪的水解和吸收14。
罂粟,在次大陆俗称罂粟或 Khashkhash,是全球公认的传统植物,具有丰富的使用历史。已从鸦片15 中分离出各种植物化学物质,包括吗啡、可待因、诺斯卡因、罂粟碱和茶碱等生物碱。虽然罂粟植物主要与其精神活性和镇痛特性有关,但它的种子因其潜在的健康益处而越来越受到认可。罂粟籽是多不饱和脂肪酸的丰富来源,尤其是 omega-3 脂肪酸,它与体重管理有关16。值得注意的是,罂粟种子含有 α-亚麻酸,这是一种 omega-3 脂肪酸,其抗肥胖潜力引起了相当大的关注。α-亚麻酸的 10 和 12 异构体与体重减轻特别相关。大量人体研究表明,补充这些异构体的组合可以降低体脂百分比17。本研究的主要目的是评估 P. somniferum 对动物模型减重的影响。此外,该研究旨在评估其对血脂谱、血液学参数、肾和肝功能以及脂肪组织组织学的影响。
研究方案
所有程序均在巴基斯坦拉合尔大学道德委员会在 2021 年 4 月 21 日举行的会议上批准后进行,注册号:REG. # EPZOOL02193026
1. 动物的饲养
- 将 35 只雄性 Wistar 白化大鼠(3 周龄)单独饲养在标准实验室笼中。在整个实验过程中随意提供啮齿动物食物和水。
- 将饲养箱环境保持在 22 ± 1 °C 的恒温和 50% ± 10% 的相对湿度。使用人工照明实施 12 小时:12 小时的明暗循环。
2. 动物分组
- 在实验开始时,将动物分为 2 组:肥胖和非肥胖。除了正常饮食外,还要为肥胖群体提供高脂肪饮食。给非肥胖组喂食正常饮食,并在实验中将其用作对照组(对照阴性)。
3. 高脂饮食 (HFD) 的准备
- 通过增加来自植物和动物来源的脂肪比例来制定高脂饮食 (HFD)。将 HFD 与标准食物混合以制备颗粒。
- 将 HFD 中的脂肪含量设置为每 30 克饲料 4 克。将颗粒放入动物笼中 24 小时。24 小时后称重并记录任何剩余的沉淀,然后将其取出。每天提供新鲜颗粒。维持这种 HFD 喂养方案 6 周以诱导肥胖。
- 监测动物的体重并每周记录一次,以检查体重是否增加。要测量体重,请将罐子放在举重机上并盖上盖子。将老鼠加入罐子里以检查重量。
- 在剩余的 4 周内用罂粟籽补充相同的颗粒,以研究它们潜在的减肥效果。
4. 肥胖动物的分组
- 6 周后,进一步将肥胖动物分为四组:第 1 组是肥胖对照(对照阳性),继续以 HFD 为食,但未提供任何治疗。第 2 组(标准)使用市售药物(见 材料表)进行肥胖控制治疗。第 3 组(未洗涤)和第 4 组(洗涤)分别用洗涤和未洗涤的罂粟种子喂养。
5. 罂粟种子的制备
- 从当地商业供应商处获取罂粟种子 (P. somniferum),因为它在商店里很容易买到。将种子晒干几个小时。将种子分为两组:未洗和洗。
- 用蒸馏水将洗净的罂粟籽洗净 7 次,然后晒干。将 500 克罂粟籽加入 1 升烧杯中,加入水并用手混合。然后倒掉水并重复该过程 7 次,以确保去除种子中的所有杂质、灰尘和其他颗粒。清洗后,将种子放在阳光下晾干。
6. 饲料用量的计算和制备
- 根据动物的采食量确定剂量,标准化为每人 30 克。以每 30 克饲料 0.5 克的浓度施用罂粟种子。
- 将罂粟籽与蒸馏水混合形成颗粒,将其掺入饲料中。在整个 4 周的实验期间每天准备新鲜的颗粒。
7. 大鼠解剖和采血
- 将大鼠禁食 24 小时。使用氯仿处死动物,并收集血液和器官样本用于进一步的程序,如下所述。
- 使用氯仿麻醉大鼠。由训练有素的实验室技术人员以 1% 吸入氯仿 (0.05 mL/L) 的速率施用氯仿,并通过捏住大鼠的脚确保大鼠之前得到适当的麻醉。
- 使用标准解剖盒器械进行解剖。在开始解剖之前,请用锋利的刀、剪刀和镊子消毒。在解剖过程中,取出肾脏、肝脏和脂肪组织样本。将切除的样品保存在充满福尔马林的离心管中。
- 在 EDTA 涂层样品瓶中采集血液样品。从每只动物中提取 12 mL 血液,然后进一步每只动物 3 mL 以测试肾功能、肝功能测试和血脂分析。
- 将收集的血液样品以 1,957 x g 离心 5 分钟。将血清与其他血清分离为透明或淡黄色液体。分离血清并将其分装到微量离心管中,用于进一步的生化分析。
8. 样品分析
- 使用标准酶比色法测定总血脂谱,包括总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、甘油三酯和 VLDL18。根据耗时的沉淀程序测定HDL 胆固醇 18.
- 在整个实验过程中,使用血糖监测仪 GL-110 定期监测大鼠血糖水平19。
9. 毒性评价
- 使用肝功能测试评估 罂 粟对参数 ALT、AST、ALP、TP 和胆红素的毒理学影响20。按照 21 中概述的方法测量血清肌酐水平。
- 使用 Neubauer 血细胞计数器确定血液学参数,包括红细胞 (RBC) 和白细胞 (WBC) 计数。使用氰化血红蛋白方法评估血红蛋白浓度。
- 对收集的组织样本进行组织病理学检查。用苏木精和伊红 (H&E) 对切片进行显微镜评估。
10. 统计分析
- 使用 SPSS 软件版本 16 进行统计分析。将独立的 t 检验应用于肥胖诱导试验的第一个月的数据。
- 在第二阶段利用重复测量方差分析和 LSD 事后检验。采用 LSD 的单因素方差分析分析血液参数以进行毒性评估
- 将统计显著性定义为 p ≤ 0.05,其中 p ≤ 0.001 被视为高度显著。
结果
选择初始体重为 40-45 g (断奶期) 的大鼠进行 70 天的实验,分为两个阶段。第一阶段持续 6 周,涉及通过用高脂肪饮食 (HFD;图 1)。在随后的 4 周阶段,肥胖大鼠给予罂粟 somniferum。在实验开始和结束时测量体重。重复测量方差分析显示,对照组和实验组之间的体重存在显著差异 (p < 0.001),以及时间 (周) 对体重的显著影响 (p < 0.001)。如图 2 所示,与对照组的初始体重相比,肥胖大鼠的最终体重显着升高 (p < 0.001)。
罂粟种子试验持续 4 周(28 天),涉及将肥胖大鼠分为四个实验组:对照阳性(仅 HFD)、对照阴性(仅标准食物)、组标准(HFD + 商业减肥药(见 材料表))、洗涤组(HFD + 洗涤的罂粟种子)、未洗涤组(HFD + 未洗涤的罂粟种子)。
对照组阳性组只接受高脂饮食 (HFD) 和饲料,而对照阴性组接受标准食物。组标准动物用市售减肥药 (0.5 g) 处理。在洗涤组和未洗涤组中,将罂粟种子 (0.5 g) 掺入 HFD 饲料中。
在第 1 周,在洗涤组和未洗涤组中都观察到体重显着增加。相比之下,与对照阳性组相比,组标准没有显示显着的体重变化 (p < 0.01)。与其他组相比,第 2 周未清洗组的体重增加 (p < 0.01)。这种趋势在第 3 周继续,未清洗组的体重显着增加。在第 4 周,与其他组相比,未洗涤组和标准组均表现出显着的体重增加 (p < 0.05)。这些结果如图 3 所示。重复测量方差分析证实时间(周)和组对体重的影响非常显着 (两者的 p < 0.001)。
图 3 显示了不同实验组的葡萄糖水平。A 表示最高值,而 D 是最低值。显示 p 值 (p < 0.001) 的非常显着结果的图表表明罂粟种子对 α-淀粉酶的抑制。 图 4A 显示了实验期间脂蛋白的密度,与对照组相比,实验组的脂蛋白密度较低;从统计学上讲,差异并不显著。罂粟籽有助于减少血液中的低密度和极低密度脂蛋白(LDL 和 VLDL),如图 4B、C 所示。从统计学上讲,差异非常显著。对甘油三酯没有显着影响, 如图 4D 所示。
在 CBC 研究中研究了红细胞计数、白细胞计数、淋巴细胞、ESR、嗜酸性粒细胞、血小板计数和平均红细胞血红蛋白。罂粟种子对血液 FBC 和血液学没有统计学意义的影响,这表明罂粟种子对血液参数没有任何副作用。在肝功能测试中研究了丙氨酸转氨酶 (ALT)、天冬氨酸氨基转氨酶 (AST)、胆红素和碱性磷酸盐,以检查罂粟籽对肝脏的任何负面影响。对胆红素和碱性磷酸盐没有观察到显著影响。在标准组和未洗涤组中观察到 ALT (p < 0.01) 和 AST (p < 0.01) 显着增加,如图 5 所示。这表现出罂粟籽的无毒作用,因为它在洗涤的组中不会增加。研究血清肌酐的肾功能,对肾功能没有显着影响 (图 6)。 组织病理学分析显示对照阴性组肝脏结构正常。相比之下,所有治疗组都表现出不同程度的肝脏炎症,从轻度到中度不等。肝细胞显示微泡和大泡脂肪变性的证据,主要位于门静脉和中央静脉周围。(图 7)。各组肾组织的组织病理学检查(图8)。各组脂肪组织的组织病理学检查显示对照组脂肪组织结构正常。相比之下,HFD 喂养组表现出脂肪组织内血管渗漏和轻度炎症的证据 (图9)。

图 1:体重增加。 该图显示,与第一周相比,大鼠的体重显著增加。通过应用独立的 t 检验进行比较。以均值 ± SE 表示的数据,对于 p 值 * 显示最不显著的结果;** 显示显著性结果,*** 显示高度显著性结果。 请单击此处查看此图的较大版本。

图 2:体重增加的差异。 图表通过应用重复测量方差分析表示为期 4 周的实验的多重比较,显示实验组体重增加的差异,而商业带来的药物和 罂 粟种子(洗涤和未洗涤)对使动物瘦没有影响。数据以 (均值 ± SE) 表示,对于 P 值,一颗星 (*) 显示最不显著的结果。两颗星 (**) 表示显著的结果。三星 (***) 表示非常显著的结果。 请单击此处查看此图的较大版本。

图 3:葡萄糖水平。 图表显示了不同实验组的血糖水平。 P 值以单向方差分析表示,比较方差分析由 LSD 表示。数据以 (均值 ± SE) 表示,对于 P 值,一颗星 (*) 显示最不显著的结果。两颗星 (**) 表示显著的结果。三星 (***) 显示非常显著的结果。 请单击此处查看此图的较大版本。

图 4:血脂概况。(A) 该图显示实验组中高密度脂蛋白的增加。P 值以 ONE WAY ANOVA 表示,成对比较用 LSD 表示。数据以 (Mean ± SE) 表示。p = 0.06。(B) 图表表示实验组中低密度脂蛋白的水平。以单向方差分析表示的 P 值和成对比较由 LSD 表示。数据以 (均值 ± SE) 表示,p=0.05*。(C) 图表表示实验组 VLDL 水平的升高。以单向方差分析表示的 P 值和成对比较由 LSD 表示。数据以 (均值 ± SE) 表示,p=0.000***。(D) 表示实验组甘油三酯水平的图表。以单向方差分析表示的 P 值和成对比较由 LSD 表示。数据以 (均值 ± SE) 表示,p= 0.22。 请单击此处查看此图的较大版本。

图 5:肝功能测试。(A) 图表表示不同实验组中的 ALT。 P 值以单向方差分析表示,成对比较由 LSD 表示。数据以 (Mean ± SE) 表示。(B) 图表显示了不同实验组的 AST。 P 值以单向方差分析表示,成对比较由 LSD 表示。数据以 (Mean ± SE) 表示。(C) 图表显示了不同实验组的胆红素水平。 P 值以单向方差分析表示,成对比较由 LSD 显示。数据以 (Mean ± SE) 表示。(D) 图表显示了不同实验组的碱性磷酸酶水平。 请单击此处查看此图的较大版本。
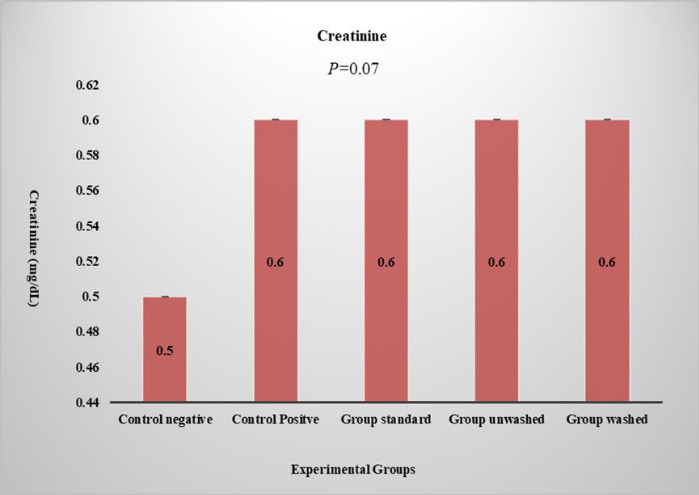
图 6:血清肌酐水平。 图表显示了不同实验组的肌酐水平。 P 值以单向方差分析表示,比较方差分析由 LSD 表示。数据以 (Mean ± SE) 表示。 请单击此处查看此图的较大版本。

图 7:肝组织的组织病理学检查。 组织病理学检查显示肝脏外观正常,对照组为阴性,但所有其他治疗组均显示轻度至中度炎症。肝细胞在门静脉间隙和静脉周围区域显示微脂肪变性和大脂肪变性。(A) 组对照阴性 (B) 组对照阳性 (C) 组标准品 (D) 未洗涤组 (E) 洗涤组显示外观正常的对照阴性肝脏,而其他组显示脂肪和受损。 请单击此处查看此图的较大版本。

图 8:肾组织的组织病理学检查。 (A) 组对照阴性 (B) 组对照阳性 (C) 组标准品 (D) 未洗涤组 (E) 洗涤组显示正常脂肪组织 (A) 组阴性 (B) 阳性组 (D) 未洗涤组 (E) 洗涤组显示正常脂肪组织。请单击此处查看此图的较大版本。

图 9:脂肪组织的组织病理学检查。各组脂肪组织的组织病理学检查显示正常的脂肪组织,伴有血管渗漏和 HFD 引起的轻微炎症。(A) 组对照阴性 (B) 组对照阳性 (C) 组标准品 (D) 未洗涤组 (E) 洗涤组显示正常脂肪组织 (A) 组阴性 (B) 阳性组 (D) 未洗涤组 (E) 洗涤组显示正常脂肪组织。请单击此处查看此图的较大版本。
讨论
该协议需要注意以下关键步骤。第一个关键步骤是通过使用高脂肪饮食诱导动物肥胖。第二步是监测高脂肪饮食的动物,确保它们不会因 HFD 而患上糖尿病或任何其他疾病。
该协议还具有以下限制。由于学术限制,研究罂粟种子确切效果的实验时间只有 10 周。应该对不同剂量的罂粟种子进行更详细的研究。由于无法获得先进的设备、资源和资金,我们只能进行基本测试,这是最大的限制。
这项研究的结果表明,这些种子没有整体影响或体重减轻。不知何故, 罂粟 种子通过使用洗涤的罂粟种子来帮助降低脂质,这支持了以下说法:随着实验传导的剂量和持续时间的更准确,使用洗涤的罂粟种子可以减轻体重。未清洗的罂粟种子由于大量存在吗啡和镇静剂,对血脂和血液学有不利影响。由于尚未对这些种子进行有关减肥的研究,因此建议进行更多的实验工作,以检查它们通过控制脂质对体重控制管理的影响。血脂异常特征,以血清总胆固醇、低密度脂蛋白胆固醇 (LDL-C) 和甘油三酯升高伴高密度脂蛋白胆固醇 (HDL-C) 水平降低为特征,是心血管疾病公认的危险因素。值得注意的是,即使在 LDL-C 和甘油三酯水平正常的情况下,低 HDL-C 也会对冠状动脉健康构成重大风险,与 LDL-C 升高相当。HDL-C 在逆转胆固醇转运中起着至关重要的作用,从而减轻动脉粥样硬化负担。此外,HDL-C 具有抗炎、抗氧化、抗血栓形成、抗凋亡和血管扩张特性22。
在本研究中,除甘油三酯外,以选定剂量施用 罂粟 种子并没有引起脂质谱参数的任何显着变化。值得注意的是,与其他组相比,未洗涤组的甘油三酯水平最低。
该研究使用洗过和未洗过的罂粟种子表明,制备方法对结果有显着影响。未清洗的种子虽然对甘油三酯水平有一些积极影响,但也导致了不利影响,特别是对血液参数和潜在的肝脏应激。洗涤过程可能会去除或降低种子中存在的某些化合物的浓度,这可以解释结果的差异。在接受未清洗的罂粟种子的组中,ALT 和 AST 水平升高表明潜在的肝脏应激是一个关键问题。洗涤过程可能会去除或稀释这些有毒物质,因为接受洗涤种子的组没有表现出相同水平的肝酶升高23。该研究提到,源自罂粟植物的鸦片含有多种生物碱,包括吗啡、可待因和茶碱。已知这些生物碱具有潜在的肝毒性作用,尤其是在以较高剂量或长期食用时。这些生物碱或其他有毒化合物的残留量可能会残留在未清洗的种子上,从而导致观察到的肝脏应激。该研究的结果强调了正确制备和加工天然产品的重要性,即使是那些传统上认为安全的产品。未清洗的罂粟种子中存在潜在有毒化合物,这凸显了进一步研究以识别和表征这些物质并建立安全食用指南的必要性。清洗过程似乎是降低罂粟籽潜在毒性的有效方法,但需要更多的研究来确定最佳清洗程序并评估食用清洗过的罂粟籽的长期安全性。
该研究的结果突出了清洗和未清洗的罂粟种子的影响之间的明显区别。洗过的种子似乎在控制肥胖和改善代谢健康方面具有潜在的好处,而不会造成明显的不利影响24。相比之下,未清洗的种子虽然对甘油三酯水平有一些积极影响,但也表现出潜在的毒性,特别是关于肝脏健康。观察到的肝脏炎症,即使是短期内为轻度至中度,也引起了人们对食用未清洗的罂粟籽的长期影响的担忧。慢性炎症会导致进行性肝损伤,可能导致纤维化、肝硬化甚至肝功能衰竭25。因此,在食用未清洗的罂粟种子时要谨慎行事,并优先使用清洗过的种子,这似乎具有更安全的特性。该研究的结果强调了进一步研究的必要性,以充分阐明 P. somniferum 的安全性,特别是关于以各种形式和剂量食用其的长期影响。
在未清洗的种子组中观察到的体重增加,加上潜在的肝毒性,表明该治疗可能产生意想不到和潜在的有害影响。必须进行更严格和长期的研究,以全面评价 P. somniferum 作为抗肥胖剂的安全性和有效性。这些研究应调查各种制备方法、剂量和治疗持续时间,以建立安全有效的食用指南。此外,需要进一步的研究来识别和表征负责观察到的效果(有益和有害)的特定化合物,以开发标准化和安全的 P. somniferum 制剂用于潜在的治疗用途。
据推测,胰腺淀粉酶活性的降低可能通过阻碍消化导致葡萄糖吸收减少,从而导致热量摄入降低26。几项科学研究表明,植物来源的 α-淀粉酶抑制剂具有减轻餐后高血糖的潜力,从而有助于管理异常的葡萄糖代谢和预防代谢紊乱。例如,口服紫 荆 提取物补充剂已被证明可以降低高胆固醇血症饮食喂养大鼠的胰脂肪酶和淀粉酶活性19。淀粉酶和脂肪酶是参与碳水化合物和脂质代谢的关键酶,越来越多地被探索为治疗包括肥胖在内的各种代谢疾病的治疗靶点。作为淀粉酶和胰脂肪酶抑制剂的饮食干预和天然产品作为阻碍肠道脂肪吸收的潜在策略越来越受欢迎,这可能促进体重管理27。
在目前的研究中,与对照组相比,治疗组的葡萄糖水平有所降低。此外,未洗涤组的甘油三酯水平降低。采用不同剂量和浓度的 罂粟 睡花的进一步研究可能阐明其在调节脂质代谢中的潜在作用,特别是关于脂肪酶抑制。
与对照组相比,治疗组的 HDL 水平也升高,这可能是由于剂量差异化。同样,与阴性对照组相比,治疗组的 LDL 水平更高,阳性对照组表现出最高的 LDL 值。相反,与对照组相比,治疗组的 VLDL 和甘油三酯水平较低。结果的这种可变性可能受到高脂肪饮食方案的影响。
由于 HFD 的积累,显示治疗组、标准组和对照阳性组的血管渗漏和炎症。根据一项研究,肉豆蔻提取物可减少脂肪细胞数量28。一项研究使用了 Tamarindus indica L.牙髓通过减少脂肪细胞的数量来减轻总体重量29。我们的结果表明,与治疗组相比,未治疗组的附睾明显更高,这表明脂肪细胞的大小减小 (p = 0.05; 图 8)。这项研究的结果表明, 罂 粟种子(洗涤)有助于降低体内的脂质水平,而未洗涤的 罂 粟种子可降低甘油三酯。同时, 罂 粟种子不会对脂肪组织的组织病理学产生不利影响。未清洗的种子会提高血液中的水平,从而对血液参数产生负面影响。因此,使用洗涤的 罂粟 种子可以控制肥胖,也许会增加进行实验和计算剂量的持续时间。对于不同的结果,应该对剂量和持续时间的增加进行更多的研究。
披露声明
作者没有什么可披露的。
致谢
作者衷心感谢沙特阿拉伯利雅得沙特国王大学支持项目编号 (RSPD2025R986) 的研究人员。
材料
| Name | Company | Catalog Number | Comments |
| Blood glucose monitor GL-110 | Certeza | GL-110 | A portable device used to measure blood glucose levels. |
| Centrifuge | Eppendorf | 22620005 | A laboratory equipment that spins samples at high speeds to separate components based on density. |
| EDTA-coated vials | BD Vacutainer | 367861 | Tubes used for collecting blood samples, preventing clotting by binding calcium ions. |
| Eppendorf tubes | Eppendorf | 0030 120.094 | Small plastic tubes used for storing and handling small volumes of liquid. |
| Falcon tubes | Corning | 352059 | Conical tubes used for centrifugation and various laboratory applications. |
| Microscope | Olympus | CX23RF100 | An optical instrument used for viewing small objects, typically magnified through lenses. |
| Neubauer hemocytometer | Hawksley | H.H1 | A specialized slide used for counting cells under a microscope. |
| Orlistat120 mg | Windlas Biotech Ltd | ||
| Pipette tips | Eppendorf | 0030 073.435 | Disposable tips used with pipettes for transferring liquids accurately. |
| Serological pipettes | Falcon | 357551 | Graduated pipettes used for transferring liquids in larger volumes. |
| SPSS software version 16 | IBM | N/A (software, not a physical product) | A statistical software package used for data analysis. |
| Standard laboratory cage (Super Mouse 750) | Lab Products, Inc. | 10021 | A cage designed to house laboratory mice, providing a controlled environment. |
参考文献
- Da Costa, G. F., et al. The beneficial effect of anthocyanidin-rich Vitis vinifera l. Grape skin extract on metabolic changes induced by a high-fat diet in mice involves anti-inflammatory and antioxidant actions. Phytother Res. 31 (10), 1621-1632 (2017).
- Andersen, M. M., Varga, S., Folker, A. P. On the definition of stigma. J Evaluat Clin Pract. 28 (5), 847-853 (2022).
- Archer, E., Hill, J. O. Body, and fat mass are not regulated, controlled, or defended: An introduction to the invisible hand and 'competition ' models of metabolism. Progr Cardiovasc Dis. 79, 56-64 (2023).
- Imhagen, A., Karlsson, J., Jansson, S., Anderzén-Carlsson, A. A lifelong struggle for a lighter tomorrow: A qualitative study on experiences of obesity in primary healthcare patients. J Clin Nurs. 32 (5-6), 834-846 (2023).
- Alonso-Castro, A. J., et al. Self-treatment with herbal products for weight loss among overweight and obese subjects from central Mexico. J Ethnopharmacol. 234, 21-26 (2019).
- Alsareii, S. A., et al. Iot framework for a decision-making system of obesity and overweight extrapolation among children, youths, and adults. Life. 12 (9), 1414(2022).
- Bautista, R. J. H., Mahmoud, A. M., Königsberg, M., Guerrero, N. E. L. D. Obesity: Pathophysiology, monosodium glutamate-induced model and anti-obesity medicinal plants. Biomed Pharmacother. 111, 503-516 (2019).
- Radin, R. M., et al. Do stress eating or compulsive eating influence metabolic health in a mindfulness-based weight loss intervention. Health Psychol. 39 (2), 147(2020).
- De Freitas Junior, L. M., De Almeida Jr, E. B. Medicinal plants for the treatment of obesity: Ethnopharmacological approach and chemical and biological studies. Am J Transl Res. 9 (5), 2050(2017).
- Awuchi, C. G. Medicinal plants: The medical, food, and nutritional biochemistry and uses. Int J Adv Acad Res. 5 (11), 220-241 (2019).
- Ozioma, E. O. J., Chinwe, O. aN. Herbal medicines in african traditional medicine. Herbal Med. 10, 191-214 (2019).
- Al-Snafi, A. E., Singh, S., Bhatt, P., Kumar, V. A review on prescription and non-prescription appetite suppressants and evidence-based method to treat overweight and obesity. GSC Biol Pharmaceut Sci. 19 (3), 148-155 (2022).
- Saad, B., Zaid, H., Shanak, S., Kadan, S. Anti-diabetes and Anti-obesity Medicinal Plants and Phytochemicals: Safety, Efficacy, and Action Mechanisms. , Springer. Cham. (2017).
- Ardeshirlarijani, E., et al. Potential anti-obesity effects of some medicinal herbs: In vitro α-amylase, α-glucosidase, and lipase inhibitory activity. Int Biol Biomed J. 5 (2), 1-8 (2019).
- Haber, I., Pergolizzi, J., Lequang, J. A. Poppy seed tea: A short review and case study. Pain Ther. 8, 151-155 (2019).
- Liu, R., et al. Omega-3 polyunsaturated fatty acids prevent obesity by improving tricarboxylic acid cycle homeostasis. J Nutri Biochem. 88, 108503(2021).
- Basak, S., Duttaroy, A. K. Conjugated linoleic acid and its beneficial effects in obesity, cardiovascular disease, and cancer. Nutrients. 12 (7), 1913(2020).
- Mcclatchey, K. Clinical laboratory medicine. , Lippincott Williams & Wilkins. Philadelphia, USA. (2002).
- Padmaja, T. K., Naidu, P. B., Kumar, G. E. N. H., Ganapathy, S., Balaji, M. Antiobesity activity of bauhinia purpurea extract: Effect on hormones and lipid profile in high-calorie diet-induced obese rats. Adv Biosci Biotechnol. 5 (11), 861(2014).
- Bülbül, T., Gür, E., Bozkurt, F., Eryavuz, A., Bülbül, A. Biochemical, hematological and histopathological evaluation of the food-safety of the leaf extract of Papaver somniferum in rats. J Trad Compl Med. 10 (6), 544-554 (2021).
- Precious, I. O., Ayoka, T. O., Nnadi, C. O. In-vivo sub-chronic toxicological evaluation of extract of vernonia glaberrima leaves in experimental rats. Notulae Sci Biol. 14 (2), 11181-11181 (2022).
- Bonizzi, A., Piuri, G., Corsi, F., Cazzola, R., Mazzucchelli, S. Hdl dysfunctionality: Clinical relevance of quality rather than quantity. Biomedicines. 9 (7), 729(2021).
- Cabot, S. Hepatitis and aids: A plan to recover with complementary and modern treatments. SCB International. , (2015).
- Mohamed, S. S., Fayed, A. H. M. Anti-obesity synergistic effect of pomegranate seed oil (pso) and arabic gum (ag) in albino rats. Int J Vet Sci. 9 (1), 84-89 (2020).
- Czaja, A. J. Hepatic inflammation and progressive liver fibrosis in chronic liver disease. World J Gastroenterol. 20 (10), 2515(2014).
- Barrett, A. H., Farhadi, N. F., Smith, T. J. Slowing starch digestion and inhibiting digestive enzyme activity using plant flavanols/tannins-a review of efficacy and mechanisms. Lwt. 87, 394-399 (2018).
- Nakajima, K., Muneyuki, T., Munakata, H., Kakei, M. Revisiting the cardiometabolic relevance of serum amylase. BMC Res Notes. 4, 1-5 (2011).
- Lesmana, R., et al. Nutmeg extract potentially alters the characteristics of white adipose tissue in rats. Vet Med Sci. 7 (2), 512-520 (2021).
- Azman, K. F., et al. Antiobesity effect of tamarindus indica l. Pulp aqueous extract in high-fat diet-induced obese rats. J Natural Med. 66, 333-342 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。