Method Article
Isolamento de vírus associados a mosquitos coletados em campo
Neste Artigo
Resumo
Numerosas novas sequências semelhantes a vírus foram encontradas em mosquitos devido ao uso extensivo de tecnologias de sequenciamento. Fornecemos um procedimento eficaz para isolar e amplificar vírus usando linhagens celulares de vertebrados e mosquitos, que pode servir de base para estudos futuros sobre vírus associados a mosquitos, incluindo vírus transmitidos por mosquitos e específicos por mosquitos.
Resumo
Com a ampla aplicação de tecnologias de sequenciamento, muitas novas sequências semelhantes a vírus foram descobertas em artrópodes, incluindo mosquitos. As duas principais categorias desses novos vírus associados a mosquitos são "vírus transmitidos por mosquitos (MBVs)" e "vírus específicos de mosquitos (MSVs)". Esses novos vírus podem ser patogênicos para vertebrados e mosquitos, ou podem ser apenas simbióticos com mosquitos. Vírus de entidade são essenciais para confirmar os caracteres biológicos desses vírus. Assim, um protocolo detalhado foi descrito aqui para isolamento e amplificação de vírus a partir de mosquitos coletados em campo. Primeiramente, as amostras de mosquitos foram preparadas como sobrenadantes de homogeneizados de mosquitos. Após centrifugação duas vezes, os sobrenadantes foram inoculados na linhagem celular de mosquito C6/36 ou na linhagem celular de vertebrado BHK-21 para amplificação do vírus. Após 7 dias, os sobrenadantes foram coletados como sobrenadantes P1 e armazenados a -80 °C. Em seguida, os sobrenadantes P1 foram passados mais duas vezes em células C6/36 ou BHK-21 enquanto o status celular estava sendo verificado diariamente. Quando o efeito citopatogênico (CPE) sobre as células foi descoberto, esses sobrenadantes foram coletados e usados para identificar vírus. Este protocolo serve como base para pesquisas futuras sobre vírus associados a mosquitos, incluindo MBVs e MSVs.
Introdução
Os mosquitos são um grupo de importantes artrópodes vetores patogênicos. Existem aproximadamente 3.500 espécies de mosquitos na família Culicidae 1,2. O desenvolvimento de tecnologias de sequenciamento de alto rendimento levou à descoberta de muitas sequências novas semelhantes a vírus em mosquitos de diferentes partes do mundo3. Geralmente, esses vírus associados a mosquitos podem ser classificados em dois grupos principais: MBVs e MSVs.
Os MBVs são um grupo de diversos vírus que são agentes causadores de muitas doenças humanas ou animais, como o vírus da febre amarela (YFV), o vírus da dengue (DENV), o vírus da encefalite japonesa (JEV), o vírus do Nilo Ocidental (WNV) e o vírus da febre do Vale do Rift (RVFV)4. Eles têm ameaçado seriamente a saúde pública, causando morbidade e mortalidade graves em humanos e animais em todo o mundo. Os MBVs sustentam naturalmente um ciclo de vida entre diversos hospedeiros através da transmissão de um mosquito infectado para um hospedeiro ingênuo, bem como de um hospedeiro infectado por vírus e para um mosquito alimentador5. Portanto, esses vírus podem infectar tanto linhagens celulares de mosquitos quanto linhagens de células de vertebrados em laboratório1.
Os MSVs, que incluem os vírus Yichang (YCN), Culex flavivirus (CxFV) e Chaoyang virus (CHAOV), constituem um subgrupo de vírus insetos-específicos 1,6,7. Nos últimos anos, houve um aumento na descoberta de novos MSVs, e alguns desses MSVs foram encontrados para ter um impacto na transmissão de MBVs. Por exemplo, o CxFV, que pode ser uma infecção persistente em Culex pipiens, poderia suprimir a replicação do WNV em um estágio inicial8. Outro flavivírus específico de um inseto, o vírus do agente de fusão celular (CFAV), inibiu a propagação do DENV e do vírus Zika (ZIKV) em mosquitos Aedes aegypti 9. Assim, este protocolo é uma abordagem útil para o isolamento de vírus associados a mosquitos e pode ajudar em futuras pesquisas sobre a distribuição de patógenos relacionados a mosquitos e o controle de doenças transmitidas por mosquitos.
Protocolo
1. Amostragem e triagem de mosquitos
- Prender os mosquitos adultos através das armadilhas de luz MXA-02 ou armadilhas de mosquitos de dióxido de carbono no campo.
- Matar os mosquitos coletados mergulhando em nitrogênio líquido10,11. Transportá-los para o laboratório pelo sistema logístico da cadeia de frio12.
NOTA: O gelo seco foi usado principalmente no sistema logístico da cadeia fria. - (Opcional) Se os locais de coleta estiverem próximos ao laboratório, enviar diretamente os mosquitos vivos nas armadilhas de rede para o laboratório e eutanasiá-los congelando a ≤-20 °C por 30 min4.
- Faça uma identificação morfológica dos mosquitos coletados através do livro de ferramentas13 para classificação e identificação dos mosquitos.
OBS: Se necessário, o DNA barcoding pode ser utilizado para classificar e identificar mosquitos14,15. - Com base em datas e locais de amostragem, atribua-os em diferentes pools e, em seguida, armazene-os em tubos de 2-5 mL.
- Desenhe uma tabela para registrar cada tubo com a espécie do mosquito, número, código de amostragem, data e locais.
- Imprima as etiquetas com códigos de amostragem e fixe-as aos tubos.
- Mantenha os tubos com as amostras do mosquito a -80 °C até uma análise mais aprofundada.
2. Moagem de mosquitos
- Colocar 20-50 mosquitos em cada tubo estéril de 2 mL com esferas cerâmicas de 3 mm com 1,5 mL de meio Roswell Park Memorial Institute (RPMI) contendo solução de penicilina-estreptomicina-anfotericina B a 2%.
NOTA: Mantenha os tubos no gelo ou na bandeja de anice. - Homogeneizar os mosquitos com homogeneizador de tecido a baixa temperatura, triturando por 30 s a 70 Hz a 4 °C por três ciclos16.
- Centrifugar as misturas a 15.000 × g por 30 min a 4 °C e transferir os sobrenadantes para novos tubos.
- Centrifugar novamente os sobrenadantes a 15.000 × g por 10 min a 4 °C para remover os restos do mosquito12,17.
NOTA: Se necessário, os sobrenadantes podem ser filtrados usando filtros de 0,22 μm. - Aliquotar os sobrenadantes (P0) em tubos de armazenamento com tampa de rosca de 2 mL (200 μL por tubo) e armazená-los a -80 °C.
3. Preparação de células e meio de manutenção de cultura celular
OBS: Linhagem celular de mosquito C6/36 (Aedes albopictus deficiente em RNAi) e linhagem celular de vertebrado BHK-21 (rim de hamster bebê) foram utilizadas para amplificação e isolamento do vírus.
- Inocular 1 ×10 6 células C6/36 em um frasco de 75cm2 com 10 mL de meio RPMI suplementado com 10% de soro fetal bovino (SFB) e 1% de penicilina/estreptomicina (P/S) a 28 °C em estufa umidificada com CO2 a 5%.
- Inocular 1 ×10 6 células BHK-21 em um frasco de 75 cm 2 com 10 mL de meio Eagle modificado de Dulbecco (DMEM) suplementado com FBS a 10% e P/S a 37 °C em estufa umidificada com CO2 a 5%.
OBS: As células foram passadas duas ou três vezes por semana17,18. - Semeando as células cultivadas em frasco de 75cm2 (células C6/36 ou BHK-21) nas placas de 24 poços (C6/36 por poço: 1,4 × 105; BHK-21 por poço: 0,8 × 105).
- Coloque as placas de 24 poços a 28 °C ou 37 °C durante a noite.
- Observe as células ao microscópio e confirme se a confluência celular em cada poço é de 80%-90%.
- Preparar o meio de manutenção da cultura celular (500 mL).
OBS: Para C6/36, o meio utilizado foi o meio RPMI suplementado com SFB a 2% e Solução de Penicilina-Estreptomicina-Anfotericina B a 2%. Para BHK-21, o meio utilizado foi meio DMEM suplementado com SFB a 2% e solução de penicilina-estreptomicina-anfotericina B a 2%.
4. Isolamento do vírus
OBS: Todas as etapas foram realizadas em laboratório de nível de biossegurança 2 (BSL-2). O requisito de nível de segurança do laboratório de biossegurança foi determinado pela avaliação de risco de biossegurança com base nas regulamentações de diferentes países e regiões. O processo deve ser realizado em um gabinete de biossegurança.
- Retirar o meio de cultura celular das placas de 24 poços e adicionar 100 μL do meio de manutenção de cultura celular e 100 μL do sobrenadante do homogeneizado do mosquito (P0) a cada poço.
- Incubar as placas a 28 °C ou 37 °C durante 60 min e agitá-las suavemente a cada 15 min para evitar a secagem celular.
- Retire o sobrenadante e lave bem cada um com 600 μL de meio de manutenção de cultura celular para remover completamente os detritos.
- Adicionar 800 μL de meio de manutenção de cultura celular a cada poço e manter as placas em estufa umidificada a 5% de CO2 a 28 °C ou 37 °C por 7 dias.
- Monitorar diariamente o estado celular de cada poço ao microscópio15.
- Coletar os sobrenadantes das células (sobrenadantes P1) no7º dia e armazenar os sobrenadantes a -80 °C.
- Repita as etapas 4.1-4.6 2x para obter os sobrenadantes P2 e P3.
NOTA: Na etapa 4.3, enxaguar cada poço suavemente com 600 μL de meio de manutenção de cultura celular foi opcional para o P2 e P3. - Dependendo do que mostra o efeito citopatogênico (CPE) — as células morrem, picnose, e se desprendem da superfície; fusão com células adjacentes para formar sincícios; ou o aparecimento de corpos de inclusão nucleares ou citoplasmáticos — adicione 300-400 μL do sobrenadante deste CPE em cada poço das novas placas de 6 poços contendo células (a confluência celular era de 80%-90%) para amplificar grandemente os vírus.
- Recolher os sobrenadantes e aliá-los em tubos de armazenamento com tampa de rosca de 2 ml (500 μL por tubo). Conservá-los a -80 °C.
OBS: Após três gerações de passagem sucessiva nas células, as amostras que não induziram ECP foram descartadas. Se necessário, as gerações de passagem sucessiva nas células podem ser aumentadas.
5. Detecção de sequências virais por RT-PCR
- Extrair o RNA total de 200 μL do sobrenadante viral usando um mini kit de RNA viral16.
NOTA: Aqui, um sistema automatizado de extração de ácido nucleico foi usado para extrair o RNA total seguindo as instruções do fabricante do instrumento. - Converter o RNA em cDNA seguindo as instruções do kit RT-PCR usando um instrumento de PCR.
- Adicionar 15 μL de RNA misturado com 1 μL de primers aleatórios no tubo de PCR. Coloque o tubo a 70 °C durante 5 min e, em seguida, coloque-o no gelo durante 5 min.
- Adicionar 5 μL de tampão 5x e 25 μL de mistura (10 mM dNTP, 40 U/μL inibidor de RNase e 200 U/μL M-MLV) no tubo e colocar o tubo a 42 °C por 60 min e 95 °C por 10 min.
- Conservar o tubo a -20 °C.
- Utilizar kit de PCR e primers universais (Tabela 1) para detecção de vírus por PCR.
- Para arbovírus, configurar o sistema de reação de PCR (total de 30 μL) com os seguintes componentes: 3 μL de tampão Taq 10x, 3 μL de dNTP (1mM), 1 μL de primer anterior (10 μm), 1 μL de primer reverso (10 μm), 0,3 μL de Taq (10 U/μL), 19,7 μL de ddH 2 O e2μL de cDNA.
- Para a detecção de flavivírus, configurar o processo de reação como: estágio 1: 35 ciclos de 94 °C por 30 s, 52 °C por 30 s e 72 °C por 30 s; estágio 2: 72 °C por 10 min.
- Para a detecção de alfavírus, configurar o processo de reação como: estágio 1: 35 ciclos de 94 °C para 30 s, 50 °C para 30 s e 72 °C para 30 s; estágio 2: 72 °C por 10 min.
- Para a detecção de bunyavirus, configurar o processo de reação como: estágio 1: 35 ciclos de 94 °C por 30 s, 50 °C por 30 s e 72 °C por 30 s; estágio 2: 72 °C por 10 min.
- Detectar os produtos de amplificação por PCR por eletroforese em gel de agarose a 1% e enviá-los para análise de sequenciamento.
NOTA: Se as condições permitirem, os sobrenadantes podem ser submetidos a análises de sequenciamento de próxima geração para identificar novos vírus e obter todo o genoma viral.
Resultados
Após a inoculação com os sobrenadantes dos homogeneizados do mosquito (P0), as células C6/36 exibiram um amplo espaço intercelular, e células esfoliadas foram observadas em 120 h (Figura 1A) em comparação com as células não inoculadas (controle) ao mesmo tempo (Figura 1B). Após incubação das células BHK-21 com o sobrenadante P3, observou-se CPE visível nas células BHK-21 em 48 h (Figura 1C), em contraste com as células controle (Figura 1D). A PCR foi realizada para determinar a espécie viral. Os primers universais para detecção de flavivírus, alfavírus e bunyavírus foram sintetizados comercialmente (Tabela 1). Um produto de PCR para o bunyavirus Ebinur Lake Virus foi definido como um controle positivo e adicionado à Faixa 1. Os primers universais para bunyavirus, flavivirus e alphaviruses foram usados para gerar os produtos de PCR para o sobrenadante viral, que foram então adicionados na Lane 2, 3 e 4, respectivamente. Os tamanhos estimados dos produtos de PCR para flavivírus, alfavírus e bunyavírus foram 266 pb, 434 pb e 251 pb, respectivamente. As bandas só eram visíveis na Faixa 2 e na Faixa 1 de controle positivo. Como resultado, é provável que o vírus nos sobrenadantes seja um bunyavirus (Figura 2).

Figura 1: Observação das células CPE após a incubação com os sobrenadantes virais. O status das células C6/36 em 120 h após a infecção (CPE) (A) e o das células controle ao mesmo tempo (B). O status das células BHK-21 a 48 hpi (C) e o das células controle (D). Barras de escala = 100 μm. Abreviações: CPE = efeito citopatogênico; HPI = horas pós-infecção. Clique aqui para ver uma versão maior desta figura.
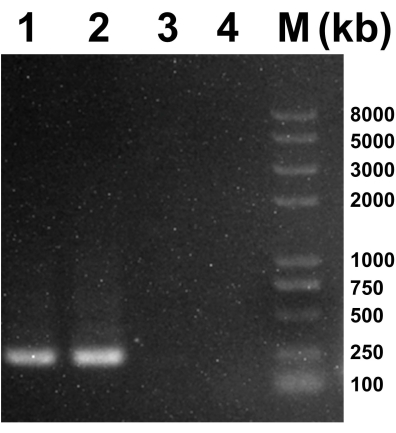
Figura 2: Resultados da PCR para sobrenadantes virais. A faixa 1 representa o controle positivo de bunyavirus (Ebinur Lake Virus). Lanes 2-4 representou os resultados da PCR do sobrenadante usando primers universais para bunyavirus (251 pb), flavivirus (266 pb) e alphavirus (434 pb). Clique aqui para ver uma versão maior desta figura.
| Vírus | Cartilha | Oligonucleotídeo (5'→3') | O tamanho do produto PCR (pb) | ||
| Flavivírus | F1 | TACAACATGATGGGAAAGAGAGAGAA | 266 | ||
| F2 | GTGTCCCAGCCGGCGGTGTCATCAGC | ||||
| Alfavírus | M2w | YAGAGCDTTTTCGCAYSTRGCHW | 434 | ||
| cMw3 | ACATRAANKGNGTNGTRTCRAANCCDAYCC | ||||
| Bunyavirus | BCS82C | ATGACTGAGTTGGAGTTTCATGATGTCGC | 251 | ||
| BCS332V | TGTTCCTGTTGCCAGGAAAAT | ||||
Tabela 1: Primers universais para detecção de arbovírus.
Discussão
O objetivo deste método foi oferecer uma maneira prática de isolar vírus associados a mosquitos usando várias linhagens celulares. É fundamental adicionar o Antibiotico-Antimicótico (Penicilina-Estreptomicina-Anfotericina) aos sobrenadantes dos homogeneizados do mosquito para evitar a contaminação por bactérias ou fungos. Os mosquitos e sobrenadantes virais obtidos no campo devem ser refrigerados a -80 °C para evitar ciclos repetidos de congelamento-descongelamento.
Outro passo crítico no protocolo foi a trituração. As amostras de mosquitos devem ser cuidadosamente pulverizadas e armazenadas no gelo. Tecidos de mosquitos insuficientemente triturados podem induzir morte celular e podem distorcer os resultados da análise de ECP. Antes do isolamento do vírus, é necessário empregar mosquitos normais para confirmar os parâmetros de trituração. A trituração deve ser feita a baixas temperaturas para evitar que o vírus fique inativo durante o processo.
Essa abordagem pode efetivamente isolar e amplificar vírus associados a mosquitos, mas só é aceitável para vírus que podem exibir CPE em linhagens celulares de mamíferos ou insetos. Essa abordagem é inadequada para vírus que não induzem ECP. Usando o protocolo, podemos obter candidatos virais que contêm apenas um tipo de vírus ou uma mistura com vírus diferentes. Mais investigações – purificação viral, identificação morfológica e análise de placa – ainda são necessárias para obter o vírus purificado.
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Este trabalho foi apoiado pelo Wuhan Science and Technology Plan Project (2018201261638501).
Materiais
| Name | Company | Catalog Number | Comments |
| 0.22 µm membrane filter | Millipore | SLGP033RB | Polymer films with specific pore ratings.To remove cell debris and bacteria. |
| 24-well plates | CORNING | 3524 | Containers for cell |
| 75 cm2 flasks | CORNING | 430641 | Containers for cell |
| a sterile 2 mL tube with 3 mm ceramic beads | |||
| Antibiotic-Antimycotic | Gibco | 15240-062 | Antibiotic in the medium to prevent contamination from bacteria and fungi |
| Automated nucleic acid extraction system | NanoMagBio | S-48 | |
| BHK-21 cells | National Virus Resource Center, Wuhan Institute of Virology | ||
| C6/36 cells | National Virus Resource Center, Wuhan Institute of Virology | ||
| Centrifugal machine | Himac | CF16RN | Instrument for centrifugation of mosquito samples |
| CO2 | |||
| Dulbecco’s minimal essential medium (DMEM) | Gibco | C11995500BT | medium for vertebrate cell lines |
| Ebinur Lake virus | Cu20-XJ isolation | ||
| Feta Bovine Serum (FBS) | Gibco | 10099141C | Provide nutrition for cells |
| high-speed low-temperature tissue homogenizer | servicebio | KZ-III-F | Instrument for grinding |
| incubator (28 °C) | Panasonic | MCO-18AC | Instrument for cell culture |
| incubator (37 °C) | Panasonic | MCO-18AC | Instrument for cell culture |
| PCR tube | |||
| penicillin-streptomycin | Gibco | 15410-122 | Antibiotic in the medium to prevent contamination from bacteria |
| Penicillin-Streptomycin-Amphotericin B Solution | Gibco | 15240096 | |
| Refrigerator (-80 °C) | sanyo | MDF-U54V | |
| Roswell Park Memorial Institute medium (RPMI) | Gibco | C11875500BT | medium for mosiquto cell lines |
| Screw cap storage tubes (2 mL) | biofil | FCT010005 | |
| sterile pestles | Tiangen | OSE-Y004 | Consumables for grinding |
| TGrinder OSE-Y30 electric tissue grinder | Tiangen | OSE-Y30 | Instrument for grinding |
| The dissecting microscope | ZEISS | stemi508 | |
| the light traps MXA-02 | Maxttrac | ||
| The mosquito absorbing machine | Ningbo Bangning | ||
| The pipette tips | Axygen | TF | |
| The QIAamp viral RNA mini kit | QIAGEN | 52906 | |
| Tweezers | Dumont | 0203-5-PO |
Referências
- Xia, H., Wang, Y., Atoni, E., Zhang, B., Yuan, Z. Mosquito-associated viruses in China. Virologica Sinica. 33 (1), 5-20 (2018).
- Atoni, E., et al. A dataset of distribution and diversity of mosquito-associated viruses and their mosquito vectors in China. Scientific Data. 7 (1), 342 (2020).
- Atoni, E., et al. The discovery and global distribution of novel mosquito-associated viruses in the last decade (2007-2017). Reviews in Medical Virology. 29 (6), 2079 (2019).
- Xia, H., et al. Comparative metagenomic profiling of viromes associated with four common mosquito species in China. Virologica Sinica. 33 (1), 59-66 (2018).
- Ong, O. T. W., Skinner, E. B., Johnson, B. J., Old, J. M. Mosquito-borne viruses and non-human vertebrates in Australia: A review. Viruses. 13 (2), 265 (2021).
- Agboli, E., Leggewie, M., Altinli, M., Schnettler, E. Mosquito-specific viruses-transmission and interaction. Viruses. 11 (9), 873 (2019).
- Halbach, R., Junglen, S., van Rij, R. P. Mosquito-specific and mosquito-borne viruses: evolution, infection, and host defense. Current Opinion in Insect Science. 22, 16-27 (2017).
- Bolling, B. G., Olea-Popelka, F. J., Eisen, L., Moore, C. G., Blair, C. D. Transmission dynamics of an insect-specific flavivirus in a naturally infected Culex pipiens laboratory colony and effects of co-infection on vector competence for West Nile virus. Virology. 427 (2), 90-97 (2012).
- Baidaliuk, A., et al. Cell-fusing agent virus reduces arbovirus dissemination in Aedes aegypti mosquitoes in vivo. Journal of Virology. 93 (18), 00715-00719 (2019).
- Atoni, E., et al. Metagenomic virome analysis of Culex mosquitoes from Kenya and China. Viruses. 10 (1), 30 (2018).
- Xia, H., et al. First isolation and characterization of a group C Banna virus (BAV) from Anopheles sinensis mosquitoes in Hubei, China. Viruses. 10 (10), 555 (2018).
- Shi, C., et al. Stability of the virome in lab- and field-collected Aedes albopictus mosquitoes across different developmental stages and possible core viruses in the publicly available virome data of Aedes mosquitoes. mSystems. 5 (5), 00640 (2020).
- Zhou, M., Chu, H. . Handbook for Classification and Identification of Main Vectors. , (2019).
- Wang, G., et al. Identifying the main mosquito species in China based on DNA barcoding. Plos One. 7 (10), (2012).
- Ratnasingham, S., Hebert, P. D. N. Bold: The Barcode of Life Data System (www.barcodinglife.org). Molecular Ecology Notes. 7 (3), 355-364 (2007).
- Huang, Y., et al. In vitro and in vivo characterization of a new strain of mosquito Flavivirus derived from Culicoides. Viruses. 14 (6), 1298 (2022).
- Zhao, L., et al. Characterization of a novel Tanay virus isolated from Anopheles sinensis mosquitoes in Yunnan, China. Frontiers in Microbiology. 10, 1963 (1963).
- Ren, N., et al. Characterization of a novel reassortment Tibet orbivirus isolated from Culicoides spp. in Yunnan, PR China. Journal of General Virology. 102 (9), 001645 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados