Method Article
Entrega e amostragem intraventricular de medicamentos para estudo farmacocinético e farmacodinâmico
Neste Artigo
Resumo
A administração de terapêutica diretamente no sistema nervoso central é uma forma de contornar a barreira hematoencefálica. O presente protocolo demonstra injeção intracerebroventricular para posterior coleta de líquido cefalorraquidiano e órgãos corporais. Isso facilita a investigação da farmacocinética e farmacodinâmica de medicamentos em modelos animais para o desenvolvimento de novos tratamentos.
Resumo
Embora a barreira hematoencefálica (BHE) proteja o cérebro de entidades estranhas, ela também impede que algumas terapias atravessem para o sistema nervoso central (SNC) para melhorar doenças ou infecções. Os medicamentos são administrados diretamente no SNC em animais e humanos para contornar a BHE. O presente protocolo descreve uma maneira única de tratar infecções cerebrais por meio da administração intraventricular de antibióticos, ou seja, polimixinas, os antibióticos de última linha para tratar bactérias Gram-negativas multirresistentes. Um protocolo de cirurgia estereotáxica simples foi desenvolvido para implantar uma cânula guia que alcança o ventrículo lateral em ratos. Após um período de recuperação de 24 horas, os ratos podem ser injetados consciente e repetidamente através de uma cânula que é encaixada na guia. As injeções podem ser administradas manualmente como bolus ou infusão usando uma bomba de microinjeção para obter uma taxa de fluxo lenta e controlada. A injeção intraventricular foi confirmada com sucesso com o corante Evans Blue. O líquido cefalorraquidiano (LCR) pode ser drenado e o cérebro e outros órgãos podem ser coletados. Essa abordagem é altamente receptiva a estudos envolvendo a administração de medicamentos ao SNC e a avaliação subsequente da atividade farmacocinética e farmacodinâmica.
Introdução
A barreira hematoencefálica (BHE) é um mecanismo de proteção crucial para o sistema nervoso central (SNC). A barreira anatômica seletivamente permeável separa o sangue circulante e seus solutos do fluido extracelular do cérebro, impedindo assim que a maioria das moléculas entre no cérebro 1,2,3,4, dependendo de seu tamanho, lipofilicidade 5 e disponibilidade de um mecanismo de transporte ativo 2.
Essa barreira protetora é benéfica para a regulação eficaz da intrincada homeostase cerebral e da saúde do SNC 4,6. No entanto, também dificulta a administração de medicamentos para tratar infecções no cérebro ou outras doenças do SNC 4,7. Além de interromper a BHE usando uma variedade de métodos 8,9, a principal abordagem para contornar a BHE é administrar um medicamento diretamente no cérebro, liberando-o no líquido cefalorraquidiano (LCR)4. Embora seja uma prática relativamente invasiva, tem sido usada com sucesso para fornecer terapias direcionadas a pacientes e animais de laboratório. Em humanos, os medicamentos podem ser administrados no sistema intraventricular ou no LCR e posteriormente amostrados usando o reservatório de Ommaya, um reservatório que reside sob o couro cabeludo, conectado a um cateter inserido no ventrículo lateral10,11. Técnicas semelhantes foram estabelecidas em animais de laboratório, como roedores, para atingir objetivos equivalentes. Bombas microosmóticas foram implantadas em camundongos 12,13,14,15 e ratos16,17 para administração contínua de drogas no sistema ventricular ou parênquima cerebral. Além disso, injeções intracerebroventriculares diretas foram realizadas em camundongos anestesiados com agulha descartável18,19 e ratos conscientes por meio de cânula implantada cirurgicamente 20,21,22,23. A entrega de medicamentos ao SNC tem sido um método inestimável para melhorar a compreensão em vários campos 20,24,25,26,27,28.
As infecções do SNC são um desses campos que precisa urgentemente de novas terapias e uma compreensão aprimorada das terapias anti-infecciosas existentes. As infecções do SNC causadas por bactérias Gram-negativas multirresistentes são particularmente preocupantes7. As polimixinas são os antibióticos de última linha cada vez mais utilizados para tratar infecções devido a essas "superbactérias"29. Quando as polimixinas são administradas por via intravenosa de acordo com as diretrizes posológicas atuais30, sua penetração no SNC é muito baixa, enquanto doses mais altas aumentam o risco de nefrotoxicidade. Portanto, a terapia intravenosa com polimixina é de pouca utilidade para tratar infecções do SNC7. Estabelecer um regime posológico seguro e eficaz para a entrega de polimixinas ao SNC é uma necessidade médica urgente não atendida 31,32,33. Portanto, o presente protocolo foi estabelecido e é descrito com foco na injeção de antibióticos diretamente no LCR de ratos. Pode, no entanto, ser usado para administrar qualquer medicamento que não seja neurotóxico e onde as concentrações terapêuticas podem ser administradas em pequenos volumes (por exemplo, até 10 μL em ratos). As técnicas descritas também podem ser modificadas para atingir diferentes regiões do cérebro e aplicar várias injeções.
O presente protocolo apresenta uma técnica simples de cirurgia e injeção que permite uma farmacocinética eficiente e distribuição pós-administração de medicamentos pela ICV. A cirurgia envolve a implantação de uma cânula guia. Por ser um procedimento menos invasivo do que o implante de uma bomba micro-osmótica 12,13,14,15,16,17, esta é uma opção avançada adequada para a administração de drogas em curto prazo no LCR. Este protocolo é simplificado e pode produzir taxas de sobrevivência muito altas e pesos corporais estáveis 24 h após a cirurgia, o que é uma melhoria em comparação com os métodos existentes34. Após a cirurgia, ratos conscientes receberam uma injeção manual de ICV em bolus ou uma entrega mais lenta usando uma microbomba para diminuir as concentrações plasmáticas máximas. Ao mesmo tempo, eles podiam se mover livremente em sua gaiola. Para estabelecer regimes de dosagem de medicamentos seguros e eficazes, amostras de LCR, cérebro, medula espinhal, rim, plasma, etc., foram usadas para estudar a farmacocinética e a distribuição de medicamentos após a administração intracerebroventricular (ICV). A distribuição de medicamentos também pode ser investigada visualmente, por exemplo, usando imuno-histoquímica ou imagem de espectrometria de massa de dessorção/ionização a laser assistida por matriz (MALDI-MSI). Se necessário, uma cânula bilateral pode ser implantada, por exemplo, para injetar drogas que, de outra forma, seriam distribuídas unilateralmente em ambos os hemisférios.
Protocolo
Todos os experimentos foram conduzidos seguindo o código australiano para o cuidado e uso de animais para fins científicos. Os experimentos foram aprovados pelo comitê de ética da Universidade de Melbourne (aplicação # 1914890). Ratos Sprague-Dawley machos e fêmeas de 8-14 semanas de idade foram usados para os experimentos.
1. Cirurgia estereotáxica para canulação do ventrículo lateral
- Use pontas de algodão autoclavadas e campos cirúrgicos durante a cirurgia.
- Configure o seguinte para a cirurgia.
- Configure a estrutura estereotáxica, o sistema de administração de anestesia, medicamentos, produtos químicos e materiais auxiliares (consulte a Tabela de Materiais). Limpe a estrutura estereotáxica, fonte de luz de fibra óptica, furadeira portátil, etc., com 80% de etanol.
- Mergulhe a cânula guia de 22 G e a cânula fictícia associada (consulte a Tabela de Materiais) em etanol a 80% para esterilização.
NOTA: O fabricante pré-cortou a guia de 22 G e a cânula fictícia com ~4 mm de comprimento abaixo do pedestal. - Esterilize os instrumentos cirúrgicos (consulte a Tabela de Materiais) usando o esterilizador de esferas de calor por 20 s e, em seguida, pulverize com etanol a 80%. Coloque os instrumentos esterilizados na cortina estéril.
- Prepare uma caixa de recuperação (uma caixa de alojamento para ratos forrada com uma almofada) com metade da caixa colocada sobre uma almofada de aquecimento.
- Realize a cirurgia.
- Aparafuse a cânula guia 22 G limpa com etanol no suporte da cânula na estrutura estereotáxica.
- Coloque o rato em uma câmara de indução (300 mm x 200 mm, consulte a Tabela de Materiais) e induza a anestesia com isoflurano a 5% a 1 L / min de oxigênio.
- Uma vez que o rato esteja profundamente anestesiado (sem reflexo podal), mova-o para a estrutura estereotáxica e reduza o isoflurano para 2% -3% em 1 L / min de oxigênio para manutenção através do cone do nariz. Prenda os dentes na barra de mordida e puxe cuidadosamente o cone do nariz sobre o nariz - puxe suavemente o rato para verificar se está seguro.
- Aplique lubrificante protetor para os olhos em ambos os olhos para evitar o ressecamento.
- Injete carprofeno (5 mg/kg), buprenorfina (0,05 mg/kg) em solução salina e 3 mL de solução salina por via subcutânea (s.c.) para controle da dor e para ajudar na recuperação pós-cirúrgica.
- Aperte os dedos dos pés para verificar o reflexo do pedal. Uma vez ausente, fixe o crânio do rato no quadro. Coloque uma barra de orelha no canal auditivo e aperte. Repita do outro lado.
- Mova as barras auriculares lateralmente para garantir que os números fornecidos nas barras auriculares sejam iguais em ambos os lados. A cabeça não deve se mover ao pressionar o crânio.
- Raspe o topo da cabeça com um aparador. Limpe o cabelo com um lenço de papel e soro fisiológico. Se necessário, reaplique o lubrificante para os olhos em ambos os olhos para evitar o ressecamento.
- Limpe o couro cabeludo com clorexidina a 4% e solução alcoólica de preparação da pele, usando cotonetes estéreis para cada etapa (consulte a Tabela de Materiais). Comece no centro do crânio e mova-se em círculos para fora até que toda a superfície esteja limpa.
- Injete ~ 150 μL de ropivacaína (1%) sc (consulte a Tabela de Materiais) ao longo do local da incisão pretendido.
- Use a lâmina do bisturi para fazer uma incisão de 10-15 mm ao longo da linha média da cabeça, entre os olhos até a base do crânio.
- Use as pontas de algodão e o bisturi para raspar o tecido conjuntivo e expor o crânio.
- Mergulhe uma ponta de algodão estéril em uma solução de peróxido de hidrogênio a 3% e aplique-a na superfície do crânio. Aguarde 5 s para que o produto químico reaja com a pele e, em seguida, limpe a área com uma ponta de algodão seca.
- Aplique peróxido de hidrogênio a 3% pela segunda vez. Isso fará com que as linhas de sutura do crânio apareçam mais claramente. Aguarde 10 s para que o produto químico reaja com a pele e, em seguida, limpe a área com uma ponta de algodão seca. Lave com soro fisiológico e seque com uma ponta de algodão limpa.
- Aplique cuidadosamente uma pequena quantidade de gel Super etch em uma ponta de algodão e aplique-o na superfície do crânio. Isso cria uma superfície mais porosa para o cimento dental aderir.
- Aplique uma quantidade generosa de solução salina no crânio para lavar o super ácido e seque-o com uma ponta de algodão limpa.
- Identifique bregma e marque-o usando a caneta hidrográfica.
- Faça um recuo para o parafuso de ancoragem em um local que não obstrua a colocação da cânula guia.
NOTA: Se o ventrículo lateral direito for canulado, perfure no hemisfério esquerdo e posteriormente em relação ao ventrículo. - Segure a broca em um ângulo de ~ 75 ° -80 ° em relação ao crânio e perfure lentamente um recuo com uma profundidade de aproximadamente metade da espessura do crânio. Use solução salina em uma ponta de algodão para limpar a poeira óssea.
- Insira cuidadosamente o parafuso, segurando-o firmemente no recuo com uma pinça e aparafusando-o no crânio com a chave de fenda, evitando quebrar o crânio. Após cada volta completa, teste se o parafuso está bem encaixado.
- Confirme se o crânio é plano. Usando os braços móveis da armação, posicione a cânula guia para tocar o crânio em bregma. Zere o DV (dorsal-ventral) que representa as coordenadas do plano Z pressionando o botão no monitor de controle do quadro.
- Levantar a cânula guia (22 G e 4 mm de comprimento) com os braços móveis da armação e deslocá-la para lambda. Abaixe-o para que toque a superfície do crânio e observe a exibição DV novamente.
NOTA: A diferença entre DV em bregma e DV em lambda deve ser inferior a 0,2 mm. Se necessário, ajuste o cone do nariz de acordo, ou seja, mova a cabeça do rato para cima ou para baixo conforme necessário e repita as medições. - Mova a cânula guia de volta para tocar bregma e zere novamente todas as três coordenadas: DV, AP (ântero-posterior) e ML (médio-lateral) pressionando os botões no monitor.
- Mova a cânula guia para as coordenadas pré-estabelecidas de escolha.
NOTA: Para canulação do ventrículo lateral direito em um rato adulto de 300-350 g, foram utilizadas as seguintes coordenadas: -0,7 mm AP, -1,4 mm ML e -4,00 mm DV (mesmo comprimento da cânula guia). - Marque a posição final da cânula colorindo a extremidade da cânula usando a caneta marcadora e, em seguida, abaixando-a até a superfície do crânio para tocar e marcar a posição.
- Faça um furo de 2,3 mm de diâmetro para a cânula guia de 22 G, segurando o eixo da broca em uma posição vertical reta, ou seja, em um ângulo de 90° em relação ao scull. Tenha cuidado para se aprofundar lenta e progressivamente no crânio, ou seja, evite perfurar o tecido cerebral.
NOTA: Se necessário, abaixe a cânula no orifício usando o braço estereotáxico móvel para testar se a cânula pode ser colocada com sucesso ou se é necessária mais perfuração. - Uma vez que a cânula tenha sido abaixada no cérebro, levante-a novamente, aplique cuidadosamente super cola na parte inferior do pedestal de plástico da cânula e abaixe a cânula de volta no orifício usando o braço móvel da estrutura estereotáxica.
- Deixe no lugar para permitir que a cola endureça.
- Enquanto espera, misture solvente dental e pó (consulte a Tabela de Materiais) em um barco de pesagem. Despeje o pó de cimento dental no recipiente de pesagem, use uma seringa de 1 mL para adicionar ~ 300 μL de solvente e misture usando a mesma seringa até engrossar e ter uma consistência utilizável. Se necessário, adicione mais pó para aumentar a viscosidade ou mais solvente para reduzir a viscosidade.
- Solte a cânula do suporte da cânula usando o parafuso dedicado e levante cuidadosamente o braço.
NOTA: A cânula deve ser colada ao crânio em um ângulo de 90°. - Aplique o cimento dentário fresco no crânio exposto, colocando-o na seringa descartável de 1 ml e aplicando-o à volta da cânula. Evite qualquer cimento dentário na pele ou abertura da cânula. Deixe agir por alguns segundos, dependendo da consistência.
- Quando o cimento dental ficar mais espesso, use uma espátula para aplicar mais cimento dental e forme a montagem final da cabeça cobrindo totalmente o parafuso.
NOTA: Tenha cuidado para não cobrir muito da cânula para que a cânula fictícia ainda possa ser aparafusada. Remova qualquer excesso de cimento dental da pele. - Insira uma cânula falsa estéril assim que o cimento dentário estiver seco e firme.
- Desligue o isoflurano, solte as barras auriculares, remova o rato da estrutura e coloque-o na caixa de recuperação.
- Assim que o animal se recuperar ~ 15-30 min, coloque-o em uma caixa limpa.
NOTA: Após a cirurgia, os ratos precisam ser alojados individualmente. Considere substituir os topos de gaiola de grade padrão onde o funil de alimentos abaixa na gaiola por topos de gaiola de grade elevados dedicados para minimizar o risco de interferência com o suporte de cabeça. Alternativamente, bloqueie quaisquer partes da gaiola que sejam muito mais baixas do que a altura de criação do animal. - Preencha a lista de verificação de monitoramento e monitore de acordo com as diretrizes de monitoramento descritas no protocolo.
NOTA: Considere colocar alguns pellets de comida no chão para facilitar o acesso. Se não interferir no experimento, alívio adicional da dor pode ser fornecido em alimentos doces para substituir injeções adicionais de SC pós-cirurgia, por exemplo, buprenorfina misturada com pasta de chocolate de nozes doces 35,36,37. Nesse caso, um pouco do mesmo doce foi fornecido como recompensa antes e depois da cirurgia para evitar a neofobia alimentar ao oferecer alívio da dor. A pasta de nozes pode ser fornecida em fita adesiva presa à parede da gaiola. - Armazene mais cânulas fictícias do que cânulas guia ou cânulas de injeção, pois elas podem se perder entre a cama da gaiola do animal se se soltarem acidentalmente. Em caso de tal evento, substitua a cânula por uma nova cânula falsa estéril.
2. Injeções de ICV
- Prepare o medicamento e o veículo, por exemplo, 30 mg / mL de polimixina B (ver Tabela de Materiais) em solução salina estéril a 0,9%. Mantenha o volume de injeção entre 5-10 μL em ratos adultos com peso corporal variando entre 300-400 g.
- No mínimo 24 horas após a cirurgia, pesar o rato e transportá-lo para a sala de procedimentos.
- Calcule o volume de injeção usando o peso corporal do rato.
- Remova a tampa da gaiola e desparafuse a cânula fictícia.
NOTA: Os ratos geralmente ficam parados quando os seguram suavemente em sua gaiola e não precisam de contenção. Um pano de prato pode ser usado para um rato curioso ou nervoso ou uma cócega nas maçãs do rosto. - Para uma injeção em bolus, conecte o tubo PE-50 (consulte a Tabela de Materiais) de pelo menos 40 cm de comprimento a uma microsseringa estanque a gás de 10 μL, puxando uma extremidade do tubo sobre a agulha fixa ou removível na seringa e garantindo uma vedação hermética. Conecte a cânula injetora instalada na outra extremidade do tubo.
- Retire a quantidade necessária através da cânula. Insira a cânula na guia até encaixar e injete. Depois que todo o líquido for injetado, segure o êmbolo da seringa no lugar por pelo menos mais um minuto para evitar o refluxo.
- Para uma taxa de entrega mais lenta, injete os medicamentos usando uma bomba de microinjeção (consulte a Tabela de Materiais).
- Primeiro, use água filtrada e uma seringa descartável de 1 mL com uma agulha de extração de 23 G para encher totalmente o tubo PE-50. Em seguida, retire a seringa descartável da agulha de extração e substitua-a pela microsseringa.
- Recue 1-3 μL para criar uma bolha de ar pequena, mas visível. Em seguida, elabore a quantidade necessária de medicamentos. Opcionalmente, marque a bolha de ar com um marcador para auxiliar na visibilidade do fluxo de drogas. Trave a seringa no lugar na bomba.
NOTA: Certifique-se de que as configurações corretas para o medicamento e o equipamento utilizado, ou seja, defina a velocidade de administração e o diâmetro interno da seringa utilizada de acordo com o manual do usuário.
- Assim que todo o líquido for injetado, pare a bomba se ela não parar automaticamente. Deixe a agulha inserida por pelo menos mais um minuto para evitar refluxo.
- Remova lentamente a cânula injetora e aparafuse a cânula guia.
- Limpe o equipamento extraindo e ejetando etanol e água DI três vezes cada.
3. Amostras de LCR e tecidos
- Transporte o rato para uma sala de procedimentos.
- Coloque o rato na câmara de indução e induza a anestesia com isoflurano a 5% em oxigênio 2 L/min até que a respiração diminua (~ 5 min).
- Mova o rato para o quadro estereotáxico e mantenha o mesmo nível de anestesia profunda através do cone do nariz.
- Verifique o reflexo do pedal. Uma vez ausente, fixe o crânio na moldura usando as barras auriculares.
NOTA: Pode ser uma armação estereotáxica mais simples, sem tela, barras auriculares arredondadas ou braços móveis. Este é um procedimento de não recuperação; O único recurso necessário são quaisquer barras de orelha de rato. - Usando o cone do nariz, incline o nariz do rato para baixo em cerca de 45° para expor o pescoço a uma boa posição de trabalho.
- Usando uma tesoura pequena, cega e curva, sinta o crânio e mova-se posteriormente até o final do crânio. Nesta posição, corte a camada muscular mais externa até a linha média do pescoço, com cerca de 2-3 cm de comprimento. Corte cuidadosamente todas as outras camadas musculares.
- Use um pequeno afastador de mola para manter a ferida aberta e permitir uma boa visibilidade. Corte até que a membrana da cisterna magna fique visível. Use uma ponta de algodão para ajudar a remover suavemente mais pele.
- Se ocorrer sangramento, use gaze para limpar e estancar o sangramento.
- Se necessário, use pequenas tiras de tecido enrolado e coloque-o ao redor da cisterna magna para evitar que o sangue contamine o LCR.
NOTA: Para confirmar o sucesso da injeção usando corante, injete 2-3 μL de corante Evans Blue a 1,1% (consulte a Tabela de Materiais) no rato anestesiado antes de coletar o LCR usando a cânula ajustada e uma seringa descartável de 1 mL. - Para preparar a ferramenta para extrair o LCR, encha a seringa com ~500 μL de água filtrada, coloque uma agulha de extração de 23 G e puxe o tubo sobre a agulha. Conecte uma pipeta de vidro puxado na outra extremidade do tubo.
- Para extrair o LCR, insira lentamente a pipeta puxada na cisterna magna exposta.
NOTA: O LCR fluirá lenta e passivamente para a pipeta e será aspirado ativamente usando a seringa. Se o corante for injetado, o LCR seria colorido de azul (Figura 1). - Adicione o LCR em um tubo rotulado e coloque-o imediatamente em gelo seco. O LCR pode então ser armazenado a -80 °C.
- Colete qualquer outro tecido de interesse para análise. Para o plasma, colete pelo menos 3 mL de sangue cardíaco.
- Coloque o rato profundamente anestesiado de costas e abra a cavidade torácica para expor o coração. Use um hemostático para prender a caixa torácica e coloque-a na garganta do animal para ajudar na visibilidade. Use uma pinça de tecido com ganchos para segurar o ventrículo direito e insira uma seringa descartável de 5 mL com uma agulha de 18 G no ventrículo esquerdo paralelamente ao septo. Retire lentamente o sangue para a seringa. Depois de coletar 3-5 mL de sangue, remova a agulha do coração.
- Retire a agulha da seringa e coloque-a num recipiente afiado. Transferir o sangue para tubos heparinizados e centrifugar a 2.739 x g e 4 °C durante 15 min antes de recolher o sobrenadante com uma pipeta de 200 μL e congelar em gelo seco.
- Eutanasiar o rato removendo o coração com uma tesoura. Desligue o suprimento de isoflurano.
- Colete quaisquer outros órgãos abdominais de interesse, como o rim ou o baço. Identifique o órgão, segure o órgão de interesse com uma pinça de tecido com ganchos, levante-o e corte os acessórios. Coloque o órgão em um tubo rotulado e congele em gelo seco.
- Para remover o cérebro, decapite o animal com uma tesoura grande e afiada, cortando a base do crânio. Retire o suporte de cabeça com a mão. Corte a pele restante que cobre o crânio.
- Usando uma tesoura de dissecação, corte o crânio na linha média da base até lambda, ou seja, corte o osso supraoccipital ao meio. Use um hemostático para agarrar uma metade e retirá-la. Repita do outro lado para expor totalmente o cerebelo.
- Prossiga para cortar ao longo da sutura sagital até o osso frontal. Use um hemostático para remover cada um dos ossos parietais. Se necessário, corte ainda mais o osso frontal e remova mais osso para expor os bulbos olfatórios.
- Segure a cabeça de cabeça para baixo e retire cuidadosamente o cérebro com uma espátula, separando-o dos nervos óptico e trigêmeo, cortando-os com a espátula. Reúna o cérebro em um tubo e congele em gelo seco.
- Os ventrículos cerebrais serão corados de azul se o corante for injetado. Use uma lâmina descartável para cortar o cérebro no local da injeção ( Figura 2A, B ) e ~ 1 cm posterior ( Figura 2C ) para investigar a distribuição do corante nos ventrículos.
- Para remover a medula espinhal, exponha a coluna vertebral cortando a pele ao longo da linha média da superfície dorsal do rato. Extirpar a coluna vertebrada fazendo uma incisão bilateral em torno dela e cortando-a transversalmente na extremidade caudal da medula espinhal lombar.
- Corte a lâmina bilateralmente ao longo da coluna usando uma tesoura até que toda a medula espinhal fique exposta. Levante a medula espinhal de uma extremidade, por exemplo, a extremidade rostral, e extraia-a clivando os nervos espinhais na direção caudal até que todos os nervos sejam cortados. Colete a medula espinhal em um tubo e congele em gelo seco.
NOTA: Pese todos os tubos antes e depois da coleta de órgãos para análise dos dados. Se necessário e apropriado, o sistema ventricular pode ser lavado após a coleta do LCR e antes da coleta do cérebro para remover drogas residuais nos compartimentos ventriculares. Use uma seringa de 1 mL cheia de solução salina conectada ao tubo e uma cânula injetora e insira-a na cânula guia. Injete 2-3 mL de solução salina. A solução salina deve sair da abertura na cisterna magna. Cânulas guia, cânulas falsas e parafusos podem ser reutilizados mergulhando-os em acetona por 24 h, seguido de imersão e limpeza com detergente médico e água. Depois de seco, o cimento dentário residual pode ser removido com pinças finas.
Resultados
O protocolo cirúrgico apresentado é altamente bem-sucedido, com cirurgiões treinados atingindo >99,8% de sobrevida e animais apresentando peso corporal estável no pós-operatório no Dia 1, em comparação com o peso pré-operatório no Dia 0 (DP médio ± de 315,8 g ± 42,1 g para o Dia 0 e 314,1 g ± 43,0 g para o Dia 1, Figura 3).
Antes de coletar o LCR, uma injeção de corante azul de Evans a 1,1% na cânula implantada pode ajudar como confirmação de que a injeção foi administrada no local pretendido. O LCR coletado será azul (Figura 1), assim como o sistema ventricular no tecido cerebral (Figura 2).
O método foi benéfico para um estudo completo da farmacocinética, com amostras coletadas em diferentes momentos pós-operatórios.

Figura 1: Coleta de LCR após injeção de corante Evans Blue (1,1%) no rato anestesiado para confirmar a localização da cânula. O LCR é extraído usando uma pipeta de vidro puxado (A) e depois coletado em um tubo para congelamento e armazenamento (B). Clique aqui para ver uma versão maior desta figura.

Figura 2: Rastreamento de materiais de injeção nos ventrículos cerebrais com corante azul de Evan. Cérebros inteiros são cortados com uma lâmina no local da injeção (A, B) ou em locais mais posteriores (C) para confirmar a injeção bem-sucedida no sistema ventricular. Barra de escala (B) = 1 mm. Clique aqui para ver uma versão maior desta figura.
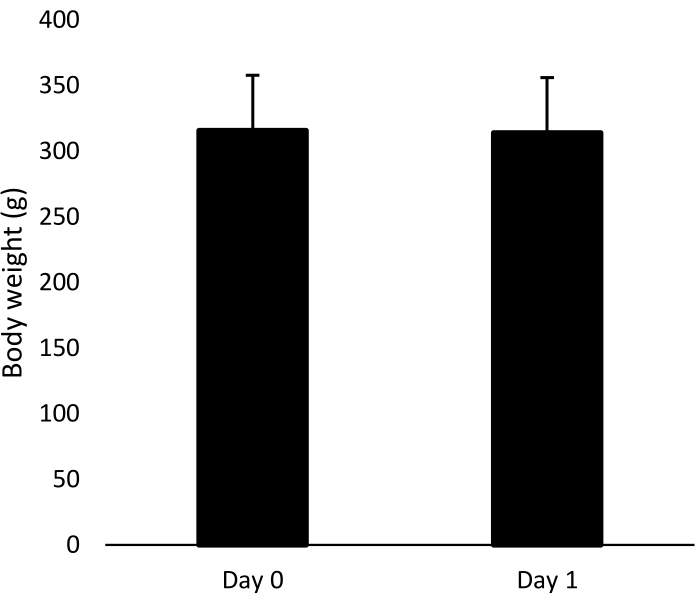
Figura 3: Peso corporal dos animais representativos. Peso corporal médio (+DP) de n = 174 animais representativos (19 coortes) antes da cirurgia (Dia 0) e no dia da injeção de ICV (Dia 1). Clique aqui para ver uma versão maior desta figura.
Discussão
Pesquisadores e clínicos empregam injeções de ICV para contornar o mecanismo de proteção da BHE e administrar medicamentos diretamente no SNC 12,18,19,21,24. O presente trabalho é um protocolo ICV completo para entrega eficiente de fármacos no SNC e extração de LCR para análise farmacocinética. No início da experimentação, quando este protocolo está sendo estabelecido em laboratório, o local da injeção pode ser confirmado pela administração do corante Evans Blue através da cânula implantada. Isso é especialmente útil e crítico se uma cepa ou idade diferente de ratos for empregada, pois coordenadas diferentes podem ser usadas. Uma opção alternativa que pode ser usada em animais experimentais é injetar angiotensina II e observar o comportamento de beber dos animais depois disso; no entanto, esse método é menos confiável38.
A neurotoxicidade induzida por drogas pode ser um fator limitante para a entrega de ICV39; no entanto, diminuir a taxa de entrega de medicamentos pode reduzir significativamente os eventos adversos40. Este método não é adequado para medicamentos em que uma dose terapêutica não pode ser administrada em pequenos volumes por curtos períodos, como <10 μL em <1 h em ratos. O regime de dose pode ser ajustado para administrar terapêutica em dose única ou ao longo de vários dias.
Estudos de imagem de cérebros inteiros ou análise de seções cerebrais dissecadas podem revelar características de distribuição da droga. Estudar a distribuição do medicamento administrado por via intraventricular é crucial para a análise farmacocinética, como LC-MS. A dinâmica exata do fluxo do LCR ainda está sob investigação e debatida41. No entanto, as características anatômicas dentro do SNC e as propriedades físico-químicas da droga injetada podem impedir que as drogas se distribuam igualmente dentro do SNC e até mesmo entre diferentes compartimentos do LCR42. Além disso, a própria condição de interesse pode influenciar a distribuição, por exemplo, a barreira hemato-LCR/sangue-encefálica pode se tornar permeável em pacientes e ratos com meningite42,43. Assim, recomenda-se que cada medicamento e sua distribuição sejam investigados para cada condição relevante. Se for demonstrado que a terapêutica sob investigação se distribui unilateralmente, ou seja, não cruza eficientemente para o outro hemisfério, os pesquisadores podem considerar o implante de cânulas bilaterais modificando o método cirúrgico descrito.
Com este protocolo, cirurgiões experientes podem alcançar taxas de sobrevivência muito altas e pesos corporais estáveis em animais. Este é um aprimoramento em comparação com os protocolos anteriores, um dos quais sugeriu a anestesia inalatória como uma melhora potencial para o bem-estar dos animais em relação à taxa média de não sobrevivência relatada de 2%34. Esse progresso pode ser combinado com a autoadministração de analgesia minimamente invasiva por meio de alimentos 35,36,37. Isso resulta em um pré-requisito otimizado para um bom bem-estar animal e compreensão do comportamento de um agente terapêutico. Com o estresse sendo uma das principais variáveis de confusão na pesquisa com animais44 , 45 , 46 , 47 , a otimização de protocolos invasivos é crucial para o fator de 'refinamento' dos três R's48 e a capacidade de obter dados mais limpos que alimentam o componente de 'redução'.
Estudar a farmacocinética é crucial para a entrega segura e eficaz de qualquer terapêutica nova ou reaproveitada. Injetar uma vez ou repetidamente no sistema cerebral ventricular é um método insubstituível na neurofarmacologia translacional. Este protocolo pode ajudar no estudo de uma ampla variedade de medicamentos. Pode ser complementado pela injeção de corantes para imagem ou pode ser usado para manipular o ambiente do SNC, por exemplo, induzindo doenças específicas, como infecções cerebrais, para investigar o efeito terapêutico dos antibióticos.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Os autores agradecem ao Biomedical Science Animal Facility da Universidade de Melbourne pelo fornecimento e cuidado dos animais. Esta pesquisa foi apoiada por uma bolsa de pesquisa do Instituto Nacional de Alergia e Doenças Infecciosas do Instituto Nacional de Saúde (R01 AI146241, GR e TV). JL é um pesquisador principal do Australian National Health Medical Research Council (NHMRC). O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente as opiniões oficiais do Instituto Nacional de Alergia e Doenças Infecciosas ou do Instituto Nacional de Saúde.
Materiais
| Name | Company | Catalog Number | Comments |
| Acetone | Terumo, Japan | SS+01T | |
| 5 mL syringes | Terumo, Japan | SS+05S | |
| Acetone | Merck, Germany | 67641 | |
| Bench protector sheets | Halyard, USA | 2765-C | |
| Betadine | Mundipharma, Netherlands | 1015695 | |
| Buprenorphine; Temgesic | Clifford Hallam Healthcare, Australia | 1238366 | |
| Carprofen | Zoetis, Australia | 10001132 | |
| Chlorhexidine | Tasman Chemicals, Australia | 890401 | |
| Chux superwipes (or equivalent) | Chux, Australia | n/a | autoclaved |
| Clippers | n/a | n/a | |
| Cotton swabs | LP Italiana, Italy | 112191 | autoclaved |
| Dental cement powder (Vertex Self cure powder) | Henry Schein, USA | VX-SC500GVD5 | |
| Dental cement solvent (Vertex Self cure liquid) | Henry Schein, USA | VX-SC250MLLQ | |
| Disposable needles: 18 G, 26 G, 30 G | Terumo, Japan | NN+2525RL | |
| Disposable surgical blades | Westlab, Australia | 663-255 | |
| Dissector scissors | F.S.T. | 14082-09 | |
| Dummy cannulas | Bio Scientific, Australia | C313DC/SPC | cut to 4.05 to fit the guide cannula |
| Ethanol 80% | Merck, Australia | 10107 | |
| Evan's blue dye | Sigma | E2129 - 50G | |
| Eye lube | Clifford Hallam Healthcare, Australia | 2070491 | |
| Felt tip pen | Sharpie, USA | D-4236 | |
| Fibre optic light source | n/a | n/a | |
| Flattened needle (18 G) or similar to apply superglue | n/a | n/a | |
| Glass pipettes, pulled | Hirschmann Laborgeraete, Germany | 9100175 | |
| Glass syringe 10 uL | Hamilton, USA | 701 LT and 1701 LT | |
| Guide cannulas | Bio Scientific, Australia | C313G/SPC | 22 G, cut 4 mm below the pedestal for lateral ventricle cannulation in adult Sprague Dawley rats |
| Haemostat | |||
| Heat bead steriliser | Inotech, Switzerland | IS-250 | |
| Heat pad | n/a | n/a | |
| Hydrogen peroxide 3% | Perrigo, Australia | 11383 | |
| Induction chamber (Perspex 300 mm x 200 mm) | n/a | n/a | |
| Injector cannula | Bio Scientific, Australia | C313I/SPC | cut to fit the 4 mm cannula + 0.5 mm projection |
| Isoflurane | Clifford Hallam Healthcare, Australia | 2093803 | |
| Isoflurane vaporiser and appropriate scavenging system | n/a | n/a | |
| Medium size weighing boats | n/a | n/a | |
| Metal spatula | Met-App, Australia | n/a | |
| Micro syringe pump | New Era, USA | NE-300 | |
| Microdrill | RWD Life Science Co, China | 87001 | |
| Polymyxin B | Beta Pharma, China | 86-40302 | |
| Protein LoBind tubes, 0.5 mL | Eppendorf, Germany | Z666491 | |
| Ropivacaine 1%; Naropin | AstraZeneca, UK | PS09634 | |
| Scissors, large | F.S.T. | 14511-15 | |
| Scissors, small | F.S.T. | 14079-10 | |
| Screwdriver | n/a | n/a | |
| Screws | Mr. Specs, Australia | n/a | |
| Stereotaxic frame | RWD Life Science Co, China | n/a | Necessary components: rat ear bars, tooth bar, anaesthesia nose cone, arm with digital readout (X, Y, Z) and cannula holder |
| Sterile saline 0.9% | Baxter, USA | AHB1323 | |
| Super etch (37% phosphoric acid) gel | SDI Limited, Australia | 8100045 | |
| Superglue | UHU, Germany | n/a | |
| Tissue forceps with hooks | F.S.T. | 11027-12 | |
| Tubing, PE-50 | Bio Scientific, Australia | C313CT |
Referências
- Goldmann, E. E. Vitalfärbung am Zentralnervensystem. Beitrag zur Physio-Pathologie des Plexus chorioideus und der Hirnhäute. Königl. Akademie der Wissenschaften. , Berlin. (1913).
- Koziara, J. M., Lockman, P. R., Allen, D. D., Mumper, R. J. The blood-brain barrier and brain drug delivery. Journal of Nanoscience and Nanotechnology. 6 (9-10), 2712-2735 (2006).
- Davson, H. Review lecture. The blood-brain barrier. The Journal of Physiology. 255 (1), 1-28 (1976).
- Pandit, R., Chen, L., Götz, J. The blood-brain barrier: Physiology and strategies for drug delivery. Advanced Drug Delivery Reviews. 165-166, 1-14 (2020).
- Oldendorf, W. H., Hyman, S., Braun, L., Oldendorf, S. Z. Blood-brain barrier: Penetration of morphine, codeine, heroin, and methadone after carotid injection. Science. 178 (4064), 984-986 (1972).
- Abbott, N. J., Patabendige, A. A. K., Dolman, D. E. M., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2010).
- Velkov, T., Dai, C., Ciccotosto, G. D., Cappai, R., Hoyer, D., Li, J. Polymyxins for CNS infections: Pharmacology and neurotoxicity. Pharmacology & Therapeutics. 181, 85-90 (2018).
- Martin, J. A., Maris, A. S., Ehtesham, M., Singer, R. J. Rat Model of blood-brain barrier disruption to allow targeted neurovascular therapeutics. Journal of Visualized Experiments. (69), e50019(2012).
- KrolI, R. A., Neuwelt, E. A., Neuwelt, E. A. Outwitting the blood-brain barrier for therapeutic purposes: Osmotic opening and other means. Neurosurgery. 42 (5), 1083-1099 (1998).
- Wei, B., Qian, C., Liu, Y., Lin, X., Wan, J., Wang, Y. Ommaya reservoir in the treatment of cryptococcal meningitis. Acta Neurologica Belgica. 117 (1), 283-287 (2017).
- Zubair, A., Jesus, O. D. Ommaya reservoir. StatPearls [Internet]. , StatPearls Publishing. Available from: https://www.ncbi.nlm.nih.gov/books/NBK559011/ (2021).
- DeVos, S. L., Miller, T. M. Direct intraventricular delivery of drugs to the rodent central nervous system. Journal of Visualized Experiments. (75), e50326(2013).
- Ajoy, R., Chou, S. -Y. Studying the hypothalamic insulin signal to peripheral glucose intolerance with a continuous drug infusion system into the mouse brain. Journal of Visualized Experiments. (131), e56410(2018).
- Sajadi, A., Provost, C., Pham, B., Brouillette, J. Neurodegeneration in an animal model of chronic amyloid-beta oligomer infusion is counteracted by antibody treatment infused with osmotic pumps. Journal of Visualized Experiments. (114), e54215(2016).
- Rauschenberger, L., Knorr, S., Volkmann, J., Ip, C. W. Implantation of osmotic pumps and induction of stress to establish a symptomatic, pharmacological mouse model for DYT/PARK-ATP1A3 dystonia. Journal of Visualized Experiments. (163), e61635(2020).
- Cooper, J. D., Heppert, K. E., Davies, M. I., Lunte, S. M. Evaluation of an osmotic pump for microdialysis sampling in an awake and untethered rat. Journal of Neuroscience Methods. 160 (2), 269-275 (2007).
- Sharma, R. K., et al. Microglial cells impact gut microbiota and gut pathology in angiotensin II-induced hypertension. Circulation Research. 124 (5), 727-736 (2019).
- Kim, H. Y., Lee, D. K., Chung, B. -R., Kim, H. V., Kim, Y. Intracerebroventricular injection of amyloid-β peptides in normal mice to acutely induce alzheimer-like cognitive deficits. Journal of Visualized Experiments. (109), e53308(2016).
- Fukushima, A., Fujii, M., Ono, H. Intracerebroventricular treatment with resiniferatoxin and pain tests in mice. Journal of Visualized Experiments. (163), e57570(2020).
- Niaz, N., et al. Intracerebroventricular injection of histamine induces the hypothalamic-pituitary-gonadal axis activation in male rats. Brain Research. 1699, 150-157 (2018).
- Yokoi, H., Arima, H., Murase, T., Kondo, K., Iwasaki, Y. Intracerebroventricular injection of adrenomedullin inhibits vasopressin release in conscious rats. Neuroscience Letters. 216 (1), 65-70 (1996).
- Savci, V., Gürün, S., Ulus, I. H., Kiran, B. K. Intracerebroventricular injection of choline increases plasma oxytocin levels in conscious rats. Brain Research. 709 (1), 97-102 (1996).
- Sunter, D., Hewson, A. K., Dickson, S. L. Intracerebroventricular injection of apelin-13 reduces food intake in the rat. Neuroscience Letters. 353 (1), 1-4 (2003).
- Moreau, C., et al. Intraventricular dopamine infusion alleviates motor symptoms in a primate model of Parkinson's disease. Neurobiology of Disease. 139, 104846(2020).
- Calvo, P. M., de la Cruz, R. R., Pastor, A. M. A single intraventricular injection of VEGF leads to long-term neurotrophic effects in axotomized motoneurons. eNeuro. 7 (3), (2020).
- Choi, C. R., Ha, Y. S., Ahn, M. S., Lee, J. S., Song, J. U. Intraventricular or epidural injection of morphine for severe pain. Neurochirurgia. 32 (6), 180-183 (1989).
- Zhong, L., Shi, X. -Z., Su, L., Liu, Z. -F. Sequential intraventricular injection of tigecycline and polymyxin B in the treatment of intracranial Acinetobacter baumannii infection after trauma: A case report and review of the literature. Military Medical Research. 7 (1), 23(2020).
- Gross, P. M., Weaver, D. F. A new experimental model of epilepsy based on the intraventricular injection of endothelin. Journal of Cardiovascular Pharmacology. 22, Suppl 8 282-287 (1993).
- Nang, S. C., Azad, M. A. K., Velkov, T., Zhou, Q. Rescuing the last-line polymyxins: Achievements and challenges. Pharmacological Reviews. 73 (2), 679-728 (2021).
- Tsuji, B. T., et al. International Consensus Guidelines for the Optimal Use of the Polymyxins: Endorsed by the American College of Clinical Pharmacy (ACCP), European Society of Clinical Microbiology and Infectious Diseases (ESCMID), Infectious Diseases Society of America (IDSA), International Society for Anti-infective Pharmacology (ISAP), Society of Critical Care Medicine (SCCM), and Society of Infectious Diseases Pharmacists (SIDP). Pharmacotherapy. 39 (1), 10-39 (2019).
- Velkov, T., Roberts, K. D., Nation, R. L., Thompson, P. E., Li, J. Pharmacology of polymyxins: New insights into an "old" class of antibiotics. Future Microbiology. 8 (6), 711-724 (2013).
- Nation, R. L., et al. Dosing guidance for intravenous colistin in critically-ill patients. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 64 (5), 565-571 (2017).
- Nation, R. L., Velkov, T., Li, J. Colistin and polymyxin B: Peas in a pod, or chalk and cheese. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 59 (1), 88-94 (2014).
- Fornari, R. V., et al. Rodent stereotaxic surgery and animal welfare outcome improvements for behavioral neuroscience. Journal of Visualized Experiments. (59), e3528(2012).
- Molina-Cimadevila, M. J., Segura, S., Merino, C., Ruiz-Reig, N., Andrés, B., de Madaria, E. Oral self-administration of buprenorphine in the diet for analgesia in mice. Laboratory Animals. 48 (3), 216-224 (2014).
- Goldkuhl, R., Hau, J., Abelson, K. S. P. Effects of voluntarily-ingested Buprenorphine on plasma corticosterone levels, body weight, water intake, and behaviour in permanently catheterised rats. In Vivo. 24 (2), Athens, Greece. 131-135 (2010).
- Hestehave, S., Munro, G., Pedersen, T. B., Abelson, K. S. P. Antinociceptive effects of voluntarily ingested Buprenorphine in the hot-plate test in laboratory rats. Laboratory Animals. 51 (3), 264-272 (2017).
- Faesel, N., Schünemann, M., Koch, M., Fendt, M. Angiotensin II-induced drinking behavior as a method to verify cannula placement into the cerebral ventricles of mice: An evaluation of its accuracy. Physiology & Behavior. 232, 113339(2021).
- Elsevier. Neurotoxicity. Neurotoxicity | Elsevier Enhanced Reader. , (2021).
- Vuillemenot, B. R., Korte, S., Wright, T. L., Adams, E. L., Boyd, R. B., Butt, M. T. Safety evaluation of CNS administered biologics-study design, data interpretation, and translation to the clinic. Toxicological Sciences: An Official Journal of the Society of Toxicology. 152 (1), 3-9 (2016).
- Cerebrospinal fluid dynamics and intracranial pressure elevation in neurological diseases. , Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6456952/ (2021).
- Nau, R., Sörgel, F., Eiffert, H. Penetration of drugs through the blood-cerebrospinal fluid/blood-brain barrier for treatment of central nervous system infections. Clinical Microbiology Reviews. 23 (4), 858-883 (2010).
- Quagliarello, V. J., Ma, A., Stukenbrok, H., Palade, G. E. Ultrastructural localization of albumin transport across the cerebral microvasculature during experimental meningitis in the rat. The Journal of Experimental Medicine. 174 (3), 657-672 (1991).
- Reinhardt, V. Common husbandry-related variables in biomedical research with animals. Laboratory Animals. 38 (3), 213-235 (2004).
- Morton, L. D., Sanders, M., Reagan, W. J., Crabbs, T. A., McVean, M., Funk, K. A. Confounding factors in the interpretation of preclinical studies. International Journal of Toxicology. 38 (3), 228-234 (2019).
- Bailey, J. Does the stress of laboratory life and experimentation on animals adversely affect research data? A critical review. Alternatives to laboratory animals: ATLA. 46 (5), 291-305 (2018).
- Moberg, G. P., Mench, J. A. The Biology of Animal Stress: Basic Principles and Implications for Animal Welfare. , CABI. (2000).
- Russel, W. M. S., Burch, R. L. The principles of humane experimental technique principles. , Methuen & Co LTD. (1959).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados