Method Article
توصيل الأدوية داخل البطينات وأخذ العينات لدراسة الحركية الدوائية والديناميكا الدوائية
In This Article
Summary
يعد توصيل العلاجات مباشرة إلى الجهاز العصبي المركزي إحدى طرق التحايل على الحاجز الدموي الدماغي. يوضح البروتوكول الحالي الحقن داخل المخ البطيني للجمع اللاحق للسائل الدماغي النخاعي وأعضاء الجسم. هذا يسهل التحقيق في الحركية الدوائية للأدوية والديناميكا الدوائية في النماذج الحيوانية لتطوير علاجات جديدة.
Abstract
على الرغم من أن الحاجز الدموي الدماغي (BBB) يحمي الدماغ من الكيانات الغريبة ، إلا أنه يمنع أيضا بعض العلاجات من العبور إلى الجهاز العصبي المركزي (CNS) لتخفيف الأمراض أو العدوى. يتم إعطاء الأدوية مباشرة في الجهاز العصبي المركزي في والبشر للتحايل على BBB. يصف البروتوكول الحالي طريقة فريدة لعلاج التهابات الدماغ من خلال توصيل المضادات الحيوية داخل البطينين ، أي البولي ميكسين ، وهي المضادات الحيوية الأخيرة لعلاج البكتيريا سالبة الجرام المقاومة للأدوية المتعددة. تم تطوير بروتوكول جراحة تجسيمية مباشر لزرع قنية إرشادية تصل إلى البطين الجانبي في الفئران. بعد فترة نقاهة مدتها 24 ساعة ، يمكن حقن الفئران بوعي وبشكل متكرر من خلال قنية مثبتة على الدليل. يمكن توصيل الحقن يدويا كبلعة أو تسريب باستخدام مضخة حقن مجهرية للحصول على معدل تدفق بطيء ومضبوط. تم تأكيد الحقن داخل البطين بنجاح باستخدام صبغة إيفانز بلو. يمكن تصريف السائل الدماغي النخاعي (CSF) ، ويمكن جمع الدماغ والأعضاء الأخرى. هذا النهج قابل للتعديل إلى حد كبير للدراسات التي تنطوي على توصيل الدواء إلى الجهاز العصبي المركزي والتقييم اللاحق للنشاط الدوائي والديناميكي الدوائي.
Introduction
الحاجز الدموي الدماغي (BBB) هو آلية وقائية حاسمة للجهاز العصبي المركزي (الجهاز العصبي المركزي). يفصل الحاجز التشريحي القابل للاختراق الانتقائي الدم المتداول ومذابه عن السائل خارج الخلية في الدماغ ، وبالتالي يمنع معظم الجزيئات من دخول الدماغ1،2،3،4 ، اعتمادا على حجمها ، ومحبة الدهون5 ، وتوافر آلية نقل نشطة2.
هذا الحاجز الوقائي مفيد للتنظيم الفعال لتوازن الدماغ المعقد وصحة الجهاز العصبيالمركزي 4،6. ومع ذلك ، فإنه يجعل من الصعب أيضا توصيل الأدوية لعلاج الالتهابات في الدماغ أو أمراض الجهاز العصبي المركزيالأخرى 4،7. بصرف النظر عن تعطيل BBB باستخدام مجموعة متنوعة من الطرق8،9 ، فإن النهج الأساسي للتحايل على BBB هو توصيل الدواء مباشرة إلى الدماغ عن طريق إطلاقه في السائل الدماغي النخاعي (CSF) 4. على الرغم من أنها ممارسة جراحية نسبيا ، فقد تم استخدامها بنجاح لتقديم العلاجات المستهدفة للمرضى المختبر. في البشر ، يمكن توصيل الأدوية إلى الجهاز داخل البطين أو السائل الدماغي النخاعي ثم أخذ عينات منها لاحقا باستخدام خزان Ommaya ، وهو خزان موجود تحت فروة الرأس ، متصل بقسطرة يتم إدخالها في البطين الجانبي10،11. تم إنشاء تقنيات مماثلة في المختبر مثل القوارض لتحقيق أهداف مماثلة. تم زرع مضخات التناضح الدقيق في الفئران12،13،14،15 والجرذان16،17 لتوصيل الدواء المستمر إلى الجهاز البطيني أو حمة الدماغ. بالإضافة إلى ذلك ، تم إجراء الحقن المباشر داخل المخ البطيني في الفئران المخدرة باستخدام إبرة يمكن التخلصمنها 18،19 والجرذان الواعية عبر قنية مزروعة جراحيا20،21،22،23. كان توصيل الأدوية إلى الجهاز العصبي المركزي طريقة لا تقدر بثمن لتعزيز الفهم في مختلفالمجالات 20،24،25،26،27،28.
تعد عدوى الجهاز العصبي المركزي أحد هذه المجالات التي تحتاج بشكل عاجل إلى علاجات جديدة وفهم معزز للعلاجات المضادة للعدوى الحالية. العدوى الجهاز العصبي المركزي التي تسببها البكتيريا سالبة الجرام المقاومة للأدوية المتعددة مثيرة للقلقبشكل خاص 7. Polymyxins هي المضادات الحيوية الأخيرة التي تستخدم بشكل متزايد لعلاج الالتهابات بسبب هذه "الجراثيم الخارقة"29. عندما يتم إعطاء البولي ميكسين عن طريق الوريد وفقا لإرشادات الجرعاتالحالية 30 ، يكون اختراقها في الجهاز العصبي المركزي منخفضا جدا ، بينما تزيد الجرعات العالية من خطر السمية الكلوية. لذلك ، فإن العلاج بالبولي ميكسين عن طريق الوريد قليل الفائدة لعلاج التهابات الجهاز العصبيالمركزي 7. يعد إنشاء نظام جرعات آمن وفعال لتوصيل البولي ميكسين إلى الجهاز العصبي المركزي حاجة طبية ملحة لم تتم تلبيتها31،32،33. لذلك ، تم إنشاء البروتوكول الحالي ووصفه مع التركيز على حقن المضادات الحيوية مباشرة في السائل الدماغي النخاعي للفئران. ومع ذلك ، يمكن استخدامه لإدارة أي دواء غير سام للأعصاب وحيث يمكن إعطاء التركيزات العلاجية بكميات صغيرة (على سبيل المثال ، ما يصل إلى 10 ميكرولتر في الفئران). يمكن أيضا تعديل التقنيات الموصوفة لاستهداف مناطق مختلفة من الدماغ وتقديم حقن متعددة.
يقدم البروتوكول الحالي تقنية جراحة وحقن مباشرة تسمح بكفاءة الحركية الدوائية وتوزيع الأدوية بعد العلاج بفيروس المضافة المضافة. تتضمن الجراحة زرع قنية إرشادية. نظرا لأنه إجراء أقل توغلا من زرع مضخة تناضحية دقيقة12،13،14،15،16،17 ، فهذا خيار متقدم مناسب للإعطاء قصير المدى للأدوية في السائل الدماغي النخاعي. تم تبسيط هذا البروتوكول ويمكن أن ينتج معدلات بقاء عالية جدا وأوزان ثابتة للجسم بعد 24 ساعة من الجراحة ، وهو تحسن مقارنة بالطرق الحالية34. بعد الجراحة ، تلقت الفئران الواعية إما حقنة يدوية للجرعة ICV أو توصيل أبطأ باستخدام مضخة دقيقة لخفض تركيزات الذروة في البلازما. في الوقت نفسه ، يمكنهم التحرك بحرية في قفصهم. لإنشاء أنظمة جرعات دوائية آمنة وفعالة ، تم بعد ذلك استخدام عينات من السائل الدماغي النخاعي ، والدماغ ، والحبل الشوكي ، والكلى ، والبلازما ، وما إلى ذلك ، لدراسة الحركية الدوائية وتوزيع الأدوية بعد إعطاء داخل المخ البطيني (ICV). يمكن أيضا التحقيق في توزيع الأدوية بصريا ، على سبيل المثال ، باستخدام الكيمياء المناعية أو التصوير الكيميائي الكتلي بالامتصاص بالليزر / التأين بمساعدة المصفوفة (MALDI-MSI). إذا لزم الأمر ، يمكن زرع قنية ثنائية ، على سبيل المثال ، لحقن الأدوية التي من شأنها أن توزع من جانب واحد في نصفي الكرة الأرضية.
Protocol
أجريت جميع التجارب وفقا للقانون الأسترالي لرعاية واستخدامها للأغراض العلمية. تمت الموافقة على التجارب من قبل لجنة الأخلاقيات بجامعة ملبورن (التطبيق # 1914890). تم استخدام ذكور وإناث فئران Sprague-Dawley التي تتراوح أعمارها بين 8 و 14 أسبوعا في التجارب.
1. الجراحة التجسيمية لقنية البطين الجانبي
- استخدم أطراف قطنية معقمة وستائر جراحية أثناء الجراحة.
- قم بإعداد ما يلي للجراحة.
- قم بإعداد إطار تجسيمي ونظام توصيل التخدير والأدوية والمواد الكيميائية والمواد المساعدة (انظر جدول المواد). قم بتنظيف الإطار التجسيمي ، ومصدر ضوء الألياف البصرية ، والمثقاب المحمول ، وما إلى ذلك ، بنسبة 80٪ من الإيثانول.
- انقع قنية التوجيه 22 G والقنية الوهمية المرتبطة بها (انظر جدول المواد) في 80٪ من الإيثانول للتعقيم.
ملاحظة: قامت الشركة المصنعة بقص دليل 22 G والقنية الوهمية مسبقا إلى طول ~ 4 مم أسفل قاعدة التمثال. - تعقيم أدوات الجراحة (انظر جدول المواد) باستخدام معقم الخرزة الحرارية لمدة 20 ثانية ثم رشها بنسبة 80٪ من الإيثانول. ضع الأدوات المعقمة على الستارة المعقمة.
- قم بإعداد صندوق استرداد (صندوق مبيت للفئران مبطن بغطاء سفلي) مع وضع نصف الصندوق فوق وسادة تدفئة.
- إجراء الجراحة.
- قم بربط قنية التوجيه 22 G التي تم تنظيفها بالإيثانول في حامل القنية على الإطار التجسيمي.
- ضع الجرذ في غرفة الحث (300 مم × 200 مم ، انظر جدول المواد) وقم بتحفيز التخدير بنسبة 5٪ من الأيزوفلوران عند 1 لتر / دقيقة من الأكسجين.
- بمجرد تخدير الجرذ بعمق (لا يوجد رد فعل دواسة) ، انقل الجرذ إلى الإطار التجسيمي وقلل الأيزوفلوران إلى 2٪ -3٪ في 1 لتر / دقيقة من الأكسجين للصيانة من خلال مخروط الأنف. اربط الأسنان بقضيب اللدغة واسحب مخروط الأنف بحذر فوق الأنف - اسحب الجرذ برفق للخلف للتأكد من أنه آمن.
- ضعي مزلق واقي للعين على كلتا العينين لتجنب الجفاف.
- حقن كاربروفين (5 ملغم/كغ)، بوبرينورفين (0.05 ملغم/كجم) في محلول ملحي، و3 مل من محلول ملحي تحت الجلد (SC) للتحكم في الألم وللمساعدة في التعافي بعد الجراحة.
- اضغط على أصابع القدم للتحقق من رد فعل الدواسة. بمجرد غيابها ، قم بإصلاح جمجمة الفئران في الإطار. ضع قضيب أذن واحد في قناة الأذن وشده. كرر على الجانب الآخر.
- حرك أشرطة الأذن بشكل جانبي للتأكد من أن الأرقام الواردة على أشرطة الأذن متساوية على كلا الجانبين. يجب ألا يتحرك الرأس عند الضغط على الجمجمة.
- احلق الجزء العلوي من الرأس باستخدام مقص. امسحي الشعر بمنديل ورقي ومحلول ملحي. إذا لزم الأمر ، أعد وضع مزلق العين على كلتا العينين لتجنب الجفاف.
- امسح فروة الرأس بمحلول تحضير الكلورهيكسيدين والكحولي بنسبة 4٪ ، باستخدام مسحات قطنية معقمة لكل خطوة (انظر جدول المواد). ابدأ في وسط الجمجمة وتحرك في دوائر للخارج حتى يتم تنظيف السطح بالكامل.
- حقن ~ 150 ميكرولتر من Ropivacaine (1٪) s.c. (انظر جدول المواد) على طول موقع الشق المقصود.
- استخدم شفرة المشرط لعمل شق 10-15 مم على طول خط الوسط للرأس ، من بين العينين إلى قاعدة الجمجمة.
- استخدم أطراف القطن والمشرط لكشط النسيج الضام وفضح الجمجمة.
- اغمس طرفا من القطن المعقم في محلول بيروكسيد الهيدروجين بنسبة 3٪ وضعه على سطح الجمجمة. انتظر لمدة 5 ثوان حتى تتفاعل المادة الكيميائية مع الجلد ، ثم نظف المنطقة بطرف قطني جاف.
- ضع 3٪ بيروكسيد الهيدروجين للمرة الثانية. سيؤدي ذلك إلى ظهور خطوط خياطة الجمجمة بشكل أكثر وضوحا. انتظر لمدة 10 ثوان حتى تتفاعل المادة الكيميائية مع الجلد ، ثم نظف المنطقة برأس قطني جاف. يغسل بمحلول ملحي ويجفف برأس قطني نظيف.
- ضع كمية صغيرة من جل الحفر الفائق بعناية على طرف قطني ثم ضعه على سطح الجمجمة. هذا يخلق سطحا أكثر مسامية لتلتصق به أسمنت الأسنان.
- ضعي كمية وفيرة من المحلول الملحي على الجمجمة لغسل النقش الفائق وتجفيفه برأس قطني نظيف.
- حدد بريجما وقم بتمييزه باستخدام قلم طرف اللباد.
- قم بحفر مسافة بادئة لبرغي التثبيت في مكان لا يعيق وضع قنية التوجيه.
ملاحظة: إذا كان البطين الجانبي الأيمن مقندا ، فقم بالحفر في نصف الكرة الأيسر والخلف بالنسبة للبطنين. - أمسك المثقاب بزاوية ~ 75 درجة -80 درجة على الجمجمة وحفر مسافة بادئة ببطء بعمق حوالي نصف سمك الجمجمة. استخدم المحلول الملحي على طرف قطني لمسح غبار العظام.
- أدخل المسمار بعناية عن طريق تثبيته بإحكام في المسافة البادئة باستخدام ملقط وربطه في الجمجمة باستخدام مفك البراغي ، وتجنب كسر الجمجمة. بعد كل منعطف كامل ، اختبر ما إذا كان المسمار يجلس بإحكام.
- تأكد من أن الجمجمة مسطحة. باستخدام الأذرع المتحركة للإطار ، ضع قنية التوجيه للمس الجمجمة عند بريجما. قم بتصفير DV (الظهري البطني) الذي يمثل إحداثيات المستوى Z بالضغط على الزر الموجود على شاشة التحكم في الإطار.
- ارفع قنية التوجيه (22 جم وطولها 4 مم) باستخدام الأذرع المتحركة للإطار وانقلها إلى لامدا. قم بخفضه بحيث يلامس سطح الجمجمة ولاحظ شاشة DV مرة أخرى.
ملاحظة: يجب أن يكون الفرق بين DV في bregma و DV في lambda أقل من 0.2 مم. إذا لزم الأمر ، اضبط مخروط الأنف وفقا لذلك ، أي حرك رأس الفئران لأعلى أو لأسفل حسب الحاجة ، وكرر القياسات. - حرك قنية التوجيه مرة أخرى للمس بريجما وأعد تصفير الإحداثيات الثلاثة: DV و AP (الأمامي الخلفي) و ML (الجانبي الإنسي) بالضغط على الأزرار الموجودة على الشاشة.
- انقل قنية الدليل إلى إحداثيات الاختيار المحددة مسبقا.
ملاحظة: بالنسبة لقنية البطين الجانبي الأيمن في فأر بالغ 300-350 جم ، تم استخدام الإحداثيات التالية: -0.7 مم AP ، -1.4 مم مل ، و -4.00 مم DV (نفس طول قنية الدليل). - ضع علامة على موضع القنية النهائي عن طريق تلوين نهاية القنية باستخدام قلم التحديد ثم خفضها إلى سطح الجمجمة للمس الموضع وتحديده.
- قم بحفر حفرة بقطر 2.3 مم لقنية التوجيه 22 G عن طريق تثبيت عمود الحفر في وضع رأسي مستقيم ، أي بزاوية 90 درجة على التمجفة. احرص على التحرك ببطء وتدريجي في عمق الجمجمة ، أي تجنب الحفر في أنسجة المخ.
ملاحظة: إذا لزم الأمر ، قم بخفض القنية في الحفرة باستخدام الذراع التجسيمي المتحرك لاختبار ما إذا كان يمكن وضع القنية بنجاح أو إذا كانت هناك حاجة إلى مزيد من الحفر. - بمجرد إنزال القنية في الدماغ ، ارفعها مرة أخرى ، وقم بتطبيق الغراء الفائق بعناية على الجانب السفلي من قاعدة التمثال البلاستيكية للقنية وقم بخفض القنية مرة أخرى في الفتحة باستخدام الذراع المتحركة للإطار التجسيمي.
- اتركيه في مكانه للسماح للغراء بالتماسك.
- أثناء الانتظار ، اخلطي مذيب الأسنان والمسحوق (انظر جدول المواد) في قارب وزن. صب مسحوق أسمنت الأسنان في قارب الوزن ، واستخدم حقنة 1 مل لإضافة ~ 300 ميكرولتر من المذيب ، واخلطه باستخدام نفس المحقنة حتى تتكاثف وتصبح ذات قوام قابل للاستخدام. إذا لزم الأمر ، أضف المزيد من المسحوق لزيادة اللزوجة أو المزيد من المذيبات لتقليل اللزوجة.
- حرر القنية من حامل القنية باستخدام المسمار المخصص وارفع الذراع بعناية.
ملاحظة: يجب لصق القنية على الجمجمة بزاوية 90 درجة. - ضع أسمنت الأسنان الطازج على الجمجمة المكشوفة عن طريق سحبه لأعلى في المحقنة التي تستخدم لمرة واحدة سعة 1 مل وتطبيقه حول القنية. تجنب أي أسمنت أسنان على الجلد أو فتحة القنية. اتركه لبضع ثوان ، اعتمادا على قوامه.
- عندما يصبح الأسمنت السني أكثر سمكا ، استخدم ملعقة لتطبيق المزيد من الأسمنت للأسنان وتشكيل حامل الرأس النهائي الذي يغطي المسمار بالكامل.
ملاحظة: احرص على عدم تغطية الكثير من القنية حتى لا يزال من الممكن تثبيت القنية الوهمية. قم بإزالة أي أسمنت أسنان زائد من الجلد. - أدخل قنية وهمية معقمة بمجرد أن يجف أسمنت الأسنان وثابتا.
- قم بإيقاف تشغيل الأيزوفلوران ، وحرر قضبان الأذن ، وقم بإزالة الجرذ من الإطار وضعه في صندوق الاسترداد.
- بمجرد أن يتعافى ~ 15-30 دقيقة ، ضعه في صندوق سكن نظيف.
ملاحظة: بعد الجراحة ، يجب أن تكون الفئران في منزل واحد. ضع في اعتبارك استبدال أسطح القفص الشبكي القياسية حيث ينخفض قادوس الطعام في القفص بقمم قفص شبكية مخصصة عالية الارتفاع لتقليل مخاطر التداخل مع حامل الرأس. بدلا من ذلك ، قم بسد أي أجزاء من القفص أقل بكثير من ارتفاع تربية. - املأ قائمة مراجعة المراقبة وراقبها وفقا لإرشادات المراقبة الموضحة في البروتوكول.
ملاحظة: ضع في اعتبارك وضع بعض كريات الطعام على الأرض لتسهيل الوصول إليها. إذا لم يتداخل مع التجربة ، فيمكن توفير تسكين إضافي للألم في الطعام الحلو ليحل محل حقن SC الإضافية بعد الجراحة ، على سبيل المثال ، بوبرينورفين ممزوج بمعجون الشوكولاتة الحلو35،36،37. في هذه الحالة ، تم تقديم بعض من نفس الحلوى كمكافأة قبل الجراحة وبعدها لتجنب رهاب الطعام الجديد عند تقديم تخفيف الآلام. يمكن توفير معجون الجوز على شريط متصل بجدار القفص. - قم بتخزين المزيد من القنيات الوهمية أكثر من قنيات التوجيه أو قنيات الحقن ، حيث يمكن أن تضيع بين فراش قفص إذا خرجت عن طريق الخطأ. في حالة حدوث مثل هذا الحدث ، استبدل القنية بقنية وهمية جديدة معقمة.
2. حقن القيمة المحلية المضافة
- تحضير الدواء والمركبة ، على سبيل المثال ، 30 مجم / مل من Polymyxin B (انظر جدول المواد) في محلول ملحي معقم بنسبة 0.9٪. حافظ على حجم الحقن بين 5-10 ميكرولتر في الفئران البالغة التي يتراوح وزنها بين 300-400 جم.
- بعد 24 ساعة على الأقل من الجراحة ، قم بوزن الجرذ ونقله إلى غرفة الإجراءات.
- احسب حجم الحقن باستخدام وزن جسم الفئران.
- قم بإزالة غطاء القفص وفك القنية الوهمية.
ملاحظة: عادة ما تجلس الفئران ساكنة عند حملها برفق في قفصها ولا تحتاج إلى ضبط النفس. يمكن استخدام منشفة الشاي لفأر فضولي أو عصبي أو دغدغة في عظام الخد. - لحقن البلعة، قم بتوصيل أنبوب PE-50 (انظر جدول المواد) بطول 40 سم على الأقل بحقنة مجهرية محكمة الغلق بالغاز سعة 10 ميكرولتر عن طريق سحب أحد طرفي الأنبوب فوق الإبرة الثابتة أو القابلة للإزالة على المحقنة وضمان إحكام الإغلاق. قم بتوصيل قنية الحاقن المجهزة على الطرف الآخر من الأنبوب.
- ارسم الكمية المطلوبة من خلال القنية. أدخل القنية في الدليل حتى يتم تركيبها وحقنها. بمجرد حقن كل السائل ، أمسك مكبس المحقنة في مكانه لمدة دقيقة إضافية على الأقل لتجنب التدفق العكسي.
- للحصول على معدل توصيل أبطأ، قم بحقن الأدوية باستخدام مضخة الحقن المجهري (انظر جدول المواد).
- أولا ، استخدم الماء المصفى وحقنة 1 مل يمكن التخلص منها مع إبرة سحب 23 جم لملء أنبوب PE-50 بالكامل. ثم قم بإزالة المحقنة التي تستخدم لمرة واحدة من إبرة الرسم واستبدلها بالمحقنة الدقيقة.
- اسحب 1-3 ميكرولتر لإنشاء فقاعة هواء صغيرة ولكنها مرئية. ثم قم بإعداد الكمية المطلوبة من الأدوية. اختياريا ، ضع علامة على فقاعة الهواء بعلامة للمساعدة في رؤية تدفق الدواء. قفل المحقنة في مكانها على المضخة.
ملاحظة: تأكد من الإعدادات الصحيحة للأدوية والمعدات المستخدمة ، أي اضبط سرعة التسليم والقطر الداخلي للحقنة المستخدمة وفقا لدليل المستخدم.
- بمجرد حقن كل السائل ، أوقف المضخة إذا لم تتوقف تلقائيا. اترك الإبرة مدخلة لمدة دقيقة إضافية على الأقل لتجنب التدفق العكسي.
- قم بإزالة قنية الحاقن ببطء وقم بربط قنية التوجيه.
- قم بتنظيف الجهاز عن طريق سحب وإخراج الإيثانول وماء DI ثلاث مرات لكل منهما.
3. السائل الدماغي النخاعي وأخذ عينات الأنسجة
- انقل الجرذ إلى غرفة الإجراءات.
- ضع الجرذ في غرفة الحث وقم بالتخدير بنسبة 5٪ من الأيزوفلوران في 2 لتر / دقيقة من الأكسجين حتى يتباطأ التنفس (~ 5 دقائق).
- حرك الجرذ إلى الإطار التجسيمي وحافظ على نفس المستوى من التخدير العميق من خلال مخروط الأنف.
- تحقق من وجود منعكس الدواسة. بمجرد غيابها ، قم بإصلاح الجمجمة في الإطار باستخدام قضبان الأذن.
ملاحظة: يمكن أن يكون هذا إطارا مجسيما أبسط بدون شاشة عرض أو قضبان أذن مستديرة أو أذرع متحركة. هذا إجراء غير متعاف. الميزة الوحيدة الضرورية هي أي قضبان أذن الفئران. - باستخدام مخروط الأنف ، قم بزاوية أنف الجرذ لأسفل عند حوالي 45 درجة لتعريض الرقبة لوضع عمل جيد.
- باستخدام مقص صغير غير حاد ومنحني ، تحسس الجمجمة وتحرك للخلف إلى نهاية الجمجمة. في هذا الوضع ، قم بقص الطبقة العضلية الخارجية مباشرة من خلال خط الوسط للرقبة ، بطول حوالي 2-3 سم. قطع بعناية من خلال جميع طبقات العضلات الأخرى.
- استخدم ضام زنبركي صغير لفتح الجرح والسماح برؤية جيدة. قطع حتى يصبح غشاء الصهريج ماجنا مرئيا. استخدمي طرفا قطنيا للمساعدة في إزالة المزيد من الجلد برفق.
- في حالة حدوث نزيف ، استخدم الشاش لتنظيف النزيف وإيقافه.
- إذا لزم الأمر ، استخدم شرائح صغيرة من المناديل الملفوفة وضعها حول صهريج ماجنا لتجنب تلويث أي دم بالسائل الدماغي النخاعي.
ملاحظة: لتأكيد نجاح الحقن باستخدام الصبغة ، قم بحقن 2-3 ميكرولتر من صبغة إيفانز الزرقاء 1.1٪ (انظر جدول المواد) في الجرذ المخدر قبل جمع السائل الدماغي النخاعي باستخدام القنية المجهزة وحقنة 1 مل يمكن التخلص منها. - لتحضير أداة استخراج السائل الدماغي النخاعي ، املأ المحقنة ب ~ 500 ميكرولتر من الماء المصفى ، وقم بإرفاق إبرة سحب 23 جم واسحب الأنبوب فوق الإبرة. قم بتوصيل ماصة زجاجية مسحوبة بالطرف الآخر من الأنبوب.
- لاستخراج السائل النخاعي ، أدخل الماصة المسحوبة ببطء في الصهريج المكشوف.
ملاحظة: سوف يتدفق السائل الدماغي النخاعي ببطء وبشكل سلبي إلى الماصة ويتم سحبه بنشاط باستخدام المحقنة. إذا تم حقن الصبغة ، تلوين السائل الدماغي النخاعي باللون الأزرق (الشكل 1). - أضف السائل الدماغي النخاعي إلى أنبوب مسمى وضعه على الفور على الثلج الجاف. يمكن بعد ذلك تخزين السائل الدماغي النخاعي عند -80 درجة مئوية.
- اجمع أي أنسجة أخرى ذات أهمية لتحليلها. بالنسبة للبلازما، اجمع ما لا يقل عن 3 مل من دم القلب.
- ضع الجرذ المخدر بعمق على ظهره وافتح تجويف الصدر لكشف القلب. استخدم hemostat لتثبيت القفص الصدري ووضعه على حلق للمساعدة في الرؤية. استخدم ملقط الأنسجة مع خطافات لتثبيت البطين الأيمن وأدخل حقنة يمكن التخلص منها سعة 5 مل بإبرة 18 جم في البطين الأيسر بالتوازي مع الحاجز. اسحب الدم ببطء إلى المحقنة. بمجرد جمع 3-5 مل من الدم ، قم بإزالة الإبرة من القلب.
- أخرج الإبرة من المحقنة وضعها في وعاء حاد. انقل الدم إلى أنابيب هيبارين وقم بالدوران عند 2,739 × جم و 4 درجات مئوية لمدة 15 دقيقة قبل جمع المادة الطافية بماصة سعة 200 ميكرولتر وقم بالتجميد المفاجئ على الثلج الجاف.
- قتل الجرذ عن طريق إزالة القلب بالمقص. قم بإيقاف تشغيل إمدادات الأيزوفلوران.
- اجمع أي أعضاء أخرى في البطن تهم، مثل الكلى أو الطحال. حدد العضو ، وامسك العضو محل الاهتمام بملقط الأنسجة بخطافات ، وارفعه وقطع أي مرفقات. ضع العضو في أنبوب مسمى وقم بتجميده على الثلج الجاف.
- لإزالة الدماغ ، اقطع رأس بمقص حاد وكبير عن طريق قطع قاعدة الجمجمة. اسحب حامل الرأس يدويا. اقطع الجلد المتبقي الذي يغطي الجمجمة.
- باستخدام مقص التشريح ، قم بقص الجمجمة عند خط الوسط من القاعدة إلى لامدا ، أي قطع العظم فوق القذالي إلى النصف. استخدم hemostat للإمساك بالنصف وإزالته بعيدا. كرر على الجانب الآخر لفضح المخيخ بالكامل.
- استمر في القطع على طول الخيط السهمي حتى العظم الأمامي. استخدم hemostat لإزالة كل عظمة من العظام الجدارية. إذا لزم الأمر ، قم بقص العظم الأمامي أكثر وإزالة المزيد من العظام لكشف البصيلات الشمية.
- امسك الرأس رأسا على عقب وانزع الدماغ بعناية باستخدام ملعقة ، وافصله عن الأعصاب البصرية وثلاثية التوائم عن طريق قطعها باستخدام الملعقة. اجمع الدماغ في أنبوب وقم بتجميده على الثلج الجاف.
- سيتم تلطيخ بطينات الدماغ باللون الأزرق إذا تم حقن الصبغة. استخدم شفرة يمكن التخلص منها لقطع الدماغ في موقع الحقن (الشكل 2 أ ، ب) و ~ 1 سم للخلف (الشكل 2 ج) للتحقيق في توزيع الصبغة في البطينين.
- لإزالة الحبل الشوكي ، قم بتعريض العمود الفقري عن طريق قطع الجلد على طول خط الوسط للسطح الظهري للفئران. استئصال عمود الفقاريات عن طريق عمل شق ثنائي حوله وقطعه بشكل عرضي في الطرف الذيلي للحبل الشوكي القطني.
- اقطع الصفيحة بشكل ثنائي على طول العمود باستخدام المقص حتى ينكشف الحبل الشوكي بالكامل. ارفع الحبل الشوكي من أحد طرفيه ، على سبيل المثال ، الطرف المنقاري ، واستخرجه عن طريق شق الأعصاب الشوكية في اتجاه ذيلية حتى يتم قطع جميع الأعصاب. اجمع الحبل الشوكي في أنبوب وقم بتجميده على الثلج الجاف.
ملاحظة: قم بوزن جميع الأنابيب قبل وبعد جمع الأعضاء لتحليل البيانات. إذا لزم الأمر ومناسب، يمكن غسل الجهاز البطيني بعد جمع السائل الدماغي النخاعي وقبل جمع الدماغ لإزالة الأدوية المتبقية في الأجزاء البطينية. استخدم حقنة سعة 1 مل مملوءة بمحلول ملحي متصل بالأنبوب وقنية حاقن وأدخلها في قنية التوجيه. حقن 2-3 مل من المحلول الملحي. يجب أن يخرج المحلول الملحي من الفتحة في صهريج ماجنا. يمكن إعادة استخدام قنيات التوجيه والقنيات الوهمية والبراغي عن طريق نقعها في الأسيتون لمدة 24 ساعة ، متبوعا بنقعها وتنظيفها بمنظفات طبية وماء. بمجرد التجفيف ، يمكن إزالة الأسمنت السني المتبقي باستخدام ملقط دقيق.
النتائج
البروتوكول الجراحي المقدم ناجح للغاية ، حيث وصل الجراحون المدربون إلى >99.8٪ من معدل البقاء على قيد الحياة وأظهرت وزن الجسم الثابت بعد الجراحة في اليوم الأول ، مقارنة بوزنها قبل الجراحة في اليوم 0 (متوسط ± SD من 315.8 جم ± 42.1 جم لليوم 0 و 314.1 جم ± 43.0 جم لليوم 1 ، الشكل 3).
قبل جمع السائل الدماغي النخاعي ، يمكن أن يساعد حقن صبغة إيفانز الزرقاء بنسبة 1.1٪ في القنية المزروعة كتأكيد على تسليم الحقن إلى الموقع المقصود. سيكون السائل الدماغي النخاعي الذي تم جمعه أزرق اللون (الشكل 1) ، وكذلك الجهاز البطيني في أنسجة المخ (الشكل 2).
كانت الطريقة مفيدة لدراسة كاملة للحركية الدوائية ، مع أخذ عينات في نقاط زمنية مختلفة بعد الجراحة.

الشكل 1: جمع السائل الدماغي النخاعي بعد حقن صبغة إيفانز الزرقاء (1.1٪) في الفئران المخدرة لتأكيد موقع القنية. يتم استخراج السائل الدماغي النخاعي باستخدام ماصة زجاجية مسحوبة (A) ثم يتم جمعها في أنبوب للتجميد والتخزين المفاجئ (B). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تتبع مواد الحقن في بطينين الدماغ بصبغة إيفان الزرقاء. يتم تقطيع الأدمغة بأكملها بشفرة في موقع الحقن (A ، B) أو في مواقع خلفية (C) لتأكيد الحقن الناجح في الجهاز البطيني. شريط المقياس (B) = 1 مم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
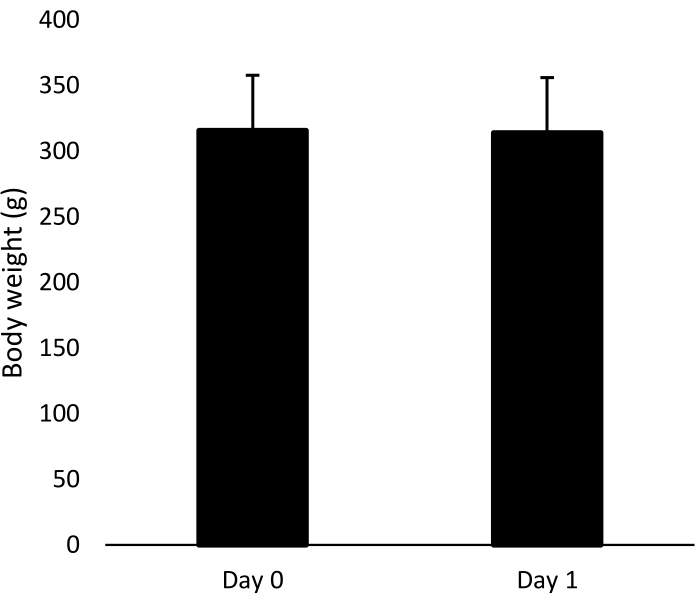
الشكل 3: وزن جسم الممثلة. متوسط وزن الجسم (+ SD) ل n = 174 ممثلا (19 مجموعة) قبل الجراحة (اليوم 0) وفي يوم حقن القيمة المحلية المضافة (اليوم 1). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يستخدم الباحثون والأطباء حقن القيمة المحلية المضافة للتحايل على آلية الحماية ل BBB وتوصيل الأدوية مباشرة إلى الجهاز العصبيالمركزي 12،18،19،21،24. العمل الحالي عبارة عن بروتوكول كامل للفيروس الدولي للمركبات لتوصيل الأدوية بكفاءة إلى الجهاز العصبي المركزي واستخراج السائل الدماغي النخاعي لتحليل الحرائك الدوائية. في بداية التجربة ، عندما يتم إنشاء هذا البروتوكول في المختبر ، يمكن تأكيد موقع الحقن عن طريق إعطاء صبغة إيفانز الزرقاء من خلال القنية المزروعة. هذا مفيد ومهم بشكل خاص إذا تم استخدام سلالة أو عمر مختلف من الفئران ، حيث يمكن استخدام إحداثيات مختلفة. خيار بديل يمكن استخدامه في التجارب هو حقن الأنجيوتنسين الثاني ومراقبة سلوك شرب بعد ذلك. ومع ذلك ، فإن هذه الطريقة أقل موثوقية38.
يمكن أن تكون السمية العصبية الناجمة عن المخدرات عاملا مقيدا لتوصيل القيمة المحليةالمضافة 39. ومع ذلك ، فإن تقليل معدل توصيل الدواء يمكن أن يقلل بشكل كبير من الأحداث الضائرة40. هذه الطريقة غير مناسبة للأدوية التي لا يمكن فيها إعطاء جرعة علاجية بكميات صغيرة على مدى فترات قصيرة ، مثل <10 ميكرولتر في <1 ساعة في الفئران. يمكن تعديل فوج الجرعة لإعطاء العلاجات بجرعة واحدة أو على مدى عدة أيام.
يمكن أن تكشف دراسات التصوير للأدمغة بأكملها أو تحليل أقسام الدماغ المقطعة عن خصائص توزيع الدواء. تعد دراسة توزيع الدواء الذي يتم تناوله داخل البطين أمرا بالغ الأهمية لتحليل الحرائك الدوائية مثل LC-MS. لا تزال ديناميكيات التدفق الدقيق للمركبات السائلة الدماغية النخاعي قيد التحقيق والمناقشة41. ومع ذلك ، فإن الخصائص التشريحية داخل الجهاز العصبي المركزي والخصائص الفيزيائية والكيميائية للدواء المحقون يمكن أن تعيق توزيع الأدوية بالتساوي داخل الجهاز العصبي المركزي وحتى بين مقصورات السائل الدماغي النخاعيالمختلفة 42. أيضا ، يمكن أن تؤثر حالة الاهتمام نفسها على التوزيع ، على سبيل المثال ، يمكن أن يصبح الحاجز الدموي الدموي / الحاجز الدموي الدماغي متسربا في المرضى والجرذان المصابين بالتهاب السحايا42،43. وبالتالي، يوصى بالتحقيق في كل دواء وتوزيعه لكل حالة ذات صلة. إذا تبين أن العلاج قيد التحقيق يوزع من جانب واحد ، أي لا يعبر بكفاءة إلى نصف الكرة الآخر ، فقد يفكر الباحثون في زرع قنيات ثنائية عن طريق تعديل طريقة الجراحة الموصوفة.
باستخدام هذا البروتوكول ، يمكن للجراحين ذوي الخبرة تحقيق معدلات بقاء عالية جدا وأوزان ثابتة للجسم في. يعد هذا تحسينا مقارنة بالبروتوكولات السابقة ، والتي اقترح أحدها التخدير بالاستنشاق كتحسن محتمل لرفاهية مقارنة بمتوسط معدل عدم البقاء على قيد الحياة المبلغ عنه البالغ 2٪ 34. يمكن الجمع بين هذا التقدم والإدارة الذاتية للمسكن طفيف التوغل من خلال الطعام35،36،37. ينتج عن هذا شرط أساسي محسن لرعاية الجيدة وفهم سلوك العامل العلاجي. نظرا لكون الإجهاد أحد المتغيرات المربكة الرئيسية في الأبحاث على44،45،46،47 ، فإن تحسين البروتوكولات الغازية أمر بالغ الأهمية لعامل "التنقيح" لثلاثة R48 والقدرة على الحصول على بيانات أنظف تغذي مكون "التخفيض".
تعد دراسة الحركية الدوائية أمرا بالغ الأهمية للتسليم الآمن والفعال لأي علاج جديد أو معاد استخدامه. يعد الحقن لمرة واحدة أو بشكل متكرر في نظام الدماغ البطيني طريقة لا يمكن الاستغناء عنها في علم الأدوية العصبية الانتقالية. يمكن أن يساعد هذا البروتوكول في دراسة مجموعة متنوعة من الأدوية. يمكن استكماله عن طريق حقن الأصباغ للتصوير أو يمكن استخدامه لمعالجة بيئة الجهاز العصبي المركزي ، على سبيل المثال ، عن طريق إحداث أمراض معينة مثل التهابات الدماغ للتحقيق في التأثير العلاجي للمضادات الحيوية.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
يشكر المؤلفون مرفق العلوم الطبية الحيوية للحيوانات في جامعة ملبورن على توفير ورعايتها. تم دعم هذا البحث من خلال منحة بحثية من المعهد الوطني للحساسية والأمراض المعدية التابع للمعهد الوطني للصحة (R01 AI146241 ، GR ، والتلفزيون). JL هو زميل باحث رئيسي في المجلس الوطني الأسترالي للبحوث الطبية الصحية (NHMRC). المحتوى هو مسؤولية المؤلفين فقط ولا يمثل بالضرورة وجهات النظر الرسمية للمعهد الوطني للحساسية والأمراض المعدية أو المعهد الوطني للصحة.
Materials
| Name | Company | Catalog Number | Comments |
| Acetone | Terumo, Japan | SS+01T | |
| 5 mL syringes | Terumo, Japan | SS+05S | |
| Acetone | Merck, Germany | 67641 | |
| Bench protector sheets | Halyard, USA | 2765-C | |
| Betadine | Mundipharma, Netherlands | 1015695 | |
| Buprenorphine; Temgesic | Clifford Hallam Healthcare, Australia | 1238366 | |
| Carprofen | Zoetis, Australia | 10001132 | |
| Chlorhexidine | Tasman Chemicals, Australia | 890401 | |
| Chux superwipes (or equivalent) | Chux, Australia | n/a | autoclaved |
| Clippers | n/a | n/a | |
| Cotton swabs | LP Italiana, Italy | 112191 | autoclaved |
| Dental cement powder (Vertex Self cure powder) | Henry Schein, USA | VX-SC500GVD5 | |
| Dental cement solvent (Vertex Self cure liquid) | Henry Schein, USA | VX-SC250MLLQ | |
| Disposable needles: 18 G, 26 G, 30 G | Terumo, Japan | NN+2525RL | |
| Disposable surgical blades | Westlab, Australia | 663-255 | |
| Dissector scissors | F.S.T. | 14082-09 | |
| Dummy cannulas | Bio Scientific, Australia | C313DC/SPC | cut to 4.05 to fit the guide cannula |
| Ethanol 80% | Merck, Australia | 10107 | |
| Evan's blue dye | Sigma | E2129 - 50G | |
| Eye lube | Clifford Hallam Healthcare, Australia | 2070491 | |
| Felt tip pen | Sharpie, USA | D-4236 | |
| Fibre optic light source | n/a | n/a | |
| Flattened needle (18 G) or similar to apply superglue | n/a | n/a | |
| Glass pipettes, pulled | Hirschmann Laborgeraete, Germany | 9100175 | |
| Glass syringe 10 uL | Hamilton, USA | 701 LT and 1701 LT | |
| Guide cannulas | Bio Scientific, Australia | C313G/SPC | 22 G, cut 4 mm below the pedestal for lateral ventricle cannulation in adult Sprague Dawley rats |
| Haemostat | |||
| Heat bead steriliser | Inotech, Switzerland | IS-250 | |
| Heat pad | n/a | n/a | |
| Hydrogen peroxide 3% | Perrigo, Australia | 11383 | |
| Induction chamber (Perspex 300 mm x 200 mm) | n/a | n/a | |
| Injector cannula | Bio Scientific, Australia | C313I/SPC | cut to fit the 4 mm cannula + 0.5 mm projection |
| Isoflurane | Clifford Hallam Healthcare, Australia | 2093803 | |
| Isoflurane vaporiser and appropriate scavenging system | n/a | n/a | |
| Medium size weighing boats | n/a | n/a | |
| Metal spatula | Met-App, Australia | n/a | |
| Micro syringe pump | New Era, USA | NE-300 | |
| Microdrill | RWD Life Science Co, China | 87001 | |
| Polymyxin B | Beta Pharma, China | 86-40302 | |
| Protein LoBind tubes, 0.5 mL | Eppendorf, Germany | Z666491 | |
| Ropivacaine 1%; Naropin | AstraZeneca, UK | PS09634 | |
| Scissors, large | F.S.T. | 14511-15 | |
| Scissors, small | F.S.T. | 14079-10 | |
| Screwdriver | n/a | n/a | |
| Screws | Mr. Specs, Australia | n/a | |
| Stereotaxic frame | RWD Life Science Co, China | n/a | Necessary components: rat ear bars, tooth bar, anaesthesia nose cone, arm with digital readout (X, Y, Z) and cannula holder |
| Sterile saline 0.9% | Baxter, USA | AHB1323 | |
| Super etch (37% phosphoric acid) gel | SDI Limited, Australia | 8100045 | |
| Superglue | UHU, Germany | n/a | |
| Tissue forceps with hooks | F.S.T. | 11027-12 | |
| Tubing, PE-50 | Bio Scientific, Australia | C313CT |
References
- Goldmann, E. E. Vitalfärbung am Zentralnervensystem. Beitrag zur Physio-Pathologie des Plexus chorioideus und der Hirnhäute. Königl. Akademie der Wissenschaften. , Berlin. (1913).
- Koziara, J. M., Lockman, P. R., Allen, D. D., Mumper, R. J. The blood-brain barrier and brain drug delivery. Journal of Nanoscience and Nanotechnology. 6 (9-10), 2712-2735 (2006).
- Davson, H. Review lecture. The blood-brain barrier. The Journal of Physiology. 255 (1), 1-28 (1976).
- Pandit, R., Chen, L., Götz, J. The blood-brain barrier: Physiology and strategies for drug delivery. Advanced Drug Delivery Reviews. 165-166, 1-14 (2020).
- Oldendorf, W. H., Hyman, S., Braun, L., Oldendorf, S. Z. Blood-brain barrier: Penetration of morphine, codeine, heroin, and methadone after carotid injection. Science. 178 (4064), 984-986 (1972).
- Abbott, N. J., Patabendige, A. A. K., Dolman, D. E. M., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2010).
- Velkov, T., Dai, C., Ciccotosto, G. D., Cappai, R., Hoyer, D., Li, J. Polymyxins for CNS infections: Pharmacology and neurotoxicity. Pharmacology & Therapeutics. 181, 85-90 (2018).
- Martin, J. A., Maris, A. S., Ehtesham, M., Singer, R. J. Rat Model of blood-brain barrier disruption to allow targeted neurovascular therapeutics. Journal of Visualized Experiments. (69), e50019(2012).
- KrolI, R. A., Neuwelt, E. A., Neuwelt, E. A. Outwitting the blood-brain barrier for therapeutic purposes: Osmotic opening and other means. Neurosurgery. 42 (5), 1083-1099 (1998).
- Wei, B., Qian, C., Liu, Y., Lin, X., Wan, J., Wang, Y. Ommaya reservoir in the treatment of cryptococcal meningitis. Acta Neurologica Belgica. 117 (1), 283-287 (2017).
- Zubair, A., Jesus, O. D. Ommaya reservoir. StatPearls [Internet]. , StatPearls Publishing. Available from: https://www.ncbi.nlm.nih.gov/books/NBK559011/ (2021).
- DeVos, S. L., Miller, T. M. Direct intraventricular delivery of drugs to the rodent central nervous system. Journal of Visualized Experiments. (75), e50326(2013).
- Ajoy, R., Chou, S. -Y. Studying the hypothalamic insulin signal to peripheral glucose intolerance with a continuous drug infusion system into the mouse brain. Journal of Visualized Experiments. (131), e56410(2018).
- Sajadi, A., Provost, C., Pham, B., Brouillette, J. Neurodegeneration in an animal model of chronic amyloid-beta oligomer infusion is counteracted by antibody treatment infused with osmotic pumps. Journal of Visualized Experiments. (114), e54215(2016).
- Rauschenberger, L., Knorr, S., Volkmann, J., Ip, C. W. Implantation of osmotic pumps and induction of stress to establish a symptomatic, pharmacological mouse model for DYT/PARK-ATP1A3 dystonia. Journal of Visualized Experiments. (163), e61635(2020).
- Cooper, J. D., Heppert, K. E., Davies, M. I., Lunte, S. M. Evaluation of an osmotic pump for microdialysis sampling in an awake and untethered rat. Journal of Neuroscience Methods. 160 (2), 269-275 (2007).
- Sharma, R. K., et al. Microglial cells impact gut microbiota and gut pathology in angiotensin II-induced hypertension. Circulation Research. 124 (5), 727-736 (2019).
- Kim, H. Y., Lee, D. K., Chung, B. -R., Kim, H. V., Kim, Y. Intracerebroventricular injection of amyloid-β peptides in normal mice to acutely induce alzheimer-like cognitive deficits. Journal of Visualized Experiments. (109), e53308(2016).
- Fukushima, A., Fujii, M., Ono, H. Intracerebroventricular treatment with resiniferatoxin and pain tests in mice. Journal of Visualized Experiments. (163), e57570(2020).
- Niaz, N., et al. Intracerebroventricular injection of histamine induces the hypothalamic-pituitary-gonadal axis activation in male rats. Brain Research. 1699, 150-157 (2018).
- Yokoi, H., Arima, H., Murase, T., Kondo, K., Iwasaki, Y. Intracerebroventricular injection of adrenomedullin inhibits vasopressin release in conscious rats. Neuroscience Letters. 216 (1), 65-70 (1996).
- Savci, V., Gürün, S., Ulus, I. H., Kiran, B. K. Intracerebroventricular injection of choline increases plasma oxytocin levels in conscious rats. Brain Research. 709 (1), 97-102 (1996).
- Sunter, D., Hewson, A. K., Dickson, S. L. Intracerebroventricular injection of apelin-13 reduces food intake in the rat. Neuroscience Letters. 353 (1), 1-4 (2003).
- Moreau, C., et al. Intraventricular dopamine infusion alleviates motor symptoms in a primate model of Parkinson's disease. Neurobiology of Disease. 139, 104846(2020).
- Calvo, P. M., de la Cruz, R. R., Pastor, A. M. A single intraventricular injection of VEGF leads to long-term neurotrophic effects in axotomized motoneurons. eNeuro. 7 (3), (2020).
- Choi, C. R., Ha, Y. S., Ahn, M. S., Lee, J. S., Song, J. U. Intraventricular or epidural injection of morphine for severe pain. Neurochirurgia. 32 (6), 180-183 (1989).
- Zhong, L., Shi, X. -Z., Su, L., Liu, Z. -F. Sequential intraventricular injection of tigecycline and polymyxin B in the treatment of intracranial Acinetobacter baumannii infection after trauma: A case report and review of the literature. Military Medical Research. 7 (1), 23(2020).
- Gross, P. M., Weaver, D. F. A new experimental model of epilepsy based on the intraventricular injection of endothelin. Journal of Cardiovascular Pharmacology. 22, Suppl 8 282-287 (1993).
- Nang, S. C., Azad, M. A. K., Velkov, T., Zhou, Q. Rescuing the last-line polymyxins: Achievements and challenges. Pharmacological Reviews. 73 (2), 679-728 (2021).
- Tsuji, B. T., et al. International Consensus Guidelines for the Optimal Use of the Polymyxins: Endorsed by the American College of Clinical Pharmacy (ACCP), European Society of Clinical Microbiology and Infectious Diseases (ESCMID), Infectious Diseases Society of America (IDSA), International Society for Anti-infective Pharmacology (ISAP), Society of Critical Care Medicine (SCCM), and Society of Infectious Diseases Pharmacists (SIDP). Pharmacotherapy. 39 (1), 10-39 (2019).
- Velkov, T., Roberts, K. D., Nation, R. L., Thompson, P. E., Li, J. Pharmacology of polymyxins: New insights into an "old" class of antibiotics. Future Microbiology. 8 (6), 711-724 (2013).
- Nation, R. L., et al. Dosing guidance for intravenous colistin in critically-ill patients. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 64 (5), 565-571 (2017).
- Nation, R. L., Velkov, T., Li, J. Colistin and polymyxin B: Peas in a pod, or chalk and cheese. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 59 (1), 88-94 (2014).
- Fornari, R. V., et al. Rodent stereotaxic surgery and animal welfare outcome improvements for behavioral neuroscience. Journal of Visualized Experiments. (59), e3528(2012).
- Molina-Cimadevila, M. J., Segura, S., Merino, C., Ruiz-Reig, N., Andrés, B., de Madaria, E. Oral self-administration of buprenorphine in the diet for analgesia in mice. Laboratory Animals. 48 (3), 216-224 (2014).
- Goldkuhl, R., Hau, J., Abelson, K. S. P. Effects of voluntarily-ingested Buprenorphine on plasma corticosterone levels, body weight, water intake, and behaviour in permanently catheterised rats. In Vivo. 24 (2), Athens, Greece. 131-135 (2010).
- Hestehave, S., Munro, G., Pedersen, T. B., Abelson, K. S. P. Antinociceptive effects of voluntarily ingested Buprenorphine in the hot-plate test in laboratory rats. Laboratory Animals. 51 (3), 264-272 (2017).
- Faesel, N., Schünemann, M., Koch, M., Fendt, M. Angiotensin II-induced drinking behavior as a method to verify cannula placement into the cerebral ventricles of mice: An evaluation of its accuracy. Physiology & Behavior. 232, 113339(2021).
- Elsevier. Neurotoxicity. Neurotoxicity | Elsevier Enhanced Reader. , (2021).
- Vuillemenot, B. R., Korte, S., Wright, T. L., Adams, E. L., Boyd, R. B., Butt, M. T. Safety evaluation of CNS administered biologics-study design, data interpretation, and translation to the clinic. Toxicological Sciences: An Official Journal of the Society of Toxicology. 152 (1), 3-9 (2016).
- Cerebrospinal fluid dynamics and intracranial pressure elevation in neurological diseases. , Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6456952/ (2021).
- Nau, R., Sörgel, F., Eiffert, H. Penetration of drugs through the blood-cerebrospinal fluid/blood-brain barrier for treatment of central nervous system infections. Clinical Microbiology Reviews. 23 (4), 858-883 (2010).
- Quagliarello, V. J., Ma, A., Stukenbrok, H., Palade, G. E. Ultrastructural localization of albumin transport across the cerebral microvasculature during experimental meningitis in the rat. The Journal of Experimental Medicine. 174 (3), 657-672 (1991).
- Reinhardt, V. Common husbandry-related variables in biomedical research with animals. Laboratory Animals. 38 (3), 213-235 (2004).
- Morton, L. D., Sanders, M., Reagan, W. J., Crabbs, T. A., McVean, M., Funk, K. A. Confounding factors in the interpretation of preclinical studies. International Journal of Toxicology. 38 (3), 228-234 (2019).
- Bailey, J. Does the stress of laboratory life and experimentation on animals adversely affect research data? A critical review. Alternatives to laboratory animals: ATLA. 46 (5), 291-305 (2018).
- Moberg, G. P., Mench, J. A. The Biology of Animal Stress: Basic Principles and Implications for Animal Welfare. , CABI. (2000).
- Russel, W. M. S., Burch, R. L. The principles of humane experimental technique principles. , Methuen & Co LTD. (1959).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved