Method Article
생존 가능하지만 배양할 수 없는 병원체를 되살리기 위한 생체 내 모델로서의 닭 배아
요약
이 방법은 닭 배아를 박테리아 병원균 L. monocytogenes를 생존 가능하지만 배양할 수 없는(VBNC) 상태에서 되살리고 박테리아 휴면 메커니즘에 대한 이해에 잠재적으로 더 사용할 수 있는 간단하고 비용 효율적인 생체 내 모델로 보여줍니다.
초록
닭 배아는 다양한 생물학적 현상 연구에서 단순성, 경제성 및 적응성으로 인해 생물 의학 연구에서 응용 프로그램이 증가하는 인기 있는 생체 내 모델로 부상했습니다. 이 모델은 미생물 병원성을 조사하는 데 사용되어 왔으며 박테리아 휴면 상태를 연구하는 데 유용한 도구가 되고 있습니다. VBNC(viable but non-culturable) 상태는 박테리아가 혹독한 환경에서 생존력을 보존하기 위해 신진대사가 정지하고 배양에 저항하는 휴면 상태입니다. 유리한 조건에서 VBNC 박테리아는 신진대사적으로 활성화되고 배양 가능한 상태로 다시 깨어날 수 있습니다. 식품매개 리스테리아증을 유발하는 리스테리아 모노사이토제네스(Listeria monocytogenes)와 같이 VBNC 상태로 전환되는 박테리아 병원체는 기존의 성장 의존적 방법으로는 검출을 피하고 회복 시 독성을 회복할 수 있기 때문에 공중 보건 문제입니다. 이는 VBNC 병원체의 부활을 이끄는 조건과 메커니즘에 대한 더 나은 이해를 촉구합니다. 여기에 제시된 방법은 닭 배아를 VBNC L. monocytogenes를 배양 가능한 상태로 되살리기 위한 효율적인 생체 내 모델임을 보여줍니다. 주로 영양 보충에 기초한 체외 부활 시도가 비생산적이었던 경우, 이 프로토콜은 미네랄 워터의 굶주림으로 인해 생성된 세포벽 결핍 VBNC 형태의 L. monocytogenes의 재활성화를 촉진하는 데 성공합니다. 중요한 것은, 얻어진 결과는 VBNC L. monocytogenes의 부활을 위한 배아의 필요성을 강조하며, 이 과정에서 배아 관련 요인의 중요한 역할을 나타냅니다. 이 방법의 다른 잠재적 용도로는 VBNC 상태 부흥 메커니즘과 관련된 박테리아 요인의 스크리닝 및 식별이 포함됩니다. 따라서 이 모델은 박테리아 휴면기의 분자 작용에 대한 통찰력을 제공할 수 있으며, 그 지식은 감지할 수 없는 병원체에 수반되는 공중 보건 위험을 줄이는 데 매우 중요합니다.
서문
관련 비용과 물류 및 윤리적 고려 사항을 줄이면서 대안적인 생체 내 연구 모델을 찾는 과정에서 닭 배아가 등장하여 가장 적용 가능하고 관리 가능하며 재현 가능한 생체 내 척추 동물 모델 시스템 중 하나가 되었습니다 1,2. 설치류나 토끼와 같은 다른 동물 모델과 비교했을 때, 수정란은 구하는 데 비용이 저렴하고 발달을 위한 복잡한 주택 물류가 필요하지 않습니다. 또한 계란 크기로 인해 수많은 배아를 병렬로 처리할 수 있어 강력한 수의 실험 테스트 조건/그룹 및 복제를 지원합니다. 배발생 기간(21일)이 짧고 발달 기간의 어느 시점에서든 배아 및 관련 구조에 접근하고 관찰할 수 있는 단순성으로 인해 발달 생물학(예: 심장 및 뇌 형성)3,4 및 약리학(약물 활성, 전달 및 독성 테스트)1,5, 6. 또한, 닭 배아의 미성숙한 면역 체계는 면역 기반 연구 및 암 연구 관련 접근법에 적합한 체계입니다7. 중요한 것은, 발달 13-14일까지만 성숙한 통각 수용 시스템을 획득하는 이 모델의 배아적 특성 때문에 8 이 기간 내에 수행되는 연구 신청은 법적, 윤리적 우려에 의해 제약을 받지 않는다는 것입니다7.
닭 배아 모델은 또한 인간과 다른 포유류에서 질병을 일으키는 미생물의 병원성을 연구하는 데 널리 사용되었습니다. 실제로, 수많은 연구에서 원생동물의 독성을 조사하기 위해 이 모델을 탐구하고 검증했습니다(예: Neospora caninum, Eimeria tenella, Cryptosporidium spp.)9,10,11, 진균(예: Candida albicans, Aspergillus fumigatus)12,13 및 박테리아 종(예: Enterococcus spp., Salmonella enterica, Francisella spp., Campylobacter jejuni, Clostridium perfringens, Listeria monocytogenes, Neisseria gonorrhoeae, Staphylococcus aureus)10, 14,15,16,17,18,19,20,21,22뿐만 아니라 항균 화합물 17,23의 치료 효과를 시험합니다.
위에서 언급한 것과 같은 미생물은 종종 환경에서 스트레스가 많은 자극에 노출되므로 잠재적으로 유해하거나 치명적인 상황을 견디기 위해 스트레스 대처 전략을 진화시켰습니다. 일부 박테리아 종은 내생포자(endospores)라고 하는 매우 탄력적이고 대사적으로 휴면 상태인 구조를 생성할 수 있으며, 이는 심각한 환경 제약 하에서 세포 및 유전적 무결성을 보존합니다. 유리한 환경 조건이 수집되면 내생포자는 발아에 의해 생존 가능한 활성 세포로 재생될 수 있습니다24. 그러나 비포자형성 박테리아는 생존 가능하지만 배양 불가능(viable but non-culturable, VBNC)이라고 하는 대체 대사 휴면 상태로 들어갈 수 있으며, 주요 표현형 특성은 일상적인 성장 매체에서 배양 가능성의 상실입니다25. VBNC 상태에 진입하는 것으로 보고된 > 100종의 박테리아 종 중 상당 부분이 인간과 다른 동물에게 병원성이며,26 VBNC 병원체가 대사적으로 활성화되고 독성이 있는 상태로 다시 부활할 수 있다는 점을 감안할 때25,26, VBNC 병원체를 검출하는 데 있어 기존의 성장 기반 방법의 실패는 우려되는 공중 보건 문제입니다. 이 재생 과정을 주도하는 환경적 단서와 분자 및 생리학적 메커니즘은 아직 잘 알려져 있지 않으며 미생물 종과 VBNC 상태 유도 스트레스에 따라 달라질 수 있습니다.
연구자들은 닭 배아 모델의 특수성을 활용하여 VBNC 상태에서 박테리아 병원체의 생체 내 부활 능력을 조사했습니다. 수질의 영양 결핍으로 인해 VBNC 상태로 전환된 인간 유래 C. jejuni 분리물은 배아된 닭 알을 통과한 후 인간 세포에서 배양 가능성과 독성을 회복했습니다27. 마찬가지로, VBNC 상태를 되돌리려는 성공적인 시도는 Edwardsiella tarda28, Legionella pneumophila29 및 L. monocytogenes30과 같은 다른 병원체에 대해서도 보고되었습니다.
우리는 최근에 L. monocytogenes 가 미네랄 워터의 굶주림으로 인해 VBNC 상태로 전환되면 막대 모양에서 코코이드 세포로 이동한다고 보고했습니다. 우리는 이러한 형태학적 변형이 세포벽의 누적된 손상으로 인해 발생하며, 박테리아에 의해 완전히 탈락하게 된 후 세포벽이 결핍된 구형 세포형태 31이 된다는 것을 밝혔습니다. 영양소 보충 접근법을 사용하여 벽이 없는 VBNC L. monocytogenes 형태를 in vitro에서 되살리려는 시도가 실패로 돌아가자 in vivo에서 이들의 구제 가능성을 조사하게 되었습니다. L. monocytogenes30과의 유망한 사용을 감안하여 이 작업을 위해 닭 배아 모델을 선택했습니다. 그 결과, 배아된 닭 난자 시스템이 세포벽이 결핍된 VBNC L. monocytogenes 를 활성 배양 가능한 상태로 되돌려 놓는 것을 촉진하는 능력을 확인하였다31.
여기에서는 배아된 계란 환경에 대한 노출을 통해 휴면 VBNC 상태에서 L. monocytogenes의 생체 내 부활을 가능하게 하는 자세한 프로토콜을 제공합니다. 닭고기 달걀 및 VBNC 박테리아의 준비 및 모니터링, 난자 접종, 배아 난자 및 비배아 난자의 처리, VBNC 세포 재생 효율을 평가하기 위한 배양 가능한 박테리아 부담 점수에 대해 설명합니다. 그 결과, 닭 배아가 박테리아 휴면과 같은 미생물 생명의 다양한 측면을 지배하는 메커니즘을 이해하는 데 간단하고 비용 효율적이며 적합한 모델임을 재확인했습니다. 이 생체 내 시스템은 부활 과정에서 개별 박테리아 유전자의 기여를 조사하기 위해 추가로 탐구될 수 있습니다.
프로토콜
이 프로토콜은 연구에서의 동물 사용에 대한 해당 기관 프랑스어(법령 번호 2013-118) 및 유럽(지침 2010/63/EU) 지침을 따릅니다. 또한, 프랑스 법률(법령 번호 2020-274)에 따라 이 프로토콜은 닭 배아에 대한 모든 실험이 배발생의 마지막 3기 이전(즉, 14일 이전)에 수행되고 완료되기 때문에 윤리적 제한과 관련이 없습니다.
1. VBNC 박테리아의 제조
- 접종 루프를 사용하여 글리세롤 스톡(-80°C에서 보관)의 박테리아 균주를 뇌 심장 주입(BHI) 한천 배지에 줄무늬 주입합니다. 37 °C에서 하룻밤 동안 배양하여 고립된 군체를 얻습니다.
알림: 필요한 경우, 한천 배지에 균주가 내성을 가지고 있는 항생제(자연적으로 또는 유전자 변형에 의해)를 보충합니다. - 각 균주에 대해 2-3개의 튜브에 5mL의 BHI 육수를 준비하고 접종 루프를 사용하여 2-3개의 콜로니를 접종합니다. 37°C에서 하룻밤 동안 교반(200rpm)으로 배양물을 배양하여 고정상까지 박테리아를 성장시킵니다. 이러한 각 배양액은 VBNC 박테리아 현탁액의 독립적인 생물학적 복제물을 준비하는 데 사용됩니다.
- 각 배양물을 BHI 육수에 1:10으로 희석하고 600nm(OD600) 파장의 분광 광도계에서 광학 밀도를 측정합니다. 리스테리아 모노사이토제네스의 최적으로 성장된 고정상 배양의 OD600 값은 2에서 4 사이입니다. 이는 박테리아 농도가 2-4 x 109 집락 형성 단위(CFU)/mL인 것과 같습니다.
- 1.5mL 마이크로튜브에 1mL의 박테리아 배양액을 6,000 x g 에서 2분 동안 원심분리하여 펠렛화합니다. 진공 펌프를 사용하여 상층액을 흡입합니다. 세포 펠렛을 1mL의 오토클레이브 및 여과된 미네랄 워터에 재현탁합니다.
- 1.4단계를 세 번 반복하여 박테리아를 철저히 씻으십시오. 이를 통해 VBNC 박테리아의 형성을 지연시킬 수 있는 배양 배지 영양소를 완전히 제거할 수 있습니다.
- 30mL의 미네랄 워터가 함유된 T25 세포 배양 플라스크에 세척된 박테리아 30μL를 첨가하여 106 CFU/mL의 시작 농도에서 박테리아 현탁액을 준비합니다.
- 혈청학적 피펫을 사용하여 현탁액을 혼합합니다. 실온, 정적(플라스크가 똑바로 세워진 상태) 및 어두운 조명 조건에서 보관하십시오.
2. VBNC 박테리아 형성 모니터링
- 박테리아 현탁액에서 배양 가능한 개체군을 1일 째(제제 직후)에 결정한 다음 아래와 같이 매주 기준으로 측정합니다.
- 미네랄 워터에서 VBNC 박테리아 현탁액의 10배 연속 희석액을 준비합니다(10-1 에서 10-3 희석). 100 μL의 희석되지 않은 현탁액과 각 희석액을 BHI 한천에 중복으로 플레이트하고 37 °C에서 밤새 배양합니다.
참고: 배양성이 1 CFU/mL <에 접근하면 더 큰 부피(0.5-2 mL)의 희석되지 않은 현탁액을 도금하여 배양 가능한 박테리아의 존재 유무를 확인해야 합니다. - 다음과 같이 배양 가능한 박테리아의 농도를 계산합니다.
배양 가능한 박테리아의 농도(CFU/mL) = (평균 콜로니 수 x 샘플 희석 계수) / 도금된 샘플 부피(mL).
- 미네랄 워터에서 VBNC 박테리아 현탁액의 10배 연속 희석액을 준비합니다(10-1 에서 10-3 희석). 100 μL의 희석되지 않은 현탁액과 각 희석액을 BHI 한천에 중복으로 플레이트하고 37 °C에서 밤새 배양합니다.
- 박테리아 현탁액에서 생존 가능한 개체군을 1일 째(제제 직후)에 결정한 다음 아래와 같이 매주 기준으로 측정합니다.
- 박테리아 현탁액 샘플(즉, 약 106 cells/mL 농도)을 생존 염료 5(6)-carboxyfluorescein diacetate(CFDA)와 함께 암흑 속에서 30분 동안 30μM의 최종 농도로 배양합니다. CFDA(염색되지 않은 대조군)가 없는 샘플과 CFDA(Non-viable/dead cell control)로 배양하기 전에 95°C에서 30분 동안 처리된 샘플도 준비합니다.
- CFDA 형광을 위한 488nm 여기 레이저와 520nm 방출 검출기가 장착된 유세포 분석기에서 샘플을 분석합니다. 통계적 견고성을 위해 최소 30μL/분의 유속에서 샘플당 약 1 x 105 개의 박테리아 이벤트를 획득합니다(이는 10-100μL의 수집된 샘플 부피로 변환됨).
- 염색되지 않은 샘플을 사용하여 로그 스케일 전방 산란(FSC) 대 측면 산란(SSC) 플롯에서 박테리아 관련 이벤트를 찾고 게이트합니다. 게이트 박테리아 이벤트를 로그 스케일의 CFDA 형광 히스토그램으로 플롯하고 염색되지 않은 세포 및 생존 불가능한/죽은 세포 샘플을 사용하여 생존 가능(CFDA 양성) 집단과 생존 불가능한(CFDA 음성) 집단을 구별합니다.
- 다음과 같이 생존 가능한 박테리아의 농도를 계산합니다.
생존 가능한 박테리아의 농도(cells/mL) = 수집된 샘플의 평균 CFDA 양성 이벤트 수/수집된 샘플 부피(mL)
참고: 세포분석기 모델에 따라 세포 정량화를 위해 유세포분석 계수 비드를 사용해야 할 수 있습니다.
3. 난자의 부화
- 공급자로부터 수령하면 수정란을 다음날까지 실온에서 수용 할 수 있습니다.
- 그 동안 계란 부화기의 물통에 탈이온수를 채우고 전원을 켭니다. 온도를 37.7°C로 설정하고 최대 상대 습도를 47%로 설정합니다.
참고: 우리 손에서 난자는 38%-42%의 상대 습도 범위에서 부화되며 예상 배아 발생률 및 성공률에 눈에 띄는 영향을 미치지 않습니다. - 배아 발생을 시작하기 위해 난자를 인큐베이터로 옮깁니다. 공기 주머니가 위를 향하도록(즉, 뾰족한 끝이 아래를 향하도록) 인큐베이터 트레이에 놓습니다.
- 알을 6일 동안 부화시킵니다. 4일 후, 촛불로 살아있는 배아 난자와 죽은 난자 또는 배아가 없는 난자를 구별합니다.
- 강한 광원(캔들러) 아래/위에 계란을 놓아 내부를 비추고 내용물을 시각적으로 식별할 수 있습니다. 부화 3-4일 후, 살아있는 배아 난자는 공기 주머니에서 아래쪽으로 확장되는 혈관 네트워크를 나타냅니다. 이 네트워크는 죽은 배아 난자에서 붕괴되고 무질서한 것으로 보이며 배아 발생을 시작하지 못한 난자에는 완전히 없습니다. 살아있는 배아가 보이는 경우, 경련하는 움직임을 보일 수도 있습니다(그림 1).
4. 접종을 위한 계란의 준비
- 접종 당일, 난자에 촛불을 촛불을 켜서 생존 가능한 배아 난자와 배아가 없는 난자의 사용 가능한 수를 결정합니다. 3.4단계에서 설명한 대로 배아가 없는 난자(총 수의 약 10%-20%)와 죽은 배아가 있는 난자를 식별합니다. 후자는 생물학적 폐기물 처리에 대한 제도적 지침에 따라 폐기하십시오.
- 공기 주머니 테두리에서 2-5mm 위에 있는 달걀 껍질의 주입 지점을 표시합니다(그림 2A). 이 부위를 70%(v/v) 에탄올에 적신 티슈로 문질러 소독합니다.
- 18G 바늘을 사용하여 껍질 멤브레인을 뚫지 않고 주입 지점의 껍질에 조심스럽게 구멍을 뚫습니다(그림 2B). 주입 부위를 70%(v/v) 에탄올을 적신 티슈로 소독합니다.
5. 난자의 접종
- 25G(0.5mm x 16mm) 바늘을 1mL 주사기에 꽂고 VBNC 박테리아 현탁액으로 채웁니다. 필요한 경우 주사기 내벽에 붙어 있는 기포를 손가락으로 튕겨 제거합니다.
- 배양 가능한 박테리아에서 유래한 무균 및 성장을 위한 제어 조건으로 BHI 육물에서 밤새 배양한 L. monocytogenes (5 x 10,3 CFU/mL)의 현탁액을 미네랄 워터 단독으로 접종합니다.
- 주입 지점에 구멍이 뚫린 쉘을 통해 바늘을 삽입하고 바늘 바닥이 쉘 표면에 닿을 때까지 수직 각도로 끝까지 삽입합니다(그림 2C). 이것은 주사기 내용물을 알란토강(배아된 난자) 또는 알부민(배아되지 않은 난자)으로 전달하기 위해 바늘 끝을 배치합니다.
- 100μL의 접종물을 조심스럽게 천천히 주입합니다. 배아가 있는 난자 안에 있을 때 배아에 치명적인 부상을 입히지 않도록 바늘의 각도를 가능한 한 움직이지 않게 유지하십시오.
- 차분하고 천천히 바늘을 제거하고 주입 부위를 둥근 스티커로 덮어 접종 입구를 밀봉합니다. 편의와 명확성을 위해 각 상태/계란 그룹에 대해 다른 색상의 스티커를 사용하십시오.
- 접종한 난자를 추가로 2일 동안 인큐베이터에 반환합니다. 배아가 발달 중인 난자가 인큐베이터 밖에서(또는 37.7°C 미만의 온도에서) 30분 이상 나오지 않았는지 확인합니다. 필요한 경우 일괄적으로 접종을 수행합니다.
6. 접종 샘플에서 배양 가능한 세포의 존재 평가
- 100μL의 VBNC 박테리아 현탁액을 96웰 마이크로플레이트의 여러 웰에 분배합니다. 우물 수 ≥ 접종된(배아 + 배아되지 않은) 난자 수의 2 x 계산합니다.
- 5.2단계에서 언급한 제어 조건을 사용하는 경우 각 접종물(즉, 미네랄 워터 또는 배양 가능한 박테리아) 100μL를 동일한 96웰 마이크로플레이트에 있는 최소 3개의 웰에 분배합니다.
- 멀티채널 피펫을 사용하여 이전 두 단계에서 준비된 각 웰에 100μL의 BHI 배지를 추가합니다.
- 배양 가능한 박테리아가 포함된 웰에서 박테리아 성장을 촉진하기 위해 정적 조건에서 37°C에서 플레이트를 배양합니다. 이러한 조건에서 배양 가능한 박테리아의 존재와 재성장 속도에 따라 배양 가능한 박테리아가 포함된 우물을 완전히 드러내기 위해 하나 이상의 잠복일이 필요할 수 있습니다.
- 각 접종물에 대해 육안으로 검사하고 박테리아 성장에 대해 양성 및 음성 점수를 받은 우물의 수를 계산합니다.
7. 배아 생존 가능성 모니터링
- 접종 다음 날, 배아가 발생한 난자에 촛불을 촛불로 촛불을 켜서 배아 치사율을 확인합니다.
- 죽은 배아가 들어 있는 난자는 옆으로 치워두고, 감염된 생물학적 배설물 처리에 대한 제도적 지침에 따라 폐기한다.
8. 배아 난자의 가공
- 인큐베이터와 양초에서 배아가 발생한 난자를 회수하여 배아 치사율을 확인합니다. 죽은 배아를 버리고 최종 결과에 고려하지 마십시오.
- 달걀에서 스티커를 제거하고 70%(v/v) 에탄올을 적신 티슈로 껍질의 상단(에어 포켓 덮음)을 소독합니다.
- 깨끗한 해부 가위를 사용하여 주입 지점에서 껍질을 잘라 에어 포켓을 노출시킵니다. 깨끗한 해부 핀셋을 사용하여 공기 주머니와 난자의 나머지 부분을 분리하는 내부 껍질 막을 뜯어냅니다.
- 계란 내용물을 멸균 페트리 접시에 조심스럽게 비우십시오. 핀셋을 사용하여 배아를 분리하여 새 페트리 접시에 이식합니다. 필요한 경우 멸균 PBS로 배아를 세척합니다.
- 4mL의 멸균 PBS가 들어 있는 15mL 원심분리 튜브에 배아를 옮깁니다. 균질화기(속도: 10,000rpm)를 사용하여 배아를 해리합니다. 각 균질화 사이에 분산 도구의 팁을 멸균 PBS, 70%(v/v) 에탄올 및 다시 멸균 PBS에 순차적으로 통과시켜 청소합니다.
- BHI 한천에서 배아 균질산의 플레이트 500 μL. 플레이트를 37°C에서 하룻밤(또는 필요한 경우 그 이상) 배양합니다.
참고: 선택적으로, 희석되지 않은 균질산물에서 CFU 수치 상승(즉, > 300)이 예상되는 경우 균질액의 연속 희석을 도금할 수 있습니다. - 각 접종 그룹에 대해 한천 플레이트에서 L. monocytogenes 성장에 대해 양성 및 음성 점수를 받은 난자의 수를 계산합니다.
참고: 배아 추출 및 균질화가 수행되는 무균 조건에도 불구하고, 배아 균질액을 도금하기 위해 비선택적 한천 배지를 사용하는 것은 오염 물질 성장의 위험을 수반합니다. 속/종 특이적 성장 배지를 사용하거나 선택적 항생제(테스트된 박테리아 균주만 내성)를 보충하면 이러한 오염을 줄이거나 예방할 수 있습니다.
9. 배아가 아닌 난자의 가공
- 인큐베이터에서 배아가 아닌 난자를 회수합니다. 8.2단계와 8.3단계를 반복하여 난자 알부민에 접근합니다.
- 마이크로피펫을 사용하여 500μL의 알부민을 채취하여 BHI 한천에 직접 펴 바릅니다. 필요한 경우 37°C에서 하룻밤 또는 그 이상 플레이트를 배양합니다.
- 각 접종 그룹에 대해 한천 플레이트에서 L. monocytogenes 성장에 대해 양성 반응을 보인 난자의 수를 계산합니다.
결과
미네랄 워터에서 굶주림으로 생성된 L. monocytogenes의 세포벽 결핍 VBNC 형태를 되살리기 위한 닭 배아 모델의 잠재력을 테스트하기 위해서는 VBNC 박테리아 접종의 준비 시기(≥ 28일)와 배아 난자의 준비 시기(6일)를 명확히 하는 것이 중요했습니다. 따라서 L. monocytogenes의 복제 현탁액은 계획된 난자 접종일 28일 전에 미네랄 워터에서 1 x 106 CFU/mL의 농도로 설정되었습니다. 이 시작 박테리아 농도는 28일 후 <1 CFU/mL의 원하는 잔류 배양성을 초래하는 것으로 나타났습니다31. 현탁액의 박테리아 세포 배양 가능성 및 생존율 수준에 대한 최종 검증을 통해 mL당 1 x 10,6개의 생존 세포 및 0.5개의 배양 가능한 세포를 포함하는 VBNC L. monocytogenes 접종물을 선택했습니다. 실험을 위해 이 접종물 100μL(즉, 1 x 105 생존 세포 및 < 0.1 CFU)를 배아 난자 및 비배아 난자 그룹에 전달했습니다. 대조군은 배아와 비배아난자에 동일한 용량의 미네랄 워터 또는 BHI 육물에서 밤새 자란 L. 모노사이토제네스의 5 x 103 CFU/mL 현탁액을 주입하여 병행하여 준비했습니다.
접종 후 2일째에 배양 가능한 L. monocytogenes의 존재를 평가하기 위해 난자를 처리했습니다. 예상대로, 미네랄 워터를 주입한 무균 대조군 난자에서는 박테리아 성장이 회복되지 않았으며, 배양 가능한 L. monocytogenes 로 처리된 대조군의 난자는 100% 한천 배지에서 성장에 양성 반응을 보였습니다(표 1). 중요한 것은 VBNC 박테리아가 접종된 난자에서 회수된 모든 배아가 플레이트에서 L. monocytogenes 성장을 일으켰다는 것인데, 이는 동일한 VBNC 박테리아가 주입된 배아가 아닌 난자의 함량으로 퍼진 모든 플레이트에 L. monocytogenes가 완전히 없는 것과 대조를 이룹니다(표 1). 이 결과는 이전에 보고된 바와 같이 VBNC L. monocytogenes의 각성 과정에 대한 닭 배아의 요구 사항을 강조합니다30.
VBNC 박테리아가 주입된 배아 난자에서 회수된 L. monocytogenes 성장이 잔류 배양 가능한 세포의 재성장이 아니라 진정한 VBNC 세포 회복에서 비롯된 것인지 여부를 결정하기 위해서는 난자 통과 전후에 박테리아 성장을 일으키는 접종 용량의 빈도를 비교할 필요가 있습니다. 전자를 얻기 위해 VBNC L. monocytogenes revival 32를 지원하지 않는 영양이 풍부한 배지인 BHI와 100μL 용량의 VBNC L. monocytogenes revival32를 96웰 플레이트에서 혼합하고 37°C에서 배양했습니다. 박테리아 성장에 양성인 접종된 BHI 웰의 9.5%(84개 중 8개)의 빈도는 회복된 배양 가능한 박테리아를 보여주는 난자의 100% 빈도와 유의하게 달랐습니다(Fisher의 정확한 테스트, p = 1.6 × 10-17). 이러한 실질적이고 통계적으로 유의미한 차이는 배아된 난자에서 회복된 L. monocytogenes 성장이 주로 VBNC 박테리아의 재활성화에 기인한다는 것을 강력하게 나타냅니다. 또한, 식물 형태와 달리 VBNC L. monocytogenes는 배아가 아닌 난자에서 재생되지 않았는데, 이는 배아 난자에서 VBNC 세포 재생이 접종물 내 잔류 배양 가능한 박테리아 때문이 아님을 뒷받침합니다.
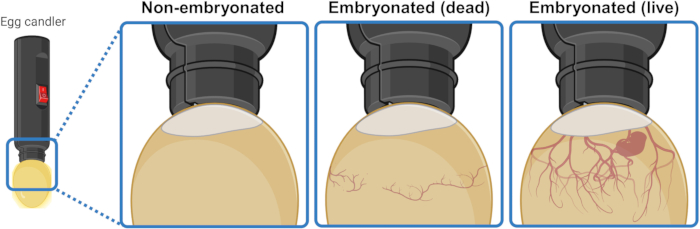
그림 1: 촛대질로 배아가 없는 닭 달걀, 죽은 배아 달걀, 살아있는 배아 달걀을 구별하는 것. 배발생 상태는 가까운 거리에서 광원(egg candler)으로 난자를 비춰서 결정됩니다. 발달 중인 살아있는 배아(눈에 보이든 보이지 않든)를 포함하는 난자는 공기 주머니에서 아래쪽으로 확장되는 강력한 혈관 네트워크를 나타냅니다. 이 네트워크는 죽은 배아가 있는 난자에서는 붕괴되고 무질서한 것처럼 보이며 배발생을 시작하지 못한 난자에서는 완전히 존재하지 않습니다. BioRender.com 년에 생성되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
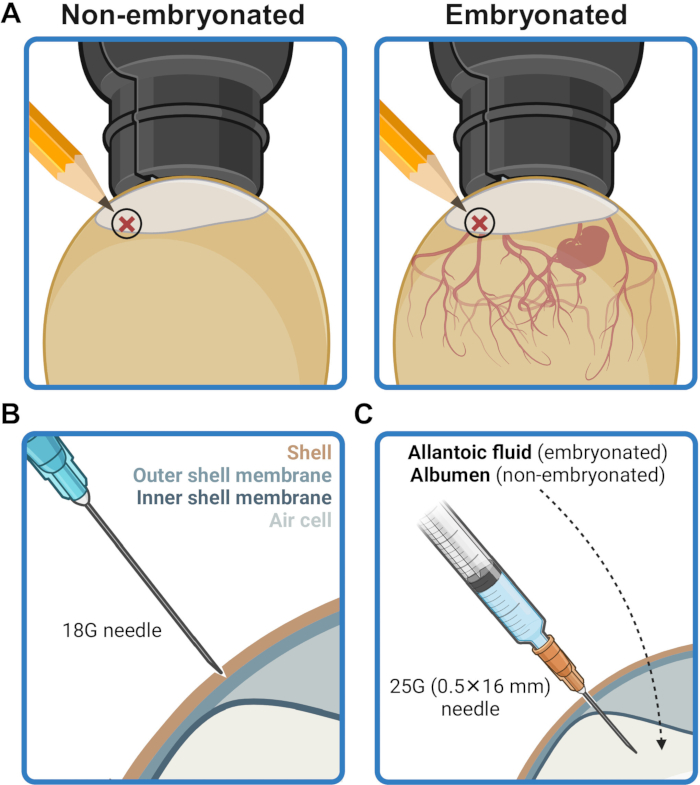
그림 2: 접종을 위한 난자 준비. (A) 주사 부위는 캔들링에서 볼 수 있듯이 공기 주머니 테두리 위 2-5mm 위치에 표시됩니다. (B) 주사 부위의 껍질은 외부 껍질 막을 뚫지 않고 18G 바늘 끝을 사용하여 구멍을 뚫습니다. (C) 접종물은 25G(0.5mm x 16mm) 바늘을 통해 배아 난자의 알란토액 또는 배아가 아닌 난자의 알부민으로 전달됩니다. BioRender.com 년에 생성되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 접종물 | 난자가 통과하기 전의 배양가능성 a | 난자 통과 후 배양가능성 b | |||
| 배아 난자 | p-값C | 배아가 아닌 난자 | p-값d | ||
| 광천수 | 0/3 (0%) | 0/10 (0%) | >0.999 | 0/10 (0%) | >0.999 |
| VBNC Lm | 8/84 (9.52%) | 24/24 (100%) | 1.63E-17 | 0/18 (0%) | 0.344 |
| 배양 가능한 Lm | 3/3 (100%) | 8/8 (100%) | >0.999 | 2/2 (100%) | >0.999 |
| ᅡ박테리아 성장이 있는 BHI 웰 수/접종된 BHI 웰 수. | |||||
| 비박테리아 증식이 있는 난자 수/접종된 난자 수. | |||||
| 씨배아 난자에서 통과 전후의 배양 가능성 비교(양면 피셔의 정확한 검정). | |||||
| 디배아가 아닌 난자의 통과 전과 후의 배양 가능성 비교(양면 피셔의 정확한 검정). | |||||
표 1: VBNC L. monocytogenes는 배아된 닭 난자에서 통과한 후 배양 가능한 상태로 되돌아갑니다. 배아 및 배아되지 않은 닭 달걀(6일)에 100μL의 미네랄 워터만 접종하거나 VBNC(1 x 10,4 세포, 28일) 또는 배양 가능(500 세포) L. 모노사이토제네스의 미네랄 워터 현탁액을 접종했습니다. 2일 후, 배아(또는 배아되지 않은 난자의 알부민)를 회수하고 BHI 한천에 도말하여 배양 가능한 L. 모노사이토제네스의 존재를 평가했습니다. 난자가 통과하기 전에 접종 용량에 존재하는 배양 가능한 세포의 빈도는 96-웰 마이크로플레이트의 여러 웰에서 각 현탁액 100μL를 BHI 브로스와 혼합하고 37°C에서 배양 후 박테리아 성장이 있는 웰 수를 점수화하여 측정했습니다. 통계적 유의성은 양측 피셔의 정확 검정을 사용하여 계산되었으며, p-값이 0.05≥ 유의하지 않은 것으로 간주되었습니다. 이 표는31에서 재현되었습니다.
토론
생존 가능하지만 배양할 수 없는(VBNC) 형태의 박테리아 병원체와 관련된 공중 보건 및 경제적 위험은 기존 미생물 성장 기반 방법에 의한 검출을 회피할 수 있는 능력과 임상 및 식품 산업 환경에서 사용되는 대부분의 항생제에 대한 내성/무감각의 결과입니다26,33. 따라서 VBNC 상태에서 박테리아 세포의 전이, 유지 및 재생을 주도하는 메커니즘을 더 잘 이해하기 위한 연구 도구와 모델을 찾는 것이 시급합니다.
여러 측면에서, 닭 배아는 보다 전통적인 포유류 연구 모델(예: 마우스, 랫트, 토끼)에 대한 유리한 대안입니다. 난생 유기체와 함께 작업하는 것이 기술적으로 더 실용적인데, 배아 발달이 빠르고 선조와 독립적으로 외부에서 발생하기 때문입니다. 중요한 것은 닭고기 달걀과 배아의 생산, 수용 및 유지와 관련된 재정적 및 물류 부담이 현저히 낮다는 것입니다. 또한 많은 수를 쉽게 얻을 수 있으므로 여러 실험 조건 및/또는 반복실험을 병렬로 테스트하고 포괄적이고 통계적으로 견고한 데이터를 생성할 수 있습니다. 어류나 선충류와 같은 비포유류 모델도 비슷한 이점을 제공할 수 있지만, 온혈 척추동물인 닭 배아는 진화적으로 인간에 더 가깝기 때문에 면역학, 질병 모델링, 발달 및 독성학과 같은 분야에서 더 나은 연구 모델입니다. 배아 모델은 윤리적 관점에서도 연구하기가 더 간단하며, 특히 성숙한 통각 수용 체계가 아직 확립되지 않은 발달의 처음 2/3 동안에는 더욱 그렇습니다8. 이 짧은 시간 창은 빠른 처리 시간이 필요한 응용 분야(예: 약물 검사1)에 편리하지만 후기 배아 형성 단계 또는 부화 후 수명(예: 발달 및 행동 연구)까지 지속되는 분석에는 제한을 초래할 수 있습니다. 적응면역 체계가 없기 때문에 닭 배아는 숙주-병원체 상호 작용 및 암 생물학과 같은 분야에서 유용한 연구 도구가 됩니다7.
닭 배아는 미생물 독성 9,10,11,12,13,14,15,16,17,18 연구에 광범위하게 사용되었지만 VBNC 병원체 27,28,29,30을 되살리기 위한 모델로는 드물게 사용되었습니다.. 여기에서는 이 in vivo 시스템이 VBNC L. monocytogenes의 구제에 어떻게 성공적으로 사용될 수 있는지에 대한 자세한 방법론적 설명을 제공했습니다.
이 방법에서 고려해야 할 중요한 점은 배양 가능한 세포의 잔류 존재와 진정한 VBNC 세포 부활을 압도할 수 있는 잠재력 문제입니다. 이 문제를 해결하기 위한 VBNC 세포 생산 방법의 한계(VBNC 세포 순도 수준은 시작 박테리아 농도와 결합됨)로 인해 배양 가능한 세포의 오염을 완전히 제거하거나 무시할 수 있는 수준으로 줄이기 위한 대체 접근 방식을 사용해야 할 필요성이 높아지고 있습니다. 이러한 접근법은 예를 들어, 배양 가능한 세포만을 표적으로 하는 항균제에 의한 중화/사멸을 포함할 수 있습니다. 대안적으로, 배양 가능한 세포 집단의 물리적 제거는 유세포 분석에 의한 고유한 형태생리학적 특성(예: 세포 모양, 표면 또는 세포질 구조 또는 분자)을 기반으로 달성할 수 있습니다. 이 접근법은 연대가 상이한(즉, 서로 다른 시점에 형성된) VBNC 세포 하위집단의 분리/정제를 가능하게 하는 추가적인 이점이 있으며, 이는 또한 난자에서 그들의 재생 능력을 테스트할 수 있습니다.
주의가 필요한 이 방법의 다른 요점으로는 특히 주입 단계 중 및 직후에 배아 난자를 조심스럽게 취급하는 것(의도하지 않은 바늘 관련 외상 또는 치사율을 방지하기 위해)과 최적의 배양 온도를 벗어난 조작 시간을 줄이기 위한 노력이 있습니다. 또한, 배아의 채취, 처리 및 도금이 수행되어야 하는 무균 조건에도 불구하고 한천 플레이트에서 원치 않는 미생물 성장이 여전히 발생할 수 있습니다. 이는 관심 박테리아 종에 대해 선택적인 제형(기초 조성물 및/또는 보충제)을 가진 한천 배지를 사용하거나 주어진 항생제에 대한 내성을 가진 균주를 사용하여 해결할 수 있습니다.
이 연구는 박테리아 휴면의 기계론적 측면을 조사하기 위해 닭 배아를 단순하지만 강력하고 비용 효율적인 생체 내 모델로 보여줍니다. 이러한 맥락에서 개별 박테리아 돌연변이의 스크리닝을 통해 VBNC 상태 각성 과정에 연루된 박테리아 요인을 식별하거나 혼합 라이브러리(예: 트랜스포손 돌연변이 라이브러리)를 사용하여 게놈 전체 규모로 식별할 수 있습니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 작업은 Micalis Institute(AAP Micalis FAMe 2023)의 보조금으로 지원되었습니다. F.C.는 Agence Nationale de Recherche (THOR: ANR-20-CE15-0008; PERMALI: ANR-20-CE35-0001).
자료
| Name | Company | Catalog Number | Comments |
| 5(6)-carboxyfluorescein diacetate (CFDA) | Sigma-Aldrich | 21879 | Prepare stock solution at 30 mM in DMSO. Aliquot and store at −20 °C. |
| Benchtop centrifuge, 24 tubes 1.5–2 mL | Eppendorf | ||
| Biosafety cabinet, class II | |||
| Brain heart infusion (BHI) agar | BD | 248130 | |
| Brain heart infusion (BHI) broth | BD | 237500 | |
| Cell culture flasks, 25 cm2 (T25), vented cap | |||
| Centrifuge tubes, 15 mL | Sarstedt | ||
| Deionised water | To fill water reservoir of egg incubator | ||
| Dissection scissors, pointed ends | |||
| Dissection tweezers, curved + serrated ends | |||
| Egg candler | FIEM (Guanzate, IT) | IM35 | |
| Egg incubator (MG 244 Mercurius SH) | FIEM (Guanzate, IT) | SH244AD | Capacity for 144 chicken eggs (rocking trays) + 100 (hatching tray) |
| Eggs, fertilized | PFIE (INRAE Val-de-Loire, FR) | From white Leghorn chickens, raised in specific pathogen-free conditions | |
| Ethyl alcohol, 70% (v/v) | |||
| Flow cytometer (CytoFLEX S) | Beckman Coulter | V0-B2-Y4-R0 | |
| Heating block (95 °C) | |||
| Incubator (37 °C) | For growth of bacteria on agar plates | ||
| Incubator w/ shaking (37 °C, 200 rpm) | INFORS-HT | For growth of liquid bacterial cultures | |
| Inoculation loops | |||
| Microcentrifuge tubes, 1.5 mL | Eppendorf | ||
| Microtiter plates w/ lid, 96-well, transparent | Greiner | To prepare serial dilutions and analyze samples in flow cytometer | |
| Mineral water | Autoclaved (121 °C, 20 min) and sterile-filtered (0.2 µm) | ||
| Needle, hypodermic, 18G | Terumo | AN1838R1 | Dimensions: 1.2 × 38 mm |
| Needle, hypodermic, 25G | Terumo | AN2516R1 | Dimensions: 0.5 × 16 mm |
| Petri dishes, 10 cm ø | Greiner | For preparation of BHI agar plates and processing of chicken embryos | |
| Phosphate buffered saline (PBS), 1X | Gibco | 14190 | |
| Plate spreaders | |||
| Serological pipettes, disposable, 5 + 10 + 25 mL | |||
| Spectrophotometer (UV-Vis) + cuvettes 1 mL | |||
| Stickers, round, colored (Tough-Spots) | Dutscher | Dimensions: 9.5 mm ø | |
| Syringe, Luer slip, 1 mL | Terumo | ||
| Tissue homogenizer | IKA | ULTRA-TURRAX T25 disperser + S25N 8G dispersion tool | |
| Vacuum pump |
참고문헌
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유