Method Article
L'embrione di pollo come modello in vivo per rianimare patogeni vitali ma non coltivabili
In questo articolo
Riepilogo
Questo metodo presenta l'embrione di pollo come un modello in vivo semplice ed economico per far rivivere il patogeno batterico L. monocytogenes da uno stato vitale ma non coltivabile (VBNC) e con potenziali ulteriori usi nella comprensione dei meccanismi di dormienza batterica.
Abstract
L'embrione di pollo è emerso come un modello in vivo popolare con una crescente applicazione nella ricerca biomedica grazie alla sua semplicità, convenienza e adattabilità nello studio di vari fenomeni biologici. Questo modello è stato utilizzato per studiare la patogenicità microbica e sta diventando uno strumento utile per studiare la dormienza batterica. Lo stato vitale ma non coltivabile (VBNC) è uno stato dormiente in cui i batteri diventano metabolicamente quiescenti e resistenti alla coltivazione per preservare la loro vitalità in ambienti difficili. In condizioni favorevoli, i batteri VBNC possono risvegliarsi in uno stato metabolicamente attivo e coltivabile. I patogeni batterici che passano a uno stato VBNC, come la Listeria monocytogenes che causa la listeriosi di origine alimentare, sono un problema di salute pubblica, in quanto eludono il rilevamento con i metodi convenzionali dipendenti dalla crescita e possono recuperare la loro virulenza dopo la rianimazione. Ciò richiede una migliore comprensione delle condizioni e dei meccanismi che guidano la rinascita dei patogeni VBNC. Il metodo qui presentato mostra l'embrione di pollo come un modello in vivo efficiente per far rivivere VBNC L. monocytogenes in uno stato coltivabile. Laddove i tentativi di rianimazione in vitro , in gran parte basati sul rifornimento nutrizionale, sono stati improduttivi, questo protocollo riesce a promuovere la riattivazione delle forme VBNC carenti di parete cellulare di L. monocytogenes generate dalla fame in acqua minerale. È importante sottolineare che i risultati ottenuti sottolineano la necessità dell'embrione per la rinascita di VBNC L. monocytogenes, indicando un ruolo importante dei fattori associati all'embrione in questo processo. Altri potenziali usi di questo metodo includono lo screening e l'identificazione di fattori batterici implicati nei meccanismi di rinascita dello stato VBNC. Questo modello può quindi fornire informazioni sul funzionamento molecolare della dormienza batterica, la cui conoscenza è fondamentale per ridurre i rischi per la salute pubblica derivanti da agenti patogeni non rilevabili.
Introduzione
Nella ricerca di modelli di ricerca alternativi in vivo, con costi associati ridotti e considerazioni logistiche ed etiche, l'embrione di pollo è emerso ed è diventato rapidamente uno dei sistemi modello di vertebrati in vivo più applicabili, gestibili e riproducibili 1,2. Rispetto ad altri modelli animali, come roditori e conigli, le uova di gallina fecondate sono poco costose da ottenere e non richiedono una complessa logistica abitativa per il loro sviluppo. Inoltre, la dimensione dell'uovo di gallina consente la manipolazione di numerosi embrioni in parallelo, supportando un numero robusto di condizioni/gruppi di test sperimentali e repliche. La breve durata dell'embriogenesi (21 giorni) e la semplicità di accesso e osservazione dell'embrione e delle strutture associate in qualsiasi momento del periodo di sviluppo lo rendono un modello utile in una varietà di campi, come la biologia dello sviluppo (ad esempio, la formazione del cuore e del cervello)3,4 e la farmacologia (test dell'attività, della somministrazione e della tossicità dei farmaci)1,5, 6. Inoltre, il sistema immunitario immaturo dell'embrione di pollo lo rende un sistema adatto per studi basati sul sistema immunitario e approcci relativi alla ricerca sul cancro7. È importante sottolineare che, a causa della natura embrionale di questo modello, che acquisisce un sistema nocicettivo maturo solo entro il giorno di sviluppo 13-148, le applicazioni di ricerca condotte in questo lasso di tempo non sono vincolate da preoccupazioni legali ed etiche7.
Il modello di embrione di pollo è stato anche ampiamente utilizzato per studiare la patogenicità dei microbi che causano malattie nell'uomo e in altri mammiferi. Infatti, numerosi studi hanno esplorato e validato questo modello per indagare la virulenza dei protozoi (ad esempio, Neospora caninum, Eimeria tenella, Cryptosporidium spp.)9,10,11, specie fungine (ad es. Candida albicans, Aspergillus fumigatus)12,13 e batteriche (ad es. Enterococcus spp., Salmonella enterica, Francisella spp., Campylobacter jejuni, Clostridium perfringens, Listeria monocytogenes, Neisseria gonorrhoeae, Staphylococcus aureus)10, 14,15,16,17,18,19,20,21,22, nonché per testare l'effetto terapeutico dei composti antimicrobici 17,23.
I microrganismi, come quelli sopra menzionati, sono spesso esposti a stimoli stressanti nel loro ambiente e hanno, quindi, sviluppato strategie di gestione dello stress per sopportare situazioni potenzialmente dannose/letali. Alcune specie batteriche possono produrre strutture altamente resilienti e metabolicamente dormienti chiamate endospore, che preservano l'integrità cellulare e genetica in presenza di severi vincoli ambientali. Se si raccolgono condizioni ambientali favorevoli, le endospore possono rigenerarsi in cellule attive vitali mediante germinazione24. I batteri non sporulanti, tuttavia, possono entrare in uno stato metabolicamente dormiente alternativo chiamato vitale ma non coltivabile (VBNC), il cui principale tratto fenotipico è la perdita di coltivabilità nei terreni di crescita di routine25. Dato che gran parte delle > 100 specie batteriche segnalate per entrare in uno stato VBNC sono patogene per l'uomo e altri animali26 e che i patogeni VBNC possono rivivere in uno stato metabolicamente attivo e virulento25,26, il fallimento dei metodi convenzionali basati sulla crescita per rilevare i patogeni VBNC è un problema preoccupante per la salute pubblica. Gli indizi ambientali e i meccanismi molecolari e fisiologici che guidano questo processo di rinascita non sono ancora ben compresi e possono variare con le specie microbiche e lo stato di VBNC che induce stress.
I ricercatori hanno sfruttato le particolarità del modello di embrione di pollo per studiare la capacità di rianimazione in vivo di patogeni batterici in uno stato VBNC. Gli isolati di C. jejuni di origine umana, spinti in uno stato VBNC dalla deprivazione nutrizionale in acqua, hanno recuperato la loro coltivabilità e virulenza nelle cellule umane dopo il passaggio in uova di gallina embrionate27. Allo stesso modo, sono stati riportati tentativi riusciti di invertire lo stato VBNC anche per altri agenti patogeni, come Edwardsiella tarda28, Legionella pneumophila29 e L. monocytogenes30.
Abbiamo recentemente riportato che quando L. monocytogenes viene spinto in uno stato VBNC dalla fame in acqua minerale, si trasforma da una cellula a forma di bastoncino a una cellula coccoide. Abbiamo rivelato che questa trasformazione morfologica è causata da un danno cumulativo alla parete cellulare, che porta alla sua completa eliminazione da parte del batterio, che diventa quindi una forma cellulare sferica carente di parete cellulare31. I nostri tentativi infruttuosi di far rivivere queste forme di VBNC L. monocytogenes in vitro, utilizzando approcci di rifornimento dei nutrienti, ci hanno portato a studiare il loro potenziale salvataggio in vivo. Dato il suo promettente utilizzo con L. monocytogenes30, abbiamo selezionato il modello di embrione di pollo per questo compito. I risultati hanno confermato la capacità del sistema embrionato dell'uovo di gallina di promuovere il ripristino di VBNC L. monocytogenes carente di parete cellulare a uno stato attivo di coltura31.
Qui, forniamo un protocollo dettagliato che consente la rinascita in vivo di L. monocytogenes da uno stato dormiente di VBNC attraverso l'esposizione all'ambiente embrionato dell'uovo di gallina. Descriviamo la preparazione e il monitoraggio delle uova di gallina e dei batteri VBNC, l'inoculazione delle uova, la lavorazione delle uova embrionate e non embrionate e il punteggio della carica batterica coltivabile per valutare l'efficienza della rianimazione cellulare VBNC. I risultati riaffermano che l'embrione di pollo è un modello semplice, economico e adatto per comprendere i meccanismi che governano diversi aspetti della vita microbica, come la dormienza batterica. Questo sistema in vivo può essere ulteriormente esplorato per studiare il contributo dei singoli geni batterici nel processo di resurrezione.
Protocollo
Questo protocollo segue le linee guida istituzionali francesi (Decreto n. 2013-118) ed europee (Direttiva 2010/63/UE) applicabili per l'uso degli animali nella ricerca. Inoltre, ai sensi della legge francese (decreto n. 2020-274), questo protocollo non riguarda le restrizioni etiche perché tutta la sperimentazione con embrioni di pollo viene eseguita e completata prima dell'ultimo terzo periodo di embriogenesi (cioè prima del giorno 14).
1. Preparazione dei batteri VBNC
- Striare i ceppi batterici dalle scorte di glicerolo (conservati a -80 °C) su terreni di agar per infusione cardiaca cerebrale (BHI) utilizzando anse di inoculazione. Incubare per una notte a 37 °C per ottenere colonie isolate.
NOTA: Se necessario, integrare il terreno di agar con antibiotici per i quali il ceppo possiede resistenza (naturale o per modificazione genetica). - Per ogni ceppo, preparare 2-3 provette con 5 ml di brodo BHI e utilizzare un ciclo di inoculazione per inoculare con 2-3 colonie. Incubare le colture per una notte a 37 °C con agitazione (200 giri/min) per far crescere i batteri fino alla fase stazionaria. Ciascuna di queste colture sarà utilizzata per preparare repliche biologiche indipendenti di sospensioni batteriche VBNC.
- Diluire ogni coltura 1:10 in brodo BHI e misurare la densità ottica in uno spettrofotometro a una lunghezza d'onda di 600 nm (OD600). Il valore OD600 delle colture in fase stazionaria coltivate in modo ottimale di Listeria monocytogenes varia tra 2 e 4. Ciò equivale a una concentrazione batterica di 2-4 x 109 unità formanti colonie (CFU)/mL.
- Pellet 1 mL di coltura batterica in una microprovetta da 1,5 mL mediante centrifugazione a 6.000 x g per 2 min. Aspirare il surnatante utilizzando una pompa a vuoto. Risospendere il pellet cellulare in 1 mL di acqua minerale autoclavata e filtrata.
- Lavare accuratamente i batteri ripetendo il passaggio 1.4 tre volte. Ciò garantisce la completa rimozione dei nutrienti del terreno di coltura che altrimenti ritarderebbero la formazione dei batteri VBNC.
- Preparare sospensioni batteriche a una concentrazione iniziale di 10-6 CFU/mL aggiungendo 30 μL di batteri lavati a fiasche per colture cellulari T25 contenenti 30 mL di acqua minerale.
- Miscelare le sospensioni utilizzando una pipetta sierologica. Conservarli a temperatura ambiente, in condizioni statiche (pallone in posizione verticale) e in condizioni di scarsa illuminazione.
2. Monitoraggio della formazione di batteri VBNC
- Determinare la popolazione coltivabile nelle sospensioni batteriche il 1° giorno ( immediatamente dopo la preparazione) e successivamente su base settimanale, come descritto di seguito.
- Preparare diluizioni seriali di 10 volte della sospensione batterica VBNC in acqua minerale (da 10-1 a 10-3 diluizioni). Piastra 100 μl di sospensione non diluita e di ciascuna diluizione, in duplicato, su agar BHI e incubare per una notte a 37 °C.
NOTA: Quando la coltivabilità si avvicina < 1 CFU/mL, un volume maggiore (0,5-2 mL) della sospensione non diluita deve essere placcato per confermare la presenza/assenza di batteri coltivabili. - Calcolare la concentrazione di batteri coltivabili come segue:
concentrazione di batteri coltivabili (CFU/mL) = (numero medio di colonie x fattore di diluizione del campione) / volume del campione placcato (in mL).
- Preparare diluizioni seriali di 10 volte della sospensione batterica VBNC in acqua minerale (da 10-1 a 10-3 diluizioni). Piastra 100 μl di sospensione non diluita e di ciascuna diluizione, in duplicato, su agar BHI e incubare per una notte a 37 °C.
- Determinare la popolazione vitale nelle sospensioni batteriche il 1° giorno ( immediatamente dopo la preparazione) e successivamente su base settimanale, come descritto di seguito.
- Incubare un campione della sospensione batterica (cioè a una concentrazione di circa 10-6 cellule/mL) con il colorante vitale 5(6)-carbossifluoresceina diacetato (CFDA) a una concentrazione finale di 30 μM per 30 minuti al buio. Preparare anche un campione senza CFDA (controllo non colorato) e un campione trattato a 95 °C per 30 minuti prima dell'incubazione con CFDA (controllo delle cellule morte non vitali).
- Analizza i campioni in un citometro a flusso dotato di un laser di eccitazione a 488 nm e di un rivelatore di emissione a 520 nm per la fluorescenza CFDA. Per robustezza statistica, acquisire circa 1 x 105 eventi batterici per campione (questo si traduce in un volume di campione acquisito di 10-100 μL) a una velocità di flusso di almeno 30 μL/min.
- Utilizzare il campione non colorato per trovare e controllare gli eventi associati ai batteri in un grafico di dispersione diretta su scala logaritmica (FSC) rispetto alla dispersione laterale (SSC). Tracciare gli eventi batterici gated in un istogramma a fluorescenza CFDA su scala logaritmica e utilizzare i campioni di cellule non colorate e non vitali/morte per distinguere le popolazioni vitali (CFDA-positive) da quelle non vitali (CFDA-negative).
- Calcola la concentrazione di batteri vitali come segue:
concentrazione di batteri vitali (cellule/mL) = numero medio di eventi CFDA-positivi nel campione acquisito/volume del campione acquisito (in mL)
NOTA: A seconda del modello di citometro, la quantificazione cellulare può richiedere l'uso di microsfere di conteggio per citometria a flusso.
3. Incubazione delle uova
- Al ricevimento da parte del fornitore, lasciare che gli ovuli fecondati siano conservati a temperatura ambiente fino al giorno successivo.
- Nel frattempo, riempire il serbatoio dell'acqua dell'incubatrice con acqua deionizzata e accendere l'alimentazione. Impostare la temperatura a 37,7 °C e l'umidità relativa massima al 47%.
NOTA: Nelle nostre mani, le uova vengono incubate a un intervallo di umidità relativa del 38%-42%, senza alcun impatto visibile sul tasso di embriogenesi e sul successo previsti. - Trasferisci gli ovuli nell'incubatrice per avviare l'embriogenesi. Posizionarli sui vassoi dell'incubatrice con la sacca d'aria rivolta verso l'alto (cioè con l'estremità appuntita rivolta verso il basso).
- Incubare le uova per 6 giorni. Dopo 4 giorni, distinguere gli ovuli embrionati vivi da quelli morti o non embrionati mediante speratura.
- Posiziona l'uovo sotto/sopra una forte fonte di luce (candelabro) per illuminare l'interno e discernerne visivamente il contenuto. Dopo 3 o 4 giorni di incubazione, le uova embrionate vive mostrano una rete di vasi sanguigni che si espandono verso il basso dalla sacca d'aria. Questa rete appare collassata e disorganizzata negli ovuli embrionali morti ed è completamente assente negli ovuli che non sono riusciti ad avviare l'embriogenesi. Se visibile, un embrione vivo può anche mostrare un movimento di contrazioni (Figura 1).
4. Preparazione delle uova per l'inoculazione
- Il giorno dell'inoculazione, accendi le uova per determinare il numero disponibile di uova embrionate e non embrionate vitali. Identificare gli ovuli non embrionati (circa il 10%-20% del numero totale) e gli eventuali ovuli con embrioni morti, come descritto nel passaggio 3.4. Disfarsi di questi ultimi secondo le linee guida istituzionali per lo smaltimento biologico dei rifiuti.
- Segnare il punto di iniezione sul guscio d'uovo a 2-5 mm sopra il bordo della sacca d'aria (Figura 2A). Disinfettare quest'area strofinando con carta velina imbevuta di etanolo al 70% (v/v).
- Utilizzando un ago da 18 G, praticare con cautela un'ammaccatura sulla calotta nel punto di iniezione senza perforare la membrana della conchiglia (Figura 2B). Disinfettare il punto di iniezione con una carta velina imbevuta di etanolo al 70% (v/v).
5. Inoculazione degli ovuli
- Inserire un ago da 25 G (0,5 mm x 16 mm) in una siringa da 1 ml e riempirla con sospensione batterica VBNC. Se necessario, rimuovere le bolle d'aria attaccate alla parete interna della siringa muovendola con un dito.
- Eseguire l'inoculazione con acqua minerale da sola o una sospensione di L. monocytogenes (5 x 103 CFU/mL) coltivata per una notte in brodo BHI come condizioni di controllo per la sterilità e la crescita derivate da batteri coltivabili, rispettivamente.
- Introdurre l'ago attraverso il guscio perforato nel punto di iniezione e inserirlo fino in fondo, con un angolo perpendicolare, fino a quando la base dell'ago tocca la superficie del guscio (Figura 2C). Questo posiziona la punta dell'ago per erogare il contenuto della siringa nella cavità allantoidea (negli ovuli embrionati) o nell'albume (negli ovuli non embrionati).
- Iniettare con cautela e lentamente 100 μL di inoculo. Mantenere l'angolo dell'ago il più fermo possibile quando si trova all'interno di un uovo embrionato per evitare di causare lesioni letali all'embrione.
- Rimuovere con cautela e lentamente l'ago e coprire il punto di iniezione con un adesivo rotondo per sigillare il sito di ingresso dell'inoculazione. Per comodità e chiarezza, usa adesivi con un colore diverso per ogni condizione/gruppo di uova.
- Rimetti gli ovuli inoculati nell'incubatrice per altri 2 giorni. Assicurarsi che gli ovuli con embrioni in via di sviluppo non siano fuori dall'incubatrice (o a una temperatura inferiore a 37,7 °C) per più di 30 minuti. Eseguire l'inoculazione in lotti, se necessario.
6. Valutazione della presenza di cellule coltivabili nei campioni di inoculazione
- Erogare 100 μl di sospensione batterica VBNC in più pozzetti di una micropiastra a 96 pozzetti. Calcolare il numero di pozzetti ≥ 2 x il numero di ovuli inoculati (embrionati + non embrionati).
- Se si utilizzano le condizioni di controllo menzionate al punto 5.2, erogare 100 μl di ciascun inoculo (ad es. acqua minerale o batteri coltivabili) in almeno tre pozzetti nella stessa micropiastra da 96 pozzetti.
- Utilizzando una pipetta multicanale, aggiungere 100 μl di terreno BHI a ciascuno dei pozzetti preparati nei due passaggi precedenti.
- Incubare la piastra a 37 °C in condizioni statiche per favorire la crescita batterica in pozzetti contenenti batteri coltivabili. A seconda della presenza di batteri coltivabili e del loro tasso di ricrescita in queste condizioni, possono essere necessari uno o più giorni di incubazione per rivelare completamente i pozzetti contenenti batteri coltivabili.
- Per ogni inoculo, ispezionare visivamente e contare il numero di pozzetti con punteggio positivo e negativo per la crescita batterica.
7. Monitoraggio della vitalità degli embrioni
- Il giorno dopo l'inoculazione, candelare gli ovuli embrionati per verificare la letalità dell'embrione.
- Mettere da parte gli ovuli contenenti embrioni morti e scartarli secondo le linee guida istituzionali per lo smaltimento dei rifiuti biologici infetti.
8. Lavorazione di ovuli embrionati
- Recupera gli ovuli embrionati dall'incubatrice e dalla candela per verificare la letalità dell'embrione. Scartare gli embrioni morti e non considerarli nei risultati finali.
- Rimuovi l'adesivo dall'uovo e disinfetta l'estremità superiore del guscio (coprendo la sacca d'aria) con carta velina imbevuta di etanolo al 70% (v/v).
- Usando un paio di forbici da dissezione pulite, tagliare il guscio dal punto di iniezione per esporre la sacca d'aria. Usando un paio di pinzette da dissezione pulite, strappa la membrana interna del guscio che separa la sacca d'aria dal resto dell'uovo.
- Svuotare con cura il contenuto dell'uovo in una capsula di Petri sterile. Usando un paio di pinzette, isolare e trasferire l'embrione su una nuova capsula di Petri. Lavare l'embrione con PBS sterile, se necessario.
- Trasferire l'embrione in una provetta da centrifuga da 15 ml contenente 4 ml di PBS sterile. Dissociare l'embrione utilizzando un omogeneizzatore (velocità: 10.000 giri/min). Pulire la punta dello strumento di dispersione tra ogni omogeneizzazione passandola in sequenza in PBS sterile, etanolo al 70% (v/v) e di nuovo PBS sterile.
- Piastra 500 μL dell'embrione omogeneizzato su agar BHI. Incubare le piastre a 37 °C per una notte (o più a lungo, se necessario).
NOTA: Opzionalmente, è possibile impiattare diluizioni seriali dell'omogenato nel caso in cui si preveda un numero elevato di CFU (ad es. > 300) nell'omogenato non diluito. - Per ogni gruppo di inoculazione, contare il numero di uova con punteggio positivo e negativo per la crescita di L. monocytogenes su piastre di agar.
NOTA: Nonostante le condizioni asettiche in cui vengono eseguite l'estrazione e l'omogeneizzazione degli embrioni, l'uso di un terreno di coltura agar non selettivo per la piastratura degli omogeneizzati embrionali comporta un rischio di crescita di contaminanti. L'uso di un terreno di crescita specifico per genere/specie o l'integrazione con un antibiotico selettivo (per il quale solo il ceppo batterico testato è resistente) può ridurre o prevenire tale contaminazione.
9. Lavorazione di ovuli non embrionati
- Recuperare gli ovuli non embrionati dall'incubatrice. Ripetere i passaggi 8.2 e 8.3 per accedere all'albume d'uovo.
- Utilizzando una micropipetta, raccogliere 500 μL di albume e stenderlo direttamente sull'agar BHI. Incubare le piastre a 37 °C per una notte o più a lungo, se necessario.
- Per ogni gruppo di inoculazione, contare il numero di uova che hanno ottenuto un punteggio positivo per la crescita di L. monocytogenes su piastre di agar.
Risultati
Per testare il potenziale del modello di embrione di pollo di far rivivere forme VBNC carenti di parete cellulare di L. monocytogenes generate dalla fame in acqua minerale, è stato importante articolare i tempi di preparazione dell'inoculo batterico VBNC (≥ 28 giorni) con quelli degli ovuli embrionati (6 giorni). Le sospensioni replicate di L. monocytogenes sono state quindi impostate a una concentrazione di 1 x 106 CFU/mL in acqua minerale 28 giorni prima del giorno previsto per l'inoculazione degli ovociti. È stato dimostrato che questa concentrazione batterica iniziale determina una coltivabilità residua desiderata di <1 CFU/mL dopo 28 giorni31. Una verifica finale della coltivabilità delle cellule batteriche e dei livelli di vitalità delle sospensioni ha portato alla selezione di un inoculo VBNC L. monocytogenes contenente 1 x 10,6 cellule vitali e 0,5 cellule coltivabili per mL. Per la sperimentazione, 100 μL di questo inoculo (cioè 1 x 105 cellule vitali e < 0,1 CFU) sono stati somministrati in gruppi di ovuli embrionati e non embrionati. I gruppi di controllo sono stati preparati in parallelo iniettando uova embrionali e non embrionate con lo stesso volume di dose di acqua minerale o di una sospensione di 5 x 103 CFU/mL di L. monocytogenes coltivato durante la notte in brodo BHI.
A 2 giorni dall'inoculazione, gli ovuli sono stati processati per valutare la presenza di L. monocytogenes coltivabile. Come previsto, non è stata recuperata alcuna crescita batterica dalle uova del gruppo di controllo della sterilità iniettate con acqua minerale, mentre il 100% delle uova del gruppo di controllo trattate con L. monocytogenes coltivabile ha ottenuto un punteggio positivo per la crescita su terreni di agar (Tabella 1). È importante sottolineare che tutti gli embrioni recuperati da uova inoculate con batteri VBNC hanno dato origine alla crescita di L. monocytogenes sulla piastra, in contrasto con la sua completa assenza su ogni piastra sparsa con il contenuto di un uovo non embrionato iniettato con gli stessi batteri VBNC (Tabella 1). Questo risultato sottolinea la necessità dell'embrione di pollo per il processo di risveglio di VBNC L. monocytogenes, come precedentemente riportato30.
Per determinare la probabilità che la crescita di L. monocytogenes recuperata da uova embrionate iniettate con batteri VBNC provenga da un vero recupero di cellule VBNC, non dalla ricrescita di cellule coltivabili persistenti, è necessario confrontare la frequenza delle dosi di inoculo che producono la crescita batterica prima e dopo il passaggio dell'uovo. Per ottenere il primo, dosi multiple di 100 μL dell'inoculo batterico VBNC sono state miscelate con BHI, un terreno ricco di sostanze nutritive che non supporta VBNC L. monocytogenes revival32, in una piastra a 96 pozzetti e incubate a 37 °C. Una frequenza del 9,5% di pozzetti BHI inoculati positivi per la crescita batterica (8 su 84) differiva significativamente (test esatto di Fisher, p = 1,6 × 10-17) dalla frequenza del 100% di uova che mostravano batteri coltivabili recuperati (Tabella 1). Questa differenza sostanziale e statisticamente significativa indica fortemente che la crescita di L. monocytogenes recuperata da uova embrionate era in gran parte dovuta alla riattivazione dei batteri VBNC. Inoltre, a differenza delle sue forme vegetative, VBNC L. monocytogenes non è stato in grado di rianimarsi in ovuli non embrionati, sostenendo che la rinascita delle cellule VBNC negli ovuli embrionati non è dovuta ai batteri coltivabili residui nell'inoculo.
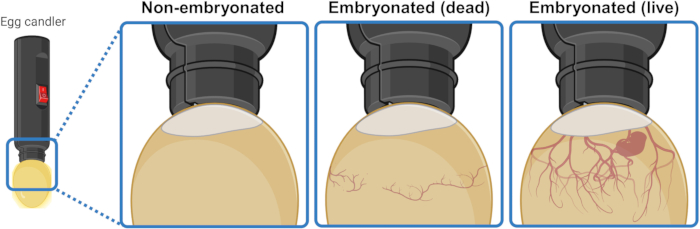
Figura 1: Distinzione tra uova di gallina non embrionate, embrionate morte ed embrionate vive mediante speratura. Lo stato dell'embriogenesi viene determinato illuminando l'uovo con una fonte di luce (candelabro per uova) da distanza ravvicinata. Gli ovuli contenenti un embrione vivo in via di sviluppo (visibile o meno) mostrano una forte rete di vasi sanguigni che si espandono verso il basso dalla sacca d'aria. Questa rete appare collassata e disorganizzata negli ovuli con embrioni morti ed è completamente assente negli ovuli che non sono riusciti ad avviare l'embriogenesi. Creato nel BioRender.com. Clicca qui per visualizzare una versione più grande di questa figura.
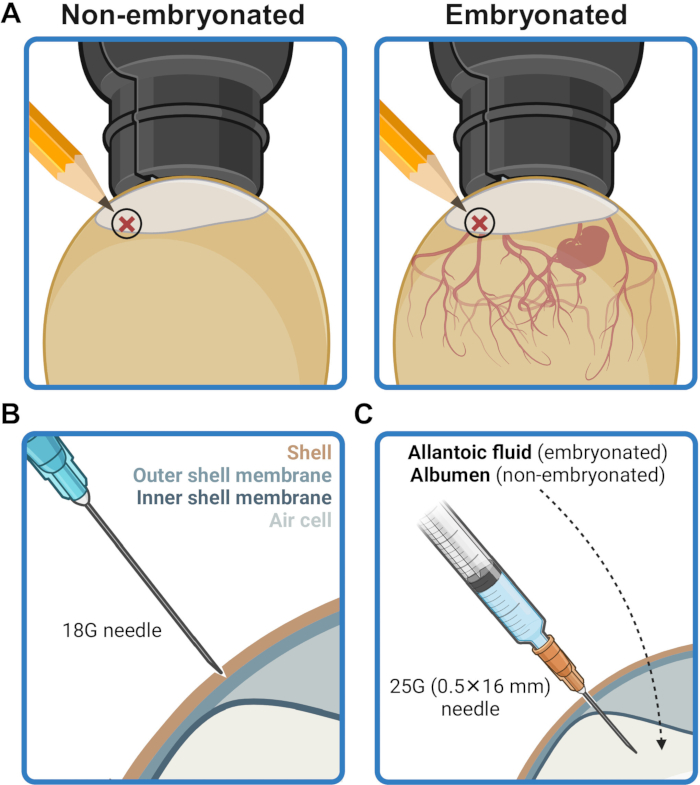
Figura 2: Preparazione dell'ovulo per l'inoculazione. (A) Il sito di iniezione è contrassegnato in una posizione di 2-5 mm sopra il bordo della sacca d'aria, come si vede dalla speratura. (B) Il guscio nel sito di iniezione viene perforato con l'aiuto della punta di un ago da 18G senza perforare la membrana esterna del guscio. (C) L'inoculo viene somministrato attraverso un ago da 25 G (0,5 mm x 16 mm) nel liquido allantoideo negli ovuli embrionati o nell'albume negli ovuli non embrionati. Creato nel BioRender.com. Clicca qui per visualizzare una versione più grande di questa figura.
| Inoculo | Coltivabilità prima del passaggio delle uovaa | Coltivabilità dopo il passaggio dell'uovob | |||
| Ovuli embrionati | Valore pc | Ovuli non embrionati | valore pd | ||
| Acqua minerale | 0/3 (0%) | 0/10 (0%) | >0,999 | 0/10 (0%) | >0,999 |
| VBNC Lm | 8/84 (9.52%) | 24/24 (100%) | 1.63E-17 | 0/18 (0%) | 0.344 |
| Lm Coltivabile | 3/3 (100%) | 8/8 (100%) | >0,999 | 2/2 (100%) | >0,999 |
| unNumero di pozzetti BHI con crescita batterica/Numero di pozzetti BHI inoculati. | |||||
| bNumero di uova con crescita batterica/Numero di uova inoculate. | |||||
| cConfronto della coltivabilità prima e dopo il passaggio in ovuli embrionati (test esatto di Fisher a due facce). | |||||
| dConfronto della coltivabilità prima e dopo il passaggio in ovuli non embrionati (test esatto di Fisher a due facce). | |||||
Tabella 1: VBNC L. monocytogenes ritorna ad uno stato coltivabile dopo il passaggio in uova di gallina embrionate. Le uova di gallina embrionate e non embrionate (6 giorni) sono state inoculate con 100 μL di sola acqua minerale o con sospensioni di acqua minerale di VBNC (1 x 104 cellule, 28 giorni) o coltivabili (500 cellule) di L. monocytogenes. Dopo 2 giorni, gli embrioni (o l'albume in ovuli non embrionati) sono stati recuperati e piastrati su agar BHI per valutare la presenza di L. monocytogenes coltivabile. La frequenza delle cellule coltivabili presenti in una dose di inoculazione prima del passaggio dell'uovo è stata determinata mescolando 100 μl di ciascuna sospensione con brodo BHI in pozzetti multipli di una micropiastra da 96 pozzetti e valutando il numero di pozzetti con crescita batterica dopo l'incubazione a 37 °C. La significatività statistica è stata calcolata utilizzando un test esatto di Fisher a due code, con valori p ≥ 0,05 considerati non significativi. Questa tabella è stata riprodotta da31.
Discussione
I rischi per la salute pubblica e l'economia associati alle forme vitali ma non coltivabili (VBNC) di patogeni batterici sono una conseguenza della loro capacità di eludere il rilevamento con i metodi convenzionali basati sulla crescita microbica, nonché della loro tolleranza/insensibilità alla maggior parte degli antimicrobici utilizzati in ambito clinico e nell'industria alimentare26,33. Diventa, quindi, urgente trovare strumenti e modelli di ricerca per comprendere meglio i meccanismi che guidano la transizione, il mantenimento e la rinascita delle cellule batteriche in uno stato VBNC.
Per molti aspetti, l'embrione di pollo è un'alternativa vantaggiosa ai modelli di ricerca più convenzionali dei mammiferi (ad esempio, topo, ratto, coniglio). È tecnicamente più pratico lavorare con un organismo oviparo, poiché il suo sviluppo embrionale è veloce e avviene esternamente e indipendentemente dal suo progenitore. È importante sottolineare che gli oneri finanziari e logistici associati alla produzione, all'alloggio e al mantenimento di uova ed embrioni di gallina sono notevolmente inferiori. Inoltre, la facilità di ottenere grandi numeri consente di testare in parallelo più condizioni sperimentali e/o repliche e la generazione di dati completi e statisticamente robusti. Sebbene i modelli non mammiferi, come i pesci o i nematodi, possano fornire vantaggi simili, l'embrione di pollo, in quanto vertebrato a sangue caldo, è evolutivamente più vicino agli esseri umani e quindi un modello di ricerca migliore in aree come l'immunologia, la modellazione delle malattie, lo sviluppo e la tossicologia. I modelli embrionali sono anche più semplici da lavorare da un punto di vista etico, in particolare durante i primi due terzi dello sviluppo, quando un sistema nocicettivo maturo non è ancora stabilito8. Questa breve finestra temporale è utile per le applicazioni che richiedono tempi di consegna rapidi (ad esempio, test farmacologici1), ma può porre restrizioni per i saggi che durano nelle fasi successive dell'embriogenesi o anche nella vita post-schiusa (ad esempio, studi sullo sviluppo e sul comportamento). La mancanza di un sistema immunitario adattativo rende anche l'embrione di pollo un utile strumento di ricerca in aree come le interazioni ospite-patogeno e la biologia del cancro7.
L'embrione di pollo è stato ampiamente utilizzato nello studio della virulenza microbica 9,10,11,12,13,14,15,16,17,18, ma con parsimonia come modello per far rivivere i patogeni VBNC 27,28,29,30. Qui, abbiamo fornito una descrizione metodologica dettagliata di come questo sistema in vivo possa essere utilizzato con successo per il salvataggio di VBNC L. monocytogenes.
Un punto critico da considerare in questo metodo è la questione della presenza residua di cellule coltivabili e del loro potenziale di sopraffare la vera rinascita delle cellule VBNC. I limiti del metodo di produzione delle cellule VBNC per affrontare questo problema (i livelli di purezza delle cellule VBNC sono abbinati alla concentrazione batterica iniziale) sollevano la necessità di impiegare approcci alternativi per eliminare del tutto le cellule coltivabili contaminanti o ridurle a un livello trascurabile. Tali approcci possono includere, ad esempio, la neutralizzazione/uccisione da parte di antimicrobici che hanno come bersaglio esclusivamente le cellule coltivabili. In alternativa, la rimozione fisica della popolazione cellulare coltivabile può essere ottenuta sulla base di caratteristiche morfofisiologiche uniche (ad esempio, forma cellulare, struttura o molecole superficiali o citoplasmatiche) mediante citometria a flusso. Questo approccio ha l'ulteriore vantaggio di consentire l'isolamento/purificazione di sottopopolazioni cellulari VBNC con età diverse (cioè formate in momenti diversi), che possono anche essere testate in ovo per la loro capacità di rianimazione.
Altri punti di questo metodo che richiedono attenzione includono l'attenta manipolazione degli ovuli embrionati, in particolare durante e immediatamente dopo la fase di iniezione (per evitare traumi o letalità involontari associati all'ago) e lo sforzo di ridurre il tempo di manipolazione al di fuori della temperatura di incubazione ottimale. Inoltre, nonostante le condizioni asettiche in cui dovrebbero essere eseguiti il prelievo, la lavorazione e la placcatura degli embrioni, può ancora verificarsi una crescita microbica indesiderata sulle piastre di agar. Questo problema può essere risolto con l'utilizzo di terreni di agar con una formulazione (composizione basale e/o integratori) selettiva per la specie batterica di interesse o utilizzando un ceppo resistente a un determinato antibiotico.
Questo lavoro mostra l'embrione di pollo come un modello in vivo semplice ma potente ed economico per studiare gli aspetti meccanicistici della dormienza batterica. In questo contesto, può potenzialmente essere utilizzato per identificare fattori batterici implicati nel processo di risveglio dello stato VBNC attraverso lo screening di singoli mutanti batterici o su scala genomica utilizzando una libreria mista (ad esempio, libreria di mutanti trasposoni).
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Questo lavoro è stato sostenuto da una sovvenzione del Micalis Institute (AAP Micalis FAMe 2023). F.C. è stato sostenuto da una sovvenzione post-dottorato dell'Agence Nationale de Recherche (THOR: ANR-20-CE15-0008; PERMALI: ANR-20-CE35-0001).
Materiali
| Name | Company | Catalog Number | Comments |
| 5(6)-carboxyfluorescein diacetate (CFDA) | Sigma-Aldrich | 21879 | Prepare stock solution at 30 mM in DMSO. Aliquot and store at −20 °C. |
| Benchtop centrifuge, 24 tubes 1.5–2 mL | Eppendorf | ||
| Biosafety cabinet, class II | |||
| Brain heart infusion (BHI) agar | BD | 248130 | |
| Brain heart infusion (BHI) broth | BD | 237500 | |
| Cell culture flasks, 25 cm2 (T25), vented cap | |||
| Centrifuge tubes, 15 mL | Sarstedt | ||
| Deionised water | To fill water reservoir of egg incubator | ||
| Dissection scissors, pointed ends | |||
| Dissection tweezers, curved + serrated ends | |||
| Egg candler | FIEM (Guanzate, IT) | IM35 | |
| Egg incubator (MG 244 Mercurius SH) | FIEM (Guanzate, IT) | SH244AD | Capacity for 144 chicken eggs (rocking trays) + 100 (hatching tray) |
| Eggs, fertilized | PFIE (INRAE Val-de-Loire, FR) | From white Leghorn chickens, raised in specific pathogen-free conditions | |
| Ethyl alcohol, 70% (v/v) | |||
| Flow cytometer (CytoFLEX S) | Beckman Coulter | V0-B2-Y4-R0 | |
| Heating block (95 °C) | |||
| Incubator (37 °C) | For growth of bacteria on agar plates | ||
| Incubator w/ shaking (37 °C, 200 rpm) | INFORS-HT | For growth of liquid bacterial cultures | |
| Inoculation loops | |||
| Microcentrifuge tubes, 1.5 mL | Eppendorf | ||
| Microtiter plates w/ lid, 96-well, transparent | Greiner | To prepare serial dilutions and analyze samples in flow cytometer | |
| Mineral water | Autoclaved (121 °C, 20 min) and sterile-filtered (0.2 µm) | ||
| Needle, hypodermic, 18G | Terumo | AN1838R1 | Dimensions: 1.2 × 38 mm |
| Needle, hypodermic, 25G | Terumo | AN2516R1 | Dimensions: 0.5 × 16 mm |
| Petri dishes, 10 cm ø | Greiner | For preparation of BHI agar plates and processing of chicken embryos | |
| Phosphate buffered saline (PBS), 1X | Gibco | 14190 | |
| Plate spreaders | |||
| Serological pipettes, disposable, 5 + 10 + 25 mL | |||
| Spectrophotometer (UV-Vis) + cuvettes 1 mL | |||
| Stickers, round, colored (Tough-Spots) | Dutscher | Dimensions: 9.5 mm ø | |
| Syringe, Luer slip, 1 mL | Terumo | ||
| Tissue homogenizer | IKA | ULTRA-TURRAX T25 disperser + S25N 8G dispersion tool | |
| Vacuum pump |
Riferimenti
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon